Оценка реактогенности гриппозной вакцины
Обновлено: 07.05.2024
Каждый год в преддверии нового эпидсезона по гриппу люди озабочены вопросом, вакцинироваться или нет, и если вакцинироваться, то какую вакцину выбрать. Известен постулат ВОЗ о том, что «вакцинация — единственно социально
Относительно эпидемической эффективности ситуация более интересная. Основными критериями оценки эффекта массовой иммунизации служат не только показатели заболеваемости, но и смертности, изменения в возрастной структуре болеющих, а также клинического течения соответствующего заболевания. Эти критерии учитываются за длительный период времени до и после проведения прививок. В условиях эпидопыта (наблюдения за заболеваемостью) определяется индекс эффективности, коэффициент защищенности, коэффициент тяжести клинического течения болезни [1]. Зарубежные издания публикуют полноценный анализ результатов грамотно организованного эпидопыта, однако в нашей печати можно регулярно встретить данные, например, о фантастическом снижении заболеваемости в отсутствие эпидемии либо о меньшей (разумеется, в разы!) эффективности вакцины конкурента.
Государство, понимая высокую важность специфической вакцинопрофилактики как общественного мероприятия, включило вакцинацию от гриппа в Национальный календарь прививок. С 2006 г. в рамках Национального календаря проводится плановая вакцинация детей 1–6 классов, лиц старше 60 лет, медицинских и социальных работников и т. п. Вакциной Национального календаря стал Гриппол.
Основные этапы разработки, исследований и внедрения вакцины Гриппол для массовой иммунопрофилактики были выполнены коллективом, объединяющим специалистов трех научно-исследовательских институтов — ГНЦ Института иммунологии МЗиСР РФ, Государственного института стандартизации и контроля медицинских иммунобиологических препаратов им. Л. А. Тарасевича и Института вирусологии РАМН, а также ряда других организаций на отдельных этапах исследований [6].
Результаты государственных и пострегистрационных испытаний вакцины Гриппол опубликованы в научных изданиях. Ниже приведены некоторые из них.
Здоровые взрослые. Государственные испытания вакцины Гриппол проведены в периоды сезонного подъема заболеваемости гриппом и острыми респираторными вирусными инфекциями (ОРВИ) на расширенном контингенте добровольцев (возраст 18–60 лет) [3].
Установлено, что вакцина Гриппол ареактогенна (отмечается практическое отсутствие общих и местных реакций), а по антигенной активности она равнозначна гриппозной тривалентной инактивированной цельновирионной вакцине.
Для анализа профилактической эффективности с ноября по апрель под медицинским наблюдением за динамикой заболеваемости гриппом и другими ОРВИ находились 4430 военнослужащих. В ходе эпидемиологического опыта методом случайной выборки были сформированы две группы в одном подразделении: первая — 1197 привитых вакциной Гриппол и вторая — 1001 получивших плацебо (группа внутреннего контроля в коллективе с 50% иммунной прослойкой). Третья группа наблюдения (2232 человека) была образована из личного состава подразделений, где иммунизацию против гриппа не проводили (группа внешнего контроля).
Анализ динамики заболеваемости гриппом и ОРВИ показал, что в группе привитых вакциной Гриппол показатель заболеваемости (26,7 на 1 тыс. привитых) существенно ниже по сравнению с группой внешнего контроля (92,3 на 1 тыс. наблюдений). Таким образом, индекс эффективности вакцины Гриппол оказался равен 3,4, коэффициент профилактической эффективности Гриппола — 71%. Следует отметить, что при сравнении клинического течения гриппа отмечалось значительно более легкое и без осложнений клиническое течение заболевания у привитых по сравнению с непривитыми.
Дети школьного возраста. Оценку профилактической эффективности вакцины Гриппол при иммунизации детей школьного возраста проводили в ряде школ г. Обнинска [4]. Результаты анализа заболеваемости гриппом и ОРВИ за 5 лет легли в основу выбора двух групп школ, территориально расположенных рядом, с сопоставимым числом учащихся и относительно одинаковым уровнем заболеваемости.
В группу внешнего контроля были включены две школы с общим числом учащихся 1315 человек. Основную опытную группу составили две школы с общим числом учащихся 1835 человек, 930 из которых было привито вакциной Гриппол, а 905 остались непривитыми, т. е. группа внутреннего контроля.
Причины, по которым часть детей осталось непривитыми, распределились следующим образом: из-за временных медицинских отводов, связанных с недостаточным интервалом после последней прививки или, в отдельных случаях, с периодом выздоровления после острого заболевания — 37,3%; из-за отказов родителей — 7,9%; из-за отсутствия детей в школе — 4,1%. Т. е. оказалось, что ежегодно в период прививочной кампании против гриппа (октябрь–ноябрь месяцы) одномоментно в школах могут быть иммунизированы около 50% детей.
Высокий уровень заболеваемости (309,5 на 1 тыс.) имел место в контрольной группе в коллективах, где прививки не проводили. В группе привитых вакциной Гриппол уровень заболеваемости гриппом и ОРВИ составил 157,0 на 1 тыс., а в группе внутреннего контроля (в коллективах с 50% иммунной прослойкой) — 235,3 на 1 тыс. Разница между показателями в каждой группе статистически достоверна (р < 0,05). Индекс эффективности Гриппола — 1,97, коэффициент эффективности — 49,3%.
Сравнение данных о тяжести клинического течения заболевания гриппом показал, что если привитые и заболевали гриппом, во всех случаях заболевание протекало в легкой форме, в то время как в контрольной группе регистрировали тяжелые случаи и заболевания средней тяжести.
Дети дошкольного возраста. Исследования вакцины Гриппол при введении ее детям дошкольного возраста от 3 лет проводили на базе детских дошкольных учреждений г. Обнинска в период предсезонного подъема заболеваемости гриппом и ОРВИ в условиях строго контролируемых эпидопытов с согласия родителей [4]. Для вакцинации и последующего наблюдения отбирали детей с согласия родителей.
Принципиально важным было определение дозы и схемы иммунизации. Из-за непереносимости детьми полной взрослой дозы в мировой практике, как правило, используется схема двукратной вакцинации с интервалом 4 нед при введении половинной дозы. Однако схема двукратной вакцинации снижает процент прививаемости детей, так как часть детей недополучает вторую прививку в силу разных причин. В наших исследованиях прививочная доза вакцины Гриппол для детей и взрослых была одинаковой стандартной при однократной схеме иммунизации и содержала по 5 мкг гемагглютинина каждого из трех актуальных штаммов вирусов гриппа типов A (H1N1), A (H3N2), В и 500 мкг Полиоксидония.
Результаты сравнительного анализа показали, что вакцина Гриппол абсолютно переносима детьми, безвредна и высокоэффективна для данного детского контингента, а применение однократной схемы вакцинации позволяет увеличить процент привитых детей.
Проводилось изучение реактогенности и иммуногенности вакцины Гриппол при вакцинации детей младшего школьного возраста с соматической патологией [4].
Итоги наблюдения показали, что повышение температуры не было отмечено ни в одном случае. При оценке общего состояния привитых, субъективные жалобы на нарушения общего характера регистрировались в единичных случаях. Их продолжительность составляла не более 1 дня.
Таким образом, установлено, что вакцина Гриппол обладает выраженной иммуногенностью ко всем антигенам актуальных штаммов вируса гриппа, а наблюдаемая у детей хроническая патология не препятствует выработке у них гуморального иммунитета при профилактических прививках вакциной Гриппол.
Опыт применения вакцины Гриппол у пожилых лиц. Мировой опыт специфической иммунопрофилактики гриппа причисляет лиц пожилого и старческого возраста к группе, требующей приоритетной защиты из-за высокого риска заболевания и развития постинфекционных осложнений.
Вакцинопрофилактику гриппа проводили среди лиц в возрасте от 60 до 99 лет. 82% из них составляли хронические больные, в основном с сердечно-сосудистой и легочной патологией. Методом случайно-выборочного распределения были сформированы равноценные группы наблюдения — основная и контрольная [2].
Полученные данные свидетельствуют о практически полном отсутствии общих реакций и в единичных случаях слабовыраженных местных реакциях. Результаты дополнительных обследований, проведенных в динамике, показали, что некоторые отклонения от нормы в показателях крови и мочи, при электрокардиографическом исследовании у отдельных привитых связаны с индивидуальным состоянием этих лиц и не связаны с вакцинальным процессом, так как имели место и до вакцинации.
Для оценки длительности поствакцинального иммунитета парные сыворотки, взятые через 1, 6 и 12 мес после прививки, исследовали в реакции торможения гемагглютинации. Отмечено, что число лиц с защитными уровнями антител за этот период снизилось умеренно (разница статистически недостоверна). Незначительное снижение отмечено и при анализе СГТА, причем разница показателей уровней СГТА к вакцинным вирусам между группами привитых и контрольной группой остается статистически значимой.
Проведенные исследования дают основания утверждать, что после иммунизации вакциной Гриппол лиц старше 60 лет создается длительный и напряженный иммунитет ко всем трем антигенам вируса гриппа, который сохраняется не менее года. Динамика снижения СГТА постепенная, и через 12 мес после вакцинации у большинства привитых сохраняются защитные титры антител ко всем трем штаммам вируса гриппа, включенным в вакцину.
В настоящее время вакцина Гриппол рекомендована для активной профилактической иммунизации против гриппа у детей с 6‑месячного возраста, подростков и взрослых без ограничения возраста, особенно показана лицам с высоким риском заболевания и возникновения осложнений в случае заболевания гриппом. Значительно расширены показания к применению у взрослых и детей, страдающих хроническими соматическими заболеваниями: болезни и пороки развития центральной нервной, сердечно-сосудистой и бронхо-легочной систем, в том числе бронхиальная астма, хронические заболевания почек, сахарный диабет, болезни обмена веществ, аутоиммунные заболевания, хроническая анемия, врожденный или приобретенный иммунодефицит, в том числе инфицирование вирусом иммунодефицита человека, аллергические заболевания (кроме аллергии к куриным белкам).
Вакцина Гриппол широко использовалась лечебно-профилактическими учреждениями Российской Федерации в эпидсезоны 1997–2007 гг. для профилактики гриппа у детей и взрослых. За эти годы было привито более 100 млн человек.
За все годы документально зафиксировано не более 100 случаев нежелательных побочных реакций в виде припухлости и покраснения места инъекции или легкого субфебрилитета, проходящие в течение суток. Иначе говоря, частота таких реакций составляет одну миллионную часть привитых, т. е. 0,0001%. В 2006 г., когда было привито 25 млн человек, публикации о нескольких таких случаях появились в газетах. Комиссия МЗиСР по расследованию причин осложнений не нашла нарушений технологии производства вакцины, транспортировки, проведения самой процедуры вакцинации. Более того, комиссия не нашла также признаков аллергической реакции при лабораторном обследовании детей.
По вопросам литературы обращайтесь в редакцию.
Р. В. Петров, доктор медицинских наук, профессор, академик РАН и РАМН
Институт иммунологии ФМБА, Москва
Резюме
Цель исследования. Изучение побочных эффектов и редких поствакцинальных осложнений, а также определение профилактической (количественная оценка активности) и противоэпидемической (реализация свойства вакцины предотвращать развитие эпидемии при тех или иных условиях) эффективности вакцины Инфлювак при массовом ее применении.
Заключение. Вакцина Инфлювак характеризуется высокими показателями профилактической и противоэпидемической защиты, обладает слабой реактогенностью, не вызывает необычных и побочных реакций при массовом применении.
В настоящее время для профилактики гриппа наиболее широкое применение находят инактивированные вакцины, содержащие антигены к трем штаммам вируса гриппа - A/H3N2, A/H1N1 и В.
По технологии изготовления инактивированные вакцины можно разделить на три группы: цельновирионные (обычные), расщепленные (сплит) и субъединичные.
Цельновирионные вакцины состоят из инактивированных цельных вирионов вируса гриппа и содержат, помимо необходимых для иммунизации антигенов, большое количество балласта в виде нуклеокапсида вируса. Расщепленные вакцины производятся из инактивированных расщепленных вирусов гриппа и содержат наряду с поверхностными и внутренние антигены. Субъединичные вакцины, к которым относится Инфлювак, содержат только поверхностные протективные антигены (гемагглютинин и нейраминидазу) и являются препаратами с наиболее высокой степенью очистки от компонентов вируса гриппа.
Целью настоящего исследования являлось изучение побочных эффектов и редких поствакцинальных осложнений, а также определение профилактической (количественная оценка активности) и противоэпидемической (реализация свойства вакцины предотвращать развитие эпидемии при тех или иных условиях) эффективности вакцины Инфлювак при массовом ее применении.
Материал и методы
Исследования проводили с октября по май, т.е. в период предсезонного и сезонного подъема заболеваемости гриппом и острыми респираторными заболеваниями (ОРЗ), в 1999-2000 гг.
Из отобранных для исследования участников были сформированы 3 группы: основная (иммунизированные против гриппа вакциной Инфлювак) и две контрольные, одна из которых вакцинирована против другой инфекции (1-я контрольная группа), вторая по условиям эпидемиологического опыта была оставлена невакцинированной (2-я контрольная группа). Она была образована из 622 студентов V курса, находившихся в тех же условиях, что и участники основной и 1-й контрольной групп, прошедших медицинское освидетельствование и не имевших противопоказаний к проведению вакцинации.
С целью получения статистически значимых показателей эффективности вакцины была определена численность основной и 1-й контрольной групп на основании результатов анализа заболеваемости гриппом и ОРЗ в этом коллективе за 4 последние года и с использованием следующей формулы [1]:
N = n*3,84*k(1+k)*100 / m(1-k) 2
где N - численность группы n - число наблюдаемых групп, m - ожидаемая минимальная заболеваемость, k - предполагаемый минимальный индекс эффективности, который может быть принят как существенный для данной вакцинации.
Из числа отобранных для проведения вакцинации 2532 участников методом рандомизации (единица выборки - подгруппы по 15-20 человек) были сформированы 2 равноценные группы: 1268 вакцинированных против гриппа (основная группа) и 1264 вакцинированных против другой инфекции (1-я контрольная группа). Таким образом, из отобранных для проведения исследования 2532 участников против гриппа были вакцинированы 50%.
Вакцинацию проводили в октябре-ноябре 1999 г. слепым методом (участники исследования не имели информации о том, какой вакциной они иммунизировались). Для этого вакцину Инфлювак и вакцину против другой инфекции, которые внешне не различались, вводили внутримышечно в наружную поверхность верхней трети плеча в объеме 0,5 мл однократно. При этом использовали коммерческие серии вакцины Инфлювак, изготовленные из 3 эпидемических штаммов вирусов гриппа А/Сидней/5/97 (H3N2), А/Пекин/262/95 (H1N1), В/Яманаши/166/98, подобный В/Пекин/184/93. Перед началом исследований все серии вакцины прошли контроль в Государственном научно-исследовательском институте стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича. Для сбора информации о возможных редких и отдаленных побочных реакциях на введение вакцины, а также данных о соматической и инфекционной заболеваемости (в том числе гриппом и ОРЗ) во всех исследуемых группах в течение 8 мес с октября по май было организовано систематическое медицинское наблюдение. С целью подтверждения клинических диагно зов была проведена выборочная серологическая расшифровка заболеваний у больных гриппом и ОРЗ. Для этого по мере обращения у заболевших гриппом или ОРЗ независимо от тяжести заболевания дважды изучали парные сыворотки: первый раз в начале заболевания и повторно - через 14-21 день. Таким образом, за весь период наблюдения двойным слепым методом (ни исследователи, ни сами больные не имели информации о том, к какой группе принадлежит тот или иной участник исследования) собраны парные сыворотки от 132 больных. Каждой паресывороток присваивался индивидуальный шифр для создания режима ослепления при изучении полученного материала в лаборатории. Эти сыворотки были исследованы в реакции торможения гемагглютинации с диагностикумами, содержащими антигены штаммов вируса гриппа A/H3N2, А/H1N1 и В. По результатам изучения сывороток, взятых в динамике, диагноз гриппа подтверждался 4-кратным и более нарастанием титров антител. После получения из лаборатории результатов изучения сывороток и их дешифровки было определено, что серологическая диагностика была выполнена у 52 лиц, вакцинированных против гриппа, и 80 невакцинированных. Кроме того; были собраны и проанализированы результаты оценки клинического течения заболевания гриппом и ОРЗ среди вакцинированных и невакцинированных участников исследования.
Для оценки эффективности вакцины Инфлювак определяли показатели (индекс и коэффициент) профилактической и противоэпидемической защиты (эффективности вакцины) по следующим формулам [1]:
K = b / a и
E = 100*(b-a) / b (%)
где К - индекс эффективности, Е - коэффициент эффективности, а - заболеваемость среди вакцинированных, b - заболеваемость среди невакцинированных.
При определении показателей профилактической эффективности вакцины в соответствии с рекомендациями ВОЗ [2] проводили сравнение показателей заболеваемости в 1-й контрольной и основной группах.
Оценку эффективности вакцинации как противоэпидемического мероприятия (противоэпидемическая эффективность) проводили путем сравнения заболеваемости во 2-й контрольной группе (группа "внешнего" контроля) и в коллективах, где одна половина вакцинирована против гриппа, а другая вакцинации против гриппа не получала (основная и 1-я контрольная группы). В данном случае проводили оценку эффективности иммунизации против гриппа при наличии в коллективе 50% иммунной прослойки. Все собранные количественные данные обрабатывали методом вариационной статистики. Достоверность различий определяли по t-критерию Стьюдента, при этом достоверно значимыми считали различия при р
Результаты и обсуждение
Рисунок. Динамика заболеваемости гриппом у иммунизированных вакциной "Инфлювак" и в контрольных группах (за период наблюдения с декабря 1999 г. по май 2000 г.)
Таким образом, полученные результаты свидетельствуют, что наличие иммунной прослойки в коллективе уменьшает вероятность заболевания гриппом невакцинированных лиц из 1-й контрольной группы.
Таблица 1. Заболеваемость гриппом и острыми респираторными заболеваниями (ОРЗ) в исследуемых группах за период сезонного подъема с ноября 1999 г. по май 2000 г.
| Группа | Число участников | Число заболевших гриппом и ОРЗ | Заболеваемость гриппом на 1000 участников (с учетом серологического подтверждения диагноза) | |
| абс. | на 1000 наблюдений | |||
| Основная (иммунизированные вакциной Инфлювак) | 1268 | 460 | 362,8+/-13,5* | 41,7+/-5,6* |
| 1-я контрольная (невакцинированные против гриппа) | 1264 | 630 | 498,4+/-14,1* | 186,9+/-10,9* |
| Всего (с 50% иммунной прослойкой) | 2532 | 1090 | 430,5+/-9,8* | 114,1+/-6,3* |
| 2-я контрольная ("внешний" контроль) | 622 | 840 | 1350,1 | 506,3+/-20,0 |
Полученные результаты также свидетельствуют, что с учетом серологического подтверждения диагноза отмечается еще более выраженная разница между показателями заболеваемости гриппом в основной группе (иммунизированные вакциной Инфлювак) (41,7 на 1000) по сравнению с 1-й и 2-й контрольными группами (186,3 и 506,3 на 1000 соответственно). Определенные по данным исследования заболеваемости гриппом в 1-й контрольной и в основной группах позволили определить показатели профилактической эффективности вакцины К и Е, которые соответственно равны 4,5 и 77,7%. Вместе с тем обращает на себя внимание, что при расчете показателей профилактической эффективности вакцины К и Е с учетом заболеваемости гриппом во 2-й контрольной группе (506,3 на 1000) и в основной группе (41,7 на 1000) они были выше и соответственно равны 12,1 и 91,8%.
В рекомендациях ВОЗ по организации испытаний профилактических препаратов отмечается, что заболеваемость гриппом в контрольной группе, живущей в одном закрытом учреждении вместе с вакцинированными, может быть меньше обычной за счет уменьшения числа больных, инфицирующих участников контрольной группы, и таким образом повлиять на естественное распространение инфекции [2]. С учетом этого обстоятельства в литературе описаны случаи определения показателей профилактической эффективности при сравнении заболеваемости вакцинированных и лиц из группы "внешнего" контроля, на которую влияние иммунной прослойки по условиям организации эпидемиологического опыта сведено к минимуму [4, 5].
Результаты исследований позволили также провести оценку эффективности иммунизации как противоэпидемического мероприятия при сравнении заболеваемости гриппом в коллективах, в которых вакцинацию не проводили (группа "внешнего", контроля), и в коллективах с 50% иммунной прослойкой за счет иммунизированных вакциной Инфлювак (см. табл. 1). При этом показатели противоэпидемической защиты К и Е в этих коллективах соответственно составили 4,4 и 77,5%.
Результаты анализа полученных материалов показывают, что практически у всех вакцинированных заболевание протекало в легкой форме, в то же время в контрольной группе регистрировали тяжелое течение и заболевания средней тяжести, при этом более чем в 70% случаев они протекали с осложнениями.
Анализ соматической и инфекционной заболеваемости за 7 мес после вакцинации (исключая грипп и ОРЗ) в группах иммунизированных вакциной Инфлювак и невакцинированных против гриппа из этого же коллектива (1-я контрольная группа) не выявил никаких особенностей ни в показателях заболеваемости по нозологическим формам, ни по общей сумме заболеваний в той или иной группе (табл. 2). Во всех случаях разница между соответствующими показателями в данных группах наблюдения оказалась статистически незначимой (р>0,05). Наряду с этим следует отметить, что при систематическом медицинском наблюдении в течение 8 мес за 1268 иммунизированными вакциной Инфлювак ни в одном случае не выявлено необычных, редко встречающихся поствакцинальных реакций.
Таблица 2. Соматическая и инфекционная заболеваемость (исключая грипп и острые респираторные заболевания) в группах вакцинированных и невакцинированных против гриппа с ноября 1999 г. по май 2000 г.
| Заболевания | Заболеваемость на 1000 участников | |
| иммунизированные вакциной Инфлювак (основная группа; n=1268) | невакцинированные против гриппа (1-я контрольная группа; n=1264) | |
| Острые воспалительные заболевания верхних дыхательных путей (кроме гриппа и ОРЗ) | 198,7+/-11,2 | 206,5+/-11,4 |
| Инфекционные | 19,7+/-3,9 | 22,2+/-4,1 |
| Кожные | 57,6+/-6,5 | 49,1+/-6,1 |
| Нервные | 5,5+/-2,1 | 6,3+/-2,2 |
| Сердечно-сосудистые | 6,3+/-2,2 | 5,5+/-2,1 |
| Желудочно-кишечные | 10,3+/-2,8 | 11,1+/-2,9 |
| Прочие | 2,4+/-1,9 | 2,4+/-1,9 |
| Всего | 300,5+/-12,8 | 303,0+/-12,9 |
Таким образом, в результате приведенных испытаний субъединичной гриппозной вакцины Инфлювак фирмы "Солвей Фарма" установлено, что она обладает слабой реактогенностью, не вызывает не обычных и побочных реакций при массовом применении. При этом вакцина Инфлювак характеризуется высокими показателями профилактической и противоэпидемической защиты (индексы и коэффициенты эффективности соответственно равны 4,5 и 77,7% и 4,4 и 77,5%). Следует отметить, что у вакцинированных грипп протекает в легкой форме без осложнений.
Результаты наших исследований подтвердили уже описанную в литературе закономерность, что при гриппозной инфекции наличие 50% иммунной прослойки в коллективе (за счет иммунизации) умень шает вероятность заболевания невакцинированных из этих коллективов по сравнению с невакцинированными лицами из группы так называемого внешнего контроля, на которую влияние иммунной прослойки по условиям эпидемиологического опыта сведено к минимуму. При сравнении уровня заболеваемости гриппом лиц из группы "внешнего" контроля и иммунизированных вакциной Инфлювак в наших исследованиях индекс и коэффициент эффективности были соответственно равны 12,1 и 91,8%.
Выводы
В результате проведенных контролируемых клинических испытаний гриппозной субъединичной вакцины Инфлювак определены параметры ее профилактической эффективности (индекс и коэффициент соответственно равны 4,5 и 77, 5%). При сравнении заболеваемости в группе иммунизированных вакциной Инфлювак и в группе "внешнего" контроля индекс и коэффициент эффективности вакцины имеют тенденцию к росту и соответственно равны 12,1 и 91,8%. Определена противоэпидемическая защита вакцинации при наличии 50% иммунной прослойки в коллективе (индекс и коэффициент соответственно равны 4,4 и 77,5%).
При гриппозной инфекции наличие 50% иммунной прослойки в коллективе (за счет иммунизации) уменьшает вероятность заболевания невакцинированных из этого коллектива.
Вакцина Инфлювак обладает слабой реактогенностью, не вызывает при массовом применении необычных и побочных реакций.
Литература:
1. Бессмертный B.C., Хейфиц Л.Б. Оценка эффективности мероприятий по профилактике инфекционных болезней. М: Медицина; 1963.
2. Поллок Т.М. Испытания профилактических препаратов, применяемых для борьбы с инфекционными болезнями. ВОЗ, Женева 1967.
3. Урбах В.Ю. Статистический анализ в биологических и медицинских исследованиях. М: Медицина; 1975.
4. Ельшина Г.А., Горбунов М.А., Шерварли В.И. и др. Оценка эффективности гриппозной тривалентной профилактической полимерсубъединичной вакцины "Гриппол". Журн микробиол 1998: 3: 40-3.
5. Ельшина Г.А., Горбунов М.А., Бектимиров Т.А. и др. Оценка реактогенности, безвредности и профилактической эффективности тривалентной профилактической полимер-субъединичной вакцины "Гриппол", при введении детям школьного возраста. Журн микробиол 2000; 2: 50-4.
Всемирная система мониторинга циркуляции вирусов, новые технологии выделения и очистки отдельных протективных субъединиц и использование новых субстратов для выращивания вакцинных вирусов позволяют производить эффективные и безопасные препараты в необходи
Всемирная система мониторинга циркуляции вирусов, новые технологии выделения и очистки отдельных протективных субъединиц и использование новых субстратов для выращивания вакцинных вирусов позволяют производить эффективные и безопасные препараты в необходимых объемах. Отечественные современные высокотехнологичные инактивированные гриппозные вакцины можно рассматривать как наглядный пример реализации накопленных знаний в сочетании с применением инновационных технологий.
Доклиническая оценка вакцины Гриппол® Нео проводилась несколькими аккредитованными организациями согласно утвержденным протоколам. В различных моделях было показано, что в дозах, многократно превышающих человеческую, вакцина не оказывает токсического, пирогенного, аллергизирующего действия как на взрослых, так и на неполовозрелых и новорожденных животных, безопасна для иммунной системы как в короткие, так и в отдаленные сроки после вакцинации. Результаты доклинических исследований позволили рекомендовать ее к проведению клинических исследований.
Цель данной статьи — ознакомить читателей с результатами клинических исследований вакцины Гриппол® Нео.
Оценка безопасности вакцины Гриппол® Нео у взрослых добровольцев
Клиническое рандомизированное сравнительное двойное слепое контролируемое исследование в параллельных группах (Фаза I), проводимое с целью оценки безопасности, включало 60 здоровых добровольцев обоего пола в возрасте 18–54 лет [2]. Все участники, отобранные в соответствии с критериями включения/исключения, были случайным образом распределены в три группы по 20 человек. Течение поствакцинального процесса, регистрацию и классификацию реакций осуществляли в соответствии с утвержденным протоколом и с учетом требований национальных регулятивных документов и рекомендаций [3–5]. Оценка реактогенности показала, что из симптомов нарушения общего состояния в основном регистрировали слабость (у 3,1% вакцинированных); из местных реакций у 4,0% вакцинированных регистрировали боль в месте инъекции при физической нагрузке или надавливании.
В табл. 1 представлено общее число вакцинированных по группам с местными и общими реакциями на прививку.
Таким образом, на основании анализа результатов исследований было установлено, что препарат Гриппол® Нео безвреден для вакцинации людей. Не выявлено сильных поствакцинальных или неожиданных реакций, серьезных нежелательных явлений. Вакцина рекомендована для проведения клинических исследований по расширению контингентов с включением детей 3–17 лет.
Безопасность вакцины Гриппол® Нео при вакцинации детей 3–17 лет
Для вакцинации детей использовали инактивированную субъединичную адъювантную вакцину Гриппол® Нео, в одной вакцинирующей дозе (0,5 мл) содержащую по 5 мкг очищенных протективных антигенов (гемагглютинин и нейраминидаза), выделенных из вируса гриппа типа А и В, выращенного в культуре клеток МDCK, связанных с водорастворимым иммуноадъювантом Полиоксидоний®. Исследования проведены в соответствии с протоколом, утвержденным компетентными регулятивными органами и согласованным с Комитетом МИБП и ФГУН ГИСК им. Л. А. Тарасевича. После получения информированного согласия от самих участников или их родителей дети были рандомизированно распределены в две группы, по 90 человек в каждой: первую группу вакцинировали Грипполом® плюс, вторую Грипполом® Нео. Вакцинацию проводили в три этапа. На первом этапе иммунизировали детей старшей возрастной группы (12–17 лет). После оценки реактогенности вакцины у детей старшего возраста была проведена иммунизация следующей возрастной группы (7–11 лет), далее — в аналогичном режиме — вакцинировали детей младшей возрастной группы (3–6 лет). После введения вакцины привитые в течение 30 минут находились под наблюдением врача, ответственного за проведение вакцинации, и в течение 5 дней под амбулаторным наблюдением медицинского персонала.
Оценку реактогенности проводили в поствакцинальном периоде с нулевого по пятый дни исследования, анализируя жалобы на недомогание, лихорадку и любые другие симптомы как проявление системных реакций, а также боль в месте инъекции, появление гиперемии и отека как симптомы местных реакций. Далее оценивали состояние пациентов в течение трех недель после прививки. Дополнительно в течение трех месяцев после вакцинации были собраны данные обо всех случаях инфекционных, соматических и аллергических заболеваний.
Местные вакцинальные реакции расценивали как слабые, если отек и гиперемия в месте введения вакцины не превышали 25 мм в диаметре, средние при диаметре 25–50 мм и сильные при диаметре более 50 мм. В качестве местной вакцинальной реакции регистрировали также болезненность по субъективным ощущениям слабой степени, средней и выраженную. Из местных реакций у одного ребенка регистрировали боль в месте инъекции при надавливании.
В табл. 2 представлены данные по количеству местных и общих реакций у привитых.
Таким образом, 94,4% привитых вакцинацию переносили бессимптомно. Полученные результаты свидетельствуют о высоком профиле безопасности и хорошей переносимости вакцины [8].
Мониторинг заболеваемости вакцинированных в течение трех месяцев после прививки выявил по два случая заболевания легкими формами ОРВИ в каждой группе.
На основании проведенных исследований были внесены изменения в инструкцию по применению вакцины Гриппол® Нео: вакцина рекомендована для вакцинации детей с трех лет и взрослых без ограничения возраста.
Иммуногенность вакцины Гриппол® Нео
Оценку иммуногенности проводили у тех же контингентов для двух дозировок гриппозной субъединичной адъювантной вакцины Гриппол® Нео — по 5 и по 10 мкг гемагглютинина (ГА) каждого из трех рекомендованных штаммов.
Парные сыворотки, взятые до и спустя 21 день после иммунизации, анализировали в методе реакции торможения гемагглютинации (РТГА) в соответствии с описанием МУ 3.3.21758–03.
Уровень сероконверсий (процент лиц с четырехкратным увеличением титра антител после вакцинации) для трех вакцинных штаммов А/H1N1, A/H3N2 и В варьировал в диапазоне от 77,4% до 92,6%; уровень серопротекций (процент людей с защитными титрами антител после вакцинации) составил от 93% до 97%, кратность прироста титров антител — 7,5 до 18,5 соответственно. Результаты оценки иммуногенности двух доз вакцины Гриппол® Нео у исходно серонегативных взрослых представлены в табл. 3.
Из таблицы видно, что две дозы вакцины (по 5 и по 10 мкг ГА каждого из актуальных штаммов) достоверно не отличаются. В качестве конечной дозировки была выбрана доза (5 + 5 + 5) мкг ГА каждого штамма.
Таким образом, Гриппол® Нео обладает хорошей иммуногенностью и удовлетворяет всем трем критериям, сформулированным Европейским комитетом для гриппозных вакцин [9].
Заключение
Неоднократно показано, что сезонная вакцинопрофилактика гриппа является надежным средством, не только обеспечивающим защиту от гриппа, но и способствующим повышению резистентности организма к другим вирусным ОРВИ. Именно результаты независимых исследований, показавшие высокую профилактическую эффективность иммунизации, стали основанием для включения прививки от гриппа в Национальный календарь профилактических прививок. А необходимость ежегодной вакцинации, в свою очередь, стала стимулом для создания ареактогенных вакцин, обладающих высочайшим профилем безопасности.
Литература
Некрасов А. В., Пучкова Н. Г. Стратегия совершенствования и методы оценки гриппозных вакцин. Гриппол® плюс — современная защита от гриппа // РМЖ. 2008, № 23 (16): 1–4.
Войцеховская Е. М., Вакин В. С., Васильева А. А., Кузнецова Е. В. и др. Иммуногенность новой гриппозной вакцины // Лечащий Врач. 2009, № 10: 77–79.
Локоткина Е. А., Харит С. М., Черняева Т. В., Брусов Н. К. Поствакцинальные осложнения (клиника, диагностика, лечение, профилактика). Пособие для врача. Под ред. Ивановой В. В. СПб, 2004, 79 с.
Методы определения показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа: Методические указания МУ 3.3.2.1758–03.2003.
Озерецковский Н. А., Федорова А. М. и др. Иммунопрофилактика-2007. Под ред. Таточенко В. К. М., 2007, 192 с.
Отчет «Клинические испытания вакцины гриппозной инактивированной субъединичной адъювантной Гриппол® ТС (I фаза). НИИ гриппа, С.-Пб, 2007.
Некрасов А. В., Пучкова Н. Г., Харит С. М., Черняева Т. В. и др. Вакцина Гриппол® Нео:Результаты клинических исследований безопасности и реактогенности (фаза II) // Эпидемиология и вакцинопрофилактика. 2009, № 5 (48): 54–60.
Харит С. М., Ерофеева М. К., Никаноров Н. Ю. и др. Безопасность вакцинации детей в возрасте 3–7 лет субъединичной адъювантной гриппозной вакциной, содержащей антигены вируса гриппа, выращенного на стерильной культуре клеток MDCK // Вопросы современной педиатрии. 2010, август, № 4.
CPMP/EWP/1045/01. Concept paper on the revision of the CPMP/BWP Note for Guidance on Harmonization of Requirements for Influenza Vaccines CPMP/BWP/214/96.
М. К. Ерофеева*, доктор медицинских наук
И. Ю. Никаноров*
С. М. Харит**, доктор медицинских наук, профессор
В. В. Романенко***, кандидат медицинских наук
Контактная информация об авторах для переписки: 197376, Россия, Санкт-Петербург, ул. Профессора Попова, дом 15/17
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с
Грипп и гриппоподобные заболевания занимают первое место по частоте и количеству случаев в мире. Эпидемия гриппа ежегодно приходит с наступлением осенне-зимнего сезона, и каждый раз иммунная система не готова к встрече с ним. Почему? Грипп является чемпионом среди вирусов по способности к генетической изменчивости, которая позволяет ему уходить от иммунного надзора. Вирус с изменившимися поверхностными белками уже не распознается специфическими противогриппозными антителами к штаммам-предшественникам.
Наиболее эффективным, безопасным и экономически оправданным средством профилактики гриппа является вакцинация. Чтобы вакцина защищала от гриппа, должно быть четкое соответствие вакцинных штаммов эпидемическим. В отличие от большинства других вакцинных препаратов, существует необходимость ежегодного обновления штаммового состава противогриппозных вакцин и, следовательно, необходимость ежегодной иммунизации. Проблема гриппа давно вышла за пределы одной страны. Центрами по гриппу ВОЗ, организованными по всему миру, проводится регулярный мониторинг и сбор информации по сезонным циркулирующим штаммам вируса гриппа и вспышкам заболеваемости. На основании анализа присланного материала эксперты делают прогнозы относительно разновидностей гриппа, которые будут циркулировать в следующем эпидсезоне, а также предлагают вирусы-кандидаты в вакцинные штаммы для производителей.
С учетом того, что дифференциальная диагностика гриппа от других ОРВИ затруднена, показатели иммуногенности вакцин принято оценивать по уровню специфических антител к гемагглютинину (ГА). Защитный эффект ГА-специфических антител неоднократно был продемонстрирован как у животных, так и у людей. Антитела нейтрализуют вирус гриппа, предотвращая его связывание с рецепторами, при этом уровень антител к гемагглютинину напрямую коррелирует с уровнем защищенности. При оценке потенциальной эффективности вакцины титр антител не менее чем 1:40 считают защитным. Антитела к другому изменчивому поверхностному белку вируса гриппа — нейраминидазе — не могут предотвратить инфекцию, однако играют важную роль в защите от тяжелых форм гриппа, препятствуя выходу вирусных частиц из инфицированных клеток и дальнейшему распространению вируса в организме. Гемагглютинин и нейраминидаза названы протективными белками, а вакцины, содержащие только эти очищенные белки, — субъединичными.
Снижение антигенной нагрузки в вакцинирующей дозе обеспечивает максимальный профиль безопасности препарата. Антигены с адъювантом образуют комплекс, который стимулирует гуморальное и клеточное звенья иммунитета. Это приводит к образованию специфических к протективным белкам антител, отвечающих за защиту от гриппа, и повышает общую резистентность организма к инфекции.
Клинические исследования безопасности и иммуногенности Гриппол ® Нео проводились с участием добровольцев в высокоспециализированных исследовательских центрах по изучению вакцинных препаратов и поствакцинальных реакций.
Изучение частоты местных и общих реакций, а также соматической и инфекционной заболеваемости во всех группах наблюдения, проведенное в рамках данного исследования, показало, что препараты хорошо переносятся и обладают низкой реактогенностью. Целью данной публикации является анализ результатов иммуногенности вакцины Гриппол ® Нео в сравнении с коммерческим препаратом — вакциной Гриппол ® .
Материалы и методы
Вакцины
Дизайн исследования
Исследования проведены в соответствии с утвержденными протоколами и согласно разрешению МЗ РФ на клинических базах ФГУ НИИ ДИ Росздрава и ГОУ ВПО СПбГМУ им. ак. И. П. Павлова в соответствии с требованиями Надлежащей клинической практики (GCP).
Дизайн исследования: рандомизированное, двойное слепое, контролируемое сравнительное в параллельных группах. Вакцинация добровольцев проведена после подписания информированного согласия.
Участники были отобраны в соответствии с критериями включения/исключения, определенными протоколом клинического испытания. Всего было вакцинировано 300 здоровых добровольцев в возрасте 18–55 лет (средний возраст — 24,5 ± 0,5 года). Перед прививкой все добровольцы были осмотрены врачом, было проведено измерение температуры тела, артериального давления, женщинам — тест на беременность.
Методом случайного выборочного распределения было сформировано три группы по 100 человек. Вакцинацию проводили однократно в дельтовидную мышцу в объеме 0,5 мл.
Постановка реакции и учет результатов
Иммуногенность оценивали в соответствии с требованиями Европейского комитета к противогриппозным вакцинам (СPMP/BWP/214/96), согласно которым должен выполняться по крайней мере один из трех критериев:
сероконверсия (процент лиц с четырехкратным приростом титра антител после вакцинации) — не менее 40%;
серопротекция (процент лиц с защитным титром антител до и через 21–28 дней после вакцинации) не менее 70%;
Статистика
Результаты исследований статистически обработаны с использованием t-критерия Стьюдента. Вариационный анализ полученных результатов проводили с применением пакета прикладных программ Statistica 6.0.
Результаты и обсуждение
Серологическое обследование с целью оценки иммунологической эффективности вакцинации проводили, сравнивая уровень антител в парных сыворотках, взятых до прививки и на 21-й день после вакцинации. Во всех экспериментальных группах в сыворотках привитых регистрировали статистически достоверное нарастание титров антител. По всем анализируемым критериям не наблюдалось статистически достоверной разницы в иммунном ответе на серии вакцины Гриппол® Нео с различными дозировками антигенов. В таблицах приведены данные, относящиеся к серии, содержащей по 5 мкг гемагглютинина каждого штамма.
Подсчеты числа лиц с серопротекциями (защитными титрами антител (≥ 1:40)) показали, что в каждой группе уровень этих антител соответствует критерию CPMP (табл. 1).
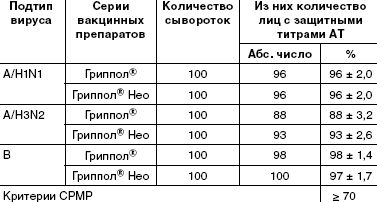
Наиболее иммуногенными оказались компоненты вакцин H1N1 и B. У привитых вакциной Гриппол ® Нео по 5 мкг уровень серопротекций составил 96% и 97% соответственно, у привитых вакциной Гриппол ® — 96% и 98%. Число людей с защитным титром антител (сероконверсий) против штамма A/H3N2 было несколько ниже — 93% для Гриппола® Нео и 88% для Гриппола ® . Достоверных различий по данному показателю между исследуемыми вакцинами и препаратом сравнения вакциной Гриппол ® (p > 0,05) не выявлено. Кратность нарастания антител и доля лиц с 4-кратным и более приростом титра антител являются важными характеристиками иммунного ответа на вакцинацию, особенно у людей, ранее не встречавшихся с данными разновидностями вируса гриппа. В табл. 2 показаны результаты вакцинации серонегативных добровольцев — людей с низким (< 1:20) исходным уровнем антител. Из результатов следует, что для всех подтипов вируса гриппа наблюдалось увеличение титров антител, значительно превышающее критерии CPMP.
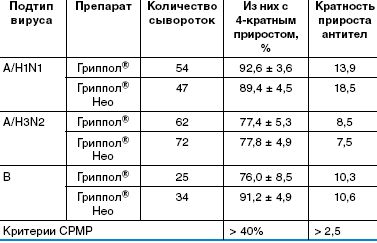
Для вакцин Гриппол ® Нео и Гриппол ® число сероконверсий к подтипу А/H1N1 составило 89,4% и 92,6%; для подтипа А/H3N2 — 77,8% и 77,4%; для типа В — 91,2% и 76,0% соответственно. Кратность прироста титра антител у серонегативных лиц составила от 7,5 до 18,5 для Гриппола ® Нео и от 8,5 до 13,9 — для препарата сравнения.
Известно, что человеческая популяция неоднородна по наличию антител к различным штаммам и подтипам вируса гриппа вследствие гриппозных эпидемий и предыдущих вакцинаций. Среди вакцинированных добровольцев выявлены как серонегативные, так и серопозитивные участники (исходно имевшие защитный титр). Представлялось интересным оценить эффективность иммунизации в общей популяции людей (табл. 3).
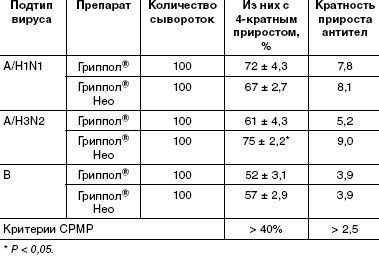
Уровень сероконверсий в целом по группам привитых для штаммов типа А составил 67–75% для вакцины Гриппол ® Нео и 61–72% для вакцины сравнения. Уровень сероконверсий для штамма В составил 57% для вакцины Гриппол ® Нео и 52% для Гриппола ® . Отметим, что в препарате сравнения содержание антигена типа В вдвое выше (11 мкг), чем в тестируемой вакцине — Гриппол ® Нео (5 мкг), однако статистически достоверных различий по иммуногенности к этому компоненту не выявлено.
Выводы и заключение
Проведены государственные клинические испытания вакцины Гриппол® Нео с уменьшенной антигенной нагрузкой, которые показали, что она обладает всеми качествами вакцинного препарата нового поколения: безвредностью, высокой иммуногенной активностью при введении.
Уровень серопротекций для вакцины Гриппол® Нео составил 93–98%; уровень сероконверсий (четырехкратный и более прирост антител) у серонегативных лиц — от 78% до 91%, кратность нарастания титра антител — от 7,5 до 18,5. Таким образом, препарат соответствует всем трем международным критериям иммуногенности, предъявляемым к инактивированным гриппозным вакцинам.
Ключевые слова: вакцина, грипп, Гриппол ® Нео, клеточная культура
Читайте также:

