Онкологические вирусы и их применение в онкологии
Обновлено: 26.04.2024
Недавно были опубликованы результаты доклинического исследования, которое показало, что онколитический вирус CF33 не только уничтожает раковые клетки, но и может активировать противоопухолевый иммунитет при раке толстой кишки. Возможно, в будущем это поможет эффективно бороться с трудноизлечимыми злокачественными опухолями.
Во время экспериментов на мышах ученые обнаружили, что вирус CF33 увеличивает экспрессию белка PD-L1 в опухолевых клетках и убивает их, одновременно стимулируя приток активированных T-лимфоцитов.
Доктор Сьюзан Уорнер (Susanne Warner), старший автор исследования из центра City of Hope (США), рассказывает:
Пока онколитический вирус CF33 не проверяли на людях, но клиническое исследование не за горами — оно запланировано на 2021 год.
Помощник иммунопрепаратов
Для подтверждения своих предположений ученые из City of Hope разделили лабораторных животных на четыре группы и протестировали на них разные виды лечения:
- Контрольная группа — не получала терапии.
- Лечение только ингибиторами PD-L1.
- Лечение только вирусом CF33.
- Комбинированное лечение ингибиторами контрольных точек и онколитическим вирусом.
Ученые проверили эффективность вируса CF33 при трижды негативном раке молочной железы, злокачественных опухолях печени, мозга, яичников, предстательной, поджелудочной железы, головы и шеи, легких. Кроме того, недавно проведенное исследование показало, что CF33 можно сочетать с CAR-T-клеточной терапией — еще одним методом иммунотерапии при онкологических заболеваниях.
Вирус CF33 можно обнаружить в организме с помощью ПЭТ-сканирования. Врачи могли бы видеть на снимках, в каких местах он накапливается, и выявить опухолевые очаги, которые не были обнаружены с помощью других исследований. Эта особенность переводит терапию CF33 в область тераностики — инновационной сферы медицины, в которой процедуры являются одновременно лечебными и диагностическими.

Обзор
Онколитические вирусы — новая стратегия лечения рака
рисунок автора статьи
Автор
Редакторы

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Во благо, не во вред

рисунок автора статьи

Рисунок 2. Схема действия онколитического вируса. Онколитический вирус инфицирует опухолевую клетку, а затем размножается в ней. В итоге это приводит к уничтожению опухолевой клетки, что привлекает внимание иммунных клеток. При этом онколитический вирус не трогает здоровую клетку.
рисунок автора статьи
Случайное не случайно
Немалое количество научных открытий, изменивших мир, произошло по счастливой неслучайности. Падение яблока около Ньютона подарило миру понятие о гравитации, а открытое окно в лаборатории Флеминга — антибиотики. Так, еще в 1897 году врач в Мичигане отметил, что одна из пациенток с лейкемией вышла в долгую ремиссию после того, как переболела гриппом. А в 1971 году в Уганде ребенок, больной лимфомой, излечился от рака, когда заболел корью. С конца 1990-х ученые уже в лабораторных экспериментах стали наблюдать, что обычные вирусы способны уничтожать раковые клетки. С тех пор начались попытки приручить дикие вирусы и заставить их работать для лечения рака.
Первый онколитический препарат на основе вируса герпеса, талимоген лагерпарепвек (T-VEC), был одобрен уже в 2015 году для неоперабельных пациентов с поздней стадией меланомы. Этот препарат представляет собой генетически модифицированный вирус простого герпеса I типа. Для безопасного использования препарата с помощью генной инженерии из вируса убрали белки, мешающие иммунитету распознавать инфекцию. За 49 месяцев наблюдения 17% пациентов полностью ответили на терапию [13], то есть у них не осталось никакого следа от опухоли. Для клинического испытания в онкологии это впечатляющий результат. Что еще важнее, среди полностью ответивших на терапию был очень высокий процент выживаемости — по расчетам, 88,5% остались живы спустя 5 лет после терапии (рис. 3).

Рисунок 3. График Каплана—Мейера показывает общую выживаемость пациентов с меланомой, которые полностью ответили (красный) или ответили не полностью (синий) на терапию онколитическим вирусом после девяти месяцев от начала исследования. Вертикальная координата показывает процент пациентов, оставшихся в живых. Горизонтальная — месяцы спустя терапии. Из графика ясно видно, что две кривые, красная и синяя, расходятся. При этом красная кривая даже спустя 55 месяцев остается на высоком уровне, что говорит о высокой выживаемость пациентов, которые ответили на терапию онколитическим вирусом.
Как это работает?
Праздновать победу рано
На протяжении прошлого века оценка вирусотерапии напоминала американские горки: от неистового восторга надежды до полного разочарования. Изначально эксперименты с дикими вирусами на людях в 1950-х годах были довольно опасными и почти убили интерес к вирусной терапии. Из-за невозможности тогда контролировать способность вирусов избегать иммунного ответа и размножаться, начальные эксперименты приводили к серьезным нежелательным инфекциям. К счастью, изобретение полимеразной цепной реакции (ПЦР) [18] и открытие генной рекомбинации в 1980-х позволило сделать использование вирусов более безопасным для людей. Генная рекомбинация позволила создавать онколитические вирусы, более избирательно поражающие опухолевые клетки и способные лучше вызывать иммунный ответ.
К сожалению, эффект онколитических вирусов может быть временным из-за роста раковых клеткой, которые вирус изначально не инфицировал. Клинические испытания показывают, что лишь небольшой процент пациентов полностью отвечают на терапию существующими онколитическими вирусами.
Уже ясно, что не все виды опухолей отвечают на онколитическую вирусную терапию. Наибольшего успеха удалось добиться в лечении меланомы и опухолей желудочно-кишечного тракта [9]. Ученым еще предстоит научиться персонализировать вирусную онколитическую терапию — подбирать вирусы для конкретного пациента и его опухоли с индивидуальным набором молекулярных черт.
Будущее онколитической вирусной терапии
Современная противоопухолевая медикаментозная терапия стоит на трех китах: химиотерапия, таргетная и иммунотерапия. Главная цель любой из них — убить раковые клетки, но не трогать здоровые. Каждая разновидность лечения справляется с этой задачей с разной долей успеха. Препараты, которые, в отличие от химиотерапии, избегают угнетения иммунитета и, наоборот, усиливают собственный противоопухолевый иммунитет человека, стали новой надеждой терапии рака. Оказалось, что вирусы способны вызывать такой противоопухолевый ответ. В отличие от таргетной терапии, мишень которой — определенная генетическая мутация, вирусная терапия эффективна против раковых клеток с разным набором генетических изменений. Эти качества однозначно делают онколитическую терапию привлекательной. Более того, доклинические исследования показывают, что лучевая и химиотерапия могут синергично работать вместе с вирусной терапией, улучшая результаты одиночной работы [19], [20].
Пожалуй, самой перспективной комбинацией с точки зрения эффективности станет комбинация онколитических вирусов и ингибиторов контрольных точек иммунного ответа или других новых иммуномодулирующих препаратов. Ингибиторы контрольных точек иммунного ответа — это препараты, которые убирают тормоза иммунного ответа, заставляя их вновь уничтожать врага. Комбинация таких препаратов с вирусной терапией может значительно повысить эффективность иммунного надзора: полицейские будут знать все фотороботы врагов и без всяких тормозов будут отлавливать и уничтожать их.
Так, посмотрев на обе стороны медали, можно перестать видеть в вирусах исключительно врагов и разглядеть в них возможного союзника в борьбе против рака.
Сегодня доступны анализы, которые помогают выявить генетические изменения в опухолевых клетках. Все эти мутации относительно легко обнаружить постфактум — а вот об их причинах зачастую остается только догадываться. К повреждению генов могут приводить некоторые химические вещества (они называются канцерогенами), физические факторы (радиация, рентгеновское, ультрафиолетовое излучение, ожоги), инфекции, хронические воспалительные процессы. В конце концов, ошибка в ДНК может произойти случайно.
Одна из причин злокачественного перерождения клеток — вирусы. Самые знаменитые возбудители, способные приводить к таким фатальным последствиям — вирусы папилломы человека, сокращенно ВПЧ. Они передаются половым путем и могут приводить к раку шейки матки, а также ряду других онкологических заболеваний.
Все ли ВПЧ опасны?
Вирусами папилломы заражается большинство взрослых людей с началом половой жизни. Этому способствуют беспорядочные половые связи и незащищенный секс. Презервативы снижают риск передачи инфекции, но не защищают полностью.
Рак вызывают ВПЧ высокого риска. К этой группе относятся 14 типов вируса, особенно опасны типы 16 и 18. Именно они ответственны за большинство случаев рака шейки матки у женщин.
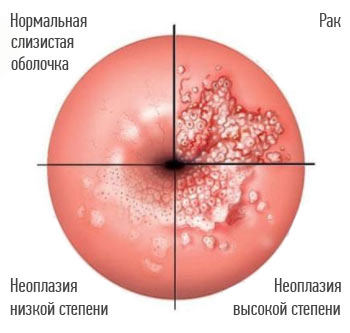
Изменения, которые вызывают ВПЧ высокого онкогенного риска в шейке матки: нормальная слизистая оболочка, внутриэпителиальная неоплазия, рак.
Какие злокачественные опухоли развиваются из-за ВПЧ?
Доказано, что вирусы папилломы человека высокого риска (главным образом 16 и 18 типа) ответственны за 70% случаев рака шейки матки. Эти возбудители способны также приводить к ряду других онкологических заболеваний у женщин и мужчин:
- Рак ротоглотки в большинстве случаев развивается в области миндалин и корня языка. Традиционно основным фактором риска развития этих злокачественных опухолей считается курение. Однако, недавние исследования показали, что от 60 до 70% случаев связаны с ВПЧ. Согласно современным представлениям, в большинстве случаев к раку ротоглотки приводит сочетание папилломавирусной инфекции, курения и частого употребления алкоголя. В последние десятилетия растет распространенность рака ротоглотки, связанного с ВПЧ, у молодых людей, которые не курят и не злоупотребляют алкоголем, но имеют в анамнезе несколько половых партнерш, с которыми занимались в том числе оральным сексом. При таких злокачественных опухолях ротоглотки, вызванных ВПЧ, у непьющих и некурящих людей, прогноз обычно более благоприятный, так как они лучше отвечают на химиотерапию и лучевую терапию.
- Рак анального канала связан с вирусами папилломы более чем в 90% случаев. Причем, число новых случаев этого онкозаболевания и смертей от него в развитых странах растет с каждым годом. У женщин рак анального канала встречается чаще, чем у мужчин.
- Рак полового члена связан с ВПЧ в 60% случаев.
- Рак влагалища также в большинстве случаев (75%) вызван вирусами папилломы высокого риска.
- Рак вульвы связан с ВПЧ в 70% случаев.
С вирусами папилломы человека связано около 5% всех онкологических заболеваний в мире: 3% у женщин и 2% у мужчин.
Какова вероятность, что ВПЧ приведет к раку?
Вероятность того, что вирус папилломы надолго сохранится в организме и приведет к онкологическому заболеванию, зависит от ряда факторов:
- Тип ВПЧ — относится ли он к высокому онкогенному риску.
- Состояние иммунной системы человека. Вероятность стойкой инфекции, развития предраковых состояний и рака повышена у ВИЧ-инфицированных людей, при различных иммунодефицитных состояниях.
- Сопутствующие инфекции, передающиеся половым путем, такие как гонорея, герпесвирусная инфекция, хламидиоз.
- Количество детей у женщины и рождение первого ребенка в юном возрасте.
- Курение.
Если ВПЧ с высоким онкогенным риском заразилась женщина с нормальным иммунитетом, то, для того чтобы развился рак шейки матки, обычно должно пройти 15–20 лет. У женщин с ВИЧ-инфекцией и иммунодефицитными состояниями этот срок сокращается до 5–10 лет.
Как вирусы папилломы человека вызывают рак?
Вирусы — очень странные создания, которые сильно отличаются от клеточных форм жизни. В настоящее время ученые до конца не решили — можно ли вообще считать эти инфекционные агенты живыми. По сути вирус представляет собой генетический материал, окруженный белковой оболочкой. Он не может размножаться самостоятельно — для этого ему нужна клетка какого-нибудь организма, которая после заражения превращается в фабрику по производству новых вирусных частиц.
Кроме того, вирусный ген E6 влияет на работу белка myc, который участвует в регуляции клеточных делений и запрограммированной клеточной смерти — апоптоза. Итогом также становится активация теломеразы.
Изучать эти механизмы очень важно, потому что знания о них, возможно, помогут создать эффективные методы лечения папилломавирусной инфекции и профилактики развития рака.
В норме иммунная система распознаёт клетки, зараженные вирусом, и уничтожает их. Если этого не происходит, то инфицированные клетки продолжают размножаться, со временем возникают предраковые изменения, а затем и злокачественная опухоль.
Можно ли излечиться от инфекции, вызванной ВПЧ?
Методов лечения, направленных непосредственно против ВПЧ, в настоящее время не существует. Папилломы и кондиломы, а также предраковые изменения, вызванные ВПЧ, можно удалить хирургически, с помощью лазера, криохирургии. При поражении шейки матки применяют петлевую электрохирургическую эксцизию (удаление патологического образования с помощью проволочной петли, нагретой электрическим током), конизацию (удаление конусообразного участка ткани шейки матки). Однако, важно понимать, что с помощью операции невозможно удалить вирус из организма.
Меры профилактики
Хотя методов лечения, направленных против ВПЧ, не существует, есть эффективные методы профилактики. Она бывает первичной и вторичной.
В 2020 году ученые доказали, что вакцины против ВПЧ предотвращают не только предраковые изменения в шейке матки, но и инвазивный рак.
Другие меры первичной профилактики злокачественных опухолей, вызванных ВПЧ:
- Половое воспитание, с учетом возраста детей и культурных особенностей социума.
- Использование презервативов. Врачи должны рассказывать населению о том, что этот метод контрацепции помогает защититься от опасных инфекций, в том числе снизить риск заражения ВПЧ.
- Отказ от курения. В этом отношении врачам и ученым также важно вести просветительскую работу.
- Мужское обрезание. Рак полового члена часто развивается в области крайней плоти, поэтому это эффективная профилактическая мера. Так называемое женское обрезание недопустимо даже под предлогом защиты от инфекций – в любом виде это однозначно калечащая операция, которая лишает женщину возможности вести полноценную половую жизнь.
Вторичная профилактика направлена на предупреждение развития злокачественных опухолей у людей, которые уже заражены ВПЧ высокого риска. Всем женщинам с началом половой жизни (в том числе вакцинированным) нужно регулярно проходить скрининг на рак шейки матки:
- До 65 лет — ПАП-тест (мазок Папаниколау) каждые 3 года или ПАП-тест в сочетании с анализами на ВПЧ каждые 5 лет. По крайней мере раз в год необходимо проходить профилактические осмотры у врача-гинеколога.
- Старше 65 лет: если в течение последних 10 лет женщина регулярно проходила скрининг, и в течение последних 25 лет у нее не было обнаружено злокачественных опухолей или предраковых состояний (внутриэпителиальная неоплазия CIN 2 или более серьезное поражение), то скрининг можно прекратить.
- Если у женщины была удалена матка вместе с шейкой (не по поводу рака или тяжелого предракового поражения) — скрининг можно не проходить. Если матка была удалена, но ее шейка оставлена — скрининг нужно проходить, как всем.
Исследования также показывают, что для людей из группы повышенного риска (занимающихся анальным сексом, ВИЧ-инфицированных) также полезно сдавать мазок Папаниколау из анального канала. Злокачественную опухоль или предраковые изменения в ротовой полости, ротоглотке может обнаружить врач-стоматолог — это еще один повод регулярно проходить профилактические осмотры.
Скрининг помогает выявить рак на ранней стадии и своевременно начать лечение — за счет этого существенно улучшается прогноз.
Конечно же, важно обращать внимание на любые подозрительные симптомы и не тянуть с визитом к врачу. Например, рак шейки матки может проявляться в виде аномальных вагинальных кровотечений (в промежутках между месячными, во время секса, в постменопаузе), болей в области таза, болезненности во время половых контактов. Эти симптомы не обязательно свидетельствуют о том, что у женщины злокачественная опухоль, чаще всего они указывают на другие заболевания. Но установить точный диагноз сможет только врач после обследования.
Многие вирусы — наши враги. Они вызывают опасные заболевания, некоторые из которых распространяются в масштабах крупных эпидемий и сильно меняют жизнь всего общества. За примерами далеко ходить не нужно — в 2020 году инфекция COVID-19, вызванная новым коронавирусом, унесла многие жизни и стала серьезным испытанием для мировой экономики.
Некоторые вирусные инфекции способствуют развитию онкологических заболеваний. Так, вирусы папилломы человека (ВПЧ) 16 и 18 типов являются причиной 70% случаев рака шейки матки, вирусные гепатиты B и C приводят к раку печени.
Еще в конце XIX века врачи заметили, что у некоторых онкологических пациентов, заразившихся вирусными инфекциями, происходил спонтанный регресс злокачественных опухолей. С тех пор онкологов не покидала идея найти или создать вирус, который мог бы прицельно уничтожать раковые клетки. Цель была достигнута только столетие спустя — в октябре 2015 года, когда Управление по контролю качества медикаментов и пищевых продуктов США (FDA) зарегистрировало T-VEC. Пока это единственный в своем роде препарат, но продолжаются поиски новых.

Лечение с лавинообразным эффектом
В настоящее время существует много разных препаратов для лечения рака: к классической химиотерапии добавилась таргетная терапия и иммунотерапия, изучаются новые молекулы, возможности применения наночастиц. Так чем же ученых так заинтересовали онколитические вирусы?
Хуан Фуэйо (Juan Fueyo), доктор медицинских наук из онкологического центра Андерсона Техасского университета (Texas MD Anderson Cancer Center), занимающийся созданием онколитических вирусов, отмечает:
Онколитическая вирусная терапия вызывает растущий интерес со стороны исследователей по одной причине: она работает.
Завербованный враг: какой вирус входит в состав Имлайджика?
Ученые смогли изменить ДНК вируса так, чтобы он заражал только опухолевые клетки. При этом злокачественная опухоль получает двойной удар:
Механизмы действия талимогена лахерпарепвека пока еще изучены не до конца, их можно схематически представить следующим образом:
Генетически модифицированный вирус вводят в злокачественную опухоль
Вирус поражает опухолевые клетки и активирует иммунный ответ
Когда зараженная клетка разрушается, из нее выходят новые копии вируса и поражают другие клетки
Как проводят лечение?
Имлайджик применяют для лечения прогрессирующей меланомы III–IV стадий, которая не может быть удалена хирургически. Это помогает затормозить прогрессирование заболевания и продлить жизнь пациента. Препарат вводят непосредственно в злокачественную опухоль. С помощью T-VEC можно лечить меланому разных локализаций:
- на поверхности кожи;
- под кожей;
- метастатические очаги в лимфатических узлах.
Первые две инъекции препарата проводят с интервалом в 3 недели. Затем введения повторяют через каждые 2 недели. Курс обычно продолжается не менее 6 месяцев. Врач рассчитывает дозу препарата, в зависимости от размеров и количества опухолей. Инъекция может быть сделана только в один очаг или в несколько разных.
Перед началом лечения пациент должен сообщить врачу обо всех своих сопутствующих заболеваниях и препаратах, которые принимает, особенно если это глюкокортикостероиды и другие лекарственные средства, подавляющие иммунитет, противовирусные препараты. Необходимо поставить врача в известность, если пациент находится в постоянном близком контакте с людьми, у которых ослаблена иммунная система.
Чем подтверждена эффективность препарата?
Талимоген лахерпарепвек был одобрен FDA в октябре 2015 года по результатам III фазы клинических испытаний, в которых показал высокую эффективность при прогрессирующей неоперабельной меланоме.
Эффективность препарата Имлайджик была изучена во время исследования, в котором приняли участие 436 пациентов с меланомой на стадиях IIIB/C (опухоль, которая распространилась в регионарные лимфоузлы, соседние ткани) и IV (меланома с отдаленными метастазами). Пациентов случайным образом поделили на две группы: одни получали талимоген лахерпарепвек, другие — гранулоцитарно-макрофагальный колониестимулирующий фактор. Были получены следующие результаты:
- У 48 (16,3%) из 295 пациентов, получавших Имлайджик, отмечался стойкий ответ, по сравнению с 2,1% (3 из 141 пациента) в контрольной группе. При этом у 14 (29,1%) из 48 пациентов, ответивших на лечение вирусом, отмечался стойкий полный ответ (исчезновение опухоли в течение 6 месяцев лечения и более), у 34 пациентов (70,8%) — стойкий частичный ответ (в течение 6 месяцев лечения и более опухоли уменьшились не менее чем на 50%).
- У 78 (26,4%) из 295 пациентов, получавших Имлайджик, меланомы уменьшились в два раза и более. Аналогичный эффект в контрольной группе отмечался только у 8 (5,7%) пациентов.
- В среднем у пациентов, получавших Имлайджик, ответ был достигнут через 4,1 месяца. При этом некоторые участники начали реагировать на лечение уже спустя 1,2 месяца, а некоторые — только через 16,7 месяца.
Также были проведены клинические испытания, которые показали хорошую эффективность онколитического вируса при меланоме в сочетании с иммунопрепаратами из группы ингибиторов контрольных точек — Пембролизумабом (Кейтруда), Ипилимумабом (Ервой). В настоящее время проводятся новые исследования, которые помогут лучше определить показания к применению талимогена лахерпарепвека самостоятельно и в комбинациях с другими препаратами.

Противопоказания и побочные эффекты
Как и всякий лекарственный препарат, талимоген лахерпарепвек может вызывать некоторые побочные эффекты. Чаще всего встречаются такие общие симптомы, как постоянное чувство усталости, повышенная утомляемость, озноб, повышение температуры тела, болезненность в месте введения препарата, проявления, напоминающие грипп.
Необходимо немедленно обратиться к врачу, если появились такие симптомы, как:
На данный момент известны пока еще не все побочные эффекты данного препарата, их изучение продолжается в клинических исследованиях и в рамках постмаркетинга.
Основные противопоказания к применению препарата:
- ВИЧ-инфекция.
- Прием глюкокортикостероидов и других препаратов, подавляющих иммунитет.
- Злокачественные заболевания крови, опухолевое поражение красного костного мозга.
- Другие иммунодефицитные состояния.
- Беременность.
Меры предосторожности
Несмотря на то, что вирус герпеса в препарате генетически модифицирован и ослаблен, он продолжает оставаться возбудителем инфекционного заболевания. Во время лечения нужно соблюдать некоторые меры, чтобы не допустить его распространения:
- После укола врач наложит повязку. Нельзя ее трогать, прикасаться к месту инъекции, чесать его.
- Место инъекции не должно соприкасаться с кожей других людей.
- Перед тем как самостоятельно менять повязку, нужно надеть медицинские перчатки. Это можно делать только с разрешения врача. Лучше, если смену повязки будут производить медицинские сотрудники в клинике.
- Как минимум в течение одной недели (или дольше, если имеется мокнутие) место укола нужно защищать повязкой, которая не допускает доступа воздуха и влаги.
- Если повязка перестала плотно держаться, ее нужно немедленно заменить.
- Снятую повязку и все средства, которыми обрабатывалось место укола, нужно сразу поместить в герметичный пакет, плотно закрыть, после чего его можно выбросить.
Поиски союзников в мире вирусов продолжаются
Терапия онколитическими вирусами — одновременно очень давнее и молодое направление в лечении онкологических заболеваний. Ученые уже целое столетие работают над созданием возбудителей, которые могли бы прицельно поражать раковые клетки, но первый и единственный препарат появился совсем недавно. Исследователи не планируют на нем останавливаться.
Большинство научных работ посвящено применению вирусов при меланоме и опухолях головного мозга. Классически такие препараты предлагается вводить непосредственно в злокачественное новообразование. Однако, в ходе одного исследования было обнаружено, что онколитический реовирус, введенный внутривенно, может успешно проникать в центральную нервную систему и находящуюся в ней опухолевую ткань. Этот возбудитель вызывает у человека симптомы простуды и кишечной инфекции.
В другом исследовании изучалось терапевтическое применение вируса Мараба как способ повысить эффективность химиотерапии при трижды негативном раке молочной железы у мышей. Эти злокачественные опухоли лишены рецепторов к гормонам и белка-рецептора HER2, и их сложно лечить.
Еще одним перспективным кандидатом в онколитические вирусы является возбудитель кори. В России в 2020 году успешно завершился доклинический этап испытаний генетически модифицированного онколитического вируса на основе вакцины против оспы.
Читайте также:

