Организация генетического аппарата у вирусов
Обновлено: 24.04.2024
Вирусы являются одним из излюбленных объектов молекулярной генетики благодаря простому строению и малой молекулярной массе их геномов, которая в 106 раз меньше массы генома эукариотической клетки. Организация генетического аппарата у ряда вирусов, например у sv40, настолько сходна с таковой генов эукариотической клетки, что получила название минихромосомы. Минихромосома широко используется для изучения организации и репликации ДНК.
Структурная организация генома клетки
В составе генома имеются структурные гены, кодирующие определенные биополимеры (белки или РНК), и регуляторные гены, которые контролируют функцию структурных генов. Регуляция происходит с помощью белковых продуктов регуляторных генов — репрессоров, подавляющих активность структурных генов. Регуляторными участками генов, контролирующих транскрипцию, являются усилитель транскрипции (enhancer) и промотор — область, предшествующая структурным генам, и определяющая место специфического связывания РНК-полимеразы.
Характерной особенностью генов эукариотической клетки является их мозаичная структура, т. е. прерывистость гена. В составе гена, кодирующего один белок, кодирующие участки прерываются вставочными последовательностями, которые не несут никакой кодирующей информации и не транслируются. Кодирующие участки гена называются экзонами, а вставки — нитронами.

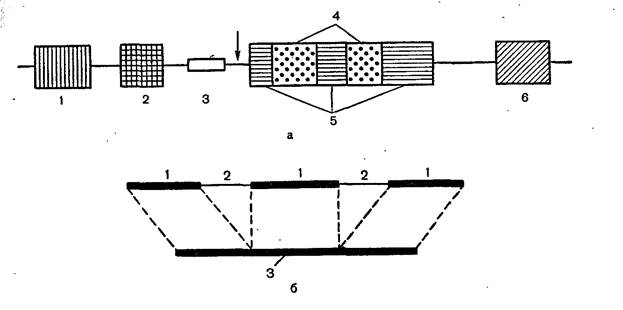
Строение эукариотического гена и его транскрипция.
а строение эукариотического гена 8У40: 1—усилитель транскрипции; 2—
промотор; 3— инициация репликации ДНК вируса (origin); 4— интроны; 5— экзоны (кодирующие области гена); 6— терминирующая последовательность ААТААА; стрелка обозначает участок начала транскрипции, б — схема сплайсинга при созревании иРНК: 1—экзоны, 2—интроны, 3—зрелая иРНК.
Основной особенностью вирусного генома является то, что наследственная информация у вирусов может быть записана как на ДНК, так и на РНК. Геном ДНК-содержащих вирусов двухнитевой (исключение составляют парвовирусы, имеющие однонитевую ДНК), несегментированный и проявляет инфекционные свойства. У вирусов, принадлежащих к родам Poxvirus и Hepadnavirus геном представлен двумя цепочками ДНК разной длины. Геном большинства РНК-содержащих вирусов однонитевой (исключение составляют реовирусы и ретровирусы, обладающие двунитевыми геномами) и может быть сегментированным (представители родов Retrovirus, Orthomyxovirus , Arenavirus и Reovirus ) или несегментированным.
Вирусные РНК в зависимости от выполняемых функций подразделяются на две группы. К первой группе относятся РНК, способные непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е выполнять функции иРНК и мРНК. Их называют плюс-нити РНК и обозначают как +РНК (позитивный геном). Они имеют характерные окончания (`шапочки') для специфического распознавания рибосом.
У другой группы вирусов РНК не способна транслировать генетическую информацию непосредственно на рибосомы и функционировать как иРНК. Такие РНК служат матрицей для образования иРНК, т.е. при репликации первоначально синтезируется матрица (+РНК) для синтеза -РНК. Такой тип РНК определяют, как минус-нить и обозначают -РНК (негативный геном). У вирусов этой группы репликация РНК отличается от транскрипции по длине образующихся молекул: при репликации длина РНК соответствует материнской нити, а при транскрипции образуются укороченные молекулы иРНК. Молекулы +РНК проявляют инфекционность, а -РНК не проявляют инфекционные свойства и для воспроизведения должны транскрибироваться в +РНК.
Исключение составляют ретровирусы, которые содержат однонитевую +РНК, служащую матрицей для вирусной РНК-зависимой ДНК-полимеразы (обратной транскриптазы). При помощи этого фермента информация переписывается с РНК на ДНК, в результате чего образуется ДНК-провирус, интегрирующийся в клеточный геном.
L Плазмиды несут необязательные для клетки-хозяина гены и придают бактериям дополнительные свойства, которые могут им обеспечить преимущества по сравнению с бактериями, не имеющими плазмид.
ПЛАЗМИДЫ
L Это внехромосомная генетическая структура бактерий, представляющая замкнутое кольцо двунитевой ДНК, находящейся в цитоплазме в автономном состоянии и ориентирующаяся на передачу хромосомы, будучи с нею в интегрированном состоянии.
Конъюгативная плазмида
l Плазмиды – это очень удобная модель для генной инженерии.
Вирусы являются одним из излюбленных объектов молекулярной генетики благодаря простому строению и малой молекулярной массе их геномов, которая в 106 раз меньше массы генома эукариотической клетки. Организация генетического аппарата у ряда вирусов, например у sv40, настолько сходна с таковой генов эукариотической клетки, что пблучила название минихромосомы. Минихромосома широко используется для изучения организации и репликации ДНК.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ГЕНОМА КЛЕТКИ
В составе генома имеются структурные гены, кодирующие определенные* биополимеры (белки или РНК), и регуляторные гены, которые контролируют функцию структурных генов. Регуляция происходит с помощью белковых продуктов регуляторных генов — репрессоров, подавляющих активность структурных генов. Регуляторными участками генов, контролирующих транскрипцию, являются усилитель транскрипции (enhancer) и промотор — область, предшествующая структурным генам и определяющая место специфического связывания РНК-полимеразы.
Характерной особенностью генов эукариотической клетки является их мозаичная структура, т. е. прерывистость гена. В составе гена, кодирующего один белок, кодирующие участки прерываются вставочными последовательностями, которые не несут никакой кодирующей информации и не транслируются. Кодирующие участки гена называются экзонами, а вставки — нитронами (рис. 25).
Строение эукариотического гена и его транскрипция.
а_ строение эукариотического гена 8У40: 1—усилитель транскрипции; 2—
промотор; 3— инициация репликации ДНК вируса (origin); 4— интроны; 5— экзоны (кодирующие области гена); 6— терминирующая последовательность ААТААА; стрелка обозначает участок начала транскрипции, б — схема сплайсинга при созревании иРНК: 1—экзоны, 2—интроны, 3—зрелая иРНК.

Основной особенностью вирусного генома является то, что наследственная информация у вирусов может быть записана как на ДНК, так и на РНК. Геном ДНК-содержащих вирусов двухнитевой (исключение составляют парвовирусы, имеющие однонитевую ДНК), несегментированный и проявляет инфекционные свойства. У вирусов, принадлежащих к родам Poxvirus и Hepadnavirus геном представлен двумя цепочками ДНК разной длины. Геном большинства РНК-содержащих вирусов однонитевой (исключение составляют реовирусы и ретровирусы, обладающие двунитевыми геномами) и может быть сегментированным (представители родов Retrovirus , Orthomyxovirus , Arenavirus и Reovirus ) или несегментированным.
Вирусные РНК в зависимости от выполняемых функций подразделяются на две группы. К первой группе относятся РНК, способные непосредственно транслировать генетическую информацию на рибосомы чувствительной клетки, т.е выполнять функции иРНК и мРНК. Их называют плюс-нити РНК и обозначают как +РНК (позитивный геном). Они имеют характерные окончания (`шапочки') для специфического распознавания рибосом.
У другой группы вирусов РНК не способна транслировать генетическую информацию непосредственно на рибосомы и функционировать как иРНК. Такие РНК служат матрицей для образования иРНК, т.е. при репликации первоначально синтезируется матрица (+РНК) для синтеза -РНК. Такой тип РНК определяют как минус-нить и обозначают -РНК (негативный геном). У вирусов этой группы репликация РНК отличается от транскрипции по длине образующихся молекул: при репликации длина РНК соответствует материнской нити, а при транскрипции образуются укороченные молекулы иРНК. Молекулы +РНК проявляют инфекционность, а -РНК не проявляют инфекционные свойства и для воспроизведения должны транскрибироваться в +РНК.
Исключение составляют ретровирусы, которые содержат однонитевую +РНК, служащую матрицей для вирусной РНК-зависимой ДНК-полимеразы (обратной транскриптазы). При помощи этого фермента информация переписывается с РНК на ДНК, в результате чего образуется ДНК-провирус, интегрирующийся в клеточный геном.
ИНФОРМАЦИОННОЙ ЕМКОСТИ ВИРУСНОГО ГЕНОМА
У многих вирусов молекулярная масса синтезирующихся белков превышает теоретически рассчитанную. Этот феномен объясняется наличием у вирусов механизмов, позволяющих получить развернутую генетическую информацию при максимальной экономии генетического материала; подобные механизмы выработаны в процессе эволюции вирусов как генетических паразитов.
Способами увеличения генетической информации являются: 1) двукратное считывание одной и той же иРНК, но с другого инициирующего кодона; 2) сдвиг рамки трансляции; 3) сплайсинг; 4) транскрипция с перекрывающихся областей ДНК и др.
2) Трансляция может происходить без сдвига рамки и со сдвигом рамки. Генетический код является триплетным, это означает, что три нуклеотида, составляющих триплет, или кодон, кодируют одну аминокислоту. В том-случае, если триплеты сохранены и генетический код не изменился, то при трансляции с двух разных инициирующих кодонов будут синтезироваться полипептиды, представляющие собой укороченную копию первого полипептида (трансляция без сдвига рамки).
В том случае, если произошел сдвиг на один или два нуклеотида, образуются новые триплеты (кодоны) и появляется новый генетический код. В этом случае одна молекула иРНК может транслироваться с образованием двух уникальных белков, т. е. таких белков, у которых нет идентичных аминокислотных последовательностей.
3) Сплайсинг со сдвигом рамки широко используется у ряда вирусов (вирусы гриппа, парамиксовирусы, буньяви-русы, аденовирусы, паповавирусы, парвовирусы и др.). Один и тот же ген парамиксовирусов (вирус Сендай) кодирует два уникальных белка: структурный белок Р и неструктурный белок С.
Одним из способов экономии генетического материала является нарезание полипептида-предшественника на участки разной длины, в результате чего образуются разные полипептиды с перекрывающимися аминокислотными последовательностями. Таким образом, число реальных генов превосходит молекулярную массу генома. Основанный на длине генома расчет числа генов неизменно приведет к ошибочным результатам. Более точные представления о числе генов можно получить путем биохимического и генетического анализов.
Конечная цель генетического изучения вирусов животных — понимание деталей структуры и функции вирусного генома и каждого из генных продуктов вируса.
Методы исследования генетики вирусов.
На раннем этапе генетические исследования вирусов животных сдерживались из-за отсутствия подходящих методов исследования индивидуального потомства при смешанном заражении. Решение этой проблемы было найдено Дульбекко [32, 33], который разработал метод бляшек для цитоцидных вирусов. Использование метода бляшек позволило точно определять количество потомства, получать чистые клональные штаммы вируса и очищать вирусы от других примесных вирусов и дефектных интерферирующих частиц того же типа вируса. С помощью этого метода была получена система, пригодная для анализа условно-летальных мутаций. Таким образом, в значительной степени генетика вирусов животных началась с введения в практику метода бляшек. В настоящее время применимость метода бляшек рассматривают как необходимое условие для начала исследований генетики новой группы вирусов подобно тому, как разработка метода фокусов трансформации для нецитолитических, трансформирующих вирусов [151] послужила ключом к развитию генетических исследований этих вирусов.
При изучении регуляции синтеза вирусных нуклеиновых кислот и белков во многих системах, например у герпесвирусов, с успехом использовали ингибиторы белкового синтеза, такие как пуромицин или циклогексимид, а также ингибиторы синтеза РНК, например актиномицин Е) Разработка электрофоретических систем с высоким разрешением для анализа белков и нуклеиновых кислот позволила провести генетические исследования вирусов с сегментированным РНК-геномом, используя в качестве маркеров полиморфизм электрофоретической подвижности РНК-сегментов и белков Применение рестрикционных эндонуклеаз сыграло аналогичную роль для ДНК-содержащих вирусов с использованием в качестве генетических маркеров полиморфизма подвижности фрагментов ДНК и белков.
Методы исследования транскрипции и трансляции in vitro вирусов доказали свою эффективность при построении физических карт, особенно в системах, где отсутствует генетическая рекомбинация. В последнее время генетические приемы используют для изучения вирусного патогенеза и иммунного ответа хозяина на вирусную инфекцию, если хотят сопоставить специфические свойства вируса с индивидуальными вирусными генами и генными продуктами. Иными словами, современный генетик, изучающий вирусы животных, охотно заимствует методы у биохимика и применяет их в генетическом анализе. Наряду с этим генетики и другие специалисты используют генетический анализ для ответа на вопросы, которым традиционно не уделялось должного внимания. Такое слияние дисциплин очень помогло генетикам и в значительной мере определило быстрый прогресс этой науки в последние несколько лет.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ГЕНОМА ВИРУСА
Вирусы являются одним из излюбленных объектов молекулярной генетики благодаря простому строению и малой молекулярной массе их геномов, которая в 10 6 раз меньше массы генома эукариотической клетки. Организация генетического аппарата у ряда вирусов, например у SV40, настолько сходна с таковой генов эукариотической клетки, что получила название минихромосомы. Минихромосома широко используется для изучения организации и репликации ДНК.
Число генов у вирусов значительно варьирует: от 3—4 генов у просто устроенных вирусов (парвовирусы) до 150 генов и больше у сложно устроенных (вирус оспы). Геном вирусов животных является гаплоидным, за исключением ретровирусов, которые имеют диплоидный геном, представленный двумя идентичными молекулами РНК. У вирусов с фрагментарным геномом (вирусы гриппа, реовирусы) каждый фрагмент обычно представляет собой один ген.
В составе генов ДНК-содержащих вирусов есть регуляторные участки, в том числе промотор, контролирующие функцию структурных генов. Сильными промоторами являются концы многих вирусных ДНК, представляющие собой длинные концевые повторы, сильный промотор имеют гены тимидинкиназы вирусов оспы и герпеса. Эти промоторы используются в генной инженерии для усиления транскрипции изучаемого гена.
СПОСОБЫ УВЕЛИЧЕНИЯ ИНФОРМАЦИОННОЙ ЕМКОСТИ ВИРУСНОГО ГЕНОМА
У многих вирусов молекулярная масса синтезирующихся белков превышает теоретически рассчитанную. Этот феномен объясняется наличием у вирусов механизмов, позволяющих получить развернутую генетическую информацию при максимальной экономии генетического материала; подобные механизмы выработаны в процессе эволюции вирусов как генетических паразитов.
Способами увеличения генетической информации являются: 1) двукратное считывание одной и той же иРНК, но с другого инициирующего кодона; 2) сдвиг рамки трансляции; 3) сплайсинг; 4) транскрипция с перекрывающихся областей ДНК и др.

Трансляция может происходить без сдвига рамки и со сдвигом рамки. Генетический код является триплетным, это означает, что три нуклеотида, составляющих триплет, или кодон, кодируют одну аминокислоту. В том случае, если триплеты сохранены и генетический код не изменился, то при трансляции с двух разных инициирующих кодонов будут синтезироваться полипептиды, представляющие собой укороченную копию первого полипептида (трансляция без сдвига рамки).
В том случае, если произошел сдвиг на один или два нуклеотида, образуются новые триплеты (кодоны) и появляется новый генетический код. В этом случае одна молекула иРНК может транслироваться с образованием двух уникальных белков, т. е. таких белков, у которых нет идентичных аминокислотных последовательностей.
Одним из способов экономии генетического материала является нарезание полипептида-предшественника на участки разной длины, в результате чего образуются разные полипептиды с перекрывающимися аминокислотными последовательностями. Подобный механизм нарезания имеет место у аденоассоциированных вирусов и у SV40.
Таким образом, число реальных генов превосходит молекулярную массу генома. Основанный на длине генома расчет числа генов неизменно приведет к ошибочным результатам. Более точные представления о числе генов можно получить путем биохимического и генетического анализов.
ОСНОВНЫЕ ПРОЦЕССЫ, КОНТРОЛИРУЮЩИЕ НАСЛЕДСТВЕННОСТЬ И ИЗМЕНЧИВОСТЬ ВИРУСОВ
Модификации. Модификациями называются не наследуемые (фенотипические) изменения у вирусов, обусловленные клеткой-хозяином. Эти изменения лежат в основе адаптации вируса к новому хозяину и преодоления зависимого от хозяина ограничения. Модификации нуклеиновых кислот вирусов осуществляют клеточные ферменты, ответственные за ограничение (рестрикцию) репродукции вируса.
Мутации. В основе изменчивости вирусов лежат мутации, т. е. изменения состава и последовательностей нуклеотидов вирусного генома. Мутации происходят у всех вирусов, независимо от того, является ли их генетическим аппаратом ДНК или РНК. В результате мутаций отдельные вирионы могут приобретать новые свойства. Дальнейшая судьба таких вирусов зависит от естественного отбора, сохраняющего популяцию, наиболее приспособленную к условиям существования.
Мутации могут иметь разные последствия. В одних случаях они ведут к изменению фенотипических проявлений в нормальных условиях. Например, увеличивается или уменьшается размер бляшек под агаровым покрытием; увеличивается или ослабляется нейровирулентность для определенного вида животных; вирус становится более чувствительным к действию химиотерапевтического агента и т. п.
В других случаях мутация является летальной, так как вследствие ее нарушается синтез или функция жизненно важного вирусспецифического белка, например вирусной полимеразы.
В некоторых случаях мутации являются условно летальными, так как вирусспецифический белок сохраняет свои функции в определенных, оптимальных для него, условиях и теряет эту способность в неразрешающих (непермиссивных) условиях. Типичным примером таких мутаций являются температурно-чувствительные (temperature sensitive) — ts-мутации, при которых вирус теряет способность размножения при повышенных температурах (39—42° С), сохраняя эту способность при обычных температурах выращивания (36—37° С).
По своему механизму мутации могут быть тоже разными. В одних случаях происходит делеция, т. е. выпадение одного или нескольких нуклеотидов, в других случаях происходит встраивание одного или нескольких нуклеотидов, а в некоторых случаях — замена одного нуклеотида другим.
Мутации могут быть прямыми и обратными. Прямые мутации меняют фенотип, а обратные мутации — реверсии — его восстанавливают. Возможны истинные реверсии, когда обратная мутация происходит в месте первичного повреждения, и псевдореверсии, если мутация происходит в другом участке дефектного гена (интрагенная супрессия) или в другом гене (экстрагенная супрессия). Реверсия не является редким событием, так как ревертанты обычно более приспособлены к данной клеточной системе. Поэтому при получении мутантов с заданными свойствами, например вакцинных штаммов, приходится считаться с возможной их реверсией к дикому типу.
Мутации носят случайный характер и объясняются статистическими законами.
В качестве физических мутагенов наиболее часто применяется ультрафиолетовое облучение, так как его энергия сопоставима с энергией химических связей. Реже применяются более жесткие виды облучения — рентгеновское и γ-облучение, а также обработка вирусных суспензий нейтронами, протонами, электронами и ядрами гелия, так как они вызывают сильные разрушения вирусных геномов и их инактивацию.
В качестве химических мутагенов применяют аналоги оснований (бромурацил, бромдезоксиуридин, 2-аминопурин, нитрозогуанидин и пр.), алкилирующие и флуоресцирующие соединения (профлавин), интеркалирующие агенты (актиномицин, этидий бромид), азотистую кислоту, гидроксиламин и многие другие.
ГЕНЕТИЧЕСКИЕ И НЕГЕНЕТИЧЕСКИЕ ВЗАИМОДЕЙСТВИЯ МЕЖДУ ВИРУСАМИ
Как в естественных, так и в экспериментальных условиях одна клетка может быть заражена не одним, а несколькими вирусами. В процессе такой смешанной инфекции могут иметь место различные формы взаимодействия как между вирусными геномами, так и между продуктами генов. При взаимодействии геномов могут наблюдаться такие формы генетических взаимодействий, как множественная реактивация, рекомбинация, пересортировка генов, кросс-реактивация, гетерозиготность. При взаимодействии на уровне продуктов генов могут иметь место негенетические взаимодействия: комплементация, интерференция, фенотипическое смешивание и др.
Множественная реактивация. Вирусная инфекция может возникнуть при заражении клетки несколькими ви-рионами с поврежденными геномами вследствие того, что функцию поврежденного гена может выполнять вирус, у которого этот ген не поврежден. Этот феномен был вначале обнаружен на бактериофагах и получил название множественной реактивации. В основе множественной реактивации лежит кооперативный процесс, при котором вирионы с поражением разных генов дополняют друг друга путем генетической рекомбинации, в результате чего репродуцируется исходный неповрежденный вирус. Эффективность множественности реактивации зависит от многих причин: степени повреждения генома вирионов, числа проникших в клетку вирионов, концентраций их в определенных участках клетки, аутоинтерференции поврежденных вирионов. Для множественной реактивации важное значение имеет расстояние между вирионами с поврежденными геномами внутри клетки. Обработка вирионов двухвалентными ионами металлов, ведущая к их агрегации, усиливает множественную реактивацию.
Рекомбинация. Генетической рекомбинацией называют обмен генетическим материалом, происходящий между родительскими вирусами. Возможен обмен полными генами (межгенная рекомбинация), так и участками одного и того же гена (внутригенная рекомбинация). Образующийся вирус-рекомбинант обладает свойствами, унаследованными от разных родителей.
Обычно рекомбинируемые штаммы обладают характерными признаками, которые обозначаются как маркеры. Например, были получены рекомбинанты между вирусами полиомиелита, обладающие повышенной устойчивостью и повышенной чувствительностью к гуанидину, разной нейровирулентностью, разной устойчивостью к повышенной температуре, разной чувствительностью к ингибиторам сывороток лошадей и коров и т. п. Для получения рекомбинантов используют штаммы, содержащие два или большее число маркеров.
Тест рекомбинации применяют для генетических исследований вирусов. С его помощью возможно построение генетических карт вирусов, в которых определяется, в каких участках генома произошли мутации, а также в условных единицах измеряется расстояние между разными мутациями.
Пересортировка генов. Вариантом рекомбинации является феномен, получивший название пересортировки генов. Она наблюдается при генетических взаимодействиях между вирусами, имеющими сегментированный геном. Образующиеся при этом гибридные формы вирусов называют реассортантами. Реассортанты вирусов гриппа получают при совместном культивировании вирусов с разными генами гемагглютинина и нейраминидазы. В этом случае из общего потомства путем нейтрализации соответствующих антигенов можно выделить интересующие исследователя варианты.
Существуют определенные группировки (констелляции или созвездия) генов, которые в данной системе клеток более стойки и делают вирус более жизнеспособным.
Сходные процессы пересортировки генов имеют место у вирусов гриппа типов А, В и С и у других вирусов с фрагментарным геном — у буньявирусов, аренавирусов (однонитчатые РНК) и реовирусов (ротавирусов) (двунитчатая РНК). Однако эти процессы не столь интенсивны и доступны изучению, как у вирусов гриппа.
Гетерозиготность. При совместном культивировании двух штаммов вируса может происходить формирование вирионов, содержащих в своем составе два разных генома или по крайней мере один полный геном и часть второго генома. Это явление названо гетерозиготностью.
Комплементация. Комплементация (дополнение) является таким видом негенетического взаимодействия при смешанной инфекции двумя вирусами, которое стимулирует репродукцию обоих партнеров или одного из них, но не изменяет генотипы вирусов. Принцип комплементации заключается в том, что вирус снабжает партнера недостающими компонентами, обычно белками, структурными или неструктурными.
Комплементация широко распространена среди вирусов и встречается как между родственными, так и неродственными вирусами. Феномен тесно связан с проблемой дефектности вирусов.
Поскольку в вирусной популяции помимо стандартных обычно присутствуют дефектные неинфекционные вирусные особи, в частности дефектные частицы, утратившие часть генетического материала, комплементация имеет место в инфекционном цикле многих вирусов и заключается в том, что члены популяции снабжают друг друга продуктами генов, которые дефектны у партнеров. Отличие комплементации от генетической рекомбинации заключается в отсутствии обмена генетическим материалом.
Комплементация встречается и у неродственных вирусов, принадлежащих к разным семействам. Одним из семейств, вирусы которого наиболее часто участвуют в комплементации, является семейство аденовирусов. В одних системах аденовирусы могут действовать как дефектные вирусы, в других — как помощники. Например, в культуре клеток почек макак резусов аденовирусы могут репродуцироваться только в присутствии SV40, который является в данном случае вирусом-помощником. В других системах сами аденовирусы действуют как вирусы-помощники, а вирусом-сателлитом является аденоассоци-ированный вирус, относящийся к семейству парвовирусов. Репродукция этого вируса полностью зависит от комплементирующего действия аденовирусов. Вирус гепатита В является помощником для дельта-агента, который покрывается его наружным белком — HBs-антигеном. Сочетание обоих вирусов обнаружено при наиболее тяжелых формах гепатита.
Возможна не только межцистронная, но и внутрицистронная комплементация в том случае, когда один ген кодирует несколько белков.
Фенотипическое смешивание. При совместном культивировании двух вирусов может наблюдаться феномен фенотипического смешивания, когда геном одного вируса бывает заключен в капсид, состоящий частично или полностью из белков другого вируса.
Фенотипическое смешивание наблюдается при смешанной инфекции,многими вирусами, причем эти вирусы могут быть как близкими друг другу (например, вирусы гриппа А и В или разные серологические подтипы вируса гриппа А), так и весьма далекими (онковирусы и рабдовирусы).
РЕСТРИКТАЗЫ И ФИЗИЧЕСКИЕ КАРТЫ ВИРУСОВ
Подлинную революцию в физическом картировании геномов вирусов произвело применение рестриктаз и секвенирование вирусных геномов. Рестриктазы имеют исключительное значение в молекулярной генетике вообще и генетической инженерии в частности. Их открытие (1968—1970 гг.) впервые дало возможность специфически расщеплять ДНК на строго определенные фрагменты, доступные для препаративного выделения и анализа.
Рестриктазы или эндодезоксирибонуклеазы — это просто организованные белки, являющиеся ферментами, широко распространенными среди прокариотов и участвующими в генетических процессах. В отличие от экзонук-леаз, отщепляющих концевые нуклеотиды или свободные остатки фосфорной кислоты, эндонуклеазы расщепляют молекулу ДНК изнутри, обычно — в местах, где преобладают пиримидиновые основания. Рестриктазы характеризуются высоковыраженной специфичностью, распознавая строго определенные последовательности нуклеотидов в двунитчатой ДНК.
Число новых рестриктаз стремительно нарастает и со временем, по-видимому, будут обнаружены рестриктазы, узнающие любую последовательность нуклеотидов.
Использование разных рестриктаз позволяет получать фрагменты разной величины, которые затем разделяются и анализируются путем электрофореза в агарозных или полиакриламидных гелях. Сочетание рестрикционного анализа с другими методами позволяет составить физические карты геномов вирусов. Физические карты вирусных геномов обозначают взаимное расположение генов, их границы, локализацию начала репликации, промоторов, лидеров, экзонов и интронов, сигнальных последовательностей и других генетических элементов.
Генетический код для синтеза белков вируса SV-40 записан не на одной, а на обеих нитях ДНК, а транскрипция разных генов идет в разных направлениях.
В настоящее время полностью расшифрованы нуклеотидные последовательности отдельных генов и целых геномов методом секвенирования (от англ. sequence — последовательность). Если речь идет о РНК-содержащих вирусах, то предварительным условием для дальнейшего их анализа является переписка РНК на ДНК с помощью РНК-зависимой ДНК-полимеразы (обратной транскриптазы), после чего генетический материал может быть подвергнут рестрикционному анализу.
Проектное задание к модулю
В качестве проектного задания студентам предлагается написание рефератов по следующим темам:
1. Природа дефектных вирусных геномов. Вирусы-сателлиты.
2. Вирусная интерференция
3. Необычные свойства ретровирусов
4. Трансформация клетки опухолеродными ДНК-вирусами
5. Классификация и основные свойства вирусов гриппа
6. Индукция специфического иммунного ответа на вирусы
7. Особенности репродукции пикорнавирусов
8. Семейство тогавирусов. Особенность репродукции и инфекционного процесса.
9. Вирус клещевого энцефалита.
10. Вирус бешенства
11. Вирусная персистенция
12. Основные свойства парамиксовирусов
13. Вирус кори. Биология возбудителя. Особенности патогенеза
14. Аденовирусы, их репликация и связь с другими вирусами
16. Пути распространения вирусных болезней растений.
17. Прионы. Возбудители или провокаторы или….
18. Вироиды как вирусоподобные инфекционные агенты.
19. Вирусы, вызывающие респираторные инфекции. Сравнительная характеристика
20. Место вирусов в биосфере.
21. Бактериофаги. Их морфологическое многообразие и взаимодействие с бактериями.
22. Атипичная пневмония и возможность происхождения новых вирусов
23. Роль вирусов в возникновении злокачественных опухолей
24. Особенности транскрипции РНК- содержащих вирусов.
25. Морфогенез вирусов или морфологические превращения в процессе репродукции.
Тест рубежного контроля

Обзор
У вирусов архей семейства Bicaudaviridae вирионы имеют крайне необычную морфологию: к одному или двум концам заостренного капсида прикрепляются белковые хвосты, длина которых может варьировать.
Автор
Редактор
Вирусы заражают все клеточные формы жизни, и археи — не исключение. Хотя сейчас известно гораздо меньше вирусов архей, чем вирусов бактерий и эукариот, разнообразие устройства их вирионов и используемых молекулярных механизмов поражает воображение: некоторые из них имеют вирионы в форме бутылки, у других генетический материал в вирионе хранится в форме А-ДНК, третьи обзавелись уникальным типом биологических мембран или используют для выхода из зараженной археи ранее неизвестные клеточные структуры. Наша статья посвящена этим пока еще малоизученным, но удивительно самобытным генетическим элементам.
Давно прошли те времена, когда археи считались обитателями исключительно тех мест, где никакая другая клеточная жизнь существовать не может, например, горячих источников. В действительности, архей можно найти везде, даже в желудочно-кишечном тракте человека, однако наиболее многочисленны они на глубоководьях морей и океанов. Так, показано, что археи, окисляющие ионы аммония до нитрата (они относятся к типу Thaumarchaeota) являются одной из самых многочисленных клеточных форм жизни в океанах. Неудивительно, что и вирусы архей также очень многочисленны: метагеномный анализ показал, что в некоторых зонах на долю вирусов архей приходится около 10% самых распространенных там вирусов. Объемы клеток архей, которые погибают из-за вирусов, тоже впечатляют: установлено, что в верхних 50 см океанического донного грунта клетки архей, лизированные вирусами, составляют до трети всей ежегодной биомассы погибших микробов, что соответствует 0,3–0,5 гигатоннам углерода ежегодно [1].
Все известные на данный момент вирусы архей имеют геномы, представленные ДНК: одноцепочечной или двухцепочечной, кольцевой или линейной. Недавно, однако, в горячих источниках Йеллоустонского национального парка, которые населены почти исключительно археей Sulfolobus solfataricus, с помощью метагеномики обнаружили вирусный РНК-геном, отдаленно напоминающий эукариотические РНК-вирусы, поэтому, возможно, существуют и РНК-содержащие вирусы архей.
Пока вирусы архей представлены 17 семействами. Стоит отметить, что вирусы архей, вообще-то, составляют две сильно различающиеся группы. К первой относят вирусы, которые структурно и генетически близки к вирусам бактерий и эукариот, а ко второй — вирусы, уникальные для архей и мало похожие на вирусы других клеточных форм. Практически все специфические для архей вирусы поражают представителей типа Crenarchaeota, а вирусы, близкие к бактериофагам и вирусам эукариот, чаще всего паразитируют на археях типа Euryarchaeota [1].
Строение вирусных частиц
Вирусы, специфичные для архей, нередко имеют вирионы необычной формы (рис. 1а).
Так, представители семейства Ampullaviridae имеют вирионы в виде бутылок из-под шампанского, причем поверх белков капсида они обтянуты липидной оболочкой. А у членов семейства Spiraviridae вирионы в виде спиралей. Столь необычная форма вирионов у вирусов этих двух семейств связана с особым способом упаковки генома при помощи белков капсида [1].

Рисунок 1а. Морфология вирионов вирусов, специфичных для архей. Просвечивающая электронная микроскопия.

Рисунок 1б. Морфология вирионов некоторых вирусов архей и бактерий
Некоторые специфичные для архей вирусы имеют веретеновидные капсиды. Среди них у вирусов семейства Fuselloviridae на одном из заостренных концов капсида находится пучок белковых филаментов, а у членов семейства Bicaudaviridae на одном или двух концах капсида — одиночные придатки в виде хвостов. Не менее удивительна морфология вирионов Guttaviridae: у этих вирусов вирионы тоже похожи на веретено, однако один их конец закруглен и имеет каплевидную форму [1].
У многих специфичных для архей вирусов нитчатые вирионы, которые могут нести специальные придатки, предназначенные для распознавания клеток архей. Иногда, как у вирусов семейства Tristromaviridae, капсид сформирован не одним, а тремя типами белков [1].
Некоторые вирусы, специфичные для архей, имеют сферические вирионы, причем иногда поверх капсида находятся липидная мембрана и еще один слой белков, из-за чего частицы принимают икосаэдрическую форму [1].
Вирионы Pleolipoviridae по строению похожи на везикулы, которые образуют многие археи: голая геномная ДНК находится внутри мембранного пузырька, который пронизан белками двух типов. Такие пузырьки могут содержать как одноцепочечную, так и двухцепочечную ДНК линейной или кольцевой формы [1].

Рисунок 2. Морфология вирионов вирусов архей, родственных бактериофагам и вирусам эукариот. Просвечивающая электронная микроскопия.
Чем можно объяснить столь необычную морфологию вирусов архей? Вирионы некоторых из них удалось не только рассмотреть под электронным микроскопом, но и детально изучить с помощью криоэлектронной микроскопии. Так ученые выяснили, что геномы некоторых вирусов архей в капсидах находятся в А-форме! Это первый известный случай, когда А-форма ДНК присутствует в живых организмах в нормальных условиях. Один из вирусов с геномом в виде А-ДНК, AFV1, имеет очень тонкую липидную оболочку с необычным химическим составом — главным ее компонентом является липид глицеролдибифитанилглицеролтетраэфир (GDGT-0), имеющий необычную U-образную конфигурацию (рис. 3). В мембране, состоящей их таких липидов, их гидрофильные головки обращены наружу, а гидрофобные дуги — внутрь. Наряду с фосфолипидным бислоем и монослоем архей такое строение можно считать третьим из известных типов биологических мембран [1].

Рисунок 3. Химическая структура GDGT-0 (вверху), его схематическое представление (внизу слева; красным цветом показаны гидрофильные головки) и модель (внизу справа) в U-образной конформации подпись
Геномы
Все выделенные на данный момент вирусы архей имеют ДНК-геномы (хотя, как отмечалось выше, в горячих источниках Йеллоустона с помощью метагеномики удалось найти РНК-геном возможного вируса архей). В большинстве случаев геном представлен двухцепочечной молекулой ДНК, и лишь у членов семейств Spiraviridae и Pleolipoviridae геномы состоят из одноцепочечной ДНК. Размеры геномов архейных вирусов варьируют от 5300 пар нуклеотидов (п.н.) у клававируса APBV1 (это один из мельчайших известных геномов ДНК-содержащих вирусов) до 143 800 п.н. у миовируса HGTV-1. Как правило, вирусы, специфичные для архей, имеют меньшие геномы, чем вирусы архей, родственные бактериофагам и вирусам эукариот [2].
Механизмы репликации геномов вирусов архей экспериментально изучены лишь для небольшого числа вирусов. Известно, что ДНК представителей порядка Caudovirales (которые, кстати, имеют самые большие геномы среди архейных вирусов) кодирует часть или даже все компоненты аппарата репликации ДНК: ДНК-полимеразы, белки скользящего зажима (PCNA), праймазы и хеликазы. Имеющие более скромные размеры геномов вирусы архей, как правило, кодируют белки, которые необходимы для привлечения аппарата репликации клетки-хозяина. Стоит, однако, отметить, что в геномах многих вирусов, специфичных для архей, не удалось найти белки, связанные с репликацией ДНК, так что они либо полностью зависимы от аппарата репликации клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы репликации ДНК. Например, удалось показать, что и инициация, и терминация репликации генома липотриксвируса AFV1 связаны с рекомбинационными процессами [1].
Механизмы упаковки генома в капсид у вирусов архей детально не изучены. Тем не менее известно, что члены порядка Caudovirales имеют гомологи терминазы, которая упаковывает геномную ДНК в пустой капсид. Механизм формирования вирионов с использованием терминазы используют также вирусы бактерий и эукариот. Можно предположить, что упаковка генома в капсид у вирусов архей протекает так же, как и у бактериофагов и вирусов эукариот, а вот в плане репликации ДНК вирусы архей или целиком зависят от клетки-хозяина, либо используют уникальные, пока еще не изученные механизмы [1].
Взаимодействие с клеткой-хозяином
Выход зрелых вирионов из клетки архей во многих случаях напоминает отпочковывание от эукариотической клетки-хозяина у вируса гриппа, ВИЧ и вируса Эбола. Когда вирион покидает клетку археи, он забирает с собой фрагмент ее мембраны, который становится дополнительной оболочкой поверх капсида. У некоторых вирусов архей финальные стадии созревания вирионов происходят уже после выхода из клетки, когда капсид претерпевает морфологические перестройки [1].
У некоторых вирусов архей (а именно, представителей семейств Rudiviridae и Turriviridae) все стадии созревания вириона проходят в цитоплазме клетки. Новые вирусные частицы покидают клетку через специальные структуры с семиосевой симметрией на их поверхности, которые получили название вирусассоциированных пирамид (virus-associated pyramids, VAP). VAP образуются на внутренней поверхности мембраны зараженной клетки, проходят сквозь ее поверхностный S-слой и открываются на финальных этапах инфекции, давая возможность вирионам выйти из клетки (рис. 4) [1].

Рисунок 4. Вирусассоциированная пирамида. а и б — Пирамида на поверхности клетки археи Pyrobaculum oguniense в закрытой (а) и открытой (б) конформациях. в и г — Открытая пирамида вируса SIRV2 на поверхности Sulfolobus islandicus. а–в — Визуализация с помощью трансмиссионной электронной микроскопии. г — С помощью электронной криотомографии (CryoET).
Выход некоторых вирусов архей из клетки сопровождается ее лизисом. К их числу относятся вирусы семейства Tristromaviridae, которые, хотя и развиваются целиком в цитоплазме, каким-то образом ухитряются приобрести липидную оболочку. Примечательно, что сифовирус ψM2 кодирует фермент псевдомуреинэндоизопептидазу, который разрушает псевдомуреиновую клеточную стенку археи [1].
Эволюция и родственные связи
Вирусы, специфичные для архей, как правило, заражают только представителей типа Crenarchaeota. Они отличаются от всех других вирусов не только нестандартной морфологией вирионов, но и генетически: около 90% их генов не имеет гомологов в существующих базах данных. В геномах некоторых архейных вирусов не удалось найти ни одного белка, для которого существовал бы функционально охарактеризованный белок-гомолог.
Иногда, если гомологию не удается установить по нуклеотидным или аминокислотным последовательностям, на помощь приходят пространственные структуры. Действительно, для различных белков вирусов архей получили пространственные структуры, но ситуация от этого не стала яснее: оказалось, что во многих из них содержатся совершенно уникальные структурные мотивы. Более того, функции многих генов вирусов архей совершенно непонятны: так, оказалось, что фузелловирус SSV1 может спокойно обойтись без половины своих генов. Можно предположить, что такие неохарактеризованные гены-сироты кодируют белки, участвующие во взаимодействии вируса с клеткой архей, например, противодействующие системам CRISPR-Cas [1].
Впрочем, многие вирусы архей родственны некоторым бактериофагам и вирусам эукариот. Однако вирусы, специфичные для архей, стоят особняком среди всех ДНК-содержащих вирусов. Более того, различные группы вирусов, специфичных для архей, неродственны друг другу и эволюционируют независимо друг от друга. Высказывается предположение, что некоторые группы специфичных для архей вирусов появились на заре эволюции клеточной жизни и были впоследствии утрачены бактериями и эукариотами. Другие группы специфичных архейных вирусов могли появиться в момент обособления домена архей или даже позже, в отдельных группах архей [1].
Любопытно, что некоторые вирусы архей родственны лишенным капсидов мобильным генетическим элементам (например, плазмидам) . Эти вирусы, так же как и мобильные генетические элементы, имеют родственные гены основных белков репликативного аппарата [1], [2].
Несмотря на то, что мы только-только начинаем приподнимать завесу тайны над вирусами архей, многие уже известные особенности их морфологии или генетического аппарата поражают воображение. Несомненно, дальнейшее изучение вирусов архей при помощи метагеномики и других подходов подарит нам множество сюрпризов.

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Читайте также:

