Организация генома вируса гепатита с
Обновлено: 24.04.2024
Вирус гепатита С (HCV) представляет собой небольшой вирус, покрытый липидной оболочкой, содержащей одноцепочечную РНК. HCV относится к флавивирусам, роду семейства тогавирусов. Между 5' и 3' терминальными участками генома вируса располагаются структурные и неструктурные гены (рис. 1). 6 Структурные гены (С - core, Е1, Е2) кодируют ядерный и оболочечные гликопротеиды, в то время как неструктурные гены (NS2, NS3, NS4, NS5) - ферменты, участвующие в репликации вируса. Внутри генома имеются вариабельные и гипервариабельные участки, 6, 7 и в зависимости от их строения выделяют по крайней мере 6 различных генотипов HCV (возможно, их 12 или больше). 5, 8, 9 Генотипы вируса, по-видимому, различаются по иммуногенности, географическому распределению и, вероятно, влияют на течение HCV-инфекции и результаты лечения (см. также "Зависимость тяжести течения от генотипа HCV", "Ответ на лечение ИФН альфа-2b, влияние генотипа HCV"). 5, 7, 8 Вариабельность генома также может снижать чувствительность имеющихся диагностикумов для тестирования донорской крови и осложнять разработку вакцин против вируса. 10 (В настоящее время все усилия направлены на разработку вакцин на основе core региона, являющегося относительно стабильным участком у всех генотипов). 11, 12
Разные генотипы могут выявляться на протяжении инфекции у одного и того же больного. 13, 14 Исходя из этого было предположено, что наличие более вариабельных участков генома может отражать стратегию ускользания вируса от механизмов защиты хозяина. 5, 13, 15 По мнению других исследователей, данный феномен не имеет значения для репликации вируса. 13
Рис. 1 Организация генома HCV (По Van der Poel и соавт., 6 воспроизведено с разрешения)
ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ ПРИ HCV-ИНФЕКЦИИ
Anti-HCV и HCV РНК
По мере расширения представлений о структуре HCV методы выявления вируса становятся все более чувствительными. В настоящее время нет тест-систем для прямого определения антигенов HCV и больные тестируются на антитела к вирусу (anti-HCV). Скрининговым тестом обычно является иммуноферментный анализ (ELISA) (описан ниже). Положительные результаты контролируются более чувствительными методами рекомбинантного иммуноблоттинга (RIBA). По возможности необходимо исследование HCV РНК (с помощью полимеразной цепной реакции или метода амплификации разветвленной ДНК) для подтверждения наличия или отсутствия вируса в сыворотке.
Скрининговые тесты. Первые тест-системы для выявления anti-HCV основывались на обнаружении антител к вирусному антигену c 100 (anti-c100) с помощью ELISA первого поколения (табл. 1). 16 Однако anti-c100 могут появляться через много лет после инфицирования HCV; при этом наблюдается высокая частота ложноположительных результатов в популяциях низкого риска (таких как доноры), 14, 17-20 при исследовании длительно хранившихся образцов крови и у больных с гипергаммаглобулинемией. 21-23
Второе поколение тест-систем ELISA является более чувствительным, позволяя обнаруживать антитела к другим вирусным белкам, включая с22 и с33 (табл. 1). 24-26 Антитела к данным антигенам обнаруживаются чаще, чем anti-c100, и появляются в более ранние сроки. Они могут использоваться в диагностике как острой, так и хронической HCV-инфекции. 26-28
Третье поколение тест-систем ELISA сейчас широко используется для скрининга донорской крови, является более чувствительным и специфичным по сравнению с тест-системами ELISA предыдущих поколений 29-30 и дает почти 100% гарантию предотвращения заражения реципиентов донорской крови. Однако антитела могут быть не обнаружены у больных, инфицированных менее 6 месяцев назад, и у больных с иммуносупрессией. Возможны ложноположительные результаты (часто среди доноров). В связи с этим положительные результаты ELISA должны подтверждаться дополнительными тестами.
Табл. 1 Методы выявления антител к вирусу гепатита С (anti-HCV)
| Метод | Выявляемые антитела (кодирующий ген) |
| Скрининговые тесты | |
| I поколения ELISA | anti-c100 (NS4) |
| II поколения ELISA | anti-c22(C), anti-c33+anti-c100[anti-c200] (NS3/NS4) |
| II поколения ELISA | (С, NS3, NS4, NS5) |
| Дополнительные тесты | |
| I поколения RIBA | anti-c100 (NS4), anti-5-1-1 (белки NS3/NS4 регионов) |
| II поколения RIBA | anti-c22(C) ,anti-c33 (NS3), anti-c100 (NS4), anti-5-1-1 (NS3/NS4) |
| II поколения RIBA | (С, NS3, NS4, NS5) |
*Полимеразная цепная реакция (ПЦР), позволяющая выявить, клонировать и определить последовательность генома вируса, имеет наибольшую чувствительность из принятых тестов, позволяя определять РНК вируса даже при низком уровне виремии. ПЦР пока не доступна для широкого применения, имеет ограничения, связанные с возможностью загрязнения и количественным определением; в то же время амплификация вирусного генома дает большое преимущество в выявлении низких концентраций вируса и различий в нуклеотидной последовательности между разными генотипами. Количественное определение HCV РНК стало возможным благодаря адаптированию ПЦР с использованием метода серийных разведений или коамплификации РНК. 5 Новейший метод количественного определения основан на амплификации разветвленной ДНК (bDNA, Chiron). 36-39 Данный метод, выявляющий линейную корреляцию между тест-сигналом и титром вируса (более 3-4 log), более прост в исполнении, 40 но менее чувствителен, 5, 37 чем ПЦР. Результаты исследования могут различаться в зависимости от генотипа вируса. 38 Указанные тесты имеют важное значение при установлении связи титра HCV РНК с инфекциозностью, уровнем аминотрансфераз, тяжестью заболевания и ответом на противовирусную терапию.
HCV РНК. Тест-системы для прямого определения антигенов HCV в сыворотке еще не разработаны, и в настоящее время HCV РНК является лучшим маркером виремии, инфекциозности и активности болезни (см. "Хронический гепатит С. Биохимические показатели, сывороточные маркеры HCV"). Тестирование на HCV РНК проводится в основном в специализированных центрах, однако недавно появились коммерческие наборы для ПЦР. 32 Выявление HCV РНК с помощью ПЦР может подтвердить наличие виремии при отрицательных результатах исследования anti-HCV методами ELISA и RIBA. HCV РНК появляется в крови гораздо раньше других маркеров, обнаруживаясь спустя несколько дней после инфицирования. 33, 34 Следует, однако, отметить, что при циркуляции вируса в низких, подпороговых концентрациях HCV РНК может периодически не определяться. Поэтому суждение об отсутствии виремии на основании единичного отрицательного результата ПЦР не является окончательным.
Вирус гепатита С и его геном
Вирус гепатита С (HCV) идентифицирован в 1989 году американскими исследователями под руководством М. Houghton, когда была выделена нуклеиновая кислота при экспериментальном заражении шимпанзе и в дальнейшем получена ДНК-копия, которую использовали для создания библиотеки клонов. Скрининг образцов из этой библиотеки позволил выявить клон, экспрессирующий антиген, который реагировал с антителами из сывороток людей, больных посттрансфузионным гепатитом ни А ни В.
Далее был получен рекомбинантный белок, который содержал последовательность из 363 аминокислотных остатков вирусного белка. Эту последовательность обозначили как С-100-3 и использовали в качестве антигена при создании иммуноферментной тест-системы.
Геном вируса гепатита С представлен однонитевой позитивной линейной молекулой РНК, состоящей из 9379 оснований и кодирующей полипротеин из ЗОН аминокислот, который под действием вирусных и клеточных протеаз нарезается на отдельные вирусные белки. Таксономический анализ выявил принадлежность вируса гепатита С к семейству Flaviviridae самостоятельному роду Hepacivirus.
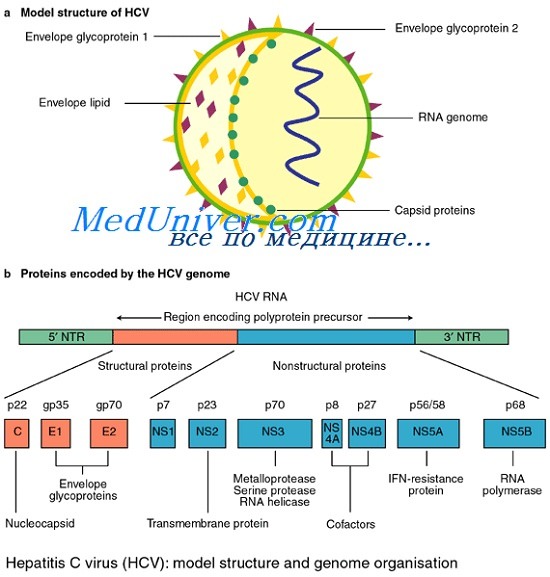
Проведенный анализ нуклеотидных последовательностей изолятов вируса гепатита С различных частей его генома сделал возможным классификацию этого вируса. Наиболее удобной в настоящее время является номенклатура P. Simmonds et al, 1993, основанная на анализе последовательностей области NS5. Эта классификация, а также разработанная примерно в это же время система Н. Okamoto et al., 1992 стала общепринятой. К наиболее распространенным в мире генотипам вируса гепатита С относят: la, lb, 2а, 2b и 3а. Эти генотипы распространены в странах Западной Европы и в Америке, причем преобладающим является генотип lb.
Совсем другое распределение генотипов HCV в странах центрального Востока и Северной и Центральной Африки. Генотип 4, главным образом 4а, доминирует в Египте, Йемене, Кувейте, Ираке, Саудовской Аравии, Заире, Бурунди, Габоне. На юге Африке наиболее часто встречается генотип 5а, который в других частях мира находили исключительно редко. Генотип 3 выявлен в странах Западной Европы, в Сингапуре, Таиланде, Мьянме и Восточной Индии. Всего выделено 9 подтипов третьего генотипа HCV.
В России также проведены исследования по определению структуры генотипов ВГС, циркулирующих в различных ее регионах. Наиболее часто — 60-70 % случаев определен генотип HCV lb. Далее следуют генотипы За, 1а, и 2а. Так, в 1998 году Е. В. Лисицина во Владимирской области выявила следующую структуру генотипов HCV: lb — 72,9 %, 2а — 2,9 %, 2Ь — 2,9 % и За — 15,7 %. В 5,7 % случаев с имеющимся набором праймеров генотип определить не удалось.
При этом было отмечено, что у лиц различного возраста структура генотипов различается. У лиц в возрасте 7-14 лет генотип It и За выявлен с одинаковой частотой —42,9%. Среди лиц старше 50 лет генотип lb выявлен в 90% случаев, тогда как За не определен вовсе.
Белки и антигены вируса гепатита С. Диагностика ВГС
Сегодня известно минимум 10 структурных и неструктурных белков, кодируемых геномом HCV. К структурным белкам относят core, envelop 1 и envelop 2. Белок core является белком нуклеокапсида, тогда как envelop 1 и envelop 2 — гликопротеины внешней оболочки вируса. В структурной зоне кодируется также белок р7, функция которого не ясна, однако аналогия с другими представителями семейства Flaviviridae позволяет предположить, что его функция связана с высвобождением вириона из инфицированной клетки.
Этот белок отщепляется клеточной пептидазой от envelop 2, но не во всех случаях, что обусловливает существование envelop 2 в виде двух форм более и менее протяженной.
Неструктурная область генома HCV кодирует 6 белков — NS2, NS3, NS4A, NS4B, NS5A и NS5B. Белок NS2 является вирусной металлозависимой протеиназой. Белок NS4A действует как эффектор или кофактор для NSЗ-протеолитической активности в NS4A/NS4B, NS4B/NS5A, NS5A/NS5B сайтах нарезания полипротеина вируса.
В настоящее время фрагменты структурных и неструктурных белков, полученных генноинженерным путем (рекомбинантные белки) или с помощью химического синтеза, используют в качестве антигенов при конструировании иммуноферментных тест-систем. Первое поколение иммуноферментных тест-систем появилось на рынке в 1989 году и было основано на прямом ИФА. В качестве иммуносорбента были использованы фрагменты двух белков, NS3 и NS4, обозначаемых как 5-1-1 и С100-3.
Одновременно были разработаны и подтверждающие тесты на основе иммуноблота с рекомбинантными белками (RIBA). Чувствительность этих тест-систем первого поколения составляла только 64% для ИФА и 55% для иммуноблота. Тест-системы второго поколения появились на рынке в 1991 году. В качестве антигенов, сорбированных на твердой фазе, в этих тест-системах использовали капсидные белки (фрагмент с22-3) и антигены неструктурных регионов NS3 (фрагменты с200 и сЗЗс) и NS4, что позволило повысить чувствительность и специфичность исследований. Поскольку гуморальный иммунный ответ на капсидные антигены (структурные белки) нагинается быстрее, гем на неструктурные белки, период от инфицирования до выявляемой сероконверсии удалось уменьшить до двух месяцев.
Подтверждающие тест-системы на основе иммуноблота позволяли идентифицировать участвующие в реакции антигены. Результаты, полученные при помощи этих тест-систем, интерпретировали как положительные лишь при реакции антител, находящихся в исследуемом субстрате, по крайней мере, с двумя антигенами, тогда как при наличии реакции лишь с одним из антигенов результат считали неопределенным. Было установлено, что специфичность второго поколения тест-систем зависела от источника антигенов. В 1993 году на рынке появилось третье поколение тест-систем. В дополнение к вышеупомянутым антигенам в этих тест-системах используются также антигены, аминокислотная последовательность которых соответствует иммунодоминантным участкам NS5 белков.
В тест-системах первого, второго и третьего поколений в качестве антигенов использовались или рекомбинантные, или синтетические пептиды. В настоящее время можно выделить также тест-системы четвертого поколения, в которых в качестве иммуносорбента используют сочетания рекомбинантных и синтетических пептидов.
Опыт применения тест-систем различных поколений в мире очень большой. Было установлено, что если с помощью тест-систем первого или второго поколения у больных с острым вирусным гепатитом С антитела выявляли на 10-16, а в ряде случаев и 25-30 неделе от начала заболевания, то диагностикумы третьего поколения позволяли сократить этот срок до 2-3 недель. Согласно обобщенным данным чувствительность тест-систем первого, второго и третьего поколений составляет соответственно 70-80%, 92-95% и 97%.
В то же время, по данным С. Colin, 2001, чувствительность тест-систем третьего поколения составила 98,9% у пациентов с хроническими заболеваниями печени и 97,2% на специальных контрольных панелях сывороток. Достижение высокой чувствительности иммуноферментных тест-систем 3 и 4 поколения сопряжено с некоторыми проблемами в обеспечении специфичности исследований, что в ряде случаев может приводить к появлению ложноположительных результатов. В литературе имеются данные о возможных погрешностях в специфичности ELISA 3 тест-систем. Они являются общими для всех ELISA тест-систем, включая тест-системы для диагностики СПИДа.
Ложнопозитивные результаты могут быть следствием повышенного содержания в образцах гамма-глобулинов (сыворотки пациентов африканской расы, миеломная болезнь, ревматоидные факторы), заболеваний печени (цирроз, рак), аутоиммунных заболеваний (коллагенозы, аутоиммунные гепатиты), других вирусных инфекций (ВИЧ, гепатит В) и длительного хранения сывороток в меняющихся температурных условиях. Проведение какой-либо иммунизации также может сопровождаться повышением частоты ложнопозитивных реакций. Рекомендуемые в настоящее время меры по устранению этой проблемы следующие: а) повторная постановка образца в этой же ИФТС; б) повторная детекция anti-HCV в другой ИФТС; в) использование подтверждающих тестов на основе ИФА и иммуноблота.
Однако использование предлагаемых способов подтверждения результатов зачастую приводят к расхождениям в их итоговой трактовке, что показано исследованиями российских и зарубежных исследователей.
В настоящее время производители ИФТС для детекции anti-HCV достигают высокой чувствительности или за счет более полного выявления антител к NS3 или антител к антигенам core. Сравнительные исследования, выполненные на различных группах риска и специальных контрольных панелях показали, что тест-системы, лучше выявлявшие антитела к NS3, оказались несколько более чувствительными, чем тест-системы, лучше выявлявшие антитела к антигенам core. Их чувствительность составляла, соответственно 99,9% и 98,6%.
Гепатит С. Вирус гепатита С. Диагностика гепатита С. Лечение гепатита С. Профилактика гепатита С.
Гепатит С обычно протекает хронически и характеризуется преимущественным развитием хронических форм гепатита с исходом в цирроз и первичную карциному печени. Вирус гепатита С включён в состав рода семейства Flaviviridae.
Резервуар возбудителя гепатита С — инфицированный человек. Основной путь передачи вируса гепатита С — парентеральный. Основное отличие от эпидемиологии вируса гепатита В — более низкая способность вируса гепатита С к передаче от беременной к плоду и при половых контактах.
Больной выделяет вирус гепатита С за несколько недель до появления клинических признаков и в течение 10 нед после начала проявлений. Заболевание чаще регистрируют в США (до 90% всех трансфузионных гепатитов) и Африке (до 25%).
Для клинической симптоматики вирусного гепатита С характерны изменение консистенции и размеров печени. При активном процессе печень обычно увеличена и болезненна при пальпации, её консистенция умеренно плотная. Другие проявления включают спленомегалию, диспепсический и астенический синдромы, желтуху, артралгии и миалгии, кардиты, васкулиты, лёгочные поражения, анемии и др. Осложнения хронического процесса — цирроз и первичная карцинома печени.

Принципы микробиологической диагностики гепатита С
Маркёры репликации вируса гепатита С — AT [IgM) к Аг вируса гепатита С и вирусная РНК. Маркёры гепатита С выявляют методами ИФА и ПЦР.
Показание для поиска AT или РНК вируса гепатита С — любое воспалительное заболевание печени. Вирусспецифические AT появляются в среднем через 3 мес и указывают на возможное инфицирование вирусом гепатита С или на перенесённую инфекцию. В серонегативный период выявляют РНК вируса гепатита С. Для подтверждения результатов ИФА, а также при обследовании пациентов, не относящихся к основным группам риска, применяют метод рекомбинантного иммуноблотинга, позволяющий эффективно исключить ложноположительные результаты ИФА.
Лечение и профилактика гепатита С
Средства этиотропной терапии гепатита С отсутствуют; при хронических инфекциях можно использовать а-ИФН. На фоне терапии ИФН у 40-70% больных отмечают стихание воспалительного процесса (на что указывает снижение содержания концентрации аминотрансфераз в сыворотке), однако по окончании курса у 40-50% пациентов наблюдают рецидив воспаления.
Средства специфической иммунопрофилактики гепатита С не разработаны.
Нуклеокапсид вируса имеет форму икосаидра диаметром 50нм с липидной оболочкой, включающей белковые структуры – выступы высотой 6-8 нм (рис. 1.1) [15]. Применение поли- и моноклональных антител к Е1-протеину вируса гепатита С позволило S. Wotanabe с соавторами локализовать эти белки на оболочке вируса. Они чаще ассоциированы с липопротеинами низкой плотности или находятся в составе иммунных комплексов. От чего зависит величина плавучей плотности частицы вируса [14].
Нуклеокапсид вируса содержит однонитевую линейную молекулу РНК позитивной полярности длиной 9,4-9,5 тысяч нуклеотидов (рис. 1.2). В геноме выделяют две зоны: кодирующая структурные белки расположена у 5'-области РНК, кодирующая неструктурные (функциональные) – у 3'-области.

Рисунок 1.3 – Строение вириона вируса гепатита С
Протяженность 5'-NTR РНК ВГС составляет около 340 нуклеотидов. Функция этого участка заключается в инициации трансляции. Специфически связываясь с рибосомами (благодаря наличию внутреннего рибосомального сайта связывания) и факторами трансляции клетки-хозяина, он направляет рибосому к инициирующему кодону (AUG) в позиции 342, после чего начинается синтез полипротеина [15, 21].
Участок РНК вируса гепатита С, примыкающий к 3'-концу 5'-NTR- региона, протяженностью в 573 нуклеотида, кодирует белок, формирующий капсид вируса (С, или Core) (рис. 1.3). Его С-терминальный регион является необходимым для правильной укладки полипептидной цепи [22].
Выявлено три формы С-белка. Полноразмерная (р21) с молекулярной массой 21 кДа и усеченная (р19), которые обнаружены в мембране эндоплазматического ретикулума. Форма (р16) С-белка, обнаруженная в ядрышках инфицированных гепатоцитов [14, 21]. Он может оказывать влияние на человеческие онкогены, задействованные в развитии гепатоклеточной карциномы у пациентов с хроническим гепатитом С путем супрессии отдельных генов клетки-хозяина. Считается, что С-белки р16 и р21 разнонаправленно влияют на транскрипционную активность опухолевого репрессора р53: первый блокирует, а второй усиливает ее. Таким образом, специфически подавляется апоптоз инфицированных клеток [15]. Кроме того, капсидный белок играет основную роль в индукции митохондриальной дисфункции [23].
На своей поверхности С-белок несет различные высоко-консервативные В-клеточные эпитопы, существование которых чрезвычайно важно для выявления анти-ВГС в процессе лабораторной диагностики инфекции. Core-белок обладает способностью связываться с вирусной РНК, а также выполняет регуляторную роль в репликации вируса [14, 21, 24].
В Е1- и Е2-регионах РНК вируса гепатита С регистрируется значительная генетическая изменчивость и содержится информация о белках оболочки вируса, участвующих в проникновении вируса в клетку, в развитии иммунитета и ускользании от иммунного ответа организма за счет отбора мутантов, способных уклоняться от действия нейтрализующих антител [14, 15]. Кроме того, на мышиной модели показано, что участок Е1-Е2 совместно с Сore ускоряет опухолеобразование, блокируя способность клеток к апоптозу [25].
Зоны генома Е1 и Е2 кодируют белки с молекулярной массой 31 и 70 кДа соответственно. Имеются две формы белка Е2: gp70A (E2) и gp70B (E2-p7). Последний в структуре вируса не обнаружен, предполагается его участие в высвобождении вновь синтезированного вириона вируса из инфицированной клетки [14, 15]. Белки Е1 и Е2 сильно гликозилированы и содержат С-терминальный гидрофобный домен, функционирующий как мембранный якорь. Их созревание происходит при удалении С-концевой последовательности сигнальными пептидазами клетки [24]. Установлено, что при отсутствии белка Е2 происходит нарушение пространственной структуры оболочечного белка Е1 [14].
В неструктурной зоне, расположенной ближе к 3'-концу РНК вируса гепатита С, выделяют участки NS2, NS3, NS4A, NS4B, NS5A и NS5B. В отличие от других флавивирусов, в РНК вируса гепатита С отсутствует первая зона, кодирующая неструктурные белки (NS1), а к Е2-региону примыкает зона NS2 (рис. 1.4). Большинство белков, кодированных неструктурными зонами РНК вируса гепатита С, необходимо для репликации вируса [14, 15]. Антитела, вырабатываемые на неструктурные белки, не обладают полноценными протективными свойствами в отношении вируса гепатита С вследствие его высокой генетической вариабельности [24, 26, 27]. NS2 протеин является трансмембранным белком с молекулярной массой 23 кДа [14]. Его С-конец смотрит в просвет цистерн эндоплазматического ретикулума, N-конец – в цитозоль. Этот белок является цинк-зависимой аутопротеазой, разрезающей NS2 и NS3 белки [15].

Рисунок 1.4 – Организация генома вируса гепатита С
NS3 протеин, с молекулярной массой 70 кДа, выполняет несколько различных функций: является сериновой протеазой (амино-терминальная часть), отщепляя от полипротеина все остальные неструктурные белки (NS3/NS4A, NS4A/NS4B, NS4B/NS5A и NS5A/NS5B); обладает хеликазной и нуклеотидтрифосфатазной активностью [14, 15].
При репликации вируса NS3 белок связывается с поли-U последовательностью на 3'-конце вирусного генома своим РНК-связывающим доменом и затем происходит раскручивание двунитевой РНК. Одновременно идет гидролиз дезоксирубонуклеотидтрифосфатов, осуществляемый другим доменом NS3 [15].
P. Brunetal. (2010) в своей работе показал, что NS3 протеаза может ингибировать сигнальные пути трансдукции врожденного иммунитета. Белок способен специфически взаимодействовать с каталитической субъединицей клеточной протеинкиназы А, участвующей в передаче клеточных сигналов, влияя на переход клетки в состояние неконтролируемого роста. C другой стороны, взаимодействие NS3 с иммунной системой может влиять на течение заболевания либо со спонтанным очищением от вируса, либо развитием хронической инфекции [15, 28].
В NS4 регионе выделяют две зоны – NS4A и NS4B, которые кодируют два гидрофобных белка с молекулярными массами 8 и 26 кДа [14, 15]. NS4A протеин является кофактором для NS3 протеазы, образуя с NS3 белком единый комплекс и выполняя функцию якоря, удерживающего на мембране ядра клетки репликативный комплекс вируса гепатита С [14]. Он также необходим для гиперфосфорилирования NS5A протеина. Функция NS4B протеина остается неясной, предполагается, что он также принимает участие в формировании репликативного комплекса [15]. NS5 регион полипротеина построен из двух больших белков — NS5A (56 кДа) и NS5B (65 кДа). Они освобождаются из полипротеина с помощью NS3-NS4A протеазного комплекса.
NS5A белок высококонсервативен, на ядерной мембране инфицированных клеток он совместно с NS5B образует мембранно-связанный репликативный комплекс. NS5A протеин участвует в процессах фосфорилирования и играет важную роль в формировании механизмов устойчивости клеток к действию интерферона. Предположительно белок NS5A ингибирует один или несколько клеточных белков (например, взаимодействует с интерферон-индуцированной клеточной протеинкиназой), участвующих в начальных стадиях противовирусного действия интерферона [12, 14].
NS5B протеин консервативен и является РНК-зависимой РНК-полимеразой с молекулярной массой 68 кДа, обеспечивая репликацию/ транскрипцию генома вируса [15]. Изучение функциональной роли вирусных белков, кодированных неструктурной зоной РНК вируса гепатита С, прежде всего, важно для поиска новых лечебных препаратов, которые могли бы эффективно блокировать репликативную активность вируса.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Читайте также:

