Оснащение лабораторий на гепатиты
Обновлено: 24.04.2024
Диагностические лаборатории медицинских организаций, как правило, осуществляют работы с патогенными биологическими агентами (ПБА) III–IV групп патогенности. Чтобы обеспечить в лаборатории требования биологической безопасности, необходимо предусмотреть поточность технологических процессов, зонирование производственных помещений, своевременное проведение дезинфекционных мероприятий. Расскажем о том, как это сделать.
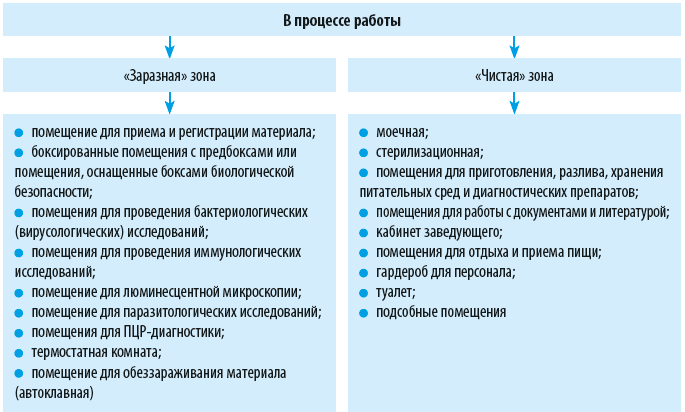
Зонирование лаборатории
Обратите внимание!
Выносить за пределы лаборатории оборудование, лабораторную или хозяйственную посуду, реактивы, инструменты и прочие объекты можно только после их дезинфекции и с разрешения руководителя лаборатории.
Требования к отделке помещений лаборатории
Поверхности пола, стен, потолка, мебели, оборудования и прочих объектов в помещениях лаборатории должны быть гладкими, устойчивыми к влажной уборке с применением моющих и дезинфицирующих средств. Для пола необходимо предусмотреть гидроизоляцию и антискользящее покрытие.
Если лаборатория располагается на первом этаже или в цоколе, то окна обязательно оснащают металлическими решетками, не нарушающими правил пожарной безопасности. Для защиты рабочих столов от попадания прямого солнечного света используют светозащитную пленку или жалюзи из материалов, устойчивых к воздействию дезсредств.
Доставка и прием биологического материала
На дно контейнера для транспортировки укладывают адсорбирующий материал (марлевую салфетку, ткань, вату).
Обратите внимание!
Не допускается доставка материала в хозяйственных сумках, чемоданах, портфелях и других предметах личного пользования.
Чтобы исключить контакт бланков-направлений с биологическим материалом, их вкладывают в отдельный полиэтиленовый пакет.
Важно!
Персонал лаборатории должен осуществлять прием и разбор биологического материала с использованием средств индивидуальной защиты: масок и резиновых перчаток.
Работа с патогенными биологическими агентами
Важно!
Запрещается пипетировать ртом и переливать жидкий инфекционный материал через край пробирки, покидать рабочее место во время манипуляций с ПБА, удалять необеззараженные сгустки крови из пробирок вытряхиванием, сливать жидкие отходы в канализацию без предварительного обеззараживания.
- центрифугирование ПБА и другие манипуляции, вследствие которых образуются аэрозоли;
- приготовление суспензий;
- работа с лиофилизированными ПБА;
- работа по ведению коллекционных штаммов;
- работа по идентификации и изучению выделенных штаммов микроорганизмов.
- серологические исследования и ПЦР-исследованияпо детекции в клиническом материале возбудителей парентеральных вирусных гепатитов В и С, ВИЧ-инфекции и других микроорганизмов II группы патогенности.
Во время работ двери боксов и предбоксов должны быть закрыты. До момента окончания работ выход из боксов не допускается.
Перед началом работ с использованием боксов биологической безопасности включают вентиляцию, проверяют исправность оборудования, наличие аварийного запаса дезинфицирующих средств. Манипуляции с ПБА должны выполняться ближе к задней стенке бокса на поддонах с салфетками, смоченными дезинфицирующим раствором.
После окончания работ с ПБА переднюю панель бокса биологической безопасности опускают, внутри бокса включают бактерицидные лампы.
Обратите внимание!
Боксы биологической безопасности должны проверяться на защитную эффективность:
после монтажа и подготовки к использованию;
после перемещения или ремонта;
не реже одного раза в год при наличии фильтров предварительной очистки воздуха от крупнодисперсных частиц;
не реже 2 раз в год при отсутствии фильтров предварительной очистки воздуха от крупнодисперсных частиц.
При проверке боксов должны контролироваться параметры эффективности работы фильтров очистки воздуха и скорость воздушного потока в рабочем проеме бокса.
Дезинфекционные мероприятия в лаборатории
При организации дезинфекционных мероприятий в лабораториях применяют физические и химические методы дезинфекции.
Для обеззараживания лабораторной посуды, защитной одежды персонала, бактериологических посевов, а также жидких отходов можно применять паровые стерилизаторы.
В воздушных стерилизаторах допускается обеззараживать лабораторную посуду из стекла, металлов или силикона, не загрязненную органическими веществами.
Обратите внимание!
Параметры паровой и воздушной стерилизации контролируют с помощью максимальных термометров, которые размещаются в контрольных точках. Количество контрольных точек зависит от объема камеры стерилизатора. Параметры паровой стерилизации дополнительно контролируются при помощи мановакуумметров.
Химический контроль термической стерилизации осуществляют при каждом цикле работы с использованием специальных тест-индикаторов, необходимое количество и точки расположения которых зависят от вида аппаратуры и объема стерилизационной камеры.
Контроль стерилизации с помощью бактериологических методов (биотестов) должен осуществляться не реже 2 раз в год, а также после ввода в эксплуатацию и ремонта аппаратуры. Биотесты, содержащие некоторое количество жизнеспособных микроорганизмов, обладающих высокой резистентностью, помещают в контрольные точки стерилизационной камеры. При качественно проведенном процессе стерилизации микроорганизмы погибают. Вид применяемых биотестов зависит от типа стерилизационного оборудования.
Химическими методами проводят обеззараживание различных поверхностей, медицинской мебели, оборудования, жидких отходов, спецодежды и других объектов.
К сведению
При выборе химических дезинфектантов предпочтение следует отдавать средствам с широким спектром антимикробной активности.
Объекты, загрязненные кровью, необходимо дезинфицировать растворами, обладающими активностью в отношении возбудителей парентеральных инфекций.
Рабочие растворы дезсредств готовят в специально отведенных помещениях или в вытяжном шкафу. Контейнеры (емкости) с растворами маркируют, указывая название дезсредства и его назначение, концентрацию раствора, дату приготовления и дату конечной реализации.
Дезсредства, применяемые для проведения текущих и генеральных уборок, должны обладать моющими свойствами. Текущую уборку проводят 2 раза в день. Обрабатывают полы, мебель, оборудование, подоконники, двери.
Генеральные уборки проводят не реже 1 раза в месяц, в боксированных помещениях — не реже 1 раза в неделю.
После влажной уборки включают бактерицидные облучатели. Их следует эксплуатировать в соответствии с действующими методическими документами и инструкциями по применению конкретного оборудования.
Обратите внимание!
Если в течение дня нужно экстренно обработать небольшие по площади или труднодоступные поверхности, следует использовать готовые к применению формы дезсредств, которые имеют небольшое время экспозиции и выпускаются в виде спреев или дезинфицирующих салфеток.
Медицинские изделия и посуду дезинфицируют способом полного погружения в рабочий раствор дезинфицирующего средства. Разъемные изделия обеззараживают в разобранном виде, каналы и полости изделий заполняют дезинфицирующим раствором.
Особенности обращения с отходами лабораторий
Лабораторную посуду с культурами микроорганизмов, как правило, обеззараживают в паровых стерилизаторах.
Важно!
Пробирки со сгустками крови обеззараживают с использованием дезинфицирующих растворов или с применением физических методов дезинфекции. Вытряхивать необеззараженные сгустки крови из пробирок запрещено.
При погружении в дезинфицирующий раствор пробирок со сгустками крови необходимо соблюдать осторожность. Пробирку берут анатомическим пинцетом так, чтобы одна его бранша вошла немного внутрь, и погружают ее в наклонном положении до полного заполнения раствором. При правильном погружении воздушные пузыри не образуются, пробирка опускается на дно.
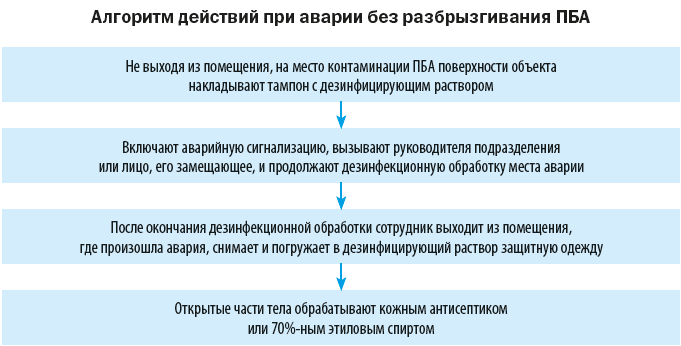
Техника безопасности и ликвидация аварийных ситуаций
Помещения лаборатории должны быть оборудованы пожарной сигнализацией и обеспечены средствами пожаротушения в соответствии с требованиями пожарной безопасности.
Сотрудники диагностических лабораторий должны быть обеспечены спецодеждой соответствующего размера: медицинскими халатами и костюмами, шапочками, медицинской обувью и средствами индивидуальной защиты, в том числе перчатками и масками, респираторами.
Для работы в боксированных помещениях используют отдельный халат, доходящий до нижней трети голени, и тапочки.
Рабочая одежда и обувь должны быть индивидуальными, храниться отдельно от личной одежды. Смена рабочей одежды проводится по мере загрязнения, но не реже 1 раза в неделю. Стирать спецодежду следует централизованно. Перед сдачей в стирку защитную одежду обеззараживают.
Важно!
На случай аварийных ситуаций, при которых создается угроза выделения ПБА в воздух рабочей зоны или есть риск заражения персонала, в лаборатории должен быть план ликвидации аварии и запас дезинфицирующих средств.
Объем мероприятий по ликвидации аварии зависит от характера выполняемой работы, вида и свойств ПБА, масштабов аварии.
Кроме того, в специально отведенном месте хранят аварийную аптечку, гидропульт, комплекты рабочей одежды для переодевания пострадавших и защитной одежды для сотрудников, ликвидирующих последствия аварии. Ответственным за комплектование аптечки и аварийной укладки является заведующий лабораторией.
Состав аварийной аптечки:
1. Спирт этиловый 70%-ный — 2 флакона по 100 мл.
2. Спиртовой раствор йода 5%-ный — 1 флакон.
3. Раствор борной кислоты 1%-ный — 1 флакон.
4. Нашатырный спирт — 1 флакон.
5. Бинт марлевый медицинский стерильный (5 м × 10 см) — 2 шт.
6. Лейкопластырь бактерицидный (не менее 1,9 см × 7,2 см) — 3 шт.
7. Салфетка марлевая медицинская стерильная (не менее 16 см × 14 см, № 10) — 1 уп.
8. Ножницы с закругленными браншами.
При аварии во время работы на центрифуге крышку медленно открывают только спустя 30–40 минут, чтобы сформировавшийся аэрозоль успел осесть. Центрифужные стаканы и разбитое стекло помещают в дезинфицирующий раствор, поверхность крышки, внутренние части центрифуги, ее наружную поверхность дезинфицируют (после отключения ее от электросети).
О каждом случае аварийной ситуации руководитель лаборатории обязан сообщить комиссии по контролю соблюдения требований биологической безопасности, а также руководителю медорганизации.
Не реже 1 раза в год в лаборатории должны проводиться тренировочные учения по ликвидации аварий.
Допуск персонала к работе с ПБА
Допуск персонала к работе с ПБА III–IV групп патогенности, а также допуск инженерно-технического персонала к обслуживанию лабораторного оборудования должен осуществляться на основании приказа главного врача. Приказ издается не реже одного раза в два года, корректируется по мере необходимости.
В лабораториях медорганизаций работу с ПБА могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским или биологическим образованием, прошедшие необходимую профессиональную подготовку.
Лица, имеющие медицинские противопоказания к вакцинации, лечению специфическими препаратами, использованию средств индивидуальной защиты, к работам с ПБА не допускаются.
Не реже 1 раза в год медицинский персонал, работающий с ПБА, должен проходить инструктаж по соблюдению требований биологической безопасности. Инженерно-технический персонал, дезинфекторы и санитарки лаборатории также должны проходить вводные и периодические инструктажи по биологической безопасности.
При приеме на работу сотрудников лаборатории направляют на предварительный медицинский осмотр для выявления противопоказаний с учетом специфики трудовой деятельности[1].
Все сотрудники, которые привлекаются к работам с ПБА, должны быть привиты в соответствии с календарем профилактических прививок и календарем прививок по эпидемическим показаниям.
К работе с паровыми стерилизаторами (автоклавами) могут быть допущены лица, обученные, аттестованные и имеющие удостоверение на право обслуживания сосудов, работающих под давлением.
Организация работы комиссии по биологической безопасности
Для контроля за соблюдением мер биологической безопасности при работе с ПБА в медорганизации создается специальная комиссия. В ее состав, как правило, включают заведующего лабораторией, врача-эпидемиолога или его помощника, инженера по охране труда и других заинтересованных специалистов.
Задачи комиссии по биологической безопасности:
- организация и проведение постоянного контроля за соблюдением регламентированного порядка обеспечения биологической безопасности лаборатории;
- разработка комплекса мер по совершенствованию биологической безопасности;
- организация и проведение мероприятий, направленных на предупреждение аварийных ситуаций при работе с ПБА и ликвидацию их последствий;
- контроль за подготовленностью сотрудников к работе с ПБА и организация наблюдения за состоянием их здоровья.
Заседания комиссии проводятся не реже 2 раз в год. Решения комиссии доводятся до сведения руководителя медорганизации.
Сейчас практически все пациенты и медицинский персонал должны обследоваться на COVID-19, при этом важно отличить коронавирусное поражение от других инфекционных и неинфекционных болезней. Поэтому значение ПЦР-метода возросло, ведь такие исследования являются золотым стандартом диагностики многих инфекционных заболеваний. Это один из самых быстрых, специфичных и чувствительных способов выявить этиологический агент инфекции, а значит, и возможность вовремя назначить подходящее лечение пациенту.
В статье мы подскажем, как организовать ПЦР-лабораторию и безопасно проводить ПЦР-диагностику на ее базе. Вы узнаете, какие требования предъявляются к таким лабораториям, что вам нужно обязательно предусмотреть при их проектировании и открытии, получите пакет необходимых документов.
Лучше всего размещать ПЦР-лабораторию в отдельно стоящем корпусе или части здания, изолированной от других подразделений медицинской организации.
Если соблюсти такие условия невозможно, то на базе уже действующей лаборатории выделите специальный блок для ПЦР-исследований. При этом в блоке организуйте самостоятельные рабочие зоны, которые соответствуют:
- этапам выполнения диагностических работ;
- поточности движения персонала;
- поточности материалов, содержащих патогенные биологические агенты (далее — ПБА).
КАКИЕ РАБОЧИЕ ЗОНЫ ДОЛЖНЫ БЫТЬ В ПЦР-ЛАБОРАТОРИИ?
Все помещения для ПЦР-диагностики должны быть боксированными, промаркируйте и пронумеруйте их в соответствии с этапами исследований.
Требования к отделке помещений
Для ПЦР-лаборатории выбирайте отделочные материалы, мебель и оборудование, устойчивые к мытью, обработке дезинфицирующими средствами и ультрафиолетовым облучением.
Для стен и пола используйте кафельную плитку (предпочтительно).
Все поверхности должны быть гладкими, без трещин или щелей.
На окна поставьте надежные запирающие устройства. Можете использовать светозащитные пленки из материалов, устойчивых к дезинфектантам.
Устанавливать жалюзи нельзя — они адсорбируют пыль.
Каждое рабочее помещение оборудуйте водопроводом, канализацией, электричеством, отоплением, средствами пожаротушения, естественным и искусственным освещением, а также приточно-вытяжной вентиляцией.
Требования к оборудованию
Проверьте себя по чек-листу.
Требования к вентиляции и обеззараживанию воздуха
Требования к вентиляции представлены на схеме 2. Допустима установка кондиционеров, но при условии их выключения на время проведения работ с использованием методов амплификации нуклеиновых кислот и последующей дезинфекции рабочих мест, ежемесячной дезинфекции оборудования и замены фильтров.
Требования к боксам биологической безопасности
Различают боксы трех классов (см. схему 3).
В рабочих зонах 1 и 2 все манипуляции с материалами, которые могут содержать ПБА, включая процедуры с риском образования аэрозолей, выполняйте в боксах биологической безопасности классов II или III.
В зонах 3, 4-1 и 4-2 используйте боксы биологической безопасности классов I и II либо ПЦР-боксы.
При работе с материалом, содержащим микроорганизмы III-IV групп патогенности, этапы анализа, выполняемые в рабочих зонах 4-1 и 4-2, проводите на лабораторных столах.
Как организовать работу ПЦР-лаборатории: требования и документирование
Сейчас практически все пациенты и медицинский персонал должны обследоваться на COVID-19, при этом важно отличить коронавирусное поражение от других инфекционных и неинфекционных болезней. Поэтому значение ПЦР-метода возросло, ведь такие исследования являются золотым стандартом диагностики многих инфекционных заболеваний. Это один из самых быстрых, специфичных и чувствительных способов выявить этиологический агент инфекции, а значит, и возможность вовремя назначить подходящее лечение пациенту.
В статье мы подскажем, как организовать ПЦР-лабораторию и безопасно проводить ПЦР-диагностику на ее базе. Вы узнаете, какие требования предъявляются к таким лабораториям, что вам нужно обязательно предусмотреть при их проектировании и открытии, получите пакет необходимых документов.
Лучше всего размещать ПЦР-лабораторию в отдельно стоящем корпусе или части здания, изолированной от других подразделений медицинской организации.
Если соблюсти такие условия невозможно, то на базе уже действующей лаборатории выделите специальный блок для ПЦР-исследований. При этом в блоке организуйте самостоятельные рабочие зоны, которые соответствуют:
- этапам выполнения диагностических работ;
- поточности движения персонала;
- поточности материалов, содержащих патогенные биологические агенты (далее — ПБА).
КАКИЕ РАБОЧИЕ ЗОНЫ ДОЛЖНЫ БЫТЬ В ПЦР-ЛАБОРАТОРИИ?
Все помещения для ПЦР-диагностики должны быть боксированными, промаркируйте и пронумеруйте их в соответствии с этапами исследований.
Требования к отделке помещений
Для ПЦР-лаборатории выбирайте отделочные материалы, мебель и оборудование, устойчивые к мытью, обработке дезинфицирующими средствами и ультрафиолетовым облучением.
Для стен и пола используйте кафельную плитку (предпочтительно).
Все поверхности должны быть гладкими, без трещин или щелей.
На окна поставьте надежные запирающие устройства. Можете использовать светозащитные пленки из материалов, устойчивых к дезинфектантам.
Устанавливать жалюзи нельзя — они адсорбируют пыль.
Каждое рабочее помещение оборудуйте водопроводом, канализацией, электричеством, отоплением, средствами пожаротушения, естественным и искусственным освещением, а также приточно-вытяжной вентиляцией.
Требования к оборудованию
Проверьте себя по чек-листу.
Требования к вентиляции и обеззараживанию воздуха
Требования к вентиляции представлены на схеме 2. Допустима установка кондиционеров, но при условии их выключения на время проведения работ с использованием методов амплификации нуклеиновых кислот и последующей дезинфекции рабочих мест, ежемесячной дезинфекции оборудования и замены фильтров.
Требования к боксам биологической безопасности
Различают боксы трех классов (см. схему 3).
В рабочих зонах 1 и 2 все манипуляции с материалами, которые могут содержать ПБА, включая процедуры с риском образования аэрозолей, выполняйте в боксах биологической безопасности классов II или III.
В зонах 3, 4-1 и 4-2 используйте боксы биологической безопасности классов I и II либо ПЦР-боксы.
При работе с материалом, содержащим микроорганизмы III-IV групп патогенности, этапы анализа, выполняемые в рабочих зонах 4-1 и 4-2, проводите на лабораторных столах.
Мы проводим исследования крови на:
Преаналитический этап

При исследовании на инфекционные маркеры необходимо соблюдать все правила преаналитического этапа, который включает в себя комплекс мероприятий, выполняемых от назначения на инфекционные маркеры до осуществления лабораторных измерений взятого биоматериала.
Преаналитический этап-это условия, в которых находится пациент перед взятием у него биоматериала, его первичной обработки, хранения и доставки в лабораторию. Соблюдение правильного проведения преаналитического этапа важно, так как до 60% погрешностей в КДЛ по России приходится на преаналитический этап.
Преаналитический этап включает:
- правильное взятие биоматериала
- хранение
- транспортировка
При исследовании в цельной крови, сыворотке или плазме образец крови берут чаще всего из локтевой вены. При плановом назначении лабораторного теста кровь для его выполнения следует брать натощак (после примерно 12ч. голодания и воздержания от приема алкоголя и курения), при минимальной физической активности непосредственно перед взятием (в течение 20-30 мин), в положение пациента лежа или сидя.
Взятие венозной крови облегчается применением вакуумных пробирок. Под влиянием вакуума кровь из вены быстро поступает в пробирку, что упрощает процедуру взятия и сокращает время наложения жгута.
В зависимости от назначенного вида исследования образец крови должен собираться при наличии строго определённых добавок. Для получения плазмы кровь собирают с добавлением антикоагулянтов: этилендиаминтетрауксусной кислоты (ЭДТА), цитрата, оксалата, гепарина. Для исследований системы свертывания крови применяется только цитратная плазма. В большинстве гематологических исследований используют венозную кровь с солями этилендиаминтетрауксусной кислоты (ЭДТА, К2 или К3-ЭДТА). Взятие биоматериала для иммуносупрессантов (такролимус и циклоспорин) проводят в пробирке с ЭДТА, К2 до верхней метки, содержимое пробирки незамедлительно, с осторожным переворачиванием 5-10 раз, перемешать.

Для предупреждения контаминации (механический перенос инфекционного агента из одного образца в другой) необходимо строго соблюдать правила забора биоматериала и его транспортировки.
Доставка образцов крови происходит с соблюдением всех этапов холодовой цепи. Холодовая цепь – это соблюдение температурного режима от момента взятия биоматериала до лабораторного тестирования.
Пробирки с образцами крови после оседания эритроцитов или оседания сгустка крови (не ранее чем через 30мин. после взятия крови) подвергаются центрифугированию. Кровь для получения сыворотки или плазмы центрифугируют в течение 10-15 мин при 800-1600 х g .
Несоблюдение правил преаналитического этапа приводит к возникновению неспецифических реакций.
Общие правила по подготовке к исследованиям на ВИЧ-инфекцию, вирусный гепатит В (HbSAg), вирусный гепатит С, сифилис.
- кровь сдавать утром натощак;
- исключить физические нагрузки в течение 24 часов;
- накануне избегать пищевых нагрузок;
- исключить курение минимум за 2 часа до исследования;
- исключить приём алкоголя накануне исследования;
- при себе иметь паспорт или заменяющий его документ с фотографией
Вич-инфекция

ВИЧ-инфекция - болезнь, вызванная вирусом иммунодефицита человека-антропонозное инфекционное хроническое заболевание, характеризующееся специфическим поражением иммунной системы, приводящим к медленному ее разрушению до формирования синдрома приобретенного иммунодефицита (СПИД).
Возбудитель ВИЧ-инфекции - вирус иммунодефицита человека - относится к семейству ретровирусов. Вирус преимущественно поражает клетки иммунной системы-Т-лимфоциты, называемые СD4 Т-клетками. СD4 Т-клетки - это субпопуляция лимфоцитов, которая выполняет важнейшие функции в регуляции и осуществлении иммунного ответа организма против бактерий, вирусов и других микроорганизмов. В клетке человека вирус образует участок ДНК, встраивает его в геном хозяина. Пораженная вирусом клетка производит материалы для построения вирусных частиц, на ее поверхности появляются антигены вируса. При делении дочерние клетки получают вирусную ДНК.
К антигенам вируса, расположенным на поверхности клеток, вырабатываются антитела, которые используются для диагностики инфекции. В настоящее время известны 2 типа вируса: ВИЧ-1 и ВИЧ-2. Считают, что ВИЧ-2 имеет меньшую способность к распространению и медленнее разрушает иммунную систему.

Источником ВИЧ-инфекции является человек. Почти во всех биологических жидкостях инфицированного человеческого организма (кровь, сперма, грудное молоко, влагалищный и цервикальный секрет) в различной концентрации обнаруживаются вирусные частицы.
Основным методом лабораторной диагностики ВИЧ-инфекции является обнаружение антител к вирусу с помощью иммуноферментного анализа. Антитела к ВИЧ появляются у 90-95% зараженных в течение 3-х месяцев после заражения, у 5-9% - через 6 месяцев от момента заражения и у 0,5-1 %- в более поздние сроки. Наиболее ранний срок обнаружения антител-2 недели от момента заражения.
В терминальной стадии СПИД количество антител может значительно снижаться, вплоть до полного их исчезновения. Серологическая диагностика инфекции ВИЧ на первом этапе строится на выявлении суммарного спектра антител против антигенов ВИЧ с помощью твердофазного анализа. На втором этапе методом иммунного блотинга проводится определение антител к отдельным белкам вируса.

Гепатит С

Гепатит С - вирусное заболевание , характеризующееся поражением печени и аутоиммунными нарушениями, часто имеющее первично-хроническое и латентное течение. Протекает в желтушной (5%) или безжелтушной (95%) формах. Вирус гепатита С относится к семейству флавивирусов, представляет собой небольшой(40-50нм в диаметре), покрытый оболочкой вирус, достаточно устойчивый во внешней среде. Его геном представлен одноцепочечной РНК, которая кодирует 3 структурных и 5 неструктурных белков вируса. К структурным относятся нуклеокапсидный белок(С-core) и гликопротеины оболочки(Е1-Е2). Неструктурную область представляет комплекс белков с ферментативной активностью(NS1,NS2, NS3, NS4,NS5).
Протекая бессимптомно, долгие годы остающейся нераспознанной, именно ВГС-инфекция является основной причиной формирования всей группы хронических болезней печени - хронического гепатита, цирроза, гепатоцеллюлярной карциномы.
Источниками ВГС являются больные всеми формами острого и хронического гепатита С. Вирус попадает в кровь при любых парентеральных манипуляциях: гемотрансфузии, инъекциях, при посещении стоматолога и гинеколога, оперативных вмешательствах, зондовом обследовании и т.д. К группе риска относятся больные, находящиеся на гемодиализе, страдающие гемофилией и другими заболеваниями крови, получающие плазму, гемоконцентраты, иммуноглобулины. Наркоманы, употребляющие наркотики внутривенно. Медицинские работники, имеющие контакт с кровью. Относительно меньшее значение имеют половой, бытовой и вертикальный пути передачи, что связано с низкой виремией ВГС.

Инкубационный период длится в среднем 6-8 недель с возможными колебаниями от 2-4-х недель до 4-6 месяцев больше. В конце инкубационного периода повышаются уровни печеночных трансаминаз (превышают норму в 5-30раз). Сероконверсия наступает через 15-20 недель от момента заражения. На 3-4 недели раньше анти-ВГС-IgG обнаруживается анти-ВГС-IgM. РНК вируса с помощью ПЦР определяется через 1-3 недели после инфицирования.
Лабораторная диагностика гепатита С основана на обнаружении в образцах сывороток крови человека специфических маркеров вируса гепатита С: антител к антигенам ВГС, относящихся к иммуноглобулинам классов G и M, а так же нуклеиновой кислоты возбудителя (РНК ВГС).

Гепатит В

Гепатит В (ГВ) - является одним из самых распространенных и опасных вирусных инфекционных заболеваний человека, что обусловлено высокой устойчивостью возбудителя во внешней среде и широким спектром клинико-эпидемиологических особенностей.
Вирусный гепатит В- инфекционное заболевание, которое характеризуется тяжелым воспалительным поражением печени. Источниками возбудителя инфекции являются больные острыми и хроническими формами болезни, а также лица с субклиническим течением инфекционного процесса и здоровые носители.
ГВ передается через кровь и контактным, преимущественно половым путем. Большому риску подвергаются медики, имеющие контакты с кровью. Вирус может передаваться от матери к ребенку во время беременности или непосредственно при родах.
Лабораторная диагностика ГВ основана на выявлении специфических для ГВ антигенов и соответствующих антител в крови, а также вирусных нуклеиновых кислот, основными из которых являются:
- HBsAg
- анти-НВs
- анти-НВс класса IgM и IgG
- HВe-Ag-антиНВе
- ДНК | ВГВ
В диагностике ГВ наиболее широко используется определение HBsAg. HBsAg – поверхностный антиген вируса гепатита В, основной маркер острого и хронического гепатита В- представляет собой белковую молекулу, ответственную за адсорбцию вируса на поверхности гепатоцитов. После встраивания вируса в геном печеночных клеток они начинают продуцировать вирусную ДНК и белки, и новые молекулы HBsAg поступают в кровь.

Данный антиген выявляется как при остром, так и при хроническом заболевании. При остром ГВ поверхностный антиген вируса обнаруживается через 3-5 недель от момента инфицирования, то есть задолго до появления клинических признаков болезни и в этих случаях является единственным серологическим маркером.
Обнаружение поверхностного антигена вируса гепатита В в крови больше 6 месяцев от начала болезни указывает на затяжное или хроническое течение болезни, и позволяет предположить хроническое носительство вируса. Элиминация HBsAg и появление антител к нему является непременным условием выздоровления. Серологическими маркерами репликации ВГВ являются- анти-НВс класса IgM, НвеAg, ДНК и ДНК-полимераза, которые обнаруживаются при остром ГВ с первых дней клинических проявлений или при обострении. HВcAg выявляется в ткани печени и не определяется в сыворотке крови. Опосредованно его присутствие в организме отражают циркулирующие антитела- анти-НВс класса IgM и IgG. В острый период ГВ наличие анти-НВс класса IgM является дополнительным маркером этого заболевания. Наличие в сыворотке крови только анти-НВс класса IgG наблюдается в период между исчезновением HBsAg и образованием анти-HBs. Сочетанное выявление анти-НВс класса IgG в низком титре с анти-НВs указывает на перенесенную ГВ-инфекцию и наличие иммунитета. Тестирование НВеАg проводят в сыворотках крови только с наличием HBsAg и позитивный результат данного маркера свидетельствует об активном процессе - либо подтверждает диагноз острого ГВ, либо свидетельствует об обострении хронического ГВ. Наличие ДНК-ВГВ( наиболее чувствительный маркер продолжающейся репликации ВГВ) в сыворотке крови указывает на высокую инфекционность данного образца и активное размножение вируса в организме. Высокая активность аминотрансфераз сыворотки отражает воспалительное повреждение ткани печени. Сероконверсия HBsAg в анти-HBs происходит у 90-95% больных с острым ГВ в стадии разрешения инфекционного процесса и, является показателем иммунитета к вирусу ГВ, то есть наличие анти-HBs свидетельствует о перенесенной инфекции и наличии иммунитета к этой инфекции. Лица, имеющие эти антитела в защитной концентрации(10МЕ и более), не болеют ГВ и не нуждаются в вакцинации.
Сифилис

Сифилис – хроническое инфекционное заболевание, вызываемое Treponemapallidum (бледная трепонема), характеризуется полиорганным поражением и стадийным течением.
Treponemapallidum относится к семейству Spirochaetaceae, роду Treponema. Имеет спиралевидную форму с завитками, грамотрицательный анаэроб. Сифилис , как правило передается половым путем, а важнейшим фактором проникновения бледных трепонем в организм и его инфицирования является нарушение целостности кожных и слизистых покровов и большое количество вирулентных возбудителей. Трансплацентарное заражение или инфицирование новорожденных через родовые пути больных сифилисом матерей, а также при кормлении грудью представляет серьезную опасность и диктует необходимость обследования.
Инкубационный период длится 3-4 недели, первичный серонегативный -1 месяц, затем первичный серопозитивный -1 месяц, затем вторичный период-2-4 года, далее третичный период. В первичном периоде возникает твердый шанкр( безболезненная язва в месте проникновения бледной трепонемы), сопровождающийся регионарным лимфаденитом. В конце первичного периода шанкр самостоятельно заживает, а лимфаденит переходит в полиаденит и сохраняется до пяти месяцев. Началом вторичного периода являются генерализованные высыпания ( пятнистые, папулезные, пустулезные сифилиды). На втором полугодии вторичного сифилиса исчезает полиаденит. Появление третичных сифилидов (бугорков и гумм) знаменует начало третичного периода, который наступает у 40% нелеченных и неполноценно леченных больных. Волны третичного периода разделены более продолжительными периодами латентного течения инфекции. В третичных сифилидах содержится крайне мало трепонем, поэтому они практически не заразны. Передача сифилиса потомству наиболее вероятна в первые три года заболевания. В результате возникают поздние выкидыши (на 12-16 неделе), мертворождение. Ранний и поздний врожденный сифилис. Проявления раннего врожденного сифилиса возникают сразу после рождения и аналогичны проявлениям вторичного сифилиса.
Диагноз сифилиса должен быть подтвержден лабораторными исследованиями, однако, при отрицательном результате скринингового теста обследование пациента с существующим риском недавнего заражения сифилисом следует повторить через 1-2 недели. Образцы, давшие положительный результат в тест-системе для выявления суммарных антител, необходимо проанализировать в системах, выявляющих конкретные классы иммуноглобулинов(JgG и IgM). Положительный результат на JgG и IgM является подтверждением положительного результата, полученного в скрининговом тесте, и свидетельствует о наличии специфических антитрепонемных антител.
Читайте также: