Особенности иммунного ответа при вирусных инфекциях
Обновлено: 19.04.2024
Механизмы противовирусного иммунитета имеют особенности, определяемые природой вирусов, паразитизмом на уровне молекулярных и субмолекулярных структур. Внеклеточный вирус не проявляет своего патогенного действия, а иммунные реакции против внеклеточных вирионов сходны с реакциями на другие микроорганизмы.
Защитные реакции, направленные на внутриклеточные стадии развития вируса, действуют не на вирус, а на инфицированную вирусом клетку. Только таким путем происходит подавление репродукции вируса и освобождение от него.
Кардинальные особенности противовирусной защиты - защита клетки от проникшей в нее генетически чужеродной информации и подавление репродукции вируса.
Несмотря на особенности, иммунные реакции в отношении вируса подчиняются тем же закономерностям, что и иммунные реакции в отношении других антигенов.
Механизмы противовирусной защиты можно разделить на факторы резистентности организма, в норме невосприимчивого к определенному виду вируса (обладающего видовой невосприимчивостью), факторы неспецифической защиты восприимчивого организма и факторы приобретенного иммунитета.
3.1.Факторы врожденной (естественной, видовой) резистентности невосприимчивого организма обусловливают врожденное состояние невосприимчивости к данной вирусной инфекции. Видовая резистентность определяется не иммунологическими реакциями организма, а неспецифическими механизмами. Имеют значение анатомические барьеры (кожа, слизистые респираторного тракта с мощным ресничными аппаратом, секреты слизистых, желудочный сок). Главную роль играет клеточная резистентость, обусловленная неспособностью вируса адсорбироваться и проникнуть в клетку, вирус не может быть депротеинизирован. Это обеспечивает абсолютную видовую невосприимчивость. Она может быть искусственно преодолена введением депротеинизированных нуклеиновых кислот непосредственно в клетку, что приводит к репродукции одного поколения зрелых вирионов, неспособных к проникновению в соседние клетки.
3.2. Факторы неспецифической резистентности восприимчивого организма способны на первых этапах взаимодействия вируса с организмом подавить дальнейшее размножение и генерализацию вируса задолго до включения механизмов иммунитета.
Наиболее изученными являются белковые вещества плазмы и секретов слизистых человека ингибиторы вирусной активности. Это термостабильные и термолабильные вируснейтрализующие факторы, которые могут нейтрализовать вирус за счет антигемагглютинирующего действия, активации комплекса вирус-антитело (как кофактор). Вирусные ингибиторы играют существенную роль в защите организма от вируса на первых этапах инфекции, их активность может быть соизмерима с титром антител. Поэтому при серодиагностике вирусных инфекций необходимо дифференцировать выявляемые антитела от вирусных ингибиторов, часто приходится для этого обрабатывать сыворотку для удаления ингибиторов.
Фагоцитоз, играющий очень важную роль в противобактериальной защите, малоэффективен против вируса. Фагоцитированные вирусы не погибают в фагоците, могут быть защищены от действия других противовирусных факторов и транспортироваться внутрь организме в фагоците. Тем не менее. имеются данные об участии фагоцитарной системы в борьбе против вируса, особенно в очаге воспаления. Роль фагоцитоза в противовирусном иммунитете опосредованная, фагоцитоз включается в уничтожение клеток, пораженных вирусом, на этапе взаимодействия такой клетки с антителами против вируса. Различна роль микрофагов и макрфагов. Полиморфнонуклеарные лейкоциты лейкоциты не играют существенной роли в защите против вирусных инфекций. Фактически, большинство вирусных заболеваний характеризуется полиморфнонуклеарной лейкопенией. С другой стороны, макрофаги фагоцитируют вирусы и пораженные вирусами клетки и играют важную роль в освобождении кровотока от вирусов.
Температурный фактор, повышение температуры тела при вирусной инфекции имеет существенное значение в защите, так как не только активирует многие защитные механизмы, но и обеспечивает термоинактивацию вирусов. Большинство вирусов подавляется при температуре более 39 С. Поэтому при вирусных инфекциях не рекомендуют назначать антипиретики (жаропонижающие средства), если температура не повышается выше 38 С. Играет также роль регенерация клеток, в результате которой идет селекция резистентных к вирусу клеток.
Интерфероны - семейство кодируемых хозяином белков, продуцируемых клетками при стимуляции вирусными или невирусными индукторами. Интерферон сам по себе не обладает прямым действием на вирусы, но он воздействует на другие клетки того же вида, обеспечивая им невосприимчивость к вирусной инфекции.
Интерфероны видоспецифичны, интерферон, образованный одним видом может защищать от вирусной инфекции только клетки того же или родственного вида, но не клетки неродственных видов. Таким образом, в клетках человека проявляется антивирусный эффект человеческого интерферона, и, до некоторой степени, интерферона обезьяны, но не интерферона мыши или цыпленка. Активность не является вирусспецифической. Интерферон, индуцированный одним вирусом (или даже невирусными индукторами) может обеспечивать защиту против инфекции как тем же, так и неродственным вирусом. Однако, вирусы варьируют по их чувствительности к интерферону. Вирусы также варьируют по способности индуцировать интерферон, цитоцидные и вирулентные вирусы – плохие индукторы, а слабо вирулентные вирусы – хорошие индукторы интерферона. РНК–содержащие вирусы являются лучшими индукторами, чем ДНК-содержащие. Примерами сильных индукторов могут служить вирус везикулярного стоматита и вирус Сендай. Нуклеиновые кислоты (например, двухспиральная РНК) и некоторые синтетические полимеры - особенно эффективные ирндукторы. Продукция интерферона увеличивается при повышении температуры до 40 С и подавляется стероидами и повышенным кислородным потенциалом. Синтез интерферона начинается примерно через час после индукции и достигает высокого уровня через 6-12 часов.
Быстрота индукции интерферона, намного более высокая, чем гуморальный иммунный ответ, говорит о том, что интерфероны могут играть первостепенную роль в защите хозяина против вирусных инфекций.
На основании антигенной характеристики, клеточного происхождения и других свойств, интерфероны классифицированы на три типа - альфа, бета и гамма. Обычно интерферон сокращенно обозначается как ИФН.
Интерфероны инактивируются протеолитическими ферментами, но не нуклеазами или липазами. Они устойчивы к нагреванию при 56 -60 C в течение 30-60 минут и устойчивы к широкому диапазону pH (2-10), кроме -ИФН, который является лабильным при pH 2,0. Они имеют молекулярную массу приблизительно 17 000. Они слабо антигенны, поэтому обычные серологические тесты непригодны для их обнаружения и оценки. Исследование интерферонов основывается на его биологической активности, например, способности ингибировать бляшкообразование чувствительным вирусом. Активность ИФН выражается в международных единицах (МЕ/мл, IU/ml).
Хотя интерферон был сначала признан как антивирусный агент; теперь он известен больше как регуляторный пептид, принадлежащий к классу цитокинов. Главные биологические действия интерферонов - следующее:
1. Антивирусные эффекты: индукция устойчивости инфекциям.
2. Антимикробные эффекты: резистентность к внутриклеточным инфекциям, например, к токсоплазмозу, хламидиозу, малярии.
3. Клеточные эффекты: подавление клеточного роста и пролиферации, а также синтеза ДНК и белка, увеличение экспрессии антигенов ГКС (главного комплекса совместимости) на поверхности клеток.
4. Иммунорегуляторные эффекты: увеличение цитотоксической активности NK, K и T клеток; активация цитоцидной активности макрофагов, активация Т-супрессоров, подавление ГЗТ.
3.3. Иммунологические механизмы противовирусной защиты
Факторы специфического иммунитета при вирусных инфекциях те же, что и при инфекциях другой этиологии: антигенреактивные молекулы (антитела) и клетки (антигенреактивные Т-лимфоциты), обеспечивающие соответственно гуморальный и клеточный иммунитет.
Вирусы как антигены принципиально не отличаются от других возбудителей. Стимуляция иммунной системы организма вирусными антигенами приводит к формированию иммунитета, который при многих вирусных заболеваниях настолько прочен, что сохраняется пожизненно (после натуральной и ветряной оспы, полиомиелита, кори, эпидемического паротита). При бактериальных инфекциях это наблюдается редко. Следует, однако, отметить, что сохранение пожизненного иммунитета может быть следствием пожизненной персистенции вируса в организме.
Антигены вирусов различны, их роль в иммунных реакциях неодинакова. Например, антитела к нейраминидазе вируса гриппа в меньшей мере нейтрализуют инфекционные свойства вируса, чем антитела к гемагглютинину. Антитела к нуклеиновым кислотам вируса имеют малое значение. Главную роль играют оболочечные антигены, блокада которых антителами препятствует проникновению вируса в клетку.
Вирусные антигены могут находиться и на поверхности зараженных клеток (вирусиндуцированные антигены), так как окончательное созревание может происходить во время выхода вируса из клетки. В процессе репродукции вируса в клетке происходит также синтез вирусспецифических неструктурных белков, не входящих в состав вириона, но необходимых для репродукции. Эти белки могут обладать антигенными свойствами и являются вирусиндуцированными.
Вирионы стимулируют, и гуморальные и клеточные иммунные реакции. Размножение вируса в теле во время инфекции вызывает не только количественно большую иммунную реакцию но также и освобождает и делает доступным для иммунной системы целый диапазон вирусных антигенов, включая поверхностные и внутренние антигены, а также неструктурные антигены типа ранних белков.
В осуществлении гуморального антивирусного иммунитета наиболее важную роль играют антитела классов IgG, IgM и IgA. IgG и IgM играют главную роль в крови и тканевом пространстве, в то время как IgA более важны на поверхностях слизистых оболочек.
Антитела осуществляют нейтрализацию вируса несколькими механизмами. Они могут предотвращать адсорбцию вируса на клеточных рецепторах, увеличивая деградацию вирусов, или предотвращать выход вирусного потомства из инфицированных клеток. Комплемент может реагировать вместе с антителами, вызывая повреждение поверхностей оболочечных вирионов, а также цитолиз инфицированных вирусом клеток.
Не все антитела способны нейтрализовать инвазионную способность вирусов. Антитела к внутренним антигенам не нейтрализуют. Антитела к поверхностным антигенам различаются по их способности к нейтрализации. Например, два типа антител к поверхностным антигенам появляются после гриппозной инфекции – антигемагглютинин и антинейраминидаза. Первое нейтрализовать инфекционность вируса гриппа а второе – нет. Антинейраминидаза может, однако, подавлять выход потомства вирионов из инфицированных клеток.
Некоторые антитела могут, как это ни парадоксально, увеличивать инвазионную способность вируса. Гуморальные антитела могут фактически иногда участвовать в патогенезе. Антитела могут вызывать комплемент-зависимое повреждение клеток или индуцировать иммунокомплексное повреждение тканей. Учащение инфекций, вызванных респираторно-синцитиальным вирусом в раннем детстве, как полагают, является результатом присутствия пассивно приобретенных материнских антител. У старших детей, у которые нет антител, вирус вызывает не причиняет более умеренное заболевание. Патогенез некоторых вирусных геморрагических лихорадок, как полагают, является иммунологической тромбоцитопенией. Большинство внепеченочных поражений при серозном гипатите должно быть обусловлено иммунными комплексами.
Было выдвинуто предположение, что гуморальные антитела не могут играть существенную роль в защите против вирусных инфекций. Такие взгляды были основаны в значительной степени на наблюдении, что лица с агаммаглобулинемией способны иметь нормальную устойчивость к вирусным инфекциям, в отличие от их чрезвычайной восприимчивости к бактериальным инфекциям. Это наблюдение не может быть абсолютным доказательством, поскольку даже лица с агаммаглобулинемией образуют небольшие количества антител, которое может оказаться достаточным для защиты против вирусных инфекций. Антивирусная активность гуморального иммунитета наглядно проявляется в эффективности материнских антител и пассивно введенного иммуноглобулина для предупреждения многих вирусных инфекций. Защитный эффект убитых вирусных вакцин опирается на их способность стимулировать гуморальные антитела.
Самым ранним признаком клеточного иммунитета при вирусных инфекциях было проявление повышенной чувствительности после прививки у иммунных лиц. Подобная кожная реактивность также отмечается при паротите (свинке). Нормальная устойчивость к вирусным инфекциям, обнаруживаемая при агаммаглобулинемии связывается с клеточным иммунитетом, хотя она может также быть обусловлена интерфероном или другими неиммунными механизмами. Лица с недостаточностью клеточного иммунитета проявляют повышенную восприимчивость к заражению вирусами герпесы, оспы и кори. Введение антилимфоцитарной сыворотки вызывает смертельную инфекцию у мышей, зараженных сублетальной дозой вируса эктромелии. Как полагают, клеточно-опосредованный иммунитет играет главную роль в выздоровлении от вирусных инфекций, при которых вирусемия не играет существенной роли и при которых инфицированные клетки имеют вирусные специфические антигены на своей поверхности. При некоторых вирусных инфекциях клеточный иммунитет может играть роль в поражении тканей, как например при в лимфоцитарном хориоменингите у мышей.
Клеточный иммунитет реализуется за счет действия Т-киллеров на пораженную вирусом клетку за счет взаимодействия рецепторов Т-киллера с вирусными или вирусиндуцированными антигенами на поверхности пораженной клетки. В результате клетка погибает, цикл репродукции вируса прерывается.
Некоторые вирусные инфекции вызывают подавление иммунной реакции. Коревая инфекция приводит к временному угнетению повышенной чувствительности к туберкулину.
Вообще, вирусные инфекции сопровождаются прочным иммунитетом к реинфекции, который может в некоторых случаях быть пожизненным. Кажущиеся исключения, подобные вирусному насморку и гриппу, обусловлены не недостаточностью иммунитета, а результатом повторной инфекции, вызываемой антигенно различающимися вирусами. Живые вирусные вакцины также стимулируют более длительную защиту, чем бактериальные вакцины.
Особенности иммунитета при вирусных инфекциях. Патогенез противовирусного иммунного ответа.
Эффективная иммунизация организма против вирусных инфекций тесно связана с их пато- и иммуногенезом. Поэтому рациональное проведение вакцинации, а также максимальная ее эффективность требуют изучения иммунологических и патогенетических основ инфекционного процесса.
Выздоровление от вирусной инфекции обеспечивают, по крайней мере, три феномена:
1) подавление репродукции вируса и нейтрализация инфекционности вирионов;
2) разрушение инфицированных клеток;
3) образование интерферона.
Иммунный цитолиз инфицированных вирусом клеток является существенным фактором в выздоровлении от вирусной инфекции, в основе которого лежат различные процессы, включающие Тц-клетки (антителозависимая, комплементзависимая цитотоксичность). Циркулирующие антитела играют важную роль в выздоровлении от многих генерализованных инфекций (пикорна-, тога-, флави-, парвовирусной и других инфекций). Менее важная роль Т-лимфоцитов связана с тем, что иммунодоминантные Тц-детерминанты часто находятся на консервативных белках, локализованных внутри вириона или на неструктурных вирусных белках, которые находятся только в инфицированных клетках.

При генерализованных инфекциях вирус могут нейтрализовать только те антитела, которые связываются с рецепторами поверхности вириона, которыми они прикрепляются к клетке и блокируют адсорбцию и проникновение вируса в клетку. Некоторые моноклональные антитела, не обладающие нейтрализующей активностью, могут способствовать выздоровлению — предположительно, благодаря антитело-зависимой клеточной цитотоксичности, комплемент-зависимому лизису антителами. В присутствии антител макрофаги могут поглощать и переваривать инфицированные вирусом клетки.
NK-клетки активируются интерфероном или непосредственно вирусными гликопротеинами. Они не обладают иммунологической специфичностью, но преимущественно лизируют клетки, инфицированные вирусом.
Ниже приведены основные примеры стратегии вирусов, направленные на преодоление или снижение иммунологического прессинга со стороны хозяина.
1. Репликация без цитопатогенного действия
Аренавирусы и хантавирусы, например, вызывают хронические инфекции у грызунов без гибели клеток, в которых они размножаются. Инфекция, как правило, не сопровождается заметными изменениями в организме. Ретровирусы также не вызывают изменений в клетках-мишенях, тканях и органах естественных хозяев.
2. Распространение от клетки к клетке путем сплавления мембран
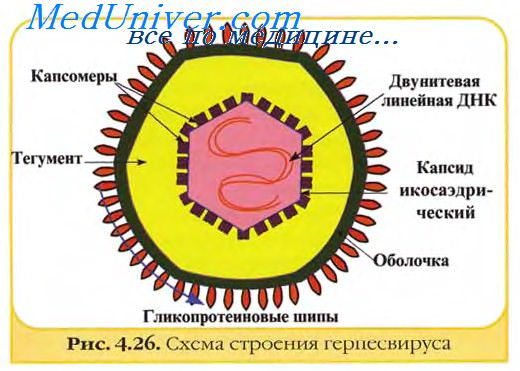
Лентивирусы, морбилливирусы и герпесвирусы (цитомегаловирусы) вызывают слияние клеток, обеспечивая передачу вирусного генома от клетки к клетке и избавляя его от влияния гуморальных иммунных механизмов хозяина.
3. Латентная непродуктивная инфекция непермиссивных клеток
Вирус может размножаться продуктивно в клетках одного типа и вызывать непродуктивную латентную инфекцию в клетках другого типа. Многие герпес-вирусы находятся в латентном состоянии в нервных ганглиях или В-лимфоцитах, но размножаются продуктивно и вызывают острые поражения эпителиальных клеткок слизистых. Пермиссивность клеток может зависеть от стадии дифференциации или активации. Например, папилломавирусы поражают базальные клетки эпителия в начале дифференцировки, но образуют инфекционные вирионы только в полностью дифференцированных клетках вблизи поверхности тела.
4. Частичная экспрессия вирусных генов
Латенция вирусов может поддерживаться ограниченной экспрессией генов, которая может убивать клетки. В течение латентной инфекции некоторые вирусы, такие как герпесвирусы, экспрессируют только ранние гены, которые необходимы для поддержания латенции. В течение реактивации, которую часто стимулирует иммуносупрессия и/или действие цитокинов или гормонов, полный вирусный геном транскрибируется снова. Эта стратегия в течение латентного состояния защищает вирус от всех иммунных механизмов организма.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

У РНК-содержащих ретровирусов сначала происходит обратная транскрипция генома в ДНК, затем ее интеграция в клеточные хромосомы и лишь после этого транскрипция генов.
Цитопатические эффекты при вирусных инфекциях разнообразны, они определяются как вирусом, так и клеткой и сводятся к разрушению клетки (цитолитический эффект), сосуществованию вируса и клетки без гибели последней (латентная и персистирующая инфекция) и трансформации клетки.
Вовлеченность организма в инфекционный процесс зависит от ряда обстоятельств - количества погибших клеток, токсичности вирусов и продуктов распада клеток, от реакций организма, начиная от рефлекторных и заканчивая иммунными. Количество погибших клеток влияет на тяжесть инфекционного процесса. Например, будут ли поражены при гриппе только клетки носа и трахеи или вирус поразит клетки эпителия альвеол, зависит тяжесть и исход болезни.
Хотя вирусы и не образуют типичных токсинов, однако и вирионы, и вирусные компоненты, накапливающиеся в пораженных тканях, выходя в кровоток, оказывают токсическое действие. Неменьшее токсическое действие оказывают и продукты распада клеток. В этом случае действие вирусной инфекции столь же неспецифично, как и действие патогенных организмов, убивающих клетки и вызывающих их аутолиз. Поступление токсинов в кровь вызывает ответную реакцию - лихорадку, воспаление, иммунный ответ. Лихорадка является преимущественно рефлекторным ответом на поступление в кровь и воздействие на ЦНС токсичных веществ.
Если лихорадка - общий ответ организма на вирусную инфекцию, то воспаление - это местная многокомпонентная реакция. При воспалении происходят инфильтрация пораженных тканей макрофагами, утилизация продуктов распада, репарация и регенерация. Одновременно развиваются реакции клеточного и гуморального иммунитета. На ранних стадиях инфекции действуют неспецифические киллеры и антитела класса IgM. Затем вступают в действие основные факторы гуморального и клеточного иммунитета. Однако гораздо раньше, уже в первые часы после заражения, начинает действовать система интерферона, представляющая семейство секреторных белков, вырабатываемых клетками организма в ответ на вирусы и другие стимулы. Описанные явления относятся к так называемой острой репродуктивной вирусной инфекции. Взаимодействие вируса и клеток может происходить, как отмечалось выше, без гибели последних. В этом случае говорят о латентной, т.е. бессимптомной или персистирующей хронической вирусной инфекции. Дальнейшая экспрессия вируса, образование вирусспецифических белков и вирионов вызывает синтез антител, на этой стадии латентная инфекция переходит в персистирующую и появляются первые признаки болезни.
Репродукция вируса в клетках сопровождается развитием цитопатических процессов, специфичных для разных вирусов и для разных типов инфекционных процессов. Цитопатические процессы при вирусных инфекциях разнообразны, они определяются как вирусом, так и клетками, причем специфика их больше "задается" клеткой, нежели вирусом, и сводится в основном к разрушению клеток, сосуществованию вируса и клеток без гибели последних и трансформация клеток. Несмотря на значительные различия цитоцидного действия разных вирусов, в общем, они сходны. Подавление синтеза клеточных макромолекул - нуклеиновых кислот и белков, а также истощение энергетических ресурсов клетки ведут к необратимым процессам, заканчивающимся гибелью пораженной клетки. Повреждение клеток вирусами, их отмирание и распад переносят вирусную инфекцию с клеточного уровня на уровень организма в целом.
При встрече организма с вирусной инфекцией продукция интерферона (растворимого фактора, вырабатываемого вирус-инфицированными клетками, способного индуцировать антивирусный статус в неинфицированных клетках) становится наиболее быстрой реакцией на заражение, формируя защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность, - делая клетки непригодными для размножения вирусов.
Продукция и секреция цитокинов относятся к самым ранним событиям, сопутствующим взаимодействию микроорганизмов с макрофагами. Этот ранний неспецифический ответ на инфекцию важен по нескольким причинам: он развивается очень быстро, поскольку не связан с необходимостью накопления клона клеток, отвечающих на конкретный антиген; ранний цитокиновый ответ влияет на последующий специфический иммунный ответ.
Интерферон активирует макрофаги, которые затем синтезируют интерферон-гамма, ИЛ-1, 2, 4, 6, ФНО, в результате макрофаги приобретают способность лизировать вирус-инфицированные клетки.
Интерферон-гамма является специализированным индуктором активации макрофагов, который способен индуцировать экспрессию более 100 разных генов в геноме макрофага.
Продуцентами этой молекулы являются активированные Т-лимфоциты (Тh1-тип) и естественные киллеры (NK-клетки). Интерферон-гамма индуцирует и стимулирует продукцию провоспалительных цитокинов (ФНО, ИЛ-1, 6), экспрессию на мембранах макрофагов, антигенов МНС II; гамма-интерферон резко усиливает антимикробную и противовоспалительную активность путем повышения продукции клетками супероксидных радикалов, а усиление иммунного фагоцитоза и антителоопосредованной цитотоксичности макрофагов под влиянием гамма-интерферона связано с усилением экспрессии Fc-рецепторов для JgG. Активирующее действие интерферона-гамма на макрофаги опосредовано индукцией секреции этими клетками ФНО -альфа. Этот пик наблюдается совместно с ФНО-альфа. Максимум продукции ИЛ-4 наступает через 24-48 ч с момента активации клеток. При этом ИЛ-4 рассматривается как цитокин, ограничивающий иммуновоспалительные реакции и снижающий ответ организма на инфекцию, угнетая при этом экспрессию гамма-интерферона. Интерферон-гамма ин витро усиливает фагоцитарную активность нейтрофилов, что обусловлено усилением экспрессии Fc-рецепторов и поверхностных белков семейства интегринов на нейтрофилы. Это позволяет нейтрофилам осуществлять цитотоксические функции и фагоцитоз. В качестве основных эффекторных клеток воспалительного процесса, они обеспечивают элиминацию инфекта из организма.
Взаимодействие цитокина с клеткой определяется универсальной биологической системой, специфическим механизмом которой является рецепторный аппарат, связанный с восприятием метаболического кода. Для проявления биологической активности цитокина необходимо присутствие на поверхности чувствительных клеток специфических рецепторов, которые могут экспрессироваться параллельно с синтезом цитокина. Рецепторы цитокинов представляют собой комплексы, состоящие из двух и более рецепторных молекул, которые объединяются на мембране клетки-мишени и образуют высокоаффинный рецепторный комплекс. Большинство рецепторов состоит из отдельных молекул, связывающих цитокины, которые ассоциируются после связывания лиганда с сигналпередающим рецепторным компонентом; часть рецепторов существует как растворимые изоформы, способные связывать и растворять цитокины, а часть функционирует как многокомпонентные блоки; механизм комплексирования субъединиц рецепторов объясняет плейотропные и дублирующие эффекты цитокинов, имеющих большое структурное сходство. Рецепторы ИЛ-10 имеют гомологию рецепторов интерферона, и подобно ИЛ-10 индуцирует экспрессию в моноцитах гена Fc- рецептора. Для полного функционирования цитокиновой системы необходимы повышение уровня цитокина в ответ на инфект и экспрессия нормального количества рецепторов к ним на клетках. Изменение рецепторов после их связывания с цитокином заключается в интернализации комплексов цитокин - рецептор внутрь клетки. На поверхности клеток рецептор появляется заново, постепенно синтезируясь в течение 24-36 ч (время появления рецепторов интерферон-альфа). В этот период клетки остаются чувствительными к последующим дозам цитокина, чем объясняется эффективность введения препаратов интерферона и их индукторов три раза в неделю.
При антигенной стимуляции клеток трансдукция сигнала с активированного рецептора на генетический аппарат осуществляется с помощью внутриклеточных регуляторных систем, компоненты которых (белки мембран, ферментов, хроматина) связываются с чувствительными к ним последовательностями ДНК. После связывания цитокина (интерферон) с поверхностными клеточными мембранными рецепторами происходит активация ферментов протеинкиназы-С (ПКС), тирозинкиназы, ц-АМФзависимой протеинкиназы, серин-треонинкиназы. Интерферон-альфа активирует tyk 2 и jak 1-киназы, а интерферон-гамма активирует jak 1 и 2-киназы. Далее факторы транскрипции перемещаются в ядро клетки и связывают гены раннего ответа.
Первый ответ клеток на цитокин - это быстрая индукция генов раннего ответа ("immediate early" генов), в число которых и входит ген интерферон-гамма. Стимуляция экспрессии этих генов важна для выхода клеток из Go-стадии и перехода в Gi-стадию и дальнейшей прогрессии клеточного цикла. Их индукция происходит после активации рецепторов роста на клеточной мембране и активации протеин-киназной системы. Гены раннего ответа являются ключевыми регуляторами клеточной пролиферации и дифференцировки, кодируют белки, регулирующие репликацию ДНК.
Таким образом, при активации клеток происходит стимуляция генов раннего ответа, что ассоциируется с изменением фаз клеточного цикла. Основная протективная роль в иммунном ответе, направленном против внутриклеточных паразитов (грибы, простейшие, вирусы, микобактерии туберкулеза), принадлежит клеточным механизмам. Способность перечисленных возбудителей переживать и размножаться внутри клеток делает их защищенными от действия антител и системы комплемента. Резистентность к антимикробным факторам макрофагов позволяет им длительно переживать внутри этих клеток. Для элиминации возбудителя необходим специфический клеточно-опосредованный ответ. Его специфичность определяется антигенраспознающими СД8+-Т-лимфоцитами, которые пролиферируют, активируются и формируют клон эффекторных цитотоксических лимфоцитов. Решающий момент специфического иммунного ответа - это ответ СД4+Т-лимфоцитов с хелперной направленностью на распознавание антигена. На этом этапе определяется форма иммунного ответа: либо с преобладанием гуморального иммунитета, либо с преобладанием клеточных реакций (ГЗТ). Направление дифференцировки СД4 + -лимфоцитов, от которого зависит форма специфического иммунного ответа, контролируется цитокинами, образующимися в ходе воспалительной реакции. Так, в присутствии ИЛ-12 и интерферон-гамма СД4 + -лимфоциты дифференцируются в воспалительные Тh1-клетки, начинают продуцировать и секретировать интерлейкин-2, интерферон-гамма, ФНО и определяют клеточный характер специфического иммунного ответа. Присутствие ИЛ-12 обеспечивается его продукцией макрофагами, а интерферон-гамма - естественными киллерами, активированными в раннюю фазу ответа на внутриклеточно паразитирующие бактерии и вирусы. В отличие от этого, в присутствии ИЛ-4 СД4 + -лимфоциты дифференцируются в хелперы Тh 2, которые начинают продуцировать и секретировать ИЛ-4, ИЛ-5, ИЛ-6 и запускают гуморальный иммунный ответ, т.е. синтез специфических антител - иммуноглобулинов. Воспалительные Тh 1-лимфоциты нужны для борьбы с внутриклеточными паразитами, а Тh 2 хелперы нужны для элективной защиты от внеклеточных паразитов.
Вирусная инфекция может вызывать быстрое подавление экспрессии ряда клеточных генов (из которых наиболее изучены интерфероновые гены и гены, кодирующие дс-РНК-зависимые ферменты -2,5-ОАС и ПК-дс), принимающих участие в антивирусном действии. Специальные исследования механизма антивирусного действия интерферонов и дс-РНК в клеточных и бесклеточных системах показали ключевую роль в этом процессе вышеуказанных ферментов. ПК-дс, взаимодействуя с дс-РНК, фосфорилируется и в активной форме фосфорилирует регуляторные факторы транскрипции и трансляции, из которых наиболее изучен инициирующий фактор трансляции (eIF2).
ПК-дс выполняет регуляторную роль в системе клеточной пролиферации на уровне факторов трансляции и активации ряда генов цитокинов. Вероятно, существует связь между подавлением транскрипции мРНК и ПК-дс, угнетением общего синтеза клеточного белка при вирусных инфекциях и накоплением в ядрах клеток белка нуклеокапсида и белка NSP2. Фрагментация клеточных хромосом, наблюдающаяся на ранних сроках вирусной инфекции, может быть одной из причин подавления экспрессии генов, участвующих в противовирусном ответе.
Есть основания предполагать участие белков NSP2 в регуляции активности генов цитокинов - низкомолекулярных белковых регуляторных веществ, продуцируемых клетками и способных модулировать их функциональную активность. Нарушения в системе цитокинов приводят к нарушению кооперативных взаимодействий иммунокомпетентных клеток и нарушению иммунного гомеостаза.
В последние годы показано, что ИЛ- 12, относящийся к провоспалительным цитокинам, является ключевым для усиления клеточно-опосредованного иммунного ответа и инициации эффективной защиты против вирусов.
Средства терапии гриппа и ОРЗ можно разделить на этиотропные, иммунокорригирующие, патогенетические и симптоматические. Приоритет принадлежит этиотропным препаратам, действие которых направлено непосредственно на возбудитель инфекции. Все препараты этиотропного действия целесообразно рассматривать с учетом их точек приложения в цикле репродукции вирусов гриппа и других ОРЗ.
Применение химиопрепаратов для профилактики и лечения гриппа и ОРЗ относится к базовой терапии и является общепризнанным мировым стандартом. Многолетние клинические исследования достоверно выявили их высокую лечебно-профилактическую значимость. Химиотерапевтические средства представлены тремя основными группами: это блокаторы М2-каналов (амантадин, ремантадин); ингибиторы нейраминидазы (занамивир, озельтамивир) и ингибиторы протеаз (амбен, аминокапроновая кислота, трасилол). Препараты оказывают прямое антивирусное действие, нарушая различные фазы репликативного цикла вирусов. Несколько особняком стоит группа вирулицидных препаратов, применяемых местно для предотвращения адсорбции и проникновения вирионов в клетки.
Типы гуморального иммунного ответа при вирусной инфекции. Иммуноглобулин A.
Иммунная система организма на вирусные инфекции или иммунизацию вирусными вакцинами отвечает выработкой антител, обладающих специфичностью к различным вирусным компонентам и принадлежащих к разным классам иммуноглобулинов.
Важнейшая биологическая функция иммуноглобулинов - специфическое связывание с антигеном. Антитела против некоторых эпитопов на поверхности вирионов нейтрализуют инфекционность, они могут также действовать как опсонины, облегчая поглощение и разрушение макрофагами. Кроме того, антитела могут прикрепляться к вирусным антигенам на поверхности инфицированных клеток, вызывая их разрушение вследствие активации классического или альтернативного действия комплемента или с помощью активации Fc-рецепторсвязывающих клеток, таких как NK-клетки, полиморфноядерные лейкоциты и макрофаги (антителозависимая цитотоксичность).
Различают четыре основных класса антител: два мономера IgG и IgE и два полимера IgM и IgA. Все иммуноглобулины имеют подобную структуру, но широко варьируют по аминокислотной последовательности антигенсвязывающего сайта, который определяет их специфичность для данной антигенной детерминанты. N-концевая последовательность L- и Н-цепей образует антигенсвязывающий центр, то есть антидетерминанту. Чем больше антидетерминант на поверхности иммуноглобулина, тем выше его активность.
Авидность характеризует прочность связи антитела с соответствующим антигеном. Афинность - прочность связи между отдельными антидетерминантами и детерминантами.
IgG является основным классом антител в крови. Он состоит из двух Н- и L-цепей, каждая из которых содержит постоянные и вариабельные участки. Молекулы IgG содержат два идентичных антигенсвязывающих Fab-фрагмента и Fc-фрагмент, выполняющий эффекторные функции (связывание комплемента, прикрепление к фагоцитам и плацентарному или колостральному трансферу).
В результате системной вирусной инфекции IgG синтезируется в течение длительного периода и является главным фактором защиты от реинфекции. Субклассы IgG отличаются константной областью их V-цепей и, соответственно, биологическими свойствами, такими как фиксация комплемента и прикрепление к фагоцитам.
Первоначально антитела относятся к классу IgM, но соматические рекомбинации (транслокации) затем рождают класс, обусловленный связыванием V-генных сегментов различными постоянными участками Н-цепей. В изменении изотипов (переход изотипов на другой путь) важная роль принадлежит различным цитокинам. Таким образом, через несколько дней IgG , IgA и иногда IgE-антите-ла той же самой специфичности становятся доминантными в иммунном ответе.
Тц-клетки достигают своего пика обычно через неделю после инфекции, а антитела — через 2—3 недели. NK-клетки максимально активируются через два дня, а активность интерферона совпадает с пиком концентрации вируса.
Динамика гуморального иммунного ответа проявляется, в первую очередь, в смене синтеза антител различных классов. В начальной фазе иммунного ответа синтезируется преимущественно IgM с относительно слабым сродством к антигену (авидный класс антител). IgM является пентамером с 10 Fab-фрагментами. Синтез IgM сменяется синтезом IgG, а затем IgA. IgM-антитела находятся в большинстве случаев в плазме крови и лимфе, обладая способностью преципитировать, агглютинировать и лизировать антигены.
Устойчиво высокие титры антител могут отражать также персистенцию вирусной инфекции (например, вирусов герпеса, кори) или повторную стимуляцию вирусным антигеном, однако антитела к некоторым вирусам могут персистировать и без явных признаков заболевания. IgG -антитела содержатся в сыворотке крови в наиболее высокой концентрации (~12г/л), откуда они поступают в тканевую жидкость. В отличие от других иммуноглобулинов, у человека и приматов они способны проникать через плаценту и снабжать плод материнскими антителами. Период полураспада их равен 10-35 дням.
Иммуноглобулин A (IgA) является димером с 4 Fab-фрагментами. Проходя через эпителиальные клетки, IgA приобретает J-фрагмент (секреторный фрагмент), становясь секреторным slgA, который секретируется через эпителий респираторного, кишечного и урогенитального трактов. Секреторный IgA более устойчив к протеазам, чем другие иммуноглобулины, и является основным иммуноглобулином на слизистых поверхностях, в молозиве и молоке многих видов млекопитающих. Поэтому IgA-антитела играют важную роль в защите от инфекции респираторного, кишечного и урогенитального трактов. Иммунизация через слизистые при некоторых инфекциях является более эффективной, чем системное введение вакцины.
Секреторные антитела появляются на 4-7-й день после инфицирования и представлены в основном IgA, IgG и IgM. Они считаются менее специфичными, чем сывороточные. Динамика накопления антител в сыворотке крови и секретах практически одинакова.
В отличие от сывороточного IgA, большая часть которого является мономером, молекула секреторного IgA представляет собой димер. Мономерный IgA синтезируется плазматическими клетками костного мозга, периферических лимфатических узлов, селезенки и других органов. Димерные формы sIgA с соединительной j-цепью синтезируются лимфоидной тканью желудочно-кишечного, респираторного и урогенитального трактов.
Добавочный структурный компонент секреторного IgA, вероятно, функционирует как поверхностный рецептор клеток секреторного эпителия и придает устойчивость sIgA к действию протеаз. Биологическая функция sIgA состоит в основном в местной защите слизистых оболочек от инфекции. Формирование местных секреторных IgA на поверхности слизистых оболочек имеет особое значение для формирования устойчивости организма к вирусам, обычно проникающим через дыхательный, кишечный или урогенитальный эпителий. Для индукции секреторных IgA в кишечнике вирус должен вступить в контакт с лимфоидной тканью кишечника. После формирования местного ответа В-клетки памяти, образующие IgA, мигрируют в другие участки кишечника. Аналогичный механизм индукции IgA функционирует в респираторном тракте.
Система секреторного иммунитета функционирует и регулируется иначе, чем иммунная система в целом. Она может коррелировать с общей иммунной реакцией или быть независимой от нее. Кроме секреторного IgA, существенное значение для иммунитета слизистых оболочек имеют содержащиеся в секретах у человека IgM и IgG. IgM также представляет секреторный иммуноглобулин, однако он не так прочно, как sIgA, связывает секреторный компонент. В пищеварительном тракте IgM играет более важную роль, чем IgG, а в носоглотке - наоборот.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Респираторные органы и вирусная инфекция. Роль дыхательной системы в противовирусном иммунитете.
Специфическая защита их сопряжена главным образом с функционированием секреторных IgA. Лимфоидная ткань респираторного тракта является частью единой иммунной системы слизистых. В подслизистом слое бронхов имеются лимфатические фолликулы, которые покрыты клетками, подобными М-клеткам пейеровых бляшек.
Преобладание IgA-синтезирующих клеток отмечено в слизистой носа, трахеи, бронхов и легких у человека и свиней. Аэрозольное и интраназальное введение различных агентов, как правило, сопровождается локальной выработкой антител класса IgA, при этом аппликация инактивированных антигенов оказывается менее эффективной. Инактивированная и живая вакцины вызывали иммунитет к полиовирусу, соответственно, при парентеральной и энтеральной вакцинации, однако лишь последняя вызывала IgA-ответ, хотя защитный эффект был практически одинаков.
Инактивированную вакцину против гриппа вводили мышам с питьевой водой, орально — в желатиновых капсулах или инокулировали в просвет двенадцатиперстной кишки. Во всех случаях антительный ответ был дозозависимым и менее выраженным, чем после внутримышечного введения вакцины в меньшей дозе. Респираторная иммунизация инактивированной вакциной против ньюкаслской болезни защищала цыплят. Защитный эффект и антительный ответ зависели от дозы вакцины.
Интраназальная иммунизация свиней живой вакциной против болезни Ауески обеспечивала более выраженный иммунитет, чем парентеральная вакцинация. Живая вакцина против парагриппа-3 при интраназальном применении обеспечивает защиту телят от инфекции. Интраназальная иммунизация субъединичной вакциной (гликопротеины HN и F) против парагриппа-3 обеспечивала полную защиту и синтез локальных и системных антител. Подкожная иммунизация вызывала лишь частичную устойчивость и синтез системных антител.
Аналогичные данные получены с компонентной вакциной против гриппа.

Эффективность живой и инактивированной эмульгированной вакцин против ньюкаслской болезни сравнивали на 20-недельных индюшатах. Аэрозольная иммунизация живой вакциной сопровождалась образованием антител в более высоком титре, чем подкожное введение инактивированной вакцины. После интраназального контрольного заражения вирус из трахеи выделяли только от вакцинированных инактивированной вакциной, хотя заражение птиц обеих групп сопровождалось серологическим ответом, свидетельствующим о приживляемости вирулентного вируса.
Живая холодоадаптированная гриппозная вакцина вызывала иммунитет только после двукратного интраназального применения.
При интраназальной вакцинации животных препаратами ВИЧ наблюдали образование IgA-антител не только в носоглотке, но и во влагалище и кишечнике.
Для усиления иммунного ответа вакцинацию часто проводят различными способами, сочетая при этом живые и инактивированные вакцины. Так, пероральная иммунизация мышей инактивированными препаратами вируса Сендай не вызывала локальной защиты респираторного тракта; интраназальная — частично защищала только нижний отдел. Наиболее эффективной оказалась назооральная иммунизация. Усиление иммунного ответа к гриппу у людей отмечали при сочетании интраназального применения живой вакцины с последующим парентеральным введением инактивированной вакцины. Наибольший иммунизаторный эффект при PC-инфекции у взрослых серопозитивных пациентов с использованием живого аттенуированного штамма вируса достигался при сочетании интраназального и внутрикожного введений.
Парентеральная вакцинация инактивированной полиовирусной вакциной усиливает системный и местный IgA-ответ у людей только после предварительной оральной вакцинации живой вакциной.
Интраназальное введение мышам белка F респираторно-синцитиального вируса вызывало образование сывороточных IgG и местных IgA-антител к белку F, причем IgA-антитела выявлялись не только в носовой полости, но и во влагалище. Известно, что при парентеральном введении инактивированных вакцин образования IgA практически не происходит. В исследованиях на людях титр IgG-антител при дву- и трехкратной интраназальной вакцинации был сравним с титром при однократной парентеральной иммунизации, хотя в последнем случае IgA антитела не выявлялись.
Кроме иммунологической связи BALT и GALT, реализуемой в рамках общей иммунной системы слизистых, не менее важное значение имеет иммунологическая кооперация BALT — молочная железа. В результате антигенной сенсибилизации предшественники IgA-продуцирующих клеток из BALT могут мигрировать в молочную железу и давать начало новым клонам клеток, синтезирующим специфические антитела класса IgA. Однако для эффективной иммунологической кооперации с бронхоальвеолярной лимфоидной тканью и молочной железой, по-видимому, необходим контакт антигена с иммунокомпетентными клетками нижнего отдела респираторного тракта, то есть с клетками BALT
В пользу этого предположения свидетельствуют данные иммунизации свиноматок против трансмиссивного гастроэнтерита респираторным коронавирусом свиней. Высокий уровень вируснейтрализующих антител в молозиве и молоке ассоциирован в равной мере с IgA и IgG.
В аналогичных опытах с вирусом болезни Ауески получены менее демонстративные результаты. Это можно объяснить тем, что основное место репликации вируса болезни Ауески — верхний отдел респираторного тракта.
Вирус иммунодефицита кошек вводили интраназально, интраректально или парентерально. Гуморальный или клеточный иммунитет образовывался при всех способах, однако был более выражен при введении антигена непосредственно в лимфоузлы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

