Острый гастроэнтерит вирусной этиологии
Обновлено: 22.04.2024
Ротавирусный гастроэнтерит – заболевание из группы острых вирусных диарей, протекающее с признаками поражения желудочно-кишечного и респираторного тракта. Течение ротавирусного гастроэнтерита характеризуется субфебрильной или фебрильной температурой, умеренной гиперемией зева, рвотой, болями в животе, частым водянистым стулом кратностью до 5-15 раз в сутки. Диагноз ротавирусного гастроэнтерита подтверждается с помощью ПЦР-анализа испражнений и серологического исследования крови методами ИФА, РСК, РТГА. Лечебные мероприятия при ротавирусном гастроэнтерите включают диету, регидратацию, прием ферментных препаратов, энтеросорбентов, противовирусных препаратов.

Общие сведения

Причины ротавирусного гастроэнтерита
Инфекционный возбудитель относится к роду Rotavirus, семейству Reoviridae. Вирион имеет сферическую форму, двухслойную капсидную оболочку, диаметр 70-75 нм, содержит рибонуклеиновую кислоту. Различают 9 серотипов ротавируса, из которых для человека патогенны серотипы 1-4, 8 и 9; остальные вызывают диарейные заболевания у животных. Ротавирусы длительно, от 1 до нескольких месяцев, сохраняют жизнеспособность во внешней среде (в фекалиях, водопроводной воде, на овощах и т. д.), относительно устойчивы к дезинфицирующим средствам.
Эпидемическую опасность для окружающих представляют вирусоносители и больные ротавирусным гастроэнтеритом: первые могут выделять вирус до нескольких месяцев, вторые наиболее контагиозны в первую неделю заболевания (иногда до 20-30 дней). Передача инфекции происходит по фекально-оральному механизму; пищевым, водным, воздушно-капельным или бытовым путем. Инфицирующими факторами в большинстве случаев выступают водопроводная вода, молоко и молочные продукты, овощи и фрукты, игрушки и предметы обихода.
Наибольшая восприимчивость к ротавирусу отмечается среди новорожденных с неблагоприятным преморбидным фоном и находящихся на искусственном вскармливании, а также детей до 3-х лет. Считается, что к 5 годам 95% детей хотя бы раз переболевают ротавирусным гастроэнтеритом. После перенесенной ротавирусной инфекции остается непродолжительный типоспецифический иммунитет. Ротавирусный гастроэнтерит нередко возникает в виде внутрибольничных вспышек в родильных домах и детских стационарах различного профиля, а также групповых вспышек в организованных дошкольных коллективах. Для заболевания характерна весенне-зимняя сезонность.
При попадании в пищеварительный тракт ротавирусы начинают размножаться в энтероцитах тонкой кишки, вызывая дистрофию и разрушение эпителия ворсинок. Это приводит к нарушению синтеза дисахаридаз и скоплению в кишечнике нерасщепленных дисахаридов. Ферментная недостаточность сопровождается нарушением переваривания пищи и всасывания воды в толстом кишечнике, гипермоторикой кишечника, что в конечном итоге вызывает развитие осмотического диарейного синдрома.
Симптомы ротавирусного гастроэнтерита
Симптоматика ротавирусного гастроэнтерита разворачивается после кратковременного инкубационного периода, длящегося от 15 часов до 3-5 суток (в среднем 1-2 дня). Клинические проявления манифестируют остро и достигают максимальной выраженности в течение 12-24 часов. Самыми характерными синдромом ротавирусного гастроэнтерита является расстройство пищеварения: острая диарея, тошнота, рвота, боли в животе. Обычно рвота повторяется не более 3-4 раз и только в течение первых суток. Стул учащается до 5-15 раз в сутки; при легком течении ротавирусного гастроэнтерита имеет кашицеобразную консистенцию; при тяжелой форме приобретает водянистый, пенистый характер, желтый или желто-зеленый цвет, имеет резкий кислый запах, не содержит патологических примесей (слизи, крови). В некоторых случаях испражнения становятся мутными, белесоватой окраски и напоминают стул при холере. Диарея сопровождается постоянными или схваткообразными болями в эпигастральной области и в районе пупка, урчанием в животе. Проявлениями дегидратации у грудных детей служат снижение массы тела и тургора тканей; возможны сильная слабость, головокружение, судороги.
Температура тела при ротавирусном гастроэнтерите повышается до субфебрильных или фебрильных значений и обычно удерживается 3-4 дня. У 60-70% пациентов одновременно с поражением ЖКТ развивается респираторный синдром, характеризующийся гиперемией слизистой оболочки мягкого неба, ринитом, першением в горле, фарингитом. Изменения со стороны почек обычно кратковременны; могут включать альбуминурию, микрогематурию, цилиндрурию, олигурию. В отдельных случаях развивается декомпенсированный метаболический ацидоз и острая почечная недостаточность.
Общая продолжительность ротавирусного гастроэнтерита составляет 7-10 суток. Лихорадочно-интоксикационный синдром выражен в первые 2-3 дня, длительность диарейного синдрома составляет 3-6 дней, рвота отмечается в первые 2 суток. У лиц с иммунодефицитами, включая ВИЧ-инфицированных, ротавирусный гастроэнтерит может осложниться геморрагическим гастроэнтеритом или некротическим энтероколитом.
Диагностика
Подтвердить диагноз ротавирусного гастроэнтерита позволяет совокупность эпидемиологических, клинических и лабораторных данных. В пользу вирусной диареи свидетельствуют семейные или коллективные вспышки, зимне-весенняя сезонность, бурное развитие симптоматики (обильный водянистый стул, приступообразные боли в животе, императивные позывы на дефекацию, кратковременная лихорадка и т. п.).
Диагностическая ректороманоскопия не выявляет каких-либо специфических изменений, кроме слабой гиперемии и отечности слизистой оболочки кишки. Критерием лабораторной диагностики ротавирусного гастроэнтерита является обнаружение антигена возбудителя в испражнениях с помощью ПЦР или РЛА. Четырехкратное нарастание титра антител к ротавирусу, выявляемое методами ИФА, РСК и РТГА, позволяет удостовериться в правильности диагноза лишь спустя 2 недели.
Отсутствие находок при бактериологическом исследовании кала на кишечную группу является основанием для исключения сальмонеллеза, дизентерии, эшерихиоза и других кишечных инфекций. Также необходимо проведение дифференциальной диагностики с пищевыми токсикоинфекциями, энтеровирусной инфекцией, иерсиниозом, лямблиозом, криптоспоридиозом, балантидиазом, холерой.
Лечение ротавирусного гастроэнтерита
В легких и среднетяжелых случаях лечение ротавирусного гастроэнтерита проводится амбулаторно под наблюдением участкового педиатра или инфекциониста; госпитализации полежат дети раннего возраста и лица с тяжелым эксикозом. В остром периоде ротавирусного гастроэнтерита больным показан покой, диета с исключением молочных продуктов, ограничением углеводов и увеличением количества белка. Показан прием ферментных препаратов (панкреатина), энтеросорбентов, пробиотиков. Регидратационная и дезинтоксикационная терапия в легких случаях проводится перорально; в тяжелых – парентерально в соответствии с объемом потерянной жидкости. Рекомендовано питье чая, морсов, минеральной воды; внутривенное введение растворов натрия хлорида, калия хлорида, натрия гидрокарбоната, глюкозы и др. Антибактериальные препараты при ротавирусном гастроэнтерите не показаны; в качестве этиотропной терапии назначают умифеновир, альфа интерферон.
Прогноз и профилактика
Прогноз течения ротавирусного гастроэнтерита почти всегда благоприятный. Крайне редко, преимущественно у грудных детей, наблюдаются летальные исходы, обусловленные сердечно-сосудистой недостаточностью, ОПН или присоединением бактериальной инфекции. Профилактические меры заключаются в раннем выявлении и изоляции больного, соблюдении санитарно-гигиенического режима в ДОУ, проведение заключительной дезинфекции. Для детей первого года жизни профилактикой ротавирусного гастроэнтерита служит грудное вскармливание. В старшей возрастной группе предлагается дополнительная вакцинация от ротавирусной инфекции.
Гастроэнтерит – это воспалительный процесс в желудке и тонком кишечнике, причиной которого может быть бактериальное (в том числе хеликобактерное), вирусное или протозойное поражение, действие химических и физических факторов, развитие аллергических реакций. Ведущие клинические признаки – диспепсический, болевой синдром, при остром инфекционном гастроэнтерите – дегидратация. Диагностика заключается в изучении анамнеза заболевания, эпидемиологической обстановки, выявлении возбудителя, проведении эндоскопических и других дополнительных методов исследования. Лечение консервативное, определяется формой патологии.
Общие сведения
Гастроэнтерит – воспалительный процесс, локализующийся в слизистой оболочке желудка и тонкого кишечника, приводящий к нарушению секреторной, пищеварительно-транспортной функции, вторичным иммунным и метаболическим изменениям. Заболевание может протекать в двух формах – острой и хронической, которые имеют принципиальные отличия в этиологии, проявлениях и методах лечения.
Распространенность очень высокая: в структуре инфекционных заболеваний острый гастроэнтерит занимает второе место после респираторных инфекций, а хронический встречается более чем у половины школьников и лиц старших возрастных групп. Актуальность данной патологии обусловлена постоянным появлением новых штаммов возбудителей, развитием устойчивости к антибиотикам, распространенностью таких факторов риска, как нерациональное питание, употребление алкоголя и курение, а также крайне частыми случаями самолечения.
Причины гастроэнтерита
Основной причиной развития острого воспаления является инфицирование бактериями, вирусами, простейшими (шигеллами, сальмонеллами, кишечной палочкой, энтеротропными вирусами, амебами и др.), а также действие на слизистую оболочку желудка и тонкого кишечника химических или физических повреждающих факторов (алкоголя, некоторых лекарственных препаратов, агрессивных химических веществ, ионизирующей радиации). Реже острая форма возникает в результате несбалансированного питания (употребления слишком острой, жирной пищи) или индивидуальной непереносимости определенных продуктов питания (аллергическая форма).
Наиболее часто встречается острый инфекционный гастроэнтерит, при котором происходит попадание патогенной флоры в ЖКТ, адгезия и инвазия микроорганизмов, продукция ими энтеротоксинов. Эти процессы сопровождаются повышением осмотического давления содержимого кишечника и секрецией в его просвет большого количества воды и электролитов. Вероятность острого инфекционного гастроэнтерита повышается при нарушении микробиоценоза кишечника и пониженной кислотности желудочного сока.
Хронический гастроэнтерит может формироваться как осложнение и продолжение перенесенного острого процесса, но в большинстве случаев его причиной является инфицирование Helicobacter pylori. Хеликобактерии – это кислотоустойчивые микроорганизмы, обладающие тропностью к эпителиальной ткани желудка и имеющие защитные механизмы, позволяющие существовать в агрессивной кислой среде.
Развитие этих бактерий приводит к повышению кислотообразующей функции, а в результате постоянного действия на слизистую тонкого кишечника кислого содержимого желудка – метаплазии кишечного эпителия, который трансформируется в желудочный. При этом слизистая приобретает благоприятные свойства для заселения хеликобактерий. Хронический воспалительный процесс приводит к недостаточной выработке пищеварительных соков и угнетению местных иммунных механизмов.
По наблюдениям специалистов в сфере практической гастроэнтерологии, хроническая форма патологии часто наблюдается при алкоголизме. При этом имеют место атрофические изменения в слизистой оболочке желудочно-кишечного тракта с выраженными нарушениями переваривания пищи и всасывания ценных питательных веществ.
Классификация
Гастроэнтерит классифицируется в зависимости от формы (острая или хроническая), этиологического фактора и преобладающего клинического синдрома. В течении острого гастроэнтерита выделяют три степени тяжести. Первая характеризуется нечастой диареей и рвотой, сохранением нормальной температуры тела и отсутствием симптомов обезвоживания. Средняя степень тяжести определяется рвотой и диареей до десяти раз в сутки, признаками легкой дегидратации и повышением температуры до 38,5ºС. Тяжелое течение сопровождается выраженным обезвоживанием, лихорадкой, нарушениями сознания.
Хронический гастроэнтерит классифицируют по этиологическим факторам (инфекционный, алиментарный, вызванный физическими или химическими факторами, заболеваниями печени и поджелудочной железы), преобладающим функциональным изменениям (нарушение мембранного пищеварения, всасывательной или моторной функции), повышенной или пониженной кислотности. В зависимости от анатомо-морфологических изменений различают поверхностный гастроэнтерит с повреждением эпителиальных клеток, хроническое воспаление без атрофии, хронический атрофический процесс. В течении хронической формы выделяют обострения и ремиссии.
Симптомы гастроэнтерита
Клиническая картина зависит от формы заболевания. Острый процесс развивается бурно, из-за частой и обильной диареи и рвоты в течение нескольких часов состояние пациента может существенно ухудшиться. Если причиной патологии является инфекционный процесс, инкубационный период может длиться от 3-4 часов до нескольких дней. Чаще всего первый симптом – диарея, возможна тошнота и рвота. Выраженность проявлений отличается в зависимости от видовой принадлежности возбудителя.
При бактериальном гастроэнтерите течение обычно более тяжелое, чем при вирусном, характерны гипертермия и интоксикационный синдром. Особенностью является повреждение клеток эпителия токсинами, поэтому в большинстве случаев бактериальный гастроэнтерит сопровождается выраженными спастическими болями по ходу кишечника. Вирусное поражение крайне редко сопровождается болью в животе, у маленьких детей заболевание может быстро привести к значительному обезвоживанию. Вирусный гастроэнтерит часто протекает с признаками респираторной инфекции.
При остром процессе ведущим клиническим синдромом, требующим ранней коррекции, является обезвоживание. Дегидратация может достигать значительной степени, когда пациент теряет жидкость в количестве 10% массы тела и более. При этом возможны судороги, нарушение сознания, выраженная слабость, тахикардия, снижение артериального давления. Больные ощущают сильную жажду; кожные покровы сухие, тургор снижен. При значительном обезвоживании температура тела понижается до 35 ºС, уменьшается количество выделяемой мочи вплоть до анурии.
Хроническая форма болезни сопровождается общими симптомами и признаками местного поражения слизистой оболочки. Общие проявления характеризуются слабостью, астенизацией, снижением веса вследствие нарушенного всасывания питательных веществ, раздражительностью, бессонницей. У большей части пациентов наблюдаются трофические изменения ногтей (слоящиеся, ломкие ногти), волос (ломкие, секущиеся волосы), кожи и слизистых. Нарушение всасывания кальция может привести к парестезиям, судорогам мелких мышц.
Боль при хроническом гастроэнтерите возникает через 1-2 часа после еды, сопровождается тошнотой, отрыжкой, реже – рвотой. К кишечным проявлениям заболевания относятся диарея, полифекалия, вздутие живота, урчание. В клинике хронического процесса сменяются периоды обострений и ремиссий. Обострения имеют осенне-весеннюю сезонность, их провоцируют нарушения диеты и сопутствующие заболевания. При адекватной терапии симптомы регрессируют приблизительно за десять дней.
Диагностика
В случае острой формы гастроэнтерита ведущая роль в диагностике отводится изучению жалоб и анамнеза заболевания, эпидемиологической обстановки в регионе, факторов риска, а также методам выявления возбудителя. Характер изменений испражнений и степень обезвоживания позволяют определиться с началом лечения. Точный диагноз выставляется после выявления возбудителя, однако эти исследования требуют длительного времени (7-10 дней). При осмотре определяется сухость кожных покровов и снижение их тургора, болезненность живота при пальпации. Язык сухой, обложен сероватым или белым налетом. Возможна гипертермия, нарушение сознания, при выраженной дегидратации – гипотермия и судороги.
Копрологическое исследование (копрограмма) выявляет в испражнениях примеси слизи, гноя, крови, непереваренной клетчатки, мышечных волокон, крахмала и жиров. В клиническом анализе крови определяется лейкоцитоз и ускорение СОЭ, а в случае обезвоживания – признаки гемоконцентрации (уменьшения жидкой составляющей крови). Обнаружение возбудителя осуществляется бактериологическими и вирусологическими методами. Исследуются испражнения, рвотные массы, кровь и моча. Наиболее информативна серологическая диагностика – четырехкратный прирост титра специфических антител в парных сыворотках.
Для верификации хронического гастроэнтерита проводятся дополнительные исследования ЖКТ. При эзофагогастродуоденоскопии оценивается состояние слизистой оболочки желудка и начальных отделов тонкого кишечника, проводится биопсия измененных участков слизистой для последующего гистологического анализа. Это позволяет обнаружить атрофию, метаплазию или гиперплазию. Для выявления нарушения моторики применяется антродуоденальная манометрия. Обязательно проводится внутрижелудочная pH-метрия, поскольку пониженная и повышенная кислотность требуют различного подхода к лечению. С целью выявления Helicobacter pylori осуществляется ПЦР-диагностика, дыхательный уреазный тест и морфологическое исследование биоптатов. Для оценки состояния печени и поджелудочной железы выполняется УЗИ органов брюшной полости.
Лечение гастроэнтерита
При остром процессе лечение может проводиться в амбулаторных условиях или в инфекционном стационаре, при хроническом – в отделении гастроэнтерологии. Основой терапии при острой форме является регидратация, диетотерапия, в некоторых случаях – применение антибиотиков и вспомогательных средств. Любая степень тяжести острого инфекционного гастроэнтерита требует раннего начала оральной регидратационной терапии. Особенно это касается маленьких детей, у которых обезвоживание развивается очень быстро. Даже если признаков эксикоза нет, требуется обильное питье.
При наличии жажды, сухости кожи, снижения объема мочи применяются специальные пероральные солевые растворы. Пациент должен выпивать жидкость в объеме, превышающем потери в полтора раза. Если жажда уменьшается и увеличивается диурез, значит, дегидратация компенсируется достаточно. При значительных потерях воды и электролитов проводится инфузионная регидратация солевыми растворами.
Антибиотики в случае острого гастроэнтерита показаны только при его бактериальной этиологии (наличие слизи, гноя и крови в испражнениях, выраженной гипертермии). При вирусном поражении антибактериальная терапия противопоказана. Для уменьшения диареи и выведения токсинов назначаются энтеросорбенты: активированный уголь, диоктаэдрический смектит, полифепан и другие. С целью нормализации кишечной флоры применяются пробиотики и эубиотики.
Лечение хронического гастроэнтерита определяется его формой. В случае повышенной кислотности применяются антациды, ингибиторы протонной помпы. Обнаружение хеликобактерий требует обязательного проведения специфической терапии: назначаются антибиотики, препараты висмута и ингибиторы протонного насоса. При сниженной кислотности используется натуральный желудочный сок, ферментативные и репаративные препараты. Обязательно проводится восстановление микрофлоры кишечника. При выраженном болевом синдроме, особенно с явлениями солярита, эффективна физиотерапия: электрофорез с анестетиками, магнитотерапия.
При острой и хронической форме болезни обязательно соблюдение диеты. Пища должна быть химически и механически щадящей, исключаются экстрактивные вещества, жирные и острые блюда. С целью снижения риска рецидивирования пациентам рекомендуется исключить курение, употребление алкоголя, кофе и газированных напитков. В период ремиссии проводится санаторно-курортное лечение. Терапия гастроэнтерита не должна проводиться больными самостоятельно – нерациональное применение симптоматических средств только уменьшает проявления, но не приводит к излечению.
Прогноз и профилактика
При своевременном лечении, соблюдении диеты прогноз благоприятный. В то же время самостоятельное лечение острого гастроэнтерита может привести к хронизации процесса. При наличии факторов риска (возраст до 6 месяцев и после 65 лет, сопутствующие почечные, сердечно-сосудистые и неврологические заболевания, сахарный диабет, онкологическая патология) острая патология может протекать в тяжелой форме, при этом летальность достаточно высокая.
При хроническом гастроэнтерите обязательна диспансеризация и регулярное обследование. врачом-гастроэнтерологом. Профилактические меры включают соблюдение личной гигиены (мытье рук после посещения санузлов и перед приемом пищи), тщательное промывание употребляемых в сыром виде овощей, зелени, достаточная термическая обработка продуктов, детальное обследование работников пищевой промышленности с отстранением от производства при выявлении острого инфекционного процесса.
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо). Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гаст
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо).
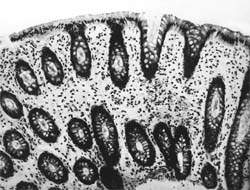 |
| Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимально выраженный катаральный колит. х 100. |
Ротавирусы представляют собой род семейства Reoviridae, который объединяет большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих гастроэнтерит у человека, млекопитающих и птиц. Систематическое изучение ротавирусов человека началось с 1973 года, когда они были обнаружены при электронной микроскопии ультратонких срезов биоптатов слизистой оболочки двенадцатиперстной кишки, полученных от больных острым гастроэнтеритом детей Австралии (Р. Бишоп и соавторы). В том же году Т. Флеветт обнаружил сходный вирус в копрофильтратах больных гастроэнтеритом методом электронной микроскопии при негативном контрастировании препаратов.
Вирусные частицы имеют диаметр от 65 до 75 нм. При проникновении контрастирующего вещества в вирион выявляется электронно-плотный центр диаметром 38 — 40 нм, который представляет собой так называемую сердцевину, окруженную электронно-прозрачным слоем. Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободом, поэтому их стали называть ротавирусами (лат. rota — колесо).
Ротавирусы имеют две белковые оболочки — наружный и внутренний капсиды. Сердцевина содержит внутренние белки и генетический материал, представленный двунитчатой фрагментированной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, которые могут быть разделены при электрофорезе в полиакриламидном геле (ПААГ) или агарозе. В составе ротавирусов обнаружено четыре антигена; основной из них — это групповой антиген, обусловленный белком внутреннего капсида. С учетом группоспецифических антигенов все ротавирусы делятся на пять групп: A, B, C, D, E. Ротавирусы одной группы имеют общий групповой антиген, который выявляется иммунологическими реакциями: иммуноферментный анализ, иммунофлюоресценция, иммунная электронная микроскопия и др. Большинство ротавирусов человека и животных относятся к группе A.
| Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями |
Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями. Вирусы в фекалиях заболевших появляются одновременно с развитием клинических симптомов, наибольшая концентрация их в кале (до 109 — 1011 вирусных частиц в 1 г) регистрируется в первые 3 — 5 дней болезни. В эти дни больные представляют наибольшую эпидемиологическую опасность для лиц, контактирующих с ними. Наиболее частым источником заболевания для детей первого года жизни являются инфицированные ротавирусом матери; для взрослых и детей более старшего возраста — дети, в основном из детских коллективов. Возможность заражения человека от животных не доказана.
Патогенез ротавирусной инфекции характеризуется проникновением вируса в эпителиоциты слизистой оболочки желудочно-кишечного тракта, преимущественно тонкой кишки, что приводит к их повреждению и отторжению от ворсинок. Вследствие этого на ворсинках тонкой кишки появляются функционально и структурно незрелые энтроциты с низкой способностью синтезировать пищеварительные ферменты. При ротавирусном гастроэнтерите это проявляется снижением уровня дисахаридаз, развивается вторичная дисахаридазная недостаточность, при которой в просвете тонкой кишки накапливаются нерасщепленные дисахариды, что создает повышенное осмотическое давление и приводит к выводу в просвет кишечника воды и электролитов из тканей организма. Это является основной причиной диареи и дегидратации и определяет основные клинические проявления болезни.
Ротавирусный гастроэнтерит как инфекционное заболевание имеет циклическое течение. Инкубационный период продолжается чаще всего от 12 — 24 часов до двух суток. Клиническая картина ротавирусного гастроэнтерита характеризуется в основном острым началом, однако в ряде случаев может иметь место продромальный период длительности от 12 до 48 — 72 часов. В этот период больные отмечают недомогание, общую слабость, повышенную утомляемость, снижение аппетита, головную боль, познабливание, урчание и неприятные ощущения в животе, умеренно выраженные катаральные явления: заложенность носа, першение в горле, легкий кашель.
В клинической картине ротавирусного гастроэнтерита в период развернутых клинических проявлений ведущими являются синдромы гастроэнтерита и интоксикации. Выраженность диареи и обусловленной ею той или иной степени дегидратации организма, а также токсикоза, продолжительность этих симптомов в значительной мере определяет тяжесть течения заболевания.
Синдром гастроэнтерита характеризуется развитием диареи, снижением аппетита, появлением урчания и болей в животе, тошноты и рвоты. Наиболее типичен для ротавирусного гастроэнтерита обильный водянистый пенистый стул желтого или желто-зеленого цвета. У больных с легким течением заболевания стул может быть кашицеобразным. Как правило, патологические примеси в стуле отсутствуют. Боль локализуется преимущественно в верхней половине живота или является диффузной, она может быть разной интенсивности. Почти всегда она сопровождается громким урчанием в животе.
Синдром интоксикации появляется в самом начале заболевания. Слабость, зачастую резкая, является наиболее частым проявлением этого синдрома; реже отмечается головная боль. При более тяжелом течении имеют место головокружение, обморочное состояние, коллапс. Обращает на себя внимание следующая особенность ротавирусного гастроэнтерита: два ведущих в клинической картине болезни синдрома развиваются в процессе заболевания не всегда однонаправленно; у некоторых больных на фоне сравнительно слабо выраженных диспепсических явлений могут наблюдаться резко выраженные симптомы общей интоксикации, особенно слабость.
Повышение температуры тела не всегда может отмечаться при ротавирусном гастроэнтерите, особенно у взрослых. У некоторых больных может быть озноб без повышения температуры. В то же время нередко в разгар заболевания выраженность лихорадочной реакции варьируется от субфебрильных цифр и выше и может достигать 38 — 39°С как у детей, так и у взрослых.
Важным в диагностическом плане для ротавирусного гастроэнтерита считается сочетание двух ведущих клинических синдромов с симптомами поражения верхних дыхательных путей. Катаральный синдром встречается приблизительно у 50% больных и проявляется в виде гиперемии и зернистости слизистых оболочек мягкого неба, небных дужек, язычка, задней стенки глотки, а также насморка, заложенности носа, кашля, болей в горле. В ряде случаев катаральные симптомы наблюдаются уже в продромальном периоде, до проявления симптомов гастроэнтерита.
В разгар болезни отмечается изменение функционального состояния сердечно-сосудистой системы, чаще у пациентов с более тяжелым течением и при наличии сопутствующих заболеваний органов кровообращения. У большинства пациентов отмечается тенденция к артериальной гипертензии, тахикардия, определяется глухость сердечных тонов при аускультации. У больных с тяжелым течением заболевания, как правило, возникают обмороки и коллапсы из-за выраженных расстройств гемоциркуляции, в генезе которых наряду с токсическими воздействиями существенное значение имеет гиповолемия. Потери жидкости и электролитов вследствие рвоты и диареи могут быть значительными и приводят к развитию дегидратации. Клинические проявления дегидратации зависят от ее степени. При легком и среднетяжелом течении ротавирусного гастроэнтерита отмечается жажда, сухость во рту, слабость, бледность (дегидратация I — II степени), при тяжелом течении наряду с этими симптомами наблюдаются также осиплость голоса, судороги мышц конечностей, акроцианоз, снижение тургора кожи, уменьшение диуреза (дегидратация III степени).
В связи с развитием при ротавирусном гастроэнтерите возможных осложнений, главным образом циркуляторных расстройств, острой сердечно-сосудистой недостаточности, нарушений гомеостаза, выделяют группы больных повышенного риска, в которые включают новорожденных, детей младшего возраста, лиц пожилого возраста, а также больных с тяжелыми сопутствующими заболеваниями. Описанные в литературе и наблюдавшиеся нами случаи ротавирусного заболевания с летальным исходом относятся именно к этим группам.
Выделяются две основные клинические формы ротавирусного заболевания — гастроэнтерическая и энтерическая. Симптомы только острого гастрита (гастритический вариант) встречаются в 3 — 10% случаев. Функциональные и морфологические нарушения со стороны желудочно-кишечного тракта, возникающие при ротавирусном гастроэнтерите в случае наличия у пациентов фоновой гастроэнтерологической патологии, нередко способствуют развитию таких осложнений основного заболевания, как обострение сопутствующих болезней: хронического гастрита, энтероколита, панкреатита, часто в сочетании с выраженными явлениями дисбактериоза кишечника, требующими коррекции при лечении.
Методы диагностики ротавирусной инфекции
При ротавирусном гастроэнтерите гемограмма изменяется следующим образом: в остром периоде заболевания с высокой частотой выявляются лейкоцитоз с нейтрофилезом и повышенная СОЭ. В периоде реконвалесценции картина крови обычно нормализуется полностью. Изменения урограммы у большинства больных имеют кратковременный характер и проявляются чаще всего небольшой протеин-, лейкоцит- и эритроцитурией; в редких случаях в моче появляются гиалиновые цилиндры в незначительном количестве. При тяжелом течении заболевания нарушения функции почек могут быть более выраженными, с повышением уровня мочевины крови, олигоурией или анурией, снижением клубочковой фильтрации. На фоне проводимой терапии указанные изменения быстро исчезают и при повторных обследованиях не отмечаются.
В качестве примера, иллюстрирующего особенности клинического течения ротавирусного гастроэнтерита, приводим выписку из истории болезни.
Лечение: обильное питье солевых растворов, парентеральная регидратационная и дезинтоксикационная терапия — трисоль 1000 мл внутривенное капельное введение, внутрь ферментные препараты: абомин, панкреатин, тансол, карболен. Течение заболевания без осложнений. На третий день болезни — субфебрильная температура, оставалась слабость; боли в животе прекратились. Стул кашицеобразный до пятого дня от начала заболевания. Полное выздоровление наступило на седьмой день болезни.
Дифференциальный диагноз у больных ротавирусным гастроэнтеритом проводят с другими острыми кишечными инфекциями как вирусной так и бактериальной этиологии, прежде всего в тех случаях, когда в клинической картине на первый план выступает синдром гастроэнтерита: с вирусными диареями различной этиологии (аденовирусы, коронавирусы, астровирусы, калицивирусы, вирус Норфолк, энтеровирусы Коксаки и ЕСНО); с гастроинтестинальной формой сальмонеллеза, с гастроэнтеритическим и гастроэнтероколитическим вариантами острой дизентерии, с пищевыми токсикоинфекциями, вызванными условно-патогенными бактериями; с холерой.
Обнаружение специфических антител и нарастание их титра в сыворотке крови больных и переболевших ротавирусным гастроэнтеритом при помощи серологических реакций с целью текущей диагностики на практике в настоящее время широкого распространения не получило и используется в основном для ретроспективного анализа различных эпидемиологических ситуаций.
Методы обнаружения вирусспецифической РНК, которые можно назвать высокочувствительными и специфичными, имеют, однако, ряд недостатков, ограничивающих их практическое применение (необходимость наличия специальной аппаратуры, реактивов, квалифицированного персонала и др.) Наиболее простой метод в этой группе — электрофорез ротавирусной РНК в полиакриламидном геле. Этот метод, позволяющий идентифицировать штаммы вирусов, вызвавшие заболевание, и дать характеристику штаммов, циркулирующих на данной территории, в основном применяется при эпидемиологических исследованиях.
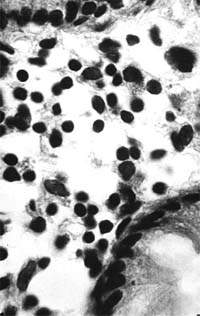 |
| Рисунок 2. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимальное содержание плазматических клеток в собственной пластинке, увеличение в ней числа макрофагов. х 400 |
В клинической практике врач нередко сталкивается с обстоятельствами (сомнительные результаты вирусологических и серологических исследований, случаи микст-инфекций), когда возникает необходимость в применении дополнительных методов для верификации диагноза. С этой целью может быть использован доступный для практического здравоохранения интрументальный метод исследования — ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки. При гистологическом, морфометрическом и гистохимическом исследованиях биоптатов при ротавирусном гастроэнтерите выявляются характерные изменения в виде поверхностного минимально выраженного катарального колита с незначительной дистрофией эпителия (рис. 1), снижения числа серотонинсодержащих желудочно-кишечных эндокриноцитов (ЕС-клетки) в эпителиальном пласте кишечных желез, умеренной инфильтрацией собственной пластинки плазматическими клетками и увеличением в ней числа макрофагов (рис. 2). Эти особенности имеют дифференциально-диагностическое значение, поскольку отличаются указанным показателем от других острых кишечных инфекций, что может быть использовано в диагностически сложных случаях.
Здравоохранение в настоящее время не располагает препаратами, обладающими специфическим антиротавирусным действием, поэтому терапия ротавирусного гастроэнтерита является патогенетической. Основные ее цели — борьба с дегидратацией, токсикозом и связанными с ними наиболее часто встречающимися при ротавирусном гастроэнтерите нарушениями функции жизненно важных органов — сердечно-сосудистой системы и органов мочевыделения, степень выраженности которых во многом определяет тяжесть течения заболевания и его прогноз.
Для правильного выбора характера и объема проводимой регидратационной терапии в первую очередь необходимо установить степень дегидратации у того или иного пациента. При эксикозе I — II степени следует ограничиваться пероральной регидратационной терапией (препараты регидрон, глюксолан и др.). При дегидратации III степени целесообразно прибегать к комбинированной парентеральной и пероральной регидратации. Для парентеральной регидратации применяют растворы трисоль, квартасоль, ацесоль и др. С целью дезинтоксикации и улучшения гемодинамики при среднетяжелом и тяжелом течении заболевания показаны коллоидные растворы (гемодез, полиглюкин и др.).
| Для ротавирусной инфекции характерно сочетание гастроэнтерита, интоксикации и симптомов поражения верхних дыхательных путей |
Современными представлениями о патогенезе диарейного синдрома при ротавирусном гастроэнтерите обусловлено и назначение соответствующих средств, способствующих нормализации состояния пищеварительного тракта, а также диеты. Учитывая нарушения активности ряда пищеварительных ферментов, в частности лактазы, рекомендуется исключить в острый период заболевания из пищевого рациона больных молоко и молочные продукты. Кроме того, по этой же причине целесообразно ограничивать и пищу, богатую углеводами. В связи с вышеизложенным, в острый период необходимы энзимные препараты (панзинорм-форте, фестал и др). Кроме того, в остром периоде заболевания могут быть использованы адсорбирующие и вяжущие средства, способствующие ускоренному формированию стула (смекта, карболен и др.) также возможно применение хилака-форте. Высокой частотой дисбактериозов кишечника различной степени выраженности у больных ротавирусным гастроэнтеритом обусловлена необходимость применения в комплексной терапии бактерийных биологических препаратов. Лучшая терапевтическая эффективность при ротавирусном гастроэнтерите отмечена при применении лактосодержащих бактерийных биологических препаратов (ацилакт, лактобактерин и др.), что, по-видимому, связано с заместительным действием бактериальной лактазы, содержащейся в лактобактериях. В последние годы в комплексной терапии ротавирусного гастроэнтерита начал применяться комплексный иммуноглобулиновый препарат (КИП), который разработан и выпускается в МНИИЭМ им. Г. Н. Габричевского. Это первый отечественный иммуноглобулиновый препарат для энтерального применения. КИП характеризуется повышенной концентрацией антител к микроорганизмам, возбудителям острых кишечных инфекций, в том числе ротавирусам, сальмонеллам, шигеллам, эшерихиям и др. Применение КИП в комплексной терапии больных ротавирусным гастроэнтеритом оказывает отчетливый положительный терапевтический эффект, существенно сокращая продолжительность интоксикации и диареи, что открывает новые возможности в лечении этого заболевания.
Литература
1. Букринская А. Г., Грачева Н. М., Васильева В. И. Ротавирусная инфекция. М., 1989.
2. Дроздов С. Г., Покровский В. И., Шекоян Л. А., Машилов В. П. и др. Ротавирусный гастроэнтерит. М., 1982.
3. Новикова А. В. и др. Архив патологии, 1989, №6.
4. Щербаков И. Т. и др. Архив патологии, 2995, №3.
5. Юшук Н. Д., Царегородцев А. Д.. Лекции по инфекционным болезням. М., 1996.
- заболевания, вызываемые неустановленным возбудителем (около 70% случаев);
- острые кишечные инфекции, вызываемые установленным возбудителем (около 20%);
- бактериальная дизентерия (около 10%).
Важно, что в наиболее обширную группу ОКИ неустановленной этиологии входят и большинство так называемых пищевых токсикоинфекций (ПТИ) — эту группу составляют приблизительно 20 этиологически разных, но патогенетически и клинически сходных заболеваний, не представляющих эпидемической опасности.
Более чем в половине случаев этиологию ОКИ не удается установить ни клинически, ни лабораторно. Эта задача, равно как и выбор патогенетического лечения, тем более не может быть решена (да и не ставится) на этапе догоспитальной помощи. Усилия врача скорой медицинской помощи (СМП) должны быть направлены на:
- коррекцию тяжелых нарушений жизненно важных функций организма больного;
- дифференцирование инфекционного, терапевтического или хирургического генеза заболевания;
- решение вопроса о необходимости госпитализации больного для специализированного лечения или проведения противоэпидемических мероприятий.
Клиническая картина ОКИ
ОКИ — заболевания различной этиологии и семиотики — объединяют общий для всех этих состояний, преимущественно фекально-оральный, способ передачи возбудителя и развитие вследствие этого характерного симптомокомплекса острой диареи (табл. 1).
ПТИ также относятся к БД, так как вызываются условно-патогенными бактериями и в ряде случаев имеют групповой, эксплозивный характер. Однако в подавляющем большинстве случаев ПТИ протекают спорадически с развитием острого гастрита, гастроэнтерита или гастроэнтероколита, с той или иной степенью обезвоживания и интоксикации и имеют благоприятный прогноз.
При диарее вирусной этиологии (ВД) целостность слизистой оболочки желудочно-кишечного тракта в большинстве случаев не нарушается и в процесс редко вовлекается толстая кишка. Инкубационный период, как правило, более короткий, чем при эпидемической БД. Острый вирусный гастроэнтерит, хотя и сопровождается лихорадкой и нарушением общего состояния больного, редко приводит к тяжелой интоксикации, развитию выраженной воспалительной реакции и дегидратации организма больного. К числу значимых дифференциальных критериев ВД можно отнести отсутствие при этих заболеваниях выраженной боли в животе, водянистый, а не слизисто-гнойный и кровавый характер испражнений. ВД нередко сопровождается острым респираторным заболеванием, особенно у детей. Продолжительность ВД редко превышает 3 дня, и в целом заболевание имеет благоприятный прогноз. Пациенты с относительно легким течением ВД в госпитализации не нуждаются.
Из ОКИ паразитарного происхождения (ПД) наибольшее клиническое значение имеют амебиаз и лямблиоз. Известно, что клиническая картина амебной дизентерии развивается приблизительно у 10% инфицированных амебой больных. Амебный колит характеризуется сильнейшей болью в животе, лихорадкой и кровавой диареей, которая чревата перфорацией толстой кишки. Генерализация амебиаза сопровождается септикопиемией с образованием абсцессов печени, легких или головного мозга и крайне неблагоприятным прогнозом для жизни больного. Заболевание носит эндемичный характер. Лямблиоз на территории России распространен очень широко и в 25-50% случаев приводит к развитию острого или хронического энтерита, сопровождающегося диареей. Наибольшую помощь в постановке доклинического диагноза при ПД может оказать тщательный сбор анамнеза настоящего заболевания и анамнеза жизни пациента, поскольку особую группу риска образуют лица, практикующие анальные сексуальные контакты.
В современной классификации ОКИ выделяют так называемые особые формы заболевания:
- диарея путешественников;
- диарея у мужчин-гомосексуалов;
- диарея у ВИЧ-инфицированных;
- антибиотико-ассоциированная диарея;
- синдром избыточного роста бактерий в желудочно-кишечном тракте.
Из особых форм ОКИ для практики врача СМП имеет значение лишь один из вариантов антибиотико-ассоциированной диареи — псевдомембранозный колит. Это заболевание развивается во время или значительно после приема антибактериальных препаратов и связано с колонизацией кишечника условно-патогенным микроорганизмом сlostridium difficile. Протекает псевдомембранозный колит с высокой лихорадкой, кровавой диареей, болью в животе и сопровождается существенной интоксикацией со всеми возможными осложнениями острой профузной диареи. При подозрении на псевдомембранозный колит больной должен быть госпитализирован в инфекционный стационар.
Доклиническая и дифференциальная диагностика ОД
Всестороннее изучение анамнеза настоящего заболевания является первым шагом в обследовании пациентов, имеющих характерные признаки ОКИ (табл. 1).
У больных необходимо выяснить:
- когда и как началось заболевание (например, внезапное или постепенное развитие заболевания, наличие инкубационного или продромального периода);
- характер испражнений (водянистые, кровянистые, с примесью слизи или гноя, жирные и т. д.);
- частоту стула, количество и болезненность испражнений;
- наличие симптомов дизентерии (лихорадка, тенезмы, примесь крови и/или гноя в испражнениях).
В беседе с больным очень важно установить наличие и, что особенно существенно, развитие субъективных и объективных проявлений обезвоживания (жажды, тахикардии, ортостатических реакций, уменьшения диуреза, вялости и нарушений сознания, судорог, снижения тургора кожи) и интоксикации (головной боли, тошноты, рвоты, мышечных болей).
На догоспитальном этапе ОКИ необходимо дифференцировать с рядом острых неинфекционных заболеваний хирургического, терапевтического, гинекологического и иного профиля. Единственной целью дифференциального диагноза в данном случае является выбор направления госпитализации больного. Основные критерии для проведения дифференциального диагноза отражены в предлагаемом нами алгоритме догоспитальной медицинской помощи (рис. 2).
Распространенность ошибочной диагностики ОКИ иллюстрируют данные DuPont H. L. (1997). Предоставленные автором данные анализа более 50 тысяч случаев госпитализации больных с ОКИ констатируют, что в 7,4% случаев этот диагноз был установлен при таких заболеваниях, как острый аппендицит, острый холецистопанкреатит, странгуляционная кишечная непроходимость, тромбоз мезентериальных сосудов, инфаркт миокарда, крупозная пневмония, декомпенсация сахарного диабета, гипертонический криз. Напротив, указанные выше заболевания были ошибочно диагностированы у больных с ОКИ в 11,1% случаев.
Догоспитальная терапия ОД
Наибольшую угрозу для пациентов с ОКИ представляет развитие дегидратации и ассоциированной с ней артериальной гипотензии на фоне интоксикации, провоцирующей падение артериального давления и нарушение функции центральной нервной системы. Объем догоспитальной терапии при ОКИ базируется на мониторинге жизненно важных функций организма больного: состоянии сознания и функции внешнего дыхания, уровне АД и гидратации пациента. При наличии соответствующего оснащения бригады СМП терапия клинически значимой гиповолемической и инфекционно-токсической артериальной гипотензии должна осуществляться под контролем центрального венозного давления. В соответствии со стандартными рекомендациями терапия на этом этапе направлена:
- на восстановление сердечного ритма;
- на оптимизацию объема циркулирующей крови;
- на устранение гипоксии и нормализацию кислотно-щелочного равновесия;
- на проведение инотропной/вазопрессорной терапии.
Для устранения гипоксии больному назначают оксигенотерапию газовой смесью с 35%-ным содержанием кислорода.
Регидратацию больного начинают с диагностики обезвоживания, тяжесть которой может варьировать от I до IV степени (табл. 2).
При дегидратации I и II степеней (85-95% больных ОКИ) восполнение потери жидкости может и должно осуществляться оральным путем. ВОЗ рекомендует применять для оральной регидратации растворы следующей прописи: 3,5 г NaCl, 2,5 г NaHCO3 (или 2,9 г цитрата натрия), 1,5 г KCl и 20 г глюкозы или ее полимеров (например, 40 г сахарозы, или 4 столовые ложки сахара, или 50-60 г вареного риса, кукурузы, сорго, проса, пшеницы или картофеля) на 1 л воды. Это позволяет получить раствор, содержащий приблизительно 90 ммоль Na, 20 ммоль K, 80 ммоль Cl, 30 ммоль HCO3 и 111 ммоль глюкозы. Можно с успехом использовать любой из готовых растворов для оральной регидратации (цитроглюкосалан, регидрон, гастролит). Количество выпитой жидкости должно в 1,5 раза превышать ее потери с испражнениями и мочой. Компенсация обезвоживания сопровождается очевидным уменьшением жажды, нормализацией диуреза и улучшением общего состояния больного.
Дегидратация III и IV степеней, выраженная тошнота или рвота, а также бессознательное состояние больного требуют неотложной инфузионной терапии. Для внутривенной регидратации используют полиионные кристаллоидные растворы: трисоль, квартасоль, хлосоль, ацесоль. Менее эффективно введение моноионных растворов (физиологического раствора хлорида натрия, 5%-ного раствора глюкозы), а также несбалансированных полиионных растворов (раствора Рингера, мафусола, лактасола). Коллоидные растворы (гемодез, реополиглюкин, рефортан) вводят только в случаях упорной гипотонии, после восстановления объема циркулирующей крови в целом. В тяжелых случаях инфузия водно-электролитных смесей начинается с объемной скоростью 70-90 мл/мин, при средней тяжести состояния больного — с объемной скоростью 60-80 мл/мин. В ряде случаев необходимая скорость инфузии обеспечивается путем одновременного вливания в 2-3 вены. После стабилизации артериального давления скорость инфузии снижается до 10-20 мл/мин. Для предотвращения прогрессирования обезвоживания, развития гемодинамической недостаточности, отека легких, пневмонии, ДВС-синдрома и острой почечной недостаточности объем жидкости, вводимой после стабилизации состояния больного, может составлять 50-120 мл на 1 кг веса.
Назначение антибактериальной терапии среднетяжелых и тяжелых ОКИ на доклиническом этапе не только не входит в задачи врача СМП, но и категорически противопоказано, поскольку может существенно ухудшить состояние больного и затруднить лабораторную верификацию возбудителя заболевания. Возрастающая угроза инфекций, вызванных антибиотико-резистентными штаммами микроорганизмов, наличие нежелательных реакций при применении антимикробных препаратов, суперинфекция, связанная с эрадикацией нормальной микрофлоры антибактериальными средствами, и возможность индукции антибиотиками некоторых факторов вирулентности у энтеропатогенов (например, индукция фторхинолонами фага, ответственного за продукцию шигеллезного токсина), заставляют тщательно взвешивать все за и против при решении вопроса об антимикробной терапии и назначать ее только после точной диагностики возбудителя ОКИ. В связи с вышеизложенным антибактериальные препараты особенно не рекомендуются при гастроэнтеритическом варианте ОД любой степени тяжести, при легком, стертом течении колитического варианта и в период реконвалесценции при любой форме кишечного заболевания.
Эмпирическое назначение антибиотиков возможно в случае легкопротекающей и среднетяжелой ОКИ любой этиологии, а также при диарее путешественников, наиболее вероятным возбудителем которой являются энтеротоксигенные штаммы E.coli или другие бактериальные патогены. В этом случае взрослым назначают фторхинолоны, а детям — ко-тримоксазол, применение которых позволяет сократить длительность заболевания с 3-5 до 1-2 дней. Этой категории больных, как правило, не нуждающихся в госпитализации, можно рекомендовать амбулаторный прием антисептиков кишечного действия: эрцефурила, интетрикса или энтероседива в стандартных дозах в течение 5-7 дней, а также препаратов неантимикробного действия, облегчающих течение диареи (табл. 3).
Столь же опасным, как антибиотики, в отношении усугубления интоксикации является применение при ОКИ любого клинического течения сильных противодиарейных препаратов (имодиума) и противотошнотных средств (церукала, торекана).
Особое значение при ОКИ имеет коррекция микробиоценоза кишечника пробиотиками, проводимая на различных этапах лечения: в остром периоде — в целях конкурентного вытеснения патогенной микрофлоры, у реконвалесцентов — для обеспечения реабилитационных процессов. Весьма эффективно раннее, не позже второго дня болезни, назначение бифидумбактерина форте в ударных дозах (по 50 доз 3 раза каждые 2 часа в первый день лечения) с последующим приемом поддерживающих доз (30 доз в день, по показаниям — до 6 дней).
Пробиотик IV поколения бифидумбактерин форте обеспечивает высокую локальную колонизацию слизистой оболочки кишечника, элиминацию патогенной и условно-патогенной микрофлоры. Положительный клинический эффект при сальмонеллезе средней тяжести отмечен через 1-2 дня, при тяжелом течении сальмонеллеза и дизентерии — к окончанию курса. Из пробиотиков, приготовленных на основе микроорганизмов рода Bacillus, препаратом выбора является биоспорин, назначаемый по 2 дозы 2-3 раза в день в течение 5-7 дней. Препарат обладает выраженным антибактериальным, антитоксическим и иммуномодуляторным действием, индуцирует синтез эндогенного интерферона, стимулирует активность лейкоцитов крови, синтез иммуноглобулинов. При преобладании энтеритического синдрома рекомендуется энтерол, получаемый из сахаромицетов Буларди. Он назначается по 250 мг 2 раза в день в течение 5 дней. В периоде реконвалесценции наряду с традиционными патогенетическими средствами (стимуляторами репарации, общего и местного иммунного ответа) целесообразно применение препаратов облигатной флоры, оптимально — бифидумбактерина форте, оказывающего стабилизирующее влияние на микробиоценоз кишечника и гомеостатические процессы.
Несмотря на расширение возможностей по верификации возбудителя и большой выбор методов этиопатогенетической терапии, появившихся в арсенале врача за последние 20 лет, ОКИ и сегодня по-прежнему сопряжены с высокой летальностью. Так, по данным Н. Д. Ющука, при ПТИ и сальмонеллезе летальность составляет около 0,1%, а при дизентерии — 1,4%, при этом причиной 20% летальных исходов при бактериальной дизентерии и 44,4% летальных исходов при всех остальных ОКИ является инфекционно-токсический шок. Причины столь высокой летальности, вероятно, кроются в неадекватной оценке прогноза и тяжести состояния больного ОКИ и неоказании ему, в том числе по причинам недостаточного инструментального, медикаментозного и информационного обеспечения, неотложной помощи именно на догоспитальном этапе. Хочется надеяться, что предложенный нами простой алгоритм догоспитальной медицинской помощи при ОД (рис. 2) окажется небесполезным для практикующих врачей и их пациентов.
Читайте также:

