Отзывы о лечении гепатита стволовыми клетками
Обновлено: 25.04.2024
Побочные эффекты от недоказанной терапии стволовыми клетками встречаются чаще, чем можно себе представить.
Пациенты, страдающие от необратимых повреждений спинного или головного мозга, или имещие прогрессирующие неврологические заболевания, часто встречаются с крайне скудным арсеналом в методах лечения таких патологий. Этот факт делает их легкой "приманкой" для клиник, использующих терапию стволовыми клетками. Зачастую эти учреждения работают за рамками имеющихся регуляторных механизмов, действующих в медицинской среде, при этом данные методы лечения на настоящий момент практически не имеют доказательной базы, несмотря на их высокую стоимость. Многие пациенты могут платить от $25,000 до $50,000 за курс процедур по лечению рассеянного склероза или паралича, включающих физиопроцедуры и инъекции стволовых клеток.
Для полноценной оценки эффективности терапии стволовыми клетками в неврологии, исследователи из Института нейронаук Охайо провели национальный опрос в академической среде неврологов.
Результаты опроса показали, что плохие исходы в данных методах лечения встречаются намного чаще, чем можно было представить. Каждый четвертый опрошенный невролог сталкивался с осложнениями терапии стволовыми клетками: инфекции, инсульт, новообразования в спинном мозге, припадки и даже с летальными исходами. 73% неврологов заявили, что существует необходимость в большем уровне обучения пациентов.
"Терапия стволовыми клетками дает надежду многим пациентам – не только тем, у кого имеется терминальная стадия заболевания, но и тем, для кого современные методы лечения оказались неэффективными. Многие из них ищут "натуральные" способы лечения. Я провел многие часы, объясняя пациентам как работает иммунотерапия в предотвращении рецидивов рассеянного склероза или оптиконейромиелита, но когда они меня спрашивали, поможет ли им это снова ходить или видеть, мне приходилось честно отвечать "нет", – рассказывает директор отделения нейроиммунологии и нейроинфекций Гарвардского университета.
Главная цель опроса заключалась в том, чтобы установить частоту возникновения осложнений терапии стволовыми клетками, а также готовность неврологов консультировать своих пациентов по поводу этого метода лечения. Большинство врачей заинтересовано в том, чтобы настоящая клеточная терапиия вошла в реальную клиническую практику, но это потребует длительное время, а также строгих и воспроизводимых исследований.

Обзор
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
Автор
Редакторы


Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Лекарства, применяемые при ревматических болезнях
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.

Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).

Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.

Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.

Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
Блокаторы интерлейкиновых рецепторов
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].

Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.

Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].

Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).

Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.

Обзор
Слева — ладонь здорового человека; справа — ладонь человека, больного желтухой.
Автор
Редакторы

Открытие, предсказанное мифами: регенерация у рептилий
Открытие, сделанное случайно: регенерация у мышей

Рисунок 2. Этапы восстановления ткани уха у обычной лабораторной мыши (снизу) и трансформированной линии MRL (сверху).
Повседневная реальность: возможности регенерации у человека
А среди внутренних органов заслуженным лидером по регенерации является печень. Легенда о титане Прометее, у которого всего за одну ночь выклеванная печень вырастала вновь (рис. 3), имеет в себе рациональное зерно.
Получается, что, несмотря на мощный регенеративный потенциал, восстановительные способности печени имеют предел. В случаях, когда патологический процесс заходит слишком далеко, эффект от работы гепатоцитов оказывается недостаточным. Например, когда здоровая печень поражается в результате токсических или вирусных воздействий, что провоцирует разрастание соединительной ткани (фиброз). Существуют ли другие способы восстановления структуры этого жизненно важного органа без участия гепатоцитов? На этот вопрос позволяет ответить совместное исследование команды ученых из Эдинбургского университета, Массачусетского технологического института и Сколковского института науки и технологий [6].
Перспективная реальность: ускоренная регенерация печени

Рисунок 4. Регенерация печени с помощью клеток желчных протоков (выделены белым цветом).
Для того чтобы отследить регенеративные способности холангиоцитов, использовали три независимых пути:
- Моделирование холестатической болезни печени.
- Моделирование метаболического неалкогольного стеатогепатита (воспалительного процесса, связанного с чрезмерным накоплением триглицеридов в печени).
- Моделирование фиброза печени (разрастания соединительной ткани в печени при повреждении гепатоцитов).
Для изучения регенерации печени за счет не-гепатоцитов по всем трем путям визуализировали отдельные участки печени. Оказалось, что за счет холангиоцитов восстанавливается примерно 20–30% гепатоцитов, причем малые пролиферативные гепатоциты идентифицировали уже с 7 дня, а к 14 дню регенерации их количество значительно увеличивалось (рис. 4–6).

Рисунок 5. Динамика восстановления печеночной ткани с помощью холангиоцитов (на примере модели холестатической болезни печени). Звездочками показаны некротические области; стрелками обозначены области с клеточным инфильтратом.

Рисунок 6. Клетки печени мыши, трансформированной по гену ITGB1 (14 день регенерации). Визуализация с помощью красных флуоресцентных белков. 1 — стрелками показаны инвазивные клетки; 2 — пунктиром обведена область регенеративного узла.
Можно ли профилактировать рассеянный склероз (РС), какие факторы могут запустить заболевание опасна ли вакцинация от коронавируса для пациента с РС, возможна ли беременность с диагнозом рассеянный склероз – на вопросы отвечает заведующая межокружным отделением рассеянного склероза больницы Вересаева, врач-невролог Екатерина Дубченко.
Рассеянный склероз – генетическое заболевание или может развиться у любого человека?
Рассеянный склероз не является генетическим заболеванием и может возникнуть у любого человека. Факторами-провокаторами, запускающими процесс, могут стать выраженный стресс, недостаток витамина D, перенесенные герпесвирусные инфекции – в частности, цитомегаловирус или вирус Эпштейна-Барр, курение и т.п.
Возможно ли человеку, имеющему в роду близкого с рассеянным склерозом, пройти генетический тест и профилактировать болезнь?
Специфического анализа предрасположенности к рассеянному склерозу нет, поскольку эта мутация не в одном гене, а в сотнях тысяч. Исследовать все эти гены нерационально.
Основная профилактика заболевания – поддержание здорового образа жизни с адекватным уровнем физической и умственной активности, снижением уровня стресса, поддержанием уровня витамина D не ниже 35 нг/мл. Больше движения, положительных эмоций и головоломок для мозга.
Относятся ли пациенты с рассеянным склерозом к группе повышенного риска при COVID-19?
Да, пациенты входят в группу риска, особенно из числа имеющих высокую инвалидизацию. По европейским рекомендациям и по рекомендациям наших специалистов вакцинация от коронавируса является крайне желательной, даже обязательной.
Побочных эффектов вакцины за полуторагодовой период наблюдения выявлено не было, в том числе у нас в МОРСе.
Прививка не может спровоцировать обострение и привести к прогрессированию заболевания, поскольку вирусный агент, содержащийся в вакцине, не является живым или ослабленным. Будучи инактивированным, он не жизнеспособен, не может ни размножаться, ни вызвать заболевание само по себе, но при этом является иммуногенным и может активировать внутреннюю защиту организма от коронавируса.
Самая распространенная реакция на вакцину от ковида – гриппоподобный синдром.
Влияет ли рассеянный склероз на продолжительность жизни?
От рассеянного склероза не умирают, но патология влияет на качество жизни человека. Объем последствий для пациента с РС зависит от течения заболевания и от того в каком возрасте оно обнаружено. Чем раньше выявлено, тем больше у организма ресурсов для компенсации.
Опасной для жизни является высокая инвалидизация, когда человек не может себя обслуживать и не получает должного ухода. На фоне этих неблагоприятных факторов могут возникать инфекции дыхательных путей, мочевого пузыря, ротовой полости, колиты, венозные проявления…
Возможно ли вылечиться от рассеянного склероза навсегда?
Нет, нельзя. Но если человек будет соблюдать все рекомендации врачей и терапия будет эффективной, есть все шансы ввести заболевание в длительную ремиссию и сохранить удовлетворительное качество жизни.
Существует метод оценки неврологических поражений при рассеянном склерозе – шкала EDSS, где 0 баллов – полнейшее здоровье, 10 – летальный исход от РС. Прогноз благоприятный, если человек начинает эффективную и подходящую ему терапию в референсе до 3,5 баллов. При таких показателях, как правило, человека практически ничего не беспокоит, при этом невролог по итогам осмотра может зафиксировать минимальный неврологический дефицит, например, отсутствие некоторых рефлексов, сам пациент диагностировать их не сможет. При этом данные нарушения не снижают качество жизни человека, а организм (головной и спинной мозг) имеет запас прочности. Если на этом этапе начать терапию, то воспалительные процессы в мозге и атрофия не будут выраженно прогрессировать.
Можно ли лечить рассеянный склероз по ОМС?
Да, любой гражданин РФ имеет право на получение такой помощи в своем регионе по ОМС. В Москве при наличии постоянной или временной регистрации пациент с РС также может получать всю необходимую терапию, в том числе на базе городских межокружных отделений рассеянного склероза.
Что включает в себя реабилитация пациентов с рассеянным склерозом?
Реабилитация требуется всем пациентам с установленным диагнозом РС с первых дней заболевания. Это как физическая, так и психологическая работа. Она направлена на поддержание физического здоровья и предотвращения психологических проблем. Зачастую пациенты, сталкиваясь с заболеванием, не готовы к такому обременению в молодом возрасте, отчего возникают депрессии, что снижает качество жизни и может привести к прогрессированию заболевания.
В особенности важна ранняя реабилитация после выхода пациента из обострения, направленная на возращение функций поврежденных зон.
Новые пути проведения нервных импульсов помогают поддерживать функций памяти, мышления, сохранять чувствительность и подвижность.
Физкультура мозга и тела должна включать в себя различные развивающие игры, занятия йогой и пилатесом, которые помогают развивать координацию движений, устойчивость и гармонизировать работу мышц, эффект показывает иппотерапия.
Пациентам может потребоваться помощь логопеда и нейрофизиолога, уролога.
Обязательно ли при РС страдают речевые и глотательные функции?
Не обязательно. Проявление той или иной симптоматики зависит от области поражения головного или спинного мозга.
Если очаг располагается в зоне, отвечающей за бульбарные функции, то может нарушаться глотание. Нарушение речи также может иметь множество причин: от нарушения чувствительности языка до поражения речевого центра.
Правда ли, что при рассеянном склерозе может ухудшаться зрение?
При рассеянном склерозе часто поражаются черепные нервы, как правило, в первую очередь зрительные. В подавляющем большинстве случаев поражение зрительного нерва диагностируется уже в дебюте РС.
Сам по себе зрительный нерв короткий, при длительном течении заболевания происходит его постепенная атрофия, зрительные нарушения нарастают.
Как избежать поражения зрительного нерва при рассеянном склерозе?
Избежать поражения зрительного нерва совсем нельзя, это необратимый процесс. Но чем раньше человек начинает получать терапию, тем лучше прогноз: процесс атрофии можно притормозить.
Можно ли беременеть женщине, страдающей рассеянным склерозом?
Рассеянный склероз не является противопоказанием для беременности. Возможность реализоваться как мама является очень важной для каждой женщины и, безусловно, беременность, роды и материнство оказывают позитивное влияние на психологическое состояние пациентки с РС. Это благоприятно сказывается на течении заболевания в целом.
Как планировать беременность с рассеянным склерозом?
Основное условие планирования беременности – относительно стабильное состояние, при котором как минимум год не было обострений – на терапии или без нее.
В терапии РС сегодня используются в том числе препараты, разрешенные для применения в беременность. Они безопасны для женщины и плода, поскольку не проникают через плацентарный барьер.
Однако есть лекарства, на которых категорически нельзя беременеть. Поэтому в любом случае будущей маме важно проконсультироваться со своим лечащим врачом.
При планировании беременности также надо учитывать общее состояние пациентки, ее неврологический статус. При наличии выраженных нарушений двигательных и тазовых функций могут возникнуть серьезные сложности как с вынашиванием, так и в процессе родов.
Увеличение кратности визитов к неврологу на фоне беременности не требуется, посещать врача нужно при возникновении жалоб.
При условно благополучном и компенсированном течении РС женщина может рожать самостоятельно – естественным путем.

Обзор
Био+нано: мышиная эмбриональная стволовая клетка, выращиваемая на подложке, состоящей из нанотрубок
Автор
Редакторы
Генетически все клетки организма (кроме половых) идентичны друг другу , а вся разница в их строении и, следовательно, функциях (а также способности делиться и дифференцироваться) определяется режимом работы (экспрессии) генов, различающимся в клетках разных тканей. Дифференцировка клеток управляется цитокинами — химическими сигналами (молекулами), выделяемыми другими клетками.
Итак, наиболее существенными характеристиками стволовых клеток (для определённости возьмём ЭСК) являются:
Чем плохи эмбриональные стволовые клетки?
Впрочем, новый президент США Барак Обама, видимо, уже дал законодательное послабление: летом 2009 года начнутся первые испытания по применению стволовых клеток для лечения больных. Около десяти парализованных пациентов в одной из американских клиник получат спинномозговую инъекцию стволовых клеток — предшественников олигодендроцитов (один из типов клеток центральной нервной системы). Этот метод уже был опробован на лабораторных животных, и через полгода станет ясно, поможет ли он людям [3].
Недавно появились данные, что ЭСК можно получать из зародышей, не разрушая их: если от эмбриона на стадии четырёх или восьми клеток отделить один из бластомеров, то из него можно получить линию ЭСК, а зародыш тем временем продолжит развитие, по крайней мере, до стадии бластоцисты [4]. (Дальнейшее наблюдение не проводилось исходя из всё тех же этических соображений.) И хотя, очевидно, способ не повреждающего эмбрионы получения ЭСК существует — ведь описанная процедура практически ничем не отличается от изъятия одного бластомера для генетического скрининга при ЭКО, — многочисленные этические проблемы и сопротивление общественного мнения вряд ли обещают этой методике большое будущее.
Скорее всего, прогнозируемый в ближайшее десятилетие прорыв в передовой медицине, связанный со стволовыми клетками, будет основан не на ЭСК, а на так называемых индуцированных плюрипотентных стволовых клетках (ИПСК, от Induced Pluripotent Stem Cell) — обычных дифференцированных зрелых клетках, перепрограммированных в состояние плюрипотентности.
Сюрпризы стволовых клеток
Транскрипционные факторы и гены, участвующие в работе стволовых клеток
Oct3/4 (Octamer-binding transcription factor 4) — белковый транскрипционный фактор (ТФ) семейства гомеобокс, играющий ключевую роль в раннем эмбриональном развитии. Необходим для поддержания плюрипотентности стволовых клеток. Нарушение его работы приводит к тому, что на стадии бластоцисты не формируется эмбриобласт, а это ведёт к ранней летальности. Во взрослом организме этот ген практически неактивен, за исключением некоторых стволовых популяций и опухолевых клеток.
Sox2 (SRY [sex determining region Y]-box 2) — белковый ТФ семейства SOX, связывающийся с малой бороздкой ДНК и также играющий решающую роль в раннем эмбриональном развитии и самоподдержании популяции СК. Мутация этого гена приводит к врождённым порокам развития, таким как отсутствие одного или обоих глаз.
Klf-4 (Krüppel—like factor 4) — ТФ семейства, названного так из-за гомологии с регуляторным белком дрозофилы Krüppel. В зависимости от обстановки, Klf-4 может быть как активатором, так и супрессором генов; он экспрессируется в дифференцирующихся клетках эпителия и при сосудистых поражениях.
Lin28 — ещё один маркер активности стволовых клеток — мРНК-связывающий и микро-РНК регулируемый белок, способный селективно усиливать трансляцию мРНК. В частности, при его участии проходит синтез инсулиноподобного фактора роста (IGF2), очень важного в эмбриональном развитии и в формировании мышц. Активность гена наблюдается в эмбриональных тканях, стволовых клетках и мышцах и миокарде во взрослом организме.
Строго говоря, первой была не эта их статья, но именно она отмечена в Science.
Гистоновый код и метилирование ДНК
Дополнительным источником мутаций может служить интеграция генетического материала в ДНК человеческих клеток (путём рекомбинации с хромосомами), и, скорее всего, пока не будет найден способ перепрограммировать клетки без трансфекции — только за счёт разовой обработки набором каких-либо факторов — использование таких СК в медицине будет очень ограничено.
Обойдёмся без онкогенов
Учёные хорошо понимают, что успех разрабатываемых ими технологий перепрограммирования соматических клеток в стволовые зависит от того, насколько безопасным будет их применение. В первую очередь опасения тут касаются, конечно, онкогенного действия генов c-Myc и Klf4, и необходимости что-то встраивать в геном клетки, от которой в дальнейшем будет зависеть жизнь человека.
Стволовые клетки из вóлоса
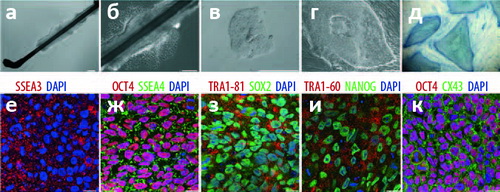
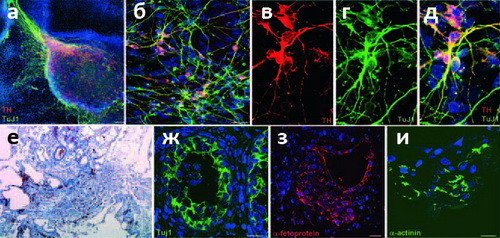
Рисунок 2. КиПС клетки дифференцируются в ткани всех трёх зародышевых листков как in vitro, так и in vivo. а — Дифференциация в среде стромальных клеток линии PA6 при добавлении фактора роста фибробластов FGF-8 и гомолога белка Sonic Hedgehog (SHH) приводит к образованию дофаминергических нейронов с типичной морфологией и экспрессией маркера нервной ткани TuJ1 (зелёный) и маркера дофаминергических нейронов тирозингидроксилазы (красный). б–д — Примеры дифференциации по этому типу. е–и — Спонтанную дифференциацию сразу во все три зародышевых листка удаётся наблюдать на срезах тератом (опухолей, образующихся у мышей с генетически ослабленным иммунитетом при инъекции стволовых клеток) при окраске по принятым в гистологии гемотоксилину/эозину (е) или иммуногистохимическим способом. Флуоресцентное мечение на TuJ1 (ж), α-фетопротеин (з) и α-актинин (и) позволяет идентифицировать эктодерму, эндодерму и мезодерму, соответственно.
Стволовые клетки без трансфекции
Пока что эффективность подобного перепрограммирования, опять-таки, существенно ниже, чем при использовании ретровирусов, да и сам принцип был продемонстрирован не на клетках взрослого человека, а на эмбриональных фибробластах мыши. Однако первый недостаток, возможно, связан всего лишь с более низким уровнем экспрессии генов с плазмиды, чем с встроенного в хромосому фрагмента ДНК, — и в этом случае наверняка удастся найти выход путём оптимизации протокола обработки клеток. А в том, что и на человеческих клетках удастся сделать то же самое — уже и сомневаться не приходится.
Заключение
Стволовые клетки найдут применение и в области тестирования лекарств и других биологических препаратов, позволяя быстро и эффективно исследовать влияние различных веществ на клетки различных типов, предсказывая тем самым спектр активности будущего препарата в разных тканях и органах.
Читайте также:

