Панкреатит с токсическим гепатитом
Обновлено: 22.04.2024
Наличие хронического гепатита С (ХГС) и ВИЧ-инфекции одновременно ассоциируется со значительной частотой неблагоприятных исходов вследствие развития цирроза и/или первичного рака печени, а также общностью эпидемиологических, социальных и экономических факторов. При сочетании этих инфекций отмечаются более высокий титр вируса гепатита С, выраженное прогрессирование хронического гепатита и высокий риск цирроза печени. При этом цирроз печени развивается быстрее и в 3 раза чаще у ВИЧ-инфицированных, чем у больных моноинфекцией гепатита С.
Цель исследования: выявить клинические и лабораторные особенности больных ХГС и ВИЧ-инфекцией.
Материал и методы: в исследование включены 173 пациента с ХГС и ВИЧ-инфекцией. Стандартную терапию ХГС (пегилированный интерферон альфа-2а + рибавирин) получали 45 больных, антиретровирусную терапию — 29. Чаще определялся генотип 1 вируса гепатита С (91 пациент, 52,6%). ХГС преобладал у пациентов мужского пола (в группе 1 — 64,3%, в группе 2 — 71,1%) и в наиболее трудоспособном возрасте от 20 до 30 лет (в группе 1 — 68,8%, в группе 2 — 80%).
Результаты исследования: среди больных, поступивших в стационар, 55,5% имели смешанную форму гепатита (ХГС + токсический гепатит) и у 17,2% выявлен цирроз печени. У 22,6% больных противовирусная терапия была отменена вследствие развития побочных реакций или неэффективности. Значительное количество пациентов до поступления в стационар злоупотребляли алкоголем (54,7%), наркотиками (25,8%), имели хронические заболевания: панкреатит, бронхит.
Заключение: среди пациентов с ХГС и ВИЧ-инфекцией, поступающих в стационар, преобладают больные со смешанной формой гепатита (ХГС + токсический гепатит). Большинство больных не получают стандартную противовирусную терапию ХГС вследствие выраженного иммунодефицита, злоупотребления алкоголем, приема психотропных веществ или отказа от лечения.
Ключевые слова: ВИЧ-инфекция, хронический гепатит С, цирроз печени, противовирусная терапия, антиретровирусная терапия, интерферон альфа-2а, рибавирин, генотип, оппортунистические инфекции.
Для цитирования: Сундуков А.В., Мельников Л.В., Евдокимов Е.Ю. Характеристика больных хроническим гепатитом С и ВИЧ-инфекцией. РМЖ. Медицинское обозрение. 2018;2(7(II)):64-67.
A.V. Sundukov 1 , L.V. Melnikov 2 , E.Yu. Evdokimov 3
1 Evdokimov Moscow State University of Medicine and Dentistry
2 Penza State University
3 Central Research Institute of Epidemiology, Moscow
The presence of HIV infection together with chronic hepatitis C (CHC) is associated with a significant incidence of an adverse events due to the development of cirrhosis and/or primary liver cancer, as well as a similarity of epidemiological, social and economic factors. In the case of these infections, there is a higher titer of hepatitis C virus, significant progression of chronic hepatitis and a high risk of the liver cirrhosis. At the same time, liver cirrhosis develops faster and 3 times more often in HIV-infected patients than in patients with hepatitis C monoinfection.
Aim: to identify the clinical and laboratory features of patients with CHC and HIV infection.
Patients and Methods: the study included 173 patients with CHC and HIV infection. 45 patients underwent standard therapy (pegylated interferon alfa-2a + ribavirin) of CHC. Antiretroviral therapy was followed by 29 patients. The 1 genotype of the hepatitis C virus was identified more frequently (91 patients, 52.6%). CHC prevailed in male patients (group 1 — 64.3%, group 2 — 71.1%) at the most working age from 20 to 30 years (group 1 — 68.8%, group 2 — 80%).
Results: among the patients admitted to the hospital, 55.5% had a mixed form of hepatitis (CHC + toxic hepatitis) and 17.2% had cirrhosis of the liver. In 22.6% of patients, antiviral therapy was canceled due to the development of adverse events or non-
response to therapy. A significant number of patients before admission to the hospital abused alcohol (54.7%), drugs (25.8%), had chronic diseases: pancreatitis, bronchitis.
Conclusion: patients with mixed hepatitis (CHC + toxic hepatitis) prevail among patients with CHC and HIV infection admitted to hospital. Most patients do not receive standard antiviral therapy for CHC due to pronounced immunodeficiency, alcohol abuse, psychotropic substances intake, or refusal of treatment.
Key words: HIV infection, chronic hepatitis C, liver cirrhosis, antiviral therapy, antiretroviral therapy, interferon alfa-2a, ribavirin, genotype, opportunistic infections.
For citation: Sundukov A.V., Melnikov L.V., Evdokimov E.Yu. Characteristics of patients with chronic hepatitis C and HIV infection // RMJ. Medical Review. 2018. № 7(II). P. 64–67.
В статье приведены характеристика больных хроническим гепатитом С и ВИЧ-инфекцией с целью определения клинических и лабораторных особенностей больных с данными заболеваниями.
Введение
Актуальность проблемы вируса иммунодефицита человека (ВИЧ) и хронического гепатита С (ХГС) определяется широким распространением этих инфекций, многообразием клинических форм, значительной частотой неблагоприятных исходов вследствие развития цирроза и/или первичного рака печени, а также общностью эпидемиологических, социальных и экономических факторов. Эпидемиологическая ситуация в России по ВИЧ и ХГС остается сложной, и в последнее время отмечается увеличение смешанной инфекции (ВИЧ/ХГС). Из 42 млн ныне живущих ВИЧ-инфицированных людей примерно у 20% (8,4 млн) диагностирован ХГС [1–3]. Как правило, у данной категории пациентов в анамнезе отмечают случаи внутривенного введения наркотиков [4].
В настоящее время более 80% всех случаев ВИЧ-инфекции приходится на потребителей инъекционных наркотиков, и в этой группе маркеры вирусного гепатита С определяются более чем у 90% больных [4–7]. Наличие ХГС и ВИЧ-инфекции одновременно ассоциируется с более высоким титром вируса гепатита С, выраженным прогрессированием хронического гепатита и возрастающим риском цирроза печени. При этом цирроз печени развивается быстрее и в 3 раза чаще у ВИЧ-инфицированных, чем у больных моноинфекцией гепатита С [4, 7, 8].
Цель настоящего исследования: выявить клинические и лабораторные особенности больных ХГС и ВИЧ-инфекцией.
Материал и методы
Работа выполнялась с 2013 по 2017 г. на базе инфекционной клинической больницы (ИКБ) № 2 Москвы и Московского городского центра по борьбе с ВИЧ/СПИД.
Всего под нашим наблюдением находилось 173 пациента с ХГС и ВИЧ-инфекцией. При постановке диагноза использовались эпидемиологические, клинические, биохимические, инструментальные методы исследования. Этиологический диагноз основывался на определении специфических серологических маркеров вирусных гепатитов и результатах молекулярно-биологических исследований с определением генотипа вируса гепатита С в лаборатории ИКБ № 2.
Стадия ВИЧ-инфекции определялась по Российской классификации ВИЧ-инфекции (В.И. Покровский, 2001 г.) [4].
В зависимости от схемы лечения все больные были разделены на 2 группы. Группа 1 включала 128 (74%) больных, которые получали только патогенетическую дезинтоксикационную терапию: раствор 5% глюкозы, солевые растворы, витамины (аскорбиновая кислота, витамины группы В), абсорбенты, гепатопротекторы. Из них 29 (22,6%) человек получали антиретровирусную терапию (АРТ): ламивудин, зидовудин, ставудин, абакавир, эфавиренз и др. Среди не получающих АРТ были пациенты, которым по иммунологическим характеристикам было показано лечение против ВИЧ-инфекции. Однако на фоне злоупотребления алкоголем у этих пациентов отмечалось обострение ХГС, в связи с чем АРТ не назначалась.
Группа 2 состояла из 45 (26%) человек — 32 (71,1%) мужчин и 13 (28,9%) женщин. Они получали стандартную противовирусную терапию (пегилированный интерферон альфа-2а + рибавирин). Пегилированный интерферон альфа-2а назначался в дозе 180 мг 1 р./нед. подкожно, рибавирин — по 800–1200 мг/кг в зависимости от массы тела. Длительность терапии составила 48 нед. Лечение в группе 2 проводилось амбулаторно, назначение АРТ не требовалось.
Статистическую обработку данных проводили с использованием MS Excel 2003 и подсчетом критерия Стьюдента (t).
Результаты исследования
Распределение пациентов в группах в зависимости от генотипа вируса гепатита С представлено на рисунках 1 и 2. Распределение по генотипам ХГС было сопоставимо, при этом генотип 1 встречался наиболее часто: у 67 (52,3%) больных в группе 1 и у 22 (48,9%) — в группе 2. У остальных пациентов в группе 1 генотип 2 встречался у 28 (21,9%) человек, генотип 3 — у 33 (25,8%); в группе 2 — соответственно у 9 и 14 (20,0 и 31,1%).
Большинство больных имели III (бессимптомную) или IVА стадию ВИЧ-инфекции (табл. 1): в группе 1 таких было 95 (74,2%) человек, в группе 2 — 45 (100%). В группе 2 не было больных с поздними стадиями ВИЧ-инфекции, т. к. это является абсолютным противопоказанием для назначения этиотропной терапии ХГС (интерферон + рибавирин).
Смешанную форму гепатита (ХГС + токсический гепатит) диагностировали у 71 (55,5 %) пациента. Хронический гепатит с исходом в цирроз печени отмечался в 22 случаях (17,2 %). Данные представлены на рисунке 3.
Распределение больных в зависимости от пола и возраста представлено в таблице 2.
Чаще ХГС встречался у пациентов мужского пола (в группе 1 — 64,3%, в группе 2 — 71,1%) и в наиболее трудоспособном возрасте от 20 до 30 лет (в группе 1 — 68,8%, в группе 2 — 80%).
Распределение пациентов в зависимости от сопутствующей патологии и оппортунистических инфекций представлено в таблице 3.
Как видно из представленных данных, сопутствующие заболевания встречались в обеих группах, однако, учитывая, что пациенты группы 2 лечились амбулаторно и к врачу обращались в плановом порядке, частота встречаемости сопутствующей патологии у данной группы больных была достоверно ниже. Анализ больных показал, что в группе 1 наиболее часто встречались такие заболевания, как обострение хронического панкреатита (31,3%), обострение хронического бронхита (27,3%), пневмония (19,5%). Выявлена высокая частота наркомании в обеих группах (25,8% и 13,3% соответственно). Часть больных в группе 1 не получала стандартную (этиотропную) терапию ХГС вследствие ряда объективных и субъективных факторов, которые приведены в таблице 4.
Из представленных данных видно, что чаще всего стандартная терапия не назначалась из-за злоупотребления алкоголем и/или приема психоактивных веществ, а также вследствие выраженного иммунодефицита (СД4+ лимфоциты менее 350 клеток). Также большую группу составили пациенты, которым стандартная терапия назначалась, но была отменена в результате развития побочных эффектов (16,4%) и/или неэффективности лечения (6,2%).
В качестве иллюстрации отказа от противовирусной терапии ХГС приводим собственное наблюдение.
Клинический пример
Выводы
Таким образом, в результате анализа клинических и лабораторных данных больных ХГС и ВИЧ-инфекцией можно сделать следующие выводы:
среди пациентов с ХГС и ВИЧ-инфекцией, поступающих в стационар, преобладают больные со смешанной формой гепатита (ХГС + токсический гепатит);
среди токсических причин поражения печени в абсолютном большинстве случаев отмечено злоупотребление алкоголем;
большинство пациентов имеют генотип 1 вируса гепатита С;
основные причины неназначения противовирусной терапии гепатита С: злоупотребление алкоголем, наркомания, низкий иммунный статус и отказ пациента от лечения.
Холестатический гепатит – это заболевание, в развитии которого ключевое значение имеет затруднение тока желчи, а также накопление составляющих ее компонентов в печени. Клинически болезнь проявляется зудом, дискомфортом в зоне правого подреберья, интенсивной желтухой, диспепсией, увеличением печени и появлением ксантелазм на коже. В диагностике основное значение имеют общеклиническое и биохимическое исследования крови с определением печеночных проб, УЗИ печени и желчного пузыря, сонография поджелудочной железы, МРТ органов брюшной полости. Терапия направлена на улучшение оттока желчи и нормализацию функции органа.
МКБ-10
Общие сведения
Холестатический гепатит представляет собой достаточно редкую патологию, в основе патогенеза которой лежит внутрипеченочный холестаз с ухудшением экскреторной функции клеток и повреждением протоков. Частота выявления заболевания не превышает 10% среди всех гепатитов с хроническим течением. Холестатический гепатит преимущественно встречается у людей пожилого возраста.
Несмотря на свою относительно низкую распространенность, заболевание плохо поддается лечению в связи с тем, что не всегда возможно четко установить его причину. Изучением этиологии и патогенеза, а также разработкой новых методов терапии холестатического гепатита занимается клиническая гастроэнтерология.

Причины
Данная патология может быть обусловлена внутрипеченочным или внепеченочным застоем желчи. В первом случае нарушение оттока желчи возможно как на уровне клеток печени, так и на уровне внутрипеченочных протоков. Причинами внутрипеченочного холестаза с последующим развитием гепатита может выступать:
- переход острого вирусного гепатита В, С или других типов в хроническую форму;
- поражение печени вирусами Эбштейна-Барра, герпеса, цитомегаловирусом, микоплазменная инфекция;
- прием различных препаратов, таких как аминазин, некоторые диуретики, антибиотики, анаболические стероиды, контрацептивы;
- воздействие токсинов, алкоголя, ядов;
- эндокринные заболевания.
Внепеченочный холестаз является следствием обструкции крупных протоков. В этом случае его возможными причинами служат:
- закупорка камнем общего желчного протока;
- хронический калькулезный холецистит;
- хронический панкреатит;
- рак головки поджелудочной железы и опухоли других органов гепатобилиарной системы.
На фоне холестаза в печени происходит деструкция гепатоцитов с последующим нарушением функции органа. В некоторых случаях установить причину развития заболевания не удается, что трактуется как идиопатический холестатический гепатит.
Симптомы холестатического гепатита
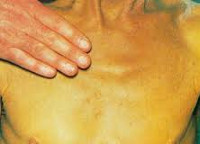
Симптоматика холестатического гепатита похожа на проявления других хронических заболеваний печени. Отличительными особенностями являются более выраженная желтуха и кожный зуд, который часто выступает первым проявлением болезни. Зуд в данном случае обусловлен попаданием в кровь желчных кислот вследствие застоя желчи в печени. Также у больных холестатической формой гепатита часто возникают ксантомы, которые имеют вид желтых пятен.
Цвет кала, как правило, становится более светлым, а моча темнеет. Пальпаторно определяется увеличение размеров и повышение плотности печени без спленомегалии. В период обострения возможно повышение температуры и неяркие симптомы интоксикации. Тяжесть клинической картины зависит от выраженности холестаза.
Диагностика
В диагностике заболевания важную роль играют лабораторные и инструментальные методы исследования. Из лабораторных методик основным для постановки диагноза холестаза считают биохимический анализ крови.
- Печеночные пробы. При биохимическом исследовании отмечается увеличение уровня билирубина за счет прямой фракции, повышение уровня трансаминаз, щелочной фосфатазы (более чем в 5 раз), гамма-глутаминтрансферазы и холестерина. Также можно определить повышенное количество в крови фосфолипидов, В-липопротеидов и желчных кислот.
- Серологическая и ПЦР-диагностика. Для подтверждения вирусной этиологии заболевания проводится исследование специфических маркеров методами ИФА и ПЦР. Характерным серологическим маркером внутрипеченочного холестаза является определение антимитохондриальных антител.
Из инструментальных методов используется эхографическая, рентгеновская, магнитно-резонансная, инвазивная диагностика:
- УЗИ печени и желчного пузыря. При ультразвуковом исследовании выявляются признаки хронического гепатита. УЗИ желчных путей, желчного пузыря и поджелудочной железы позволяет подтвердить или исключить внепеченочный холестаз.
- Рентгенография. При наличии сложностей в диагностике холестаза проводится ретроградная холангиопанкреатография, чрескожная чреспеченочная холангиография или холецистография, которые позволяют обнаружить камни в желчных путях в тех случаях, когда они не видны на УЗИ.
- МРТ. Современными неинвазивными методами выявления причин холестатического гепатита являются МР-панкреатохолангиография и МРТ гепатобилиарной зоны.
- Биопсия с гистологией. Для изучения морфологических изменений может проводиться пункционная биопсия печени, хотя она и не играет решающей роли в диагностике холестаза.
Лечение холестатического гепатита
Лечение хронического гепатита с холестатическим синдромом должно быть основано на устранении причины, которая привела к холестазу. Если причиной заболевания является воздействие токсических факторов или медикаментозных препаратов, то необходимо прекратить их поступление в организм. Всем больным рекомендуется придерживаться диеты №5, которая предусматривает исключение острой, жирной и жареной пищи. Обязательно минимизировать употребление алкоголя, который негативно влияет на клетки печени. Также рекомендовано полноценное питание с достаточным содержанием белка.
Медикаментозная терапия
На любой стадии заболевания желателен прием жирорастворимых витаминов А, Е, а также В12. Для улучшения функции гепатоцитов могут назначаться гепатопротекторы, эссенциальные фосфолипиды и липоевая кислота. При наличии внутрипеченочного холестаза с высокой активностью воспалительного процесса показано назначение небольших доз преднизолона для уменьшения выраженности патологических изменений.
Если больного беспокоит сильный зуд, необходимо применение препаратов для нейтрализации желчных кислот, таких как холестирамин или лигнин. Самым эффективным средством для лечения внутрипеченочного холестаза считается урсодезоксихолевая кислота, которая улучшает отток желчи. Препарат рекомендован всем больным с холестатическим гепатитом.
Хирургическое лечение
Если гепатит вызван внепеченочным холестазом, необходимо устранить его причину. Для этого используются различные оперативные методы:
- лапароскопическая или открытая холецистэктомия;
- резекция головки поджелудочной железы;
- экстракция конкрементов желчных протоков при РПХГ;
- эндоскопическая баллонная дилатация сфинктера Одди и др.
Прогноз и профилактика
При правильном лечении и устранении причины холестаза прогноз при холестатическом гепатите в целом благоприятный. Профилактика заболевания сводится к прекращению поступления в организм алкоголя и других гепатотоксических веществ, а также своевременному лечению патологии печени.
Токсический гепатит – поражение печени промышленными, сельскохозяйственными и бытовыми химическими веществами, гепатотропными ядами, приводящее к воспалительной реакции и некрозу гепатоцитов, изменению реактивности печени. Клинически проявляется гепатомегалией и болью в правом подреберье, желтухой, диспепсическими явлениями, энцефалопатией, асцитом, анорексией. Диагностика включает клинический и биохимический анализы крови, УЗИ, КТ либо МРТ печени и допплерометрию ее сосудов, биопсию, радиоизотопное исследование. Лечение направлено на прерывание контакта с токсическим веществом, выведение его из организма, проведение симптоматической терапии, трансплантации печени.
Общие сведения
Токсический гепатит – поражение печени острого, подострого либо хронического характера, развивающееся в результате попадания в организм токсических веществ, которые губительно воздействуют на клетки печени, вызывая их некроз. Токсическое поражение печени встречается не так уж часто – не более 1-2 случаев на 100 тысяч населения в год. Среди всех госпитализированных в отделения гастроэнтерологии в РФ токсические гепатозы, вызванные приемом гепатотропных ядов, выявляются примерно у 3% пациентов. Среди причин формирования печеночной недостаточности данная патология занимает второе место после алкогольного гепатита. Изучением гепатотоксичности различных химических веществ занимаются ведущие гепатологи, гастроэнтерологи и токсикологи всего мира.

Причины токсического гепатита
В зависимости от строения все гепатотоксичные химические вещества подразделяются на несколько групп. К первой группе относят хлорированные углеводороды – хлороформ, дихлорэтан, четыреххлористый углерод, хлористый метил, этилхлорид и другие. Эти вещества применяются в производстве автомобилей, самолетов, огнетушителей, в машиностроении, при пошиве обуви, в химчистках, для дезинфекции, дезинсекции и дегельминтизации, в качестве растворителей жиров. В организм проникают через кожу, при дыхании и употреблении внутрь. Выделяются легкими, почками, кишечником. Четыреххлористые углеводороды воздействуют на эндоплазматический ретикулум, разрушая ферментативные системы гепатоцита; усиливают переокисление ненасыщенных жирных кислот в клеточных мембранах.
Вторая группа веществ включает дифенилы и хлорированные нафталины – они используются в оболочках электропроводов, в электроконденсаторах, могут применяться в качестве аналогов воска, смолы, каучука. Третья группа состоит из бензола и его производных: анилина, толуола, тринитротолуола и др. Эти соединения в последние годы активно эксплуатируются в промышленности при производстве взрывчатых веществ, органических красок. В кровоток попадают после контакта с кожей, слизистыми оболочками, при приеме внутрь.
В четвертой группе находятся металлоиды и металлы – золото, фосфор, мышьяк, олово, ртуть, свинец. В настоящее время данные химические элементы в промышленности используются редко, производители стараются найти им более безопасную замену. Тяжелые металлы связываются с сульфгидрильными группами, блокируя активность печеночных ферментов. В отдельную группу выносят природные гепатотропные яды (ядовитые грибы, семена гелиотропа опушенного), сельскохозяйственные и бытовые инсектициды.
Все химические вещества, попадающие в организм, подвергаются разрушению либо связыванию. Основную роль в этих процессах играет печень. Некоторые вещества и их производные, образующиеся при биотрансформации, могут оказывать токсическое действие на гепатоциты. При этом гепатотоксичность может быть истинной (возникает у всех людей при введении определенной дозы вещества в организм) либо проявляться идиосинкразией (индивидуальная гиперчувствительность организма к данному соединению). Механизм действия гепатотропного яда зависит от его химического строения и дозы, однако результатом в любом случае будет разрушение клеток печени и сбой обменных процессов в ней.
Разрушающее влияние перечисленных токсических веществ значительно усиливается, если в прошлом гепатоциты подвергались воздействию больших доз алкоголя, гепатотоксичных лекарственных препаратов, вирусов и бактерий. Также токсический гепатит быстрее развивается у людей, страдающих истощением и дефицитом белка в организме.
Симптомы токсического гепатита
Для всех токсических гепатитов характерно наличие двух групп симптомов: признаков поражения непосредственно печени (желтуха, гепатомегалия, боли в правом подреберье) и признаков токсического воздействия на другие органы (зависят от химического строения отравляющего вещества).
Острое поражение четыреххлористыми углеводородами манифестирует симптомами повреждения головного мозга: угнетение сознания вплоть до комы в пределах одних-двух суток, головная боль, выраженная слабость. Затем присоединяются желтуха, тошнота, рвота, понос, повышение температуры до субфебрильных цифр, затрудненное дыхание, синюшный цвет кожи, желудочно-кишечные кровотечения. Смерть от острой печеночной недостаточности может наступить в течение нескольких дней – двух недель (в зависимости от дозы токсина). Хроническое отравление данными химическими веществами проявляется головной болью, болью в области печени, диспепсическими явлениями, слабостью. Постоянный контакт с четыреххлористыми углеводородами может привести к развитию цирроза печени на протяжении нескольких месяцев.
Для отравления производными бензола характерен токсический гепатит, которому сопутствуют апластическая анемия, поражение головного мозга, катаракта. Постоянный контакт с бензолом приводит к развитию хронического токсического гепатита, сопровождающегося геморрагическим синдромом, асцитом, циррозом печени.
Отравление мышьяком клинически проявляется желтухой, увеличением размеров печени, нарушением функции почек и периферических нервов. Для поражения фосфором, кроме симптомов токсического гепатита, характерны повышенная кровоточивость, гипогликемия. Токсический гепатит при воздействии меди развивается только в случае попадания в организм более одного грамма этого химического элемента, смерть – при превышении дозы в 10 грамм. Симптомы отравления медью – острая боль в области желудка, тошнота, рвота, профузный понос, кровотечения, уменьшение объема мочи. Смерть наступает от фульминантной почечной и печеночной недостаточности. Токсическое поражение печени железом напоминает отравление медью.
При употреблении ядовитых грибов клиническая картина токсического гепатита развивается в течение ближайших двадцати часов. Также поражаются почки, центральная нервная система. Пациенты предъявляют жалобы на желтушность кожных покровов, тошноту, рвоту, сильные боли в животе, диарею. Выраженная дегидратация и дисэлектролитемия приводят к сбоям в работе сердечно-сосудистой системы (нарушения ритма вплоть до остановки сердца) и головного мозга (судорожный синдром, угнетение сознания). Острый некроз печени приводит к прекращению ее белково-синтезирующей функции, что проявляется массивным геморрагическим синдромом. Каждый второй больной погибает от печеночной энцефалопатии, уремии, сердечно-сосудистых нарушений; у остальных формируется цирроз печени.
Употребление злаков, зараженных семенами гелиотропа, чаще всего приводит к хронической интоксикации, проявляющейся симптомами токсического поражения печени и вено-окклюзионной болезни (желтуха, гепатомегалия, боли в правом подреберье, асцит, ожирение).
При отравлении инсектицидами данные химические соединения накапливаются в жировых клетках печени и других органов, что ведет к формированию полиорганной недостаточности: токсического гепатита, миокардита, нефрита, поражения центральной нервной системы, развития агранулоцитоза. При хроническом поражении инсектицидами, помимо клинической картины токсического поражения печени, пациент отмечает появление полирадикулопатий, болей в сердце, нарушения функций почек; в анализах выявляют анемию и лейкопению. После прекращения воздействия инсектицида на организм данные патологические изменения быстро регрессируют.
Диагностика
Лабораторная диагностика токсического гепатита не позволяет выявить специфичные признаки данной патологии. Следует помнить, что у 3% здоровых людей печеночные пробы могут быть изменены, еще примерно у 5% их изменение никак не связано с поражением печени. И наоборот, примерно в 10% случаев токсического гепатита лабораторные показатели будут находиться в границах нормы. Оценка тяжести поражения печени проводится на основании исследования уровней общего билирубина и его фракций, трансаминаз, ферментов (ЩФ, ГГТП, ЛДГ), альбумина и протромбина. Для выявления некоторых гепатотоксичных веществ возможно проведение специальных лабораторных тестов. Обязательно проводят исследования на вирусные гепатиты, ВИЧ.
Из инструментальных методов в диагностике токсического гепатита используют УЗИ, КТ и МРТ печени, допплерометрию печеночных сосудов, эластографию, радиоизотопное исследование гепатобилиарной системы. Перечисленные методики не дают возможности определить этиологию гепатита, но позволят подтвердить поражение печени. Наиболее точным способом оценки морфологических изменений при токсическом гепатите является биопсия печени с последующим гистологическим исследованием биоптатов.
Токсический гепатит следует дифференцировать с поражением печени алкоголем, медикаментами, бактериями, вирусами и паразитами; с желчнокаменной болезнью, раком печени и другими опухолями данной локализации, аутоиммунным гепатитом, пороками развития печени и ЖВП, болезнями обмена веществ, острым панкреатитом, реактивным гепатитом.
Лечение токсического гепатита
Основное направление лечения токсического гепатита любой этиологии – прекращение контакта с химическим агентом, обезвреживание и быстрое выведение его из организма. При отравлении тяжелыми металлами антидотами являются унитиол, тиосульфат натрия (для ртути, мышьяка, свинца); дефероксамин (для железа); бензиламин, глюкокортикостероиды (для меди). Всем пациентам обязательно назначают витамины группы В, фолиевую, никотиновую и аскорбиновую кислоты. Если на фоне токсического гепатита развилась тяжелая печеночная и/или почечная недостаточность, проводят гемодиализ. При формировании фульминантной печеночной недостаточности может потребоваться трансплантация печени.
Прогноз и профилактика
В большинстве случаев проявления токсического гепатита регрессируют после прекращения контакта с ядовитым веществом, наступает полное выздоровление. После тяжелого токсического поражения печени с массивным некрозом гепатоцитов развивается цирроз печени, в редких случаях – рак печени.
Профилактика токсического гепатита заключается в строгом соблюдении техники безопасности при контакте с токсичными веществами, проведении регулярных медицинских осмотров всего контингента контактирующих с токсинами рабочих (для своевременного выявления лиц с патологией печени и недопущения их к работе с токсическими химическими соединениями), налаживании здорового питания с достаточным количеством белка, борьбе с алкоголизмом.
Панкреонекроз – деструктивное заболевание поджелудочной железы, являющееся осложнением острого панкреатита и приводящее к развитию полиорганной недостаточности. К проявлениям панкреонекроза относят острую опоясывающую боль в животе, упорную рвоту, тахикардию и энцефалопатию. Лабораторная диагностика предполагает определение уровня альфа-амилазы; инструментальная – проведение обзорной рентгенографии брюшной полости, УЗИ, КТ и МРТ поджелудочной железы, РХПГ, диагностической лапароскопии. Лечение включает в себя консервативные мероприятия (угнетение протеолитических ферментов, восстановление оттока соков поджелудочной железы, дезинтоксикацию и обезболивание) и оперативное вмешательство.
МКБ-10

Общие сведения
Панкреонекроз является наиболее тяжелым осложнением панкреатита, поражает в основном молодых трудоспособных людей, составляет 1% всех случаев острого живота. В основе патогенеза панкреонекроза лежит сбой механизмов внутренней защиты поджелудочной железы от разрушающего действия панкреатических ферментов.
В последнее время в России увеличивается количество острых панкреатитов – данная патология выходит на второе место после острого аппендицита в хирургических стационарах. Также растет и число деструктивных форм панкреатита, в частности панкреонекроза - до 20-25%. В разных клиниках летальность при деструкции поджелудочной железы достигает 30-80%. Ведущий способ снижения летальности при некрозе поджелудочной железы – своевременная диагностика, госпитализация и раннее начало патогенетического лечения.
Причины панкреонекроза
Причинами развития, как панкреатита, так и панкреонекроза, обычно являются нарушения диеты и эпизодический прием алкоголя. Исследования в области гастроэнтерологии показали, что панкреонекрозами обычно страдают люди, не склонные к постоянному употреблению алкоголя. Тем не менее, в подавляющем большинстве случаев началу панкреонекроза предшествует эпизод употребления спиртного в больших количествах. У пациентов, страдающих хроническим алкоголизмом, практически всегда развивается хронический панкреатит, редко осложняющийся панкреонекрозом. Первые признаки заболевания могут появиться спустя часы или сутки после действия провоцирующих факторов.
Патогенез
В основе патогенеза панкреонекроза лежит нарушение местных защитных механизмов поджелудочной железы. Обильный прием пищи и алкоголя приводит к значительному усилению внешней секреции, перерастяжению протоков поджелудочной железы, нарушению оттока панкреатических соков. Повышение внутрипротокового давления провоцирует отек паренхимы, разрушение ацинусов поджелудочной железы, преждевременную активацию протеолитических ферментов, которые и приводят к массивному некрозу ткани железы (самоперевариванию).
Активация липазы вызывает некроз жировых клеток, эластазы – разрушение сосудистой стенки. Активированные ферменты и продукты распада тканей, благодаря воздействию эластазы, попадают в кровоток, оказывая токсическое действие на все органы и ткани. В первую очередь страдают печень, почки, сердце, головной мозг.
Классификация
В зависимости от того, какие повреждающие механизмы лидируют в патогенезе, выделяют жировую, геморрагическую и смешанную формы панкреонекроза.
- Жировая форма. Если преобладает повышение активности липазы, происходит разрушение жировой ткани поджелудочной железы. Липаза попадает за пределы панкреатической капсулы, вызывая появление очагов некроза в большом и малом сальнике, листках брюшины, брыжейке, внутренних органах. Жировая форма панкреонекроза обычно оканчивается развитием тяжелейшего химического асептического перитонита, полиорганной недостаточности.
- Геморрагическая форма. В случае же преобладания микроциркуляторных нарушений развивается спазм сосудов поджелудочной железы, приводящий к быстрому нарастанию отека паренхимы. В течение нескольких часов или дней токсемия постепенно приводит к парезу сосудистой стенки, расширению сосудов и замедлению кровотока в тканях железы. Все это способствует повышенному тромбообразованию, а в дальнейшем – развитию ишемического некроза. Активация эластазы вызывает разрушение сосудистой стенки сначала в толще поджелудочной железы, затем и в других органах. В конечном итоге это ведет к геморрагическому пропитыванию панкреас, кровоизлияниям во внутренние органы и забрюшинную клетчатку. Признаком геморрагического панкреонекроза является выпот в брюшную полость с примесью крови.
- Смешанная форма. Если активность эластазы и липазы находятся примерно на одном уровне, развивается смешанная форма панкреонекроза. В этом случае явления жирового некроза и геморрагической имбибиции выражены одинаковы. При панкреонекрозе также значительно повышается уровень альфа-амилазы, однако в патогенезе этот факт не играет никакой роли. Измерение уровня амилазы имеет только клиническое значение.
Симптомы панкреонекроза
Развитие клиники панкреонекроза происходит в три этапа. Этому состоянию может предшествовать гнойный панкреатит, острый алкогольный панкреатит, билиарный панкреатит, геморрагический панкреатит. На первом этапе активное размножение бактерий в поджелудочной железе вызывает выраженную токсинемию и усиление панкреатической ферментативной активности. Пациента беспокоят лихорадка, рвота, неустойчивость стула. На втором этапе заболевания происходит гнойное и ферментативное расплавление тканей железы с формированием одной или нескольких каверн. На последней стадии воспалительный процесс распространяется на окружающие ткани, приводя к полиорганной недостаточности и смерти больного.
Заболевание имеет острое начало, обычно пациенты четко связывают появление первых симптомов с погрешностями в диете и приемом алкоголя. Около 70% больных поступают в стационар в состоянии сильного алкогольного опьянения, что говорит об очень быстром развитии патологических изменений в поджелудочной железе.
Первым симптомом обычно выступает острая опоясывающая боль, иррадиирующая в левую половину живота и поясницы, левое плечо. Безболевых форм панкреонекроза не бывает. Между выраженностью болевого синдрома и тяжестью некроза поджелудочной железы существует прямая зависимость. Распространение деструктивных изменений на нервные окончания приводит к постепенному уменьшению болевого синдрома, в сочетании с сохраняющейся интоксикацией это является плохим прогностическим признаком.
Через некоторое время после появления боли развивается неукротимая рвота, не связанная с приемом пищи и не приносящая облегчения. В рвотных массах содержится желчь, сгустки крови. Из-за рвоты развивается дегидратация, проявляющаяся сухостью кожи и слизистых, язык обложен, постепенно снижается темп диуреза. Развивается метеоризм кишечника, перистальтика ослаблена, отмечается задержка газов и стула. Интоксикация и дегидратация сопровождаются лихорадкой.
Токсемия, колебания уровня глюкозы в крови, гиперферментемия приводят к поражению головного мозга и развитию энцефалопатии, которая выражается спутанностью сознания, возбуждением, дезориентацией, вплоть до развития комы (примерно у трети пациентов).
Прогрессирование воспалительного процесса приводит к значительному увеличению поджелудочной железы в размерах, формированию инфильтрата в брюшной полости. Уже к пятым суткам от начала заболевания инфильтрат можно не только пропальпировать, но и увидеть невооруженным глазом. В проекции поджелудочной железы появляется гиперестезия кожи.
Осложнения
Указанные патологические сдвиги в организме приводят к формированию полиорганной недостаточности на фоне тяжелого токсического гепатита, нефрита, кардита, дыхательных нарушений. Панкреонекроз может осложняться шоком, перитонитом, абсцессом брюшной полости, желудочно-кишечными кровотечениями.
Из местных осложнений часто встречаются абсцесс, киста или ложная киста поджелудочной железы, ферментная недостаточность, фиброз поджелудочной железы, флегмона забрюшинной клетчатки, язвы ЖКТ, тромбоз воротной и мезентериальных вен.
Диагностика
Осмотр пациента должен осуществляться совместно гастроэнтерологом, хирургом, реаниматологом. Наличие панкреонекроза предполагает крайнюю тяжесть состояния пациента, поэтому во всех случаях рекомендуется госпитализация в отделение интенсивной терапии. В отделении производится постоянное определение ферментов поджелудочной железы в крови и моче. Плохим прогностическим признаком является прогрессирующий рост уровня амилазы либо резкий скачок данного показателя.
При физикальном осмотре отмечается вздутие живота, на боковых поверхностях передней брюшной стенки и пояснице появляются синюшные пятна (проявление внутренних гематом, кровоизлияний в мягкие ткани). Кожные покровы землисто-бледные или желтушные, мраморные, холодные. Тахикардия, артериальная гипотония, учащенное поверхностное дыхание являются признаком тяжелой интоксикации. Диагноз подтверждается с помощью:
- Рентгенодиагностики. Обзорная рентгенография органов брюшной полости позволяет выявить косвенные признаки воспалительного процесса. Введение контрастного вещества может дать возможность визуализировать фистулы поджелудочной железы. Исследовать состояние выводящих протоков поджелудочной железы, выявить причину застоя панкреатического сока позволяет ретроградная холангиопанкреатография.
- УЗИ-диагностики.Ультрасонография поджелудочной железы и желчных путей указывает на наличие камней в желчевыводящих протоках, увеличение и изменение структуры железы, анэхогенные очаги некроза в полости живота.
- Томографической диагностики. Более детально визуализировать патологические изменения можно с помощью МРТ поджелудочной железы, МРПХГ, компьютерной томографии.
- Диагностической операции. В сложных случаях проводится диагностическая лапароскопия – наиболее точный способ визуализации и постановки диагноза, оценки состояния поджелудочной железы и окружающих тканей и органов.
Дифференциальный диагноз проводят с кишечной непроходимостью, острыми воспалительными заболеваниями аппендикса, желчного пузыря, желчной коликой, перфорацией полого органа, тромбозом мезентериальных сосудов, инфарктом миокарда, разрывом аневризмы брюшной аорты.

КТ ОБП. Панкреонекроз. Диффузный отек и нарушение структуры поджелудочной железы, отсутствие накопления контраста в ее паренхиме.
Лечение панкреонекроза
Консервативная терапия
Лечение панкреонекроза начинают с обеспечения полного покоя воспаленной поджелудочной железе. Исключаются физические нагрузки, энтеральное питание, может назначаться промывание желудка прохладными растворами. Основными направлениями лечения являются обезболивание, обезвреживание протеолитических ферментов, дезинтоксикационная терапия.
- Аналгезия. Адекватное обезболивание включает в себя введение анальгетиков (при необходимости - наркотических), спазмолитиков, рассечение капсулы поджелудочной железы, новокаиновые блокады. Уменьшение отека железы под влиянием диуретиков приводит к угасанию болевого синдрома (так как ведет к ослаблению натяжения панкреатической капсулы).
- Инфузионная терапия. Дезинтоксикация проводится большим количеством инфузионных растворов под контролем диуреза. В инфузионный раствор добавляют апротинин. Обязательно назначаются антигистаминные препараты.
- Антибиотикотерапия. С целью профилактики гнойных осложнений проводится антибактериальная терапия антибиотиками широкого спектра действия. Симптоматическое лечение включает в себя противошоковые мероприятия, восстановление функции других органов и систем.
Хирургическое лечение
Практически во всех случаях развития панкреонекроза требуется проведение хирургического лечения для восстановления оттока панкреатических соков, удаления некротических масс (некрэктомия поджелудочной железы). В первые пять суток от начала патологического процесса проводить оперативное вмешательство не рекомендуется, так как в эти сроки еще невозможно оценить уровень некроза, зато повышается риск вторичного инфицирования и послеоперационных осложнений.
На этапе гнойного воспаления в брюшной полости могут использоваться разнообразные методики (пункционные, лапароскопические, лапаротомные) восстановления оттока из протоков поджелудочной железы; устранения некротических масс, воспалительного и геморрагического экссудата; остановки внутрибрюшного кровотечения. Для улучшения состояния внутренних органов может потребоваться дренирование брюшной полости.
Прогноз и профилактика
Составление прогноза для пациентов с панкреонекрозом является очень сложной задачей, так как зависит от многих обстоятельств. Значительно ухудшается прогноз при наличии одного или нескольких из следующих факторов: возраст более пятидесяти пяти лет, лейкоцитоз более 16х10 9 /л, гипергликемия, гипокальциемия, метаболический ацидоз, артериальная гипотензия, повышение уровня мочевины, ЛДГ и АСТ, значительные потери жидкости из кровеносного русла в ткани. Наличие семи из указанных критериев обеспечивает 100% летальность пациента. Профилактика панкреонекроза заключается в своевременном обращении за медицинской помощью, раннем начале лечения, в том числе и хирургического.
Общие сведения
Панкреатит – это группа воспалительных заболеваний поджелудочной железы, которые вызывают повреждение ее тканей и могут иметь как острое, так и хроническое течение с периодами обострений и ремиссии. В отличие от печени, обладающей способностью к регенерации, повреждения тканей поджелудочной железы необратимы и приводят к постепенной утрате ее функций.

Поджелудочная железа один из жизненно важных органов нашего организма, который выполняет две отличные друг от друга функции - внутри и внешнесекреторную. Благодаря этим функциям она участвует как в механизмах усвоения глюкозы клетками организма и поддержания уровня сахара в крови, так и в процессе пищеварения. Выработка гормонов инсулина и глюкагона относится внутрисекреторной (эндокринной) функции. Внешнесекреторная функция связана с выделением пищеварительного секрета необходимого для переваривания белков, жиров и углеводов.
Несмотря на небольшие размеры, вес поджелудочной железы всего 80-100 г, она выделяет до 2-3 л пищеварительного секрета в сутки. Кроме воды и вспомогательных веществ – бикарбонатов, пищеварительный секрет содержит более 25 проферментов в неактивном виде, которые активизируются, уже попадая в кишечник. Самые известные из них – амилаза, липаза, трипсин и химотрипсин обеспечивают расщепление белков, жиров и углеводов на более мелкие составляющие. Ферменты вырабатываются в поджелудочной железе в неактивной форме для того, чтобы избежать ее повреждения. Активация ферментов внутри поджелудочной железы в силу различных причин вызывает ее повреждение, запускающее воспалительный процесс, называемый панкреатитом.
Острый панкреатит и его особенности
Острый панкреатит характеризуется резким началом и требует срочного обращения в стационар. По частоте обращения за медицинской помощью среди острых заболеваний брюшной полости находится на третьем месте после аппендицита и острого холецистита.
Причины для развития воспалительного процесса в поджелудочной железе при этом заболевании:
- употребление алкоголя в дозах превышающих нормативы ВОЗ – 55%;
- заброс желчи в панкреатические протоки при желчнокаменной болезни – 35%;
- травма поджелудочной железы – 2-4%
- аутоиммунные процессы, прием лекарственных средств, аллергические реакции, инфекционные заболевания, гормональные нарушения, другие болезни ЖКТ - 6-8%.
Приступ острого панкреатита сопровождается нестерпимой болью в верхней части живота, опоясывающей или отдающей в спину, к которой присоединяются неукротимая рвота и вздутие живота.
Предотвратить развитие острого панкреатита помогут ограничение употребления алкоголя или отказ от него и своевременное лечение желчнокаменной болезни. Сбалансированное питание снижает риск развития желчнокаменной болезни и панкреатита одновременно.
Как протекает хронический панкреатит?

В отличие от острого хронический панкреатит – это длительно развивающееся воспалительное заболевание, которое постепенно приводит к необратимым изменениям в поджелудочной железе и снижению ее функций. Течение хронического панкреатита сопровождается болевым синдромом различной интенсивности, усиливающейся при обострениях.
Выделяют следующие клинические стадии хронического панкреатита:
- Доклиническая – симптомы хронического панкреатита практически отсутствуют, но можно обнаружить изменения в поджелудочной железе с помощью инструментальных исследований.
- Начальных проявлений – появление непродолжительных болевых приступов чередующихся с длительными без болевыми периодами.
- Постоянно присутствующих симптомов – учащение болевых приступов и повышение их интенсивности, присоединение жалоб, связанных с внутри и внешнесекреторной недостаточностью.
- Выраженной внутри и внешнесекреторной недостаточности – боли в животе стихают, но усиливаются симптомы нарушения пищеварения и повышения уровня глюкозы в крови. Повышается риск развития рака поджелудочной железы.
Симптомы хронического панкреатита варьируются в зависимости от стадии заболевания и в начальной стадии могут вообще отсутствовать. К ранним его признакам относятся
Поджелудочная железа обладает большим запасом своих пищеварительных функций - 10% ее нормально функционирующих клеток могут обеспечить наш организм необходимыми для пищеварения ферментами, поэтому жалобы связанные с нарушением пищеварения присоединяются на более поздних стадиях хронического панкреатита.
Как отличить гастрит от панкреатита по симптомам?

Поджелудочная железа расположена в верхней части брюшной полости за желудком, поэтому некоторые люди могут предположить, что боль в этой части живота можно будет связать как с гастритом, так и панкреатитом. Но это совершенно не соответствует действительности.
Прежде всего, интенсивные болевые приступы не свойственны хроническому гастриту. Длительное время он вообще протекает без симптомов. При прогрессировании заболевания в некоторых случаях могут появляться неинтенсивные боли, а также ощущение дискомфорта, тяжесть и распирание в верхней части живота после еды. О том, почему гастрит не болит, смотрите в нашем видео:
В отличие от гастрита боль при панкреатите является основным симптомом и имеет высокую интенсивность и зачастую плохо поддается коррекции. Характер боли - опоясывающий или отдающий в спину.
Поэтому главное отличие панкреатита от гастрита заключается в высокой интенсивности болевых приступов и в их локализации.
Причины развития хронического воспаления поджелудочной железы
Существует целый ряд различных причин развития хронического панкреатита, которые могут объединяться и усугублять действие друг друга. Кроме того в 10-30% процентах случаев причину развития заболевания найти не удается, такой панкреатит называют идиопатическим.
Одни из самых распространенных причин развития хронического воспаления поджелудочной железы - длительное злоупотребление алкоголем и курение. Курение может быть как самостоятельным фактором риска, так и усугубляющим хроническое злоупотребление алкоголем.
Кроме алкоголя и курения панкреатит, связанный с токсическим поражением поджелудочной железы, могут вызывать употребление ряда лекарственных средств, повышенный уровень в крови триглицеридов (жиров), вызванный метаболическими нарушениями, и повышенный уровень кальция в крови при заболевании паращитовидных желез.
Достаточно часто хронический панкреатит развивается у людей страдающих желчнокаменной болезнью и имеющих другие патологии желчевыводящих путей, его называют билиарнозависимым.
Также выделяют хронический панкреатит с наследственной предрасположенностью и аутоиммунный панкреатит.
Наличие инфекционных заболеваний, например хронических гепатитов В и С может также вызывать воспаление поджелудочной железы.
Травмы поджелудочной железы, аномалии ее строения, образование в ней кальцификатов, камней и новообразований могут вызывать нарушение проходимости панкреатических протоков и оттока панкреатического секрета, приводящие к старту воспалительных процессов, вызванных активацией ферментов внутри органа.
Методы диагностики заболеваний поджелудочной железы

Первый самый простой и доступный метод проверки здоровья поджелудочной железы - УЗИ, выполненное на современном ультразвуковом аппарате опытным специалистом с оценкой структуры и размеров железы и исключением наличия в ней кист, псевдокист и других новообразований.
Также для обследования поджелудочной железы применяются:
- анализы крови, мочи и кала;
- эластрография сдвиговой волной
- компьютерная томография;
- магнитно-резонансная томография с 3D реконструкцией изображения;
- магнитно-резонансная холангиопанкреатография;
- эндосонография или эндо-УЗИ.
Можно ли вылечить хронический панкреатит?
Пока не создано лекарство для того, чтобы можно было остановить и обратить вспять процессы, происходящие в поджелудочной железе при хроническом воспалении. Поэтому лечение направлено на замедление прогрессирования заболевания и предотвращение обострений. На более поздних стадиях, когда происходит значительное снижение функций поджелудочной железы, терапия дополняется средствами для нормализации пищеварения и уровня сахара в крови. Для достижения ремиссии хронического панкреатита используются ингибиторы протонного насоса, спазмолитики, обезболивающие средства, ферментные препараты, их выбор индивидуальный и зависит от клинической картины заболевания.
Важным направлением профилактики является своевременное лечение заболеваний, приводящих к развитию хронического панкреатита.
Алкоголь и курение при хроническом панкреатите
Употребление алкоголя и курение негативно воздействуют на поджелудочную железу и способствуют ускорению развития хронического панкреатита. Даже небольшое количество алкоголя может привести к обострению уже имеющегося заболевания и развитию болевого приступа. Кроме того употребления алкоголя снижает эффективность противоболевой терапии.
Поэтому при выявлении рекомендуется полный отказ от алкоголя и курения для снижения частоты обострений и уменьшения болевого синдрома, а также для предотвращения обострений.
Как питаться при хроническом панкреатите?

Соблюдение лечебной диеты – это эффективное, доказанное научными исследованиями средство для предотвращения обострений. Существуют несколько модификаций лечебных диет для стадии обострения и ремиссии. В основе используемых диет исключение продуктов стимулирующих повышение секреции желудка и поджелудочной железы. Покой для поджелудочной железы очень важен для снижения активности воспаления. В стадии обострения используется протертый вариант диеты, а при переходе в ремиссию не протертый вариант.
При хроническом панкреатите важно обеспечивать организм достаточным количеством белка, в рацион включают 110-120 г белка в сутки, что немного превышает физиологическую норму. При этом 60% от этого количества должны составлять животные белки. В меню включают блюда из нежирного мяса, птицы, рыбы, творога и яичных белков. А вот жиры и простые углеводы напротив ограничивают.
Рацион с недостаточным количеством белков и излишком жиров может негативно влиять на состояние поджелудочной железы, вызывая ее повышенную нагрузку и вынуждая избыточно вырабатывать ферменты. А излишек сахара приводит к появлению изжоги, обострению болей, вздутию кишечника. Кроме того несбалансированное питание с избытком жиров и простых углеводов часто сочетается с повышенным уровнем триглицеридов в крови, что способствует накоплению жира в поджелудочной железе.
Тем не менее, на сегодняшний день считается, что при хроническом панкреатите следует избегать применения низкожировой диеты, так как она усугубляет дефицит жирорастворимых витаминов (витамина Д, А, Е и К), а также снижает активность ферментов (липазы) в тонкой кишке, необходимых для нормального переваривания пищи. Поэтому, содержание животных жиров должно составлять не менее 30% калорийности пищи или возможна их замена на растительные жиры.
Питание при хроническом панкреатите должно быть регулярным и дробным – 5-6 раз в день небольшими порциями. Подробнее о питании при панкреатите
Что надо знать о раке поджелудочной железы?
Люди с хроническим панкреатитом находятся в зоне риска по развитию рака поджелудочной железы. Это опасное заболевание, плохо поддающееся лечению, но выявление его на ранних стадиях может продлить жизнь.
Во многих случаях рак поджелудочной железы сложно выявить на ранних стадиях заболевания, когда его лечение может быть более успешным. Поэтому модификация той части факторов риска, которые подлежат управлению, может существенно повысить эффективность профилактики этого заболевания.
Кроме хронического панкреатита к факторам риска относятся:
- курение – повышает риск на 75% и связано с 20% выявленных случаев;
- сахарный диабет;
- ожирение – повышает риск на 47%;
- возраст более 60 лет;
- наследственная предрасположенность.
Среди возможных симптомов:
Подобно печени поджелудочная железа может накапливать избыточное количество жира, которое происходит двумя путями. Первый - это накопление жира в клетках поджелудочной железы при ожирении и метаболических нарушениях, второй – замещение ее клеток жировыми клетками при вирусных инфекциях, токсическом поражении, связанном с накоплением железа вследствие гемохроматоза, редких наследственных болезнях и нарушении проходимости панкреатических протоков. При накоплении жира в клетках процесс обратим, а при замещении ткани железы жировой тканью нет. В медицине в качестве универсального термина, характеризующего оба этих состояния, используется стеатоз, также могут быть использованы липоматоз или жировая инфильтрация поджелудочной железы.
Для диагностики стеатоза поджелудочной железы используются инструментальные исследований – УЗИ, КТ или МРТ. При ультразвуковом исследовании он может проявляться диффузным повышением эхогенности органа, изменением его контуров органа (нечеткость, неровность) и небольшим превышением размеров, а также наличием кальцификатов, кист и псведокист.
Заболевания поджелудочной железы – одно из важных направлений в гастроэнтерологии. В настоящее время продолжаются исследования по поиску новых способов раннего обнаружения таких заболеваний и маркеров для выявления предрасположенности к ним, а также лекарственных препаратов для лечения хронического панкреатита.
Важным условием сохранения здоровья поджелудочной железы является профилактика хронического панкреатита, а также выявление его на ранних стадиях. Для этого достаточно раз в год проходить УЗИ брюшной полости и посещать гастроэнтеролога даже при отсутствии жалоб.
Также вы можете узнать подробнее о профилактике хронического панкреатита в нашей статье.
Читайте также:

