Переливание плазмы при гепатите
Обновлено: 25.04.2024
Выявляемость вирусных гепатитов в контингенте доноров
Журнал: Доказательная гастроэнтерология. 2016;5(3): 10‑17
В статье представлено исследование, проведенное на основе статистических показателей заболеваемости гепатитами В и С в Москве и обнаружений маркеров данных заболеваний среди доноров. Результаты работы позволяют говорить о Службе крови как об источнике наиболее достоверных медицинских статистических данных, а также свидетельствуют об остроте проблемы парентеральных вирусных гепатитов в современном мире
Гепатиты В и С входят в группу инфекционных заболеваний вирусной этиологии с парентеральным механизмом передачи и с преимущественным поражением печени. В основном эти гепатиты протекают бессимптомно, тяжело поддаются лечению, часто переходят в хроническую форму (гепатит В в 5—10% случаев, гепатит С в 50—80%) и нередко ведут к летальному исходу. В связи с этим проблема вирусных гепатитов давно является общечеловеческой и наряду с ВИЧ-инфекцией требует самого пристального к себе внимания со стороны современной медицины [1, 2].
В задачи Служб крови всех без исключения стан мира входит обеспечение безопасности донорской крови и ее компонентов для пациентов, получающих трансфузии в клиниках. Безусловным приоритетом является обеспечение инфекционной безопасности в отношении гемотрансмиссивных инфекций, среди которых наиболее распространены вирусные гепатиты. Диагностика гепатитов В и С на современном уровне является обязательной как в России, так и за рубежом. При этом необходимо подчеркнуть, что именно в Службе крови применяются наиболее современные диагностические методики, обладающие максимальной чувствительностью. В последние несколько лет традиционная иммунологическая диагностика гепатитов В и С была дополнена молекулярно-биологическими методиками — технологиями амплификации нуклеиновых кислот (nucleic acid amplification technologies, NAT), позволяющими выявить инфекционный агент на ранней стадии до образования иммунологических маркеров [3].
В табл. 1 представлены данные Управления Роспотребнадзора по городу Москве о структуре случаев выявления парентеральных гепатитов В и С за 2013 и 2014 гг.

Таблица 1. Число случаев обнаружения различных форм вирусных гепатитов В и С по данным Управления Роспотребнадзора по Москве
Частота обнаружения гепатита С среди населения Москвы превалирует над числом обнаруженных случаев гепатита В (рис. 1). Вирусоносители гепатита В в данном случае не учитываются. Интересно также, что в клинико-морфологических формах гепатита С вирусоносительство отсутствует.

Рис. 1. Отношение числа выявленных случаев гепатита В к числу заболевших гепатитом С (без вирусоносителей).
Согласно приказу Управления Роспотребнадзора по городу Москве № 138 от 23.12.2014, все статистические показатели инфекционной заболеваемости населения, в том числе по парентеральным вирусным гепатитам, поступают из медицинских организаций и медработников учреждений иного профиля в Отдел регистрации и учета инфекционных болезней (ОРУИБ) и далее в органы государственной статистики заболеваний (ОГРЗ) и Роспотребнадзор [4]. Суммарные данные формируются из количества пациентов, обратившихся за медицинской помощью в медицинские организации, из случайных диагностических находок, а также во время очередной диспансеризации. Все случаи выявления инфекционных заболеваний Службой крови передаются также в ОРУИБ. Однако, исходя из информации Управления Роспотребнадзора (см. табл. 1), сказать с уверенностью, что данные учтены в общей статистике, нельзя.
Служба крови Департамента здравоохранения Москвы (ДЗМ) ведет работу с донорами в 17 учреждениях, расположенных по 18 географическим адресам в разных административных округах столицы (рис. 2).

Рис. 2. Структура Службы крови Департамента здравоохранения Москвы.
Согласно действующему законодательству донором может быть любой гражданин России, независимо от места его постоянной регистрации, а также иностранный гражданин, находящийся в России более 1 года на законных основаниях [7]. Единый донорский центр (ЕДЦ), находящийся на базе головного учреждения Службы крови ДЗМ — Станции переливания крови, — аккумулирует все данные о выявленных на территории Москвы инфекционных заболеваниях, получая информацию не только от учреждений Службы крови ДЗМ, но также и от иноведомственных Служб крови, работающих в столице. Кроме того, в ЕДЦ поступают данные об инфицированных от ОГРЗ и Московского городского Центра по профилактике и борьбе со СПИДом.
Другим важным преимуществом Службы крови ДЗМ является централизованное лабораторное обследование донорской крови на маркеры инфекций, которое проводят на базе Станции переливания крови.
Уникальность Службы крови ДЗМ как комплекса медицинских организаций заключается в работе с людьми, считающими себя здоровыми, либо по той или иной причине скрывающими свое заболевание, принявшими решение сдать донорскую кровь. Поэтому работа Службы крови строго регламентирована и направлена на максимальное снижение риска попадания инфицированной крови в лечебную сеть.
На втором этапе проводится медицинское освидетельствование донора, включающее определение группы крови, резус-фактора, Kell-фактора, уровня гемоглобина, анализ данных анамнеза жизни и полный физикальный врачебный осмотр [8]. Благодаря этому лица, имеющие клинические симптомы заболеваний, не допускаются к сдаче крови и направляются в медицинские организации (МО) по месту прикрепления с соответствующей направляющей документацией. При этом данные обследования на этом этапе вносятся в базу данных ЕДЦ, что сводит к минимуму риск приема такого человека в другом учреждении Службы крови.
Третьим этапом работы с донором является собственно выполнение донации (сдачи) крови или ее компонентов, во время которой в первую очередь отбираются пробы крови для лабораторного исследования. При этом если даже по техническим причинам донация окажется не выполненной и кровь не пойдет в дальнейшую переработку, образцы будут доставлены в лабораторию и исследованы с занесением результатов в базу данных ЕДЦ. В случае выявления у донора инфекции его активно вызывают в учреждение Службы крови, где он выполнил донацию, для беседы с врачом и выдачи результатов исследований и направления в медицинскую организацию по месту прикрепления на углубленное обследование. При этом данные о таком доноре не только заносятся в базу данных ЕДЦ, но и активно передаются в ОРУИБ.
Помимо определения маркеров инфекций, проводится дополнительное тестирование донорской крови на уровень активности аланинаминотрансферазы (АЛТ), которое было регламентировано приказом Министерства здравоохранения СССР № 600 в 1981 г. [9]. Повышенная активность данного фермента исходно расценивалась как возможный ранний признак инфекционной зараженности. На сегодняшний день этот вид диагностики не теряет свою актуальность как маркер гепатитов и как признак функциональной патологии печени. При показателях, превышающих норму в 2 и более раза, донора отстраняют от последующих донаций и направляют на дообследование в МО по месту прикрепления. При результатах, превышающих норму менее чем в 2 раза, донор отстраняется на 3 мес с последующей сдачей контрольных анализов. При этом все показатели определения уровня АЛТ (как нормальные, так и повышенные) заносятся в базу данных ЕДЦ.
Таким образом, Служба крови представляет собой уникальный источник информации о состоянии здоровья граждан (инфицировании в первую очередь), находящихся на территории Москвы и считающих себя здоровыми.
Цель: оценить вклад Службы крови ДЗМ в выявляемость больных парентеральными вирусными гепатитами В и С.
Материал и методы
Материалом исследования стал контингент доноров Службы крови ДЗМ за 2013—2015 гг., данные о котором получены из отчетов Службы крови.
Для идентификации инфекции проводят дискриминаторные исследования на анализаторе Tigris с помощью тест-систем на отдельные инфекции Ultrio HIV, Ultrio HCV, Ultrio HBV или на анализаторе Cobas s201 с помощью дискриминаторной тест-системы Cobas МРХ 2 TagScreen.
Исследование активности АЛТ в образцах крови проводят кинетическим методом на анализаторе Architect 8000. В норме показатели активности АЛТ до 55 МЕ/л.
Для подсчета результатов использовалась программа Microsoft Excel 2010.
Результаты
За период с 2013 по 2015 г. количество людей, ставших донорами, увеличилось почти на 10 тыс. человек (табл. 2).

Таблица 2. Число людей, ставших донорами в Службе крови ДЗМ в 2013, 2014 и 2015 гг., абс.
Согласно данным отчетов учреждений Службы крови ДЗМ показатель обнаружения маркеров парентеральных гепатитов В и С у доноров в 2013 г. составил 603 человека, затем резко снизился до 489 и в 2015 г. снова возрос до 669 человек (рис. 3). При этом в соотношении числа людей, ставших донорами, к случаям обнаружения маркеров гепатитов, наибольшее значение соответствует 2013 г., показатель обнаружения маркеров парентеральных гепатитов в 2013 г. наибольший — 0,83%. Однако, в целом, этот процент за 3 года относительно невелик и находится в интервале от 0,63 до 0,83% (табл. 3). Также обращает на себя внимание тот факт, что количество выявленных маркеров гепатита В заметно разнится с таковым по гепатиту С в сторону меньшего значения и составляет 25—28% от общего числа (табл. 4, рис. 4).

Таблица 3. Доля обнаружений в донорском контингенте Службы крови ДЗМ маркеров гепатитов В и С, % Доля доноров с маркерами гепатитов В и С, % 0,82 0,63 0,83

Таблица 4. Число выявленных маркеров гепатитов В и С в донорском контингенте Службы крови ДЗМ, распределение по виду гепатита и по годам, абс.

Рис. 3. Количество доноров Службы крови ДЗМ, у которых были обнаружены маркеры гепатитов В и С.

Рис. 4. Доля выявленных маркеров гепатитов В и С в донорском контингенте Службы крови ДЗМ.
Доноры являются случайной выборкой общего числа населения города. В связи с этим справедливо будет сопоставить долю обнаружения маркеров вирусных гепатитов В и С среди доноров Службы крови ДЗМ к доле обнаружения заболевших среди населения Москвы (табл. 6).

Таблица 6. Обнаружение маркеров гепатитов В и С среди доноров Службы крови ДЗМ и выявленные заболевания среди населения Москвы (включая вирусоносителей гепатита В), %
Из данных табл. 6 видно, что показатель обнаружения маркеров гепатитов В и С среди доноров превышает показатель выявления заболеваний гепатитами В и С среди населения Москвы в 5—8 раз.
Как известно, основными источниками распространения вируса гепатита В являются вирусоносители. Вероятность их обнаружения существенно меньше, нежели больных острой и хронической формой, в связи с полным отсутствием симптоматики и сохранением активного образа жизни. А поскольку доноры в связи с тщательным предварительным отбором состоят из клинически здоровых и активных людей, то вероятнее всего тех, у кого был обнаружен маркер вирусного гепатита В в Службе крови, можно отнести к категории вирусоносителей (табл. 7). Поскольку число доноров по годам составляло от 72 до 81 тыс. человек в год, мы сочли правильным экстраполировать эти данные на 100 тыс. населения.

Таблица 7. Число доноров Службы крови ДЗМ, у которых обнаружен маркер гепатита В
При анализе данных, представленных Управлением Роспотребнадзора по Москве, обращает на себя внимание преобладание числа обнаруженных больных хроническими формами гепатитов В и С над острыми в зависимости от года в 15 и 18 раз от общего количества. Это говорит о том, что при острых формах гепатитов обращаемость граждан за медицинской помощью в связи с жалобами и при этом правильная своевременная диагностика лечащим врачом заболевания по причинам, указанным выше, происходят довольно редко.
В соотношении обнаруженных вирусных гепатитов В к гепатитам С острых и хронических форм преобладает число гепатитов С (в 2014 г. — 81%, в 2013 г. — 78%). Такая же картина наблюдается и в донорском контингенте (в 2014 г. — 72%, в 2013 г. — 75%). Однако если в общем числе заболевших учесть вирусоносителей гепатита В среди населения Москвы, можно заметить тенденцию к выравниванию значений (табл. 8).

Таблица 8. Общее число заболевших гепатитами В и С острыми и хроническими формами в Москве с учетом и без учета вирусоносителей гепатита В, абс. (%)
Из этого следует, что число вирусоносителей настолько велико, что риск распространения гепатита В недооценен и требует в совокупности как иммунопрофилактических, так и диагностических мер предупреждения.
Учреждения Службы крови ДЗМ располагаются на территории города и рассредоточены таким образом, что охватывают весь возможный спектр населения города, а также жителей Подмосковья, являющихся донорами в Москве. Тщательный отбор доноров, осуществляемый до донации, способствует отсеву большинства возможных больных парентеральными гепатитами и вирусоносителей гепатита В. В последующем методы современной лабораторной диагностики позволяют отсеять оставшихся доноров, кровь которых может быть инфекционно небезопасна. При этом используются не только основные методы (ИФА, ИХЛА и NAT-тестирование) донорской крови, но и дополнительный, принятый только в нашей стране, скрининг уровня АЛТ.
За рубежом определение АЛТ упразднено, за что выступает и ряд специалистов в России, мотивируя отсутствием диагностической ценности в отношении гепатитов В и С. Однако, по данным исследований [12], повышенный уровень АЛТ может быть единственным обнаруженным маркером вирусных гепатитов и, как следствие, барьером для предотвращения переливания реципиенту инфицированной донорской крови. При этом, как видно из табл. 5, число доноров, предположительно зараженных вирусными гепатитами, не мало, а в расчете на численность населения города — значительно. Уровень АЛТ в крови также является показателем функционального состояния печени. Поскольку в печени синтезируется большинство факторов свертывания крови, доноры с нарушенной функцией печени не могут быть источником качественных компонентов крови.

Таблица 5. Количество исследований АЛТ, в которых результат превышает норму в 2 и более раз, среди доноров Службы крови ДЗМ
Учитывая, что Служба крови работает со срезом населения, а абсолютное число доноров составляет не менее 70 тыс. человек ежегодно, получаемые данные могут быть достоверно экстраполированы на 100 тыс. населения. При таком подходе инфицированные гепатитами составляли 626 и 827 человек на 100 тыс. населения в 2014 и 2013 гг. соответственно, что в 5 и 7 раз больше показателей Управления Роспотребнадзора по Москве.
То же можно сказать и о количестве обнаруженных вирусоносителей гепатита В. Доноры, имеющие в своем состоянии клинические либо лабораторные отклонения от нормы, до донации не допускаются. В связи с этим можно также предполагать, что те доноры, у которых были обнаружены маркеры к данному виду гепатитов, являются вирусоносителями. Их число выше статистического по Москве в 5 раз и в 2014 и в 2013 гг.
Выводы
Уже на протяжении нескольких десятилетий мировое медицинское сообщество продолжает борьбу с вирусными гепатитами. Эти усилия дают положительные результаты, в том числе и в нашей стране. Благодаря программе по всеобщей иммунизации населения мы можем говорить о значительных успехах, отразившихся в цифрах статистики: за 7 лет (2006—2013) показатель заболеваемости острым гепатитом В снижен в 23,5 раза. Но в результате анализа данных отчетов Службы крови ДЗМ, мы можем утверждать, что проблема гепатитов В и С остается актуальной и требует прогрессивных мер: иммунологических, диагностических и лечебных. Все они могут быть реализованы только в совместной работе медицинских организаций различных областей направленности. Для этого необходима не только качественная работа специалистов, но и четко отлаженная связь между медицинскими учреждениями. Служба крови ДЗМ представляет собой уникальный источник достоверной информации о состоянии здоровья населения и при взаимодействии с другими организациями может стать научно-практической базой московского здравоохранения.
Селективная плазмосорбция и плазмообмен при печеночной недостаточности у больных с механической желтухой
Журнал: Анестезиология и реаниматология. 2018;(5): 91‑98
В последнее десятилетие прослеживается стойкая тенденция роста частоты заболеваний, сопровождающихся развитием внепеченочного холестаза. В ближайшие 15 лет прогнозируется рост заболеваемости органов желчевыделительной системы на 30—50% в мире. В Российской Федерации число больных механической желтухой различной этиологии ежегодно увеличивается на 800 000 человек [1].
Хирургические вмешательства у больных с механической желтухой, выполняемые по экстренным показаниям, сопровождаются большим числом осложнений, связанных с нарушением в системе гемостаза и повышенной кровоточивостью в зоне операции. Летальность достигает 15—30%, что в 4 раза выше, чем в тех случаях, когда холестаз удается ликвидировать до операции, или, по крайней мере, уменьшить его [1—6].
Клинические симптомы и общепринятые лабораторные показатели не всегда соответствуют глубине патологического процесса, поэтому продолжаются поиски объективных критериев оценки тяжести состояния больных при механической желтухе. Специализированные оценочные шкалы в отношении определенных форм печеночной недостаточности имеют статистически значимую прогностическую точность (шкала Schindl — для смешанной формы печеночной недостаточности и гепаторенального синдрома, шкала Child—Turcotte—Pugh — для определения тяжести цирроза печени, шкалы MELD и SOFA — для оценки печеночной энцефалопатии). Ни одна из предложенных шкал не обладает прогностической значимостью по отношению ко всем формам печеночной недостаточности.
В.Д. Федоров и В.А. Вишневский в 2004 г. предложили балльную классификацию печеночной недостаточности при механической желтухе (табл. 1, 2) Таблица 1. Оценка тяжести печеночной недостаточности при механической желтухе [4] Таблица 2. Степень тяжести механической желтухи и исход заболевания [4] [4]. В 2009 г. на пленуме Правления Ассоциации хирургов-гепатологов России и стран СНГ отмечено, что печеночная недостаточность при механической желтухе чаще носит скрытый характер и редко сопровождается явлениями энцефалопатии в отличие от печеночной недостаточности при циррозе печени. Тогда же Э.И. Гальперин и соавт. [2] предложили рабочую классификацию печеночной недостаточности, которая позволяет определить прогноз предстоящей операции и лечебные действия в зависимости от тяжести холестаза.
Риск хирургического вмешательства значительно снижается, если явления печеночной недостаточности купированы в дооперационном периоде [7]. Длительный анамнез желтухи с высоким уровнем билирубина приводит к тяжелой печеночной недостаточности, а ее прогрессирование в послеоперационном периоде в 50% случаев является причиной летального исхода при общей летальности 12,5% [1—8].
Основными целями применения экстракорпоральных методов гемокоррекции при печеночной недостаточности являются временное протезирование и поддержание детоксикационной функции печени, предотвращение дальнейшего развития и усугубления печеночной недостаточности, создание условий для регенерации поврежденных гепатоцитов, предупреждение и сведение к минимуму развития вторичных осложнений органов и систем [9].
В лечении больных печеночной недостаточностью используют такие методы экстракорпоральной гемокоррекции, как плазмообмен, плазмофильтрация, плазмосорбция [10]. Эффективность плазмообмена и плазмофильтрации в основном ограничена объемами удаляемых компонентов крови [10, 11]. Системы MARS (молекулярная адсорбирующая рециркулирующая система) и Prometheus (сепарация и адсорбция фракционированной плазмы, или FPSA) широко не используются в связи с высокой стоимостью расходного материала. В настоящее время перспективным направлением в экстракорпоральной гемокоррекции является применение сорбционных методов, обладающих определенной селективностью [6].
Цель исследования — провести сравнительную оценку эффективности селективной плазмосорбции и плазмообмена при печеночной недостаточности у больных с механической желтухой.
Материал и методы
Исследование проведено у 32 (15 мужчин и 17 женщин) больных с механической желтухой обструктивного генеза и длительным желтушным периодом. Средний возраст пациентов составил 57±10 лет (минимальное значение 48 лет, максимальное значение — 67 лет). Длительность желтушного периода в среднем составляла 9,1±1,5 (3—14) нед.
Основными причинами механической желтухи были желчнокаменная болезнь с холедохолитиазом и стриктура общего желчного протока (ductus choledochus) с локализацией на разных уровнях, при этом у 9 пациентов установлен диагноз острый холангит. Исходный средний уровень общего билирубина был 385,6±34,6 (285—589) мкмоль/л. Всем больным выполнены билиодигестивные вмешательства — эндоскопическая папиллосфинктеротомия и эндоскопическая литоэкстракция, либо лапаротомия, холедохолитотомия и дренирование общего желчного протока.
Степень печеночной дисфункции и тяжесть состояния оценивали по следующим параметрам: степень тяжести холестаза (уровень билирубинемии, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), желчных кислот, щелочной фосфатазы — ЩФ), степень тяжести печеночной энцефалопатии, состояние гемостаза (фибриноген, активированное частичное тромбопластиновое время (АЧТВ), международное нормализованное отношение (МНО), протромбин, антитромбин III.
Поскольку, как указано выше, ни одна из предложенных ранее шкал не обладает прогностической значимостью по отношению ко всем формам печеночной недостаточности [12], нами с целью определения прогноза заболевания использована классификация печеночной недостаточности при механической желтухе, предложенная В.Д. Федоровым и В.А. Вишневским в 2004 г. [3, 4] (см. табл. 1, 2).
Критериями исключения из исследования были: пациенты моложе 18 и старше 80 лет, выявленные у пациентов в процессе обследования и лечения злокачественные опухоли гепатопанкреатобилиарной зоны с обструкцией желчевыводящих путей.

Исходные клинико-демографические характеристики пациентов с механической желтухой представлены в табл. 3. Таблица 3. Исходная клинико-демографическая характеристика пациентов с механической желтухой Примечание. Данные представлены в виде среднего значения и стандартного отклонения (M±SD) (минимальное значение — максимальное значение), абсолютных (n) и относительных (%) величин. * — статистическая значимость различий с исходным показателем при р
Пациенты, участвующие в исследовании, разделены на две группы. 1-я группа — 18 пациентов (9 мужчин и 9 женщин), которым в качестве экстракорпоральной гемокоррекции выполняли СПС. 2-я группа — 14 пациентов (6 мужчин и 8 женщин), которым в качестве экстракорпоральной гемокоррекции выполняли П.О. Каждому пациенту выполнены по 3 процедуры СПС или ПО — по 1 процедуре перед операцией и по 2 — в раннем послеоперационном периоде.
Кровь от пациента с помощью роликового насоса поступает в плазмофильтр Plasmaflo, где происходит отделение плазмы от крови, после чего плазма проходит через сорбционную колонку Plasorba BR-350, далее соединяется с деплазмированной кровью и возвращается обратно к пациенту. Сорбент Рlasorba BR-350 состоит из самой адсорбирующей колонки и фильтра (см. рисунок).
Процесс очищения крови основан на принципе ионообмена, т. е. на замещении ионов на поверхности сорбента ионами сорбата. По виду ионообмена выделяют катиониты, аниониты и полиамфолиты. Сорбционная способность колонки Plasorba BR-350 основана на принципе анионного обмена для селективного удаления билирубина и желчных кислот из крови при печеночной недостаточности различной этиологии [13]. Действующим веществом являются дивинилбензола стирол и пропилен, покрытый этиленвиниловым спиртом сополимера. В данной системе лиганд представляет собой заряженную четвертичную соль аммония, которая позволяет селективно захватывать билирубин, имеющий отрицательный заряд на карбоксильных группах [14].
Каждому пациенту 1-й группы проведены по 3 процедуры СПС с обработкой двух объемов циркулирующей плазмы (2 ОЦП). При этом 1 сеанс проводили непосредственно за 1 день перед операцией, а 2 других — в раннем послеоперационном периоде с перерывом между процедурами 1—2 дня. Длительность процедуры варьировала от 3 ч 45 мин до 4 ч 25 мин, скорость кровотока — от 130 до 160 мл/мин. Скорость плазмотока поддерживалась на уровне 25—30 мл/мин. Антикоагуляцию проводили раствором гепарина: магистрали и фильтр промывали раствором гепарина из расчета 4000 ЕД на 2 л физиологического раствора, болюсно вводили 5000 ЕД гепарина в магистраль в начале процедуры. Для сосудистого доступа использовали двухпросветный диализный катетер, установленный в центральную вену.
Каждому пациенту 2-й группы проведено по 3 сеанса ПО с эксфузией 0,7—1 ОЦП, что в среднем составило 2976±243 мл. При этом 1 сеанс проводили непосредственно за 1 день перед операцией, а 2 других — в раннем послеоперационном периоде с перерывом между процедурами 1—2 дня. В качестве сосудистого доступа чаще всего использовали периферическую вену, в основном кубитальную, устанавливали иглу для диализа. Антикоагулянт цитрат натрия подавался автоматически с регулировкой соотношения антикоагулянт: кровь, стандартное соотношение — 1:14 — 1:16. Удаляемый объем плазмы восполняли введением 5% раствора альбумина и донорской свежезамороженной плазмы (СЗП) в соотношении 1:1. С целью снижения потерь плазменных факторов свертывания замещение начинали 5% раствором альбумина в 1-й половине процедуры, а СЗП вводили во 2-й части плазмообмена.
Для оценки эффективности СПС и ПО нами изучена динамика некоторых биохимических показателей и показателей коагулограммы в ходе процедуры (табл. 4—5). Таблица 4. Влияние селективной плазмосорбции и плазмообмена на основные биохимические показатели у пациентов с механической желтухой Примечание. Данные представлены в виде среднего значения и стандартного отклонения (M±SD), относительных (%) величин. * — статистическая значимость различий с исходным показателем при р M±SD). Попарные сравнения связанных выборок (до и после процедур) проводили парным критерием Стьюдента в программе SPSS. Различия считали статистически значимыми при р
Результаты
У пациентов обеих групп перед подключением пациента к экстракорпоральному контуру оценивали показатели гемодинамики и волемический статус. Для профилактики гемодинамических реакций проводили введение раствора хлористого натрия 0,9% 500—1000 мл или изотонического раствора стерофундина 500—1000 мл [7]. При явлениях гиповолемии проводили необходимую дополнительную инфузионную терапию. Во время проведения ПО у 10 (71,5%) пациентов в середине процедуры отмечалось снижение среднего артериального давления (САД) до 70 мм рт.ст. При проведении СПС примерно на 30—40-й минутах от начала процедуры у 12 (66,6%) пациентов отмечалось снижение САД до 65 мм рт.ст. У пациентов обеих групп гипотензия купировалась путем внутривенного введения солевых растворов и преднизолона. После окончания процедуры ни у кого из пациентов выраженных гемодинамических нарушений не отмечали.
После окончания экстракорпоральной гемокоррекции оценена тяжесть состояния пациентов по классификации В.Д. Федорова и В.А. Вишневского. К моменту окончания процедур состояние пациентов обеих групп улучшилось, что нашло отражение в балльном исчислении. Уменьшение количества баллов в каждой группе (см. табл. 3), согласно этой классификации, существенно влияет на дальнейший прогноз и исход заболевания. В этом случае летальность составляет уже не 42,9%, а 10,5% (см. табл. 1, 2), что статистически значимо.
Для оценки эффективности СПС и ПО исследовали динамику некоторых биохимических показателей. В табл. 4 показаны сравнительная характеристика и динамика биохимических показателей у пациентов исследуемых групп. Проводили забор венозной крови перед процедурой и сразу после нее. Установлено снижение уровней общего билирубина на 39,8±3,8% после проведения СПС, по сравнению с ПО, после которого снижение общего билирубина составляло 38,5±6,4%, что может расцениваться как сопоставимое снижение у пациентов обеих групп. Уровень конъюгированного билирубина после СПС снизился на 38,2±18%, после проведения ПО — на 37,2±5%, что также может быть расценено как равнозначное снижение.
Однако уровень неконъюгированного билирубина после СПС снизился на 32,5±11,9%, а после ПО — на 27,5±2,3%, что почти на 5% больше. Динамика АЛТ в виде снижения на 23,5±3,4% после СПС и снижения АЛТ на 23,4±4,1% после ПО была примерно одинаковой. АСТ снизилась после СПС на 37±2,3%, а после ПО — на 30,4±3,5%, что составляет разницу почти в 6,5% в пользу СПС. Уровень желчных кислот после СПС снизился на 31,4±2,8%, после ПО — на 30,3±5,4%; это снижение мы посчитали равнозначным.
Обращает на себя внимание снижение уровня щелочной фосфатазы после ПО на 34,2%, в то время как после СПС снижения уровня щелочной фосфатазы не происходило. По окончании процедур СПС и ПО выявлено незначительное снижение уровня общего белка и альбумина. Так, после проведения СПС уровень общего белка снизился на 2,05±0,8%, уровень альбумина — на 3,9±2,4%. После П.О. уровень снижения общего белка составлял 6,6±1%, уровень альбумина — 6,5±1,3%. Несмотря на отсутствие статистически значимого снижения уровня белка у пациентов обеих групп, снижение уровня белка у пациентов 2-й группы было более выраженным и превышало таковое у пациентов 1-й группы. Отмечен больший уровень (в 2—3 раза больше) снижения содержания общего белка и альбумина при проведении ПО, чем при СПС.
Исходный уровень электролитов плазмы у пациентов обеих групп был в пределах нормы. Процедуры СПС не оказывали влияния на уровень электролитов плазмы.
У пациентов обеих групп произведен забор крови до и после процедур для исследования показателей коагулограммы (см. табл. 5). Исходно у больных отмечены признаки гипокоагуляции. При сравнительном исследовании коагулограмм у пациентов обеих групп не отмечено существенных изменений.
После проведения ПО у 4 пациентов отмечены посттрансфузионные реакции в виде озноба, кожных высыпаний (крапивница), зуда, повышения температуры тела до 38,0 °С. Эти симптомы появились примерно через 1,5—2 ч после окончания процедуры ПО и купировались внутривенным введением антигистаминных препаратов, преднизолона и 10% раствора хлористого кальция.
По окончании процедур экстракорпоральной гемокоррекции у больных исследуемых групп происходила стабилизация гемодинамики, по-видимому, связанная с коррекцией эндотоксикоза и адекватной инфузионной терапией.
Из представленных данных видно, что использование методов экстракорпоральной гемокоррекции — СПС и ПО при печеночной недостаточности у пациентов с механической желтухой — одинаково положительно влияют на динамику биохимических показателей, эффективность ПО согласуется с данными литературы [16]. Полученные результаты позволяют нам сделать вывод о снижении уровня билирубина, АСТ, АЛТ, желчных кислот после проведения СПС и П.О. Так, билирубин снизился на 39,8±3,8% после СПС и на 38,5±6,4% после П.О. Динамика снижения неконъюгированного билирубина отличалась на 5% в пользу СПС. Снижение желчных кислот признано равнозначным у пациентов обеих групп и составляло немного больше 30%. В динамике некоторых биохимических показателей статистически значимых различий не отмечено, возможно, это обусловлено малым количеством наблюдений.
При анализе предварительных результатов отмечена четко однонаправленная тенденция к улучшению анализируемых показателей. Это позволяет нам считать, что предварительные результаты нашего исследования являются удовлетворительными. Следует отметить, что в целом при равнозначном эффекте для достижения нужного уровня детоксикации необходимо соблюдение принципа достаточного объема эксфузии плазмы при проведении ПО, что в свою очередь требует адекватного восполнения СЗП и раствором альбумина. Увеличение объема введения компонентов и препаратов крови может способствовать увеличению числа посттрансфузионных осложнений. В нашем исследовании отмечено большее (в 2—3 раза) снижение уровня общего белка и альбумина при проведении ПО, чем при СПС даже при адекватном его восполнении. Так, после проведения СПС уровень общего белка снизился на 2,05±0,8%, уровень альбумина — на 3,9±2,4%. После П.О. уровень снижения общего белка составлял 6,6±1%, уровень снижения альбумина составлял 6,5±1,3%. Отсутствовало статистически значимое снижение уровня белка у пациентов обеих групп. Нами отмечено, что СПС не оказывает отрицательного влияния на показатели гемостаза.
Согласно данным литературы [17, 18], другие сорбционные методы детоксикации, такие как MARS-терапия, позволяют нормализовать показатели коагулограммы в постперфузионном периоде, а ПО не оказывает влияния на показатели коагуляционного гемостаза при печеночно-клеточной недостаточности. На фоне исходной гипокоагуляции у пациентов с печеночной недостаточностью применение ПО может иметь преимущество по сравнению с СПС, так как трансфузия донорской СЗП может способствовать нормализации показателей гемостаза. С другой стороны, мы не можем не рассматривать риск развития посттрансфузионных осложнений и аллергических реакций у данной категории больных, связанных с введением донорской плазмы и альбумина. Следует учитывать, что при ПО для восполнения белковых и жидкостных потерь использовали 5% раствор альбумина и донорскую СЗП.
Преимуществом СПС является отсутствие необходимости во введении раствора альбумина и донорской плазмы, что уменьшает риск посттрансфузионных осложнений. Это связано с особенностями проведения данной процедуры. Кроме того, при СПС снижается риск заражения опасными инфекционными заболеваниями такими, как ВИЧ, гепатит В и С.
Выводы
1. Селективная плазмосорбция и плазмообмен являются безопасными методами экстракорпоральной гемокоррекции при печеночной недостаточности у больных с длительной механической желтухой, позволяющими эффективно корригировать эндотоксикоз при высоком уровне билирубина на этапах подготовки к оперативному вмешательству, а также в послеоперационном периоде.
2. Установлено, что селективная плазмосорбция имеет преимущества по сравнению с плазмообменом. Потери белка и альбумина после селективной плазмосорбции минимальные, и нет необходимости в дополнительной трансфузии донорской плазмы и альбумина, что исключает возможность развития связанных с этим осложнений.
3. Отсутствие геморрагических осложнений у пациентов во время селективной плазмосорбции и плазмообмена, отсутствие статистически значимых изменений в показателях коагулограммы после процедуры позволяют рекомендовать данные методики поддержки функции печени у больных с печеночной недостаточностью при механической желтухе.
4. В ходе процедуры селективной плазмосорбции не отмечено снижение уровня общего белка и альбумина плазмы, а также и некоторых других показателей, что подтверждает селективность данного сорбента. При проведении плазмообмена отмечено снижение уровней общего белка на 6,5% и альбумина на 3,9%.
Финансирование. Работа не имела финансовой поддержки.
Авторы заявляют об отсутствии конфликта интересов.
Научно-диагностический центр лабораторных технологий

Телефоны для справок:

Личный кабинет клиента

В корзине пусто!
Вирусный гепатит С (HCV) в плазме
Вирусный гепатит С (HCV) в плазме – это исследование для выявления возбудителя гепатита C (HCV), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется наличие генетического материала (РНК) вируса в крови. Вирус гепатита С (HCV) – РНК-содержащий вирус из семейства Flaviviridae, который поражает печень. HCV благодаря высокой мутационной активности может избегать воздействия защитных механизмов иммунной системы. Существует 6 генотипов и множество субтипов вируса, которые имеют разные значения для прогноза развития заболевания и эффективности противовирусной терапии. Основной путь передачи инфекции – через кровь (препараты для переливания элементов крови и плазмы, донорские органы, нестерильные шприцы, иглы, инструменты для татуирования, пирсинга). Вероятно заражение при половом контакте и ребенка от матери во время родов, но это случается нечасто. Острый вирусный гепатит, как правило, характеризуется бессимптомным течением и остается невыявленным в большинстве случаев. Только у 15% инфицированных заболевание протекает остро – с тошнотой, ломотой в теле, отсутствием аппетита и потерей веса (редко сопровождается желтухой). У 60-85% инфицированных развивается хроническая инфекция, что в 15 раз превышает частоту хронизации при гепатите В. Хронический вирусный гепатит С протекает с повышением печеночных ферментов и скудным проявлением симптомов. У 20-30% больных заболевание приводит к циррозу печени, увеличивая риск развития печеночной недостаточности и гепатоцеллюлярной карциномы.
Выявление РНК HCV свидетельствует о размножении вируса в организме и помогает диагностировать заболевание. Благодаря качественному методу подтверждается присутствие вируса гепатита С и его активное размножение. Согласно рекомендации ВОЗ установление диагноза гепатита С возможно на основании троекратного обнаружения РНК ВГС в сыворотке крови больного при отсутствии других маркёров гепатита. В острую фазу гепатита С РНК вируса выявляют в крови уже через 1-2 недели после инфицирования, т. е. задолго до появления антител к гепатиту С.
Подготовка к исследованию
- специальной подготовки не требуется.
Показания к исследованию
- для раннего выявления вирусного гепатита С.
Для дифференциальной диагностики гепатитов.
- для контроля за эффективностью противовирусного лечения.
Для мониторинга течения вирусного гепатита С.
- для проверки донорской крови.
Интерпретация
Референсные значения:
- отрицательно
Причины положительного результата
- вирусный гепатит С.
Причины отрицательного результата
- отсутствие вируса гепатита С в крови исследуемого.
На результаты могут влиять
Причины ложноотрицательного результата:
- минимальная вирусная нагрузка крови (менее 200 копий/мл);
- наличие в образце ингибиторов – химических и белковых субстанций, влияющих на различные компоненты ПЦР;
- присутствие в крови гепарина;
- высокий уровень криоглобулинов в крови;
- нарушение транспортировки и хранения материала.
Причины ложноположительного результата:
- загрязнение пробы.
Назначается в комплексе с
- общий анализ крови базовый
- биохимический анализ крови при заболеваниях ЖКТ
- коагулограмма базовая
- антитела к вирусу гепатита С, HCV ab
- тест, подтверждающий наличие антигена вируса гепатита С, HCV Ag+Ab
- ПЦР HCV количественный
- Генотипирование вируса гепатита С (1а, 1b, 2a, 2b, 3a)

+(998 71) 256-09-19

c 08:00 до 18:00, Пн-Пт

c 08:00 до 16:00, Сб
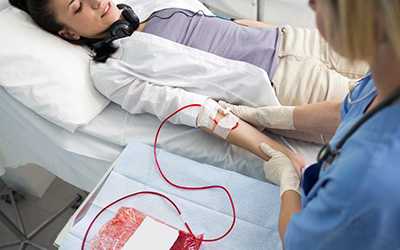
Плазмаферез – один из самых популярных видов экстракорпоральной детоксикации, направленной на изменение органического, газового или водно-электролитного состава кровяной субстанции посредством её химической и механической обработки вне организма. Для проведения манипуляций по очистке требуется специально оборудование. Изменениям подвергаются как качественные, так и количественные характеристики
Особенности процедуры
Суть метода предусматривает элиминацию (удаление) всех элементов, содержащихся в плазме. Максимально значимый терапевтический эффект достигается, когда вредные вещества сконцентрированы именно в жидкой составляющей кровотока.
Как и любая другая лечебная процедура, плазмаферез требует точного дозирования количества забираемого объема циркулирующей плазмы (ОЦП). Расчет допустимого ОЦП определяется для каждого пациента индивидуально по специальным таблицам с учетом возрастных характеристик, половой принадлежности, антропометрических данных.
В зависимости от количества удаляемой за одну процедуру плазмы выделяют несколько разновидностей этого метода:
Показания
Плазмаферез в современной медицинской практике используется как основной или вспомогательный метод.
К патологическим состояниям, при которых процедура является одним из основных компонентов терапии, относятся:
- эритромиелоз;
- посттрансфузионная пурпура;
- повышение числа лейкоцитов и тромбоцитов при гемобластозах (неопластических процессах);
- миастения Гравис (тяжелое аутоиммунное заболевание, сопровождающееся разрушением собственных рецепторов в поперечнополосатых мышцах);
- серповидно-клеточные нарушения строения гемоглобина;
- генетически обусловленный сбой обмена железа;
- нарушения пигментного обмена;
- наследственное увеличение содержания холестерина;
- отравление химикатами и ядами;
- синдром Гийена-Барре (полирадикулоневрит);
- массивный распад эритроцитов в кровотоке;
- хронические множественные поражения периферических нервов, приводящие к параличам и парезам;
- болезненная реакция на холод;
- повышение вязкости крови, как одно из проявлений миеломной болезни (злокачественной опухоли появляющейся из плазматических клеток);
- синдром Гудпасчера (аутоиммунное заболевание, разрушающее альвеолы легких и почечные клубочки);
- ДВС-синдром (одно из нарушений свертываемости);
- ускоренное образование тромбов и закупорка мелких сосудов;
- тромбоцитопеническая пурпура (одна из разновидностей недостатка тромбоцитов);
- миоглобинемия.
Перечень заболевания, терапия которых предусматривает включение процедуры очистки крови в протокол лечения:

- тяжелые формы аллергии и псевдоаллергических реакций;
- аутоимунное поражение миелиновой оболочки нервных волокон головного и спинного мозга;
- псориаз;
- ревматоидный артрит;
- пузырные дерматозы;
- системные воспаления и разрушения сосудистых стенок (васкулиты);
- экстракапилярный гломерулонефрит;
- острый панкреатит;
- бронхиальная астма;
- красная волчанка;
- тяжелая форма сепсиса.
Плазмаферез: польза и вред
Лечебное действие плазмафереза основывается на следующих молекулярных механизмах:
- Количественное выведение различных биомолекул: парапротеинов, антител, продуктов распада, экзотоксинов, неспецифических эндогенных молекул и др.
- Полное или частичное возмещение недостающих компонентов донорскими.
- Воздействие на структуры форменных элементов крови мембраны плазмофильтра (деплазмирование эритроцитов, уменьшение вязкости фильтруемой жидкости).
- Допустимый плацебо – эффект, наиболее ожидаемый в терапии хронических заболеваний.
В то же время, одномоментное выведение из организма более 30% ОЦП дает стабильное существенное снижение концентраций полезных для организма человека белков плазмы, факторов, обеспечивающих свертывание, и иммунных антител. Восстановление этих показателей происходит на протяжении долгого времени (не менее 7 дней). При удалении за один сеанс около 50 % ОЦП, в организме отсутствуют резервы для самостоятельного восстановления и обеспечения нормального функционального состояния органов. Такие состояния поддаются коррекции с помощью введение донорских компонентов. Выведение свыше 100% ОЦП не корригируется даже инфузиями альбумина и донорской плазмы, такие состояния тяжело переносятся пациентами. Поэтому процедура плазмообмена проводится лишь в критических и угрожаемых для жизни состояниях.
Как делают плазмаферез крови (разновидности методик)
Гравитационные методы основываются на фрагментации кровяной субстанции на форменные элементы и плазму, под воздействием ускоренного осаждения.
Этот метод предусматривает два варианта проведения плазмафереза:
- неаппаратный – осуществляющийся посредством естественного осаждения клеточных структур;
- центрифужный, когда разделение крови обеспечивается с помощью центрифугирования определенного ее объема.
Современные клиники выполняют два вида аппаратного гравитационного плазмафереза:
- Дискретный. Осуществляется забор крови у пациента в специальную пластиковую тару объемом 400-450 мл м последующее центрифугирование полученного материала, после этого функциональные клетки крови разводят в стерильном растворе для инфузий и возвращают пациенту.
- Непрерывно – поточный. Эта методика предусматривает использование специального аппарата для плазмафереза (сепаратора), благодаря которому производится одномоментные забор крови, разделение и возвращение пациенту неудаляемых компонентов.
Самым инновационным методом плазмафереза является мембранный, осуществляемый через особую мембрану, имеющую поры диаметром 0,2-0,6 мкм. Такой размер пропускного отверстия позволяет задерживать клетки крови и без проблем пропускает плазму. Эта методика адаптирована для выведения патологических гамма-глобулинов и хорошо зарекомендовала себя при аллергии. Одна из его разновидностей – каскадная очистка, подразумевающая пропускание кровяной субстанции через два мембранных фильтра.
Противопоказания
Существуют относительные и абсолютные противопоказания к очищению крови при помощи плазмафереза.
К ним относятся:

- критические и некомпенсируемые состояния у пациента;
- хирургические кровотечения и потенциальные источники неконтролируемых кровотечений (эрозии, опухоли, язвы);
- индивидуальная непереносимость или аллергические реакции в анамнезе на один из компонентов процедуры;
- инфекционные и гнойные процессы в стадии обострения;
- гипертермии неясного генеза;
- первичные или вторичные патологические нарушения гемостаза;
- анемии различной этиологии;
- гипопротеинемия;
- отсутствие возможности обеспечения периферического или центрального венозного доступа;
- период беременности, менструационных кровотечений у женщин.
Преимущества плазмафереза крови
Благодаря гемосорбции удается достичь:
- Полного или частичного исчезновения клинически значимых симптомов многих заболевания.
- Повышения эффективности базисной специальной медикаментозной терапии или снижение дозировок медикаментов.
- Полного выздоровления.
Побочные эффекты
Несмотря на неоспоримую пользу плазмафереза, во время проведения процедуры или сразу после ее окончания иногда могут наблюдаться следующие состояния:

- эмболические поражения мелких и крупных сосудов;
- острая гиповолемия, проявляющаяся резким снижением показателей артериального давления;
- острая гиперволемия, характеризующаяся левожелудочковой острой недостаточностью (одышка, дыхательная недостаточность, отек легких);
- геморрагический синдром;
- аллергические реакции различной интенсивностивплоть до анафилактического шока;
- пирогенные реакции;
- гипокальциемия (ощущения онемения конечностей, языка, губ).
При этом частота осложнений при плановых процедурах, после проведения всех подготовительных и диагностических мероприятий сводится к минимуму.
Читайте также:

