Периодонтит может быть от герпеса
Обновлено: 23.04.2024
Взаимосвязь фокальных одонтогенных очагов инфекции и воспалительных заболеваний глаза
C. Jones описал клинический случай пациента 16 лет, у которого развилось паренхиматозное воспаление роговиц обоих глаз. Несмотря на активное антисифилитическое и другое противовоспалительное лечение в течение 6 мес, кератит прогрессировал до состояния, когда обе роговицы стали полностью непрозрачными. При этом васкуляризации роговиц не было отмечено. Лишь спустя 9 мес от начала болезни у пациента были выявлены и удалены 9 зубов с апикальными абсцессами, а также была произведена тонзиллэктомия инфицированных миндалин. Посевы гнойного содержимого из миндалин и апикальных абсцессов выявили рост одного и того же микроорганизма — гемолитического стрептококка. Впервые за все время болезни уже спустя 48 ч после санации очагов фокальной инфекции было зафиксировано улучшение состояния обоих глаз — значительное уменьшение мучительной фотофобии, гиперемии и резорбция инфильтрации обеих роговиц. Острота зрения стала уверенно расти и в итоге повысилась с правильной светопроекции до 1,0 в течение последующих 8 мес. При этом прозрачность роговиц OU полностью восстановилась, за исключением помутнения верхненаружного квадранта роговицы правого глаза [3].
Согласно теории F. Billings [6], фокус инфекции может оставаться неактивным в течение продолжительного времени, так как защитные функции организма препятствуют развитию инфекции. Однако при негативных воздействиях на организм, таких как травма, переохлаждение, стресс, острая вирусная инфекция, высокая температура и др., фокус латентной инфекции способен активироваться и привести к развитию септических осложнений.
R. Haden [7] в своих исследованиях выделил бактериальные культуры из околоверхушечных тканей 1500 удаленных зубов. Из 400 недепульпированных удаленных зубов лишь в 15% были выявлены стрептококки. Но из 500 раннее депульпированных удаленных зубов с выявленными рентгенологически гранулемами и кистами стрептококки выявлялись в 72,4% случаев, а из 600 раннее депульпированных удаленных зубов, где рентгенологически очаги инфекции выявлены не были, — в 55,7%. Самой распространенной культурой были негемолитические стрептококки.
Депульпирование зубов потенциально создает риск развития хронического инфекционно-воспалительного процесса в полости рта из-за неправильной или неполной очистки зубных каналов, неполного удаления пораженных нервов или недостаточного пломбирования открытых каналов. Эти факторы способствуют распространению микробов и образованию фокальных очагов одонтогенной инфекции [8].
P. Chojnocki [10] внутривенно вводил подопытным кроликам инфекционный материал, выделенный из депульпированных зубов 10 пациентов с иридоциклитом и 4 пациентов с ретробульбарным невритом. В большинстве случаев у кроликов проявлялась та же глазная патология, что и у пациентов. Ученый отметил также, что экстракция больного зуба пациента благоприятно влияла на состояние его глаза.
C. Henry [11] описал 50 случаев циклитов, иридоциклитов и конъюнктивитов, развившихся как следствие инфицирования непрорезавшегося 3-го моляра (зуба мудрости) и быстро купированных после его удаления. Автор считал, что поиск зубного сепсиса никогда не должен рассматриваться как полноценный, если он не включает прицельную рентгенограмму зубов мудрости. Зуб мудрости, как и любой другой зуб, может быть местом развития инфекции, однако автор приводит ряд примеров, где совершенно здоровый, но непрорезавшийся, дистопированный или ретинированный зуб мудрости вызывал воспаление глаза вследствие давления на верхние или нижние зубные нервные сплетения и рефлекторного раздражения тройничного нерва.
Дентальные источники инфекции расценивались J. Doggart [12] как пусковые факторы таких заболеваний глаза, как конъюнктивиты, склериты, эписклериты, различные формы кератитов с изъязвлениями или без, катаракты, хориоретиниты, тромбозы вен сетчатки, ретробульбарные невриты, орбитальные целлюлиты, блефариты, дакриоциститы.
P. Klieve и J. Reh описали более 50 случаев иридоциклитов и кератитов, успешно вылеченных лишь после удаления пораженных зубов. F. Krusin доложил о нескольких случаях язв роговицы, полностью излеченных после устранения дентальных очагов инфекции (цит. по [14]).
S. Mujevic [15] после тщательного обследования 127 пациентов с иридоциклитами выявил, что одонтогенная инфекция послужила непосредственной причиной развития заболевания у 49 (38,5%) из них. Причем автор заметил, что санация очагов инфекции приводила к короткому обострению симптомов с последующим немедленным выздоровлением, естественно, на фоне адекватной консервативной терапии. W. Lang [16] в ходе работы отмечал, что очаги одонтогенной инфекции были обнаружены примерно у 1/3 его пациентов, страдающих иридоциклитом. У ряда пациентов им же была выявлена ЛОР-патология, в частности тонзиллит. При этом одонтогенная инфекция была причиной иридоциклитов в 40 раз чаще, чем очаги инфекции в миндалинах.
K. Langmann [19] указывает на возможность рецидива герпетического кератита вследствие одонтогенной инфекции. У наблюдаемого им больного с тяжелым рецидивирующим герпетическим кератитом и вторичной глаукомой при рентгенологическом исследовании была обнаружена зубная гранулема в верхней челюсти на стороне пораженного глаза. После удаления зуба с гранулемой быстро достигнуто выздоровление, внутриглазное давление нормализовалось и рецидивы кератита не повторялись.
L. King и соавт. [22] описан случай септического тромбоза центральной вены сетчатки, развившегося вследствие транзиторной бактериемии на фоне глубокого кариеса верхних моляров. После проведения системной антибиотикотерапии зрение пациента полностью восстановилось.
S. Blum и cоавт. (цит. по [14]) полагали, что кератиты возникали под влиянием раздражения тригеминального ганглия, которое производил воспаленный зуб на тройничный нерв. S. Blum описал 7 случаев кератита, при которых устранение очага одонтогенной инфекции способствовало уменьшению выраженности симптомов кератита или излечению.
S. Theobald (цит. по [23]) также предположил наличие рефлекторного ответа ветвей тройничного нерва на раздражители со стороны зубных очагов инфекции и, как следствие, развитие воспаления роговицы. Автор отметил, что значительно чаще подвергается воспалению тот глаз, на стороне которого находится пораженный зуб. Преимущественно такая связь наблюдалась при очагах, расположенных в верхней челюсти. В своих работах автор призывал незамедлительно удалять пораженные зубы во избежание глазных осложнений.
И.Г. Лукомский (цит. по [25]) выдвинул нейротоксическую концепцию механизма действия инфекционных очагов полости рта на организм, суть которой заключается в следующем: при воспалительном процессе в тканях периодонта образуются промежуточные продукты распада белка типа биогенных или протеиногенных аминов, а также клеточные и тканевые яды. Эти вещества, всасываясь в кровь, раздражают нервно-трофический аппарат и воздействуют на процессы обмена и функцию вегетативной нервной системы в отдельных органах. В то же время указанные вещества, являясь антигенами, изменяют чувствительность организма, что приводит к сенсибилизации и развитию явлений общей интоксикации. И.Г. Лукомский считал, что наиболее частой причиной ротового сепсиса является хронический гранулирующий апикальный периодонтит, который из всех других форм периодонтитов является наиболее активной формой нейротоксической связи между хроническими очагами в периодонте и другими системами организма.
Поскольку стоматологические манипуляции всегда сопровождаются кровотечением, риск развития транзиторной бактериемии очень высок. В 88% случаев микрофлора одонтогенных очагов инфекции попадает в кровяное русло и временно циркулирует там до 15 мин [26].
A. Heimdahl и соавт. [27] выявили бактериемию после экстракции зуба у 100% пациентов, у 70% — после глубокой чистки зубов, у 55% — после хирургического вмешательства на 3-м моляре, у 20% — после эндодонтического лечения (механической и лекарственной обработки зубных каналов с последующей герметизацией) и у 55% — после тонзиллэктомии. D. Kaye (1985) (цит. по [28]) также установил, что в 90% случаев после удаления зубов возникала бактериемия. При этом в 74% удаленных зубов из корневых каналов были выделены Streptococcus viridans, а в 61% — Bacteroides melanogenicus. Кроме того, в корневых каналах были выявлены стафилококки, энтерококки и другие микроорганизмы.
Чаще всего бактериемия протекает бессимптомно, однако пациенты со сниженным иммунитетом имеют высокий риск развития тяжелых последствий подобной бактериемии — от случаев кератитов и эндофтальмитов, абсцессов глазницы, синдрома верхушки глазницы до абсцесса мозга, что требует срочного привлечения врачей других специальностей — офтальмологов, отоларингологов, нейрохирургов [3, 29—32]. D. May и соавт. [33] описали случай гематогенного распространения инфекции через 1 нед после стоматологического лечения, когда у пациента появились симптомы прогрессирующего увеита, перешедшего в эндофтальмит (гнойное воспаление внутренних оболочек глазного яблока), что потребовало эвисцерации — хирургического удаления содержимого глазного яблока с сохранением фиброзной оболочки. В литературе имеется множество работ, описывающих развитие эндофтальмита после удаления больного зуба [34, 35].
В исследовании G. Debelian и соавт. [36] использовали фенотипические и генетические методы, чтобы проследить распространение микроорганизмов из полости рта на фоне эндодонтического лечения. Микробиологические образцы были взяты из корневых каналов 26 пациентов с бессимптомным апикальным периодонтитом однокорневых зубов. В материале были выявлены штаммы анаэробных бактерий: Propionibacterium acnes, Peptostreptococcus prevotii, Fusobacterium nucleatum, Prevotella intermedia, Saccharomyces cerevisiae, Actinomyces israelii, Streptococcus intermedius, Streptococcus sanguis. Те же штаммы были обнаружены в кровотоке у пациентов через 10 мин по окончании пломбировки канала зуба.
В подтверждение изложенного M. Kilian и соавт. [37] приводят данные о том, что распространение микроорганизмов из полости рта в кровоток происходит в большинстве случаев менее чем за 1 мин после стоматологических процедур, и микроорганизмы из очагов инфекции способны проникать в мозг, сердце и легкие.
Анализ статистических данных за последние 40 лет показывает, что число больных с острой одонтогенной инфекцией неуклонно растет. По данным стоматологических клиник, в 1978 г. этот показатель составил 51,1—56%, в 1992 г. — 56—59%, в 2000 г. уже 63—70%, а в 2017 г. 85,5—95,6%. Болезни периодонта занимают одно из важнейших мест среди проблем в современной стоматологии [38, 39].
Результаты опроса среди стоматологов, проведенного Department of Oral Pathology (Индия) в 2017 г., показали, что 45,7% опрошенных не знали о существующей связи между фокальными очагами инфекции полости рта и заболеваниями глаз. Только 26,8% были согласны с данной теорией, в то время как 16,2% отрицали наличие взаимосвязи [40].
Хронический гранулирующий и гранулематозный периодонтиты сопровождаются воспалительными и деструктивными изменениями кости альвеолярного отростка, а продукты распада тканевых белков (биогенные амины) представляют большую опасность для организма, вызывая хроническую интоксикацию и сенсибилизацию. В 85—98% случаев периодонтит зубов служит этиологическим фактором острых воспалительных процессов в челюстно-лицевой области (периостит, абсцесс, флегмона, лимфаденит, остеомиелит челюсти) [41].
Как правило, хронический апикальный периодонтит протекает в бессимптомной форме. Гранулемы и корневые кисты часто обнаруживают в области разрушенного зуба, а также зубов после травмы и на фоне недостаточного или неправильного эндодонтического лечения кариеса и пульпита. Местом образования кисты может быть любой поврежденный зуб, однако в 2,5—3 раза чаще гнойные кисты локализуются на верхней челюсти. Киста образуется из околоверхушечной гранулемы, в которую пролиферируют активированные воспалением эпителиальные остатки периодонтальной связки, приводящие к образованию кистогранулемы, затем трансформирующейся в кисту. В неактивном состоянии гранулемы и кисты содержат незначительное количество гноя и не вызывают жалоб у пациентов, что затрудняет клиническую диагностику. В период обострения количество гноя увеличивается за счет гибели макрофагов. Гнойное воспаление повреждает костные структуры, нервные окончания и сосуды альвеолы и кости. Корневая киста всегда инфицирована — содержимое может варьировать от прозрачного серозного до гнойного; в нем обнаруживаются микроорганизмы, которые находятся в полости рта и кариозных зубах. Прорыв гноя из полости кисты в околочелюстные мягкие ткани приводит к таким осложнениям, как развитие абсцесса или флегмоны, а также образованию свищевого хода, который располагается в преддверии полости рта, небе или коже лица [42, 43].
Пути распространения инфекции. Сложные пути, по которым инфекция распространяется в организме, изучены недостаточно. Однако экспериментальные данные позволяют считать возможным существование трех путей распространения инфекции в организме — неврального, гематогенного и лимфогенного.
Невральный путь. Экспериментальные исследования, проведенные И.Ф. Баринским и соавт. [44], И.Ф. Баринским и Ф.Р. Махмудовым [45] с помощью светового микроскопа в 1964 и 1986 гг., подтвердили предположения S. Blum, S. Theobald, A. Nesburn и P. Absell о том, что герпесвирусная инфекция распространяется в различные органы двумя путями — невральным (по чувствительным, двигательным и симпатическим нервным волокнам) и гематогенным (в результате выраженного эритротропизма вируса простого герпеса — ВПГ), вследствие чего происходит заражение новых клеток.
В ходе экспериментов на кроликах A. Nesburn и соавт. [46] и P. Absell и соавт. [47] доказали, что ганглий тройничного нерва является основным резервуаром для латентного существования вируса простого герпеса (ВПГ) в течение многих лет.
При изучении механизма распространения герпетической инфекции K. Hayashi и Y. Uchida [48] пришли к выводу, что раздражение ганглия тройничного нерва приводит к реактивации ВПГ и обратному поступлению вируса из ганглия по первой ветви тройничного нерва к органу-мишени — глазу. Развиваются острый герпетический кератит или его рецидивы. Миграция вируса по нервным путям осуществляется с помощью аксоплазматического транспорта в анте- и ретроградном направлениях, распространяется интрааксонально, периневрально, эндоневрально, по леммоцитам. J. Szanto и J. Rajcani [49] доказали, что вирионы вируса герпеса после прикрепления к нервным окончаниям поглощаются аксонами и транспортируются внутри них со скоростью 1,5 мм/ч. Авторы считают невральный путь распространения ВПГ преобладающим.
Гематогенный путь. По мнению J. Bullock и J. Fleishman [50], предположительным путем гематогенного распространения инфекции является ретроградный занос через глазные вены. Верхняя и нижняя глазные вены анастомозируют с угловой и лицевой венами у медиального угла глаза. Нижняя глазная вена проходит через нижнюю глазную щель и соединяется с крыловидным венозным сплетением. Эти вены не имеют клапанов, и в них нет сопротивления распространению инфекции. Отсутствие клапанов при наличии анастомозов между венами глазницы и лица, пазух носа и крылонебной ямки формирует условия для оттока крови в трех направлениях: в пещеристую пазуху, крылонебную ямку и к венам лица. Это создает возможность распространения инфекции с кожи лица, из пазух носа в глазницу и пещеристую пазуху. C кровотоком по указанным венам инфекция распространяется из полости рта и придаточных пазух носа в орбиту, далее — по глазным, вортикозным и эписклеральным венам, осуществляющим венозный отток от переднего отрезка глаза [29, 50, 51]. R. Brooks [52] и D. Parke и соавт. [53] описано 38 и 32 соответственно случаев гематогенного распространения Candida albicans, приводивших к возникновению эндофтальмитов.
Лимфогенный путь. Лимфатическая система находится в тесной связи с кровеносной, принимая активное участие в обменных процессах, а также обеспечивая защитную функцию организма от инфекционного и интоксикационного воздействий. От фокальных очагов инфекции бактерии, вирусы и грибы способны по афферентным лимфатическим сосудам достигать лимфатических узлов (ЛУ). Далее инфекция распространяется от пораженного ЛУ к следующему ЛУ по эфферентным лимфатическим сосудам, достигая глубоких ЛУ и попадая в кровеносное русло [54].
По данным Y. Shinomura и S. Higaki [55], ВПГ обладает не только тропизмом к нервной ткани и эритроцитам, но и способностью к сохранению и размножению в лейкоцитах и лимфоцитах, что приводит к дальнейшей реактивации вируса при определенных условиях. Инфицированные ВПГ лейкоциты и лимфоциты обеспечивают последующее его распространение по ходу лимфатических сосудов, поражая близлежащие структуры.
От перикорнеального лимфатического кольца лимфа оттекает в сторону экватора, в густую сеть широко анастомозирующих между собой извитых лимфатических сосудов. Первыми Л.У. для конъюнктивальных лимфатических сосудов являются околоушные; кроме того, установлены дренажные связи конъюнктивального лимфооттока с подчелюстными и шейными ЛУ. В подчелюстные ЛУ осуществляется отток от всех зубов, кроме нижних резцов и верхних третьих моляров (для них отток лимфы идет в глубокие ЛУ шеи). Таким образом, подчелюстные и шейные ЛУ могут быть связующим звеном лимфооттока от зубов и глаз [56].
Заключение
Многочисленные наблюдения врачей разных специальностей (офтальмологов, стоматологов), изложенные в настоящем обзоре, подтверждают существование несомненной взаимосвязи очагов одонтогенной инфекции и воспалительных заболеваний глаз.
По данным литературы, фокальные очаги инфекции оказывают раздражающее или токсическое воздействие на вторую и третью ветви тройничного нерва, вызывая рефлекторное раздражение ганглия тройничного нерва, являющегося резервуаром для вируса герпеса. Вирус простого герпеса, имеющий тропность к нервной ткани и эритроцитам, распространяется из ганглия тройничного нерва по глазничной ветви тройничного нерва нейрогенным, а также гематогенным путем. Таким образом, инфекция через сосуды и нервы в супрахориоидальном пространстве достигает переднего отрезка глаза. Гематогенный путь распространения микробной инфекции возможен благодаря анастомозу верхней и нижней глазных вен с угловой и лицевой венами. Лимфатический путь распространения предположительно осуществляется через подчелюстные и шейные лимфатические узлы, которые служат общим звеном в системе оттока лимфы от зубов и глаз.
Знание того, что одонтогенные очаги инфекции являются потенциальными триггерами возникновения и развития тяжелых воспалительных заболеваний глаз, обеспечит стоматологам и офтальмологам повышение качества своевременной дифференциальной диагностики с установлением этиологии заболевания, эффективность лечения и предупреждение рецидивов данных тяжелых заболеваний.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
КАК ЦИТИРОВАТЬ:
Что такое периодонтит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Козлов В. И., стоматолога со стажем в 17 лет.
Над статьей доктора Козлов В. И. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Периодонтит — это заболевание, вызванное бактериями, травмой или лекарственными препаратами, в результате которого происходит воспаление комплекса соединительной ткани (периодонта), расположенной между цементом зуба и зубной альвеолой. [9] [20]
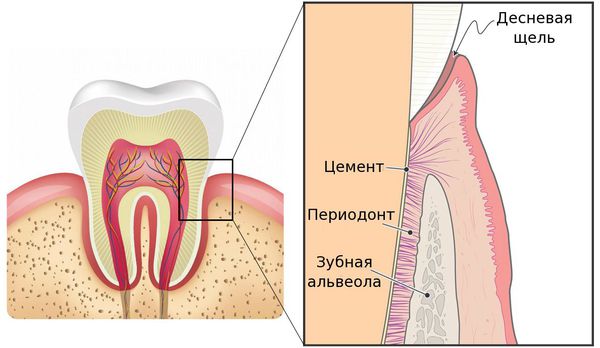
В общей структуре стоматологических заболеваний периодонтит встречается во всех возрастных группах пациентов и составляет 25–30% от общего числа обращений в стоматологические учреждения. [3]
В зависимости от причин возникновения выделяют три типа периодонтита:
- Травматический периодонтит — может развиться как при однократном сильном механическом воздействии (ушиб, удар, попадание косточки), так и при неоднократных небольших механических повреждениях (например, при постоянном откусывании нитей швеёй).
- Медикаментозный периодонтит — возникает в результате выхода сильнодействующих препаратов из корневого канала в ткани периодонта (например, когда в зубе было оставлено лекарство, а следующий приём состоялся позже, чем это было показано по инструкции безопасного периода нахождения препарата в канале). [11]
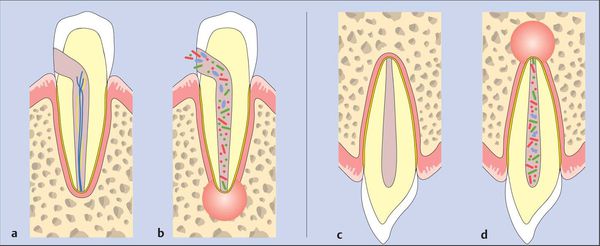
Пути инфицирования тканей периодонта:
- внутризубной — выход токсинов и бактерий через систему корневого канала после инфицирования пульпы и её некротизации в ткани периодонта;
- внезубной — переход воспаления из окружающих тканей (остеомиелит, остит, гайморит, пародонтит и т. д.).
Крайне редко возможно инфицирование тканей периодонта гематогенным (через кровь) и лимфогенными путями.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы периодонтита
Проявления заболевания напрямую зависят от его формы.
Хронические формы периодонтита в большинстве случаев протекают бессимптомно и выявляются во время рентгенологического исследования либо при обострении.
Признаки острого периодонтита и обострения его хронической формы:
- боль в зубе (причём чаще всего можно точно указать, какой именно зуб болит) — в начале заболевания боль слабо выраженная, ноющая, но позднее она становится более интенсивной, рвущей и пульсирующей;
- боль при жевании и прикосновении к зубу;
- чувство "выросшего зуба" — ощущение, что зуб стал длиннее других и первым смыкается с зубами-антагонистами;
- наличие большой кариозной полости в больном зубе или его предшествующее лечение по поводу глубокого кариеса или пульпита;
- иногда возникает отёк мягких тканей в области поражённого зуба — связано с выходом воспалительного экссудата (жидкости) из очага, находящегося в периодонте, в поднадкостничное пространство или мягкие ткани;
- открытие свищевого хода, чаще всего располагающегося на десне в проекции корня поражённого зуба (может возникнуть при обострении хронического периодонтита);
- отсутствие реакции больного зуба на холодное, горячее, сладкое или кислое;
- возможная подвижность зуба, связанная с инфильтрацией периодонта.
Патогенез периодонтита
Острый верхушечный периодонтит
После повреждения периодонта по одной из указанных выше причин возникает кратковременный интенсивный тканевый ответ. Этот процесс сопровождается клиническими симптомами острого периодонтита. [7]
Ответ ткани, как правило, ограничен периодонтальной связкой. Он приводит к типичным нервно-сосудистым реакциям воспаления, которые проявляются гиперемией (переполнением кровью), застоем сосудов, отёком периодонтальной связки и экстравазацией (вытеканием в ткани) нейтрофилов. Поскольку целостность кости, цемента и дентина ещё не нарушена, периапикальные изменения на этом этапе не обнаруживаются при рентгенологическом исследовании.
Если воспаление было вызвано неинфекционными раздражителями, то поражение может исчезнуть, а структура апикального периодонта восстанавливается. [13] [14]
Когда происходит инфицирование, нейтрофилы не только борются с микроорганизмами, но также выделяют лейкотриены и простагландины. Первые привлекают больше нейтрофилов и макрофагов в область поражения, а вторые активируют остеокласты — клетки, участвующие в разрушении костной ткани. Так, через несколько дней кость, окружающая периодонт, может резорбироваться (раствориться), тогда в области верхушки корня рентгенологически обнаруживается расширение периодонтальной щели. [15]
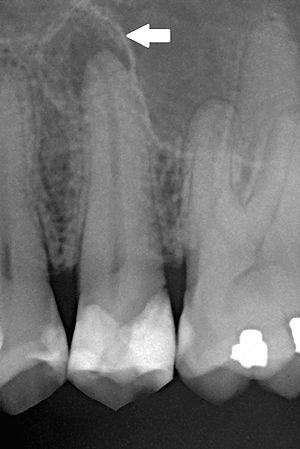
Нейтрофилы погибают в месте воспаления и высвобождают из своих гранул ферменты, которые вызывают разрушение внеклеточных матриксов и клеток. Такое "расщепление" тканей предотвращает распространение инфекции в другие части тела и обеспечивает пространство для проникновения защитных клеток.
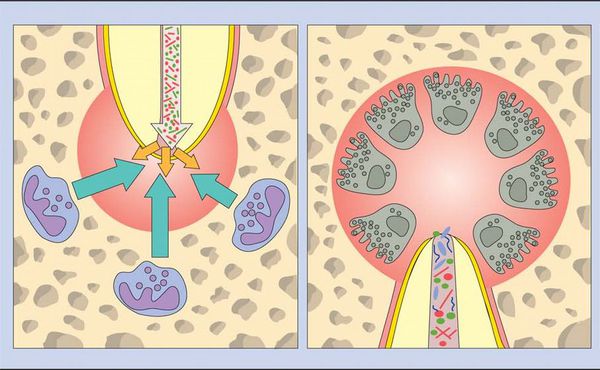
Во время острой фазы макрофаги также появляются в периодонте. Они продуцируют провоспалительные и хемотаксические (аллергические) цитокины. Эти молекулы усиливают местный сосудистый ответ, разрушение кости и деградацию внеклеточных матриц, а также могут заставить гепатоциты повысить выработку белков острой фазы.
Острый первичный периодонтит имеет несколько возможных исходов:
- самопроизвольное заживление;
- дальнейшее усиление и распространение в кости (альвеолярный абсцесс);
- выход наружу (образование свищей или синусового тракта);
- хронизация процесса. [19]
Хронический периодонтит
Длительное присутствие микробных раздражителей приводит к сдвигу в сторону макрофагов, лимфоцитов (Т-клеток) и плазматических клеток, которые инкапсулировуются в коллагеновой соединительной ткани.
Провоспалительные цитокины (клетки иммунной системы) являются мощными стимуляторами лимфоцитов. Активированные Т-клетки продуцируют множество цитокинов, которые снижают выработку провоспалительных цитокинов, что приводит к подавлению процесса разрушения кости. Напротив, полученные из Т-клеток цитокины могут одновременно усиливать выработку факторов роста соединительной ткани, что оказывает стимулирующее и пролиферативное воздействие на фибробласты и микроциркуляторное русло.
Возможность подавления деструктивного процесса объясняет отсутствие или замедленную резорбцию кости и восстановление коллагеновой соединительной ткани во время хронической фазы заболевания. Следовательно, хронические поражения могут оставаться бессимптомными в течение длительного времени без существенных изменений на рентгенограмме. [21]
В результате во время этих острых эпизодов микроорганизмы могут быть обнаружены в костной ткани, окружающей периодонт, с быстрым увеличением рентгенологических проявлений. Эта рентгенографическая картина обусловлена разрушением апикальной кости, которое происходит быстро во время острых фаз и относительно неактивно на протяжении хронического периода. Следовательно, прогрессирование заболевания не является непрерывным, а происходит прерывистыми скачками после периодов "стабильности".
Цитологические исследования показывают, что около 45% всех хронических периодонтитов эпителизированы. Когда эпителиальные клетки начинают разрастаться, они могут делать это во всех направлениях случайным образом, образуя неправильную эпителиальную массу, в которую попадают сосудистая и инфильтрированная соединительная ткань. При некоторых поражениях эпителий может врастать во вход корневого канала, образуя пломбоподобное уплотнение на апикальном отверстии.
Классификация и стадии развития периодонтита
Классификация периодонтитов главным образом отображает причину воспаления, и что именно происходит в тканях пародонта. Самой распространённой классификацией, используемой на практике, является классификация И.Г. Лукомского: [17]
- Острый верхушечный (апикальный) периодонтит:
- серозный;
- гнойный.
- Хронический верхушечный (апикальный) периодонтит:
- фиброзный;
- гранулирующий;
- гранулематозный.
- Обострение хронического периодонтита.
Также при постановке диагноза используется классификация по МКБ-10:
K04.4 Острый апикальный периодонтит пульпарного происхождения:
K04.5 Хронический апикальный периодонтит:
- апикальная или периапикальная гранулема;
- апикальный периодонтит БДУ.
K04.6 Периапикальный абсцесс с полостью:
- зубной (дентальный) абсцесс с полостью;
- дентоальвеолярный абсцесс с полостью.
K04.7 Периапикальный абсцесс без полости:
- зубной (дентальный) абсцесс БДУ;
- дентоальвеолярный абсцесс БДУ;
- периaпикальный абсцесс БДУ.
K04.8 Корневая киста:
- апикальная (периодонтальная) киста;
- периaпикaльная киста;
- остаточная корневая киста.
Осложнения периодонтита
Осложнения периодонтита зависят от причинного зуба, локализации воспалительного очага, формы и стадии заболевания. Условно можно разделить все осложнения на несколько групп. [8]
Осложнения, вызванные распространением инфекции из периодонтального очага:
- Одонтогенный периостит — распространение воспалительного процесса на надкостницу альвеолярного отростка и тела челюсти из периодонтального (одонтогенного) очага.
- Одонтогенный абсцесс — формирование ограниченного полостного гнойного очага, возникающего в результате гнойного расплавления подслизистой, подкожной, межмышечной, межфасциальной клетчатки, лимфоузлов, мышечной ткани или кости. Формирование абсцессов преимущественно происходит в околочелюстных мягких тканях.
- Одонтогенная флегмона — формирование разлитого гнойного воспаления клетчатки, расположенной под кожей, слизистой оболочкой, между мышцами и фасциями.
- Одонтогенный гайморит — формирование воспаления в гайморовой пазухе, вызванное распространением инфекции из периодонтального (одонтогенного) очага.
- Одонтогенный лимфаденит — формирование воспаления в регионарных лимфатических узлах, вызванного распространением инфекции из периодонтального (одонтогенного) очага.
- Одонтогенный остеомиелит — гнойное воспаление челюстной кости (одновременно всех её структурных компонентов) с развитием участков остеонекроза.
Осложнение, вызванное деструктивными изменениями в перерадикулярной кости:
- Вторичная адентия — потеря одного или нескольких зубов, причиной которой служит разрушение костной ткани, окружающей корень зуба, препятствующее дальнейшему функционированию такого зуба.
Осложнение, вызванное формированием свищевого хода:
- Кожные свищи — образование свищевого хода, открывающегося на поверхность кожи.
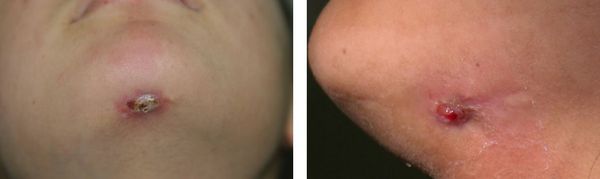
Диагностика периодонтита
Диагностика периодонтита проводится на основании жалоб пациента, анамнеза заболевания, оценки общесоматического статуса, осмотра головы и шеи, полости рта, зуба, его перкуссии, зондирования и термопробы, электроодонтодиагностики (ЭОМ) и рентгенологического исследования. [10]
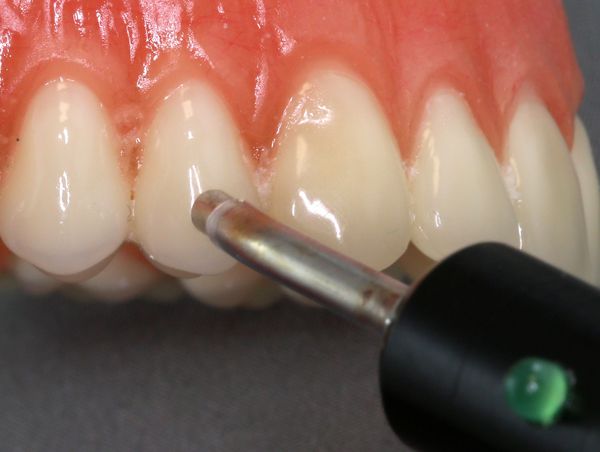
ЭОМ — это метод стоматологического исследования, основанный на определении порогового возбуждения болевых и тактильных рецепторов пульпы зуба при прохождении через неё электрического тока.
Диагностические признаки острого периодонтита:
Диагностические признаки хронического периодонтита:
Диагностические признаки обострения хронического периодонтита
Чаще всего клиническая картина соответствует острому периодонтиту, за исключением того, что всегда рентгенологически выявляются изменения в тканях периодонта, характерные для той или иной формы периодонтита. [12]
Лечение периодонтита
Лечение периодонтита направлено на устранение причин, механизмов и проявлений заболевания. Методы лечения бывают терапевтическими, хирургическими и комбинированными.
Терапевтическое лечение
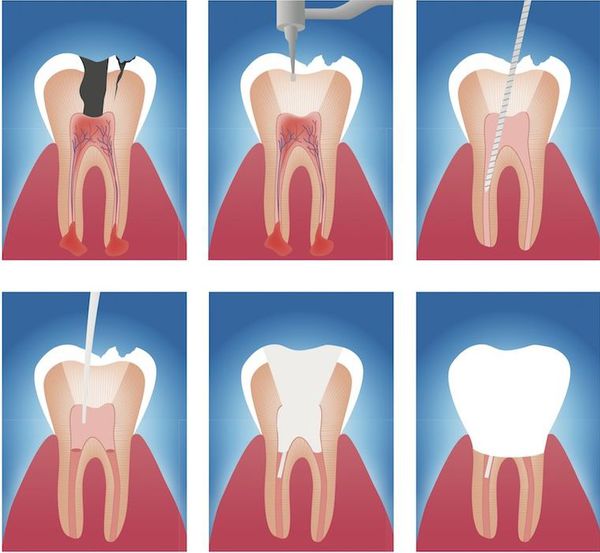
Данный метод лечения нацелен на устранение патогенной микрофлоры, находящейся в эндодонте — комплексе поражённых тканей, включающем пульпу и дентин, которые связаны между собой морфологически и функционально. Поэтому иначе такое лечение называют эндодонтическим. [16]
Этапы эндодонтического лечения:
- адекватное обезболивание;
- изоляция зуба или нескольких зубов, в которых будут проводится манипуляции, от полости рта;
- создание эндодонтического доступа (иссечение твёрдых тканей зуба или пломбировочного материала, закрывающих доступ в систему корневого канала;
- прохождение и определение длинны корневого канала (это длинна от устья до верхушки корня);
- создание корневого канала определённого диаметра и формы;
- введение в корневой канал лекарственных препаратов;
- пломбирование корневого канала;
- восстановление анатомии и функции зуба с помощью пломбировочного материала или ортопедической конструкции.
Хирургическое лечение
К оперативному лечению прибегают только в случаях неэффективности или невозможности терапевтического лечения.
К хирургическим методам лечения относятся:
- удаление части корня зуба (резекция) — позволяет сохранить зуб, даже если у верхушки корня присуствовала киста;
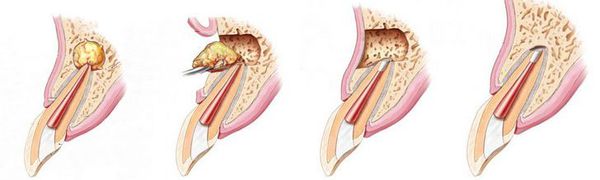
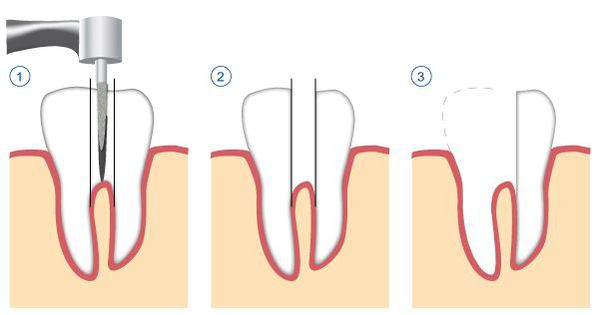
- удаление зуба целиком, с последующим замещением утраченного зуба.
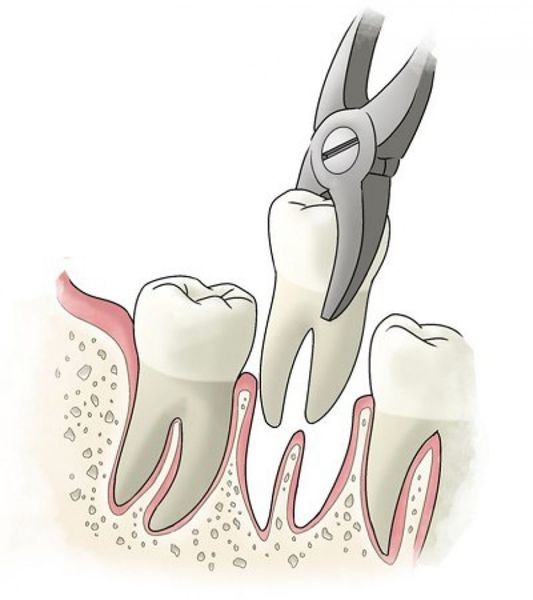
Прогноз. Профилактика
Течение и прогноз периодонтита, безусловно, зависят от своевременности обращения к стоматологу и качества проведенного им лечения. При эффективном лечении каналов происходит восстановление участка разрушенной кости, и зуб сохраняет свои функциональные свойства. При несвоевременном обращении пациента или безуспешном лечении высока вероятность потери зуба, а осложнения хронического периодонтита могут представлять серьёзную угрозу здоровью и жизни.
Для профилактики периодонтита необходимо тщательно ухаживать за полостью рта, регулярно проводить осмотры у врача-стоматолога и своевременно лечить одонтогенные очаги инфекции, такие как кариес и пульпит. [2] [5] [6]
Московский городской центр профилатики и борьбы со СПИД
Роль герпес-вирусов в патогенезе воспалительных заболеваний пародонта
Журнал: Стоматология. 2016;95(2): 89‑91
Московский городской центр профилатики и борьбы со СПИД
Герпес-вирусы (цитомегаловирус, вирус Эпштейна—Барр, вирус простого герпеса) являются потенциально важным звеном в патогенезе воспалительных заболеваний пародонта. Патогенность вирусов этого семейства комплексна и осуществляется как опосредованно, через модуляцию Т-лимфоцитарного иммунного ответа, так и непосредственно вирусной репликацией и инфицированием тканей. Актуальность изучения данного аспекта патогенеза пародонтита вызвана ростом числа больных его агрессивными формами, а также нарушениями иммунитета.
Московский городской центр профилатики и борьбы со СПИД

Содержание ГВ ткани десны у больных пародонтитом и с интактным пародонтом, %.
Заболевания пародонта — одна из важнейших проблем стоматологической науки. По данным экспертов ВОЗ, воспалительные заболевания пародонта выявляются у 90—95% взрослого населения. В последнее время все чаще отмечается тяжелое течение пародонтита, увеличилось число больных с его агрессивными формами [1].
Показано, что воспаление пародонта вызывают бактериальные облигатные и факультативные патогены. С конца 90-х годов прошлого века все большее внимание исследователей привлекает влияние вирусов на характер течения воспалительного процесса в тканях пародонта и их вероятное включение в патогенетическую цепь [2]. Изучение вирусной экологии полости рта (ПР) выявило ее значительное изменение при пародонтите [3]. Наибольший интерес в этом отношении представляет многочисленное семейство Herpesviridae (герпес-вирусы — ГВ). В тканях ПР чаще всего выделяют вирусы простого герпеса (ВПГ) 1, 7-го генотипов — ВПГ1 и ВПГ7, цитомегаловирус (ЦМВ), вирус Эпштейна—Барр (ВЭБ), вирус папилломы человека [4]. Описан случай пародонтита у молодого пациента, вызванный тяжелой ВПГ-инфекцией [5].
На ранних фазах пародонтита у пациентов со здоровым иммунитетом преобладают цитопатические процессы. Большинство клинических проявлений у иммунокомпетентных пациентов вторично по отношению к клеточному/гуморальному иммунному ответу. Антигены вирусов и бактерий способствуют деструкции пародонта. В ряде исследований показано, что у больных пародонтитом активирован управляемый Т-лимфоцитами иммунный ответ [6].
Специфический лимфоцитарный ответ вызывает аллергизацию организма и поддерживает сложный воспалительный каскад с участием цитокинов, хемокинов и других медиаторов. Герпес-ассоциированные цитокины/хемокины стимулируют костную резорбцию остеокластами, регулируют активность фермента матричной металлопротеиназы, препятствуя обменно-репаративным процессам в пародонте и увеличивая риск его деструкции [7].
ГВ-инфекция нарушает антибактериальную защиту организма и в конечном счете способна увеличить патогенность пародонтальной микрофлоры [8]. A. Kato и соавт. указывают, что сосуществование ВЭБ и пародонтопатогенных бактерий приводит к синергетическому эффекту и усиливает прогрессирование пародонтита. В инфицированных ВЭБ тканях пародонта повышено содержание анаэробных бактерий [9].
Есть наблюдения, указывающие на определенную роль ассоциации Porphyromonasgingivalis, ВЭБ и ЦМВ в патогенезе хронического пародонтита [10]. Таким образом, взаимодействие между ГВ и бактериями, вероятно, двунаправленное: вирусы увеличивают агрессивность пародонтопатогенных бактерий, которые, в свою очередь, с помощью собственных ферментов и других провоспалительных факторов способны повысить вирулентность ГВ [11].
Ключевыми клетками защиты от пародонтопатогенных бактерий являются полиморфно-ядерные лейкоциты. ГВ нарушают механизмы их адгезии, хемотаксиса, фагоцитоза, что приводит к снижению бактерицидной активности. ВЭБ способствуют нейтропении, выработке антинейтрофильных антител, стимулируют поликлональную пролиферацию и дифференцирование B-лимфоцитов.
Имеется наблюдение, доказывающее участие ЦМВ в патогенезе пародонтита, причем чаще данный вирус выявляется в слюне у женщин [12]. ЦМВ способен увеличить адгезивность Actinomycesactinomycetemcomitans к эпителиальным клеткам пародонтальных карманов (ПК) и к HeLa-клеткам (опухолевые клетки). ЦМВ-специфические CD8 + Т-лимфоциты реагируют на молекулы HLA-DR4 и вызывают аутоиммунные реакции, что осложняет течение пародонтита. ГВ синергически отягощают течение патологических процессов в пародонте, что подтверждается частым выявлением ЦМВ и ВЭБ или ЦМВ и ВПГ в случаях тяжелого пародонтита [13].
ГВ проявляют прямой цитопатический эффект в отношении фибробластов, кератиноцитов, эндотелиальных клеток и так называемых клеток воспаления — полиморфно-ядерных лейкоцитов, лимфоцитов, макрофагов и, вероятно, остеоцитов. ВЭБ и ЦМВ на фоне пародонтита нарушают функции моноцитов, макрофагов и лимфоцитов. Отмечают, что при агрессивном течении пародонтита в пародонте содержится меньше T-супрессоров и больше B-лимфоцитов, чем при хроническом течении заболевания [14].
Роль В-лимфоцитов в патогенезе пародонтита не менее важна, чем Т-популяций. Увеличение содержания В-лимфоцитов, дифференцирующихся в плазматические клетки (плазмоциты), — важнейший морфологический признак воспалительного процесса. Концентрация плазмоцитов тем выше, чем тяжелее течение заболевания и больше степень деструкции — как соединительнотканной, так и костной. Большинство В-лимфоцитов и плазматических клеток аутореактивны, т. е. продуцируют антитела к собственным тканям [15].
ВЭБ- и ЦМВ-инфекции вызывают выброс бета-интерлейкина-1 и фактора некроза опухоли-α моноцитами/макрофагами. Увеличенные уровни провоспалительных цитокинов в пародонте связаны с риском его деструкции. ЦМВ-специфические CD8 + Т-лимфоциты реагируют на молекулы HLA-DR4 и вызывают аутоиммунные реакции, что также осложняет клиническое течение пародонтита [13].
К числу ГВ, наиболее часто встречающихся в ПР, относятся ЦМВ и ВПГ7, которые также присутствуют в воспаленном пародонте [16]. Индийские ученые считают, что распространенность ГВ при агрессивном пародонтите варьирует в зависимости от возраста и расы пациента [17]. В Бразилии, например, при изучении этого вопроса выявилась частая пораженность ВПГ1 и ВЭБ1 при хроническом и агрессивном пародонтите и отсутствие ЦМВ [18]. Немецкие исследователи вообще не обнаружили ГВ в пародонте в случаях агрессивного течения воспалительного процесса [19].
Данные приведенных авторов позволяют предположить, что ЦМВ-инфекция сопровождается инфильтрацией CD3 + Т-лимфоцитами, тогда как ВПГ — CD4 + T-клетками [20].
На рисунке показано значительное увеличение количества большинства патогенных ГВ при воспалении пародонта по сравнению с таковыми в интактном пародонте [21].
По данным R. Sharma и соавт., распространенность ВЭБ1 и ЦМВ выше как при хроническом, так и при агрессивном течении пародонтита, чем в контрольной группе. Авторы отмечают, что наличие этих вирусов положительно коррелировало с глубиной ПК [22].
В литературе описаны случаи микстинфекций — пародонтит в сочетании с плоскоклеточной карциномой языка, вызванной вирусом папилломы человека 16-го генотипа. Авторы предполагают, что контакт патологически измененного пародонта с языком — потенциальный источник онкогенных папилломавирусов [23].
Высокая встречаемость у ВИЧ-положительных пациентов ГВ при пародонтите и патологии слизистой оболочки рта (СОР) позволяет предположить их участие в патогенезе этих заболеваний. Так, ВЭБ1 встречался в 1,5 раза чаще в ПР ВИЧ-положительных пациентов, чем ВИЧ-отрицательных больных с пародонтитом. ВПГ8 присутствовал у 24% ВИЧ-положительных больных пародонтитом (без клинических симптомов саркомы Капоши), но не был найден в пародонте ВИЧ-негативных пациентов [24]. По наблюдениям E. Botero и соавт., наличие ЦМВ в ПК коррелировало с их глубиной [25].
У ВИЧ-позитивных больных с пародонтитом отмечают более выраженную тяжесть его течения и склонность к прогрессированию, активную утрату зубодесневого соединения, более выраженную рецессию десны, чем у ВИЧ-негативных пациентов [26]. Вирусно-бактериальная микстинфекция, вероятно, служит отягощающим фактором пародонтальной деструкции при ВИЧ/СПИД.
Многолетние наблюдения показали, что антиретровирусная терапия способна незначительно снизить распространенность/вирусную нагрузку ГВ в слюне [27].
Итак, ГВ — потенциально важное звено патогенеза хронического агрессивного пародонтита. Патогенность Г.В. комплексна и осуществляется путем как прямого инфицирования тканей, так и вирусно-иммунной альтерации через модуляцию Т-лимфоцитарного ответа. Актуальность изучения этого аспекта патогенеза пародонтита обусловлена как ростом числа больных с его агрессивными формами, так и высокой распространенностью иммунодефицитных состояний. Терапия заболеваний СОР и пародонта у таких пациентов должна быть дифференцированной, в первую очередь — этиотропной/патогенетической [28]. Для прогнозирования пародонтальной деструкции перспективно определение ДНК ГВ с применением полимеразной цепной реакции в реальном времени [29].

Периодонтит – следующий этап воспаления после пульпита. Инфекция локализуется на верхушке корня зуба и окружающих ее тканях. Болезнь часто протекает бессимптомно, но без своевременной помощи приводит к потере зуба.
Причины:
- Вовремя не вылеченный пульпит. Если зуб болел, а потом перестал, значит, воспаление перешло в хроническую стадию. Хронический пульпит будет медленно распространяться по зубу и превратится в периоднонтит.
- Пульпит, леченый по устаревшим методикам. До появления апекс-локатора измерить длину корневого канала было нечем, и врач действовал вслепую. Если канал пролечен не полностью, и в нем остались частички инфицированной пульпы, возникают осложнения. Чтобы этого избежать, врач мог перестараться и вывести стоматологический материал за пределы верхушки корня. Вокруг комочка пасты иногда с годами развивается очаг инфекции.
- Травма зуба. Частая проблема у активных детей. Вследствие травмы (часто страдают резцы), пульпа гибнет, и вслед за этим развивается периодонтит. По сути, причина - тот же не замеченный и не вылеченный вовремя пульпит.
Виды периодонтита
| Форма | Вид | Как болит |
|---|---|---|
| Острый | Серозный | Легкие ноющие боли в области зуба. |
| Гнойный | Пульсирующая боль. Может усилиться подвижность зуба. Возможна припухлость щеки, слабость, температура, флюс. | |
| Хронический | Фиброзный | Без симптомов или небольшое потемнение, тусклый цвет коронковой части зуба. |
| Гранулирующий | Легкая болезненность при накусывании со временем переходит в боль от горячего, при жевании, при давлении. Десна краснеет и опухает. | |
| Гранулематозный | Отсутствие симптомов. Появляется свищ для оттока отделяемого, но пациент не всегда может его увидеть. |
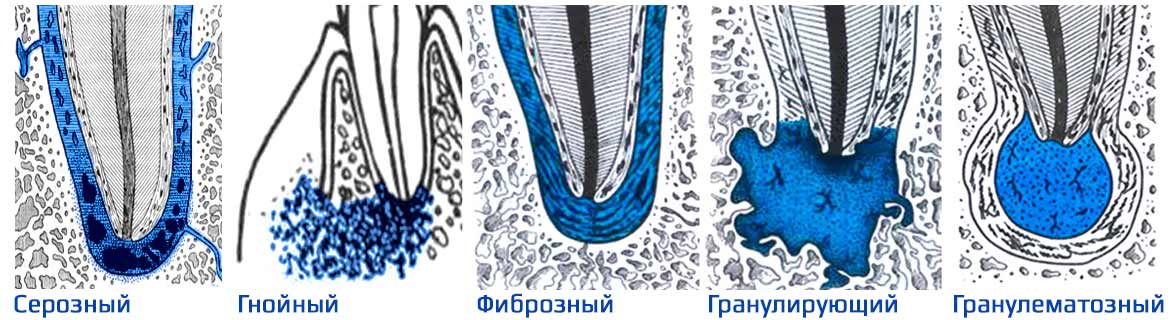
Самым агрессивным считается гранулирующий периодонтит, который очень быстро распространяется на соседние ткани. При таком диагнозе чаще всего зуб не удается сохранить.
При гранулематозной разновидности болезни у очага воспаления есть твердая оболочка, а внутри она заполнена гноем. В зависимости от размера эти новообразования называют гранулемой (до 5 мм), кистогранулемой или радикулярной кистой (более 1 см).
Таким образом, гранулема и киста корня зуба – это проявления хронического периодонтита.
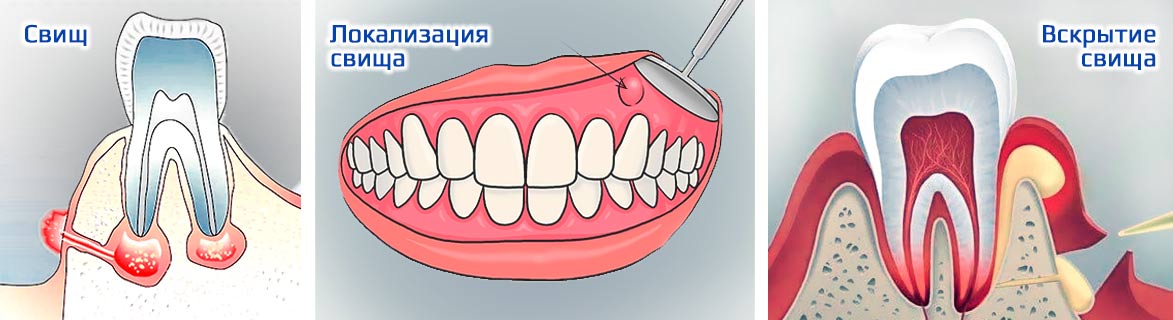
Диагностика
Не путайте свищ со стоматитом. Свищ похож на прыщик, расположен на десне около корней зуба, не болит при надавливании. При появлении свища скорее обратитесь к стоматологу.
Заподозрить проблему до образования свища или флюса врач может по жалобам. Очень важно, чтобы пациент описывал все симптомы, не стеснялся жаловаться на слабую, невыраженную, изредка появляющуюся боль и дискомфорт.
Точно установить диагноз помогает рентген. Периодонтит виден даже на маленьком прицельном снимке. Далее для планирования лечения стоматолог предложит сделать панорамный снимок (все зубы на одном кадре) или компьютерную томограмму (трехмерное изображение зубочелюстной системы).


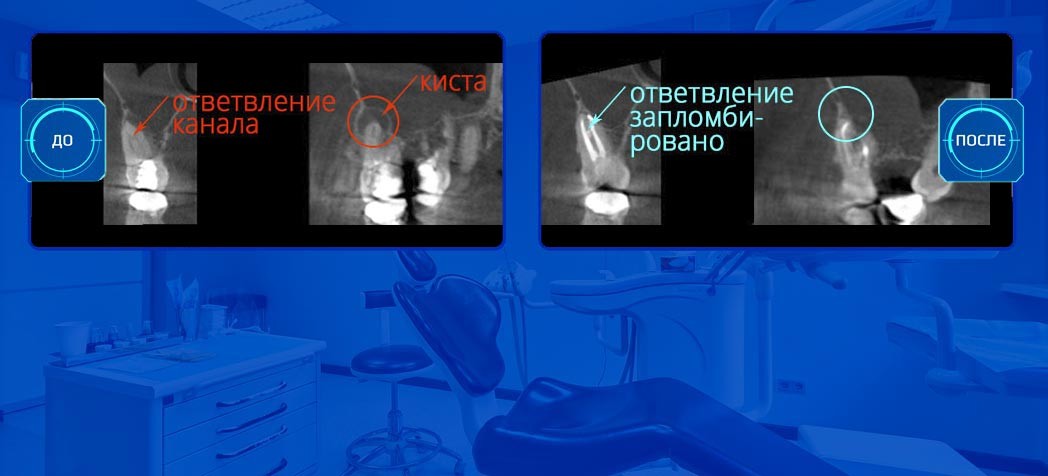
Лечение
В зависимости от стадии и формы болезни доктор подберет оптимальный метод.
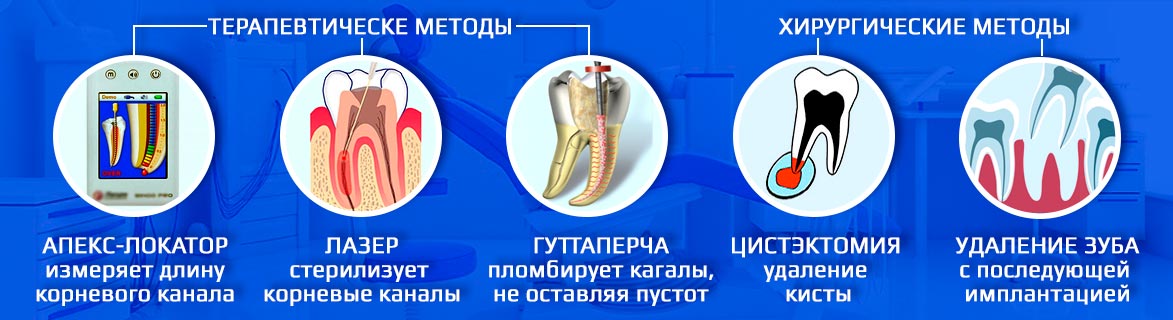
1. Терапевтическое лечение. Как правило, требуется три посещения стоматологического кабинета.
- Неотложная помощь. Стоматолог удалит очаг воспаления: проведет очистку и дезинфекцию каналов с помощью лекарств и стерилизации лазером. При необходимости врач установит дренаж для оттока гноя.
- Лечение каналов зуба и установка временной пломбы. Если есть сомнения, что иммунитет справится с оставшимися микроорганизмами, стоматолог может назначить прием антибиотиков, физиотерапию, полоскания и лечебные ванночки.
- Реставрация зуба. На последнем визите стоматолог сделает рентгеновский снимок, чтобы убедиться, что очаг воспаления удален. После этого можно приступать к пломбированию и восстановлению эстетики и жевательной функции зуба.
- Наблюдение. О положительной динамике тканей, окружающих зуб, можно говорить через 1-2 года по результатам рентгенологического исследования.
2. Зубосохраняющие операции. Иногда консервативных методов недостаточно. Стоматолог-хирург может провести цистэктомию (удаление кисты) или резекцию верхушки корня (отсечение части зуба вместе с кистой).
3. Удаление зуба. В запущенных стадиях полностью победить очаги инфекции не получится. Попытки спасти зуб приведут к большим финансовым тратам и поставят под угрозу соседние зубы. Наилучшим решением будет установить на месте пораженного зуба имплантат.
Если оставить зуб без лечения, его ждет преждевременное удаление. Воспаление будет разрастаться и перейдет в острую стадию, причем в самый неудачный момент.
Хронический периодонтит врачи называют бомбой замедленного действия. Обострение провоцируется стрессами, нагрузками, переохлаждением или сменой климата. То есть, оно случится в долгожданной поездке на море, во время работы над важным проектом, перед экзаменом или при инфекционной болезни.
Периодонтит у детей
У ребенка воспаление периодонта может развиться как на молочных, так и на постоянных зубах. Особенности детского периодонтита:
- высокая скорость протекания,
- выраженная симптоматика (температура, боль, отек, возможны нагноения),
- повышенный риск осложнений. Если не принять срочные меры, пострадают зачатки постоянных зубов.
Лечение проходит по той же схеме, что и у взрослых. Если до выпадения молочного зуба осталось меньше года или корни уже рассосались, детский стоматолог предложит удалить зуб.
Профилактика
Простые и не затратные меры позволят снизить риски появления периодонтита и потери зуба.
- Соблюдайте гигиену полости рта.
- Правильно питайтесь. Избыток углеводной пищи провоцирует развитие патогенных микроорганизмов.
- Своевременно обращайтесь к специалисту для лечения зубов. Приходите на плановый осмотр раз в полгода, даже если ничего не болит. Озвучивайте все жалобы.
- С пониманием относитесь к предложению доктора пройти панорамную рентгенографию или компьютерную томографию. Полная информация позволит заметить и вылечить болезнь.
За экспертную помощь в написании статьи и предоставленные примеры работ благодарим стоматолога-терапевта Юрьеву Ольгу Юрьевну.
Читайте также:

