Перитонит у вич инфицированных
Обновлено: 24.04.2024
Наличие хронического гепатита С (ХГС) и ВИЧ-инфекции одновременно ассоциируется со значительной частотой неблагоприятных исходов вследствие развития цирроза и/или первичного рака печени, а также общностью эпидемиологических, социальных и экономических факторов. При сочетании этих инфекций отмечаются более высокий титр вируса гепатита С, выраженное прогрессирование хронического гепатита и высокий риск цирроза печени. При этом цирроз печени развивается быстрее и в 3 раза чаще у ВИЧ-инфицированных, чем у больных моноинфекцией гепатита С.
Цель исследования: выявить клинические и лабораторные особенности больных ХГС и ВИЧ-инфекцией.
Материал и методы: в исследование включены 173 пациента с ХГС и ВИЧ-инфекцией. Стандартную терапию ХГС (пегилированный интерферон альфа-2а + рибавирин) получали 45 больных, антиретровирусную терапию — 29. Чаще определялся генотип 1 вируса гепатита С (91 пациент, 52,6%). ХГС преобладал у пациентов мужского пола (в группе 1 — 64,3%, в группе 2 — 71,1%) и в наиболее трудоспособном возрасте от 20 до 30 лет (в группе 1 — 68,8%, в группе 2 — 80%).
Результаты исследования: среди больных, поступивших в стационар, 55,5% имели смешанную форму гепатита (ХГС + токсический гепатит) и у 17,2% выявлен цирроз печени. У 22,6% больных противовирусная терапия была отменена вследствие развития побочных реакций или неэффективности. Значительное количество пациентов до поступления в стационар злоупотребляли алкоголем (54,7%), наркотиками (25,8%), имели хронические заболевания: панкреатит, бронхит.
Заключение: среди пациентов с ХГС и ВИЧ-инфекцией, поступающих в стационар, преобладают больные со смешанной формой гепатита (ХГС + токсический гепатит). Большинство больных не получают стандартную противовирусную терапию ХГС вследствие выраженного иммунодефицита, злоупотребления алкоголем, приема психотропных веществ или отказа от лечения.
Ключевые слова: ВИЧ-инфекция, хронический гепатит С, цирроз печени, противовирусная терапия, антиретровирусная терапия, интерферон альфа-2а, рибавирин, генотип, оппортунистические инфекции.
Для цитирования: Сундуков А.В., Мельников Л.В., Евдокимов Е.Ю. Характеристика больных хроническим гепатитом С и ВИЧ-инфекцией. РМЖ. Медицинское обозрение. 2018;2(7(II)):64-67.
A.V. Sundukov 1 , L.V. Melnikov 2 , E.Yu. Evdokimov 3
1 Evdokimov Moscow State University of Medicine and Dentistry
2 Penza State University
3 Central Research Institute of Epidemiology, Moscow
The presence of HIV infection together with chronic hepatitis C (CHC) is associated with a significant incidence of an adverse events due to the development of cirrhosis and/or primary liver cancer, as well as a similarity of epidemiological, social and economic factors. In the case of these infections, there is a higher titer of hepatitis C virus, significant progression of chronic hepatitis and a high risk of the liver cirrhosis. At the same time, liver cirrhosis develops faster and 3 times more often in HIV-infected patients than in patients with hepatitis C monoinfection.
Aim: to identify the clinical and laboratory features of patients with CHC and HIV infection.
Patients and Methods: the study included 173 patients with CHC and HIV infection. 45 patients underwent standard therapy (pegylated interferon alfa-2a + ribavirin) of CHC. Antiretroviral therapy was followed by 29 patients. The 1 genotype of the hepatitis C virus was identified more frequently (91 patients, 52.6%). CHC prevailed in male patients (group 1 — 64.3%, group 2 — 71.1%) at the most working age from 20 to 30 years (group 1 — 68.8%, group 2 — 80%).
Results: among the patients admitted to the hospital, 55.5% had a mixed form of hepatitis (CHC + toxic hepatitis) and 17.2% had cirrhosis of the liver. In 22.6% of patients, antiviral therapy was canceled due to the development of adverse events or non-
response to therapy. A significant number of patients before admission to the hospital abused alcohol (54.7%), drugs (25.8%), had chronic diseases: pancreatitis, bronchitis.
Conclusion: patients with mixed hepatitis (CHC + toxic hepatitis) prevail among patients with CHC and HIV infection admitted to hospital. Most patients do not receive standard antiviral therapy for CHC due to pronounced immunodeficiency, alcohol abuse, psychotropic substances intake, or refusal of treatment.
Key words: HIV infection, chronic hepatitis C, liver cirrhosis, antiviral therapy, antiretroviral therapy, interferon alfa-2a, ribavirin, genotype, opportunistic infections.
For citation: Sundukov A.V., Melnikov L.V., Evdokimov E.Yu. Characteristics of patients with chronic hepatitis C and HIV infection // RMJ. Medical Review. 2018. № 7(II). P. 64–67.
В статье приведены характеристика больных хроническим гепатитом С и ВИЧ-инфекцией с целью определения клинических и лабораторных особенностей больных с данными заболеваниями.
Введение
Актуальность проблемы вируса иммунодефицита человека (ВИЧ) и хронического гепатита С (ХГС) определяется широким распространением этих инфекций, многообразием клинических форм, значительной частотой неблагоприятных исходов вследствие развития цирроза и/или первичного рака печени, а также общностью эпидемиологических, социальных и экономических факторов. Эпидемиологическая ситуация в России по ВИЧ и ХГС остается сложной, и в последнее время отмечается увеличение смешанной инфекции (ВИЧ/ХГС). Из 42 млн ныне живущих ВИЧ-инфицированных людей примерно у 20% (8,4 млн) диагностирован ХГС [1–3]. Как правило, у данной категории пациентов в анамнезе отмечают случаи внутривенного введения наркотиков [4].
В настоящее время более 80% всех случаев ВИЧ-инфекции приходится на потребителей инъекционных наркотиков, и в этой группе маркеры вирусного гепатита С определяются более чем у 90% больных [4–7]. Наличие ХГС и ВИЧ-инфекции одновременно ассоциируется с более высоким титром вируса гепатита С, выраженным прогрессированием хронического гепатита и возрастающим риском цирроза печени. При этом цирроз печени развивается быстрее и в 3 раза чаще у ВИЧ-инфицированных, чем у больных моноинфекцией гепатита С [4, 7, 8].
Цель настоящего исследования: выявить клинические и лабораторные особенности больных ХГС и ВИЧ-инфекцией.
Материал и методы
Работа выполнялась с 2013 по 2017 г. на базе инфекционной клинической больницы (ИКБ) № 2 Москвы и Московского городского центра по борьбе с ВИЧ/СПИД.
Всего под нашим наблюдением находилось 173 пациента с ХГС и ВИЧ-инфекцией. При постановке диагноза использовались эпидемиологические, клинические, биохимические, инструментальные методы исследования. Этиологический диагноз основывался на определении специфических серологических маркеров вирусных гепатитов и результатах молекулярно-биологических исследований с определением генотипа вируса гепатита С в лаборатории ИКБ № 2.
Стадия ВИЧ-инфекции определялась по Российской классификации ВИЧ-инфекции (В.И. Покровский, 2001 г.) [4].
В зависимости от схемы лечения все больные были разделены на 2 группы. Группа 1 включала 128 (74%) больных, которые получали только патогенетическую дезинтоксикационную терапию: раствор 5% глюкозы, солевые растворы, витамины (аскорбиновая кислота, витамины группы В), абсорбенты, гепатопротекторы. Из них 29 (22,6%) человек получали антиретровирусную терапию (АРТ): ламивудин, зидовудин, ставудин, абакавир, эфавиренз и др. Среди не получающих АРТ были пациенты, которым по иммунологическим характеристикам было показано лечение против ВИЧ-инфекции. Однако на фоне злоупотребления алкоголем у этих пациентов отмечалось обострение ХГС, в связи с чем АРТ не назначалась.
Группа 2 состояла из 45 (26%) человек — 32 (71,1%) мужчин и 13 (28,9%) женщин. Они получали стандартную противовирусную терапию (пегилированный интерферон альфа-2а + рибавирин). Пегилированный интерферон альфа-2а назначался в дозе 180 мг 1 р./нед. подкожно, рибавирин — по 800–1200 мг/кг в зависимости от массы тела. Длительность терапии составила 48 нед. Лечение в группе 2 проводилось амбулаторно, назначение АРТ не требовалось.
Статистическую обработку данных проводили с использованием MS Excel 2003 и подсчетом критерия Стьюдента (t).
Результаты исследования
Распределение пациентов в группах в зависимости от генотипа вируса гепатита С представлено на рисунках 1 и 2. Распределение по генотипам ХГС было сопоставимо, при этом генотип 1 встречался наиболее часто: у 67 (52,3%) больных в группе 1 и у 22 (48,9%) — в группе 2. У остальных пациентов в группе 1 генотип 2 встречался у 28 (21,9%) человек, генотип 3 — у 33 (25,8%); в группе 2 — соответственно у 9 и 14 (20,0 и 31,1%).
Большинство больных имели III (бессимптомную) или IVА стадию ВИЧ-инфекции (табл. 1): в группе 1 таких было 95 (74,2%) человек, в группе 2 — 45 (100%). В группе 2 не было больных с поздними стадиями ВИЧ-инфекции, т. к. это является абсолютным противопоказанием для назначения этиотропной терапии ХГС (интерферон + рибавирин).
Смешанную форму гепатита (ХГС + токсический гепатит) диагностировали у 71 (55,5 %) пациента. Хронический гепатит с исходом в цирроз печени отмечался в 22 случаях (17,2 %). Данные представлены на рисунке 3.
Распределение больных в зависимости от пола и возраста представлено в таблице 2.
Чаще ХГС встречался у пациентов мужского пола (в группе 1 — 64,3%, в группе 2 — 71,1%) и в наиболее трудоспособном возрасте от 20 до 30 лет (в группе 1 — 68,8%, в группе 2 — 80%).
Распределение пациентов в зависимости от сопутствующей патологии и оппортунистических инфекций представлено в таблице 3.
Как видно из представленных данных, сопутствующие заболевания встречались в обеих группах, однако, учитывая, что пациенты группы 2 лечились амбулаторно и к врачу обращались в плановом порядке, частота встречаемости сопутствующей патологии у данной группы больных была достоверно ниже. Анализ больных показал, что в группе 1 наиболее часто встречались такие заболевания, как обострение хронического панкреатита (31,3%), обострение хронического бронхита (27,3%), пневмония (19,5%). Выявлена высокая частота наркомании в обеих группах (25,8% и 13,3% соответственно). Часть больных в группе 1 не получала стандартную (этиотропную) терапию ХГС вследствие ряда объективных и субъективных факторов, которые приведены в таблице 4.
Из представленных данных видно, что чаще всего стандартная терапия не назначалась из-за злоупотребления алкоголем и/или приема психоактивных веществ, а также вследствие выраженного иммунодефицита (СД4+ лимфоциты менее 350 клеток). Также большую группу составили пациенты, которым стандартная терапия назначалась, но была отменена в результате развития побочных эффектов (16,4%) и/или неэффективности лечения (6,2%).
В качестве иллюстрации отказа от противовирусной терапии ХГС приводим собственное наблюдение.
Клинический пример
Выводы
Таким образом, в результате анализа клинических и лабораторных данных больных ХГС и ВИЧ-инфекцией можно сделать следующие выводы:
среди пациентов с ХГС и ВИЧ-инфекцией, поступающих в стационар, преобладают больные со смешанной формой гепатита (ХГС + токсический гепатит);
среди токсических причин поражения печени в абсолютном большинстве случаев отмечено злоупотребление алкоголем;
большинство пациентов имеют генотип 1 вируса гепатита С;
основные причины неназначения противовирусной терапии гепатита С: злоупотребление алкоголем, наркомания, низкий иммунный статус и отказ пациента от лечения.
Гнойный перитонит – это отграниченное или тотальное воспалительное поражение брюшины, протекающее с участием гноеродной флоры. В начальной стадии проявляется симптомами основного заболевания (аппендицита, холецистита, язвы желудка и т. д.), затем присоединяются сильные боли в животе, метеоризм, парез кишечника, водно-электролитные нарушения. При отсутствии должного лечения патология приводит к смерти больного. Заподозрить перитонит можно на основании изменений в общем анализе крови и мочи, биохимических анализах; данных ультразвуковой и рентгенологической картины, диагностической лапароскопии. Лечение только хирургическое.
Общие сведения
Гнойный перитонит – инфекционно-неспецифическое или специфическое воспаление брюшины, возникшее вследствие острых хирургических заболеваний или травм органов брюшной полости. К проявлениям гнойного перитонита относят интоксикацию, парез кишечника, тяжелейшие водно-ионные расстройства. Отсутствие патогенетического лечения приводит к развитию недостаточности различных органов и систем: легких, печени, почек, местного и общего кровотока и т. д.
По данным абдоминальных хирургов, перитонит формируется у каждого пятого пациента, поступающего в стационар по поводу острых хирургических заболеваний. Чаще всего развитие данного состояния провоцирует острая хирургическая патология (85%), реже – травмы органов брюшной полости (5-8%), в 5-10% случаев патология становится осложнением оперативного вмешательства. Примерно у двух третей больных, умерших от хирургических заболеваний и травм живота, причиной смерти является гнойный перитонит.
Причины
Наиболее часто развитие гнойного перитонита сопряжено с нарушением целостности стенки какого-либо органа брюшной полости и попаданием его содержимого на брюшину. Такой механизм возникновения патологии может наблюдаться при гангренозно-перфоративном аппендиците, перфоративной язве желудка или двенадцатиперстной кишки, перфоративном холецистите, разрыве кишечной стенки инородным телом, разрыве дивертикула желудка или кишечника, прорастании опухолью стенки желудка или кишки с развитием перфорации.
Еще одним путем распространения инфекции на брюшину является контактный – воспаление переходит с очага инфекции на висцеральный или париетальный листок брюшины без нарушения целостности органа. Этот механизм развития воспаления брюшины присущ флегмонозному аппендициту, гнойному холециститу, панкреатиту, воспалительным гинекологическим заболеваниям. Также инфекция может попасть в брюшную полость при травмах, когда происходит нарушение целостности органов брюшной полости, во время и после операций (при ненадлежащем соблюдении правил асептики и антисептики, послеоперационного ухода за больным).
Причиной развития гнойного перитонита крайне редко может служить один инфекционный агент, обычно к этому заболеванию приводит обсеменение органов брюшной полости несколькими видами бактерий одновременно. Патология может иметь различную этиологию: неспецифическую - при инфицировании стафилококками, стрептококками, кишечной палочкой, энтерококками, протеем, синегнойной палочкой, акинетобактером, лактобациллами, клостридиями, пневмококками; специфическую - при попадании в брюшную полость микобактерий туберкулеза, нейссерий гонореи и др.
Кроме того, гнойный перитонит может осложнять течение изначально асептического перитонита (развивается при повреждении брюшины излившейся кровью, желчью, соком поджелудочной железы, мочой, желудочным соком), а также особых форм воспаления брюшины (канцероматозного, ревматоидного, паразитарного, гранулематозного перитонита).
Классификация
По механизму развития перитонит делится на первичный, вторичный и третичный. Первичный процесс формируется на фоне экстраперитонеальной патологии (чаще всего это туберкулеза, реже - красной волчанки, поражения почек у детей, цирроза печени, хронической почечной недостаточности у взрослых). Возбудитель попадает в брюшную полость гематогенным либо лимфогенным путем. У женщин возможно проникновение инфекции в брюшную полость через фаллопиевы трубы. Данная разновидность патологии встречается не более чем в 1% случаев.
Вторичный гнойный перитонит формируется на фоне воспалительных заболеваний органов брюшной полости, травм живота, перенесенных операций. Составляет 85-90% всех случаев патологии. Третичный процесс возникает у ослабленных больных с тяжелым иммунодефицитом, перенесших несколько абдоминальных хирургических вмешательств. Протекает вяло, симптоматика стертая. Очень часто приводит к развитию тяжелейшего сепсиса, является причиной смерти пациентов.
По причине развития гнойный перитонит может быть перфоративным, аппендикулярным, травматическим, послеоперационным и криптогенным (когда причину выявить не удалось). По распространенности состояние бывает местным (затрагивает менее двух зон) – чаще всего это периаппендикулярный инфильтрат или абсцесс; и неотграниченным. Неотграниченный перитонит по распространенности также разделяется на диффузный (поражается от 2 до 5 зон) и разлитой (отмечается воспаление в двух и более этажах брюшной полости).
Отдельно выделяют три стадии заболевания: реактивную, токсическую и терминальную. Реактивная стадия длится 12-24 часов, характеризуется возникновением или усилением болей в животе, появлением рвоты, повышением температуры тела до фебрильных цифр. Токсическая стадия продолжается 2-3 суток, для нее характерно появление неукротимой рвоты, артериальной гипотензии на фоне тахикардии. Терминальная стадия – признак наступления необратимых изменений в брюшине, омертвения нервных окончаний, нарушения жизненно важных функций. При перфоративном перитоните процесс протекает быстрее, терминальная стадия может начаться уже через сутки от начала заболевания.
Симптомы гнойного перитонита
Начало обычно характеризуется симптоматикой основного заболевания, в дальнейшем присоединяются специфические симптомы воспаления брюшины. Первым признаком перитонита является разлитая боль в животе. Она не имеет четкой локализации, достаточно интенсивная, усиливается при физических нагрузках, кашле и чихании. Интенсивность боли вначале нарастает, в последующем может снижаться вплоть до полного исчезновения. Стихание боли на фоне ухудшения общего состояния пациента является плохим прогностическим признаком и говорит о некрозе брюшины и ее нервных окончаний.
Наряду с возникновением боли наблюдается рефлекторная изнуряющая тошнота, переходящая в непрекращающуюся рвоту сначала содержимым желудка, затем кишечным и в конечной стадии – каловым содержимым. Связано это с выраженным парезом кишечника. Тяжелая рвота приводит к обезвоживанию, электролитному дисбалансу. Из-за пареза петли кишечника перераздуты, переполнены газами, пациента беспокоит выраженный метеоризм.
Больной занимает вынужденное положение на боку с подтянутыми к груди коленями (так меньше выражено натяжение брюшины, интенсивность боли снижается). Кожные покровы сухие, бледные, возможно появление мраморного рисунка, акроцианоза. Кисти и стопы холодные, влажные, ногти синие. Слизистая губ, ротовой полости тоже сухая, язык обложен грязно-серым налетом. Появляется неприятный запах изо рта.
В начальных стадиях заболевания тахикардия и артериальная гипертензия постепенно нарастают, в терминальной стадии отмечается несоответствие пульса и давления. Пациент становится беспокойным, отмечает чувство страха. Частота дыхания постепенно нарастает, а в терминальной стадии вдохи становятся редкими, поверхностными. В случае выраженного водно-ионного дефицита развивается полиорганная недостаточность, которая проявляется постепенным помрачением сознания вплоть до комы, развитием судорог.
При пальпации наблюдается выраженное защитное напряжение мышц живота (доскообразный живот), положительный симптом Щеткина-Блюмберга (при нажатии на брюшную стенку отмечается болезненность, которая значительно усиливается при резком отнятии пальпирующей руки). При перкуссии живота отмечается тимпанит (звонкий звук, свидетельствующий о наличии большого количества газа), в отлогих местах притупление звука (говорит о выпоте в брюшной полости).
При аускультации в первые часы заболевания возможно некоторое усиление перистальтики, затем она постепенно ослабевает до полного прекращения. На поздних стадиях при аускультации слышен шум плеска, шум падающей капли. Газы и стул не отходят. Мочи из-за обезвоживания и интоксикации выделяется очень мало, она концентрированная, темно-коричневого цвета. Ректальное и вагинальное исследование очень болезненны.
Диагностика
При подозрении на развитие гнойного перитонита диагностические мероприятия должны осуществляться предельно быстро. Пациентам показано проведение УЗИ органов брюшной полости (выявляет перераздутые петли кишечника, отсутствие перистальтики, выпот в брюшной полости), обзорной рентгенографии ОБП (на ней будут видны кишечные арки, уровни жидкости, затемнение в отлогих местах, где скапливается жидкость). Мультисрезовая спиральная компьютерная томография дает возможность детально рассмотреть изменения органов брюшной полости, определить наличие выпота.
При сомнительных результатах перечисленнных исследований может потребоваться консультация врача-эндоскописта, проведение диагностической лапароскопии. Во время лапароскопии виден воспалительный процесс брюшины, гнойно-фибринозный выпот, можно обнаружить источник развития гнойного перитонита (аппендицит, холецистит, прободную язву). Полученный при лапароскопии выпот отправляют в бактериологическую лабораторию для определения чувствительности выделенной микрофлоры к антибиотикам.
В общем анализе крови выявляются выраженные воспалительные изменения (лейкоцитоз может достигать 40х10 9 ), сдвиг лейкоформулы влево, анемия, тромбоцитопения. В биохимическом анализе крови отмечается гемоконцентрация, снижение уровней калия, хлора, натрия (из-за рвоты).
Лечение гнойного перитонита
В ряде случаев пациенты изначально госпитализируются в отделение гастроэнтерологии с клиникой обострения заболеваний органов пищеварительного тракта. Если гастроэнтеролог заподозрит катастрофу в брюшной полости, больной немедленно переводится в отделение абдоминальной хирургии, где сразу начинается предоперационная подготовка. Она включает в себя устранение обезвоживания, восстановление объема циркулирующей крови, коррекцию электролитных нарушений. С этой целью проводится инфузия изотонических полиионных растворов, белковых и коллоидных препаратов.
Производится коррекция различных расстройств, вызванных токсическим поражением внутренних органов, эндотоксикозом, основным и фоновыми заболеваниями. Предоперационная подготовка должна быть полностью завершена в течение 2-4 часов. Важным аспектом лечения является эрадикация инфекции. Антибиотики широкого спектра действия начинают вводить еще до операции, чтобы создать достаточную их концентрацию в тканях и предупредить дальнейшее распространение инфекции после оперативного вмешательства. Длительное введение антибиотиков должно сопровождаться назначением противогрибковых средств.
Основной метод лечения гнойного перитонита – оперативный. Наличие гнойного выпота предполагает проведение расширенной лапаротомии срединным доступом для обеспечения хорошего обзора и возможности тщательной санации брюшной полости. Производится ревизия органов, интубация кишечника, санация (отсасывание выпота, промывание брюшной полости растворами антисептиков) и дренирование брюшной полости. При необходимости осуществляется поиск первичного очага инфекции, резекция некротизированного кишечника.
В послеоперационном периоде могут потребоваться повторные релапаротомии с санацией и дренированием брюшной полости, разделением спаек. Продолжается коррекция гемодинамических, метаболических и водно-электролитных нарушений, антибактериальная и дезинтоксикационная терапия. Необходимо обеспечить нормальный газообмен, восполнить потребность в питательных веществах и энергии, устранить функциональную недостаточность кишечника. Показано рациональное обезболивание, симптоматическое лечение.
Прогноз и профилактика
Прогноз гнойного перитонита неблагоприятный – летальность составляет не менее 25-30%, а при развитии полиорганной недостаточности достигает 90%. Исход в значительной степени зависит от своевременности операции. При начале лечения в первые часы заболевания благоприятный исход наступает в 90% случаев, при проведении операции в первые сутки – в половине случаев, если от начала заболевания прошло более трех суток, выживает лишь 10% пациентов. Единственный метод профилактики – своевременное лечение заболеваний, которые могут привести к этому тяжелому осложнению.
Перитонит – локальное или диффузное воспаление серозного покрова брюшной полости – брюшины. Клиническими признаками перитонита служат боль в животе, напряжение мышц брюшной стенки, тошнота и рвота, задержка стула и газов, гипертермия, тяжелое общее состояние. Диагностика перитонита основывается на сведениях анамнеза, выявлении положительных перитонеальных симптомов, данных УЗИ, рентгенографии, вагинального и ректального исследований, лабораторных тестов. Лечение перитонита всегда хирургическое (лапаротомия, санация брюшной полости) с адекватной предоперационной и послеоперационной антибактериальной и дезинтоксикационной терапией.
МКБ-10
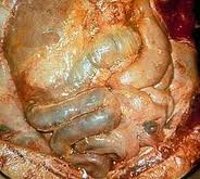
Общие сведения
Перитонит – тяжелое осложнение воспалительно-деструктивных заболеваний органов брюшной полости, сопровождающееся выраженными местными и общими симптомами, развитием полиорганной недостаточности. Летальность от перитонита в гастроэнтерологии составляет 20-30%, а при наиболее тяжелых формах достигает 40-50%.
Брюшина (peritoneum) образована двумя переходящими друг в друга серозными листками - висцеральным и париетальным, покрывающими внутренние органы и стенки брюшной полости. Брюшина является полупроницаемой, активно функционирующей мембраной, выполняющей множество важных функций: резорбтивную (всасывание экссудата, продуктов лизиса, бактерий, некротических тканей); экссудативную (выделение серозной жидкости), барьерную (механическая и противомикробная защита органов брюшной полости) и др. Важнейшим защитным свойством брюшины является ее способность к отграничению воспаления в брюшной полости благодаря фиброзным спайкам и рубцам, а также клеточным и гуморальным механизмам.

Причины перитонита
Этиологическим звеном при перитоните выступает бактериальная инфекция, в большинстве случаев представленная неспецифической микрофлорой желудочно-кишечного тракта. Это могут быть грамотрицательные (энтеробактер, кишечная палочка, протей, синегнойная палочка) и грамположительные (стафилококки, стрептококки) аэробы; грамотрицательные (фузобактерии, бактероиды) и грамположительные (эубактерии, клостридии, пептококки) анаэробы. В 60-80% наблюдений перитонит вызывается ассоциацией микробов – чаще кишечной палочкой и стафилококком. Реже развитие перитонита бывает обусловлено специфической микрофлорой – гонококками, гемолитическим стрептококком, пневмококками, микобактериями туберкулеза. Поэтому для выбора рационального лечения перитонита первостепенное значение имеет бактериологический посев содержимого брюшной полости с определением чувствительности выделенной микрофлоры к антибактериальным препаратам.
В соответствии с этиологией различают первичные (идиопатические) и вторичные перитониты. Для первичных перитонитов характерно проникновение микрофлоры в брюшную полость лимфогенным, гематогенным путем или по фаллопиевым трубам. Непосредственное воспаление брюшины может быть связано с сальпингитами, энтероколитами, туберкулезом почек или гениталий. Первичные перитониты встречаются нечасто – в 1-1,5% случаев.
В клинической практике гораздо чаще приходится сталкиваться с вторичными перитонитами, развивающимися вследствие детсруктивно-воспалительных заболеваний или травм брюшной полости. Наиболее часто перитонит осложняет течение аппендицита (перфоративного, флегмонозного, гангренозного), прободной язвы желудка или 12-перстной кишки, пиосальпинкса, разрыва кисты яичника, кишечной непроходимости, ущемления грыжи, острой окклюзии мезентериальных сосудов, болезни Крона, дивертикулита, флегмонозно-гангренозного холецистита, панкреатита, панкреонекроза и др. заболеваний.
Посттравматический перитонит развивается вследствие закрытых и открытых повреждений органов брюшной полости. Причинами послеоперационных перитонитов могут служить несостоятельность анастомозов, дефекты наложения лигатур, механическое повреждение брюшины, интраоперационное инфицирование брюшной полости, гемоперитонеум при неадекватном гемостазе. Отдельно выделяют канцероматозные, паразитарные, гранулематозные, ревматоидные перитониты.
Классификация
По этиологии различают бактериальные и абактериальные (асептические, токсико-химические) перитониты. Последние развиваются в результате раздражения брюшины агрессивными неинфекционными агентами (желчью, кровью, желудочным соком, панкреатическим соком, мочой, хилезной жидкостью). Абактериальный перитонит довольно быстро принимает характер микробного вследствие присоединения инфекционных возбудителей из просвета ЖКТ.
В зависимости от характера перитонеального выпота различают серозный, фибринозный, геморрагический, желчный, гнойный, каловый, гнилостный перитонит.
По клиническому течению перитониты делятся на острые и хронические. С учетом распространенности поражения по поверхности брюшины различают отграниченный (местный) и диффузный перитонит. К вариантам местного перитонита относят поддиафрагмальный, аппендикулярный, подпеченочный, межкишечный, тазовый абсцессы. О диффузном перитоните говорят, когда воспаление брюшины не имеет тенденции к ограничению и четких границ. По степени поражения брюшины диффузные перитониты подразделяются на местные (развивающиеся в одной анатомической области, вблизи от источника инфекции), распространенные (охватывают несколько анатомических областей) и общие (при тотальном поражении брюшины).
В развитии перитонита принято выделять раннюю фазу (до 12 часов), позднюю (до 3-5 суток) и конечную (от 6 до 21 дня от начала заболевания). В соответствии с патогенетическими изменениями различают реактивную, токсическую и терминальную стадии перитонита. В реактивную стадию перитонита (24 часа от момента поражения брюшины) отмечается гиперергическая реакция на раздражение брюшины; в эту фазу максимально выражены местные проявления и менее выражены общие симптомы. Токсическая стадия перитонита (от 4 до 72 часов) характеризуется нарастанием интоксикации (эндотоксическим шоком), усилением и преобладанием общих реакций. В терминальной стадии перитонита (позднее 72 часов) происходит истощение защитно-компенсаторных механизмов, развиваются глубокие нарушения жизненно важных функций организма.
Симптомы перитонита
В реактивном периоде перитонита отмечаются абдоминальные боли, локализация и интенсивность которых определяются причиной воспаления брюшины. Первоначально боль имеет четкую локализацию в области источника воспаления; может иррадиировать в плечо или надключичную область вследствие раздражения нервных окончаний диафрагмы гнойно-воспалительным экссудатом. Постепенно боли распространяются по всему животу, становятся незатихающими, теряют четкую локализацию. В терминальном периоде в связи с параличом нервных окончаний брюшины болевой синдром становится менее интенсивным.
Характерными симптомами перитонита служат тошнота и рвота желудочным содержимым, которые в начальной стадии возникают рефлекторно. В более поздние сроки перитонита рвотная реакция обусловлена парезом кишечника; в рвотных массах появляется примесь желчи, затем - содержимое кишечника (фекальная рвота). Вследствие выраженного эндотоксикоза развивается паралитическая кишечная непроходимость, клинически проявляющаяся задержкой стула и неотхождением газов.
При перитоните, даже в самой ранней стадии, обращает на себя внимание внешний вид больного: страдальческое выражение лица, адинамия, бледность кожных покровов, холодный пот, акроцианоз. Пациент принимает вынужденное положение, облегчающее боль – чаще на боку или спине с поджатыми к животу ногами. Дыхание становится поверхностным, температура повышенная, отмечается гипотония, тахикардия 120-140 уд. в мин., не соответствующая субфебрилитету.
Диагностика
Изменения в общем анализе крови при перитоните (лейкоцитоз, нейтрофилез, увеличение СОЭ) свидетельствуют о гнойной интоксикации. Лапароцентез (пункция брюшной полости) и диагностическая лапароскопия показаны в неясных для диагностики случаях и позволяют судить о причине и характере перитонита.
Лечение перитонита
Выявление перитонита служит основанием для экстренного хирургического вмешательства. Лечебная тактика при перитоните зависит от его причины, однако во всех случаях в ходе операции придерживаются одинакового алгоритма: показано выполнение лапаротомии, проведение изоляции или удаления источника перитонита, осуществление интра- и послеоперационной санации брюшной полости, обеспечение декомпрессии тонкой кишки.
Послеоперационное ведение пациентов с перитонитом включает инфузионную и антибактериальную терапию, назначение иммунокорректоров, переливание лейкоцитарной массы, внутривенное введение озонированных растворов и др. Для противомикробной терапии перитонита чаще используется комбинация цефалоспоринов, аминогликозидов и метронидазола, обеспечивающая воздействие на весь спектр возможных возбудителей.
С целью стимуляции перистальтики и восстановления функций ЖКТ показано назначение антихолинэстеразных препаратов (неостигмина), ганглиоблокаторов (димеколония йодид, бензогексония), антихолинэргических средств (атропина), препаратов калия, физиопроцедур (электростимуляции кишечника, диадинамотерапии).
Прогноз и профилактика
Успех лечения перитонита во многом зависит от срока выполнения операции и полноты объема послеоперационной терапии. Летальность при разлитом перитоните достигает 40% и более; гибель пациентов наступает от гнойной интоксикации и полиорганной недостаточности.
Поскольку большинство перитонитов являются вторичными, их профилактика требует своевременного выявления и лечения основной патологии - аппендицита, язвы желудка, панкреатита, холецистита и др. Предупреждение послеоперационного перитонита включает адекватный гемостаз, санацию брюшной полости, проверку состоятельности анастомозов при абдоминальных операциях.
Оппортунистические инфекции – это большая группа инфекционных заболеваний, которые развиваются у пациентов с различными типами иммунодефицитов и нехарактерны для людей с нормальным иммунным статусом. Патологии поражают любую систему органов и вызывают соответствующую симптоматику. К общим клиническим проявлениям относят длительный субфебрилитет, лимфаденопатию, астенический синдром. Диагностика оппортунистических инфекций включает серологические, молекулярно-генетические, бактериологические и другие методы детекции патогенных возбудителей. Программы лечения сочетают длительную этиотропную терапию с методами иммунокоррекции.
МКБ-10


Общие сведения
Проблема оппортунистических инфекций (ОПИ) становится все более актуальной, что вызвано ростом числа ВИЧ-инфицированных людей, разработкой эффективных, однако агрессивных методов лечения онкопатологии. При этом многие люди являются бессимптомными носителями возбудителей ОПИ: 60% инфицированы цитомегаловирусом, 90% – герпесвирусами 1 и 2 типов, около 30% – токсоплазмой. Учитывая клинический полиморфизм и отсутствие специфических симптомов, диагностика и лечение оппортунистических болезней представляет серьезную мультидисциплинарную проблему.

Причины
Для манифестации оппортунистических инфекций необходимо заражение патогенным микроорганизмом: вирусом, бактерией, грибком или простейшим. Известно более 20 типичных возбудителей ОПИ, в современной инфектологии этот перечень постоянно дополняется. Болезнь возникает при активации латентного очага, реже выступает следствием текущего заражения. Первостепенную важность играет нарушение иммунного статуса вследствие следующих патологий:
- ВИЧ-инфекция. Самая частая причина, поскольку на определенном этапе снижения числа CD4-клеток ОПИ развиваются у каждого больного. Инфекционные болезни используются для диагностики заражения ВИЧ и определения стадии заболевания, поэтому в данном контексте они называются СПИД-ассоциируемыми или СПИД-индикаторными патологиями.
- Злокачественные новообразования. Патофизиология любого опухолевого процесса предполагает угнетение собственной иммунной системы пациента и снижение ее ответа на чужеродные агенты. При этом уменьшается число Т-клеток, угнетаются процессы фагоцитоза. Проблема наиболее выражена при гемобластозах – лейкозах и лимфомах.
- Хроническая соматическая патология. Угнетение активности клеточного и гуморального иммунитета происходит при эндокринных заболеваниях (сахарный диабет, гипотиреоз), почечной недостаточности, тяжелых воспалительных патологиях ЖКТ.
- Ятрогенные факторы. Применение цитостатиков и других видов иммуносупрессоров является важным предиктором развития оппортунистических инфекций. Подобная ситуация наблюдается в группе пациентов после лучевой терапии, трансплантации органов и костного мозга.
- Первичные иммунодефициты. В эту группу относят все виды иммунной недостаточности, которые имеют генетический характер или возникают внутриутробно под влиянием тератогенов. Они манифестируют в раннем детском возрасте, проявляются затяжными оппортунистическими болезнями, которые с трудом подаются терапии.
Патогенез
Хотя возбудители оппортунистических инфекций таксономически неоднородны, в развитии заболеваний большую роль имеют общие особенности их патогенности и вирулентности. К свойствам микроорганизмов, вызывающих ОПИ, относят возможность длительного и даже пожизненного персистирования в организме человека, внутриклеточное паразитирование, склонность к поражению клеток моноцитарно-макрофагальной системы.
Инфекции активизируются при иммунодефицитах любой этиологии и склонны к хроническому течению с периодическими обострениями, поражением жизненно важных органов. Для оппортунистических болезней характерна лимфогенная и гематогенная диссеминация микроорганизмов, образование эктопических очагов. Собственный иммунитет пациента не способен оказать должное сопротивление инфекционному агенту, лекарственные средства не всегда эффективны.
Сложность и опасность оппортунистических инфекций заключается еще и в том, что они способны подавлять естественный иммунитет. В последние годы говорят о возможности пожизненной иммуносупрессии при персистировании герпесвирусов. Таким образом, формируется порочный круг, когда иммунодефицит провоцирует активацию возбудителей ОПИ, которые усугубляют явления иммунной недостаточности и потенциируют дальнейшие полиорганные нарушения.

Классификация
Единой систематизации оппортунистических инфекций на сегодня не существует. Условно возбудителей объединяют в 3 группы: патогены, которые поражают лиц с нарушениями иммунитета и здоровых людей; микробы, встречающиеся только при иммунодефицитах; вакцинные штаммы микроорганизмов. Общепринятой является классификация ОПИ согласно типу возбудителя:
Симптомы оппортунистических инфекций
В инфектологии выделяют общую группу клинических признаков, которая встречается при любом варианте ОПИ. Наиболее типичным симптомом признан длительный субфебрилитет, которые возникает без видимой причины и беспокоит пациента больше 1 месяца. Нередко повышение температуры возникает после перенесенного ОРВИ или кишечной инфекции, которые выступают пусковым фактором активации оппортунистического заболевания.
Вторым настораживающим симптомом считается лимфаденопатия – увеличение лимфатических улов. Чаще всего в процесс вовлекается лимфоидная ткань шейно-подчелюстной, подмышечной и паховой зоны. Лимфоузлы достигают диаметра около 1 см, имеют плотноэластическую консистенцию, не спаяны с окружающими тканями и безболезненны при ощупывании.
Третью группу общей симптоматики оппортунистических инфекций составляет астенический синдром. Он включает слабость, повышенную утомляемость, снижение переносимости умственных и физических нагрузок. Зачастую пациенты жалуются на ночную потливость, головокружения и головные боли, нарушения сна. При длительном существовании таких признаков наблюдается когнитивная дисфункция, эмоциональная подавленность, стойкое снижение работоспособности.
Пациента с иммуносупрессией должен насторожить кашель и одышка – типичные признаки туберкулеза и пневмоцистной пневмонии (ПЦП), снижение остроты зрения – возможное проявление цитомегаловирусного ретинита, длительно сохраняющаяся диарея – признак криптоспоридиоза, микроспоридиоза. Жжение и сухость полости рта в комбинации с эрозиями и белыми налетами на слизистых указывают на орофарингеальный кандидоз.
Оппортунистические болезни не имеют четко выраженного тропизма. Один и тот же вид возбудителя может вызывать миокардит, плеврит, артрит, менингит и другие нозологические формы. Зачастую они имитируют симптомы хронических соматических заболеваний, с которыми пациенты длительно и безрезультатно посещают врачей разных специальностей. Исключение составляет пневмоцистоз, который в основном поражает легкие с развитием ПЦП.
Осложнения
Оппортунистические инфекции – тяжелые и потенциально смертельные заболевания. Среди пациентов с терминальными стадиями ВИЧ-инфекции ОПИ составляют 90% в структуре летальности, оставшиеся 10% приходятся на саркому Капоши, лимфомы и прочие неинфекционные последствия СПИДа. Смертность при церебральном токсоплазмозе составляет около 33%, при криптококковом менингите – 20-30%, при пневмоцистной пневмонии – 10-20%.
Особую тревогу вызывает сочетание нескольких видов оппортунистических заболеваний у одного пациента. Микробные ассоциации более характерны для позднего периода и хронического течения основной патологии, вызвавшей иммунодефицит. Сочетанное инфицирование типично для иммунокомпрометированных пациентов, пребывающих на стационарном лечении: у 40-50% больных в послеоперационном периоде, у 70-80% при перитонитах и плевритах.
Распространение оппортунистических инфекций негативно сказывается на репродуктивном здоровье населения. Они обуславливают многие случаи самопроизвольного прерывания беременности, эмбриопатий и фетопатий, задержки внутриутробного развития. Дети, рожденные от матерей с ОПИ, находятся в группе риска развития заболеваний новорожденных, перинатальных энцефалопатий.

Диагностика
Обследование пациентов проводится мультидисциплинарной командой врачей, в которую входят врач-инфекционист, иммунолог, онколог и другие узкопрофильные специалисты. Большое клиническое значение имеет выяснения времени и условий появления симптоматики, характера течения заболевания, наличия факторов риска иммунодефицитных состояний. Для подтверждения оппортунистических инфекций проводятся следующие методы диагностики:
Лечение оппортунистических инфекций
В процессе лечения практикующие инфекционисты сталкиваются с такими нюансами, как множественная лекарственная устойчивость патогенов, гетерогенность популяции возбудителей, низкая активность естественных иммунных факторов. Основу терапии составляет прием этиотропных противомикробных препаратов: антибиотиков, антимикотиков, противопротозойных и противовирусных. Лечение ОПИ имеет ряд особенностей:
- в основном назначаются комбинации из 2-3 препаратов для повышения их эффективности;
- продолжительность противомикробной терапии повышается в 1,5-2 раза и более в сравнении с лечением инфекционных болезней у иммунокомпетентных лиц;
- при подборе терапии ориентируются не только на клиническую картину болезни, но и на текущий иммунный статус пациента;
- при вирусных инфекциях обязательно назначаются этиотропные препараты, тогда как у людей без иммуносупрессии противовирусные средства используют только по показаниям.
Для успешного лечения ОПИ требуется максимально возможное восстановление иммунной функции. В группе пациентов с ВИЧ-инфекцией назначаются протоколы антиретровирусной терапии (ВААРТ), чтобы повысить число CD4-клеток и улучшить отдаленные прогнозы. При ведении онкологических больных используются персональные схемы иммуномодуляторов, экспериментальные направления иммунотерапии и регенеративной медицины с применением стволовых клеток.
Прогноз и профилактика
Течение любой инфекции на фоне иммуносупрессии является сложным и непредсказуемым, однако усовершенствованные протоколы лечения позволяют достичь стойкой ремиссии или даже полного излечения. К прогностически неблагоприятным факторам относят пожилой и старческий возраст, неправильно подобранную терапию, невозможность проведения иммунокоррекции основного заболевания.
При иммунодефицитах показана первичная медикаментозная профилактика оппортунистических инфекций. Применяют сульфаниламиды, макролиды‑азалиды, противогрибковые средства. При положительной пробе Манту или недавнем контакте с больным туберкулезом назначается химиопрофилактика сроком на 6 месяцев. Также пациентам рекомендовано строго соблюдать противоэпидемические меры, в периоде резкой иммуносупрессии необходимо пребывание в стерильных боксах.
3. Клинические особенности сочетанных оппортунистических инфекций (обзор)/ В.В. Шкарин, Н.В. Саперкин// Медицинский альманах. – 2017. – №4.
4. Оппортунистические инфекции: проблемы и перспективы/ Под общ. ред. проф. Ю.В. Редькина, О.А. Мирошника, В.В. Лобова. – 2002.
Читайте также:

