Первичный билиарный цирроз печени аутоиммунный гепатит
Обновлено: 26.07.2024
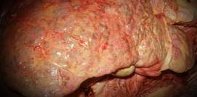
Первичный билиарный цирроз печени – хронический прогрессирующий деструктивно-воспалительный процесс аутоиммунного генеза, поражающий внутрипеченочные желчные протоки и приводящий к развитию холестаза и цирроза. Первичный билиарный цирроз печени проявляется слабостью, кожным зудом, болью в правом подреберье, гепатомегалией, ксантелазмами, желтухой. Диагностика включает исследование уровня печеночных ферментов, холестерина, антимитохондриальных антител (АМА), IgM, IgG, морфологическое исследование биоптата печени. Лечение первичного билиарного цирроза печени требует проведения иммуносупрессивной, противовоспалительной, антифибротической терапии, приема желчных кислот.
Общие сведения
Первичный билиарный цирроз печени развивается преимущественно у женщин (соотношение заболевших женщин и мужчин 10:6), средний возраст пациентов составляет 40-60 лет. В отличие от вторичного билиарного цирроза печени, при котором имеет место обструкция внепеченочных желчных протоков, первичный билиарный цирроз протекает с постепенным разрушением внутрипеченочных междольковых и септальных желчных протоков. Это сопровождается нарушением желчевыделения и задержкой токсических продуктов в печени, приводя к прогрессирующему снижению функциональных резервов органа, фиброзу, циррозу и печеночной недостаточности.

Причины первичного билиарного цирроза печени
Этиология первичного билиарного цирроза печени неясна. Заболевание часто носит семейный характер. Отмеченная связь между развитием первичного билиарного цирроза печени и антигенами гистосовместимости (DR2DR3, DR4, В8), характерными для патологии аутоиммунного характера. Данные факторы указывают на иммуногенетическую составляющую заболевания, обусловливающую наследственную предрасположенность.
Первичный билиарный цирроз печени протекает с системным поражением эндокринных и экзокринных желез, почек, сосудов и довольно часто сочетается с сахарным диабетом, гломерулонефритом, васкулитом, синдромом Шегрена, склеродермией, тиреоидитом Хашимото, ревматоидным артритом, системной красной волчанкой, дерматомиозитом, целиакией, миастенией, саркоидозом. Поэтому первичный билиарный цирроз печени находится в фокусе внимания не только гастроэнтерологии, но и ревматологии.
В развитии первичного билиарного цирроза печени не исключается пусковая роль бактериальных агентов и гормональных факторов, инициирующих иммунные реакции.
Стадии первичного билиарного цирроза печени
В соответствии с происходящими гистологическими изменениями выделяют 4 стадии первичного билиарного цирроза печени: дуктальную (стадию хронического негнойного деструктивного холангита), дуктуллярную (стадию пролиферации внутрипеченочных протоков и перидуктального фиброза), стадию фиброза стромы и стадию цирроза.
Дуктальная стадия перевичного билиарного цирроза печени протекает с явлениями воспаления и деструкции междольковых и септальных желчных протоков. Микроскопическая картина характеризуется расширением портальных трактов, их инфильтрацией лимфоцитами, макрофагами, эозинофилами. Поражение ограничено портальными трактами и не распространяется на паренхиму; признаки холестаза отсутствуют.
В дуктуллярной стадии, соответствующей пролиферации холангиол и перидуктальному фиброзу, отмечается распространение лимфоплазмоцитарной инфильтрации в окружающую паренхиму, снижение числа функционирующих внутрипеченочных протоков.
В стадии фиброза стромы на фоне воспаления и инфильтрации печеночной паренхимы отмечается появление соединительнотканных тяжей, соединяющих портальные тракты, прогрессирующая редукция желчных протоков, усиление холестаза. Происходит некроз гепатоцитов, нарастают явления фиброза в портальных трактах.
В четвертой стадии развивается развернутая морфологическая картина цирроза печени.
Симптомы первичного билиарного цирроза печени
Течение первичного билиарного цирроза печени может быть бессимптомным, медленным и быстропрогрессирующим. При бессимптомном течении заболевание обнаруживается на основании изменений лабораторных показателей – повышения активности щелочной фосфатазы, увеличения уровня холестерина, выявления АМА.
Наиболее типичным клиническим проявлением первичного билиарного цирроза печени служит кожный зуд, который предшествует появлению желтушного окрашивания склер и кожи. Кожный зуд может беспокоить в течение нескольких месяцев или лет, поэтому часто пациенты все это время безуспешно лечатся у дерматолога. Беспокоящий зуд приводит к множественным расчесам кожи спины, рук и ног. Желтуха обычно развивается спустя 6 месяцев-1,5 года после начала кожного зуда. У пациентов с первичным билиарным циррозом отмечаются боли в правом подреберье, гепатомегалия (селезенка чаще всего не увеличена).
В развернутой стадии первичного билиарного цирроза печени появляется субфебрилитет, нарастает желтуха, ухудшение самочувствия, истощение. Прогрессирующий холестаз вызывает диспепсические расстройства – диарею, стеаторею. Осложнениями первичного билиарного цирроза печени могут служить желчнокаменная болезнь, язвы 12-перстной кишки, холангиокарциномы.
В поздней стадии развивается остеопороз, остеомаляция, патологические переломы, геморрагический синдром, варикозное расширение вен пищевода. Гибель пациентов наступает от печеночноклеточной недостаточности, которая может провоцироваться портальной гипертензией, желудочно-кишечными кровотечениями, асицтом.
Диагностика первичного билиарного цирроза печени
Ранними диагностическими критериями первичного билиарного цирроза печени служат изменения биохимических показателей крови. При исследовании печеночных проб отмечается повышение активности щелочной фосфатазы, уровня билирубина, аминотрансфераз, рост концентрации желчных кислот. Характерно увеличение содержания меди и снижение уровня железа в сыворотке крови. Уже на ранних стадиях определяется гиперлипидемия – увеличение уровня холестерина, фосфолипидов, b-липопротеидов. Определяющее значение имеет выявление титра антимитохондриальных антител выше 1:40, повышение уровня IgM и IgG.
По данным УЗИ печени и МРТ печени внепеченочные желчные протоки не изменены. Для подтверждения первичного билиарного цирроза показано проведение биопсии печени с морфологическим исследованием биоптата.
Первичный билиарный цирроз печени дифференцируют от заболеваний, протекающих с обструкцией гепетобилиарного тракта и холестазом: стриктурами, опухолями печени, конкрементами, склерозирующим холангитом, аутоиммунным гепатитом, карциномой внутрипеченочных протоков, хроническим вирусным гепатитом С и др. В ряде случаев с целью дифференциальной диагностики прибегают к проведению ультрасонографии желчных путей, гепатобилисцинтиграфии, чрескожной чреспеченочной холангиографии, ретроградной холангиографии.
Лечение первичного билиарного цирроза печени
Терапия первичного билиарного цирроза печени включает назначение иммуносупрессивных, противовоспалительных, антифибротических препаратов, желчных кислот. Диета при первичном билиарном циррозе печени требует достаточного употребления белка, поддержания необходимой калорийности пищи, ограничения жиров.
К препаратам патогенетической терапии относятся глюкокортикостероиды (будесонид), цитостатики (метотрексат), колхицин, циклоспорин А, урсодезоксихолевая кислота. Длительный и комплексный прием препаратов позволяет улучшить биохимические показатели крови, замедлить прогрессирование морфологических изменений, развитие портальной гипертензии и цирроза.
Симптоматическая терапия первичного билиарного цирроза печени включает мероприятия, направленные на уменьшение кожного зуда (УФО, седативные препараты), потери костной массы (прим витамина D, препаратов кальция) и др. При рефрактерных к основной терапии формах первичного билиарного цирроза показана как можно более ранняя трансплантация печени.
Прогноз первичного билиарного цирроза печени
При бессимптомном течении первичного билиарного цирроза печени продолжительность жизни составляет 15-20 и более лет. Прогноз у пациентов с клиническими проявлениями значительно хуже – гибель от печеночной недостаточности наступает примерно в течение 7-8 лет. Значительно отягощает течение первичного билиарного цирроза печени развитие асцита, варикозного расширения вен пищевода, остеомаляции, геморрагического синдрома.
После трансплантации печени вероятность рецидива первичного билиарного цирроза достигает 15-30%.
Аутоиммунный гепатит – это прогрессирующее хроническое воспаление печени, протекающее с признаками перипортального или более обширного поражения и наличием аутоантител к печеночным клеткам. Клинические проявления включают астеновегетативные расстройства, желтуху, боли в правом подреберье, кожные сыпи, гепатомегалию и спленомегалию, аменорею у женщин, гинекомастию – у мужчин. Диагностика основывается на серологическом выявлении антинуклеарных антител (ANA), тканевых антител к гладкой мускулатуре (SMA), антител к микросомам печени и почек и др., гипергаммаглобулинемии, увеличения титра IgG, а также данных биопсии печени. Основу лечения составляет иммуносупрессивная терапия глюкокортикостероидами.
МКБ-10
Общие сведения
В структуре хронических гепатитов в современной гастроэнтерологии на долю аутоиммунного поражения печени приходится 10-20% случаев у взрослых и 2% - у детей. Женщины заболевают аутоиммунным гепатитом в 8 раз чаще, чем мужчины. Первый возрастной пик заболеваемости приходится на возраст до 30 лет, второй – на период постменопаузы. Течение аутоиммунного гепатита носит быстропрогрессирующий характер, при котором довольно рано развивается цирроз печени, портальная гипертензия и печеночная недостаточность, ведущая к гибели пациентов.

Причины
Вопросы этиологии аутоиммунного гепатита изучены недостаточно. Считается, что в основе развития аутоиммунного гепатита лежит сцепленность с определенными антигенами главного комплекса гистосовместимости (HLA человека) - аллелями DR3 или DR4, выявляющаяся у 80-85% пациентов. Предположительными триггерными факторами, запускающими аутоиммунные реакции у генетически предрасположенных индивидуумов, могут выступать вирусы Эпштейна–Барр, гепатитов (А, В, С), кори, герпеса (HSV-1 и HHV-6), а также некоторые лекарственные препараты (например, интерферон). Более чем у трети пациентов с аутоиммунным гепатитом выявляются и другие аутоиммунные синдромы – тиреоидит, болезнь Грейвса, синовит, язвенный колит, болезнь Шегрена и др.
Патогенез
Основу патогенеза аутоиммунного гепатита составляет дефицит иммунорегуляции: снижение субпопуляции Т-супрессорных лимфоцитов, что приводит к неуправляемому синтезу В-клетками IgG и разрушению мембран клеток печени – гепатоцитов, появлению характерных сывороточных антител (ANA, SMA, анти-LKM-l).
Классификация
В зависимости от образующихся антител различают аутоиммунный гепатит I (анти-ANA, анти-SMA позитивный), II (анти-LKM-l позитивный) и III (анти-SLA позитивный) типов. Каждый из выделяемых типов заболевания характеризуется своеобразным серологическим профилем, особенностями течения, откликом на иммуносупрессивную терапию и прогнозом.
- I тип. Протекает с образованием и циркуляцией в крови антинуклеарных антител (ANA) – у 70-80% пациентов; антигладкомышечных антител (SMA) у 50-70% больных; антител к цитоплазме нейтрофилов (pANCA). Аутоиммунный гепатит I типа чаще развивается в возрасте от 10 до 20 лет и после 50 лет. Характеризуется хорошим откликом на иммуносупрессивную терапию, возможностью достижения стойкой ремиссии в 20% случаев даже после отмены кортикостероидов. При отсутствии лечения в течение 3 лет формируется цирроз печени.
- II тип. В крови у 100% пациентов присутствуют антитела к микросомам печени и почек 1-го типа (анти-LKM-l). Данная форма заболевания развивается в 10-15% случаях аутоиммунного гепатита, преимущественно в детском возрасте и характеризуется высокой биохимической активностью. Аутоиммунный гепатит II типа более резистентен к иммуносупрессии; при отмене препаратов часто наступает рецидив; цирроз печени развивается в 2 раза чаще, чем при аутоиммунном гепатите I типа.
- III тип. Образуются антитела к растворимому печеночному и печеночио-панкреатическому антигену (анти-SLA и анти-LP). Довольно часто при этом типе выявляются ASMA, ревматоидный фактор, антимитохондриальные антитела (АМА), антитела к антигенам печеночной мембраны (антиLMA).
К вариантам атипичного аутоиммунного гепатита относят перекрестные синдромы, включающие также признаки первичного билиарного цирроза, первичного склерозирующего холангита, хронического вирусного гепатита.
Симптомы аутоиммунного гепатита
В большинстве случаев патология манифестирует внезапно и в клинических проявлениях не отличается от острого гепатита. Вначале протекает с выраженной слабостью, отсутствием аппетита, интенсивной желтухой, появлением темной мочи. Затем в течение нескольких месяцев разворачивается клиника аутоиммунного гепатита. Реже начало заболевания постепенное; в этом случае преобладают астеновегетативные расстройства, недомогание, тяжесть и боли в правом подреберье, незначительная желтуха. У части пациентов аутоиммунный гепатит начинается с лихорадки и внепеченочных проявлений.
Период развернутых симптомов аутоиммунного гепатита включает выраженную слабость, чувство тяжести и боли в правом подреберье, тошноту, кожный зуд, лимфаденопатию. Для аутоиммунного гепатита характерны непостоянная, усиливающаяся в периоды обострений желтуха, увеличение печени (гепатомегалия) и селезенки (спленомегалия). У трети женщин при аутоиммунном гепатите развивается аменорея, гирсутизм; у мальчиков может наблюдаться гинекомастия. Типичны кожные реакции: капиллярит, пальмарная и волчаночноподобная эритема, пурпура, акне, телеангиэктазии на коже лица, шеи и рук. В периоды обострений аутоиммунного гепатита могу наблюдаться явления преходящего асцита.
К системным проявлениям аутоиммунного гепатита относится рецидивирующий мигрирующий полиартрит, затрагивающий крупные суставы, но не приводящий к их деформации. Достаточно часто аутоиммунный гепатит протекает в сочетании с язвенным колитом, миокардитом, плевритом, перикардитом, гломерулонефритом, тиреоидитом, витилиго, инсулинозависимым сахарным диабетом, иридоциклитом, синдромом Шегрена, синдромом Кушинга, фиброзирующим альвеолитом, гемолитической анемией.
Диагностика
Аутоиммунный гепатит диагностируется в ходе консультации гепатолога или гастроэнтеролога. Критериями патологии служат серологические, биохимические и гистологические маркеры. Согласно международным критериям, об аутоиммунном гепатите можно говорить в случае, если:
- в анамнезе отсутствуют гемотрансфузии, прием гепатотоксичных препаратов, злоупотребление алкоголем;
- в крови не обнаруживаются маркеры активной вирусной инфекции (гепатитов А, В, С и др.);
- уровень γ-глобулинов и IgG превышает нормальные показатели в 1,5 и более раза;
- значительно повышена активность АсТ, АлТ;
- титры антител (SMA, ANA и LKM-1) для взрослых выше 1:80; для детей выше 1: 20.
Биопсия печени с морфологическим исследованием образца тканей позволяет выявить картину хронического гепатита с признаками выраженной активности. Гистологическими признаками аутоиммунного гепатита служат мостовидные или ступенчатые некрозы паренхимы, лимфоидная инфильтрация с обилием плазматических клеток. Инструментальные исследования (УЗИ печени, МРТ печени и др.) при аутоиммунном гепатите не имеют самостоятельного диагностического значения.
Лечение аутоиммунного гепатита
Патогенетическая терапия заболевания заключается в проведении иммуносупрессивной терапии глюкокортикостероидами. Такой подход позволяет снизить активность патологических процессов в печени: повысить активность Т-супрессоров, уменьшить интенсивность аутоиммунных реакций, разрушающих гепатоциты.
Обычно иммуносупрессивная терапия при аутоиммунном гепатите проводится преднизолоном или метилпреднизолоном в начальной суточной дозе 60 мг (1-ю неделю), 40 мг (2-ю неделю), 30 мг (3-4-ю недели) со снижением до 20 мг в качестве поддерживающей дозы. Уменьшение суточной дозировки проводят медленно, учитывая активность клинического течения и уровень сывороточных маркеров. Поддерживающую дозу пациент должен принимать до полной нормализации клинико-лабораторных и гистологических показателей. Лечение аутоиммунного гепатита может продолжаться от 6 месяцев до 2-х лет, а иногда и на протяжении всей жизни.
При неэффективности монотерапии возможно введение в схему лечения аутоиммунного гепатита азатиоприна, хлорохина, циклоспорина. В случае неэффективности иммуносупрессивного лечения аутоиммунного гепатита в течение 4-х лет, множественных рецидивах, побочных эффектах терапии ставится вопрос и трансплантации печени.
Прогноз и профилактика
При отсутствии лечения аутоиммунного гепатита заболевание неуклонно прогрессирует; спонтанные ремиссии не наступают. Исходом аутоиммунного гепатита служит цирроз печени и печеночная недостаточность; 5-летняя выживаемость не превышает 50%. С помощью своевременной и четко проводимой терапии удается достичь ремиссии у большинства пациентов; при этом выживаемость в течение 20 лет составляет более 80%. Трансплантация печени дает результаты, сопоставимые с лекарственно достигнутой ремиссией, 5-летний прогноз благоприятен у 90% пациентов.
При аутоиммунном гепатите возможна лишь вторичная профилактика, включающая регулярное наблюдение гастроэнтеролога (гепатолога), контроль активности печеночных ферментов, содержания γ-глобулинов, аутоантител для своевременного усиления или возобновления терапии. Пациентам с аутоиммунным гепатитом рекомендуется щадящий режим с ограничением эмоциональных и физических нагрузок, соблюдение диеты, отвод от профилактической вакцинации, ограничение приема лекарственных препаратов.
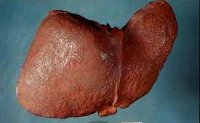
Билиарный цирроз печени – это хроническое прогрессирующее заболевание, характеризующееся постепенным замещением печеночной ткани фиброзными рубцами. Патология длительное время никак не проявляется. На поздних стадиях характерны внешние малые печеночные знаки, портальная гипертензия, печеночная энцефалопатия. Предварительный диагноз цирроза устанавливается на основании УЗИ, КТ гепатобилиарной системы, ЭРХПГ, клинических и биохимических анализов. Окончательный диагноз ставится на основании биопсии печени и обнаружения антимитохондриальных антител. Нехирургическое лечение состоит из симптоматической терапии, дезинтоксикации, витаминотерапии и соблюдения диеты. На поздних стадиях показана пересадка печени.
МКБ-10
Общие сведения
Билиарный цирроз печени – тяжелейшая патология печени, при которой нормальная печеночная ткань замещается фиброзной. Чаще встречается у женщин после сорока лет, а общая распространенность составляет 40-50 случаев на 1 млн населения. Замечена тесная связь заболевания с наследственными факторами – среди родственников эта патология встречается в 570 раз чаще. На сегодняшний день патогенез первичного билиарного цирроза до конца не изучен, поэтому неизвестны и точные причины его возникновения.
Более чем в 95% случаев заболевания в крови определяются антимитохондриальные антитела. Однако ученые до сих пор не могут выяснить, почему поражаются только митохондрии печеночной ткани, а в других тканях этого не происходит. Коварство данного недуга в его скрытом начале – очень часто биохимические признаки болезни могут быть случайно выявлены при обследовании по поводу других заболеваний. Течение заболевания прогрессирующее, на поздних стадиях поражения печени показана ее пересадка.
Причины
Специалисты в сфере современной гастроэнтерологии и гепатологии связывают развитие первичного билиарного цирроза с аутоиммунными нарушениями в организме. Заболевание это имеет наследственную природу: случаи билиарного цирроза очень часты в семейном кругу. Об аутоиммунной природе болезни говорит и ее связь с другими заболеваниями этой группы: ревматоидным артритом, тубулярным почечным ацидозом, синдромом Шегрена, аутоиммунным тиреоидитом и другими.
Провоцируют начало процесса и другие заболевания: врожденные пороки развития и приобретенные деформации желчных путей, желчнокаменная болезнь, внутрипеченочные опухоли и увеличенные лимфоузлы в печени, кисты желчного протока, первичный склерозирующий или гнойный холангит. Также провоцировать начало болезни может грамотрицательная инфекция – энтеробактерии, которые имеют на своей поверхности схожие с митохондриальными антигены.
Вторичный билиарный цирроз развивается на фоне заболеваний, приводящих к застою желчи во внепеченочных желчных путях. К ним относятся атрезии, камни и стриктуры желчных протоков, рак внепеченочных желчных путей, киста холедоха и муковисцидоз.
Патогенез
Несмотря на обнаружение антител к митохондриям практически у всех больных первичной формой цирроза, установить связь этих антител с разрушением клеток печени так и не удалось. Известно, что начинается болезнь с асептического воспаления желчных путей, выраженной пролиферации эпителия и прогрессирующего фиброза в области протоков. Постепенно воспалительный процесс стихает, но фиброз продолжает распространяться на ткань печени, вызывая ее необратимое разрушение.
В крови при данном заболевании определяются не только антитела к митохондриям и гладкомышечным клеткам, но и другие иммунные расстройства: повышение уровня иммуноглобулина М, нарушение выработки В- и Т-лимфоцитов. Все это говорит в пользу аутоиммунного патогенеза первичного билиарного цирроза.
Классификация
Правильная классификация первичного билиарного цирроза важна для выработки тактики дальнейшего лечения. Функция печени оценивается по шкале Чайлд-Пью. В этой шкале учитывается наличие асцита, энцефалопатии, цифры билирубина, альбумина и протромбиновый индекс (показатель свертывающей системы крови). В зависимости от суммы баллов, присвоенных за эти показатели, различают стадии компенсации цирроза:
- Класс А. Характеризуется минимальным количеством баллов, продолжительностью жизни до 20 лет, выживаемостью после полостных операций более 90%.
- Класс В. Продолжительность жизни меньше, а летальность после полостных операций более 30%.
- Класс С. Продолжительность жизни не более 3 лет, а смертность после полостных операций больше 80%.
Присвоение пациенту класса В или С говорит о необходимости пересадки печени. В России широко используется шкала METAVIR, при которой степень фиброзирования оценивается на основе данных биопсии, градация степени – от 0 до 4; 4 степень говорит о наличии цирроза.
Симптомы билиарного цирроза
На ранних стадиях симптоматика цирроза неспецифична и стерта. Так, в большинстве случаев жалобы начинаются с кожного зуда. Более половины больных предъявляют жалобы на периодический зуд кожи, а каждого десятого беспокоит нестерпимый зуд с расчесами на коже. Чаще зуд появляется за полгода, а то и несколько лет до появления желтухи, но иногда эти два симптома могут возникать одновременно. Также характерными признаками начинающегося цирроза являются повышенная утомляемость, сонливость, сухость глаз. Изредка первым признаком заболевания может быть тяжесть и боль в правом подреберье. При обследовании обнаруживается повышенный уровень гамма-глобулинов, нарушение соотношения АСТ к АЛТ, склонность к артериальной гипотензии.
По мере развития заболевания появляются другие признаки. Внешне цирроз проявляется группой малых печеночных признаков: сосудистыми звездочками на коже; покраснением лица, ладоней и стоп; увеличением слюнных желез; желтушностью кожи и всех слизистых; сгибательной контрактурой кистей рук. Изменяются и ногти пациента – становятся широкими и плоскими (деформация ногтей по типу "часовых стекол"), на них появляются поперечные белесоватые полосы; ногтевые фаланги утолщаются ("барабанные палочки"). Вокруг суставов и на лице, веках образуются белесоватые узелки – жировые отложения.
Кроме внешних проявлений, появляются симптомы портальной гипертензии: за счет повышения давления в воротной вене селезенка увеличивается в размерах, в венах органов брюшной полости возникает застой – формируется варикозное расширение геморроидальных и пищеводных вен, на передней брюшной стенке образуется расширенная венозная сеть по типу "головы медузы". Венозный застой приводит к пропотеванию жидкости в брюшную полость с формированием асцита, в тяжелых случаях – перитонита.
Осложнения
Чем более выражено поражение печени, тем выше вероятность возникновения осложнений билиарного цирроза. Из-за нарушения усвоения витамина Д примерно у трети больных возникает остеопороз, проявляющийся патологическими переломами. Нарушение всасывания жиров приводит к дефициту всех жирорастворимых витаминов (А, К, Д, Е), что проявляется признаками полигиповитаминоза. С калом выводятся излишки жиров – стеаторея. У пятой части больных появляется сопутствующий гипотиреоз, развиваются миелопатии и нейропатии.
Варикозное расширение вен пищевода и прямой кишки может привести к массивному кровотечению с развитием геморрагического шока. Поражение печени приводит к дисфункции других органов и систем: развиваются гепаторенальный, печеночно-легочной синдромы, гастро- и колопатия. Из-за того, что печень не выполняет функцию очистки организма от токсинов, они свободно циркулируют в крови и оказывают токсическое воздействие на головной мозг, вызывая печеночную энцефалопатию. Очень часто в финале билиарного цирроза может развиться гепатоцеллюлярная карцинома (злокачественная опухоль), полное бесплодие.
Диагностика
При наличии признаков застоя желчи оценивается клинический и биохимический профиль, для начальных стадий билиарного цирроза печени характерно повышение уровня щелочной фосфатазы и Г-ГТП, смещение соотношения АЛТ и АСТ, уровень билирубина повышается позже. Исследуется иммунный статус пациента: повышается уровень иммуноглобулина М, антител к митохондриям, также отмечается повышение уровня ревматоидного фактора, антител к гладкомышечным волокнам, тканям щитовидной железы, ядрам клеток (антинуклеарные антитела).
Признаки фиброзирования печени могут выявляться на УЗИ печени и КТ гепатобилиарной системы, однако окончательный диагноз можно поставить только после проведения биопсии печени. Даже при исследовании биоптата характерные для билиарного цирроза изменения в печени можно обнаружить только на ранних стадиях заболевания, потом морфологическая картина становится одинаковой для всех видов цирроза.
Выявление или исключение заболеваний, приводящих к развитию вторичного билиарного цирроза, возможно путем проведения дополнительных исследований: УЗИ органов брюшной полости, МР-панкреатохолангиографии, ЭРХПГ.
Лечение билиарного цирроза печени
В лечении этого заболевания принимают активное участие врач-гепатолог, терапевт, гастроэнтеролог и хирург. Задачами терапии при циррозе является остановка прогрессирования цирроза и устранение явлений печеночной недостаточности. Замедлить процессы фиброза можно с помощью иммуносупрессивных препаратов (угнетают аутоиммунный процесс), желчегонных средств (устраняют холестаз).
Симптоматическая терапия заключается в предупреждении и лечении осложнений цирроза: печеночная энцефалопатия устраняется с помощью диетотерапии (уменьшение доли белка, увеличение растительного компонента пищи), дезинтоксикационной терапии, уменьшение портальной гипертензии достигается с помощью диуретиков. Обязательно назначаются поливитаминные препараты, для улучшения пищеварения назначаются ферменты. При циррозе класса А и В рекомендуется ограничение физических и эмоциональных нагрузок, а при классе С - полный постельный режим.
Наиболее действенным методом лечения билиарного цирроза является трансплантация печени. После пересадки более 80% пациентов выживают в последующие пять лет. Рецидив первичного билиарного цирроза возникает у 15% пациентов, однако у большей части больных результаты хирургического лечения превосходны.
Прогноз и профилактика
Предупредить появление билиарного цирроза практически невозможно, но значительно снизить его вероятность может отказ от алкоголя и курения, регулярное обследование у гастроэнтеролога при наличии случаев заболевания в семье, полноценное питание и здоровый образ жизни.
Прогноз патологии неблагоприятный. Появление первых симптомов возможно лишь через десять лет от начала болезни, однако продолжительность жизни при начавшемся циррозе не более 20 лет. Прогностически неблагоприятным является быстрое прогрессирование симптомов и морфологической картины, пожилой возраст, ассоциированные с циррозом аутоиммунные заболевания. Наиболее неблагоприятным в плане прогноза является исчезновение зуда, уменьшение ксантоматозных бляшек, снижение уровня холестерина в крови.
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменени
 |
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменения, приводящие к фиброзу и циррозу печени (ЦП). Генетически детерминированная предрасположенность к этому заболеванию выявлена во многих исследованиях. Доказано, что большая часть больных АГ имеют фенотип по антигенам главного комплекса гистосовместимости HLA-B8, HLA-DR4, DR3 и DR52a. Пусковой агент пока неизвестен, однако есть некоторые данные о роли вирусов гепатита [31, 26], кори [27], Эпштейн-Барр вируса [32], а также интерферона (ИФН) [14] как инициаторов начала АГ.
| Аутоиммунный гепатит (АГ) — хроническое воспалительное заболевание печени невыясненой этиологии, характеризующееся определенными лабораторными, клиническими и гистологическими признаками. Болеют им в основном женщины молодого возраста |
АГ — это прогрессирующее воспаление печени, характеризующееся наличием некрозов в перипортальной, септальной зонах (ступенчатые некрозы) или, более широко, лобулярным гепатитом (ЛГ), гипергаммаглобулинемией и аутоантителами в сыворотке крови [7]. Портальные тракты печени на биоптатах находят расширенными с накоплением в них обширных инфильтратов, имеющих разный клеточный состав: лимфоциты, макрофаги, плазматические клетки. ЛГ — дольковый гепатит, когда некрозы выявляются во второй и третьей зонах ацинусов, а также обнаруживается внутридольковая лимфоидноклеточная инфильтрация, которая выражена значительно больше, чем инфильтрация портальных трактов. ЛГ является частью гистологической картины АГ, если он выявляется одновременно с перипортальным гепатитом. По гистологической картине на АГ может указывать, кроме вышеперечисленного, наличие многоядерных гепатоцитов [2].
Наконец, картина фиброза может присутствовать в той или иной степени даже при умеренной степени активности АГ, а в запущенных случаях, особенно при отсутствии эффективной терапии, формируются мостовидные некрозы и, в конце концов, ЦП.
Хотя гистологическая картина при АГ очень характерна, все-таки она неспецифична. Отличительной чертой АГ является обнаружение в биоптатах преимущественно плазматических клеток, так как выраженная инфильтрация в портальной, перипортальной зоне, вовлечение в процесс долек печени — в равной мере присущи и хроническому вирусному гепатиту (ХВГ).
Одной из основных клинических характеристик АГ является обнаружение аутоантител к клеточным и субклеточным структурам клеток разных органов [22]. Типичным маркером АГ являются антитела к ядрам клеток — ANA. Из других маркеров выявляются антитела к клеткам гладкой мускулатуры (SMA), антитела к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек (LKM), антитела к растворимому печеночному антигену (SLA), антитела к антигенам (цитокератины 8, 18) мембран гепатоцитов — LMA.
Клинические проявления АГ очень разнообразны [1, 3, 4]. С одной стороны, встречаются бессимптомные формы, когда случайно выявляется повышение АЛТ, АСТ, а с другой — острое начало болезни с тяжелым течением вплоть до развития фульминантного гепатита (ФГ).
Нередко заболевание начинается незаметно с астеновегетативных проявлений, болей в области правого предреберья, незначительной желтухи. Однако у большинства больных АГ начало болезни острое, как при остром вирусном гепатите (ОВГ), и при осмотре пациента врач впервые выявляет признаки хронического гепатита (ХГ) — телеангиоэктазии, пальмарную эритему, увеличение печени и селезенки, а также изменения в анализах крови — гипергаммаглобулинемию, увеличение IgG, снижение содержания общего белка, резкое увеличение СОЭ. Лейкопения и тромбоцитопения наблюдаются у больных на поздних стадиях болезни или при развившихся гиперспленизме и синдроме портальной гипертензии.
Когда АГ впервые проявляется желтухой, как при ОВГ, приходится дифференцировать его от гепатитов А, В, Е и особенно С, при котором антитела в сыворотке крови могут появляться через достаточно продолжительное время после начала болезни. Желтуха у пациентов с АГ может быть разной степени выраженности, часто появляется на поздних стадиях заболевания, бывает непостоянной и усиливается в период обострений. В общем же у большинства больных чаще всего изменяются аминотрансферазы, нежели щелочная фосфотаза (ЩФ) или билирубин.
| Аутоиммунный гепатит был выделен из группы болезней печени и впервые описан как отдельная нозология в начале 50-х годов [33]. В научной литературе существовал под разными названиями. Термин люпоидный гепатит, который часто использовался в нашей стране, ввел в 1956 году Дж. Маккей с соавторами в журнале Lancet, так как при этом заболевании нередко в сыворотке крови больных выявлялись волчаночные клетки. Потом, в последующие годы, люпоидный, или классический, АГ стали называть аутоиммунным активным хроническим гепатитом, но в 1993 году Международная группа по изучению болезней печени предложила термин АГ, а также критерии установления его диагноза [17] |
Для АГ характерно поражение кожи в виде геморрагической сыпи, оставляющей после себя пигментацию. Из других симптомов встречаются волчаночная и узловатая эритемы, очаговая склеродермия, пальмарная эритема и телеангиоэктазии. У всех больных выявляются изменения в эндокринной системе — аменорея, угри, гирсутизм, стрии. Диагностическое значение отдельных симптомов болезни при АГ неодинаково. К наиболее значимым относятся длительная лихорадка и арталгии. В большинстве случаев АГ они присутствуют одновременно, являясь наиболее частыми и постоянно встречающимися жалобами больных [4].
Один из вариантов начала АГ — появление лихорадки с внепеченочными проявлениями, из которых следует назвать аутоиммунный тиреоидит, язвенный колит, гипертиреоидизм, гемолитическая анемия, идеопатическая тромбоцитопения, сахарный диабет, целиакия, полимиозит, фиброзирующий альвеолит, гломерулонефрит и т. д. Желтуха при этом варианте появляется позже [20].
Часто АГ сопровождается бесплодием, однако при возникновении беременности и последующих родах на фоне компенсированного процесса это не влияет на течение АГ и судьбу ребенка даже при постоянном приеме преднизолона (ПР) [30]. Беременность на стадии сформировавшегося ЦП и синдрома портальной гипертензии, которые выявляются у трети больных на момент выявления АГ, нежелательна [3].
В отличие от ХВГ течение АГ у больных непрерывно прогрессирующее, без самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических процессов не происходит. Прогноз течения АГ хуже у пациентов с острым началом болезни по типу ОВГ, с наличием признаков холестаза, асцитом, повторными эпизодами острой печеночной энцефалопатии (ОПЭ). Как правило, больные, пережившие критический период, имеют лучший прогноз.
Диагноз АГ выставляется на основании соответствия лабораторных и гистологических данных, отсутствия маркеров ВГ, исключения злоупотребления алкоголем и контактов с препаратами крови, гипотоксическими веществами, повышения гамма-глобулинов не менее чем в 1,5 раза выше нормы. Повреждение желчных протоков, отложение меди, гемосидероз, при которых также могут выявляться ЛГ и ступенчатые некрозы, предполагают другую причину ХГ и исключают диагноз АГ. ANA, SMA и LRM-1 должны быть в титрах не менее 1:80 у взрослых и 1:20 у детей (рекомендации Международной группы, 1993).
Дифференциальный диагноз между АГ и другими аутоиммунными заболеваниями, в основном первичным билиарным циррозом (ПБЦ), первичным склерозирующим холангитом (ПСХ), ХВГ основывается на клинических, гистологических и иммунологических параметрах. Однако нередко выявляется так называемый overlap-синдром, когда одновременно у пациентов выявляются признаки АГ и вышеперечисленных хронических заболеваний печени. Далее они будут описываться как варианты АГ [7, 13]. Предполагаемый диагноз АГ в данном случае подразумевает сходство с клиникой АГ (жалобы на слабость, арталгии, миалгии), а биохимический анализ крови отражает преимущественно изменения холестатического порядка, имеет место кожный зуд разной степени выраженности. Пациенты с такими вариантами АГ могут быть обоего пола, любого возраста, но все же чаще это женщины в возрасте до 40 лет и моложе. На гистологии находят перипортальный гепатит с или без ЛГ, часто с поражением желчных протоков, жировой дистрофией гепатоцитов и лимфоидной инфильтацией портальных трактов в виде гранулем [7, 10].
Деление АГ на подтипы практического значения не имеет, однако следует иметь в виду, что подтип 2 АГ может быть связан с гепатитом С либо HCV может индуцировать появление АГ у генетически предрасположенных лиц. Нет данных о различиях гистологической картины при отдельных подтипах АГ
Большинство больных с ПБЦ можно точно отделить от пациентов с АГ с помощью характерных лабораторных и иммунологических данных. Однако при этом варианте наряду с характерными параметрами АГ нередко выявляются гистологические признаки холангита и АМА (антитела к антигенам внутренней поверхности мембраны митохондрий), что очень характерно для ПБЦ. Наиболее важным для подтверждения диагноза ПБЦ является обнаружение АМА подтипа М2 [6]. АМА выявляются у 20-27% больных АГ в разных титрах [19]. Это может отражать диагностические ошибки в определении иммуносерологических маркеров, другие заболевания или одну из стадий ПБЦ. Если у больного повышена щелочная фосфатаза (ЩФ), IgM сыворотки крови и обнаружена АМА — вероятен диагноз ПБЦ. Трех-шестимесячный курс лечения стероидами помогает расшифровать преобладающую патологию — при реакции на лечение можно говорить о превалировании АГ.
Установлено, что у 16% больных АГ выявляется язвенный колит (ЯК), наличие которого характерно для пациентов с ПСХ (от 40 до 60% больных). К тому же при таком сочетании — АГ и признаки ПСХ (наличие ЯК, поражение желчных протоков, слабый ответ на стероиды) — также обнаруживают фенотип HLA-B8, HLADR3, HLA DR4. Поэтому наличие кожного зуда у больных АГ и повышение ЩФ более чем в четыре раза против нормы указывают на необходимость проведения холангиографии (ХГР) и вероятность развития варианта АГ и ПСХ. Поражения желчных протоков несовместимы с диагнозом АГ. Они редки, но когда появляются у больных АГ с сопутствующей патологией кишечника или атипичным повышением ЩФ, можно допустить этот вариант АГ. Окончательный диагноз зависит от результатов ХГР. ХГР выявляет признаки склерозирующего холагнита у 42% больных АГ и ЯК. Но иногда ХГР бывает в норме у 14% больных ПСХ при гистологически подтвержденном диагнозе. Об этом необходимо помнить [24].
АГ считается заболеванием невирусной этиологии, но у 4% больных АГ выявляются антиHCV и еще у 4% — маркеры вируса гепатита В. Больные АГ, имеющие атипичное течение болезни либо плохо отвечающие на терапию стероидами, нередко имеют в сыворотке крови HCV RNA. Любопытно, что 11% больных ХВГ имеют SMA и 28% — ANA. У 62% выявляются аутоантитела к щитовидной железе и ревматоидный фактор. Большая часть этих больных имеют низкие титры SMA и ANA (1:80 и ниже), а пациенты с точным диагнозом АГ — SMA в титрах 1:160 и ANA 1:320. Поэтому больные АГ и с выявляемыми SMA или ANA в титрах ниже 1:320 могут быть отнесены к группе с превалированием вирусного заболевания [11].
Тем не менее пациенты с АГ имеют более выраженную инфильтрацию портальных трактов плазматическими клетками, более выраженные воспалительные изменения в дольках и больше ступенчатых и перисептальных некрозов по сравнению с пациентами ХВГ, особенно ХГС. У больных ХВГ/ХГС наоборот — в портальных трактах преобладает лимфоидноклеточная инфильтрация, чаще выявляется стеатоз и повреждения желчных протоков, особенно при ХГС.
У 13% взрослых больных с признаками АГ не обнаруживаются аутоантитела, а все остальные признаки — иммунологические, биохимические и гистологические, а также возраст и пол соответствуют критериям постановки диагноза АГ. Что важно, эти больные также хорошо реагируют на лечение стероидами [8, 9]. Отмечено, что с течением времени при динамическом наблюдении у некоторых из них появляются соответствующие аутоантитела, характерные для АГ.
Несмотря на разнообразие клинической картины, при АГ основой лечения является назначение преднизолона (ПР). Ответ на данную терапию — один из критериев постановки диагноза АГ. Целесообразность назначения ПР при АГ доказана в многочисленных исследованиях и обусловлена редкими самопроизвольными ремиссиями в течении болезни, высокой смертностью и ухудшением качества жизни [12, 18, 23, 28, 29]. При назначении ПР смертность удается снизить в течение пяти лет с 50 до 20%, а частоту индуцированных ремиссий довести до 80%. У большинства больных ремиссии появляются в течение первых двух лет терапии и почти у всех в последующие четыре года лечения.
Лечение ПР следует назначать всем больным АГ высокой степени активности с фиброзом и циррозом или без. У больных с умеренной степенью активности болезни назначение ПР часто определяется наличием жалоб и симптомов болезни. Больные без симптомов и с умеренной степенью активности процесса по гистологической картине не нуждаются в лечении, но должны тщательно и регулярно наблюдаться для своевременного выявления признаков прогрессирования болезни.
Как правило, начальная доза ПР составляет 20-30 мг/сутки с последующим постепенным снижением ее до поддерживающей — обычно 10 мг/сутки. Из всех схем лечения предпочтителен ежедневный прием однократно утром. Осложнения терапии наблюдаются при дозе более 10 мг/сутки. Нет точных рекомендаций по отмене или снижению дозы иммуносупрессоров, некоторые больные могут долго оставаться в ремиссии после отмены ПР.
Однако было установлено, что у большей части больных в дальнейшем, даже спустя несколько лет после ремиссии, появляются признаки обострения и часто требуется большая доза для ее достижения [15].
Комбинация ПР с азатиоприном (АЗА) может уменьшить побочные эффекты (при этом требуется небольшая доза ПР). Лучше давать 10 мг/сутки ПР с 50 мг/сутки АЗА, чем один ПР, но в большей дозе. Сам АЗА не способен индуцировать ремиссию, но его добавление к ПР поддерживает ее даже в дозе 1 мг/кг/сутки. При неэффективности лечения АЗА назначали 6-меркаптопурин с хорошим эффектом [25]. У 20% больных АГ не удается достигнуть ремиссии — чаще всего у пациентов с признаками ЦП, лиц молодого возраста, при длительном анамнезе болезни до начала терапии ПР и у больных с фенотипом HLA-B8, DR3 [28]. Побочные эффекты при назначении иммунодепрессантов редкие, это в основном диспепсический синдром, сыпи, кушингоидизм, нарушение роста и развития у детей, сахарный диабет и остеопороз у женщин в менопаузе. АЗА может индуцировать миелосупрессию, возникновение катаракты, обладает онкогенным и, возможно, тератогенным эффектами.
Лечение вариантов АГ представляет определенные трудности. Основа терапии, препарат выбора для начала лечения — и здесь ПР. При сочетании АГ и ПБЦ назначают ПР в дозе 20 мг/сутки от трех до шести месяцев, а при отсутствии эффекта — урсодезоксихолевую кислоту (УДХК) или ее коммерческие препараты (урсофальк, урсосан, урсодиол и др.) по 13-15 мг/сутки от трех до шести месяцев.
Тактика лечения больных с вариантом АГ и ПСХ та же, что и при АГ и ПБЦ. Больные АГ и ЯК отвечают на терапию ПР хуже, чем больные с одним АГ (не столь часты ремиссии, чаще и быстрее выявляют прогрессирование к ЦП). Эти пациенты, возможно, должны лечиться УДХК большими дозами (до 15-20 мг/кг/сутки), если признаки холестаза выражены.
При сочетании АГ и ХВГ назначают ПР 20 мг/сутки или 10 мг/сутки ПР и 50 мг/сутки АЗА на три–шесть месяцев, если превалируют признаки АГ. Рекомбинантный ИФН в дозе 3 млн. МЕ/сутки три раза в неделю до 6 месяцев назначают при выявлении признаков ХВГ и маркеров репликации вируса либо неэффективности стероидной терапии [21, 5]. Лечение таких больных представляет собой сложную задачу, так как ПР усиливает вирусную репликацию, а ИФН может усилить иммуноопосредованный печеночно-клеточный некроз, перевести ХВГ в АГ, который до этого мог быть в латентном состоянии, обострить течение болезни с развитием внепеченочных аутоиммунных проявлений, индуцировать выброс антител с неясным клиническим значением. Поэтому лечение состоит в правильном определении преобладания тех или иных клинических синдромов или признаков. В любом случае обострение болезни печени или внезапное появление признаков аутоиммунного заболевания у пациентов с признаками АГ, но с преобладанием вирусного поражения указывает на необходимость прерывания лечения ИФН.
Тактика лечения больных криптогенным ХГ состоит в назначении ПР 10-20 мг/сутки вместе с 50 мг/сутки АЗА до появления ремиссии или максимального эффекта.
Литература
Читайте также:

