Плазматическая мембрана есть у клеток вирусов и бактерий
Обновлено: 24.04.2024
Приближается сезон простуд, а значит вопрос вирусов, бактерий и, конечно же, способов лечения вызываемых ими недугов вновь станет актуальным.
Известно, что, несмотря на то, что многие инфекционные заболевания вызываются именно вирусами, нередко при них назначаются антибиотики. Но эффективны ли эти препараты при вирусных инфекциях? Каковы отличия вирусов и бактерий, и какое это имеет значение при лечении инфекционных заболеваний?
Эти и некоторые другие вопросы мы затронем в нашей статье.
Дивный, дивный микромир
Невидимых невооружённым глазом обитателей, населяющих нашу планету - великое множество. Бактерии и вирусы, грибки и простейшие - число их огромно. Есть среди них как безвредные (и даже полезные и безусловно нужные) для организма, так и вызывающие различные инфекционные патологии.
Примеры некоторых болезней, вызываемых бактериями: дифтерия, сальмонеллёз, бактериальная дизентерия (не путать с амёбной), брюшной тиф, холера, дифтерия, туберкулез и многие другие.
А вот такие заболевания, как грипп, цитомегаловирусная болезнь, эпидемический паротит, инфекционный мононуклеоз, полиомиелит, ветряная оспа, корь, краснуха, ВИЧ, бешенство, некоторые гепатиты и т.д. - вирусной природы.
В ПРОЦЕССЕ ЭВОЛЮЦИОННОГО РАЗВИТИЯ
ОРГАНИЗМ НАУЧИЛСЯ БОРОТЬСЯ СО
МНОГИМИ ИЗ ИНФЕКЦИОННЫХ ПАТОГЕНОВ
В процессе эволюционного развития организм научился бороться со многими из инфекционных патогенов: на страже - наша иммунная система, реагирующая на внедрение инфекционных агентов. Однако, как и ранее, есть инфекции и случаи конкретного течения болезней, когда иммунитет отвечает недостаточно, либо его сил может не хватить, чтобы победить возбудителя.
Последующие исследования показали, что, во-первых, пенициллин действует далеко не на все болезнетворные микроорганизмы, а лишь на некоторые из них. Во-вторых, антибиотики в целом не действуют на вирусы.
АНТИБИОТИКИ В ЦЕЛОМ
НЕ ДЕЙСТВУЮТ НА ВИРУСЫ
Чтобы ответить на этот вопрос, нужно понимать, чем вирус концептуально отличается от бактерии.
Вирус - что это такое?
Что из этого можно заключить, возвращаясь к вопросу о влиянии антибиотиков на вирусы? Как минимум следующее: если мы назначим антибиотик, нарушающий процесс образования клеточной стенки, то эффекта не получим: у вируса этой стенки просто нет.
Есть только одно абсолютное правило: всё относительно
ПРИНЦИП "АНТИБИОТИКИ - ТОЛЬКО ПРОТИВ БАКТЕРИЙ"
НЕ АБСОЛЮТЕН: СУЩЕСТВУЮТ ТАКИЕ, КОТОРЫЕ
ДЕЙСТВУЮТ НА НЕКОТОРЫЕ ОПУХОЛЕВЫЕ
КЛЕТКИ ЧЕЛОВЕЧЕСКОГО ОРГАНИЗМА
Врачи думают иначе? Почему при вирусных инфекциях назначают антибиотики?
Исследование показало, что ликвидация этих бактерий ведёт к тому, что без них иммунитет не может правильно активировать систему противовирусной защиты. В результате клетки становятся более восприимчивыми к вирусу.
Вывод: антибиотики против вирусов - бесперспективная идея?
Как оказалось, нет, но пока вопрос находится на уровне экспериментов. Ещё одно проведённое исследование показало, что антибиотик неомицин подавляет активность вируса простого герпеса в слизистой оболочке влагалища, которую обрабатывали этим средством. В результате симптомы патологии были выражены более слабо.
Читайте материал по теме: Герпес: как распознать и вылечить?
При выяснении возможного механизма такого подавления было установлено, что неомицин активировал клеточные гены, которые управляют противовирусной защитой. Каким именно способом - пока неизвестно.
Дадут ли эти данные и дальнейшие исследования в этом направлении что-то клинической практике, пока неизвестно.
Против вирусов
Клетка прокариот бактерий и архей
Основные положения:
• В прокариотической клетке плазматическая мембрана окружает один компартмент
• Во всем компартменте присутствует одинаковая водная среда
• В клетке генетический материал занимает компактную область
• Бактерии и археи относятся к прокариотам, однако различаются по своим структурным особенностям
Прокариоты подразделяются на два царства. Раньше считали, что все прокариоты представлены бактериями, но сейчас часть их мы причисляем к археям. Как бактерии, так и археи существуют в форме только одноклеточных организмов (хотя некоторые бактерии в популяции проявляют способность к агрегации).
Область, ограниченная плазматической мембраной, называется цитоплазмой. У прокариот мембрана окружена клеточной стенкой, жесткая структура которой обеспечивает защиту клетки от физических воздействий внешней среды.
На рисунке ниже показано, что в компартменте бактериальной клетки генетический материал расположен компактно, однако не отделен мембраной от содержимого цитоплазмы. К простейшим формам бактерий относится микоплазма, которая, однако, не способна к самостоятельному существованию, поскольку не может производить многие из жизненно необходимых продуктов.
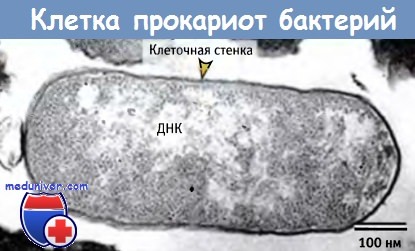
У бактерий существует один компартмент, хотя внутренние области могут отличаться друг от друга.
Поэтому микоплазма существует внутри других организмов, в которых эти продукты образуются. В геноме микоплазмы содержится всего лишь около 500 генов, которые кодируют лишь минимальное количество продуктов, необходимых для построения клетки. Геном свободноживущих бактерий содержит более 1500 генов и кодирует синтез ферментов метаболизма, необходимых для превращения небольших молекул, а также обеспечивает функционирование более сложного аппарата регуляции экспрессии генов.
Бактерии подразделяются на две группы, дивергенция между которыми произошла, вероятно, около двух миллиардов лет назад. Эти группы называются грамположительные и грамотрицательные, в зависимости от того, приобретают ли клетки окраску при прокрашивании по Граму. К числу наиболее полно охарактеризованных грамотрицательных бактерий относится Escherichia coli, а из грамположительных бактерий наиболее изучена Bacillus subtilis. Окраска развивается при взаимодействии красителя с клеточной стенкой.
У грамположительных бактерий клеточная стенка окружает плазматическую мембрану, и краситель непосредственно взаимодействует с компонентами стенки. У грамотрицательных бактерий существует вторая мембрана, окружающая клеточную стенку. Наличие этой мембраны и различия в составе клеточной стенки препятствуют развитию окраски. Область, находящаяся между наружной и внутренней мембранами, называется периплазматическим пространством. В этом пространстве находятся специфические белки и другие компоненты. Если за критерий компартмента принимать область, ограниченную мембранами, то можно считать, что грамотрицательные бактерии имеют два компартмента.
Однако периплазматическое пространство следует рассматривать как компартмент лишь в аспекте взаимодействия между клеткой и окружающей средой. Это никак не сказывается на основополагающем факте, что синтетическая активность бактериальной клетки сосредоточена в том же компартменте, где находится генетический материал.
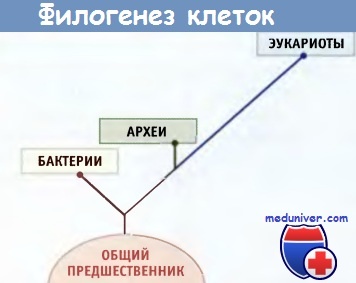
Данные филогенетического анализа с использованием современных молекулярных методов позволяют считать,
что организмы можно подразделить на три царства.
Некоторые бактерии могут развиваться, давая начало определенному типу специализированных клеток, что напоминает процесс развития у высших организмов.
Известно много различных видов бактерий, которые возникли на ранних этапах эволюции. Установить их филогенетические взаимоотношения достаточно сложно, поскольку, в отличие от эукариот, ископаемых остатков не сохранилось. Однако современные молекулярные методы, основанные на секвенировании рибосо-мальных РНК, и недавно разработанные приемы полного секвенирования генома привели к революционным выводам относительно происхождения прокариот. Как отдельное царство прокариот были идентифицированы археи.
По виду и строению археи напоминают бактерии: они характеризуются небольшими размерами и представляют собой одноклеточные организмы. Обычно они существуют в экстремальных условиях (например, при высоких температурах), и раньше их ошибочно принимали за бактерии, которые приспособились к таким условиям существования. Как и клетки бактерий, археи представляют собой клетки с одним компартментом и не имеют внутренних мембран.
У них могут проявляться такие же морфологические признаки, как у бактерий, например наличие жесткой стенки или капсулы, окружающей плазматическую мембрану, а также жгутиков, направленных в окружающую среду. Основные отличия наблюдаются на молекулярном уровне, и компоненты клетки археев отличаются от таковых у бактерий. Аппарат, осуществляющий экспрессию генов у археев, больше напоминает аналогичный аппарат клеток эукариот, чем клеток бактерий. Клеточная стенка у них построена из субъединиц, отличающихся от субъединиц клеточной стенки бактерий или растений. Существуют отличия в составе мембранных липидов. По генетической сложности археи больше напоминают свободно-живущих бактерий.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Различные молекулы проходят через цитоплазматическую мембрану за счет пассивной диффузии или активного перемещения
• Большинство растворенных веществ перемещается через мембрану с участием специфических транспортных белков
• Цитоплазматическая мембрана поддерживает протонный градиент между цитоплазмой и внеклеточной средой
Клетки всех организмов обладают цитоплазматической (или плазматической) мембраной, которая предотвращает выход и поступление в клетку растворимых соединений. У прокариот цитоплазматическая мембрана, толщиной примерно 8 нм, служит барьером между содержимым клетки и окружающей средой. Цитоплазматические мембраны содержат липиды и белки. Так же как и для других биологических мембран, в основе их структуры лежит фосфолипидный бислой. Фосфолипиды содержат фосфатную группу, присоединенную к основной трехуглеродной структуре глицерина.
Гидрофобные цепи жирных кислот связаны со свободными атомами углерода этой структуры, причем они ориентированы по направлению друг к другу и в противоположную сторону от внешней среды, содержащей воду. Напротив, гидрофильные фосфатные группы ориентированы в сторону водного окружения. Цитоплазматическая мембрана не дает возможность большинству биологических молекул и ионов пассивно диффундировать через нее в обоих направлениях. Исключение составляет вода, которая способна к медленной диффузии через цитоплазматическую мембрану; небольшой размер молекул и отсутствие заряда позволяют ей свободно проходить через фосфолипидный бислой.
С цитоплазматической мембраной связано много типов белков. Часто мембранные белки содержат участки гидрофобных аминокислот, которые взаимодействуют с гидрофобными цепями жирных кислот, находящихся в мембране. Белки, гидрофобные участки которых пронизывают мембрану, называются интегральными мембранными белками. Многие белки, находящиеся в цитоплазматической мембране, играют определенную роль в транспорте молекул в клетку и в выходе из нее. Такой транспорт через плазматическую мембрану может представлять собой активный или пассивный процесс. При пассивном транспорте молекулы движутся по концентрационному градиенту, т. е. из области их высокой концентрации в область с низкой концентрацией.
Таким образом, пассивный транспорт не требует затрат энергии. В противоположность пассивной диффузии, в результате активного транспорта, внутри клетки и вне ее устанавливаются различные концентрации растворенных метаболитов. Транспортные системы состоят из белков, которые связаны или с мембраной в виде ее стабильных интегральных компонентов, или с расположенными на периферии липидами через модифицированные концевые аминогруппы, за счет которых белок прикрепляется к поверхности мембраны. Такие большие молекулы, как белки, которые не могут свободно диффундировать через мембраны, транспортируются в процессе активного транспорта. Часто транспортные системы проявляют высокую специфичность, транспортируя только молекулы одного вещества или группы веществ.
Комплекс транспортных белков, связывающий АТФ (ABC), представляет собой самое обширное семейство транспортных белков прокариот. Только у Е. coli оно насчитывает свыше 200 белков. ABC-переносчики могут перемещать субстраты в клетку и из нее. Они проявляют активность по отношению к разнообразным субстратам, от ионов до молекул белков. ABC-переносчики, транспортирующие субстраты в клетки грамотрицательных бактерий, обычно состоят из трех компонентов: транспортный белок, пронизывающий мембрану, периплазматический белок, связывающий субстрат, и белок, гидролизующий АТФ, локализованный в цитоплазме. Периплазматические связывающие белки проявляют крайне высокое сродство к специфическим субстратам.
Это позволяет им осуществлять транспорт субстратов, даже если они присутствуют в крайне низких концентрациях. Белки связывающие АТФ, расположенные на цитоплазматической стороне мембраны, обеспечивают энергией процесс транспорта. Эти белки стабильно связаны с мембраной через липидную часть со стороны N-концевого участка.
Цитоплазматическая мембрана играет важную роль в энергетических процессах у прокариот. Электроны, которые генерируются в процессе дыхания, сопрягаются со своими рецепторами в мембране. Протоны транспортируются к клеточной поверхности посредством мембранных транспортных белков; при этом наружная мембрана приобретает слабый положительный заряд.
Внутренняя часть мембраны заряжена отрицательно. Таким образом, создается трансмембранный протонный градиент. Энергетически выгодное движение протонов по градиенту, от наружной поверхности вглубь клетки, обеспечивает протекание многих внутриклеточных реакций. Иными словами, энергия, запасенная в цитоплазматической мембране может использоваться клеткой для разных целей. Например, ферменты используют протонный градиент для образования АТФ из АДФ. Некоторые мембраносвязанные ферментные комплексы способствуют генерации протонного градиента в ходе окислительного фосфорилирования.
При окислительном фосфорилировании терминальным акцептором электронов служит кислород. Однако в анаэробных условиях многие прокариоты могут использовать другие акцепторы электронов, например серу, азот, железо и марганец. Энергия, которая запасается в цитоплазматической мембране за счет функционирования ферментов, обеспечивает большую часть потребностей растущей клетки, т. е. такие процессы, как синтез молекул, транспорт белков и субстратов, а также ее подвижность. Изучение молекулярных механизмов генерации энергии в бактериальных клетках представляет собой активно развивающуюся область современных исследований.
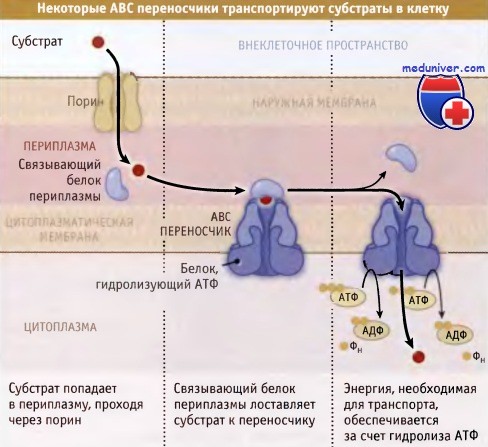
У грамотрицательных бакерий растворимые субстраты поступают в периплазму при участии поринов,
представляющих собой белки, которые образуют в наружной мембране определенных размеров поры.
Субстраты связываются специфическими белками, присутствующими в периплазме, которые, в свою очередь,
в цитоплазматической мембране связываются с ABC переносчиками.
Для транспортировки субстратов в цитоплазму, эти переносчики используют энергию гидролиза АТФ.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Вирус (лат. virus - яд) - неклеточная форма жизни, мельчайшие болезнетворные микроорганизмы, не видимые в микроскоп. Они значительно меньше бактерий: легко проходят через бактериальные фильтры.
Вирусы способны размножаться только внутри живых клеток, до проникновения в них вирусы не имеют признаков жизни: пассивно перемещаются во внешней среде, ожидая встречи с клеткой-мишенью.
В 1892 году Ивановский Д.И. в ходе изучения мозаичной болезни табака обнаружил, что болезнь вызывается мельчайшими субстанциями, которые проходят через бактериальный фильтр, то есть были меньше бактерий. Вирусы впервые увидели в электронный микроскоп в 1939 году (спустя 19 лет со смерти Ивановского), однако считается, что именно Ивановский положил начало вирусологии как науке.

- Наличие наследственности и изменчивости
- Способность к репродукции (воспроизведению себе подобных)
-
Неживое (инертное) состояние
Вне клетки хозяина находятся в неживом состоянии, ожидая внедрения. Вирусы - облигатные внутриклеточные паразиты.
У вирусов отсутствует обмен веществ с внешней средой (метаболизм).
Не имеют клеточной мембраны, ограничивающих их от внешней среды, и, соответственно, клеточного строения.
У вирусов отсутствует половое размножение и деление. Попав в живую клетку, вирус встраивает свою нуклеиновую кислоту (РНК/ДНК) в наследственный материал клетки-мишени. В результате клетка начинает синтезировать вирусные белки (новые вирусы): так увеличивается численность вирусов.
Вирусы не растут, не увеличиваются в размерах. Стратегия их жизни - безудержное размножение.
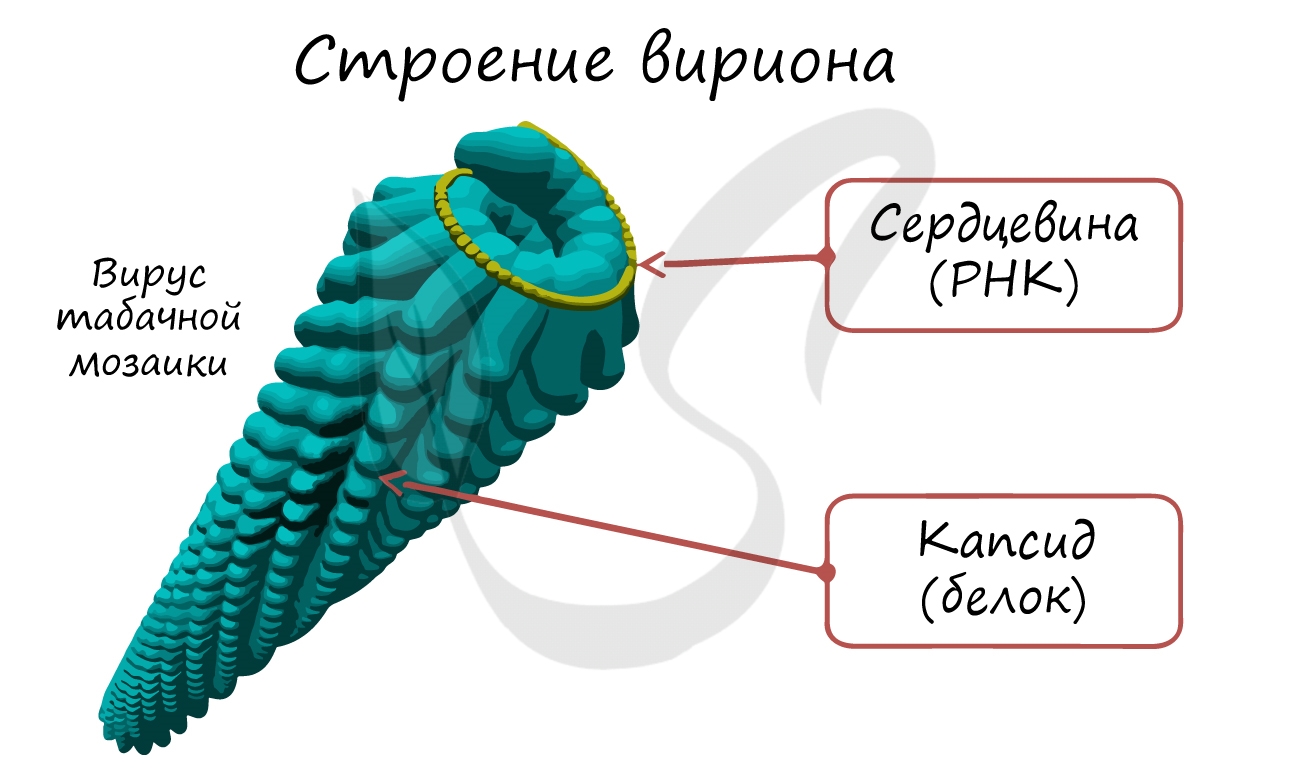
Если мы заглянем в клетку, инфицированную вирусом, то от вируса мы увидим только один элемент - его нуклеиновую кислоту (ДНК/РНК). Во внешней среде вирусы существуют в виде вирионов - полностью сформированных вирусных частиц, состоящих из белковой оболочки (капсида) и нуклеиновой кислоты внутри.
Носителем наследственной информации у вирусов может быть ДНК, РНК. В связи с этим все вирусы подразделяются на ДНК- и РНК-содержащие.
Взаимодействие вируса с клеткой
Найдя клетку, на поверхности которой есть подходящий рецептор, вирус взаимодействует с ним и прикрепляется к мембране клетки. Путем эндоцитоза (образование вакуоли) вирус проникает внутрь клетки, выходит из вакуоли в цитоплазму. Наследственный материал (ДНК/РНК) вируса реализуется по схеме: ДНК ↔ РНК → белок.
Проникнув внутрь клетки (инфицировав ее), вирус реализует собственный генетический материал (ДНК/РНК) путем синтеза вирусного белка на рибосомах клетки хозяина. Клетка даже и не подозревает, что вирус встроил в ее РНК/ДНК свой генетический код - она принимает его как свой собственный, а в результате синтезирует вирусные белки.
Образовавшиеся белки объединяются в вирусные частицы, которые могут выходить из клетки разными путями. Вирионы вирусов гепатита C выходят из клетки путем почкования (экзоцитозом), при таком варианте клетка долгое время остается живой и служит для продукции новых вирионов.
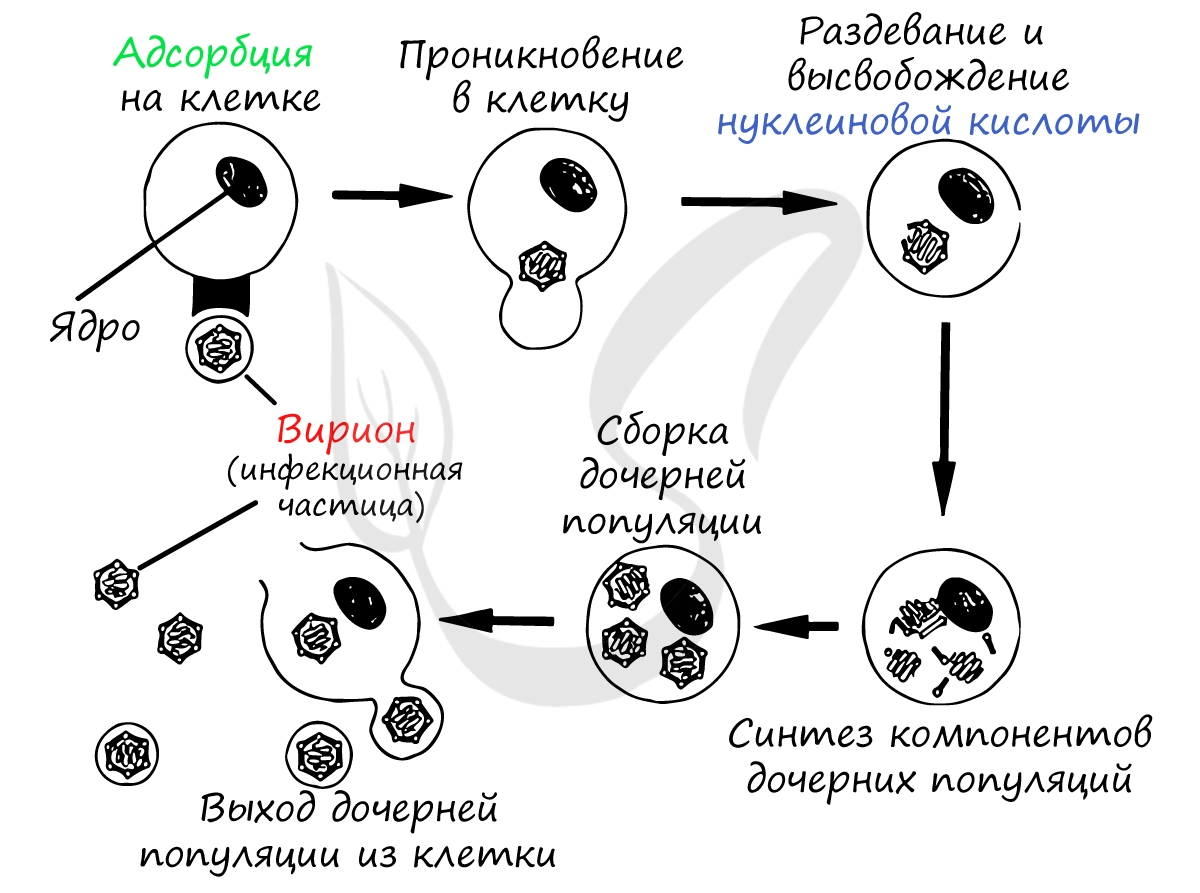
Известен и другой механизм выхода вирионов из клетки: взрывной, при котором оболочка клетки разрывается, и тысячи вирионов отправляются инфицировать новые клетки. Такой способ характерен для аденовирусов, ротавирусов.
Бактериофаги ("бактерия" + греч. phag(os) — пожирающий)
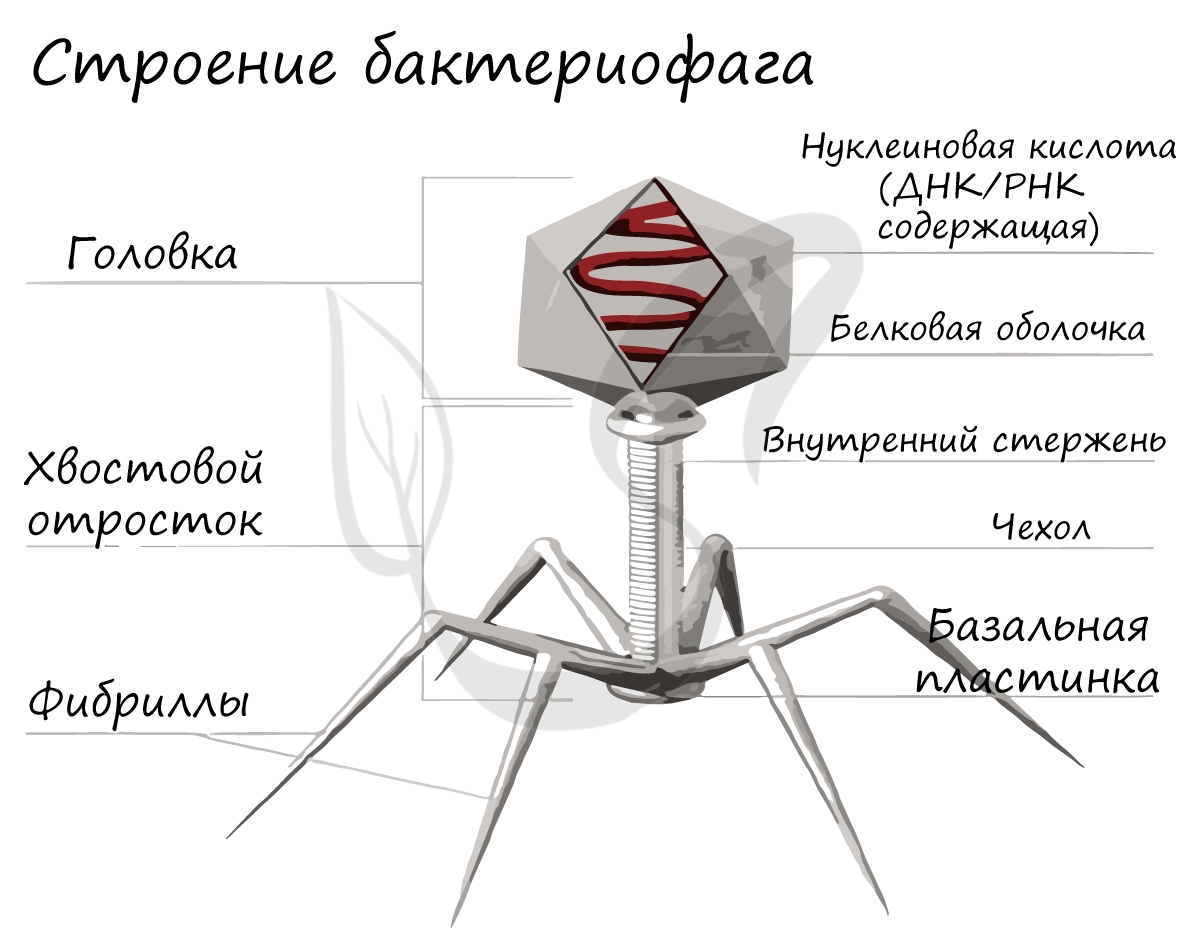
Это уникальная группа вирусов, инфицирующая только бактерии. Бактериофаг имеет капсид, с содержащимся внутри наследственным материалом - ДНК (реже РНК), протеиновым хвостом. Бактериофаги открыты в 1915 году и с тех пор активно применяются в ходе генетических исследований.
Ниже вы можете видеть типичное строение бактериофага. Бактериофаг напоминает шприц, который протыкает стенку бактерии и впрыскивает внутрь нее свою нуклеиновую кислоту.
Бактериофаги успешно применяются в медицине для лечения многих заболеваний. Это высокоэффективные, дорогостоящие препараты, которые помогают, например, нормализовать микрофлору кишечника при бактериальных инфекциях.
Вирусные инфекции
Вирусы вызывают множество заболеваний человека и животных. Некоторые из них неизлечимы даже на современном этапе развития медицины, например бешенство. К вирусным инфекциям относятся грипп, корь, свинка, СПИД (вызванный ВИЧ), полиомиелит, желтая лихорадка, онковирусы.
Такая группа, как онковирусы, потенцируют развитие опухолей в организме. К ВИЧ и онкогенным вирусам не существует специфических антител, что затрудняет процесс создания вакцины. В то же время против ряда вирусных инфекций: корь, ветряная оспа созданы вакцины, создающие стойкий пожизненный иммунитет.
Клетки вырабатывают защитный белок - интерферон. Это вещество подавляет синтез новых вирусных частиц, приводит к повышению температуры тела (например, при гриппе).

Вирус иммунодефицита человека (ВИЧ) представляет для организма большую опасность. Он размножается в T-лимфоцитах - клетках крови, которые выполняют иммунную функцию. С гибелью T-лимфоцитов разрушается иммунная система, становится невозможным сопротивление организма бактериями, вирусам и грибам, что в отсутствии лечения приводит к вторичным инфекциям.
Риск заражения ВИЧ присутствует при гемотрансфузии (переливании крови), половом акте. Инфекция также может быть передана от ВИЧ инфицированной матери к плоду.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

Обзор
картинка в мраморе: Singer & Nicholson, 1972 [3]
Авторы
Редакторы
Краткая история исследования липидов и биомембран

где Mr — масcа 1 моля триолеина, NA — число Аводгадро, Sпятна — площадь пятна, Vложки — объем ложки, ρмасла — плотность масла. В результате мы получим значение площади Sмол ≈ 1 нм 2 (на молекулу). Несложно оценить и толщину мономолекулярного слоя, равную размеру одной молекулы триолеина, разделив Vложки на Sпятна — 2,5 нм.
Более ста лет спустя, Чарльз Овертон заметил, что через биомембраны сравнительно легко проникают вещества, хорошо растворимые в липидах, из чего он сделал заключение, что мембрана должна быть образована тонким липидным слоем. Так эксперименты Франклина оказались впереди современных биофизических изысканий. 1925-м годом датируется идея бислойности мембраны: Гортер и Грендель обнаружили, что монослой липидов, выделенных из мембран эритроцитов, ровно вдвое превосходит площадь поверхности самих клеток.
Текучесть липидной фазы мембраны обусловлена присутствием в углеводородных цепях большинства структурных фосфолипидов минимум одной ненасыщенной связи, понижающей температуру плавления липида. Проследить такое фазовое поведение достаточно просто на примере растительного масла и маргарина: первое при комнатной температуре жидкое (содержит жиры, включающие ненасыщенные жирные кислоты, — например, триолеин [Tплавления = 5 °C]), второй же, получаемый из растительного масла гидрированием, твердый (двойные связи ацильных цепей насыщены; для соответствующего насыщенного жира — стеарина — Tплавления = 55 °C (!)).
В данной статье мы постарались осветить современные представления о биофизике липидных компонентов биологических мембран, и в первую очередь, подробнее остановиться на способности липидов к самоорганизации, которая широко используется клетками в своих нуждах.

Многообразие биомембран
Другая важная особенность эукариот — холестерол (известный также как холестерин), отсутствующий в прокариотических мембранах. Вопреки своей дурной славе у обывателей [12], холестерол играет важнейшую и еще, видимо, не до конца осознанную роль в работе мембран наших клеток (не говоря уже о том, что он является предшественником половых гормонов). Вместе со сфинголипидами (такими как сфингомиелин) холестерол образует рафтовые структуры, придающую эукариотическим мембранам прочность и особую функциональную гетерогенность, о чем подробнее будет сказано ниже.

Из всего сказанного следует, что липидный состав мембран отнюдь не является чем-то выбранным раз и навсегда [15]: он претерпел существенные изменения в процессе эволюции. Даже в разные периоды жизни одного и того же организма состав мембран может существенно варьировать. По всей видимости, липидную организацию мембран эукариот можно считать эволюционно наиболее прогрессивной, поскольку она обеспечивает максимально гибкую адаптацию микроскопического окружения под нужды белковых молекул, создавая частично изолированные области в пределах одной, казалось бы, жидкой фазы. Далее мы остановимся на этих аспектах функционирования гетерогенной эукариотической мембраны подробнее.
Латеральная гетерогенность эукариотических мембран
Основной фосфолипид плазматических мембран эукариот — пальмитоилолеилфосфатидилхолин (ПОФХ) — содержит двойную связь в остатке олеиновой кислоты, и этого уже оказывается достаточно, чтобы температура плавления этого липида снизилась до −3 °C (по сравнению с его полностью насыщенным аналогом — дипальмитоилфосфатидилхолином (ДПФХ), — температура фазового перехода которого составляет 41,5 °C).
Равновесие между Lo/Ld фазами было давно показано на искусственных мембраноподобных системах (например, гигантских везикулах, изготовленных из липидов легочного сурфактанта) (рис. 3б), однако непосредственно в биологической мембране такого разделения (а, значит, и рафтов) пронаблюдать долгое время не удавалось. В чем же дело, если липидный состав искусственных мембран был подобран максимально похожим на мембраны настоящие?

На маленьком липидном плоту
Модель рафтовой гетерогенности показана на рис. 4.
Однако, несмотря на то, что определение рафтам дано, само их существование представлялось до недавнего времени довольно-таки спорным, то есть — не подтвержденным в прямом эксперименте. Как же понимать этот парадокс?

Кластеризация липидов in silico
Современные методы молекулярного моделирования позволяют изучить процесс самоорганизации липидных смесей с разной степенью детализации. Расчеты молекулярной динамики (МД; [7], [22]) модельных мембран, в которых все атомы липидов и окружающего растворителя представлены в явном виде, дают наиболее полную информацию. И хотя при таком подробном рассмотрении системы, доступные для моделирования даже на современных суперкомпьютерах, ограниченны в своих размерах (10 2 –10 3 молекул липида) и длительности наблюдения за их динамическим поведением (

Рисунок 6. Мозаичная организация поверхности простейшей однокомпонентной мембраны. Слева представлена идеальная модель мембраны, справа — поверхность полноатомной мембраны (ДОФС), раскрашенной по гидрофобности.

Рисунок 7. Предпочтительная локализация трансмембранных пептидов WALP23 в Ld-фазе . Модельная мембрана состоит из липидов ДЛФХ , ДПФХ и холестерола .
Что ограничивает размер рафтов в биомембранах
В реальных экспериментальных системах наблюдается достаточно парадоксальный контраст с искусственными мембранами, разделение фаз Lo/Ld в которых наблюдали неоднократно и при разных условиях. В живой клетке это удалось сделать непосредственно лишь недавно, да и то — используя самые современные технологии субдифракционного наблюдения [21]. В чем же причина такого разительного отличия?
Анализ огромного массива биохимических и биофизических данных относительно липидных доменов в биомембранах, накопившихся за последние 15 лет, привел ученых к выводу, что состав липидного матрикса мембран эволюционно подобран, чтобы при физиологических условиях всегда находиться вблизи фазового перехода (рис. 8). Это способствует образованию в мембранах мезофазы (рафтов), которые, несмотря на свой малый размер и динамическую природу, играют важную (хотя не до конца еще изученную) роль. Какую? Читайте в заключительной части статьи.

Биологическая роль наноразмерных неоднородностей в мембране
Роль такого сложного фазового поведения липидного матрикса мембран еще только предстоит понять в полной мере. Впрочем, сегодня ясно главное — такие свойства позволяют группировать (сортировать) разные белки в частично изолированные области, что позволяет им выполнять предназначенные функции. Также эти свойства определяют то, каким образом мембраны делятся и сливаются, — а это и деление самих клеток, и везикулярный транспорт, и жизненный цикл вирусов, и способность многих токсинов проникать внутрь клеток. Рассмотрим несколько примеров биологической роли рафтов немного более подробно [20]:
Перспективы биофизического изучения мембран
История с изучением липидного матрикса мембран в очередной раз показывает, что живая материя устроена значительно сложнее, чем представлялось ранее, и изобретение новых высокоточных методик наблюдения лишь усугубляет эту сложность.
Словарик
Читайте также:

