Почему брадикардия при гепатитах
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Брадикардия: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Брадикардия – это состояние сердечной мышцы, когда частота ее сокращений составляет менее 60 ударов в минуту. Брадикардия не всегда считается патологией, редко бывает самостоятельным заболеванием и чаще указывает на наличие проблем других органов или систем.
Незначительное снижение частоты сердечных сокращений (ЧСС) обычно никак не отражается на общем самочувствии человека.
Нарушения гемодинамики наблюдаются при выраженном замедлении ЧСС, у людей с различными сопутствующими заболеваниями (чаще у пожилых). К основным симптомам брадикардии относят необъяснимую слабость, повышенную утомляемость, побледнение кожных покровов, головокружения и предобморочные состояния, обмороки (приступы Морганьи-Адамса-Стокса – обморочные или синкопальные состояния во время приступа брадикардии), одышку (затрудненное дыхание), боли и ощущение дискомфорта в груди, колебания артериального давления.
Разновидности брадикардии
Брадикардию принято разделять на физиологическую, патологическую и лекарственную.
- Физиологическая брадикардия – это уменьшение частоты сердечных сокращений, которое не связано с патологическими процессами в организме. Например, у спортсменов в связи с большой тренированностью сердечной мышцы отмечается снижение нормальных границ частоты сердечных сокращений. Это нормальное состояние при отсутствии других симптомов (сонливости, слабости, головокружения, затрудненного дыхания и дискомфорта в грудной клетке). Уменьшение ЧСС во время сна или при понижении температуры тела (например, при переохлаждении организма) также относят к физиологическим состояниям.
- Патологическая брадикардия (нейрогенная, эндокринная, токсическая, миогенная).
Нейрогенная брадикардия дает о себе знать при повышении внутричерепного давления, язвенной болезни, почечных, печеночных и кишечных коликах, гломерулонефрите, а также после тяжелых инфекционных заболеваний.
Эндокринная брадикардия выявляется при снижении функции щитовидной железы и коры надпочечников.
Токсическая брадикардия сопутствует состояниям интоксикации (уремии, печеночной недостаточности), а также гиперкалиемии и гиперкальциемии.
Фармакологическая, или лекарственная, брадикардия возможна при злоупотреблении и передозировке некоторых лекарственных препаратов (сердечных гликозидов, бета-адреноблокаторов, блокаторов кальциевых каналов, антидепрессантов), наркотических веществ и др.
- латентную форму, характеризующуюся отсутствием клинических и ЭКГ-проявлений, а дисфункция синусового узла определяется при электрофизиологическом исследовании;
- компенсированную форму со слабо выраженными клиническими проявлениями (жалобами на головокружение и слабость), на ЭКГ присутствуют изменения;
- декомпенсированную форму, при которой определяется стойкая синусовая брадикардия, проявляющаяся головокружением, обморочными состояниями, преходящими парезами, сердечной недостаточностью.
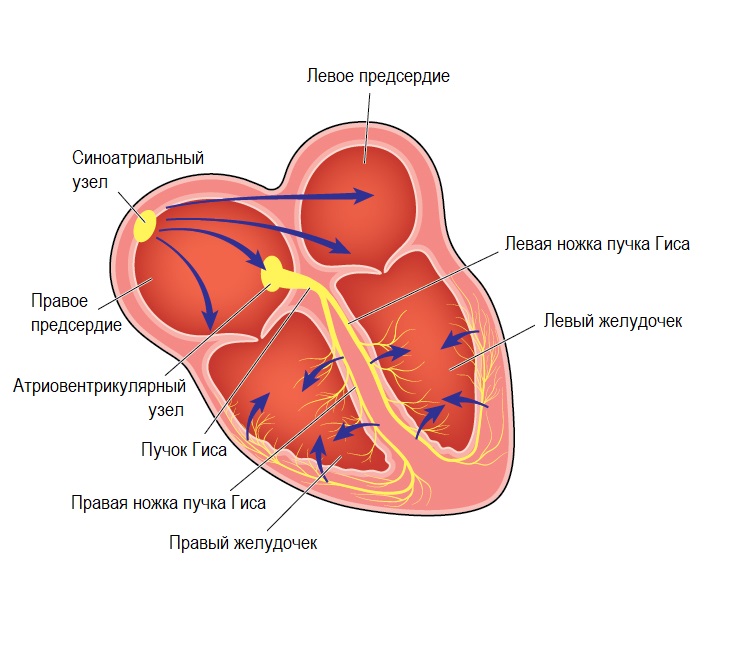
Далее электрический импульс следует в атриовентрикулярный узел через систему проводящих пучков. В случае если на этом уровне происходит повреждение волокон, формируется несинусовая брадикардия. По своим проявлениям виды брадикардии ничем не отличаются, но это разделение важно для постановки диагноза и выбора правильной тактики лечения.
Причинами, которые нарушают структуру проводящей системы сердца, т.е. вызывают органическое поражение миокарда, являются:
- инфаркт миокарда с последующим замещением соединительной тканью разрушенных структур сердца, в том числе и важных пучков, проводящих электрический импульс из синусового узла;
- ишемическая болезнь сердца, когда вследствие атеросклероза коронарных артерий нарушается адекватное кровоснабжение участков миокарда в месте проводящих пучков и развивается склеродегенеративный фиброз (замещение соединительной тканью) пораженных участков;
- миокардит - поражение сердечной мышцы воспалительного характера;
- врожденные аномалии строения проводящей системы сердца.
При интоксикации во время инфекционных заболеваний, при выраженном потоотделении, рвоте и диарее происходит значимая потеря электролитов (ионов калия, натрия и магния), что приводит к нарушению водно-солевого баланса в организме и возникновению различных нарушений ритма сердца.
Некоторые заболевания щитовидной железы, например гипотиреоз, характеризуются снижением синтеза и функции тиреоидных гормонов, в результате чего нарушается обмен веществ и урежается ЧСС.
К возможным причинам брадикардии относят общее переохлаждение, повышение внутричерепного давления (при отеке мозга, опухолевом процессе, менингите, кровоизлиянии в головной мозг), отравление свинцом, никотином и др.
При каких заболеваниях возникает брадикардия
Список заболеваний и состояний, при которых диагностируется брадикардия, достаточно обширен:
- синдром слабости синусового узла;
- атриовентрикулярные блокады;
- инфаркт миокарда;
- ишемическая болезнь сердца;
- миокардиты;
- инфекционный эндокардит;
- пороки сердца;
- гипотиреоз;
- некоторые инфекционные заболевания (брюшной тиф, вирусные инфекции);
- отравления свинцом, фосфорорганическими соединениями, в том числе пестицидами, наркотическими веществами;
- общее переохлаждение;
- опухоли сердца.
Терапией заболеваний, одним из симптомов которых является брадикардия, занимаются врачи-кардиологи, терапевты, эндокринологи.
Диагностика и обследования при брадикардии
Прежде всего, для выявления нарушений ритма сердца используют такие методики обследования, как подсчет пульса и частоты сердечных сокращений.
При осмотре пациента врач использует метод аускультации для выслушивания сердечного ритма и обнаружения других сопутствующих симптомов, позволяющих диагностировать заболевание, вызвавшее изменение частоты сердечных сокращений.
При постановке диагноза обязательно используют инструментальные и лабораторные методы диагностики:
-
электрокардиографическое исследование (ЭКГ), эхокардиографию (ЭхоКГ), а в случае необходимости динамического наблюдения - холтеровское суточное мониторирование;
Расшифровка ЭКГ с заключением, выполненная квалифицированным кардиологом ИНВИТРО.
ПВТ — противовирусная терапия
СН — сердечная недостаточность
ХГС — хронический гепатит С
HCV — вирус гепатита С
NT-pro-BNP — N-концевой предшественник мозгового натрийуретического пептида
Хронический гепатит С (ХГС) — актуальная междисциплинарная проблема. Хорошо изучены различные внепеченочные проявления ХГС, такие как смешанная криоглобулинемия, гломерулонефрит, поздняя кожная порфирия, красный плоский лишай, синдром Шегрена и др. Однако существует целый ряд системных проявлений, которые нуждаются в более тщательном изучении, в частности поражение сердца. При ХГС описаны миокардит, гипертрофическая (ГКМП) и дилатационная (ДКМП) кардиомиопатии, коронарит вследствие криоглобулинемического васкулита мелких сосудов сердца, аритмогенная дисплазия правого желудочка, аневризма левого желудочка, раннее развитие атеросклероза и ишемической болезни сердца [1—6]. Возможно развитие цирротической кардиомиопатии (КМП), которая наблюдается при циррозах печени различной этиологии, в том числе вирусной. Развивается диастолическая дисфункция миокарда и синдром удлиненного интервала Q—T, выраженность которого увеличивается по мере нарастания декомпенсации функции печени [7—11]. Наконец, широко используемая противовирусная терапия (ПВТ) ХГС может сопровождаться кардиотоксичностью интерферона (ИФН), имеющей клинические особенности и нередко проявляющейся развитием декомпенсации деятельности сердца.
Миокардит является одним из мало изученных внепеченочных проявлений ХГС [3, 4]. В клинике им. Е.М. Тареева описана серия наблюдений из 22 больных хроническим гепатитом вирусной этиологии с миокардитом, у 13 из которых диагностирован цирроз печени. Поражение сердца у 4 больных стало причиной летального исхода. В 3 наблюдениях на аутопсии выявлена картина хронического активного миокардита: обширные очаги лизиса кардиомиоцитов (КМЦ) с очаговой лимфогистиоцитарной инфильтрацией; многочисленные продуктивные и продуктивно-деструктивные эндофлебиты; диффузный фиброз стромы; лимфогистиоцитарная инфильтрация стромы. В одном случае диагностированы диффузный кардиосклероз, миокардиофиброз, диффузный склероз эндокарда. Особенностью двух других наблюдений явились выраженные изменения в проводящей системе сердца: волокна проводящей системы замурованы в грубоволокнистую фиброзную ткань, отмечены резко выраженная дистрофия и некробиоз КМЦ. У этих больных наблюдались различные нарушения проводимости [4].
Первичные КМП представляют собой гетерогенную группу заболеваний миокарда различной этиологии. Наибольший интерес к проблеме миокардитов и КМП, ассоциированных с HCV-инфекцией, отмечен у исследователей из Японии. Выявлена высокая распространенность HCV-инфекции у больных ГКМП, ДКМП и миокардитом [17—20]. При многоцентровом исследовании по программе Комитета по изучению идиопатических КМП в Японии, антитела HCV в сыворотке выявлены у 74 (10,6%) из 697 больных ГКМП и у 42 (6,3%) из 633 больных ДКМП, значительно превышая частоту обнаружения антител HCV у сопоставимых по возрасту доноров крови (2,4%) [20].
По данным A. Matsumori [1], у 113 больных ГКМП, HCV-инфекция диагностирована у 16 (14,1%), причем ни у одного из них не было семейного анамнеза по ГКМП. В 4 наблюдениях имелись указания на гемотрансфузии в анамнезе, у 10 больных определялся повышенный уровень трансаминаз в сыворотке, у 7 выявлен гепатоцеллюлярный рак. При морфологическом исследовании отмечены умеренная или выраженная гипертрофия правого и левого желудочков, фиброз различной степени и умеренная клеточная инфильтрация миокарда. РНК HCV генотипа 1b выявлена в сыворотке у 7 больных, РНК HCV в ткани миокарда — у 6, минус-цепи РНК HCV обнаружены в биоптатах сердца у 2 больных. Другая группа исследователей выявила антитела HCV у 18 (22,5%) из 80 больных ГКМП [21].
Многоцентровое исследование, проводимое научным комитетом по изучению КМП Всемирной федерации заболеваний сердца, ставило задачу выявления вирусных геномов энтеровирусов, аденовируса, цитомегаловируса и HCV в формалиновых срезах ткани сердца. Геном HCV выявлен в 2 (18%) из 11 биоптатов больных ДКМП и миокардитом в Италии и у 4 (36%) из 11 больных в США, у 2 из них выявлен миокардит и у 2 — аритмогенная дисплазия правого желудочка. Несмотря на то что метод выявления генома HCV в парафиновых (фиксированных в формалине) срезах менее чувствительный, чем в замороженных образцах, предполагается, что HCV-инфекция может быть более частой причиной ряда заболеваний миокарда, в первую очередь миокардита [22]. Показано также, что частота развития КМП, обусловленных HCV, варьирует в различных регионах мира и различных популяциях. Среди больных КМП в Канаде (Ванкувер) РНК HCV не обнаружена ни в одном из 24 образцов ткани сердца. Ряд европейских исследователей также высказываются против связи HCV-инфекции и заболеваний сердца [23].
В последние годы также изучается вопрос о взаимосвязи ХГС и уровня натрийуретических пептидов. Так, в крупном ретроспективном исследовании антитела к HCV выявлены у 59 (4,4%) из 1355 больных с СН неясной этиологии, что значительно превышало частоту НCV-инфекции в общей популяции (1,8%). Уровень N-концевого предшественника мозгового натрийуретического пептида (NT-pro-BNP) в сыворотке у больных с СН и ХГС достоверно выше, чем у больных с СН без маркеров HCV (р<0,0001) [24]. Интересным представляется исследование А. Antonelli и соавт. [25], которые выявили повышенный уровень NT-pro-BNP у 34% больных ХГС, в то время как в группе неинфицированных, сопоставимых по полу и возрасту, повышение данного лабораторного показателя отмечалось лишь в 6% наблюдений. Это может свидетельствовать в пользу субклинического поражения сердца у некоторых больных ХГС.
Генетические факторы и патогенетические звенья поражения сердца при HCV. Несмотря на то что в последнее время в литературе описываются клинические наблюдения ДКМП и ГКМП, ассоциированных c HCV [1, 6, 18, 21]; механизм, посредством которого HCV приводит к их развитию, полностью не изучен. У ряда пациентов с ассоциированной с HCV КМП идентифицированы HLA- и не-HLA-гаплотипы, которые дают основание полагать, что фактором развития данного вида поражения сердца является генетическая предрасположенность. Так, в развитии ДКМП участвует α-фактор некроза опухоли (α-ФНО) — один из ключевых цитокинов, усиление синтеза которого наблюдается при HCV-инфекции [26].
Причиной миокардита, приводящего к ДКМП и СН, могут быть некоторые вирусы, обладающие тропизмом к миокарду [27, 28]. Считается, что в основе развития вирусного миокардита и прогрессирования его в КМП лежат механизмы смерти клетки в результате апоптоза, а также индуцированные вирусами иммунные реакции [29]. Предполагаемым иммунным механизмом является постоянное обновление иммунокомпетентных клеток и продуцируемых ими цитокинов [30, 31]. Среди всех цитокинов, участвующих в развитии и прогрессировании миокардита, наиболее важную роль играет α-ФНО [32—34]. Отдельные исследования показали, что имеется связь как между сниженной функцией миокарда и повышенной экспрессией α-ФНО, так и между концентрацией α-ФНО в плазме и миокарде у больных миокардитом [35] и ДКМП [36]. С помощью иммуногистохимического анализа установлено, что α-ФНО продуцируется КМЦ при вирусных миокардитах, ассоциированных с аденовирусом, цитомегаловирусом, вирусом Эпштейна—Барр, вирусами гриппа, А и B, а также HCV [35, 37]. Отрицательный инотропный эффект α-ФНО обусловлен связыванием α-ФНО со специфическими рецепторами TNFR1 и TNFR2, которые экспрессируются на мембране КМЦ [38]. Также вероятно, что α-ФНО ингибирует кальциевые каналы L-типа, что приводит к снижению систолической функции миокарда [39]. Другим механизмом, посредством которого α-ФНО влияет на миокард, является стимулирование продукции оксида азота (NO), который оказывает отрицательное инотропное действие на миокард, действуя как эндогенный ингибитор и фактически уменьшая положительный инотропный ответ на β-адренергическую стимуляцию [40].
Некоторые гены, например гены системы HLA, причастны к клиренсу и персистенции HCV-инфекции [41]. В нескольких исследованиях сообщалось, что ДКМП и ГКМП ассоциируются с некоторыми аллелями системы HLA. Так, у инфицированных HCV пациентов, у которых развивается ДКМП, более часто выявляются гаплотипы HLA-DPB1*0901 и HLA-DRB1*1201, а у инфицированных HCV пациентов с ГКМП — гаплотипы HLA DRB1*0901 и DQB1*0303 [1, 42]. По данным других авторов, развитие ДКМП, ассоциированной с HCV, наиболее отчетливо коррелирует с аллелями не-HLA-генов, чем с генами системы HLA [43]. Таким образом, пилотные исследования демонстрируют, что имеется генетическая предрасположенность к развитию поражения миокарда у пациентов с ХГС (рис. 1).

Рис. 1. Генетическая предрасположенность к поражению миокарда при HCV-инфекции.
По данным N. O’Garra и соавт. [44], в печени развивается выраженный CD4+ Th1 клеточный ответ, наиболее вероятно индуцируемый интерлейкином (ИЛ) 12, ИФН-α и ИФН-β, которые продуцируются моноцитами, нейтрофилами и макрофагами после стимуляции Toll-like-рецепторов HCV производными продуктами. Если определенные гаплотипы кодируют молекулы главного комплекса гистосовместимости (ГКГ) II класса с более высоким сродством к производным пептидам HCV, то их функция как молекул, презентирующих антигены клеткам Th1 CD4+, повышается. После активации клетки Th1 CD4+ продуцируют ИФН-γ, который активирует макрофаги к продукции провоспалительных цитокинов [44]. Главными цитокинами, продуцируемыми макрофагами, являются ИЛ-1 и α-ФНО [45], которые могут приводить к обновлению иммунных клеток и высокой концентрации α-ФНО в миокарде.
Другим механизмом, посредством которого гаплотипы HLA могут влиять на развитие ДКМП, ассоциированной с HCV, в контексте α-ФНО является так называемая неклассическая функция клеток ГКГ II класса, т. е. их роль в качестве сигнальных трансдукционных молекул, активируемых суперантигенами в клетках некоторых типов [46, 47]. Суперантигены являются протеинами бактериального или вирусного происхождения, которые активируют до 20% Т-клеточной популяции путем одновременного связывания Т-клеточных рецепторов и молекул ГКГ II класса, что приводит к массивному высвобождению цитокинов, которые секретируются как Т-клетками, так и антигенпрезентирующими клетками [48—50]. В контексте полиморфизма HLA предполагалось, что они принимают непосредственное участие в исходе, к которому приводит продукция цитокинов, стимулируемая суперантигенами [51, 52]. Можно предположить, что определенные гаплотипы HLA кодируют эпитопы молекул ГКГ II класса с высоким сродством к производным HCV суперантигенам или антителам, а это ведет к чрезмерной продукции цитокинов, в частности α-ФНО. Более активное обновление иммунных клеток может привести у генетически предрасположенных инфицированных HCV пациентов к развитию миокардита и впоследствии к ДКМП. Следует отметить, что часто при ассоциированном с HCV хроническом активном миокардите у пациентов отмечался нормальный уровень активности печеночных трансаминаз в сыворотке крови вплоть до формирования терминальной стадии СН [53].
Развитие и прогрессирование вирусного миокардита, в том числе у больных ХГС, осуществляется через различные патогенетические звенья (рис. 2): 1) прямое действие вируса на миокард; 2) непрямое (иммунологическое) действие; 3) смерть клеток в результате апоптоза.

Рис. 2. Механизмы поражения миокарда при HCV-инфекции. АФК — активные формы кислорода.
Воздействие HCV на миокард. Ряд исследователей указывают на возможность прямого воздействия HCV на миокард. Показано, что HCV реплицируется в миокарде, о чем свидетельствует выявление там негативных цепей РНК [53—55]. Механизм, посредством которого протеин HCVcorе вызывает повреждение миокарда, остается неясным; однако он может быть сходным с механизмом поражения печени. Показано, что изменения в структуре рецепторов TNFR1, вызываемых протеином HCVcorе, повышают чувствительность клеток к цитолизу, опосредованному α-ФНО [56]. Кроме того, протеин HCVcorе вызывает дисфункцию митохондрий, что приводит к развитию окислительного стресса клеток печени [57, 58]. Фактически, протеин HCVcore ограничивает свое действие в митохондриях, в частности он взаимодействует с наружной мембраной митохондрий, повышает поглощение кальция митохондриями и вызывает окисление глутатиона, что приводит к дальнейшему повышению продукции АФК [59, 60]. Повышение образования АФК инициирует продукцию α-ФНО [61], который, как отмечено ранее, оказывает отрицательное инотропное действие на миокард. В некоторых ранее проводимых исследованиях продемонстрировано, что у пациентов с острой и хронической СН, развившихся в исходе КМП, в миокарде определяется повышение выработки АФК [62, 63].
К тому же ряд исследований на животных подтверждают роль протеина HCVcore в развитии КМП. В частности, развитие КМП наблюдалось у трансгенных мышей, носителей гена HCVcore, в возрасте 12 мес. Гистологический анализ миокарда этих мышей выявил гипертрофию КМЦ, кардиальный фиброз, дезорганизацию, дефицит и лизис миофибрилл, вакуолизацию и деформацию ядер, повышенное количество митохондрий неправильной формы [55], что убедительно подтверждает определяющие действие протеина HCVcore на развитие КМП, ассоциированной с HCV.
Непрямой иммунологический механизм поражения миокарда включает вовлечение в патологический процесс В-клеток, Т-клеток и макрофагов. Участие В-клеток в КМП, ассоциированной с HCV, предположено в результате обследования 3 пациентов с ассоциированным с HCV миокардитом, ответивших на иммуносупрессивную терапию. В сыворотке крови этих больных выявлены антитела к миокарду, что дало основание предполагать иммунологический механизм повреждения клеток. В дальнейшем подтверждение иммуноопосредованного механизма КМП, ассоциированной с HCV, было основано на эффективности иммуносупрессивных препаратов (преднизолон и азатиоприн), терапия которыми привела к нормализации размеров камер сердца и регрессу признаков СН, несмотря на продолжающуюся персистенцию HCV [54].
Прямой и непрямой механизмы развития ДКМП, ассоциированной с HCV, связаны со смертью клеток через апоптоз. Благодаря способности повышать продукцию АФК, протеин HCVcore может инициировать митохондриальный путь апоптоза. АФК могут вызывать диссоциацию цитохрома С на внутренней мембране митохондрий, что приводит к активации каспаз, результатом чего является фрагментация геномной ДНК и смерть клетки [64]. В результате связывания лигандов с внеклеточными рецепторами суперсемейства рецепторов α-ФНО происходит активация рецепторзависимого сигнального пути апоптоза [65]. Наиболее важными лигандами этих рецепторов являются α-ФНО и Fas-лиганд (FasL). Высокий уровень α-ФНО в миокарде у пациентов с ассоциированным с HCV миокардитом может активировать данный механизм смерти клеток путем взаимодействия с рецепторами ФНО [66].
Заключение
Имеются убедительные доказательства того, что поражение сердца служит одним из внепеченочных проявлений HCV-инфекции. Механизм, посредством которого HCV может приводить к поражению миокарда у генетически предрасположенных пациентов, является многофакторным и включает прямое повреждающее действие вируса, аутоиммунный механизм и апоптоз.
Поражение миокарда при ХГС может прогрессировать в хронический персистирующий миокардит через прямой (вирусный) и непрямой (иммунный) механизмы повреждения, которые приводят к активации зависимой от рецепторов смерти КМЦ, результатом чего является развитие фиброза миокарда с возможной трансформацией в ДКМП. Кроме того, описаны случаи взаимосвязи HCV и ГКМП.
До настоящего момента HCV-инфицированным больным с вовлечением сердца ПВТ, как правило, не проводилась из-за побочных эффектов ИФН. Однако за последние несколько лет в ПВТ вирусного гепатита С произошли кардинальные изменения. Длительное изучение механизмов репликации HCV привело к созданию ингибиторов протеаз HCV (NS¾A, NS5A, NS5B), которые позволяют достичь элиминации вируса у 90—99% пациентов за существенно более короткий срок (как правило, 12 нед) без применения препаратов ИФН (так называемая безинтерфероновая терапия). Это делает данную терапию гораздо более безопасной и хорошо переносимой, в том числе в отношении миокарда [67—69].
Нуждается в отдельном изучении вопрос эффективности и безопасности ПВТ у пациентов с ХГС и ассоциированного с ним поражения сердца, включая сравнение только ПВТ и сочетания ПВТ с сердечно-сосудистыми препаратами и/или иммуносупрессорами. Выявление антител к миокарду и определение уровня α-ФНО в сыворотке крови во время терапии может быть использовано для оценки влияния терапии на данные маркеры.
Что такое гепатит А (болезнь Боткина)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Вирусный гепатит А (Hepatitis A viruses, HAV) — острое инфекционное заболевание, вызываемое вирусом гепатита А, клинически характеризующееся синдромом общей инфекционной интоксикации, синдромом нарушения пигментного обмена, синдромами энтерита, холестаза, увеличением печени и в некоторых случая селезёнки, сопровождающееся нарушением функции печени, преимущественно доброкачественного течения.
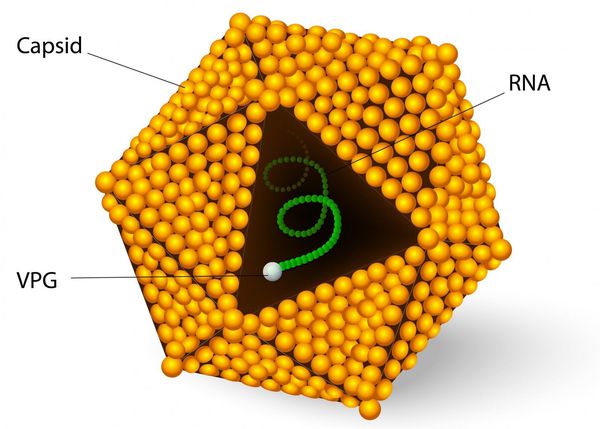
Этиология
семейство — пикорнавирусы (Picornaviridae)
вид — вирус гепатита А (HAV)
Во внешней среде очень устойчив: при температуре окружающей среды около 4°C сохраняется несколько месяцев, при 2°C — несколько лет, при замораживании очень длительно, при комнатной температуре — несколько недель. В растворе хлорсодержащих средств (0,5-1 мг/л) гибнет в течение часа, при 2,0-2,5 мг/л — в течение 15 минут, ультрафиолетовое облучение приводит к гибели в течение минуты, при кипячении сохраняется до 5 минут. В кислой среде желудка не погибает.
Наиболее значимым маркером вирусного гепатита А являются антитела класса М (анти-HAV IgM), которые образуются в начальный период заболевания и выявляются до 5 месяцев. Появление анти-HAV IgG (маркера перенесённой ранее инфекции) начинается с 3-4 недели заболевания. Антиген вируса выявляется в каловых массах за 7-10 дней до начала манифестных (явно выраженных) проявлений болезни. [1] [2] [4]
Эпидемиология
Заражение гепатитом А происходит при контакте с источником инфекции — живым человеком (больной различными формами заболевания и вирусоноситель). Больные с типичными формами являются главным источником распространения вируса (от конца скрытого и всего желтушного периодов).
Ежегодно в мире регистрируется примерно 1,5 млн случаев заболевания (количество субклинических и бессимптомных форм сложно даже представить). Смертность по миру в 2016 г., по данным ВОЗ, составила 7134 человек [10] .
Условно существует территориальное распределение по уровням инфицирования населения: высокий, средний и низкий.
Районы с высоким уровнем инфицирования это преимущественно Юго-Восточная Азия, Средняя Азия, Африка, Центральная Америка (плохие санитарные условия и низкий доход) — большинство населения к периоду взросления уже переболели и имеют иммунитет, вспышки болезни встречаются редко.
Районы со средним уровнем инфицирования — страны с переходной экономикой, развивающиеся, имеющие различия в санитарно-гигиенических условиях на территории одного региона, например Россия (большая часть населения к периоду взросления не болела и не имеет иммунитета к вирусу, возможны большие вспышки болезни).
Районы с низким уровнем инфицирования — развитые страны с высоким уровнем дохода и хорошими санитарно-гигиеническими условиями, например США, Канада, Европа, Австралия. Большинство людей не имеет иммунитета и не болела, вспышки случаются редко и чаще среди групп риска [7] .
В окружающую среду вирус выделяется преимущественно с фекалиями.
Механизм передачи: фекально-оральный (пути — водный, контактно-бытовой, пищевой), парентеральный (редко при переливании крови), половой (орально-анальный контакт).
Восприимчивость населения высокая.
Факторы риска заражения:
- высокая скученность населения;
- несоблюдение правил личной гигиены и правил хранения, обработки и приготовления продуктов питания;
- неудовлетворительное состояние объектов водоснабжения;
- бытовой очаг заболевания.
Кто находится в группе риска
- путешественники (особенно в страны жаркого климата и с плохими социальными условиями);
- гомосексуалисты;
- люди, употребляющие наркотики (любые), алкоголики;
- медработники (непривитые и не болевшие);
- бездомные;
- люди, имеющие постоянные контакты (в силу профессии или иных причин) с мигрантами из неблагополучных по гепатиту А регионов.
Характерна осенне-весенняя сезонность, повышенная привязанность к жарким южным регионам.
Иммунитет после перенесённого заболевания стойкий, пожизненный, то есть повторно заболеть нельзя [1] [3] [4] [7] [10] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гепатита А
Заболевание начинается постепенно. Инкубационный период гепатита А протекает 7-50 дней.
Синдромы вирусного гепатита А:
- общей инфекционной интоксикации;
- нарушения пигментного обмена (желтуха);
- энтерита (воспаление слизистой тонкой кишки);
- холестаза (уменьшение количества желчи, поступающей в двенадцатиперстную кишку);
- гепатолиенальный (увеличение печени и селезёнки);
- отёчный;
- нарушения функции печени.
Типичное течение болезни — это желтушная форма болезни средней степени тяжести (устаревшее название — желтуха или болезнь Боткина).
Начальный период болезни (преджелтушный) имеет продолжительность от 2 до 15 дней и может протекать по нескольким вариантам:
При осмотре обнаруживается увеличение печени и, в меньшей степени, селезёнки, чувствительность края печени, повышение ЧСС (пульса), носовые кровотечения. В конце периода моча темнее, а кал становится светлее.
Следующий период (желтушный) длительностью около 7-15 дней характеризуется снижением выраженности симптомов предшествующего периода (то есть с появлением желтухи самочувствие улучшается). Усиливается желтушное окрашивание склер, кожных покровов и слизистой оболочки ротоглотки. Моча приобретает цвет тёмного пива, кал белеет. Присутствует общая слабость, недомогание, плохой аппетит, чувство тяжести и переполненности в правом подреберье, больной расчёсывает себя из-за зуда кожи (лихенификация), появляются петехии (мелкие кровоизлияния) на коже.
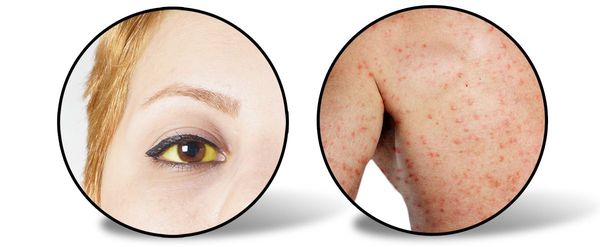
При врачебном исследовании выявляется увеличение печени и селезёнки, явственно положителен симптом Ортнера (болезненность при поколачивании ребром ладони по правой рёберной дуге), гипотония (может быть и нормотония), токсическая брадикардия (снижение ЧСС), появляются периферические отёки, возможны боли в суставах (артралгии).
Далее при благоприятном течении заболевания (которое наблюдается в большинстве случаев) происходит регресс клинической симптоматики, осветление мочи и потемнение кала, более медленное спадение желтушности кожи, склер и слизистых оболочек.
Под нетипичным течением болезни подразумеваются лёгкие безжелтушные формы гепатита А (отсутствие симптомов или лёгкая слабость без желтухи, тяжесть в правом подреберье), фульминантные формы.
Факторы, увеличивающие риск тяжёлого течения гепатита А:
Последствия для беременных
У беременных гепатит А протекает в целом несколько тяжелее, чем у небеременных. Примерно в 36 % случаев возможно развитие слабости родовой деятельности, преждевременные роды (31-37 неделя) и послеродовые кровотечения. Вирус не проникает через плаценту, то есть какого-то специфического действия на плод не оказывает. В грудном молоке вирус не содержится [1] [2] [4] [7] .
Патогенез гепатита А
Воротами для проникновения вируса является слизистая оболочка органов желудочно-кишечного тракта, где происходит его первичное размножение в эндотелиальной выстилке тонкого кишечника и мезентериальных лимфоузлах.
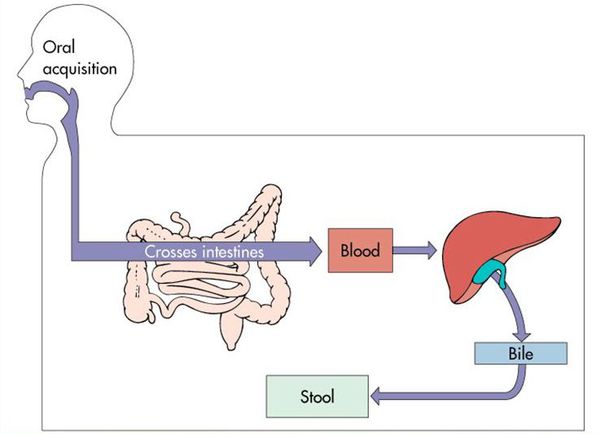
Далее происходит гематогенное распространение вирусных частиц и проникновение их в печень, где они локализуются в ретикулогистиоцитарных клетках Купфера и гепатоцитах. В результате этого происходит повреждение клеток:
- проникновение вируса в клетку;
- захват лизосомой;
- разрушение белковой оболочки вируса;
- сборка белков по программе вирусной РНК;
- встраивание этих белков в цитолемму клетки;
- образование патологических пор в оболочке клетки;
- поступление внутрь клетки ионов натрия и воды;
- баллонная дистрофия (разрушение ультраструктур клетки и образование крупных вакуолей) с последующим некрозом (его объём, как правило, ограничен);
- гибель клетки и лимфоцитарная иммунная реакция, приводящая к основному объёму поражения.
В дальнейшем вирус попадает в желчь, с ней он проникает в кишечник и выводится в окружающую среду с фекалиями. Вследствие компетентных реакций иммунной защиты размножение вируса заканчивается, и он покидает организм больного. [2] [3] [4]
Классификация и стадии развития гепатита А
По степени разнообразия проявлений выделяют две формы гепатита А:
- клинически выраженная (желтушная, безжелтушная, стёртая);
- субклиническая (инаппарантная).
По длительности течения также выделяют две формы гепатита А:
- острая циклическая (до трёх месяцев);
- острая затяжная (более трёх месяцев).
Степени тяжести гепатита А:
- лёгкая;
- среднетяжёлая;
- тяжёлая;
- фульминатная (молниеносная).
Согласно МКБ-10 (Международной классификации болезней десятого пересмотра), заболевание подразделяют на три вида:
- В15. Острый гепатит А;
- В15.0. Гепатит А с печёночной комой;
- В15.9. Гепатит А без печёночной комы. [2][4]
Осложнения гепатита А
Заболевание может привести к следующим осложнениям:
- печёночная кома (дисфункция центральной нервной системы, связанная с тяжёлым поражением печени — встречается крайне редко);
- холецистохолангит (выраженные боли в правом подреберье, нарастание желтухи и зуда кожи);
- гемолитико-уремический синдром, преимущественно у детей (гемолитическая анемия, тромбоцитопения, острая почечная недостаточность);
- развитие аутоиммунного гепатита I типа.
Гепатит А не приводит к формированию хронических форм, однако из-за выраженного воспалительного процесса возможно появление длительных резидуальных (остаточных) явлений:
- дискинезия (нарушение моторики) желчевыводящих путей;
- постгепатитная гепатомегалия (увеличение размеров печени из-за разрастания соединительной ткани);
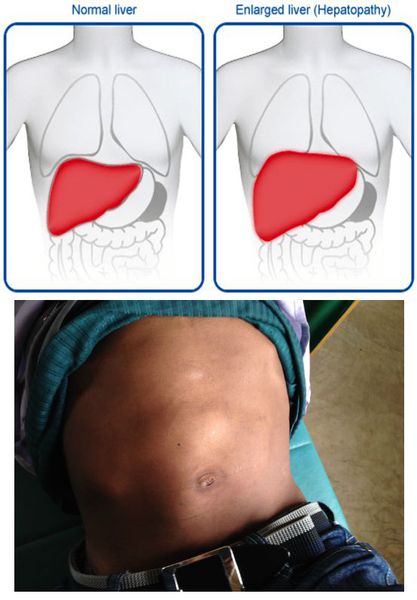
- постгепатитный синдром (повышенная утомляемость, аснено-невротические проявления, тошнота, дискомфорт в правом подреберье). [1][5]
Диагностика гепатита А
Методы лабораторной диагностики:
- Клинический анализ крови — нормоцитоз или лейкопения, лимфо- и моноцитоз, нейтропения, СОЭ в норме или снижена.
- Биохимический анализ крови — повышение общего билирубина и в большей степени его связанной фракции (реакция Эрлиха), повышение аланинаминотрансферазы и аспартатаминотрансферазы, снижение протромбинового индекса, повышение тимоловой пробы (снижение альбуминов и повышение гамма-глобулинов), повышение гамма-глутамилтранспептидазы, щелочной фосфатазы и другие показатели.
- Биохимический анализ мочи — появление уробилина и желчных пигментов за счёт прямого билирубина. Ранее, особенно в вооруженных силах, для выявления больных на начальной стадии практиковалось использование пробы Разина: утром производится опускание индикаторной полоски в мочу (при наличии уробилина она меняет цвет), и военнослужащий с подозрением на заболевание госпитализировался для углублённого обследования. Тест на уробилин становится положительным в самом начале заболевания — в конце инкубационного периода из-за болезни печёночной клетки.
- Серологические тесты — выявления анти-HAV IgM и анти-HAV IgG методом ИФА (иммуноферментного анализа) в различные периоды заболевания и HAV RNA с помощью ПЦР-диагностики (полимеразной цепной реакции) в острый период.
- Ультразвуковое исследование органов брюшной полости — увеличение печени и иногда селезёнки, реактивные изменения структуры печёночной ткани, лимфаденопатия ворот печени.
Обследование лиц, бывших в контакте с больным
Лица, контактирующие с больным вирусным гепатитом А, подлежат осмотру врачом-инфекционистом с последующим наблюдением до 35 дней со дня разобщения с больным. Наблюдение включает термометрию, осмотр кожных покровов, определение размеров печени и селезёнки, а также лабораторное обследование (АЛТ, общий билирубин, антитела классов М и G к вирусу гепатита А вначале и через три недели от первичного обследования).
Дифференциальная диагностика проводится со следующими основными заболеваниями:
- в начальный период: ;
- гастрит, гастроэнтероколит;
- полиартрит;
- энтеровирусная инфекция;
- в желтушный период: ;
- псевдотуберкулёз; ;
- желтухи другой этиологии (гемолитическая болезнь, токсические поражения, опухоли ЖКТ и другие заболевания);
- гепатиты другой этиологии (вирусные гепатиты В, С, Д, Е и другие, аутоиммунные гепатиты, болезнь Вильсона — Коновалова и т.п.) [1][2][3][4][9] .
Лечение гепатита А
Этиотропная терапия (направленная на устранение причины заболевания) не разработана.
Медикаменты
В зависимости от степени тяжести и конкретных проявлений назначается инфузионная терапия с глюкозо-солевыми растворами, обогащёнными витаминами. Показано назначение сорбентов, препаратов повышения энергетических ресурсов, при необходимости назначаются гепатопротекторы, в тяжёлых случаях — гормональные препараты, препараты крови, гипербарическая оксигенация и плазмаферез.
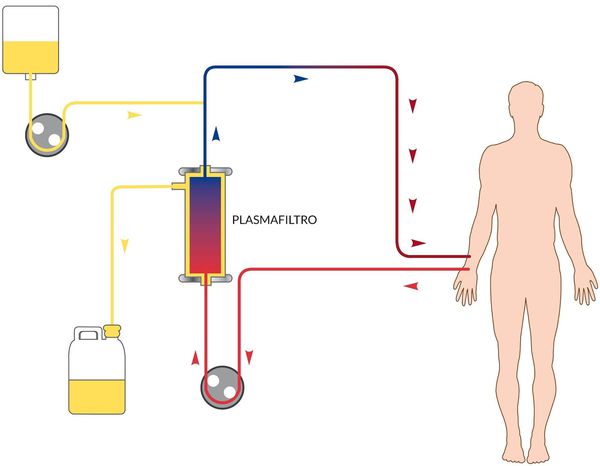
Нужна ли госпитализация
В случае лёгких форм гепатита А лечение может проводиться на дому (при наличии условий). Госпитализация потребуется, начиная со среднетяжёлых форм, лицам групп риска по тяжёлому течению, пациентам с осложнёнными формами, беременным и детям. Каких-либо особенностей при дальнейшем лечении вирусного гепатита А у детей нет.
Режим постельный или полупостельный. При гепатите А нарушаются процессы образования энергии в митохондриях, поэтому предпочтителен длительный отдых.
Лечение в стационаре и выписка
Лечение гепатита А проходит в инфекционном отделении больницы. Выписка пациентов происходит после появления стойкой и выраженной тенденции к клиническому улучшению, а также улучшения лабораторных показателей.
Критерии выписки больных:
- стойкая и выраженная тенденция к клиническому улучшению (отсутствие интоксикации, уменьшение размеров печени, регресс желтухи);
- стабильное улучшение лабораторных показателей (нормализация уровня билирубина, значительное снижение уровня АЛТ и АСТ).
При неосложнённых формах реконвалесценты (выздоравливающие больные) подлежат наблюдению в течении трёх месяцев с осмотром и обследованием не реже одного раза в месяц. [2] [3] [6]
Физиотерапия
В фазе реконвалесценции, особенно при затяжных формах болезни, возможно применение физиотерапевтических методов лечения:
- грязевых аппликаций на область правого подреберья;
- акупунктуры;
- массажа проекции области печени, желчного пузыря, желчевыводящих протоков.
Диета
Показана диета № 5 по Певзнеру — механически и химически щадящая, употребление повышенного количества жидкости и витаминов, запрет алкоголя. Исключается острое, жареное, копчёное, ограничивается кислое и соль. Все блюда готовятся на пару, тушатся, отвариваются и подаются только в тёплом виде.
Прогноз. Профилактика
Прогноз заболевания, как правило, благоприятный. Пациенты выздоравливают спустя 1-3 месяца после выписки из стационара. В редких случаях заболевание приобретает затяжной характер.
Критерии излеченности:
- отсутствие интоксикации;
- полная нормализация уровня билирубина, АЛТ и АСТ;
- нормализация размеров печени и селезёнки;
- появление в крови антител к вирусу гепатита А класса G (Anti-HAV-IgG).
Неспецифические мероприятия, позволяющие снизить количество случаев инфицирования:
- обеспечение условий и факторов потребления безопасной питьевой воды (водоснабжение);
- обеспечение и контроль за соблюдением утилизации сточных вод (канализационное хозяйство);
- контроль за качеством обследования персонала, связанного с пищевой промышленностью;
- контроль и соблюдение технологии хранения, приготовления и транспортировки пищевых продуктов и воды.
К личным профилактическим мерам относится тщательное мытьё рук после посещения туалета, смены подгузников, а также перед приготовлением или приёмом пищи.
Вакцинация
Специфическим профилактическим мероприятием является проведение иммунизации против гепатита А: практически у 100% привитых двукратно людей вырабатывается стойкий иммунитет, предотвращающий развитие заболевания. Вакцинация — это самый лучший способ предотвратить заражение.

Актуальность. На сегодняшний день вирусные заболевания печени занимают одно из ведущих мест в патологии человека. Вирусные гепатиты с парентеральной передачей инфекции остаются серьезной проблемой во всем мире, в том числе в республике Узбекистан. Среди хронически протекающих вирусных гепатитов лидирующее положение в Центрально-Азиатском регионе занимает НВV инфекция, в связи с высоким уровнем заболеваемости, тяжестью осложнений, приводящих к значительной инвалидизации и летальности [1, 2].
По данным ВОЗ треть населения мира инфицирована различными видами гепатотропных вирусов. В настоящее время в мире насчитывается около 200 млн. носителей вируса гепатита С, более 2 млрд. человек в мире являются носителями HBV-инфекции [1, 8].
Установлено, что в патогенез вирусных заболеваний печени вовлекается не только печень, но и другие органы, что обуславливает неблагоприятное течение и исход заболевания, создает препятствия при лечении, и как правило снижает эффективность последнего [2, 3, 7].
В настоящее время доказана тесная взаимосвязь поражений печени и сердечно-сосудистых заболеваний. Связь этих изменений рассматриваются с двух точек зрения: во-первых, в печени наступают изменения, обусловленные изначально поражением миокарда и связанные с этим расстройствами гемодинамики, кислородным голоданием, а с другой стороны, патология печени может явится причиной для возникновения или ухудшения уже имеющихся сердечно-сосудистых нарушений. Механизм возникновения сердечных осложнений объясняется нарушением сосудистой регуляции, также нарушается циркуляция медиаторов регуляции кровообращения, замедляется скорость инактивации альдостерона.
Целью исследования:изучить частоту и характер поражения сердца при хронических вирусных патологиях печени.
Материал и методы. Исследования проведены у 42 больных хроническим гепатитом (ХГ) вирусной этиологии (HBV, HCV, HBV+HCV), 28 мужчин (66,6 %) и 14 женщин (33,3 %), в возрасте от 20 до 67 лет. Диагноз и клиническая форма ХГ устанавливались в соответствии с приказом МЗ РУз № 5 от 05.01.2012г. В соответствии с заболеванием больные были разделены на 2 группы: ХГ умеренной степени лабораторной активности (ХГ II ст. акт.) — 20 (47,6 %), ХГ высокой степени лабораторной активности (ХГ III ст. акт.) — 22 (52,3 %).
Наряду с этим изучалось влияние курсовой дозы ингибитора ангиотензин превращающего фермента периндоприла (престариум) на динамику функциональных изменений сердца у 21 больного. Периндоприл назначался по 2 мг 1 раз в сутки в течение 120 дней, сначала в стационаре, затем в амбулаторных условиях.
Результаты исследования и их обсуждение. Результаты проведенных исследований показали, что у больных ХГ отмечается четкая тенденция функциональных изменений в миокарде.
У больных ХГ в патологический процесс вовлекались как правые, так и левые отделы сердца. В группе с ХГ II ст. акт. (n=20) после проведения УЗДКГ после поступления в стационар было отмечено повышение КДР-5,24±0,08; КСР-3,41±0,07; КДО-136,0±1,9; КСО-56,58±2,3; УО-73,29±0,22; ТЗСЛЖд,-1,2±0,053; ТМЖПд.-1,31±0,45. Изменение этих эхокардиографических параметров было статистически достоверно выше, по сравнению с показателями в контрольной группе (Р≤0,05). Наряду с изменениями в ЛЖ в патологический процесс вовлекались правые отделы — ТСПЖ-5,87±0,3; а также некоторое снижение ИС-0,24±0,56, что отражает процесс изменения геометрии ПЖ по типу концентрического ремоделирования (при этом индекс миокардиального стресса оставался в пределах нормы). Данные результаты указывают на развитие концентрического ремоделирования сердца.
Анализ результатов больных с ХГ III ст. акт. (n=22) позволил отметить нарастание систолической и диастолической перегрузок ЛЖ и ПЖ. Для некоторых параметров изменения были незначительными по сравнению с предыдущей группой — КДР-6,03±0,09; КДО-136,01±1,9, ТЗСЛЖ-1,32±0,03, ОТСЛЖ — 0,56±0,05 (Р≥0,05). Для других параметров — КСР-4,28±0,04. КСО-59,02±1,32, ИС-0,41±0,2 и МС-11,4 изменения были статистически достоверно больше, чем у больных ХГ II ст. активности (Р≤0,05). Миокард больных ХГ III ст. активности имел тенденцию к развитию концентрической гипертрофии ЛЖ. Также как у больных умеренной степени лабораторной активности наблюдались изменения правых отделов сердца. Были утолщение стенки ПЖ, увеличение индекса относительной толщины стенки ПЖ, ИС и повышение МС выше нормы (Р≤0,05). Как отмечалось выше, ЭхоКГ проводилось у подавляющего числа больных дважды до и после лечения, а также на 120 день амбулаторного наблюдения и лечения.
Анализ результатов повторного исследования на 14 день на фоне комплексного метаболического лечения показал, что в целом отмечалось незначительное улучшение работы сердца (Р≥0,05). Регистрировалось снижение КДО, КСО, ИС и МС; некоторое увеличение УО. В группе больных ХГ II ст. акт. КДО-130,01±0,9; КСО-51,23±1,3; ИС-0,27±0,026; МС-4,6±0,2. В группе ХГ III ст. акт. КДО-136,41±0,36; КСО-58,0±0,09; ИС-0,39±0,018; МС-12,2±2,1. УО-80,1±0,3.
Регистрировалось снижение КДО, КСО, ИС и МС практически до контрольных цифр (Р≤0,05). Наблюдалось некоторое недостоверное увеличение УО (Р≥0,05). В группе больных ХГ II ст. акт. КДО-127,0±0,4; КСО — 44,82±0,9; ИС-0,45±0,07; МС — 0,98±0,9. В группе ХГ III ст. акт. КДО-134,11±0,21; КСО-48,0±0,05; ИС-0,49±0,02; МС — 5,9±0,8, УО — 77,10±0,3.
Таким образом, ремоделирование сердечно-сосудистой системы при поражении печени является мультифакторным процессом и результатом взаимодействия гемодинамических и гуморальных составляющих, процессов адаптации и дезадаптации, на него оказывает влияние медикаментозная терапия. При изучении влияния препарата из группы и-АПФ (периндоприла) на гемодинамику сердца показал, что на фоне метаболической терапии в стационаре и лечения в течение 120 дней и-АПФ периндоприлом в группах больных наблюдалась отчетливая положительная динамика с клинически значимым изменением параметров функциональной перестройки.
- У больных ХГ с умеренной активностью воспаления изменения сердца характеризуются развитием концентрического ремоделирования, а у больных с высокой активностью -концентрической гипертрофией левого желудочка.
- Курсовое в течение 120 дней назначение больным хроническими гепатитами комплексного лечения с включением ингибитора АПФ лизиноприла, способствует улучшению структурно-функциональных изменений сердца и кардиогемодинамики.
Основные термины (генерируются автоматически): III, левый желудочек, акт, больной, группа больных, лабораторная активность, относительная толщина стенки, контрольная группа, концентрическая гипертрофия, патологический процесс.
Брадикардия – вид аритмии, с частотой сердечных сокращений менее 60 ударов в минуту. Встречается как вариант нормы у тренированных спортсменов, но чаще сопровождает различную сердечную патологию. Проявляется слабостью, полуобморочными состояниями и кратковременной потерей сознания, холодным потом, болями в области сердца, головокружением, нестабильностью АД. При выраженной брадикардии (чсс менее 40 ударов в минуту), ведущей к развитию сердечной недостаточности, может потребоваться операция по имплантации электрокардиостимулятора.
Общие сведения
Брадикардия – вид аритмии, с частотой сердечных сокращений менее 60 ударов в минуту. Встречается как вариант нормы у тренированных спортсменов, но чаще сопровождает различную сердечную патологию. Проявляется слабостью, полуобморочными состояниями и кратковременной потерей сознания, холодным потом, болями в области сердца, головокружением, нестабильностью АД. При выраженной брадикардии (чсс менее 40 ударов в минуту), ведущей к развитию сердечной недостаточности, может потребоваться операция по имплантации электрокардиостимулятора.
Независимо от причины, в основе брадикардии лежит нарушение способности синусового узла вырабатывать электрические импульсы с частотой выше 60 в минуту либо неадекватное их распространение по проводящим путям. Умеренная степень брадикардии может не вызывать расстройства гемодинамики. Редкий сердечный ритм при брадикардии приводит к недостатку кровоснабжения и кислородному голоданию органов и тканей, нарушая их полноценное функционирование.
У физически тренированных людей встречается физиологическая брадикардия, рассматриваемая как вариант нормы: у четверти молодых здоровых мужчин ЧСС составляет 50-60 в минуту; во время сна под влиянием физиологических колебаний вегетативной регуляции происходит урежение сердечного ритма на 30%. Однако, чаще брадикардия развивается на фоне уже имеющихся патологических процессов.

Классификация брадикардии
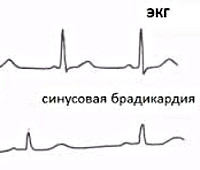
По локализации выявленных нарушений различают брадикардию синусовую, связанную с нарушениями автоматизма в синусовом узле, и брадикардию при блокадах сердца (синоатриальной или атриовентрикулярной), при которых нарушается проведение импульсов между синусовым узлом и предсердиями или предсердиями и желудочками. Частота сердечных сокращений может уменьшаться при физиологических условиях (у спортсменов, во сне, в покое) – это функциональная или физиологическая брадикардия; патологическая брадикардия сопровождает течение различных заболеваний.
Патологическая брадикардия может протекать в острой форме (при инфаркте миокарда, миокардитах, интоксикациях и т. д.) и исчезать после излечения вызвавшего ее заболевания, или хронической форме (при возрастных склеротических заболеваниях сердца). По причинам развития синусовой брадикардии выделяют следующие формы: экстракардиальную (нейрогенную), органическую (при поражениях сердца), лекарственную, токсическую и синусовую брадикардию спортсменов. Иногда по этиологии брадикардию подразделяют на токсическую, центральную, дегенеративную и идиопатическую.
Причины брадикардии
Экстракардиальная форма брадикардии может развиваться при нейроциркуляторной дистонии, неврозах с вегетативной дисфункцией, давлении на каротидный синус (при ношении тугого воротника или галстука), надавливании на глазные яблоки (рефлекс Ашнера), повышенном внутричерепном давлении (при менингите, ушибе мозга, субарахноидальном кровоизлиянии, отеке или опухоли мозга), язвенной болезни желудка и 12-перстной кишки. Брадикардия, развивающаяся при микседеме, пропорциональна выраженности гипотиреоза.
Причинами органической формы брадикардии могут являться инфаркт миокарда, миокардиодистрофии, миокардит, кардиосклероз. Эти заболевания приводят к дегенеративным и фиброзным изменениям в синусовом узле или нарушениям проводимости в миокарде, сопровождаясь развитием брадикардии.
При органическом поражении водителя ритма развивается синдром слабости синусового узла, и частота генерации импульсов в нем резко снижается. Это состояние сопровождается синусовой брадикардией - ритмичными, но очень редкими сокращениями сердца; сменой бради- и тахикардии или чередованием спонтанных водителей ритма. Крайняя степень поражения синусового узла проявляется отказом функции автоматизма, в результате чего им перестают вырабатываться электрические импульсы сердца.
При поражении проводящих путей миокарда развивается блокада проведения импульсов, в результате чего часть сигналов, генерируемых синусовым узлом, блокируется и не может достичь желудочков - развивается брадикардия. Развитию лекарственной формы брадикардии может способствовать прием сердечных гликозидов, хинидина, β-адреноблокаторов, симпатолитических препаратов (например, резерпина), блокаторов кальциевых каналов (например, верапамила, нифедипина), морфина.
Токсическая форма брадикардии развивается при выраженных интоксикациях, вызванных сепсисом, гепатитом, уремией, брюшным тифом, отравлением фосфорорганическими соединениями, и замедляющих процессы автоматизма и проведения в сердечной мышце. К этой группе иногда также относят брадикардию, вызванную гиперкальциемией или выраженной гиперкалиемией.
Так называемая, брадикардия спортсменов, характеризуется ЧСС до 35-40 в минуту даже в дневное время. Ее причиной служат особенности вегетативной регуляции сердечного ритма у людей, профессионально занимающихся спортом. Также к брадикардии могут приводить естественные процессы старения в организме; иногда причины брадикардии так и остаются невыясненными - в этих случаях говорят о ее идиопатической форме.
Симптомы брадикардии
Умеренно выраженная брадикардия обычно не сопровождается нарушениями кровообращения и не ведет к развитию клинической симптоматики. Возникновение головокружения, слабости, полуобморочных и обморочных состояний наблюдается при брадикардии с ЧСС менее 40 ударов в минуту, а также на фоне органических поражений сердца. Также при брадикардии появляются усталость, затрудненное дыхание, боли в груди, колебания АД, нарушение концентрации внимания и памяти, кратковременные расстройства зрения, эпизоды спутанного мышления.
В целом проявления брадикардии соответствуют тяжести нарушений гемодинамики, развивающихся на ее фоне.
На ослабление сократительной функции миокарда и замедление кровообращения первым реагирует головной мозг, испытывая гипоксию. Поэтому брадикардия нередко приводит к приступам потери сознания, судорог (приступы или продромы Морганьи-Адемса-Стокса), которые могут продолжаться от нескольких секунд до 1 минуты. Это самое опасное состояние при брадикардии, требующее оказания неотложных медицинских мероприятий, т. к. при затянувшемся приступе может наступить остановка дыхательной деятельности.
Диагностика брадикардии
Характерные для брадикардии признаки выявляются при сборе жалоб пациента и объективном обследовании. При осмотре определяется редкий пульс, который при синусовой брадикардии имеет правильный ритм, выслушиваются сердечные тоны обычной звучности, нередко обнаруживается дыхательная аритмия. Пациентам с выявленной брадикардией рекомендована консультация кардиолога.
Электрокардиографическое исследование при брадикардии позволяет зафиксировать редкую ЧСС, наличие синоатриальной или атриовентриуклярной блокады. Если в момент регистрации ЭКГ эпизоды брадикардии не выявляются, прибегают к проведению суточного мониторирования ЭКГ.
При органической форме брадикардии проводят УЗИ сердца. Методом ультразвуковой ЭхоКГ определяется снижение фракции выброса менее 45%, увеличение размеров сердца, склеротические и дегенератвные изменения миокарда. С помощью проведения нагрузочной велоэргометрии оценивается прирост ЧСС в связи с заданной физической нагрузкой.
При невозможности выявления преходящих блокад методами ЭКГ и холтеровского мониторирования, проводится чреспищеводное электрофизиологическое исследование проводящих путей сердца. С помощью проведения ЧПЭФИ можно определить органический или функциональный характер брадикардии.
Лечение брадикардии
Функциональная и умеренная брадикардия, не сопровождающаяся клиническими проявлениями, не требуют терапии. При органической, экстракардиальной, токсической формах брадикардии проводится лечение основного заболевания. При лекарственной брадикардии требуется коррекция дозировки или отмена препаратов, замедляющих сердечный ритм.
При проявлениях гемодинамических нарушений (слабости, головокружениях) проводится назначение препаратов красавки, корня женьшеня, экстракта элеутерококка, изопреналина, эфедрина, кофеина и других в индивидуально подобранных дозах. Показаниями к активному лечению брадикардии служат развитие стенокардии, артериальной гипотонии, обмороков, сердечной недостаточности, желудочковой аритмии.
Возникновение приступа Морганьи—Адамса—Стокса требует консультации кардиохирурга и решения вопроса об имплантации электрокардиостимулятора – искусственного водителя ритма, вырабатывающего электрические импульсы с физиологической частотой. Адекватный и постоянный заданный сердечный ритм способствует восстановлению нормальной гемодинамики.
Прогноз и профилактика брадикардии
Неблагоприятно влияет на прогноз течения брадикардии наличие органических поражений сердца. Значительно отягощает возможные последствия брадикардии возникновение приступов Морганьи—Адамса—Стокса без решения вопроса о проведении электростимуляции. Сочетание брадикардии с гетеротопными тахиаритмиями повышает вероятность тромбоэмболических осложнений. На фоне стойкого снижения ритма возможно развитие инвалидизации пациента. При физиологической форме брадикардии или ее умеренном характере прогноз удовлетворительный.
Своевременное устранение экстракардиальных причин, органических поражений сердца, токсических воздействий на миокард, правильный подбор дозировок лекарственных средств позволят предотвратить развитие брадикардии.
Читайте также:

