Почему при кишечной инфекции не пьют противовирусные
Обновлено: 05.05.2024
1 Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89
2 Самарская городская клиническая больница №2 имени Н.А. Семашко; 443008, Россия, Самара, ул. Калинина, д. 32
Резюме
Введение. Ротавирусная инфекция является ведущей причиной острых гастроэнтеритов у детей раннего возраста. В связи с отсутствием этиотропного лечения вирусных гастроэнтеритов интерес ученых и практических врачей к использованию противовирусных препаратов возрастает. В исследованиях отечественных авторов доказано, что низкомолекулярный индуктор интерферона (меглюмина акридонацетат) обладает противовирусной, иммунорегуляторной и противовоспалительной активностью.
Цель исследования. Оценить эффективность и безопасность противовирусного препарата меглюмина акридонацетата при лечении острого гастроэнтерита ротавирусной этиологии у детей 4-7 лет в условиях стационара.
Материалы и методы. Проведен проспективный анализ случаев лечения ротавирусного гастроэнтерита средней тяжести препаратом меглюмином акридонацетатом у детей дошкольного возраста (п = 29, 1-я группа). Группу сравнения составили пациенты, получавшие стандартную терапию (п = 31, 2-я группа). Наличие ротавирусной инфекции подтверждено обнаружением антигена возбудителя в кале. Препарат меглюмина акридонацетат назначался по схеме через день парентерально.
Результаты и обсуждение. Эффективность терапии противовирусным препаратом на 3-и сутки лечения ротавирусного гастроэнтерита средней тяжести составила 79,3% (р < 0,05). Ликвидация основных клинических симптомов заболевания отмечалась на 2-е-3-и сутки: наблюдалось снижение интоксикации, лихорадки, достоверное уменьшение продолжительности рвоты и диареи (р < 0,05), сокращение периода элиминации возбудителя на 2,67 суток (р < 0,01). У всех пациентов переносимость препарата была хорошей, побочные и нежелательные эффекты выявлены не были.
Выводы. Препарат меглюмина акридонацетат может быть рекомендован для комплексного лечения ротавирусной инфекции средней тяжести с первых дней заболевания.
Ключевые слова: дети, острый гастроэнтерит, ротавирусная инфекция, меглюмина акридонацетат, проспективный анализ
Experience with the use of the drug cycloferon in the treatment of rotaviral infection in children
Olga V. Borisova 1 , Nataliya M. Bochkareva 1 , Nataliya S. Polezhaeva 1 , Tamara A. Zhilyakovа 2 , Nataliya G. Tsaryova 1 , Ekaterina V. Berdnikova 1
1 Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia
2 Semashko Samara City Clinical Hospital No. 2; 32, Kalinin St., Samara, 443008, Russia
Abstract
Introduction. Rotavirus infection is the leading cause of acute gastroenteritis in young children. Due to the lack of etiotropic treatment of viral gastroenteritis, the interest of scientists and practitioners in the use of antiviral drugs is increasing. Studies of domestic authors have proven that the low molecular weight interferon inductor - meglumine acridonacetate has antiviral, immunoregulatory and anti-inflammatory activity.
Aim. Evaluation of the efficacy and safety of the antiviral drug meglumine acridonacenate in the treatment of acute gastroenteritis of rotavirus etiology in children aged 4-7 years in a hospital setting.
Materials and methods. A prospective analysis of cases of treatment with meglumine acridonacetate for moderately severe rotavirus gastroenteritis in preschool children (n = 29, group I) was carried out. The comparison group consisted of patients receiving standard therapy (n = 31, group II). The presence of rotavirus infection was confirmed by the detection of the pathogen antigen in the feces. Meglumine acridonacetate was prescribed according to the scheme, parenterally, every other day.
Results and discussion. The effectiveness of therapy with an antiviral drug on the 3 rd day of treatment of moderately severe rotavirus gastroenteritis was 79.3% (p < 0.05). The elimination of the main clinical symptoms of the disease was noted on days 2-3: a decrease in the symptoms of intoxication, fever, a significant decrease in the duration of vomiting and diarrhea (p < 0.05), a reduction in the pathogen elimination period by 2.67 days (p < 0.01), meglumine acridonacetate was well tolerated, no side effects of the drug were detected.
Conclusions. Meglumine acridonacetate can be recommended for the complex treatment of moderate rotavirus infection from the first days of the disease.
Keywords: children, acute gastroenteritis, rotavirus infection, meglumine acridonacetate, prospective analysis
Ротавирус вызывает диарейный синдром вследствие двух реализуемых механизмов: осмотической диареи, которая развивается из-за мальабсорбции (вторична по отношению к повреждению и гибели энтероцитов или снижению абсорбционной функции эпителия) и секреторной диареи, появляющейся из-за эффектов неструктурного белка энтеротоксина NSP4 и активации кальций-зависимых хлоридных каналов [4]. Восприимчивость к ротавирусной инфекции моделируется как иммунологическими, так и не иммунологическими факторами (дифференциальная экспрессия ротавирусных рецепторов в кишечнике, состав желудочного сока и др.) [5].
Ротавирусы распознаются рецепторами (PRR) в энтероцитах или в клетках иммунной системы, в т. ч. в макрофагах, дендритных клетках или в адаптивных В-клетках и Т-клетках. Вирус избегает воздействия направленных на него факторов врожденного иммунитета, синтезируя антагонист интерферонов - NSP1-протеин, - который воздействует на клеточные белки, необходимые для продукции IFN, а также ингибирует активацию STAT1, который вызывает транскрипцию IFN-стимулированных генов (ISG) и повышает продукцию IFN [3, 6, 7]. Таким образом, ротавирус блокирует ответы IFN I и III типов (рис. 1).
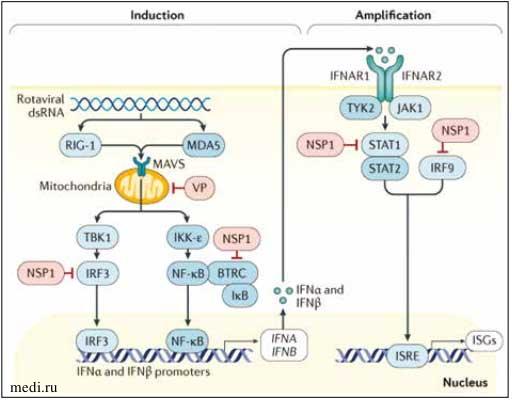
Рисунок 1. Ротавирус-опосредованное ингибирование индукции и амплификации интерферона [3]
Figure 1. Rotavirus-mediated inhibition of interferon induction and amplification [3]
Индукторы интерферона - это семейство природных и синтетических соединений, стимулирующих пролиферацию и дифференцировку клеток костного мозга с использованием механизмов врожденного и адаптивного иммунитетов [8]. Представителем низкомолекулярных индукторов IFN является Циклоферон (меглюмина акридонаце-тат), противовирусная активность которого связана с выработкой эндогенного интерферона и прямым воздействием на репликацию вируса. Препарат обладает иммунорегуляторной активностью вследствие активации IFN-γ и противовоспалительной активностью: он оказывает ингибирующее влияние на синтез провоспалительных цитокинов IL-1, IL-8, TNF-a. Кроме этого, Циклоферон активирует гуморальный и клеточный ответы, фагоцитоз, усиливает функциональную активность нейтрофильных гранулоцитов, способствует выработке всех трех типов интерферона - I, II, III (альфа-, бета-, гамма-интерферон и лямбда-интерферон) [8, 9]. Эндогенная интерферонизация (использование индукторов интерферона) имеет преимущества перед введением экзогенного IFN. При введении Циклоферона синтезируется собственный IFN, который не обладает антигенной активностью.
В Российской Федерации проводятся многочисленные исследования, посвященные эффективности использования индукторов интерферона в лечении острых респираторных вирусных инфекций. Так, Мазина Н.К. и др. в исследовании, проведенном в 2017 г., проанализировали 531 публикацию по оценке клинической эффективности Циклоферона при вирусных инфекциях органов дыхания и иммунодефицитных состояниях у детей и взрослых [10]. Однако известно не так много исследований применения препарата при кишечных инфекциях вирусной этиологии. Согласно данным научной работы Романцова М.Г. и др., осуществленной в 2010 г., Циклоферон в таблетках чаще назначается при ОРВИ (в 62,5% случаев) и герпесвирусных инфекциях (в 32% случаев), тогда как его применение при кишечных инфекциях составляет лишь 13,6% [8].Ученые Смоленского государственного медицинского университета изучили эффективность препарата у пациентов с хроническим эрозивным гастритом, ассоциированным с Helicobacter pylori, и герпесвирусной инфекцией [11]. Применение Циклоферона на фоне эрадикационной терапии позволяет сократить частоту обострений заболевания и увеличить срок ремиссии.
Гордеец А.В. и др. в 2007 г. провели плацебо-контролируемые исследования больных ротавирусной инфекцией, которые получали препарат Циклоферон (86 детей) и плацебо (22 ребенка). Авторы выявили высокую эффективность Циклоферона: основные симптомы заболевания (рвота, диарея, лихорадка) исчезали на 1,5-2 дня раньше по сравнению с группой контроля. Отмечено повышение продукции IL-2 до 60 кг/мл, что в 6 раз выше по сравнению с пациентами, получающими плацебо (10 кг/мл). Исследователи рекомендуют использовать препарат с первых дней заболевания в комплексной терапии ротавирусной инфекции [12].
Романцовым М.Г. и Тихомировой О.В. показана зависимость течения кишечных инфекций вирусной этиологии от интенсивности антительного ответа и индукции IFN-a, что является основанием применения Циклоферона в комплексной терапии кишечных инфекций [13]. Исследователями доказано, что использование препарата привело к сокращению продолжительности основных клинических проявлений ротавирусной инфекции (лихорадка, интоксикация, катаральные явления, диарея и др.). У пациентов, получавших препарат, отмечено снижение ротавирусного антигена в 7,1 раза на фоне стимуляции противовирусных антител, которые увеличились в 2,9 раза [13].
Таким образом, основываясь на данные научных исследований вышеуказанных авторов, при лечении ротавирусной инфекции Циклофероном значимое улучшение симптомов заболевания наступает на 2-й-3-й день терапии, отмечается также эффективность и хорошая переносимость лекарственного средства.
Целью нашего исследования является оценка эффективности и безопасности препарата Циклоферон при лечении ротавирусной инфекции у детей 4-7 лет.
Материалы и методы
Проведено проспективное исследование на базе инфекционного отделения Самарской городской клинической больницы №2 имени Н.А. Семашко (клиническая база кафедры детских инфекций Самарского государственного медицинского университета). В исследование вошли 60 детей, средний возраст которых составил 5,8 лет [4,2; 6,7], по половому составу преобладали мальчики (58,3%). У всех детей было диагностировано среднетяжелое течение ротавирусной инфекции. Пациенты были разделены на две группы:
1- я группа - дети с ротавирусной инфекцией (п = 29), которые получали Циклоферон (меглюмина акридонаце-тат) в инъекциях в дополнение к стандартной терапии [13]. В соответствии с инструкцией по использованию препарата детям были назначены инъекции 1 раз в сутки через день в дозировке 10 мг/кг;
2- я группа - дети с ротавирусной инфекцией (п = 31), получавшие стандартную терапию [14].
Критерии включения пациентов в исследование были следующими: наличие ротавирусной инфекции, подтвержденной обнаружением антигенов ротавируса в кале больных до начала терапии; отсутствие других вирусных и бактериальных агентов, поражающих желудочно-кишечный тракт; среднетяжелая форма заболевания; поступление в стационар не позднее 1-2 суток от начала заболевания. Критерии исключения: пациенты с легкими и тяжелыми формами ротавирусной инфекции; дети с иммунодефицитами и отягощенным преморбид-ным фоном (аллергические заболевания, дисбиотические проявления).
Всем пациентам проводились такие лабораторные исследования, как общеклинический анализ крови и мочи, биохимическое исследование крови, бактериологическое исследование кала на кишечную группу бактерий. Обнаружение антигенов ротавируса в образцах кала проведено методом иммунохроматографии с помощью набора 360 R Ротавирус (H&R Rotavirus, Испания). Методом иммунохроматографии исключали вирусную микст-инфекцию: адено-, астро- и норовирусы.
Протокол исследования был утвержден этическим комитетом Самарского государственного медицинского университета. Также было получено информированное письменное согласие законных представителей обследованных детей.
Статистическая обработка числового материала проводилась с использованием статистического пакета Statistica 7.0 (StatSoft, США). Для оценки различий показателей применялся U-критерий Манна-Уитни. Результаты считались статистически значимыми при р < 0,05.
Результаты и обсуждение
Диагноз ротавирусной инфекции устанавливался на основании характерных клинико-эпидемиологических данных: зимний/зимне-весенний сезон, локальность семейных очагов, наличие гастроэнтерита, рвоты, предшествующей им диареи или всех симптомов одновременно, у части детей присутствовали катаральные проявления. У всех пациентов заболевание началось с остро или умеренно выраженных симптомов интоксикации: дети поступали в стационар с жалобами на вялость, снижение аппетита, боль в животе, рвоту и диарею. У всех обследованных детей была среднетяжелая форма заболевания. Тяжелая форма болезни, осложненная токсикозом с эксикозом, чаще регистрировалась у детей в возрасте до 3 лет. Основные клинические симптомы при госпитализации детей представлены на рис. 2.
Рисунок 2. Основные клинические симптомы у детей с ротавирусной инфекцией
Figure 2. The main clinical symptoms in children with rotavirus infection
Всем пациентам была назначена стандартная базисная терапия: оральная или по показаниям парентеральная регидратация, диета, сорбенты (смектит диоктаэдрический - 1-2 пакетика в сутки), ферменты (креон, мезим форте, панкреатин), антипиретики (при лихорадке >38,5 о С рекомендовано применять литическую смесь или парацетамол в возрастных дозировках внутрь). В лечении всех изученных пациентов не использовались противовирусные препараты и пробиотики. В дополнение к вышеуказанной терапии пациентам 1-й группы был назначен Циклоферон в инъекциях через день. Средняя продолжительность клинических симптомов ротавирусной инфекции у детей в зависимости от терапии представлена в табл. 1.
Таблица 1.
Table 1.
Продолжительность основных симптомов ротавирусной инфекции в зависимости от проводимой терапии
The duration of the main symptoms of rotavirus infection, depending on the therapy
Основные клинические симптомы/синдромы
Средняя продолжительность (сутки)
Рисунок 3. Элиминация ротавируса у пациентов обеих групп
Figure 3. Elimination of rotavirus in patients of both groups
Согласно нашим данным, элиминация возбудителя (прекращение выделения антигена ротавируса в кале) у пациентов, получающих Циклоферон в дополнение к стандартной терапии, отмечалась на 2,67 дня раньше (р < 0,01). Следовательно, эффективность лечения была достигнута на 3-й день терапии Циклофероном и составила 79,3% (отношение шансов (ОШ): 0,22 (0,05-0,72), р < 0,05).
Безопасность препарата оценивалась по следующим критериям: переносимость и возникновение побочных реакций. Согласно проведенному исследованию Цикло-ферон обладает хорошей переносимостью, побочных нежелательных эффектов препарата выявлено не было.
Клинический случай
Мальчик, 6 лет, заболел остро: повышение температуры до 37,6 °С, двукратная рвота, на 2-е сутки болезни появился жидкий водянистый стул до 10-12 раз в день. При лихорадке в 38,5 о С машиной скорой помощи ребенок был доставлен в инфекционный стационар. В семье были больны еще двое детей-школьников. При объективном осмотре состояние пациента было средней тяжести: кожные покровы чистые бледные, губы сухие, слизистые ротоглотки гиперемированы. Живот умеренно вздут, отмечалась умеренная болезненность при пальпации. Печень и селезенка не увеличены. Обильный пенистый водянистый стул без видимых патологических примесей, с кислым запахом. Мочился достаточно. В общем анализе крови воспалительные изменения не обнаружены, СОЭ -10 мм/ч. Изменения копрограммы соответствовали поражению тонкого кишечника: наблюдалось умеренное количество непереваренной клетчатки, нейтрального жира и мышечных волокон. В кале обнаружен антиген ротавируса. В связи с этим был поставлен диагноз - ротавирусный гастроэнтерит средней тяжести.
Пациенту было назначено следующее лечение: диета, оральная регидратация, Циклоферон в дозе 10 мг/кг через день в/м, диоктаэдрический смектит, креон, литическая смесь при температуре выше 38,5 °С.
После 6-8 ч проводимой терапии состояние ребенка улучшилось: температура понизилась до 37,2 °С, рвота прекратилась, улучшился стул (3 раза в день, разжиженный, необильный). На 2-е сутки лечения наблюдалась нормализация температуры, стул - 2 раза в день, кашицеобразный. На 3-и сутки прекратилась диарея, температура тела имела нормальные показатели, восстановился аппетит, гиперемия ротоглотки не была выявлена.
Таким образом, использование Циклоферона привело к купированию основных симптомов болезни на 3-й день. Уже на 4-е сутки отмечалось полное выздоровление ребенка. Побочных эффектов при приеме препарата не было выявлено. Препарат Циклоферон доказал свое противовирусное и иммунорегуляторное действие. Показана его высокая эффективность и безопасность при лечении ротавирусного гастроэнтерита средней тяжести у детей.
Информация об авторах:
Борисова Ольга Вячеславовна, д.м.н., профессор, заведующая кафедрой детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Бочкарева Наталия Михайловна, к.м.н., доцент, доцент кафедры детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Полежаева Наталья Сергеевна, к.м.н., доцент, доцент кафедры детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Жилякова Тамара Анатольевна, ассистент кафедры детских инфекций, заведующая инфекционным отделением, Самарская городская клиническая больница №2 имени Н.А. Семашко; 443008, Россия, Самара, ул. Калинина, д. 32.
Царёва Наталия Герасимовна, ассистент кафедры детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Бердникова Екатерина Викторовна, аспирант кафедры детских инфекций, Самарский государственный медицинский университет; 443099, Россия, Самара, ул. Чапаевская, д. 89.
Information about the authors:
Olga V. Borisova, Dr. Sci. (Med.), Professor, Head of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Nataliya M. Bochkareva, Cand. Sci. (Med.), Associate Professor of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Nataliya S. Polezhaeva, Cand. Sci. (Med.), Associate Professor of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Tamara A. Zhilyakovа, Assistant of the Department of Children’s Infections, Head of the Department of Infectious Diseases, N.A. Semashko Samara City Clinical Hospital No. 2; 32, Kalinin St., Samara, 443008, Russia.
Nataliya G. Tsareva, Assistant of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Ekaterina V. Berdnikova, Postgraduate Student of the Department of Children’s Infections, Samara State Medical University; 89, Chapaevskaya St., Samara, 443099, Russia.
Список литературы / References
Острая кишечная инфекция (ОКИ) — это инфекционное воспаление желудка и кишечника, которое проявляется диареей (жидкий стул более 3 раз в сутки), иногда тошнотой, рвотой и повышением температуры тела. Примерно в 80% случаев кишечная инфекция вызывается вирусами (очень часто это ротавирус), то есть применение антибиотиков не будет иметь никакого эффекта.
Чего нужно бояться при кишечной инфекции и как не попасть в больницу
Самое опасное для ребенка с поносом и рвотой — обезвоживание. Именно из-за него приходится госпитализировать ребенка, если родители не смогли его отпоить. Как этого не допустить, мы с вами очень подробно разберем ниже.
Что мне делать, если мой ребенок заболел ОКИ?
Чаще всего нетяжелые кишечные инфекции можно лечить в домашних условиях. При появлении симптомов заболевания желательно связаться со своим врачом и предупредить его, что ваш ребенок заболел, и подробно описать всю ситуацию. Диарея и рвота (плюс еще и повышение температуры) — это потеря воды и солей, а значит, первое и основное, что должны сделать родители — восполнить уже имеющиеся потери и постоянно компенсировать то, что будет теряться дальше.
Сколько давать жидкости?
В среднем для отпаивания ребенка при острой кишечной инфекции нужно примерно 100 мл на каждый килограмм массы тела (1000 мл для малыша весом 10 кг), но может понадобиться и больше. Чтобы было более удобно, вам нужно следить за тем, чтобы у ребенка была влажная кожа и писал он примерно раз в три часа. Если писаете реже – значит, недоработали, давайте больше пить, пока мочеиспускания не участятся.
Чем отпаивать?
Чем кормить?
Пока у ребенка рвота, ему вообще нет смысла давать еду — только жидкость. Когда рвота прекратится, то параллельно с отпаиванием вы можете предлагать уже и еду, но строго по аппетиту! Не нужно кормить насильно — это только вызовет рвоту и усилит понос. Дети на грудном вскармливании прекрасно обходятся грудным молоком + солевые растворы или компот при необходимости. Более старшие дети могут начинать с легко усваиваемых продуктов: фруктовые кисели, сухари с чаем, галетное печенье, рисовая каша (с компотом, например), супы не на бульоне.
Основное правило — давайте часто, но понемногу. Через день-два уже можно возвращаться к прежним продуктам (тому, что ел до болезни), исключив на некоторое время жареное, жирное и острое.
Какое еще лечение эффективно при кишечной инфекции?
Всемирная организация здравоохранения и другие крупные медицинские организации рекомендуют помимо восполнения жидкости и продолжения кормления принимать препараты цинка. Многочисленные исследования показали, что прием препаратов цинка (10–20 мг в сутки вплоть до прекращения диареи) существенно снижает тяжесть и продолжительность диареи у детей младше 5 лет. В настоящее время на основании проведенных исследований рекомендуется вводить цинк (10–20 мг/день) в рацион всех детей с диареей в течение 10–14 дней.
Также вы много слышали о пробиотиках. Доказано, что пробиотики снижают длительность диареи у детей на фоне кишечной инфекции в среднем на 24 часа. Это все, на что вы можете рассчитывать.
Можно ли детям назначать противодиарейный препарат лоперамид?
Нет. Это лекарство запрещено для применения детям в связи с риском развития угрожающих жизни побочных эффектов.
Если почти 80 % всех кишечных инфекций вызываются вирусами, значит, будут очень полезны противовирусные препараты?
А когда нужно давать антибиотики?
Антибиотики при острых кишечных инфекциях показаны довольно редко, в основном это так называемые инвазивные диареи, когда в кале появляется кровь. Еще их применяют в случае заболевания холерой, а также внекишечными бактериальными инфекциями, которые приводят к развитию диареи (пневмония, средний отит и т. д.). Как вы уже поняли, примерно в 80 % всех случаев кишечных инфекций антибиотики назначаются зря. И это как минимум.
Я не хочу, чтобы мой ребенок заболел. Как предотвратить это?
Как все запутано! А можно на примере объяснить, как же все-таки правильно лечить острую кишечную инфекцию?
А если у ребенка поднимается температура?
Вы можете дать жаропонижающий препарат для облегчения состояния — ибупрофен или парацетамол в обычной дозировке. Подробнее о лихорадке и методах борьбы с ней можете почитать Правда и мифы о лихорадке.
Малыш отказывается пить. Как поступить?
Сколько будет длиться этот понос?
В большинстве случаев самая острая фаза диареи прекращается за 5–7, реже — 9 дней. После этого у ребенка может оставаться на некоторое время жидковатый неоформленный стул, пока не восстановится кишечник, но это уже не профузный понос 10–20 раз за сутки.
Когда нужно немедленно обращаться к врачу?
По большому счету, в двух ситуациях:
1) если у ребенка в кале появилась кровь. Появление крови в кале говорит о поражении толстого кишечника, что чаще всего бывает при бактериальных кишечных инфекциях, — в таком случае может понадобиться антибиотик;
2) если вы не справились с отпаиванием, то есть, вопреки всем вашим стараниям, у ребенка кожа стала сухой и он не писал в течение 6 часов (у грудных детей памперс сухой на протяжении 6 часов), вам нужно обратиться за медицинской помощью, поскольку, скорее всего, понадобится внутривенное восполнение жидкости.
опубликовано 02/05/2016 16:26
обновлено 03/03/2019
— Инфекционные болезни
- заболевания, вызываемые неустановленным возбудителем (около 70% случаев);
- острые кишечные инфекции, вызываемые установленным возбудителем (около 20%);
- бактериальная дизентерия (около 10%).
Важно, что в наиболее обширную группу ОКИ неустановленной этиологии входят и большинство так называемых пищевых токсикоинфекций (ПТИ) — эту группу составляют приблизительно 20 этиологически разных, но патогенетически и клинически сходных заболеваний, не представляющих эпидемической опасности.
Более чем в половине случаев этиологию ОКИ не удается установить ни клинически, ни лабораторно. Эта задача, равно как и выбор патогенетического лечения, тем более не может быть решена (да и не ставится) на этапе догоспитальной помощи. Усилия врача скорой медицинской помощи (СМП) должны быть направлены на:
- коррекцию тяжелых нарушений жизненно важных функций организма больного;
- дифференцирование инфекционного, терапевтического или хирургического генеза заболевания;
- решение вопроса о необходимости госпитализации больного для специализированного лечения или проведения противоэпидемических мероприятий.
Клиническая картина ОКИ
ОКИ — заболевания различной этиологии и семиотики — объединяют общий для всех этих состояний, преимущественно фекально-оральный, способ передачи возбудителя и развитие вследствие этого характерного симптомокомплекса острой диареи (табл. 1).
ПТИ также относятся к БД, так как вызываются условно-патогенными бактериями и в ряде случаев имеют групповой, эксплозивный характер. Однако в подавляющем большинстве случаев ПТИ протекают спорадически с развитием острого гастрита, гастроэнтерита или гастроэнтероколита, с той или иной степенью обезвоживания и интоксикации и имеют благоприятный прогноз.
При диарее вирусной этиологии (ВД) целостность слизистой оболочки желудочно-кишечного тракта в большинстве случаев не нарушается и в процесс редко вовлекается толстая кишка. Инкубационный период, как правило, более короткий, чем при эпидемической БД. Острый вирусный гастроэнтерит, хотя и сопровождается лихорадкой и нарушением общего состояния больного, редко приводит к тяжелой интоксикации, развитию выраженной воспалительной реакции и дегидратации организма больного. К числу значимых дифференциальных критериев ВД можно отнести отсутствие при этих заболеваниях выраженной боли в животе, водянистый, а не слизисто-гнойный и кровавый характер испражнений. ВД нередко сопровождается острым респираторным заболеванием, особенно у детей. Продолжительность ВД редко превышает 3 дня, и в целом заболевание имеет благоприятный прогноз. Пациенты с относительно легким течением ВД в госпитализации не нуждаются.
Из ОКИ паразитарного происхождения (ПД) наибольшее клиническое значение имеют амебиаз и лямблиоз. Известно, что клиническая картина амебной дизентерии развивается приблизительно у 10% инфицированных амебой больных. Амебный колит характеризуется сильнейшей болью в животе, лихорадкой и кровавой диареей, которая чревата перфорацией толстой кишки. Генерализация амебиаза сопровождается септикопиемией с образованием абсцессов печени, легких или головного мозга и крайне неблагоприятным прогнозом для жизни больного. Заболевание носит эндемичный характер. Лямблиоз на территории России распространен очень широко и в 25-50% случаев приводит к развитию острого или хронического энтерита, сопровождающегося диареей. Наибольшую помощь в постановке доклинического диагноза при ПД может оказать тщательный сбор анамнеза настоящего заболевания и анамнеза жизни пациента, поскольку особую группу риска образуют лица, практикующие анальные сексуальные контакты.
В современной классификации ОКИ выделяют так называемые особые формы заболевания:
- диарея путешественников;
- диарея у мужчин-гомосексуалов;
- диарея у ВИЧ-инфицированных;
- антибиотико-ассоциированная диарея;
- синдром избыточного роста бактерий в желудочно-кишечном тракте.
Из особых форм ОКИ для практики врача СМП имеет значение лишь один из вариантов антибиотико-ассоциированной диареи — псевдомембранозный колит. Это заболевание развивается во время или значительно после приема антибактериальных препаратов и связано с колонизацией кишечника условно-патогенным микроорганизмом сlostridium difficile. Протекает псевдомембранозный колит с высокой лихорадкой, кровавой диареей, болью в животе и сопровождается существенной интоксикацией со всеми возможными осложнениями острой профузной диареи. При подозрении на псевдомембранозный колит больной должен быть госпитализирован в инфекционный стационар.
Доклиническая и дифференциальная диагностика ОД
Всестороннее изучение анамнеза настоящего заболевания является первым шагом в обследовании пациентов, имеющих характерные признаки ОКИ (табл. 1).
У больных необходимо выяснить:
- когда и как началось заболевание (например, внезапное или постепенное развитие заболевания, наличие инкубационного или продромального периода);
- характер испражнений (водянистые, кровянистые, с примесью слизи или гноя, жирные и т. д.);
- частоту стула, количество и болезненность испражнений;
- наличие симптомов дизентерии (лихорадка, тенезмы, примесь крови и/или гноя в испражнениях).
В беседе с больным очень важно установить наличие и, что особенно существенно, развитие субъективных и объективных проявлений обезвоживания (жажды, тахикардии, ортостатических реакций, уменьшения диуреза, вялости и нарушений сознания, судорог, снижения тургора кожи) и интоксикации (головной боли, тошноты, рвоты, мышечных болей).
На догоспитальном этапе ОКИ необходимо дифференцировать с рядом острых неинфекционных заболеваний хирургического, терапевтического, гинекологического и иного профиля. Единственной целью дифференциального диагноза в данном случае является выбор направления госпитализации больного. Основные критерии для проведения дифференциального диагноза отражены в предлагаемом нами алгоритме догоспитальной медицинской помощи (рис. 2).
Распространенность ошибочной диагностики ОКИ иллюстрируют данные DuPont H. L. (1997). Предоставленные автором данные анализа более 50 тысяч случаев госпитализации больных с ОКИ констатируют, что в 7,4% случаев этот диагноз был установлен при таких заболеваниях, как острый аппендицит, острый холецистопанкреатит, странгуляционная кишечная непроходимость, тромбоз мезентериальных сосудов, инфаркт миокарда, крупозная пневмония, декомпенсация сахарного диабета, гипертонический криз. Напротив, указанные выше заболевания были ошибочно диагностированы у больных с ОКИ в 11,1% случаев.
Догоспитальная терапия ОД
Наибольшую угрозу для пациентов с ОКИ представляет развитие дегидратации и ассоциированной с ней артериальной гипотензии на фоне интоксикации, провоцирующей падение артериального давления и нарушение функции центральной нервной системы. Объем догоспитальной терапии при ОКИ базируется на мониторинге жизненно важных функций организма больного: состоянии сознания и функции внешнего дыхания, уровне АД и гидратации пациента. При наличии соответствующего оснащения бригады СМП терапия клинически значимой гиповолемической и инфекционно-токсической артериальной гипотензии должна осуществляться под контролем центрального венозного давления. В соответствии со стандартными рекомендациями терапия на этом этапе направлена:
- на восстановление сердечного ритма;
- на оптимизацию объема циркулирующей крови;
- на устранение гипоксии и нормализацию кислотно-щелочного равновесия;
- на проведение инотропной/вазопрессорной терапии.
Для устранения гипоксии больному назначают оксигенотерапию газовой смесью с 35%-ным содержанием кислорода.
Регидратацию больного начинают с диагностики обезвоживания, тяжесть которой может варьировать от I до IV степени (табл. 2).
При дегидратации I и II степеней (85-95% больных ОКИ) восполнение потери жидкости может и должно осуществляться оральным путем. ВОЗ рекомендует применять для оральной регидратации растворы следующей прописи: 3,5 г NaCl, 2,5 г NaHCO3 (или 2,9 г цитрата натрия), 1,5 г KCl и 20 г глюкозы или ее полимеров (например, 40 г сахарозы, или 4 столовые ложки сахара, или 50-60 г вареного риса, кукурузы, сорго, проса, пшеницы или картофеля) на 1 л воды. Это позволяет получить раствор, содержащий приблизительно 90 ммоль Na, 20 ммоль K, 80 ммоль Cl, 30 ммоль HCO3 и 111 ммоль глюкозы. Можно с успехом использовать любой из готовых растворов для оральной регидратации (цитроглюкосалан, регидрон, гастролит). Количество выпитой жидкости должно в 1,5 раза превышать ее потери с испражнениями и мочой. Компенсация обезвоживания сопровождается очевидным уменьшением жажды, нормализацией диуреза и улучшением общего состояния больного.
Дегидратация III и IV степеней, выраженная тошнота или рвота, а также бессознательное состояние больного требуют неотложной инфузионной терапии. Для внутривенной регидратации используют полиионные кристаллоидные растворы: трисоль, квартасоль, хлосоль, ацесоль. Менее эффективно введение моноионных растворов (физиологического раствора хлорида натрия, 5%-ного раствора глюкозы), а также несбалансированных полиионных растворов (раствора Рингера, мафусола, лактасола). Коллоидные растворы (гемодез, реополиглюкин, рефортан) вводят только в случаях упорной гипотонии, после восстановления объема циркулирующей крови в целом. В тяжелых случаях инфузия водно-электролитных смесей начинается с объемной скоростью 70-90 мл/мин, при средней тяжести состояния больного — с объемной скоростью 60-80 мл/мин. В ряде случаев необходимая скорость инфузии обеспечивается путем одновременного вливания в 2-3 вены. После стабилизации артериального давления скорость инфузии снижается до 10-20 мл/мин. Для предотвращения прогрессирования обезвоживания, развития гемодинамической недостаточности, отека легких, пневмонии, ДВС-синдрома и острой почечной недостаточности объем жидкости, вводимой после стабилизации состояния больного, может составлять 50-120 мл на 1 кг веса.
Назначение антибактериальной терапии среднетяжелых и тяжелых ОКИ на доклиническом этапе не только не входит в задачи врача СМП, но и категорически противопоказано, поскольку может существенно ухудшить состояние больного и затруднить лабораторную верификацию возбудителя заболевания. Возрастающая угроза инфекций, вызванных антибиотико-резистентными штаммами микроорганизмов, наличие нежелательных реакций при применении антимикробных препаратов, суперинфекция, связанная с эрадикацией нормальной микрофлоры антибактериальными средствами, и возможность индукции антибиотиками некоторых факторов вирулентности у энтеропатогенов (например, индукция фторхинолонами фага, ответственного за продукцию шигеллезного токсина), заставляют тщательно взвешивать все за и против при решении вопроса об антимикробной терапии и назначать ее только после точной диагностики возбудителя ОКИ. В связи с вышеизложенным антибактериальные препараты особенно не рекомендуются при гастроэнтеритическом варианте ОД любой степени тяжести, при легком, стертом течении колитического варианта и в период реконвалесценции при любой форме кишечного заболевания.
Эмпирическое назначение антибиотиков возможно в случае легкопротекающей и среднетяжелой ОКИ любой этиологии, а также при диарее путешественников, наиболее вероятным возбудителем которой являются энтеротоксигенные штаммы E.coli или другие бактериальные патогены. В этом случае взрослым назначают фторхинолоны, а детям — ко-тримоксазол, применение которых позволяет сократить длительность заболевания с 3-5 до 1-2 дней. Этой категории больных, как правило, не нуждающихся в госпитализации, можно рекомендовать амбулаторный прием антисептиков кишечного действия: эрцефурила, интетрикса или энтероседива в стандартных дозах в течение 5-7 дней, а также препаратов неантимикробного действия, облегчающих течение диареи (табл. 3).
Столь же опасным, как антибиотики, в отношении усугубления интоксикации является применение при ОКИ любого клинического течения сильных противодиарейных препаратов (имодиума) и противотошнотных средств (церукала, торекана).
Особое значение при ОКИ имеет коррекция микробиоценоза кишечника пробиотиками, проводимая на различных этапах лечения: в остром периоде — в целях конкурентного вытеснения патогенной микрофлоры, у реконвалесцентов — для обеспечения реабилитационных процессов. Весьма эффективно раннее, не позже второго дня болезни, назначение бифидумбактерина форте в ударных дозах (по 50 доз 3 раза каждые 2 часа в первый день лечения) с последующим приемом поддерживающих доз (30 доз в день, по показаниям — до 6 дней).
Пробиотик IV поколения бифидумбактерин форте обеспечивает высокую локальную колонизацию слизистой оболочки кишечника, элиминацию патогенной и условно-патогенной микрофлоры. Положительный клинический эффект при сальмонеллезе средней тяжести отмечен через 1-2 дня, при тяжелом течении сальмонеллеза и дизентерии — к окончанию курса. Из пробиотиков, приготовленных на основе микроорганизмов рода Bacillus, препаратом выбора является биоспорин, назначаемый по 2 дозы 2-3 раза в день в течение 5-7 дней. Препарат обладает выраженным антибактериальным, антитоксическим и иммуномодуляторным действием, индуцирует синтез эндогенного интерферона, стимулирует активность лейкоцитов крови, синтез иммуноглобулинов. При преобладании энтеритического синдрома рекомендуется энтерол, получаемый из сахаромицетов Буларди. Он назначается по 250 мг 2 раза в день в течение 5 дней. В периоде реконвалесценции наряду с традиционными патогенетическими средствами (стимуляторами репарации, общего и местного иммунного ответа) целесообразно применение препаратов облигатной флоры, оптимально — бифидумбактерина форте, оказывающего стабилизирующее влияние на микробиоценоз кишечника и гомеостатические процессы.
Несмотря на расширение возможностей по верификации возбудителя и большой выбор методов этиопатогенетической терапии, появившихся в арсенале врача за последние 20 лет, ОКИ и сегодня по-прежнему сопряжены с высокой летальностью. Так, по данным Н. Д. Ющука, при ПТИ и сальмонеллезе летальность составляет около 0,1%, а при дизентерии — 1,4%, при этом причиной 20% летальных исходов при бактериальной дизентерии и 44,4% летальных исходов при всех остальных ОКИ является инфекционно-токсический шок. Причины столь высокой летальности, вероятно, кроются в неадекватной оценке прогноза и тяжести состояния больного ОКИ и неоказании ему, в том числе по причинам недостаточного инструментального, медикаментозного и информационного обеспечения, неотложной помощи именно на догоспитальном этапе. Хочется надеяться, что предложенный нами простой алгоритм догоспитальной медицинской помощи при ОД (рис. 2) окажется небесполезным для практикующих врачей и их пациентов.
Острые кишечные инфекции (ОКИ) - это большая группа инфекционных заболеваний человека с энтеральным механизмом заражения, вызываемых патогенными и условно-патогенными бактериями, вирусами и простейшими.
В настоящее время принято классифицировать кишечные инфекции по этиологическому фактору, подтвержденному на основании лабораторных методов диагностики, что позволяет выявлять нозологические формы (шигеллез, сальмонеллез и др.). В отсутствии лабораторного подтверждения, диагноз верифицируется по топической локализации патологического процесса (гастрит, энтерит, гастроэнтерит, колит и др.). В этом случае диагноз ОКИ устанавливается на основании клинико-эпидемиологических данных, как "кишечная инфекция не установленной этиологии" с обязательным указанием (как и при лабораторном подтверждении) топики поражения ЖКТ (энтерит, колит и др.) и ведущего клинического синдрома, определяющего тяжесть заболевания (токсикоз с эксикозом, нейротоксикоз и др.).
Общепринятая классификация ОКИ по этиологическому принципу и рекомендуемая терапевтическая тактика, направленная на лечение конкретной нозологической формы (которая устанавливается, как правило, ретроспективно), в настоящее время не отвечает потребностям практического врача-педиатра. Поэтому для построения рациональной, патогенетически обоснованной терапии ОКИ (до получения результатов лабораторных исследований) рекомендуется использовать классификацию ОКИ по типу диареи, которая предусматривает их разделение на группы - "инвазивного", "секреторного" и "осмотического" типа. Тип диареи и топика поражения ЖКТ определяются, главным образом, наличием одинаковых факторов патогенности для группы возбудителей (тропизм, способность к инвазии, продукции экзотоксинов и др.) и, соответственно однотипного для всей группы инфекций "пускового" механизма и патогенеза развития диареи и инфекционного процесса.
По "инвазивному" типу диареи протекают ОКИ бактериальной этиологии, возбудители которых (шигеллы, сальмонеллы, клостридии и др.) способны к "инвазии", т.е. размножаться не только на поверхности эпителия кишечника, но и внутриклеточно, а в ряде случаев и проникать в кровь с развитием бактериемии и сепсиса. В основе "пускового" механизма развития инфекционного процесса при ОКИ "инвазивного" типа лежит воспалительный процесс в тонком и/или толстом отделе кишечника различной степени выраженности (от катарального до язвенно-некротического), которая и определяет тяжесть заболевания. Воспалительный процесс в кишечнике является основой появления рвоты, болевого синдрома, ускоренной перистальтики и быстрой эвакуации кишечного содержимого, нарушения всасывания воды из кишечника (диареи) и пищеварительной функции - нередко с развитием бродильной диспепсии (метеоризма). В испражнениях присутствуют патологические примеси (слизь, зелень, нередко примесь крови). Токсины бактерий, продукты воспаления и другие токсические соединения всасываются из кишечника в кровь и являются основной причиной (как и обезвоживание организма) развития тяжелых синдромов инфекционного токсикоза и интоксикации (эндотоксикоза), которые и определяют не только тяжесть, но и исход заболевания.
Таким образом, главными направлениями лечебных мероприятий при ОКИ "инвазивного" типа должны быть не только борьба с возбудителем, но и мероприятия, направленные на предупреждение развития тяжелого эндотоксикоза, т.е. сорбцию и элиминацию из кишечника токсических соединений и токсинов бактерий. В этом плане, особенно в начальном периоде заболевания, помимо назначения ЛС этиотропной и симптоматической терапии (противорвотных, жаропонижающих и др.) решающее значении могут сыграть энтеросорбенты, оказывающие и "этиотропное" действие за счет адсорбции или абсорбции и элиминации из кишечника возбудителей ОКИ, в т.ч. и устойчивых к антибиотикам. В то время как раннее назначение антибиотиков может даже привести к усилению эндотоксикоза и тяжести состояния больного за счет массивной гибели микробов и всасывания их токсинов в кровь. Кроме того, антибиотики способствуют прогрессированию дисбактериоза кишечника и соответственно функциональных нарушений ЖКТ, а за счет иммуносупрессивного действия нередко приводят к затяжному течению и формированию длительного бактерионосительства (например, при сальмонеллезе).
По "секреторному" типу диареи протекают ОКИ также бактериальной этиологии, возбудители которых (холерный вибрион, энтеротоксигенные эшерихии, клебсиеллы пневмония, кампилобактер и др.) размножаются только на поверхности эпителия тонкого кишечника и не проникают внутрь энтероцитов ("неинвазивные"). В основе патогенеза лежит гиперсекреция воды и электролитов эпителием в просвет кишечника и нарушение их всасывания за счет активации системы аденилатциклазы под воздействием секреторных агентов, главным образом - бактериального экзотоксина. При этом типе диареи в патологический процесс вовлекается только тонкий кишечник без развития воспалительного процесса, а кишечная инфекция сопровождается жидким, обильным водянистым стулом без патологических примесей. Как правило, заболевание начинается с появления частого жидкого стула без повышения температуры тела (или в пределах 37,2-37,8°C), затем появляется рвота и быстро наступает обезвоживание организма, которое и определяет основную тяжесть и исход заболевания.
Поэтому, главным направлением терапевтической тактики будут мероприятия, направленные на нейтрализацию экзотоксина в кишечнике (энтеросорбенты), и регидратация - возмещение дефицита воды и компенсация патологических потерь жидкости и электролитов специально разработанными ВОЗ глюкозо-солевыми растворами (Регидрон, Гастролит и др.). Антибиотики не назначаются, т.к. возбудитель не играет решающей роли в развитии инфекционного процесса. Однако для ускоренной санации организма от возбудителя при выраженной диарее обоснованным является также назначение антибактериальных ЛС, которые не всасываются или плохо всасываются из кишечника и обладают широким спектром действия (например, энтерофурил или ко-тримоксазол). Эффективными средствами альтернативной этиотропной терапии являются энтеросорбенты и пробиотики. Этиотропное действие пробиотиков связано с выраженной антагониститческой активностью в отношении всех возбудителей ОКИ бактериальной этиологии и опосредованным иммуномодулирующим действием на местное звено иммунитета.
Основным направлением терапии будет уменьшение поступления в кишечник лактозы (диета), заместительная ферментотерапия, купирование явлений метеоризма и оральная регидратация. Из средств этиотропной терапии высоко эффективны иммунные препараты, содержащие высокие титры антител против ротавируса (КИП, Кипферон), противовирусный препарата Арбидол-Ленс, а также - энтеросорбенты и пробиотики. Назначение антибиотиков и химиопрепаратов, даже при тяжелых формах заболевания противопоказано.
Таким образом, "стартовую" этиотропную терапию легких, среднетяжелых и, даже тяжелых форм ОКИ, следует начинать с "альтернативных" антибиотикам препаратов, обладающих прямым или опосредованным воздействием на возбудителей ОКИ. Высокоэффективными средствами своеобразной "микробиоценоз-сохраняющей альтернативной этиотропной монотерапии" ОКИ у детей, не зависимо от этиологии и типа диареи, как установлено многочисленными клиническими исследованиями, могут быть пробиотики, энтеросорбенты и иммуноглобулины.
При выборе средств этиотропной терапии следует учитывать, что у детей раннего возраста, особенно в осенне-зимне-весенний период года, в структуре ОКИ до 70-80% занимают вирусные диареи, которые нередко протекают как микст-инфекции по смешанному "инвазивно-осмотическому" типу. Использование в этих случаях антибактериальных препаратов, в том числе фуразолидона или гентамицина, способствует формированию или прогрессированию дисбактериоза кишечника, функциональных нарушений со стороны желудочно-кишечного тракта и, соответственно, затягиванию острого периода заболевания. В этих случаях, вместо антибиотиков или химиопрепаратов для стартовой терапии целесообразнее назначать КИП или пробиотики в комбинации с энтеросорбентами или препараты противовирусного и иммуномодулирующего действия.
| Арбидол-Ленс табл. по 0,05 и 0,1 г | Противовирусный препарат. Назначается детям 2-6 лет - по 0,05 г, 6-12 лет и старше по 0,1 г 3-4 раза/сут. 5-7 дней |
| Гепон лиоф. порош. по 1,2 мг во флаконе | Иммуномодулятор. Назначается внутрь детям старше 6 лет 1 мл 0,1% раствора 2 раза/сутки. 3-5 дней |
| Кипферон суппозитории (КИП+рекомбинантный альфа-2-интерферон) | Антибактериальный, противовирусный и иммуномодулирующий препарат. Назначается как средство этиотропной монотерапии, в том числе и ротавирусно-бактериальной микст-инфекции ректально: детям 1-12 мес по 1 супп. на 1-2 приема, 1-3 года - 1 супп. 2 раза/сут (через 12 часов), старше 3-х лет 3 раза/сут. 3-5 (до 7) дней. |
При отсутствии положительной динамики симптомов в первые 2-3 дня лечения среднетяжелых и тяжелых форм ОКИ препаратами "стартовой" альтернативной этиотропной терапии, а также при тяжелых формах с 1-х дней болезни - в качестве ЛС этиотропной терапии могут быть использованы химиопрепараты или антибиотики.
Антибактериальные химиопрепараты обладают широким спектром действия на возбудителей ОКИ, находящихся в просвете кишечника или адгезированных на эпителиоцитах, не всасываются (например, энтерофурил) или плохо всасываются из кишечника, создавая высокие концентрации в месте локализации микробов.
Антибиотики "стартовой" терапии также обладают широким спектром действия. Клиническая и санирующая эффективность этих препаратов в последние годы снижается из-за широкой циркуляции резистентных штаммов бактерий.
При отсутствии клинического эффекта и нарастании тяжести заболевания в первые 2-3 дня лечения среднетяжелых и тяжелых форм ОКИ бактериальной этиологии, а также при опасности генерализации процесса и септических формах используются антибиотики "резерва" , как внутрь, так и парентерально. Они обладают широким спектром действия и высоко эффективны в отношении практически всех возбудителей ОКИ, в т.ч. - внутриклеточно расположенных и устойчивых к антибактериальным препаратам "стартовой" терапии. При парентеральном введении хорошо секретируются кишечником, а при приеме внутрь -хорошо всасываются, создавая высокие концентрации, как в крови, так и в слизистой оболочке кишечника. Недостаток - частые побочные реакции и возрастные ограничения.
Антибактериальная терапия проводится, как правило, 5-7 дневным курсом. При повторном высеве возбудителя с целью санации используются бактериофаги (сальмонеллезный, дизентерийный и др.), а при наличии неустойчивого характера стула, как правило, связанного с дисбактериозом кишечника, назначаются пробиотики курсом 7-10 дней. При наличии синдромов токсикоза лечебные и неотложные мероприятия проводятся по общим правилам.
По вопросам литературы обращайтесь в редакцию
"Стартовая" альтернативная этиотропная терапия ОКИ у детей, независимо от предполагаемой этиологии и типа диареи
Показания к применению и схемы лечения антибактериальными препаратами ОКИ "инвазивного" типа
| ГРУППЫ ПРЕПАРАТОВ | СРЕДНЕТЯЖЕЛАЯ ФОРМА | ТЯЖЕЛАЯ ФОРМА |
| Химиопрепараты "стартовой" терапии | Схема №1 Назначаются как этиотропная монотерапия, в том числе и при легких формах (по показаниях) | Как монотерапия - не назначаются |
| Антибиотики "стартовой" терапии | Схема №2 Назначаются как монотерапия или при отсутствии положительной динамики симптомов в первые 2-3 дня лечения по схеме №1 | Схема №4 Назначаются в комбинации с иммуномодулятором "Гепон" или энтеросорбентами |
| Антибиотики "резерва" | Схема №3 Назначаются при отсутствии положительной динамики симптомов и нарастания тяжести заболевания в первые 2-3 дня лечения по схеме №1 или №2 | Схема №5 Назначаются при отсутствии клинического эффекта лечения по схеме №4, а также -при генерализованных и септических формах |
Назначение энтеросорбентов или иммуномодулятора "Гепон" (по 1 мл 0,1% раствора внутрь 2 раза/сут, 5-7-дневным курсом), не зависимо от схемы лечения, существенно повышает санирующую эффективность антибактериальной терапии и оказывает более быстрый и выраженный клинический эффект.
Антибактериальные химиопрепараты "стартовой" этиотропной терапии кишечных инфекций бактериальной этиологии "инвазивного" типа
| ПРЕПАРАТЫ | РЕЖИМ ДОЗИРОВАНИЯ ДЛЯ ДЕТЕЙ |
| Эрцефурил | Суспензия -1-6 месяцев по 2,5 мл 2-3 раза, 7-24 мес. 2,5 мл 4 раза, 2-7 лет 5 мл 3 раза/сут. Капсулы - дети старше 7 лет и взрослые по 2 капс. (100 мг) или 1 капс. (200 мг) 4 раза/сутки. 5-7 дней |
| Налидиксовая кислота | Внутрь: с 3-х мес - начальная доза 60 мг/кг/сут, затем по 30 мг/кг/сут на 4 приема. 3-5 (до 7) дней. |
| Нифуратель | Внутрь: 10-15 мг/кг 2-3 раза/сут. 5-7 дней |
| Ко-тримоксазол: o Бисептол суспензия o Бисептол таблетки o Катрифарм 480 табл. | Внутрь: 6-12 лет 1 табл. 2 раза/сут, старше 12 лет и взрослые 1-2 табл. 2 раза/сут. 5-7 дней |
| 2 раза/сутки: 3-6 мес. по 2,5 мл, 7 мес.-3 года по 2,5-5 мл, 4-6 лет по 5-10 мл, 7-12 лет по 10 мл, старше 12 лет по 20 мл. 5-7 дней | |
| 2 раза/сутки: 2-5 лет по 240 мг, 6-12 лет по 480 мг, старше 12 лет и взрослые по 960 мг. 5-7 дней | |
| С 2 мес. до 12 лет 1-2 табл. 2 раза/сутки. 5-7 дней |
Антибиотики для лечения среднетяжелых и тяжелых форм ОКИ бактериальной этиологии "инвазивного" типа
По результатам наших исследований, при этиотропной монотерапии среднетяжелых форм ротавирусной инфекции противовирусным препаратом "Арбидол" или иммуномодулятором "Гепон" уже на 3-й день лечения в 65-90% случаев наступает клиническое выздоровление, а на 5-7-й день в 70-95% санация кишечника от рота- и аденовируса, в то время как при использовании только базисной терапии и аципола - санация от ротавируса в эти сроки наступает лишь у 35-40% больных.
При сравнительном изучении клинической эффективности этиотропной терапии 5-нит-рофуранами (энтерофурил-суспензия и фуразолидон) у 60 больных в возрасте от 6 мес. до 10 лет с легкими (33%) и среднетяжелыми (67%) формами ОКИ "инвазивного" (63,3%) и "инвазивно-осмотического" (36,7%) типа диареи установлено, что энтерофурил-суспензия, в отличие от фуразолидона, способствует более быстрому купированию симптомов токсикоза, явлений метеоризма, диарейного синдрома и сокращению продолжительности острого периода заболевания с 4,97±0,23 дня (при лечении фуразолидоном) до 3,57±0,18 дня. По окончании 5-и дневного курса, лечение ОКИ у детей энтерофурил-суспензией было эффективным в 90%, а фуразолидоном - лишь в 66,7% случаев. В отличие от фуразолидона, энтерофурил-суспензия обладает более высокой санирующей эффективностью в отношении патогенной (шигелл, сальмонелл) и УПМ (Pr.vulgaris, mirabilis, Klebsiella, Citrobacter, Enterobacter, St. аureus) и не оказывает отрицательного воздействия на микробиоценоз кишечника.
Читайте также:

