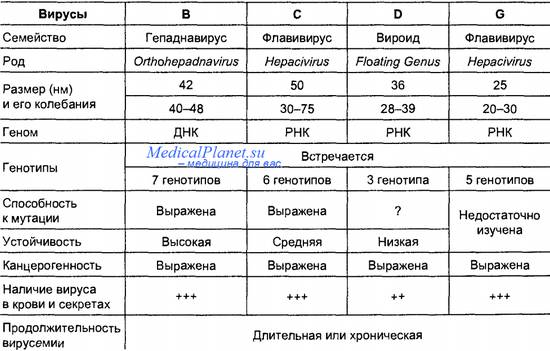
Показатели гемостаза при гепатите
Обновлено: 23.04.2024
Диагностика гепатитов В и С у гематологических больных - анализы, особенности
Современная этиологическая диагностика вирусных гепатитов основана на обнаружении специфических маркеров соответствующих вирусов. Один из методов их выявления — тестирование различных антигенов вируса и антител к ним в ИФА. Наиболее прогрессивна и информативна так называемая генная диагностика: обнаружение вирусной РНК или ДНК с помощью ПЦР.
Для диагностики гепатита В в ИФА исследуют:
1) HBsAg-поверхностный антиген гепатита В, ранее называвшийся австралийским. Он указывает на факт инфицированности гепатитом В;
2) HbeAg — антиген инфекционности, свидетельствующий об активной вирусной репликации;
3) анти-НВс —антитела к ядерному антигену вируса гепатита В: класса IgM—ранние антитела острого периода, класса IgG—поздние антитела к ядерному антигену;
4) анти-НВе — антитела к HBeAg, чаще всего характеризующие прекращение активной репликации вируса (так называемая сероконверсия);
5) анти-HBs—антитела к HBsAg, обеспечивающие протективный иммунитет.
С помощью ПЦР для диагностики гепатита В тестируют ДНК вируса гепатита В — основного маркера репликации вируса.
Для диагностики гепатита С исследуют:
1) с помощью ИФА наличие анти-HCV-антител к вирусу гепатита С (для их выявления желательно использовать тест-системы второго — третьего поколения, отличающиеся большей специфичностью). Они указывают только на инфицированность вирусом гепатита С;
2) с помощью ПЦР наличие РНК вируса гепатита С — основного маркера репликации вируса.
Говоря о специфической диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями (ОГЗ), следует рассмотреть вопрос о применимости стандартных подходов к выявлению различных маркеров этих вирусов у данного контингента в связи с возможным нарушением процесса антителообразования на фоне глубокой иммуносу-прессии, развивающейся в ходе полихимиотерапии (ПХТ).
Исследования, в которых сделана попытка подтвердить или опровергнуть роль антительных маркеров у пациентов с онкологическими гематологическими заболеваниями, пока единичны.
Так, в отдельных работах сообщается, что при гепатите В иммуносупрессия нарушает обычную последовательность обнаружения в сыворотке крови антигенов и антител: у больных, которые до начала ПХТ были анти-НВs-позитивными, в процессе лечения могут вновь определяться HBsAg и HBeAg, свидетельствуя о несостоятельности анти-HBs в качестве протективных антител. Угнетение механизмов, ограничивающих вирусную репликацию, ведет к тому, что виремия нередко достигает высокого уровня.
Если антитела к столбняку, дифтерии и полиомиелиту сохраняются во время и после ПХТ, то титры антител к вирусам (ветряной оспы, кори и гепатита В) резко снижаются. Это в большей мере относится к детям с лейкозами, чем с солидными опухолями. Снижение или отсутствие выработки анти-HBs отметили также R. Repp и соавт. и R. Rokicka-Milewska и соавт.. Если при гепатите В эта особенность может отразиться только на ретроспективной диагностике, то для распознавания гепатита С, основанного чаще всего на обнаружении анти-HCV с помощью ИФА, такое положение может иметь принципиальное значение, препятствуя полному и своевременному выявлению всех инфицированных.
Антитела к вирусу гепатита С (анти-HCV) вообще образуются медленно, в течение 8—15 нед от момента инфицирования, но у иммунокомпетентных лиц персистируют в организме длительно и в большинстве случаев пригодны для выявления гепатита С, являясь в настоящее время рутинным и скрининговым маркером.
Некоторые авторы, проводившие немногочисленные и небольшие по объему исследования у иммунокомпрометированных пациентов, указывают на возможность отсроченного образования антител к вирусу гепатита С и считают недостаточным использование только ИФА для диагностики данного заболевания у этого контингента пациентов. В частности, С. Cornu и соавт. обнаружили, что у 5 из 6 обследованных ими иммунокомпрометированных пациентов анти-HCV начали обнаруживаться лишь спустя 14 мес и более от момента инфицирования, установленного с помощью ПЦР.
По данным М. Arico и соавт., антительная диагностика позволяет выявить около 70 % детей с ОЛЛ, инфицированных вирусом гепатита С. Значение ПЦР в выявлении пациентов, инфицированных вирусами гепатитов В и С, продемонстрировано при обследовании турецких детей: у 13,9 % больных с онкологическими гематологическими заболеваниями диагноз гепатита В установлен только при обнаружении ДНК вируса гепатита В, а 5,8 % анти-HCV-негативных детей оказались инфицированными вирусом гепатита С при тестировании РНК.
В то же время синтез анти-НВс IgM, сопутствующий в иммунокомпетентном организме вирусной репликации и являющийся одним из ее маркеров, у пациентов с онкологическими гематологическими заболеваниями почти отсутствует, а у пациентов без онкологических гематологических заболеваний происходит их активная наработка (7,7 % против 78,6 %).
С общебиологической точки зрения, выявленные феномены ждут объяснения, а в прикладном плане они демонстрируют особенности специфической диагностики инфицированности вирусом гепатита В у больных с онкологическими гематологическими заболеваниями и необходимость поиска других подходов к распознаванию болезни. Этой цели служит использование ПЦР, которая позволяет существенно повысить выявляемость пациентов с онкологическими гематологическими заболеваниями, инфицированных вирусом гепатита В: в 16 % случаев обнаружение ДНК этого вируса было единственным маркером инфицирования.
Более того, у 50 % детей, находившихся на полихимиотерапии и позитивных по каким-либо маркерам вируса гепатита В, вирусная ДНК выявлялась в отсутствие HBeAg, т. е. была единственным показателем репликации вируса, в то время как среди детей без онкологических гематологических заболеваний подобная ситуация встречалась лишь в 14,5 % случаев, т. е. в 3,5 раза реже.
При гепатите С также не обнаружено параллелизма между выявлением анти-HCV и РНК вируса гепатита С. Весьма демонстративным было преимущество тестирования РНК перед антительной диагностикой: у 44,4 % детей с онкологическими гематологическими заболеваниями РНК вируса гепатита С оказалась единственным маркером инфицирования.
Как и при гепатите В, диагностическая значимость генных и антительных маркеров зависит от фазы ПХТ. Период интенсивного и поддерживающего лечения онкологического гематологического заболевания при гепатите С — это время абсолютной репликативной активности и резкого снижения антителообразования, способность к которому частично восстанавливается по завершении полихимиотерапии. В наших наблюдениях у 74,9 % детей это сопровождалось продолжением вирусной репликации.
Практические выводы о специфической диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями сводятся к следующему:
1) рутинные подходы недостаточны для распознавания инфицированности пациентов с онкологическими гематологическими заболеваниями вирусами гепатитов В и С;
2) необходимо комплексное исследование всего известного спектра маркеров;
3) ведущую, определяющую роль в диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями играет тестирование ДНК вируса гепатита В и РНК вируса гепатита С в ПЦР;
4) только путем внедрения ПЦР-диагностики в учреждениях для больных с онкологическими гематологическими заболеваниями можно обеспечить полную и своевременную диагностику гепатитов В и С;
5) обязательность обследования всех пациентов с помощью современных маркеров:
— при поступлении;
— при повышении активности АЛТ на этапах ПХТ;
— каждые 3—6 мес в ходе и в течение года после ПХТ.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Нарушения гемостаза при болезнях печени - клиника, диагностика
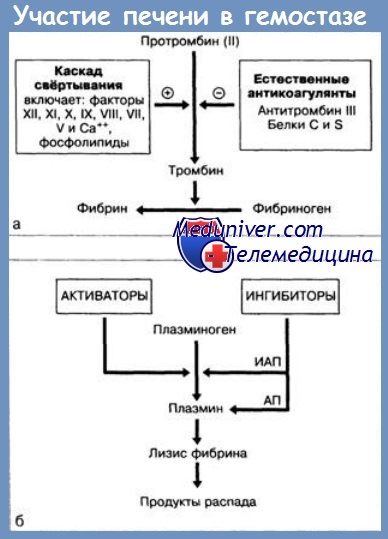
Печень принимает участие в синтезе или метаболизме всех факторов коагуляции, поэтому при тяжелых заболеваниях печени могут встречаться различные нарушения гемостаза.
Основные причины развития патологии гемостаза:
1) снижение синтеза плазменных факторов (фибриногена, протромбина, факторов V, VII, IX, X, XI, XII, XIII, прекалликреина, высокомолекулярного кининогена, антиплазмина, антитромбина III, протеинов С и S);
2) снижение клиренса факторов коагуляции (фибрин-мономера, тромбоцитарного фактора 3, факторов IXa, Xa, XIa, активаторов плазминогена);
3) повышенное разрушение факторов коагуляции (при синдроме ДВС, патологии фибринолиза);
4) тромбоцитопения (при гиперспленизме, дефиците фолиевой кислоты, хронической алкогольной интоксикации, синдроме ДВС);
5) дисфункция тромбоцитов (при острой и хронической алкогольной интоксикации, уремии, влиянии продуктов деградации фибриногена).
Нарушения гемостаза при заболеваниях печени чаще всего клинически манифестируют желудочно-кишечными кровотечениями. Геморрагический синдром сложно однозначно связать с изменениями в системе крови, поскольку практически всегда имеется локальный источник кровотечения (варикозное расширение вен пищевода, пептические язвы и др.).
Возможны также длительные кровотечения после хирургического вмешательства, экстракции зуба, диагностических процедур (биопсия). Геморрагические проявления на коже возникают относительно редко.
Показателями, которые свидетельствуют о высокой вероятности кровотечения, являются увеличение протромбинового времени, в меньшей степени — снижение протромбинового индекса.
Наиболее часто для лечения коагулопатий, обусловленных заболеваниями печени, используется викасол, который оказывает хорошее действие у 30-40% пациентов. При выраженном геморрагическом синдроме необходима заместительная терапия СЗП или фракцией плазмы, обогащенной протеинами протромбинового комплекса в сочетании с гепарином с целью профилактики тромботических осложнений.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В статье представлены результаты обследования 66 пациентов с хроническим пародонтитом различной степени тяжести на фоне активного хронического вирусного гепатита С, в том числе при его исходе в цирроз печени (n=15). Дана характеристика основных показателей сосудисто-тромбоцитарного и плазменного звеньев гемостаза в зависимости от степени тяжести пародонтита и активности хронической HCV-инфекции. Представлены данные о фазности развития синдрома диссеминированного внутрисосудистого свертывания (синдром ДВС): от гиперкоагуляционной фазы при хроническом пародонтите средней степени тяжести у больных активным хроническим гепатитом C (ХГС) до выраженной гипокоагуляции — при хроническом пародонтите тяжелой степени на фоне цирроза печени в исходе ХГС.
Ключевые слова: хронический пародонтит, хронический вирусный гепатит, гемостаз, ДВС-синдром.
Yu.V. FAZYLOVA, N.V. GALEYEVA
Kazan State Medical University, 49 Butlerov St., Kazan, Russian Federation, 420012
Condition of a hemostasis in patients with chronic periodontal disease and chronic virus hepatitis C
The article presents results of examination of 66 patients with chronic periodontal disease of varying severity with active chronic virus hepatitis C, including at its outcome to cirrhosis (n=15). The main indicators of vascular placelet and plasma links of hemostasis are characterized depending on the severity of periodontal disease and activity of chronic HCV infection. Data is given on the stages of disseminated intravascular coagulation (DIC syndrome): from a hyper coagulative phase at a chronic periodontal disease of moderate severity in patients with the active chronic hepatitis (HCV) to the expressed hypocoagulation — with heavy chronic periodontal disease with cirrhosis in HCV outcome.
Key words: chronic periodontal disease, chronic virus hepatitis, hemostasis, DIC-syndrome.
В структуре основных заболеваний органов и тканей полости рта воспалительные процессы в пародонте занимают одну из лидирующих позиций, вызывая значительные функциональные расстройства челюстно-лицевой области, обусловленные потерей зубов, согласно заключениям ВОЗ в 5 раз чаще, чем при осложненных формах кариеса 3. В патогенезе воспалительных пародонтопатий имеют значение как местные, так и общие причины, в том числе вызванные поражениями внутренних органов и систем, не исключением является патология печени и желчевыводящей системы 3.
Последние десятилетия ХХ и начало ХХI века ознаменовались резким ростом числа вирусных заболеваний печени, особенно парентеральных вирусных гепатитов, характеризующихся высокой хронизацией течения, развитием множества осложнений и смертностью, что определило медико-социальную важность проблемы вирусных гепатитов 5. Данные Всемирной организации здравоохранения свидетельствуют от инфицированности в мире вирусом гепатита С (HCV) около 500 миллионов человек. В нашей стране заболеваемость хронической HCV-инфекцией достигла более 2 миллионов человек. В общей же структуре хронических вирусных гепатитов доля ХГС составляет 74,4% (2012 г.) [7]. Согласно данным Европейской ассоциации по изучению печени HCV является причиной 20% случаев острого и 70% случаев хронического вирусного гепатита, 40% — всех наблюдений терминального цирроза печени, 60% — гепатоцеллюлярной карциномы, а в 30% — направлений пациента на трансплантацию печени 7.
По данным отечественных авторов [9, 10], при вирусных гепатитах, преимущественно при остром течении, и циррозах печени регистрируются различные фазы ДВС-синдрома. Однако на сегодняшний день не существует единого мнения о причинах и механизмах гемокоагуляционных нарушений при хронических вирусных гепатитах [11].
В стоматологических исследованиях последних лет изучалось состояние гемостаза, в том числе микроциркуляторного звена, у больных с пародонтопатиями — при переломах челюсти, гипертонической энцефалопатии, заболеваниях гастродуоденальной области 12. Исследованы патогенез нарушений сосудисто-тромбоцитарного звена при быстропрогрессирующем течении пародонтита, механизм нарушений агрегации и адгезивной активности тромбоцитов и методы их патогенетической коррекции [16, 17]. Изучалась роль функциональной активности тромбоцитов и антитромбогенной активности эндотелия сосудистой стенки, их взаимосвязь с нарушениями в коагуляционном звене гемостаза, компонентами системы фибринолиза, значение реологических свойств крови как внутрисосудистого компонента системы микроциркуляции в патогенезе хронического пародонтита при сочетанном течении с заболеваниями ЖКТ [18].
Цель исследования — оценить состояние тканей пародонта и особенности гемостаза при ХВЗП у больных ХГС в динамике естественного течения заболевания с учетом активности инфекционного процесса.
По наблюдением находился 101 пациент с хроническим пародонтитом, которые были разделены на основную (n=66) группу — пациенты с хроническим пародонтитом (ХП) на фоне активного ХГС и контрольную (n=35) — пациенты с ХП, не инфицированные парентеральными вирусными гепатитами, из них 25 человек со среднетяжелым и 10 — с тяжелым течением воспалительного процесса в пародонте.
На основании ведущих клинических признаков с учетом эпиданамнеза (парентеральные вмешательства, в т.ч. употребление инъекционных наркотических средств, длительности инфицирования и т.д.); результатах верификации (ИФА: анти-HCVcor, NS3,4,5 IgM, IgG; ПЦР; РНК HCV (количественным методом)) с определением генотипа HCV; показателях функциональных проб печени (АЛТ, АСТ, гамма-ГТ, щелочная фосфатаза, холестерин, общий билирубин и его фракции, общий белок и его фракции); морфологических данных по УЗИ, фиброскану (степень фиброза) диагностировалось вирусное поражение печени. По показаниям пациентам проводилась биопсия печени с определением ИГА и степени фиброза [4, 6].
В ходе исследования получены результаты, которые показали, что активная форма хронической HCV-инфекции сопровождается среднетяжелым и тяжелым течением хронического генерализованного пародонтита, а у больных циррозом печени в исходе ХГС — преимущественно тяжелым течением пародонтита. Динамика показателей гемостаза также отражала зависимость изменений от активности течения HCV-инфекции. Так, у 48 пациентов с хроническим пародонтитом средней тяжести на фоне активного ХГС независимо от вирусной нагрузки и генотипа отмечены нарушения гемостаза гиперкоагуляционной направленности с активацией показателей сосудисто-тромбоцитарного звена (рис. 1): повышение агрегации тромбоцитов на 25% (р<0,001) при сохранении их числа, увеличение уровня ТФ-4 — на 86,5% (р<0,001), а активности сосудистого фактора тромбопластинемии (5”-НА) — в 2,5 раза (р<0,001), снижение уровня концентрации плазменного ФН и антиагрегрционного индекса на 31,5% (р<0,001) и 21,0% (р<0,001) соответственно, при участии плазменных факторов: повышение уровня протромбина на 30,0% (р<0,001), фибриногена — на 80,0% (р<0,001), укорочение АПТВ на 31,0% (р<0,001), повышение уровня антитромбина-III как естественного антикоагулянта на 32,0% (р<0,001), значительное накопление растворимых комплексов фибрин-мономера в 5 раз и продуктов деградации фибриногена в 2 раза (р<0,001) на фоне сохранения общей фибринолитической активности крови (ОФАК) по сравнению с аналогичными показателями контрольной группы.
Рисунок 1.
Показатели гемостаза (с гиперкоагуляционной направленностью) у пациентов c хроническим пародонтитом средней тяжести на фоне активного ХГС: а) сосудисто-тромбоцитарное звено; б) прокоагулянтное и фибринолитическое звенья

У трех пациентов с активным гепатитом С (высокая репликативная активность, уровень АЛТ≥5N и степень фиброза 3 (F3 по METAVIR), стаж инфицирования более 5-7 лет) клиника хронического пародонтита средней тяжести сопровождалась выраженным геморрагическим синдромом в виде спонтанной кровоточивости десен и петехиальными кровоизлияниями на слизистой оболочке ротовой полости, а также гипокоагуляционной направленностью показателей системы гемостаза (рис. 2) в виде значительной тромбоцитопении (105±16х109/ л при норме 300х109/ л), угнетения Анти-Аг индекса на 25,2% (р<0,001), повышенной степени АгТр на 18,5% (р<0,001), повышения уровня показателя ”5,-Н” — в 2,5 раза, ТФ-4 — в 2 раза, выраженного потребления плазменного фибронектина — в 2 раза (р<0,001) на фоне повышения значения ПТИ — на 15,5% (р<0,001), ФГН — в 2 раза; АТ-3 — на 15,6% (р<0,001); выраженного увеличения содержания РКФМ в 8 раз, ПДФ — в 2,5 раза, сокращения АПТВ — на 56,1% (р<0,001) и угнетения ОФАК — на 16,4% (р<0,05).
Рисунок 2.
Характеристика переходной фазы гемостаза (от гипер- к гипокоагуляционной направленности) у пациентов c хроническим пародонтитом средней тяжести на фоне активного ХГС: а) сосудисто-тромбоцитарное звено; б) прокоагулянтное и фибринолитическое звенья

Рисунок 3.
Показатели гемостаза у пациентов с тяжелой формой хронического пародонтита на фоне декомпенсированного цирроза печени в исходе ХГС: а) сосудисто-тромбоцитарное звено; б) прокоагулянтное и фибринолитическое звенья

Таким образом, активное течение ХГС сопровождается хроническим пародонтитом среднетяжелой\тяжелой степени и нарушением всех звеньев гемостаза, преимущественно гиперкоагуляционной направленности с формированием синдрома ДВС и переходом части из них в гипокоагуляционную фазу, что клинически проявляется выраженными геморрагическими нарушениями в тканях пародонта и слизистой ротовой полости, а в клинике ХГС могут быть определены как один из предикторов исхода ХГС в цирроз печени.
Клиническая картина тяжелого пародонтита у пациентов с циррозом печени, как исходом ХГС, сопровождающегося гипокоагуляционной фазой синдрома ДВС, свидетельствует о необходимости лечения в первую очередь основного заболевания в комплексной терапии хронического пародонтита на фоне хронического вирусного гепатита С.
1. Пародонтология: национальное руководство / Под ред. проф. Л.А. Дмитриевой. — М.: ГЭОТАР-Медиа, 2013. — 712 с.
2. Грудянов А.И. Заболевания пародонта. — М.: Медицинское информационное агентство, 2009. — 336 с: ил.
3. Пародонтит / Под ред. проф. Л.А. Дмитриевой. — М.: МЕДпресс-информ, 2007. — 324 с.
4. Еналеева Д.Ш., Фазылов В.Х., Созинов А.С. Хронические вирусные гепатиты В, С и D: Руководство для врачей / Д.Ш. Еналеева, В.Х. Фазылов, А.С. Созинов. — М.: МЕДпресс-информ, 2011. — 464 с.
7. Пименов Н.Н., Чуланов В.П., Комарова С.В. и соавт. Гепатит С в России: эпидемиологическая характеристика и пути совершенствования диагностики и надзора // Эпидемиология и инфекционные болезни. — 2012. — № 3. — С. 4-9.
8. Фазылова Ю.В. Клинико-иммунологическая характеристика и терапевтическая коррекция хронических воспалительных заболеваний пародонта у больных вирусным гепатитом В: автореф. дис. … канд. мед. наук. — Казань: КГМУ, 2005. — 22 с.
10. Ягода А.В. Функциональная активность тромбоцитов при хронических вирусных заболеваниях печени / А.В. Ягода, П.В. Корой, И.В. Касторная // Российский журнал гастроэнтерологии, гепатологии, колопроктологии — 2004. — № 2. — С. 29-34.
11. Татаринова Е.А. Состояние гемостаза при вирусном гепатите В / Е.А. Татаринова, В.Х. Фазылов // Казанский медицинский журнал. — 2005. — Т. 86, № 4. — С. 322-328.
12. Ерокина Н.Л. Современные методы обследования и обоснование патогенетического лечения воспалительных заболеваний пародонта у больных с переломами нижней челюсти: автореф. дис. … д-ра мед. наук. — Волгоград: СГМУ, 2009. — 38 с.
13. Рогатина Т.В. Роль микроциркуляторного и коагуляционного звеньев системы гемостаза и реологических свойств крови в нарушении микроциркуляции у больных с переломами нижней челюсти и их воспалительных осложнениях: автореф. дис. … канд. мед. наук. — Саратов: СГМУ, 2005. — 24 с.
15. Микроциркуляторное звено системы гемостаза у больных хроническим генерализованным пародонтитом в сочетании с заболеваниями гастродуоденальной области и его динамика при комбинированной КВЧ-терапии / В.Ф. Киричук, В.Ю. Широков, Н.Л. Ерокина, С.Г. Голосеев, Т.В. Говорунова // Пародонтология. — 2005. — № 1. — С. 21-25.
17. Китаева В.Н. Нарушения микроциркуляторного звена системы гемостаза у больных с агрессивными формами генерализованного пародонтита / В.Н. Китаева // Молодые ученые — здравоохранению региона: Материалы 67-й научно-практической конференции студентов и молодых специалистов СГМУ. — Саратов, 2006. — С. 204-205.
18. Широков В.Ю. Значение нарушений внутрисосудистого компонента микроциркуляции в патогенезе хронического генерализованного пародонтита у больных с патологией желудочно-кишечного тракта и в динамике лечения: автореф. дис. … д-ра мед. наук. — Саратов, 2009. — 32 с.
21. Загидуллина А.И. Патогенетическое значение процессов перекисного окисления липидов, антиоксидантной защиты и системы гемостаза, коррекция их нарушений методом озонотерапии при роже: автореф. дис. … канд. мед. наук. — Санкт-Петербург, 2005. — 24 с.
1. Parodontologiya: natsional’noe rukovodstvo, pod red. prof. L.A. Dmitrievoy [Periodontology: national leadership. Ed. prof. L.A. Dmitrieva]. Moscow: GEOTAR-Media, 2013. 712 p.
2. Grudyanov A.I. Zabolevaniya parodonta [Periodontal disease]. Moscow: Meditsinskoe informatsionnoe agentstvo, 2009. 336 p: il.
3. Parodontit, pod red. prof. L.A. Dmitrievoy [Periodontitis. Ed. prof. L.A. Dmitrieva]. Moscow: MEDpress-inform, 2007. 324 p.
4. Enaleeva D.Sh., Fazylov V.Kh., Sozinov A.S. Khronicheskie virusnye gepatity V, S i D: Rukovodstvo dlya vrachey [Chronic viral hepatitis B, C and D: Manual for Physicians]. Moscow: MEDpress-inform, 2011. 464 p.
6. L’vov D.K., Shakhgil’dyan I.V., Deryabin P.G. Gepatit S (etiologiya, epidemiologiya, klinika, diagnostika, lechenie, profilaktika) [Hepatitis C (etiology, epidemiology, clinical features, diagnosis, treatment, prevention)]. Meditsinskaya virusologiya, rukovodstvo dlya vrachey. Moscow: MIA, 2008. Pp. 483-490.
7. Pimenov N.N., Chulanov V.P., Komarova S.V. et al. Hepatitis C in Russia: epidemiological characteristics and ways to improve the diagnostic and surveillance. Epidemiologiya i infektsionnye bolezni, 2012, no. 3, pp. 4-9 (in Russ.).
8. Fazylova Yu.V. Kliniko-immunologicheskaya kharakteristika i terapevticheskaya korrektsiya khronicheskikh vospalitel’nykh zabolevaniy parodonta u bol’nykh virusnym gepatitom V: avtoref. dis. … kand. med. nauk [Clinical and immunological characteristics and therapeutic correction of chronic inflammatory periodontal disease in patients with hepatitis B. Synopsis of dis. PhD med. sci]. Kazan: KGMU, 2005. 22 p.
9. Silivonchik N.N. Tsirroz pecheni. 2-e izd., ispr. i dop. [Cirrhosis of the liver. 2nd ed., Rev. and ext]. Minsk: UP “Tekhnoprint”, 2001. 224 p.
10. Yagoda A.V., Koroy P.V., Kastornaya I.V. Functional activity of platelets in chronic viral liver disease. Rossiyskiy zhurnal gastroenterologii, gepatologii, koloproktologii, 2004, no. 2, pp. 29-34 (in Russ.).
11. Tatarinova E.A., Fazylov V.Kh. State of hemostasis in viral hepatitis B. Kazanskiy meditsinskiy zhurnal, 2005, vol. 86, no. 4, pp. 322-328 (in Russ.).
12. Erokina N.L. Sovremennye metody obsledovaniya i obosnovanie patogeneticheskogo lecheniya vospalitel’nykh zabolevaniy parodonta u bol’nykh s perelomami nizhney chelyusti: avtoref. dis. … d-ra med. nauk [Modern methods of examination and study of pathogenetic treatment of inflammatory periodontal diseases in patients with mandibular fractures. Synopsis of dis. Dr med. sci]. Volgograd: SGMU, 2009. 38 p.
13. Rogatina T.V. Rol’ mikrotsirkulyatornogo i koagulyatsionnogo zven’ev sistemy gemostaza i reologicheskikh svoystv krovi v narushenii mikrotsirkulyatsii u bol’nykh s perelomami nizhney chelyusti i ikh vospalitel’nykh oslozhneniyakh: avtoref. dis. … kand. med. nauk [Role of microcirculation and coagulation hemostatic links and rheological properties of blood in violation of microcirculation in patients with mandibular fractures and inflammatory complications. Synopsis of dis. PhD med. sci]. Saratov: SGMU, 2005. 24 p.
15. Kirichuk V.F., Shirokov V.Yu., Erokina N.L. et al. Microcirculatory hemostasis in patients with chronic generalized periodontitis in conjunction with gastroduodenal diseases area and its dynamics in combination EHF-therapy Parodontologiya, 2005, no. 1, pp. 21-25 (in Russ.).
16. Ponukalina E.V., Bulkina N.V., Karpenko I.V. Rol’ aktivatsii protsessov lipoperoksidatsii v patogeneze rasstroystv sosudisto-trombotsitarnogo mekhanizma gemostaza pri bystroprogressiruyushchem parodontite [The role of activation of lipid peroxidation in the pathogenesis of disorders of vascular-platelet hemostasis mechanism quickly progressing periodontitis]. Aktivatsiya lipoperoksidatsii kak vedushchiy patogeneticheskiy faktor razvitiya tipovykh patologicheskikh protsessov i zabolevaniy razlichnoy etiologii. Moscow: Akademiya estestvoznaniya, 2012. 365 p.
17. Kitaeva V.N. Narusheniya mikrotsirkulyatornogo zvena sistemy gemostaza u bol’nykh s agressivnymi formami generalizovannogo parodontita [Violations of microcirculatory hemostasis in patients with aggressive forms of generalized periodontitis]. Molodye uchenye – zdravookhraneniyu regiona: Materialy 67-y nauchno-prakticheskoy konferentsii studentov i molodykh spetsialistov SGMU. Saratov, 2006. Pp. 204-205.
18. Shirokov V.Yu. Znachenie narusheniy vnutrisosudistogo komponenta mikrotsirkulyatsii v patogeneze khronicheskogo generalizovannogo parodontita u bol’nykh s patologiey zheludochno-kishechnogo trakta i v dinamike lecheniya: avtoref. dis. … d-ra med. nauk [The value of intravascular component of microcirculation disorders in the pathogenesis of chronic generalized periodontitis in patients with pathology of the gastrointestinal tract and in the dynamics of treatment. Synopsis of dis. Dr med. sci]. Saratov, 2009. 32 p.
19. Lychev V.G. Diagnostika i lechenie disseminirovannogo vnutrisosudistogo svertyvaniya krovi. 2-e izd., pererab. i dop. [Diagnosis and treatment of disseminated intravascular coagulation. 2nd ed., Rev. and ext.]. Nizhnii Novgorod: Izdatel’stvo NGMA, 1998. 191 p.: ill.
21. Zagidullina A.I. Patogeneticheskoe znachenie protsessov perekisnogo okisleniya lipidov, antioksidantnoy zashchity i sistemy gemostaza, korrektsiya ikh narusheniy metodom ozonoterapii pri rozhe: avtoref. dis. … kand. med. nauk [Pathogenetic significance of lipid peroxidation, antioxidant protection and the hemostatic system, correction of violations by ozone therapy in the face. Synopsis of dis. PhD med. sci]. Saint-Petersburg, 2005. 24 p.
Течение гепатитов В и С у гематологических больных - критерии оценки
Ряд отечественных авторов также отметили высокую частоту хронизации вирусных гепатитов у пациентов с онкологическими заболеваниями. В то же время S. Dibenedetto и соавт. приводят данные о хроническом течении гепатита С только у 17,2 % детей ОЛЛ и у 25 % пациентов с другими онкозаболеваниями. В работе U. Dutta представлены данные о 51 больном, причем ни у одного не произошло элиминации вируса.
В. Sevinir и соавт. обратили внимание на растущую роль инфицированности вирусами гепатитов В и С в развитии хронического гепатита у пациентов с онкологическими гематологическими заболеваниями и определили сроки его формирования: 13 мес при гепатите В и 5 мес при гепатите С.
Очень важно течение самого онкологического гематологического заболевания в условиях наслоения вирусного гепатита. В ряде случаев присоединение гепатитов В и С заставляет прервать терапию основного заболевания (угроза печеночной недостаточности). Следствием вынужденных перерывов и нарушений протокола лечения является более высокая частота рецидивов (56,5 % против 40,4 %).
S. Dibenedetto и соавт. сообщили о достоверно большем числе вынужденных перерывов поддерживающей терапии в группе инфицированных вирусом гепатита С детей с ОЛЛ по сравнению с неинфицированными.
Фоном, на котором происходит развитие гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями, является широкий спектр поражений печени иного происхождения. Печень пациентов с онкологическими гематологическими заболеваниями подвержена воздействию многих патогенных факторов. В первую очередь следует отметить поражение печени в рамках различных онкологических заболеваний. Наиболее часто при этом выявляется диффузная или фокальная инфильтрация печени опухолевыми клетками, затрагивающая портальные тракты и синусоиды.
Часто гепатотоксическое воздействие оказывают противоопухолевые препараты и антибиотики. Спектр наблюдаемых при этом клинико-морфологических вариантов патологии печени очень широк. В частности, при исследовании метотрексата наряду с поражением печени по типу острого гепатита может развиться печеночный фиброз различной степени выраженности. Для проявлений токсичности 6-меркаптопурина характерны некроз и ожирение гепатоцитов, формирование фиброза портальных трактов, холестатические поражения. Токсические гепатиты с нарушением функции печени могут вызывать также циклофосфан, L-аспарагиназа, декарбазин, идарубицин.

Биохимический анализ крови в норме
Известны случаи развития тяжелых гепатотоксических реакций после однократного введения дактиномицина. В литературе встречаются описания острого гепатита, ассоциированного с приемом антибактериальных препаратов (эритромицин, сульфаниламиды, тетрациклин), используемых среди прочих при лечении онкологических больных. Большие дозы тетрациклина приводят к поражению печени, сходному с острой жировой дистрофией. Использование ципрофлоксацина может обусловить возникновение тяжелого гепатонекроза. Некоторые препараты: эритромицин, амоксициллин/клавуланат, тетрациклин, циклоспорин — вызывают холестатические поражения печени.
Гепатотоксичны также противогрибковые агенты, в частности флуконазол, итраконазол, кетоконазол.
Развитие гепатонекроза возможно при лечении таким широко используемым препаратом, как парацетамол. Сочетание различных препаратов может приводить к потенцированию их гепатотоксичности. Так, воздействие на печень 6-меркаптопурина усиливается при параллельном применении его с доксорубицином. Длительное лечение цитостатическими препаратами может приводить к портальной гипертензии вследствие выраженного фиброза.
Особой формой поражения печени у больных с онкологическими гематологическими заболеваниями является веноокклюзионная болезнь печени, которая встречается главным образом в отделениях ТКМ у пациентов, которым проводят высокодозную ПХТ. Веноокклюзионная болезнь характеризуется гипербилирубинемией, быстрым увеличением и болезненностью печени и задержкой жидкости с развитием асцита.
Морфологически выявляются фиброзная облитерация терминальных печеночных венул, расширение или фиброз центролобулярных синусоидов, некроз гепатоцитов зоны 3, отложение фибрина и фактора VIII в стенках терминальных венул. Данные о распространенности веноокклюзионной болезни очень разноречивы — от 1,2 до 53 %. Ряд авторов утверждают, что риск развития веноокклюзионной болезни возрастает при повышении уровня трансами-наз перед проведением так называемого кондиционирования, которое заключается во введении больному химиопрепаратов в очень высоких дозах и последующей ТКМ.
Веноокклюзионная болезнь чаще развивается у больных, инфицированных вирусом гепатита С, а также у пациентов, длительно получавших антибиотики шикого спектра действия, противогрибковые и противовирусные препараты (амфотерицин В, ацикловир и ванкомицин). В основе патогенеза веноокклюзионной болезни, вероятно, лежат многие факторы: повреждение эндотелия, приводящее к активации факторов свертывания и усилению агрегации тромбоцитов, повышение содержания цитокинов, высокие дозы бусуль-фана, а также снижение содержания глутатиона в гепатоцитах.
У больных с онкологическими гематологическими заболеваниями (ОГЗ) может наблюдаться пострадиационное поражение печени, для которого в острый период характерно повышение уровня щелочной фосфатазы и печеночных трансаминаз, редко — желтуха и асцит. Параллельное применение доксорубицина, дактиномицина и винкристина потенцирует лучевое поражение печени. Одно из отдаленных последствий облучения — фиброз печени.
Редкой патологией печени, которая может развиться в связи с химиотерапией по поводу онкологических заболеваний, является нодулярная регенеративная гиперплазия.
В связи с широким применением цитостатической и гормональной терапии по поводу онкологического гематологического заболевания (ОГЗ), оказывающей выраженное иммуносупрессивное действие, пациенты этой категории крайне подвержены инфекционным заболеваниям. Следовательно, гепатиты у этих больных также могут быть обусловлены широким спектром инфекционных агентов: неспецифическими поражениями в рамках генерализованных инфекций, абсцессами печени, грибковыми заболеваниями (кандидоз, аспергиллез, криптококкоз) и вирусными гепатитами, в том числе обусловленными цитомегаловирусами, вирусами простого и опоясывающего герпеса, аденовирусами.
От гепатитов В и С, развивающихся на подобном фоне, уже априорно можно ожидать необычного течения и своеобразия клинико-лабораторных проявлений, имеющих большое значение для распознавания и лечения этих заболеваний.
Соотношение маркеров репликации гепатитов В и С и активности АЛТ при моно- и микст-инфекции (в процентах к числу обследованных)
| Маркер в ПЦР | Активность АЛТ - нормальная | Активность АЛТ - незначительное повышение (в 1,5—2 раза) |
| РНК ВГС+ | 5,8 | 94,2 |
| ДНК ВГВ+ | 25,0 | 75,0 |
| РНК+, ДНК+ | 58,3 | 41,7 |
По нашим данным, наличие и тяжесть клинических проявлений гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями находятся в прямой зависимости от способа выявления инфицированных. При активном скрининговом обследовании абсолютно приобладают безжелтушная и инаппарантная формы гепатита В (до 100 %). Без активного обследования у этого контингента больных обнаруживаются лишь манифестные формы гепатитов, тяжесть которых превосходит таковую при гепатите В у детей без онкологического гематологического заболевания.
Так, из 29 детей с онкологическими гематологическими заболеваниями при манифестных формах гепатитов В и С у 7 больных наблюдались формы средней тяжести, у 10 — тяжелые и у 2 — злокачественные формы с явлениями острой печеночной энцефалопатии (ОПЭ). У большинства пациентов с онкологическими гематологическими заболеваниями вирусный гепатит приобретает хроническое течение. Об этом в определенной степени свидетельствует тот факт, что из 18 HBsAg-позитивных пациентов, выявленных до начала исследования, у 15 персистенция HBsAg сохранялась более 6 мес.
К особенностям, затрудняющим диагностику вирусных гепатитов на фоне онкологического гематологического заболевания, относится отсутствие корреляции между вирусной репликацией и активностью печеночных ферментов у большинства пациентов независимо от наличия ПХТ. Так, в образцах с нормальной активностью АЛТ от детей в период ПХТ частота обнаружения ДНК составила 44,4 %, а в образцах от детей, которым лечение было отменено, — 42,9 %.
Высокая активность АЛТ обнаружена лишь у 2 % детей с онкологическим гематологическим заболеванием при наличии в крови ДНК вируса гепатита В, средняя — также у 2 %, незначительное повышение — у 32 % детей. У остальных 64 % уровень АЛТ оставался нормальным несмотря на присутствие в крови маркера активной вирусной репликации. В отсутствие онкологического гематологического заболевания наличие ДНК вируса гепатита В в 96,9 % случаев сопровождалось высокой активностью АЛТ.
При гепатите С соотношения аналогичны. У абсолютного большинства активно выявленных при скрининговом обследовании больных гепатит С протекает в безжелтушной и инаппарантной формах. У пациентов, поступающих в гепатитные отделения с манифестными формами, наблюдается широкий спектр клинических форм — от легких типичных до тяжелых холестатических.
Как и при гепатите В, активность трансаминаз у пациентов с гепатитом С и онкологического гематологического заболевания на фоне вирусной репликации повышается незначительно или остается нормальной, в то время как гепатит С без сопутствующего онкологического гематологического заболевания чаще протекает со значительным увеличением активности АЛТ.
Подавление цитолиза максимально выражено при одновременной репликации вирусов гепатитов В и С. Уровень АЛТ не повышается более чем у половины детей с активной микст-инфекцией.
Практический вывод таков: активность АЛТ не может быть использована в качестве привычного и надежного критерия диагностики и контроля за течением гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями.
Оценка собственно клинических (объективных и субъективных) проявлений гепатитов В и С у больных с онкологическими гематологическими заболеваниями также очень сложна, особенно на фоне ПХТ. Слабость, вялость, тошнота, рвота, анорексия и т. д. встречаются почти постоянно как побочные эффекты массивной ПХТ, поэтому они не могут служить признаками гепатитов В и С так же, как увеличение печени и желтуха, которые могут иметь медикаментозное происхождение, быть следствием веноокклюзионной болезни и т. д.
Таким образом, диапазон форм тяжести гепатитов В, С и микст-гепатитов у больных с онкологическими гематологическими заболеваниями достаточно широк. При активном целенаправленном выявлении абсолютно преобладают безжелтушные, субклинические и инаппарантные формы. Немногочисленные манифестные заболевания протекают преимущественно в тяжелой (35 %) и злокачественной (10 %) формах. При вирусных гепатитах у детей с онкологическими гематологическими заболеваниями корреляция между репликацией вируса и активностью печеночных ферментов в большинстве случаев отсутствует, что наряду с невыраженностью клинических признаков существенно затрудняет выявление инфицированных. Главным методом остается генная диагностика с использованием ПЦР.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В данной статье представлены результаты исследования антител к кардиолипину и ряда ведущих показателей системы плазменного гемостаза и фибринолиза у 31 больного хроническим гепатитом и 41 – циррозом печени. Установлено, что концентрация антител к кардиолипину при хронических гепатитах в 58 % случаев была в норме или умеренно повышена, а при циррозах печени, напротив, в 61,1 % случаев наблюдалось высокое содержание антител. Наиболее высокие средние значения антител к кардиолипину имелись у больных вирусными хроническими гепатитами и циррозами печени, а наименьшие – алкогольными. У больных циррозом печени с высокими значениями антител к кардиолипину часто выявлялись признаки гипокоагуляции, гиперфибринолиза и маркеры гипокоагуляционной фазы синдрома диссеминированного свертывания крови.

2. Решетняк Т.М., Середавкина Н.В., Насонов Е.Л. Кардиоваскулярные аспекты антифосфолипидного синдрома // Клин. медицина. – 2008. – № 9. – С. 4–12.
3. Ягода А.В., Корой П.В. Патология печени и функция тромбоцитов (клинико-патогенетический анализ). – Ставрополь: СтГМА, 2008. – 273 с.
4. Aldawood A., Arabi Y., Aljumah A. et al. The incidence of venous thromboembolism and practice of deep venous thrombosis prophylaxis in hospitalized cirrhotic patients // Thrombosis J. – 2011. – Vol. 9. – № 1. – Р. 1–10.
5. Andre P., Nannizzi-Alaimo L., Prasad S.K. Platelet-derived CD40L. The switch-hitting player of cardiovascular disease // Circulation. – 2002. – Vol. 106. – Р. 896–899.
6. Bick R.L., Baker W.F. Antiphospholipid syndrome and thrombosis //Semin. Thromb. Hemost. – 1999. – Vol. 25. – № 3. – Р. 333–50.
7. Branger S., Schleinitz N., Veit V. Auto-immune hepatitis and antiphospholipids // Rev. Med. Interne. – 2007. – Vol. 28. – № 4. – Р. 218–24.
8. De Groot P.G., Derksen R.H. Pathophysiology of the antiphospholipid syndrome // J. Thromb. Hemost. – 2005. – Vol. 5. – Р. 1854–60.
9. Deep Vein Thrombosis and Pulmonary Embolism / Edited by E.J.R. van Beek, H.R. Buller, M. Oudkerk. 2009: John Wiley & Sons, Ltd., 562 p.
10. Giannakopoulos B., Passam F., Ioannou Y. How we diagnose the antiphospholipid syndrome // Blood. – 2009. – Vol. 113. – № 5. – Р. 985–94.
11. Mangia A., Margaglione M., Cascavilla I. Anticardiolipin antibodies in patients with liver disease // Am. J. Gastroenterol. – 1999. – Vol. 94. – № 10. – Р. 2983–7.
12. Miyakis S., Lockshin M.D., Atmusi T. et al. International consensus statement on an update of classification criteria for definite antiphospholipid syndrome (APS) // J. Thromb. Hemost. – 2006. – Vol. 4. – Р. 295–306.
13. Zachou K., Liaskos Ch., Rigopoulou E. Presence of high avidity anticardiolipin antibodies in patients with autoimmune cholestatic liver diseases // Clin. Immune. Orlando Fla. – 2006. – Vol. 119. – № 2. – Р. 203–212.
В настоящее время важное значение в патогенезе тромбофилий придается антифосфолипидному синдрому (АФС), который характеризуется рецидивирующими венозными и артериальными тромбозами, тромбоцитопенией и гиперпродукцией антифосфолипидных антител (АФЛ) [1, 6, 8, 9].
АФЛ – гетерогенная группа аутоантител, распознающих антигенные детерминанты анионных и нейтральных фосфолипидов и комплексные эпитопы, образующиеся в процессе взаимодействия фосфолипидов и фосфолипидсвязывающих белков плазмы крови [1, 6, 10]. АФЛ являются патогенетическим медиатором тромбозов в связи с их способностью повреждать эндотелиальный барьер, подавлять функциональную активность факторов свертывания, эндогенный фибринолиз, активировать тромбоцитарное звено гемостаза [1, 8, 12].
Одним из ведущих диагностических маркеров АФС являются антитела к кардиолипину (АКЛ) – фосфолипидам клеточных мембран. Определенный уровень АКЛ присутствует в крови здоровых людей, но при его повышении происходит активация тромбоцитов и эндотелия сосудов, что способствует возникновению тромбозов и тромбоэмболий. Повышение уровня АКЛ является фактором риска первого венозного тромбоза, а также повторных тромбоэмболий в популяции [1, 2, 8, 9]. Согласно международным критериям классификации АФС (Сидней, Австралия, 2006), определение АКЛ относят к обязательным методам лабораторной диагностики АФС [12].
В литературе имеются отдельные немногочисленные данные об изменениях содержания АКЛ в крови при хронических гепатитах и циррозах печени, однако они носят противоречивый характер [4, 7, 11, 13]. Практически не изучена связь антител с показателями плазменного гемостаза, фибринолиза, маркерами синдрома диссеминированного свертывания (ДВС), что указывает на необходимость дальнейших исследований в данном направлении.
Цель исследования – изучить концентрацию антител к кардиолипину у больных хроническим гепатитом и циррозом печени и установить их связь с изменениями плазменного гемостаза и фибринолиза.
Материалы и методы исследования
Больные обследованы в стационаре в стадии обострения их основного заболевания. Диагностика ХГ и ЦП осуществлялась на основании комплекса клинико-лабораторных и инструментальных показателей в соответствии с существующими стандартами.
Определение концентрации АКЛ в плазме крови проводилось методом иммуноферментного анализа с использованием коммерческой тест-системы производства компании Orgentec (Германия). При оценке результатов исследования АКЛ в соответствии с международными рекомендациями выделялись нормальный (M ± 2 SD), умеренно повышенный (от M ± 2 SD до M ± 5 SD) и высокий (> M ± 5 SD) уровни АКЛ, где M-средняя концентрация АКЛ у здоровых лиц, а SD – стандартное отклонение [169].
Cогласно полученным данным нормальный уровень АКЛ составил от 6,0 до 16,8 МЕ/мл; умеренно повышенный – от 16,9 до 24,9 МЕ/мл; высокий – от 25,0 МЕ/мл и выше.
Всем больным проводилось исследование ведущих показателей системы гемостаза и фибринолиза, а также маркеров синдрома внутрисосудистого свертывания крови.
Результаты исследования и их обсуждение
На рис. 1 представлено распределение больных ХГ и ЦП в зависимости от уровня у них АКЛ: нормального, умеренно повышенного или высокого. Нормальная концентрация АКЛ в группе больных ХГ наблюдалась в 35,4 % случаев, умеренное повышение – в 22,6 % случаев, а значительное повышение – в 42,0 %. В группе больных ЦП соответственно 21,9 % случаев, 17,0 и 61,1 %. Следовательно если при ХГ содержание АКЛ более, чем у половины больных было в норме или повышено умеренно, то при ЦП количество больных с высоким уровнем антител превысило 60 %.
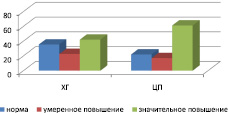
Рис. 1. Распределение больных хроническим гепатитом и циррозом печени (% случаев) в зависимости от концентрации АКЛ
Концентрация АКЛ в крови зависела от этиологии ХГ и ЦП. У больных ХГ вирусной этиологии средние значения АКЛ составили 40,8 ± 5,3 МЕ/мл, алкогольной этиологии – 15,4 ± 2,4 МЕ/мл, смешанной (вирус + алкоголь) этиологии – 22,3 ± 3,7 МЕ/мл. При вирусных ЦП средние значения АКЛ составили 45,5 ± 5,9 МЕ/мл, при алкогольных – 17,7 ± 3,4 МЕ/мл, при смешанных (вирус + алкоголь) – 31,4 ± 7,4 МЕ/мл. Следовательно, наиболее высокие средние значения АКЛ имелись в подгруппах больных ХГ и ЦП вирусной этиологии, а наименьшие – алкогольной. У пациентов смешанными ХГ и ЦП средний уровень антител приближался к значениям у лиц с вирусной этиологией заболевания.
Результаты исследования концентрации АКЛ при ЦП в зависимости от класса тяжести по Child-Pugh показало, что у больных компенсированным ЦП класса А (n = 12) уровень АКЛ составил в среднем 17,0 ± 2,5 МЕ/мл. По мере прогрессирования заболевания наблюдалось существенное нарастание концентрации антител и при субкомпенсированном ЦП класса В (n = 17) их содержание составило в среднем 44,5 ± 7,3 МЕ/мл, а при декомпенсированном ЦП класса С (n = 12) – 43,4 ± 11,6 МЕ/мл.
Достоверных корреляционных связей между величиной АКЛ в крови и показателями исследованных факторов плазменного гемостаза, фибринолиза и маркеров ДВС – синдрома при ХГ и ЦП выявлено не было. В связи с этим были проанализированы средние значения ряда ведущих показателей гемостаза и фибринолиза в группах больных ХГ и ЦП в зависимости от величины АКЛ. Обследованные пациенты с ХГ и ЦП соответственно были разделены на две подгруппы: 1 подгруппа – с нормальным и умеренным повышением уровня АКЛ, 2 подгруппа – с значительным повышением уровня АКЛ. Результаты исследования представлены в таблице.
Величина АКЛ и изменения показателей гемостаза и фибринолиза при хронических гепатитах и циррозах печени
Читайте также:

