Поражение слухового нерва при герпесе
Обновлено: 18.04.2024
Для цитирования: Камчатнов П.Р., Евзельман М.А., Чугунов А.В. Постгерпетическая тригеминальная невралгия – возможности предупреждения и лечения. РМЖ. 2014;6:454.
В основе заболевания лежит реактивация вируса Varicella zoster, способного на протяжении длительного периода времени персистировать в ганглиях заднего рога. Соответственно, в отношении тройничного нерва областью их нахождения является гассеров узел. В случае возникновения определенных условий, благоприятных для активации вируса, развивается заболевание. Считается, что факторами риска для его реактивации являются пожилой возраст или, наоборот, инфицирование в детском возрасте (до 18 мес.), состояние иммуносупрессии различного происхождения (приобретенный иммунодефицит, онкологические заболевания, иммуносупрессивная терапия), внутриутробный контакт с вирусом ветряной оспы. Заболевание реализуется в условиях снижения клеточного иммунитета, обусловленного различными причинами.
Вирус герпеса может передаваться от человека к человеку, в частности, в тех случаях, когда индивидуум не переносил ветряной оспы или не был своевременно вакцинирован по поводу данной инфекции. Заболевание не склонно к рецидивированию. Считается, что рецидивы наблюдаются примерно у 6% пациентов, причем период от первого эпизода до рецидива может составлять несколько десятилетий [5]. Клинический опыт свидетельствует о том, что рецидив может быть обусловлен возникшим у пациента заболеванием, наличие которого негативным образом сказывается на состоянии и характере иммунного ответа.
Клинические проявления
Развитию заболевания предшествует продромальный период, который характеризуется лихорадкой, тошнотой, диффузной головной болью, которые, нарастая, могут наблюдаться на протяжении нескольких суток. Характерным является нарастание локальных болей, которые имеют характер нейропатических, а также неприятный жгучий, колющий оттенок зуда, способных сопровождаться аллодинией, гиперестезией и гиперпатией. Как правило, такого рода боли локализованы в области последующих высыпаний и ограничиваются зоной одного или нескольких соответствующих дерматомов. В подавляющем большинстве случаев указанные проявления носят односторонний характер, хотя у отдельных пациентов они могут распространяться и на противоположную половину туловища [8]. Боль может носить исключительно интенсивный характер, что нередко симулирует ряд соматических заболеваний, в частности плеврит, острый инфаркт миокарда, почечную колику. Поражение гассерова узла может вызвать трудности при проведении дифференциальной диагностики со стоматологическими заболеваниями, поражением придаточных пазух носа.
На фоне указанных симптомов появляются гиперемия и множественные макулопапулярные высыпания, которые впоследствии приобретают характер везикулярных. Пузырьки заполнены прозрачным бесцветным серозным содержимым. В случаях благоприятного течения заболевания высыпания могут быль локализованы только в отдельной части дерматома. Появление новых высыпаний возможно на протяжении 5–7 дней. Через несколько суток от момента появления первых высыпаний содержимое их становится мутным (так называемая стадия пустуляции). В последующем, при отсутствии осложнений, на месте имевшихся высыпаний образуются сухие корочки, которые отпадают через 2–3 нед. В этих зонах могут оставаться рубцовые изменения или зоны измененной пигментации. Заболевание, как правило, имеет благоприятный прогноз, характеризуется монофазным течением и в незначительной степени обладает тенденцией к рецидивированию.
Диагностика может быть затруднена до появления характерных высыпаний. После их возникновения правильная постановка диагноза обычно не вызывает трудностей. Подтверждение диагноза возможно при проведении полимеразной цепной реакции, позволяющей выявить ДКН вируса Varicella zoster в содержимом имеющихся высыпаний.
Осложнения
Среди возможных осложнений следует отметить локальные инфекционные поражения, обусловленные инфицированием поврежденных кожных покровов стрептококком или стафилококком, вплоть до развития целлюлита. При вовлечении в патологический процесс офтальмической ветви тройничного нерва возможно развитие кератита, способного привести к тяжелым последствиям в виде поражения роговицы, вплоть до монокулярной слепоты. Редко встречаются поражения герпетической инфекцией ткани головного мозга (с развитием энцефалита) или его оболочек с возникновением серозного менингита.
Одним из наиболее частых и достаточно тяжелых осложнений ганглионита гассерова узла, обусловленного герпетической инфекцией, является постгерпетическая невралгия. Патогенез указанного состояния достаточно сложен и включает в себя по меньшей мере два основных механизма [5]. Во-первых, в его развитии принимает участие повышение возбудимости первичных афферентов вследствие поражения периферических нейронов. В результате этого возникают избыточная возбудимость ноцицепторов и, как следствие, формирование центральной сенситизации. Клинически такая совокупность патофизиологических процессов проявляется возникновением боли и развитием аллодинии. Во-вторых, вследствие дегенерации ноцицептивных нейронов возникает деафферентация вышерасположенных сенсорных систем, обусловливающая их гиперактивность. В результате этого наблюдается формирование боли, которая, однако, не сопровождается аллодинией. По мнению авторов, у одного пациента возможно сочетание обоих механизмов, с чем связано своеобразие болевого синдрома и различий в эффективности проводимой терапии.
Данное патологическое состояние характеризуется всеми типичными для нейропатического болевого синдрома клиническими характеристиками. Установление диагноза возможно в том случае, если боль сохраняется на протяжении не менее 30 сут после наступления полного заживления имеющихся высыпаний.
Факторами риска развития постгерпетической тригеминальной невралгии являются возраст старше 60 лет, женский пол, наличие продромального периода, множественность высыпаний, а также высокая интенсивность болевого синдрома в дебюте заболевания [6]. По мнению авторов исследования, болевой синдром умеренной интенсивности, не сопровождающийся развитием в последующем постгерпетической невралгии, наблюдается у более молодых пациентов и, вероятно, связан с обширным локальным повреждением тканей и воспалительным процессом при наличии множественных высыпаний. Следует подчеркнуть значимость возрастного фактора как важного предиктора развития болевого синдрома – у пациентов, перенесших опоясывающий герпес в возрасте старше 90 лет, постгерпетическая невралгия возникает примерно в половине случаев [5]. Неблагоприятным прогностическим фактором развития болевого синдрома является выявление вируса Varicella zoster в крови.
Как и в отношении подавляющего большинства хронических нейропатических болевых синдромов, исключительно важную роль в развитии постгерпетической невралгии играет совокупность психосоциальных факторов. Наличие предшествующих депрессивных и тревожных расстройств, недостаточная социальная адаптированность пациента, нарушение социальных связей, проживание вне семьи и др. могут повышать вероятность развития болевого синдрома.
Течение постгерпетической невралгии может быть различным. У части пациентов наблюдается значительный регресс или полное исчезновение имеющегося болевого синдрома за период времени около полугода. К сожалению, возможно менее доброкачественное течение, когда болевой синдром приобретает хронический характер и приводит к инвалидизации пациента и резкому снижению качества его жизни [10]. Риск возникновения тяжелого болевого синдрома нарастает с возрастом, так, более чем у 5% пожилых больных интенсивный болевой синдром сохраняется более 12 мес. [5]. Особенности течения заболевания могут быть связаны с различиями патогенеза болевого синдрома, направленностью и интенсивностью компенсаторных реакций организма, а также с эффективностью и адекватностью проводимой терапии, в частности, ее своевременным началом.
Достаточно часто наряду с развитием постгерпетической невралгии у пациентов наблюдаются двигательные нарушения в виде периферических парезов черепных нервов (наиболее часто – лицевого нерва) [1]. Данная форма герпетической инфекции известна в качестве синдрома Рамсея Ханта. Не получено убедительных данных о прогностической значимости моторных нарушений в отношении частоты и длительности болевого синдрома.
Лечение
Вероятно, несоблюдение указанного правила привело к тому, что результаты систематизированного обзора, посвященного изучению результатов противовирусной терапии, не смогли подтвердить ее эффективность в отношении предупреждения развития невралгии через 4 и 6 мес. после появления высыпаний [7]. Эти данные свидетельствуют о необходимости правильного выбора пациентов для достижения желаемого эффекта и своевременного начала лечения.
Для достижения терапевтического эффекта в виде уменьшения риска развития постгерпетической невралгии необходимо применение валацикловира (Вирдел) в суточной дозе 1000 мг 3 раза на протяжении 7 сут. Возможно использование и местных лекарственных форм противовирусных препаратов, но достижение терапевтического эффекта возможно только при их системном введении в адекватных суточных дозировках и достаточном сроке лечения. Препарат Вирдел хорошо переносится, возможно его одновременное применение с другими лекарственными средствами.
В качестве средства, потенцирующего лечебные эффекты валацикловира, предлагается одновременное назначение глюкокортикоидов. Имеются данные о том, что комбинированная терапия способна снизить интенсивность болевого синдрома в острой стадии заболевания [12]. Менее убедительны сведения о способности глюкокортикоидов уменьшить риск формирования постгерпетической невралгии. Авторы проведенных в этом направлении исследований указывают на то, что использование глюкокортикоидов ассоциировано с повышенным риском развития нежелательных побочных эффектов, в частности, обострения язвенной болезни желудка, гипергликемии, присоединения локального инфекционного процесса, причем частота такого рода осложнений повышается с возрастом. Несомненно, что проведение комбинированной терапии требует всестороннего учета возможного положительного ее эффекта и связанного с лечением риска побочных реакций, обусловленного состоянием конкретного пациента.
В том случае, если у больного имеется стойкая постгерпетическая невралгия, наблюдающаяся в отдаленном периоде после заживления высыпаний, лечение больного требует других подходов. В данной ситуации могут быть использованы представители трициклических антидепрессантов (амитриптилин, нортриптилин), которые обладают достаточно высокой эффективностью. Вместе с тем, несмотря на хороший противоболевой эффект, широкое применение этих препаратов ограничивается частым возникновением нежелательных побочных реакций, в особенности при их назначении в высоких дозировках. Достижение противоболевого эффекта при снижении риска побочных эффектов возможно за счет назначения антидепрессантов, обладающих способностью ингибировать обратный захват как серотонина, так и норадреналина. Следует отметить, что противоболевой эффект антидепрессантов при постгерпетической невралгии, как и при других нейропатических болевых синдромах, не связан только с их антидепрессивным эффектом.
Для лечения пациентов с постгерпетической невралгией традиционной широко применяются противоэпилептические препараты, в частности карбамазепин. В настоящее время распространение получили новые лекарственные средства, фармакологические эффекты которых реализуются вследствие взаимодействия с рецепторами гамма-аминомасляной кислоты – основного тормозного медиатора в центральной нервной системе (габапентин, прегабалин). Отмечается их лучшая переносимость по сравнению с противоэпилептическими препаратами предыдущих поколений. В ряде стран при постгерпетической невралгии используются слабые или даже сильные опиоиды.
Интерес представляет возможность применения локальных форм лекарственных препаратов. Так, показано, что местное использование препаратов лидокаина может быть целесообразным при наличии болевого синдрома, сопровождающегося аллодинией. Имеются также сведения о возможной эффективности капсаицина у пациентов с постгерпетической невралгией. Следует отметить, что его широкое применение ограничивается не всегда удовлетворительной переносимостью терапии.
Таким образом, имеющиеся сведения об эффективности использования валацикловира (Вирдел) у пациентов с опоясывающим герпесом позволяют рекомендовать его широкое применение у данного контингента больных. Своевременное начало лечения, правильный отбор больных для назначения препарата способны повысить эффективность проводимой терапии, профилактировать развитие постгерпетической невралгии.
Симптомы поражения уха опоясывающим герпесом (синдрома Ханта) и его лечение
Ушной опоясывающий герпес (herpes zoster oticus), или синдром Ханта, -вторая по частоте после глазного опоясывающего герпеса (herpes zoster ophthalmicus) форма опоясывающего герпеса головы и шеи - наблюдается в любом возрасте, но главным образом - в 40-60 лет.
а) Клиническая картина ушного герпеса:
• Нарушение общего состояния, субфебрильная температура тела.
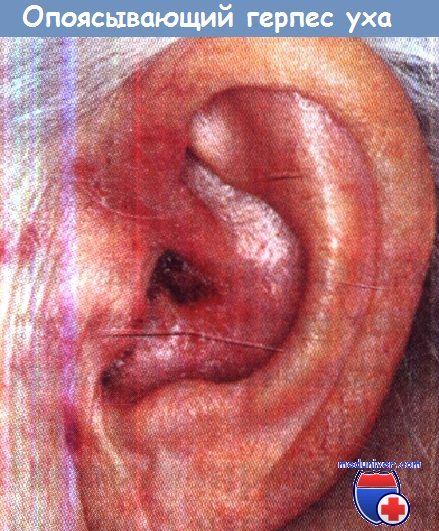
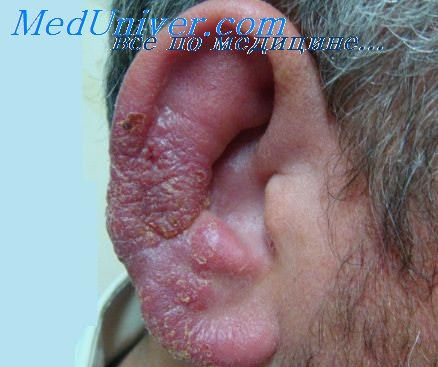
• Эритема, везикулярная сыпь на ушной раковине и в наружном слуховом проходе.
• Регионарный лимфаденит (изолированный).
• Мучительная невралгическая боль.
• Периферический паралич лицевого нерва (у 60-90% больных).
• Нейросенсорная тугоухость (у 40% больных).
• Головокружение и нарушение равновесия у 40% больных нистагмом, направленным в здоровую сторону.
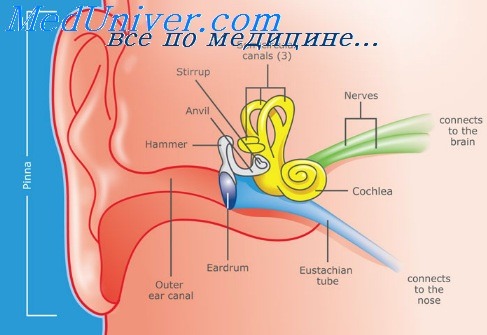
б) Причины и механизмы развития. Ушной опоясывающий герпес - вирусная инфекция, входные ворота которой не установлены. Возможно, вирус через кровь попадает в ЦСЖ и оболочки мозга, вызывая энцефаломиеломенингит и воспаление спирального или преддверного ганглия.
в) Диагностика поражения уха опоясывающим герпесом:
• Осмотр ушной раковины и отоскопия.
• Аудиография и акустическая импедансометрия.
• Вестибулярные пробы
• Исследование функции лицевого нерва.
• Проба Ширмера.
• Исследование функции языкоглоточного и блуждающего нервов.
• Серологическое исследование на противовирусные антитела.
• Поясничная пункция, исследование ЦСЖ (диагностика серозного менингита).
г) Дифференциальный диагноз:
• Буллезный мирингит.
• Идиопатический паралич лицевого нерва.
д) Лечение ушного герпеса:
• Противовирусная терапия ацикловиром или фамцикловиром (противовирусные препараты, блокирующие синтез ДНК вирусами простого герпеса 1-го и 2-го типа (ВПГ-1 и ВПГ-2) и вирусом varicella-zoster).
• у-глобулин.
• Антибиотики (профилактика суперинфекции).
• Местное лечение поражений кожи примочками или мазью.
е) Течение и прогноз. Полное выздоровление может наступить в течение 4 нед., но при поражении лицевого нерва оно бывает неполным. Нарушение функции улитки и преддверия обычно бывает необратимым.
ж) Другие вирусные инфекции. Грипп, корь, аденовирусная инфекция, ветряная оспа, коксаки-вирусная инфекция и эпидемический паротит часто вызывают вестибулярный нейронит с соответствующими симптомами.
Виру сэпидемического паротита (свинка) обладает особым тропизмом к улитке и обычно вызывает односторонний серозный лабиринтит, деструкцию волосковых клеток и дистрофию кортиева органа. Возможно также развитие нейролабиринтита с деструкцией спирального ганглия. Преддверная часть лабиринта при эпидемическом паротите почти никогда не поражается.
P.S. Эпидемический паротит - наиболее частая причина развития односторонней глухоты у детей младшего возраста.
- Течение. Основное заболевание обычно имеет легкое или абортивное течение.
- Прогноз. Прогноз неблагоприятный, что связано с необратимостью поражения.
з) Серозный лабиринтит. Серозный лабиринтит обусловлен серозным воспалением пери- и эндолимфатического пространства, вызванным вирусной инфекцией или токсинами и приводящим к частичной или полной деструкции сенсорных клеток улитки и преддверия. Нарушение функции улитки и преддверия обычно необратимо.
и) Аутоиммунные заболевания уха. Аутоиммунное заболевание или синдром могут привести к поражению внутреннего уха, приводящему обычно к быстрому асимметричному развитию двусторонней нейросенсорной тугоухости. Поражение лабиринта может иметь флуктуирующее течение и иногда сопровождается вестибулярными симптомами.
• Синдром Когана.
• Гранулематоз Вегенера.
• Рецидивирующий полихондрит.
• Первичное аутоиммунное заболевание.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Паралич лицевого нерва - паралич Белла. Токсичные для ушей лекарства
Паралич Белла — это острый односторонний паралич без установленной причины. Один из возможных этиологических факторов — вирус простого герпеса 1-го типа. Опоясывающий ушной герпес (ОУГ) вызывает острый лицевой паралич, сопровождающийся болью и патологическими изменениями, сходными с оспой, которые затрагивают ушную раковину, точнее, центральный участок вогнутой поверхности внешнего уха. Очевидно, это происходит из-за оспенно-герпесной вирусной инфекции коленчатого ганглия. Зачастую поражается черепно-мозговой нерв, что приводит к тяжелой нейросенсорной тугоухости наряду с утратой вестибулярной функции. Отек блокирует лицевой нерв в том месте, где он проходит через узкую фаллопиеву трубу, что ведет к ишемии и дисфункции нервной системы.
Применение глюкокортикостероидов для лечения острого паралича лицевого нерва остается предметом дискуссий. Эти препараты не показаны при неполном параличе лицевого нерва, поскольку обычно он полностью проходит без лечения. При полном параличе Белла или ОУГ глюкокортикостероиды следует назначать в течение 10 сут с момента проявления симптомов, а затем постепенно снижать дозу.
Ацикловир (ациклогуанозин) является аналогом нуклеозидов, который подавляет воспроизводство ДНК вирусов и уменьшает функциональный дефицит у пациентов с ОУГ на фоне сниженного иммунитета. Польза ацикловира в лечении паралича Белла не доказана. В идеале лечение необходимо начать как можно раньше, после проявления первых симптомов — в пределах 72 час после начала заболевания.
Токсичные для ушей лекарства
Поражение внутреннего уха может быть вызвано четырьмя классами клинически важных лекарств. Возможно нарушение как слуха, так и равновесия. Шум в ушах — дополнительный симптом, сопровождающий вызванную лекарствами ототоксичность.
Противомикробные препараты. У аминогликозидных антибиотиков наблюдается побочное действие на почки и на внутреннее ухо. Стрептомицин и гентамицин оказывают наибольшее токсическое воздействие на вестибулярный аппарат, а канамицин, тобрамицин и амикацин — на волосковые сенсорные клетки улиткового лабиринта. Гентамицин вызывает поражение внутреннего уха приблизительно у 5% пациентов. По некоторым данным, потеря слуха при лечении нетилми-цином происходит у 1 пациента из 250, а вестибулярная дисфункция — у 1 из 150.
Аминогликозиды связывают наружную поверхность волосковой мембраны и блокируют проходящие через нее каналы Са2+. Препараты этой группы также соединяются с бифосфатом фосфатидилинозитола внутренней поверхности клеточной мембраны. Подавление внутриклеточного Са2+ и процессов, регулируемых полиаминами, наносит дополнительный ущерб мембране и постепенно ведет к гибели клеток. Возникающая ототоксичность может быть как обратимой, так и тяжелой или необратимой, при которой часто встречаются не поддающиеся лечению ограничения слуха. Поскольку состояние некоторых пациентов, нуждающихся в аминогликозидах, характеризуется слабостью, их жалобы на головокружение и шум в ушах могут быть проигнорированы, особенно если пациент прикован к постели.
Слишком часто длительную вестибулярную токсичность у амбулаторных пациентов распознают на поздних стадиях, когда развиваются:
• непереносимость движения;
• осциллопсия (трудности при стабилизации взгляда во время движений головы);
• атаксия.
Необходимо выявлять пациентов с повышенным риском аминогликозидной ототоксичности, контролировать концентрацию сыворотки крови и как можно скорее переводить таких пациентов на антибактериальные препараты без ототоксичного побочного действия. Измерение слуховой функции, например, с помощью последовательной аудиометрии — хороший способ раннего определения ототоксичности. Слух может быть ослабленным даже при таких концентрациях сыворотки крови, которые сопоставимы с нормой. Концентрация аминогликозидов в перелимфе улиткового лабиринта зависит от времени и от плазмы. Как следствие такой ототоксичности, аминогликозиды следует назначать самыми малыми эффективными дозами в течение возможно более короткого времени.
Гликопептидные антибиотики, например ванкомицин, все больше употребляют в связи с растущей проблемой антибактериальной устойчивости. Механизм ототоксичности, вызванной гликопептидными антибиотиками, неясен, но схема утраты внешних волосковых сенсорных клеток, предшествующая утрате внутренних, такая же, как и у аминогликозидов.
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Городской клинический онкологический диспансер, Санкт-Петербург, Россия, 197044
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Поражение тройничного нерва при герпетической инфекции в оториноларингологии
Журнал: Вестник оториноларингологии. 2016;81(4): 19‑21
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Нейротропизм герпетической инфекции обусловливает разнообразный спектр ее клинических проявлений. Цель - исследование особенностей поражения тройничного нерва при герпетической инфекции. Проведено обследование и этиопатогенетическое лечение 36 больных с невропатией тройничного нерва, обусловленной ВПГ 1-го типа, и 21 больного с невропатией тройничного нерва, обусловленной Herpes zoster oticus. Помимо традиционных клинических методов использованы вирусологическая диагностика для верификации герпетической инфекции и электронейрография. Выздоровление отмечено у 23 больных 1-й группы и у 11 - 2-й группы.
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Городской клинический онкологический диспансер, Санкт-Петербург, Россия, 197044
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Герпетическая инфекция (ГИ) является одной из актуальных медицинских проблем 2. На территории России и стран СНГ различными формами герпетической инфекции ежегодно страдают 20 млн человек [1]. В Санкт-Петербурге регистрируется 23 000-25 000 случаев поражений нервной системы при герпетической инфекции ежегодно [1]. Нейротропизм Г.И. обусловливает разнообразный спектр ее клинических проявлений [1, 4-6]. Например, только при Herpes zoster oticus (ушной герпес) выделяют 12 клинических форм. Возможность поражения герпес-вирусами черепно-мозговых нервов и последующего периневрального распространения приводит к тяжелым функциональным, органическим и косметическим расстройствам. После инфицирования низковирулентные штаммы вируса простого герпеса (ВПГ) в организме человека переходят в латентное состояние и находятся в стадии провируса в чувствительных ганглиях ЦНС: тройничном, пояснично-крестцовом, крестцовом [1, 7-9].
В большинстве случаев распространение ВПГ начинается из самого крупного ганглия - гассерова узла, который расположен между листками твердой мозговой оболочки в одноименной выемке передней грани пирамиды височной кости. Общность строения сенсорных ганглиев, анатомические предпосылки, развитая сосудистая сеть и множественные коллатерали нервных волокон позволяют предполагать возможность распространения ВПГ с поражением вестибулярного, спирального, тройничного и коленчатого ганглиев [4-6, 10].
Цель - исследование особенностей поражения тройничного нерва при герпетической инфекции.
Среди проходивших обследование и лечение в клинике оториноларингологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова за период с 2010 по 2015 г. поражение тройничного нерва было выявлено у 21 больного с Herpes zoster oticus и у 36 - с невралгией тройничного нерва, вызванной ВПГ 1-го типа. Всем пациентам проводились неврологическое обследование и лабораторная вирусологическая диагностика для верификации ВПГ 1-го и вируса герпеса человека (ВГЧ) 3-го типов. В исследование были включены пациенты с высоким (более 1:800) титром специфических IgG. Также проводилось исследование на авидность (определение высокоспециализированных и низкоспециализированных антител). У всех в последующем подтвердилась либо первичная герпетическая инфекция (положительная полимеразная цепная реакция (ПЦР) крови и слюны при показателе авидности <30%), либо рецидив хронической герпетической инфекции (положительная ПЦР крови и слюны при авидности >40%).
Из 36 пациентов с невралгией тройничного нерва (23 женщины и 13 мужчин в возрасте от 21 года до 68 лет) большинство пациентов обращались в начальной стадии заболевания в связи с выраженным болевым синдромом и с подозрением на острый синусит, острый отит. 26 больных связывали появление головных болей с перенесенным ОРВИ или переохлаждением. У 12 больных в этот период имелись признаки Herpes labialis, у 6 - Herpes nasalis. Как известно, при раздражении тройничного нерва возникают интенсивные приступообразные боли в лице. По своей локализации боли совпадают обычно с проекцией одной из трех ветвей нерва. Из 32 больных у 30 пациентов болевой синдром соответствовал поражению n. ophtalmicus и n. maxillaris, у 6 - n. mandibullaris.
Из 21 больного с Herpes zoster oticus было 11 женщин и 10 мужчин в возрасте от 32 до 70 лет. 11 пациентов обратились в течение первой недели от момента заболевания, остальные спустя 7-8 дней, когда появлялись первые симптомы неврита лицевого нерва. 13 больных связывали развитие заболевания с переохлаждением, 8 - со стрессовой ситуацией. Как правило, заболевание начиналось с появления везикулярных высыпаний на ушной раковине, головных болей, недомогания, в последующем появлялись симптомы поражения лицевого, тройничного и слухового нервов. Все пациенты обследовались в острой стадии заболевания и наблюдались до стойкой стабилизации состояния.
Больным проводилось исследование тригеминофациального рефлекса. Как известно, лицевой нерв, являясь преимущественно двигательным нервом, обеспечивающим мимические движения, имеет тесные связи с чувствительными центрами тройничного нерва. Это взаимодействие получило название тригеминофациального рефлекса (ТФР). Впервые, используя методику электронейрографии, данный рефлекс зарегистрировал E. Kugelberg в 1952 г., описав его как рефлекс мигания при раздражении нижнеглазничной ветви тройничного нерва (регистрация осуществлялась с круговой мышцы глаза). Позднее исследования были проведены и для других мимических мышц при электростимуляции ветвей тройничного нерва. В отличии от прямого ответа круговой мышцы глаза, регистрируемого при стимуляции лицевого нерва, ТФР является рефлекторным ответом и состоит из двух компонентов: раннего (R1) и позднего (R2).

Таблица 1. Параметры ТФР в контрольной группе, М±m

Таблица 2. Параметры ТФР у больных с невропатиями тройничного нерва герпетической этиологии, М±m
При сравнении параметров ТФР больных с невропатиями тройничного нерва с показателями в контрольной группе выявлено статистически достоверное увеличение значений латентного периода R1-ответа и ипсилатерального R2 (р<0,001) по сравнению с контрольной группой, что свидетельствует о нарушении проведения возбуждения по системе тройничного нерва. Таким образом, исследование ТФР при поражениях тройничного нерва позволяет выявлять нарушения нервной проводимости.
При лечении герпетических невропатий тройничного нерва была использована следующая схема комплексной терапии:
1. Ацикловир в течение 3 нед по 800 мг 4 раза в сутки или валтрекс по 500 мг 2 раза в день в течение 7 дней.
3. Ибупрофен по 200 мг 4 раза в день или карбамазепин 200 мг 2 раза в день.
4. Мильгамма по 2 мл внутримышечно ежедневно в течение 10 дней, затем мильгамма композитум - внутрь по 1 драже 3 раза в день в течение 6 нед.
Все больные с Herpes zoster oticus получали пролонгированный курс лечения ацикловиром. Пациенты с герпетической невропатией тройничного нерва, обусловленной ВПГ 1-го типа, получали недельный курс валтрекса (валацикловира) гидрохлорида. В организме человека валацикловир быстро и полностью превращается в ацикловир под воздействием валацикловиргидролазы. Ацикловир in vitro обладает специфической ингибирующей активностью в отношении вирусов Herpes simplex типа 1 и 2, Varicella zoster и Эпштейна-Бар, цитомегаловируса и вируса герпеса человека типа 6. У пациентов с сохраненным иммунитетом вирусы Herpes simplex и Varicella zoster с пониженной чувствительностью к валацикловиру встречаются крайне редко. Для лечения заболеваний, вызванных вирусом Herpes simplex, взрослым назначали валтрекс по 500 мг 2 раза в сутки в течение 7 дней.
Основная сложность лечения больных с герпетическими невропатиями тройничного нерва обусловлена недостаточной эффективностью применения обычных анальгетических средств (производные метамизола, ибупрофена), что нередко является показанием к применению препаратов иных групп, в частности - карбамазепина, габапентина или амитриптилина. Для купирования болевого синдрома при невропатиях тройничного нерва, обусловленных ВПГ 1-го типа, в основном назначался нурофен (ибупрофен) по 200 мг 4 раза в день. При невропатиях тройничного нерва, обусловленных Herpes zoster oticus, как правило, назначался карбамазепин. Карбамазепин на протяжении последних нескольких десятилетий остается наиболее эффективным и доступным лекарственным средством при лечении больных с невралгией тройничного нерва. При этом максимальная эффективность карбамазепина (в качестве средства монотерапии) проявляется в начальном периоде заболевания. Основным показанием к назначению карбамазепина является приступообразно возникающая боль, охватывающая область иннервации тройничного нерва. Суточная доза карбамазепина при тригеминальной невропатии обычно составляет 200 мг 2 раза в день. Дозу препарата можно увеличивать до 800 мг в сутки и в последующем переходить на поддерживающие дозы по 200 мг 2 раза в день по мере регресса невропатии. Лечение больных с поражением тройничного нерва включало также применение высоких доз витаминов группы В в форме поликомпонентных препаратов мильгамма и мильгамма композитум.
Результаты лечения больных с невропатией тройничного нерва, обусловленного ВПГ 1-го типа, оказались достаточно оптимистичными: из 36 больных у 23 пациентов на фоне противогерпетической терапии и приема ибупрофена болевой синдром претерпел обратное развитие в течение первых 10 дней. У 8 пациентов явления невропатии сохранялись в течение 11-17 дней, болевой синдром был купирован при переходе на лечение карбамазепином. У 5 больных лечение оказалось малоэффективным.
Из 21 больного с невропатиями тройничного нерва, обусловленными Herpes zoster oticus, полностью купировать болевой синдром удалось только у 11 пациентов, у 6 удалось достичь значительного улучшения, у 4 пациентов существенной динамики от проводимого лечения не было отмечено (пациенты были выписаны с рекомендацией продолжить прием карбамазепина).
Таким образом, несмотря на успехи в лечении герпетических поражений современными противогерпетическими препаратами, проблема постзостерной невропатии тройничного нерва остается актуальной, что, вероятнее всего, связано с демиелинизирующими процессами, которые происходят при Herpes zoster oticus как в стволе тройничного нерва, так и в гассеровом узле.
Читайте также:

