После операции на инфицированный панкреонекроз
Обновлено: 11.05.2024
Острый панкреатит имеет различные степени тяжести – от клинически самоограничивающегося до быстрого смертельного течения. Как самостоятельное заболевание, он является полиэтиологическим, но монопатогенетическим. Панкреонекроз – самое тяжелое состояние, развивающееся как следствие острого панкреатита. Для него характерен неблагоприятный прогноз: смертность составляет приблизительно от 15 и до 30-39% в случае инфицирования некроза, который является основной причиной смерти. Некротическая форма острого панкреатита характеризуется тяжелым и продолжительным течением. Распространенные некрозы поджелудочной железы могут быть геморрагическими, жировыми или смешанными. Клинические наблюдения и секционные находки показывают, что в первые часы и дни (3-5 дней) заболевания граница между некротизированными и жизнеспособными тканями в поджелудочной железе является нечеткой, а связь между ними достаточно прочной. Хирургическое вмешательство обычно требуется при инфицированном панкреонекрозе, реже при стерильном. Его цель заключается в удалении некротических очагов не только из поджелудочной железы, но и из забрюшинной клетчатки. Наиболее распространенным подходом при инфицированном панкреонекрозе является открытая хирургическая некрэктомия, но она отягощена высокими показателями заболеваемости (34-45%) и смертности (11-39%). Попытка удалить омертвевшие участки поджелудочной железы и забрюшинной клетчатки сопровождаются кровотечением, поэтому более безопасно осуществлять некрэктомию не ранее, чем через 10 дней, так как в это время граница между мертвыми и живыми тканями становится четкой. Сосуды некротизированных тканей оказываются тромбированными и некрэктомию можно выполнить почти бескровно. Объем определяется степенью патологических изменений и тяжестью состояния больного. За последние два десятилетия лет лечение панкреонекроза значительно эволюционировало от открытой хирургии к малоинвазивным методам. Следует отметить, что раннее интенсивное консервативное лечение, иногда в сочетании с вышеописанными оперативными вмешательствами является эффективным методом для ведения больных с острым панкреатитом.

1. A.C. de Beaux, K.R. Palmer, D.C. Carter Factors influencing morbidity and mortality in acute pancreatitis; an analysis of 279 cases // Gut . 1995 Jul. №37. pp. 121-126.
2. Banks, P. A., Bollen, T. L., Dervenis, C., Gooszen, H. G., Johnson, C. D., Sarr, M. G.,Vege, S. S. Classification of acute pancreatitis—2012: revision of the Atlanta classification and definitions by international consensus // Gut. 2012. №62. С. 102-111. doi:10.1136/gutjnl-2012-302779
3. Bugiantella, W., Rondelli, F., Boni, M., Stella, P., Polistena, A., Sanguinetti, A., & Avenia, N Necrotizing pancreatitis: A review of the interventions // International Journal of Surgery. 2016. №28. pp. 163-171. doi:10.1016/j.ijsu.2015.12.038
5. Ismail O. Z., & Bhayana V. Organ failure and infection of pancreatic necrosis as determinants of mortality in patients with acute pancreatitis // Clinical Biochemistry. 2017. №50 (18). pp. 1275-1280. doi:10.1016/j.clinbiochem.2017.07.003
6. Ситкин С.И., Силаев В.Н., Бозова Е.Ю., Токарева С.И. Современные подходы к лечению острого панкреатита (обзор международных рекомендаций) // Тверской медицинский журнал. 2015. №2. С. 14-24.
7. Э.Э. Топузов, В.К. Балашов, Б.Г. Цатинян, Э.А. Аршба, А.В. Петряшев, М.А. Бобраков Хирургическое лечение острого панкреатита: возможности чрескожного дренирования // Хирургия. 2017. №8
Актуальность: Острый панкреатит (ОП) среди острых хирургических заболеваний является причиной 5-10% госпитализаций в хирургические стационары [7]. Общая смертность от ОП в мире составляет от 5-10% [6]. Примерно у 80% пациентов острый панкреатит является лёгким и самоограничивающимся, но у 20% он может иметь тяжелое течение с некрозом паренхимы поджелудочной железы и / или перипанкреатической ткани, ведущее к тяжелой заболеваемости и смертности до 27% [1,3]. Основной причиной смерти является инфицирование некротизированной ткани, которое связано с неблагоприятным прогнозом: смертность составляет приблизительно 15% у пациентов с панкреонекрозом и до 30-39% с инфицированием панкреонекроза (оно возникает примерно у трети пациентов) [4]. На сегодняшний день так и не удалось снизить летальность от гнойно ‑ септических осложнений, уменьшить длительность стационарного лечения, что непосредственно связано с особенностями течения заболевания [7]. Лечение больных с панкреонекрозом – одна из актуальных проблем в хирургии. Раннее распознавание острого панкреатита и выбор адекватного метода лечения являются основными задачами успешного лечения. Это обусловлено частой встречаемостью данного заболевания, а также высокой летальностью от осложнений.
Панкреонекроз – деструктивное заболевание поджелудочной железы, являющееся осложнением острого панкреатита и приводящее к развитию полиорганной недостаточности.
Этиология. Острый панкреатит – это воспаление поджелудочной железы; иногда оно связано с системным воспалительным ответом, который может нарушать функцию всех органов или систем. Воспаление может стихать самопроизвольно или прогрессировать до некроза поджелудочной железы и / или окружающей жировой ткани.
К развитию острого панкреатита может привести любая причина, вызывающая гиперсекрецию панкреатического сока и затруднение его оттока с развитием гипертензии в панкреатических протоках; заброс в протоки цитотоксических и активирующих панкреатические ферменты веществ, прямое повреждение секретирующих панкреатоцитов. Этиологическую характеристику острого панкреатита определяют условия его развития. Основными условиями действия пусковых факторов являются [2]:
‑ заболевания внепеченочных желчевыводящих путей с нарушением желчетока;
‑ заболевания ДПК и большого дуоденального сосочка (БДС);
‑ избыточная пищевая нагрузка и медикаментозная стимуляция панкреатической гиперсекреции;
‑ прием алкоголя и его суррогатов резко усиливает секреторную активность поджелудочной железы, а длительное употребление крепких алкогольных напитков приводит к дуодениту с отеком БДС, создавая затруднение оттоку панкреатического секрета и желчи;
‑ острые и хронические нарушения кровообращения с расстройствами микроциркуляции в поджелудочной железе приводят к развитию ишемического острого панкреатита.
Патогенез. Первым по значимости фактором является собственное переваривание вследствие сочетанного влияния всех ферментов поджелудочной железы, причем в остром периоде каждый из них выступает самостоятельно [10]. В здоровом организме пищеварительные ферменты начинают свою работу после того, как вступят в контакт с желчью, которая поступает в полость кишечника из печени. В том случае, если они активизируются слишком рано, не в кишечнике, а в протоках поджелудочной железы, они начинают разрушать ее.
Существуют механизмы защиты, которые предотвращают при нормальных условиях самопереваривание поджелудочной железы:
‑ ферменты секретируются преимущественно в неактивном состоянии (трипсиноген, химотрипсин и др.);
‑ эпителий протока защищен выстилающим его поверхность мукополисахаридом (слой слизи);
‑ в крови находятся ингибиторы, которые инактивируют ферменты, если им удается оказаться вне системы протока;
‑ обмен веществ, присущий ацинарной клетке, предотвращает проникновение выделенных ферментов назад в клетку.
Если у человека имеется стеноз большого дуоденального сосочка, то в протоках поджелудочной железы повышается давление, что приводит к их растяжению, а это, в свою очередь, является причиной снижения количества слизи, защищающей поверхность протоков от ферментов. Также в данной ситуации имеет место поступление желчи в протоки поджелудочной железы в больших количествах. Перерастяжение сначала возникает на ограниченном участке крупных протоков, по мере повышения давления, процесс распространяется до самых мелких протоков. Поэтому повреждения железы возникают, прежде всего, в пределах регионарной протоковой системы, когда происходит разрыв мелких протоков с выходом протеолитических ферментов в интерстиций. Ингибиторы крови инактивируют ферменты и, вместе с тем, в крови повышается количество амилазы. Однако, повышение амилазы еще не означает наличие острого панкреатита, т.к. это возникает чаще, чем определяется клиническое тому соответствие.
Вторым по значимости фактором повреждения панкреатоцитов является расстройство кровообращения в поджелудочной железе. Недостаточное кровообращение железы снижает обмен веществ до критической границы, что может привести к отдельным местным некрозам [9]. Причинами могут быть:
‑ микротромбозы и др.
На возникшие некротические ткани воздействуют протеолитические ферменты. Продукты разложения всасываются в лимфатические сосуды и через них попадают в кровь. Они представляют большую опасность для паренхиматозных органов, в частности, для почек. В случае излечения, на периферии железы поврежденные ткани замещаются соединительной, а внутри железы, при определенных обстоятельствах, формируются ложные кисты [5].
В последние годы наблюдается увеличения частоты затяжного острого панкреатита, это объясняется двумя факторами:
- Ранним поступлением больных в стационар, улучшением диагностики и, как следствие, ранним проведением интенсивной противошоковой терапии;
- Частным поражением периферии поджелудочной железы, когда некроз располагается по наружной поверхности, в то время как центральная часть железистой ткани, расположенная вокруг главного панкреатического протока, остается неповрежденной.
Диагностика острого панкреатита обычно основывается на наличии боли в животе и увеличении уровня сывороточной амилазы и / или липазы.
Методы лучевой диагностики панкреонекроза.
- Ультразвуковое исследование
Данный метод является наиболее доступным, в связи с отсутствием инвазивности, простотой выполнения, высокой специфичностью и чувствительностью в определении основных проявлений панкреонекроза. - Компьютерная томография
КТ с болюсным контрастным усилением является приоритетным методом диагностики при определении тактики хирургического лечения.
КТ позволяет оценить размеры любого отдела железы в аксиальной, сагитальной и фронтальной плоскостях, а также плотность ткани в единицах Хаунсфилда. Кальцинаты и конкременты в ПП хорошо видны на фоне паренхимы ПЖ без контрастного усиления.
Противопоказанием к назначению данного исследования является непереносимость пациентом йодсодержащих контрастных препаратов, почечная недостаточность.
Ограничивающим фактором является значительная лучевая нагрузка на пациента. - Магнитно-резонансная томография
Выполнение МРТ целесообразно у пациентов с непереносимостью йодсодержащих контрастных препаратов, метод является наиболее информативным в дифференциальной диагностике причин билиарной и панкреатической гипертензии. - Эндоскопическая ретроградная панкреатохолангиография
Эндоскопическую ретроградную панкреатохолангиографию (ЭРПХГ) в настоящее время применяют редко. Несмотря на высокую диагностическую информативность ЭРХПГ не исключает возможности развития серьезных осложнений (острого панкреатита, холангита, сепсиса, ретродуоденальной перфорации). Недостатком является также невозможность оценить изменения непосредственно паренхимы железы. ЭРПХГ позволяет детально оценить состояние протока ПЖ и его ветвей.
Некрэктомия и резекция поджелудочной железы.
Наиболее безопасно осуществлять некрэктомию не ранее, чем через 10 дней от начала заболевания, так как в первые 3-5 дней при некрэктомии высок риск развития значительных кровотечений и повреждения прилежащих жизнеспособных тканей. Через 10 дней и более от начала заболевания граница между мертвыми и живыми тканями становится четкой, сосуды некротизированных тканей оказываются тромбированными и некрэктомию можно выполнить почти бескровно. В сроки 6-14 дней от начала заболевания некрэктомию относят к операциям, выполняемым в фазе расплавления и секвестрации, то есть ко второй группе операций при остром панкреатите. Третья группа – это поздние отсроченные операции, с 3 недели заболевания и далее, т.е. в фазе септического воспаления. Операции могут быть одно -, двух- и многоэтапные.
- Абсолютные:
‑ инфицированный панкреонекроз;
‑ панкреатогенный абсцесс;
‑ деструктивный холецистит;
‑ септическая флегмона забрюшинной клетчатки;
‑ гнойный перитонит. - Относительные:
‑ стерильный некроз более 50% ткани поджелудочной железы (по данным КТ);
‑ абактериальный некроз забрюшинной клетчатки (по данным УЗИ и КТ);
‑ холедохолитиаз, механическая желтуха (ЭРПХГ, эндоскопическая папиллотомия, эндоскопическая литоэкстракция);
‑ прогрессирующее ухудшение состояния в виде полиорганной недостаточности.
Предоперационная подготовка. Подготовка больных к операции должна включать коррекцию алиментарных и водно-электролитных нарушений. У больных, страдающих сахарным диабетом, необходимо проводить терапию с участием эндокринолога. При наличии дуоденальной дистрофии с нарушением дуоденальной проходимости требуется интенсивная терапия с элементами гипералиментации [8].
Возможные ошибки и осложнения.
1. Осложнения во время операции:
b. недостаточно широкий разрез желудочно-ободочной связки;
c. за некротизированную или секвестрированную ткань поджелудочной железы принимаются очаги некроза окружающей орган клетчатки, что дает хирургу основание сделать заключение о более распространенной деструкции железы, чем это есть на самом деле;
d. рассечение капсулы поджелудочной железы при отечном панкреатите. Это вмешательство неизбежно сопровождается повреждением сосудов и паренхимы органа, в то же время, оно не снижает напряжения в ткани железы и не улучшает кровоснабжения.
2. Осложнения в послеоперационном периоде:
‑ внутрибрюшные кровотечения: кровотечения после резекционных операций на ПЖ следует классифицировать согласно рекомендациям международной группы исследователей в области хирургии ПЖ (ISGPS) , при этом учитываются следующие факторы:
a. время начала кровотечения - 24 часа после завершения операции, разграничивают ранние и поздние кровотечения;
b. тяжесть кровотечения - показатель гемоглобина и необходимость переливания компонентов крови;
c. источник и локализация кровотечения – внутрипросветное (в просвет желудочно-кишечного тракта), либо внутрибрюшное кровотечение (уровень доказательности А).
3. разлитой перитонит;
4. распространение панкреонекроза;
5. нагноение в операционной ране и эвентрация;
6. образование кист, наружных свищей поджелудочной железы, свищей желудка и кишечника;
7. развитие гнойных форм острого панкреатита;
8. флегмона забрюшинного пространства;
9. абсцесс (поддиафрагмальный, подпеченочный, межкишечный);
10. некрозы брыжейки тонкой и толстой кишок;
11. острые эрозии и язвы пищевода, желудка и кишечника;
12. геморрагический гидроторакс;
13. печеночно-почечная недостаточность.
Выводы. Таким образом, проанализировав литературу по данному вопросу можно сделать вывод о том, что панкреонекроз является полиэтиологичным заболеванием, но имеет один патогенетический механизм, что обусловливает тактику лечения данного заболевания. Хирургическое лечение панкреонекроза должно проводиться в определенные сроки от начала заболевания, это будет способствовать увеличению скорости восстановления пациентов после операции и развитию меньшего количества осложнений в послеоперационном периоде.
Результаты лечения инфицированного панкреонекроза. Исходы
Интраоперационная ревизия и выделение инфильтрированных тканей может привести к профузному кровотечению и диффузной кровоточивости. Поэтому приходится манипулировать на ограниченных участках с учетом точной топической диагностики.
Кровотечение при оперативной санации локализованных очагов у больных пожилого и старческого возраста отмечается в 15% случаев, при чрескожном дренировании — лишь в 2%. Помимо этого во время традиционного вмешательства в 4% случаев выявляется ятрогенное повреждение полых органов. При пункционном же варианте лечения это происходит в 3,7% наблюдений.
Чрескожное дренирование внебрюшинным доступом с повреждением толстой кишки не приводит к фатальным последствиям. Проведение дренажа через стенки желудка может быть запланированным ввиду особенностей расположения очага в сальниковой сумке и также не сопровождается тяжелыми осложнениями.
В послеоперационном периоде лечение пациентов с гнойными осложнениями панкреонекроза комплексное, включает направленную антибактериальную терапию, а также консервативные мероприятия, способствующие нормализации функции легких, печени, почек, кишечника. Проводится коррекция водно-электролитных нарушений, нормализация белкового обмена и иммунокоррекция.
После операции по поводу абсцессов почти у каждого десятого пациента преклонного возраста формируются наружные кишечные свищи. Высокие тонкокишечные свищи приводят к трудно- или некорригируемым потерям жидкости и электролитов.
При щадящей санации подобное осложнение диагностируется в 2% наблюдений.
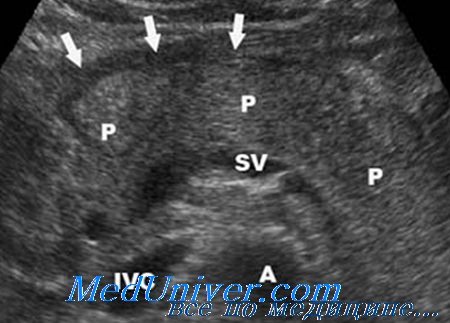
После чрескожного пункционного дренирования локализованного гнойного очага кишечные свищи, как правило, не сопровождаются наружными потерями и обнаруживаются лишь при рентгенологической фистулографии.
У трети больных в послеоперационном периоде образуются наружные панкреатические свищи. При пункционной санации это наблюдается лишь у каждого шестого пациента. В половине наблюдений отмечается поступление панкреатического сока наружу.
Стойкие панкреатические свищи, сформированные после лапаро- и люмботомий, требуют хирургического закрытия при неэффективности консервативного лечения с применением сандостатина (стиламина, октреотида). Подобные свищи не истощающие.
При лечении инфицированного панкреонекроза возможно образование желудочных, желчных и бронхиальных свищей. Желчные, желудочные, толстокишечные свищи (за исключением губовидных) склонны к самостоятельному закрытию.
После вмешательств, проводимых по поводу осумкованных гнойников, возможны аррозивные кровотечения: наружные (в послеоперационную рану) и внутренние (в полость кисты, желудочно-кишечный тракт).
При комплексном пункционном лечении распространенного гнойного поражения забрюшинной клетчатки у больных пожилого и старческого возраста значительно реже выявляются наружные аррозивные кровотечения.
Видеоскопическая санация сопровождается данным осложнением лишь в 10% случаев, при открытых операциях и запланированных реоперациях — почти у каждого второго. Кишечные свищи при указанных вариантах лечения выявляются соответственно в 20, в 32 и 37%. При распространенном поражении забрюшинной клетчатки панкреатические свищи диагностируются у каждого третьего больного, независимо от применяемого варианта хирургического лечения.
При профузном аррозивном кровотечении безальтернативно оперативное лечение. Вмешательство при этом направлено на обнаружение источника кровотечения и гемостаз.
При очаговом процессе прогноз результатов лечения панкреонекроза у лиц преклонного возраста благоприятный.
При субтотальном и тотальном поражении поджелудочной железы после завершения лечения у 38% выживших пациентов отмечаются нарушения углеводного обмена, что требует инсулинотерапии.
Почти у 70% больных после перенесенного панкреонекроза появляются признаки ферментативной недостаточности, подтверждающиеся лабораторно и клинически.
Таким образом, диагностика, лечение и выбор оптимальной хирургической тактики при остром панкреатите у больных пожилого и старческого возраста остаются актуальными задачами. Данное полиэтиологическое заболевание, как правило, сопровождается явлениями полиорганной недостаточности и требует интенсивной коррекции в условиях отделения реанимации. Развитие панкреонекроза на фоне имеющейся сопутствующей соматической патологии осложняется синдромом взаимного отягощения, что существенно отражается на результатах лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Панкреонекроз. Вторая неделя острого панкреатита.
Панкреонекроз развивается у 1/5 больных панкреатитом, когда сумма баллов по шкале Рэнсона превышает 3, а по шкале APACHE II — больше 8. Динамическая КТ с контрастным усилением — лучший метод в диагностике панкреонекроза; она должна быть выполнена у пациентов, состояние которых не улучшается к концу 1-й недели заболевания.
КТ в этой стадии служит также базисным исследованием для сравнения с последующими изображениями поджелудочной железы, паренхима которой в случае некроза не накапливает контрастный препарат; и объем некроза может быть определен в сравнении с хорошо перфузируемой неповрежденной части железы.
Как только панкреонекроз распознан, вам предстоит ответить на два вопроса
• Является ли панкреонекроз инфицированным?
• Показана ли операция, и если да — то какая?

В начале 2-й недели вероятность инфицирования крайне мала, но постепенно нарастает, достигая пика на 3-й неделе. Поскольку на основании только клинических данных трудно понять, является некроз стерильным или инфицированным, необходимы дополнительные исследования. Пузырьки газа, которые видны на обзорной рентгеноскопии(графии) брюшной полости или КТ у пациентов, являются патогномоничным признаком инфицирования. Если пузырьки газа не видны, необходима тонкоигольная аспирация некротической ткани под контролем КТ с целью бактериального посева и окраски по Граму.
Бактериальное инфицирование панкреатического или перипанкреатического некроза представляет смертельную опасность, если остается нелеченым, и, следовательно, служит абсолютным показанием к операции.
Как лечить неинфицированный панкреонекроз? Вопрос неоднозначен. С одной стороны массивный стерильный панкреонекроз протекает тяжело и даже может привести к смерти или обусловить вторичное инфицирование. С другой стороны, мы знаем, что стерильный некроз может разрешиться самостоятельно. Неясно, однако, могут ли довольно большие некротизированные участки паренхимы (более половины железы) поддаться консервативной терапии? Эта неопределенность обусловливает различные подходы к лечению.
Ранее производились попытки радикальной резекции поджелудочной железы, ценой им было резкое увеличение осложнений и летальности. При этом часто иссекалась и нормальная паренхима железы, так как и хирурги и рентгенологи переоценивали зону распространения панкреонекроза.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Панкреонекроз (некроз поджелудочной железы) – это деструктивное заболевание поджелудочной железы, которое является серьезным осложнением острого или хронического панкреатита. Код панкреонекроза по МКБ-10 — K86.8.1. Характерная особенность этого грозного недуга – постепенное омертвление тканей поджелудочной железы. Это очень опасный диагноз, представляющий угрозу для жизни человека.
Отмирание этого органа происходит ввиду того, что ткани поджелудочной растворятся ферментами, которые она сама и вырабатывает. Как правило, этот процесс сочетается и с другими патологическими явлениями – воспалительными процессами, инфекцией и др.
Этот недуг является самым тяжелым осложнением панкреатита. Как правило, он поражает молодых людей в трудоспособном возрасте. Согласно медицинской статистике, эта болезнь составляет около 1% от всех фиксированных случаев острого живота. Однако количество случаев этой болезни в последнее время увеличивается. Настораживает и высокий уровень смертности при некрозе поджелудочной железы – он составляет 30-80%. Поэтому крайне важно своевременно диагностировать недуг и начать адекватное лечение незамедлительно.
Патогенез
Основой патогенеза панкреонекроза является сбой в механизме внутренней защиты поджелудочной от влияния панкреатических ферментов, которые ее разрушают. Если человек обильно употребляет спиртное и постоянно переедает, внешняя секреция существенно усиливается, протоки железы растягиваются, и отток панкреатических соков нарушается.
Некроз поджелудочной развивается на фоне панкреатита – воспалительного процесса поджелудочной железы, при котором часто происходит отмирание части или всего органа.
Поджелудочная железа — это важный для нормального функционирования организма орган. Его основные функции – продукция основных ферментов, участвующих в пищеварении, а также регулирование содержания сахара в крови ввиду выработки гормонов инсулина и глюкагона. Соответственно, дисфункция этого органа приводит к серьезным нарушениям общего состояния организма.
Когда человек чувствует голод, соки и ферменты транспортируются через соединительный проток в тонкую кишку, благодаря чему и обеспечивается ферментативная обработка пищи. Панкреатическая жидкость воздействует на кислую среду желудочного сока, нейтрализуя ее. В кишечнике пищеварительные ферменты расщепляют и перерабатывают вещества.
Поджелудочная вырабатывает основные пищеварительные ферменты:
При панкреонекрозе определяется три стадии отмирания тканей:
- Токсемическая– в крови появляются токсины, имеющие бактериальное происхождение, железа активно вырабатывает ферменты.
- Развитие абсцесса – развивается гнойный воспалительный процесс тканей и органов, которые окружают поджелудочную.
- Гнойные изменения в тканях– если развивается гнойный сепсис, требуется немедленное оперативное вмешательство, так как это состояние угрожает жизни.
Классификация
В зависимости от преобладания повреждающих механизмов определяются три формы болезни:
В зависимости от распространенности патологических проявлений определяют две формы:
- локальный(поражена одна область);
- диффузный(поражены две или больше областей).
В зависимости от темпов прогрессирования:
В зависимости от глубины поражения:
В зависимости от протекания болезни:
В зависимости от выраженности проявлений болезни определяют несколько ее степеней:
- Легкая степень – как правило, это отечный или диффузный некроз с необширными очагами.
- Средняя степень— диффузный или локальный с более выраженными очагами.
- Тяжелая степень — диффузный или тотальный с крупными очагами.
- Крайне тяжелая стадия – панкреонекроз сопровождается осложнениями, ведущими к необратимым последствиям и летальному исходу.
Причины
Определяют ряд факторов, провоцирующих некротические процессы в тканях поджелудочной:
- регулярное чрезмерное потребление спиртного;
- постоянное переедание, злоупотребление копченой, жареной и жирной пищей; ;
- камни в желчном пузыре;
- наличие травм брюшной полости и перенесенные хирургические вмешательства в этой области;
- тяжелые инфекционные заболевания.
Под воздействием этих факторов может развиваться дисфункция поджелудочной железы, что приводит к панкреатиту и панкреонекрозу. Но, как правило, панкреонекроз проявляется на фоне эпизодических приемов алкоголя. Исследования подтвердили, что в большинстве случаев панкреонекроз развивался после эпизода потребления спиртного в очень больших количествах.
Симптомы некроза поджелудочной железы
Признаки этого заболевания могут проявиться спустя несколько часов иди дней после того, как отмечалось влияние факторов, провоцирующих болезнь.

Основной признак – боли, проявляющиеся в левом подреберье. Также болевые ощущения могут отдавать в бока, спину, ощущаться под ложечкой. Боль является постоянной, достаточно интенсивной или умеренной. Она может быть опоясывающей, отдавать в плечо, лопатку, поэтому у человека может создаться впечатление, что развивается сердечный приступ. Боль становится сильнее после того, как больной поест. При этом может проявиться тошнота и многоразовая рвота. Панкреонекроз без боли невозможен.
Также вероятны следующие симптом панкреонекроза:
- покраснение кожи, так как из-за повреждения поджелудочной железы в кровь попадают вещества расширяющие сосуды; – следствие гниения и брожения в кишечнике;
- синюшные или багровые пятна на животе, ягодицах боках – так называемый симптом Грея-Тернера;
- кровотечения желудочно-кишечные – следствие разрушающего влияния ферментов на стенки сосудов;
- повышение температуры;
- напряженность передней брюшной стенки, болезненность при ее пальпации;
- сухость слизистых, кожи, жажда – следствие обезвоживания;
- понижение кровяного давления;
- спутанность сознания, бред.
Болезнь, как правило, начинается остро, и чаще всего первые ее признаки больные связывают с чрезмерным приемом алкоголя и существенным нарушением диеты. Медики свидетельствуют, что большая часть таких пациентов поступают в больницы еще в состоянии опьянения, что подтверждает стремительное развитие патологических изменений в железе. Существует прямая зависимость между выраженностью боли и степенью тяжести некроза. Если деструктивные изменения распространяются на нервные окончания, это ведет к постепенному снижению выраженности боли. Но этот признак в сочетании с интоксикацией является достаточно тревожным в плане прогноза.
После того, как появляется боль, спустя некоторое время больного начинает беспокоить рвота. Ее сложно укротить, и она не приносит облегчения. В рвотных массах присутствуют сгустки крови, желчь. Из-за постоянной рвоты развивается обезвоживание, что ведет к сухости кожи, обложенности языка. Постепенно замедляется диурез. Отмечается метеоризм, задержка стула и газов. Эти симптомы сопровождает лихорадка.
Вследствие колебания показателей глюкозы, токсемии и гиперферментемии поражается головной мозг и развивается энцефалопатия. Если воспалительный процесс прогрессирует, поджелудочная существенно увеличивается в размерах. В брюшной полости формируется инфильтрат. Такое состояние является опасным для жизни пациента.
Анализы и диагностика
При появлении подозрения на развитие некроза необходимо сразу же обратиться к врачу-терапевту. Специалист проводит осмотр, выясняет обстоятельства развития болезни. Он обязательно проводит пальпацию и определяет наличие, характер и место проявления боли. При подозрении на патологию железы больного осматривает эндокринолог. Если на железе обнаруживают опухоли, к процессу лечения подключается и специалист-онколог.
Чтобы установить диагноз, назначают инструментальное и лабораторное обследование.
Лабораторные исследования предусматривают расширенный анализ крови, так как при некрозе отмечаются следующие патологические изменения:
- Повышенный уровень сахара, повышенная зернистость лейкоцитов, нейтрофилов.
- Повышенный показатель СОЭ.
- Повышенный уровень эластаза, трипсина, гематокрита как следствие обезвоженности.
- Увеличение печеночных ферментов вследствие воспалительного процесса.
- На развитие некроза также указывает увеличенный уровень амилазы в моче.
- В процессе лабораторных исследований определяют состояние гормонов, пищеварительных ферментов.
Также в процессе диагностики могут назначать такие исследования:
- Ультразвуковое исследование – с целью определения неравномерности структуры тканей железы, выявления кист, абсцессов, жидкости в брюшной полости, камней в желчевыводящих путях. Также УЗИ дает возможность проанализировать, в каком состоянии протоки.
- Магниторезонансная томография, компьютерная томография – позволяют определить очаги развития болезни, размеры органа, а также узнать, развивается ли воспаление, есть ли отеки, абсцессы, новообразования, деформации.
- Ангиорграфия сосудов железы.
- Диагностическая лапароскопия.
- Пункция.
Окончательный диагноз специалист сможет поставить, только получив данные всех назначенных исследований.
Лечение
Если есть подозрение на развитие некроза, пациента необходимо сразу же госпитализировать. Ведь от своевременности лечения напрямую зависит благоприятность прогноза. Лечение проводят только в стационаре. Его схема зависит от того, насколько орган поражен. Если речь идет о ранней стадии, то хирургической операции часто удается избежать. Ведь такое вмешательство достаточно небезопасно, так как выяснить, какой именно орган пострадал, сложно.
В первые дни лечения практикуется лечебное голодание, далее – строгое соблюдение диеты.

1. Арутунян А.В., Черданцев Д.В., Арутунян А.В. / Острый панкреатит: анализ заболеваемости в Красноярском крае. Сборник трудов краевой научно-практической конференции, посвященной юбилею ГКБСМП им. Н.С. Краповича.¬ – Красноярск, КрасГМУ, 2013. – С.33-38.
2. Белобородова Ю.С., Винник Ю.С., Белобородов А.А. и др. Значение методов лучевой визуализации в диагностическом алгоритме при остром панкреатите // Сибирское медицинское обозрение. – 2014. – № 1. – С. 66-70.
3. Данилов М.В., Федоров В.Д. / Хирургия поджелудочной железы. Руководство для врачей. – М.: Медицина, 1995. – 512 с.
4. Дюжева Т.Г., Джус Е.В., Рамишвили В.Ш. и др. Ранние КТ-признаки прогнозирования различных форм парапанкреонекроза // Анналы хирургической гепатологии. – 2009. – 14 (40). – С. 54-63.
5. Дюжева Т.Г. Хронический панкреатит. Как повысить эффективность лечения? // Cons. Med. Хирургия. – 2013. – № 1. – С. 20-24.
6. Зайнутдинов А.М. Профилактика и лечение гнойных осложнений у больных деструктивным панкреатитом / А.М. Зайнутдинов, И.С. Малков, А.П. Киршин // Казанский мед. журн. – 2009. – № 6. – С. 821–826.
7. Павликова Е.Ю. Диагностика панкреонекроза и его послеоперационных осложнений. Литературный обзор / Е.Ю. Павликова // Вестн. Рос. науч. центра рентгенорадиологии Федерального агентства по высокотехнологичной мед. помощи. – 2010. – № 10. – С. 30–38.
8. Первова О.В., Черданцев Д.В., Винник Ю.С. Деструктивный панкреатит: комплексное решение проблемы // Актуальные вопросы диагностики и лечения хирургической инфекции: материалы юбилейной конференции, посвященной 10-летию образования Красноярского краевого гнойно-септического центра.– Красноярск: ОИиПДККМИАЦ, 2011. – С.77–86.
9. Buchler М.W. Acute necrotizing pancreatitis: treatment strategy according to the status of infection / M.W. Buchler [et al.] // Ann. Surg. – 2014. – Vol. 232, N 5. – P. 619-626.
10. Spanier B.W. Epidemiology, and etiology and outcome of acute and chronic pancreatitis: an update / B.W. Spanier, M.G. Dijkgraaf, M.J. Bruno // Best Pract. Res. Clin. Gastroenterol. – 2013. – Vol. 1, № 22. – P. 45–63.
Актуальность. Острый панкреатит остается одной из наиболее важных проблем ургентной абдоминальной хирургии. На протяжении последних лет заболеваемость острым панкреатитом занимает второе, а в некоторых регионах – первое место в структуре острой хирургической патологии органов брюшной полости [3, 5, 9]. В 15–20 % наблюдений развитие острого панкреатита носит деструктивный характер. У 40–70 % больных происходит инфицирование очагов некротической деструкции. Именно эта категория больных является наиболее проблемной в диагностическом, лечебном и экономическом аспектах [2,4].
Cреди причин высокой летальности одно из важных мест занимает поздняя госпитализация пациентов, несвоевременная диагностика гнойно-септических осложнений, неадекватный выбор стартовой консервативной терапии, сроков и объема хирургического лечения [3, 8].
Цель исследования состояла в изучении особенностей характера течения и результатов лечения инфицированного панкреонекроза у больных на территории Красноярского края.
Степень тяжести больных определяли по шкале SAPSII [8], наличие и степень выраженности полиорганной недостаточности (ПОН) определяли по шкале SOFA [8]. Кроме балльной оценки тяжести, нами учитывались критерии синдрома системного воспалительного ответа (ССВО), отражающие степень выраженности воспалительного процесса и свидетельствующие о наличии сепсиса. Для стратификации тяжести ПН использовали шкалу, предложенную в Санкт-Петербургском НИИ скорой помощи им. И.И. Джанелидзе [9]. В зависимости от степени тяжести панкреонекроза пациенты были распределены следующим образом: средняя степень тяжести выявлена у 7 больных (26,93 %); тяжелый панкреонекроз – у 19 пациентов (73 %).
Диагноз инфицированного ПН устанавливался на основании лабораторных исследований: клинический анализ крови с определением количества лейкоцитов, лейкоцитарной формулы; биохимический (уровень амилазы, липазы, мочевины, креатинина, общего белка); и инструментальных методов. Всем пациентам при поступлении выполнялось ультразвуковое исследование (УЗИ) и мультиспиральная компьютерная томография с внутривенным болюсным контрастированием (МСКТа).
При поступлении все пациенты были госпитализированы в отделение реанимации и интенсивной терапии (ОРИТ), для проведения комплексной интенсивной терапии, направленной на коррекцию витальных функций, водно-электролитного баланса, проведения интра- и экстрокорпоральной (по показаниям) деинтоксикации, антибиотикотерапии, секретолитической и стресспротекторной терапии.
При выборе хирургической тактики отдавали предпочтение открытым методам. Все пациенты оперированы из традиционного срединного доступа. В сомнительных случаях, при неподвижных, плотно фиксированных некрозах, наличии кровотечения из окружающих тканей, манипуляцию завершали санацией и тампонадой сальниковой сумки через сформированную оментобурсостому. При септических флегмонах забрюшинной клетчатки выполняли их вскрытие и проточно-промывное дренирование через люмботомические разрезы на соответствующей очагу поражения стороне. При наличии гнойного перитонита, кишечных свищей, признаков ишемии толстой кишки, операция завершалась наложением лапаростомы. Программированный контроль состояния брюшной полости выполняли через 48, реже – через 72 часа.
Результаты и обсуждение. Основная часть пациентов с деструктивным панкреатитом доставлялась в клинику в тяжелом и крайне тяжелом состоянии. Средняя давность заболевания до госпитализации в ККБ составила 7,4±6,2дней, причем для пациентов с ПН средней степени тяжести этот показатель был в среднем 6,1±5,1 дней, в то время как для больных с тяжелым ПН – 8,8± 6,4 суток (табл. 1).
Взаимосвязь тяжести ПН от давности заболевания
Давность заболевания (сутки)
ПН средней степени
Анализ сроков выполнения первичной операции показал, что в условиях ЦРБ было оперировано 10 (38,5 %) больных, причем во всех случаях оперативное вмешательство было выполнено в ранние сроки, в среднем, на 2,3± 1,7 сутки от начала заболевания. В послеоперационном периоде эти больные были транспортированы в ККГСЦ ККБ с клиникой тяжелого ПН (табл. 2). Из них 7 больным потребовалось повторное вмешательство в экстренном порядке в связи с необходимостью редренирования гнойно-некротических полостей. Остальные 16 (61,5 %) пациентов были госпитализированы в ККБ с клиникой прогрессирования средне-тяжелого и тяжелого ПН на фоне консервативной терапии. Первичное оперативное вмешательство им было выполнено в среднем на 10–14 сутки от момента заболевания. Распределение больных в зависимости от сроков операции и тяжести ПН представлено в таблице 2. Показанием к оперативному вмешательству было формирование гнойно-некротических осложнений деструктивного панкреатита.
Средние сроки выполнения первичной операции
ПН средней степени
В момент госпитализации в ККГСЦ инфицированные формы ПН были выявлены у 88,5 % (n=23) пациентов, по шкале SAPSII общее состояние больных средней и тяжелой степени соответствовало 2–3 и 4–6 баллам, соответственно. В дальнейшем отмечалось прогрессирование степени тяжести состояния больных, максимальные значения зафиксированы на 7–10 сутки госпитализации, затем у выживших больных наблюдалась тенденция к стойкому снижению этого показателя (табл. 3).
Распределение больных ПН по SAPSII в динамике
ПН средней степени
Исходно у всех больных были выявлены признаки ПОН. В зависимости от выраженности синдрома ПОН (по шкале SOFA), больные были распределены следующим образом (табл. 4). У больных с ПН средней степени тяжести значения шкалы SOFA варьировали в пределах 6–8 баллов, с тяжелым ПН – 10–12 баллов.
Распределение больных ПН по SOFA в динамике
ПН средней степени
При поступлении все пациенты были госпитализированы в ОРИТ Красноярского краевого гнойно-септического центра. Продолжительность пребывания, в котором зависела от сроков купирования клиники синдрома полиорганной недостаточности и сепсиса. Для больных с тяжелым панкреонекрозом этот показатель составил, в среднем, 20±17,3 суток, для больных с ПН средней степени тяжести - 8±3,2 суток. Продолжительность искусственной вентиляции легких составила, в среднем, 8±11,8 суток и 1,7±1,1 суток, соответственно.
Контроль за эффективностью проводимого лечения осуществляли с помощью лабораторных и инструментальных исследований в динамике. При поступлении у всех больных был выраженный лейкоцитоз, ферментемия с многократным превышением нормальных значений, повышение азотемических показателей и билирубина крови (табл. 5).
Данные лабораторных исследований
Лейкоциты (10 9 /л)
Всем больным при поступлении выполнялось УЗИ, которое носило характер скринингового исследования.
Для оценки адекватности хирургического вмешательства, функции дренажей и их положения, а также своевременного выявления не дренированных гнойных очагов, выполняли динамическое УЗИ и МСКТа.
Повторные хирургические вмешательства в ККБ были выполнены у 15 (57,7 %) больных с тяжелым ПН. Из них четырем больным (15,3%) – по программе, вследствие продолжающегося гнойного перитонита. Остальным 11 больным (42,4 %) повторные вмешательства выполнялись по требованию. Из них у 34,6 % (n=9) больных показанием к повторной операции было прогрессирование гнойно-деструктивного процесса забрюшинной клетчатки, наличие крупных секвестров. У одного больного с тотальным поражением забрюшинной клетчатки произошел некроз поперечно-ободочной кишки, еще у одного больного послеоперационный период осложнился аррозивным кровотечением сальниковой сумки.
Среднее количество операций на 1 больного у пациентов с ПН средней степени тяжести составило – 1,4, с тяжелым ПН – 2,6.
Анализ осложнений и летальности выявил следующие закономерности. Наиболее частым осложнением у пациентов с тяжелым ПН была флегмона забрюшинного пространства -61,5 % (n=16). Поражение забрюшинной клетчатки по левостороннему типу выявлено у 36,3 % (n=4), по правостороннему типу – у 9 % (n=1), по центральному – у 23 % (n=6), тотальное поражение забрюшинной клетчатки наблюдалось у 45,4 % (n=5) больных. Следует отметить, что в группе пациентов с летальным исходом у 62,5 % определялось центральное поражение забрюшинной клетчатки.
Системные осложнения выявлены у 72,1 % больных с тяжелым ПН. Распространенный гнойный перитонит осложнил течение тяжелого ПН у 23 % (n=6) больных.
У 84,2 % (n=16) больных выявлен сепсис, из них – тяжелый сепсис у 9 и септический шок у 7 пациентов. СПОН отмечен в 7 случаях с преобладанием дыхательной, сердечно-сосудистой и почечной недостаточности. У 22,2 % (n=2) больных с тяжелым сепсисом в программу комплексной консервативной терапии был включен метод экстракорпоральной детоксикации, что способствовало благоприятному течению заболевания.
Экссудативный плеврит диагностирован у 26,3 % (n=5) пациентов с тяжелым ПН, из них левосторонний в 60 % случаев, у остальных – двусторонний.
У 15,8 % (n=3) пациентов с ПН средней степени тяжести течение осложнилось одиночными панкреатогенными абсцессами сальниковой сумки. Этим больным проводилась чрескожная пункция жидкостного образования под УЗИ контролем с последующим дренированием и санацией растворами антисептиков полости абсцесса. Полное купирование гнойного очага производилось в среднем на 12±3,5 сутки. У одного больного при динамическом УЗИ контроле была выявлена дислокация дренажа, что потребовало повторного дренирования полости абсцесса сальниковой сумки.
Летальность в группе в целом составила 30,8 % (n=8), среди больных с ПН средней тяжести летальных исходов не выявлено. При анализе летальности выявлены следующие закономерности: у всех умерших больных объем поражения ПЖ носил тотальный характер, основными осложнениями течения ПН явились забрюшинная флегмона по центральному типу и тотальное поражение забрюшинной клетчатки, что в 25 % случаев приводило к формированию флегмоны мягких тканей грудной и брюшной стенки, с последующим развитием сепсиса; у 50 % больных способствовало некротическому мезоколиту, некрозу восходящей и поперечной ободочной кишки, еще у двух больных – стрессовой перфорации тонкой кишки. Несмотря на раннее выявление этих жизнеугрожающих осложнений, своевременную активную хирургическую тактику в комплексе с интенсивной консервативной терапией, летальный исход течения ПН у данной категории больных был обусловлен развитием сепсиса, септического шока.
Заключение
Течение деструктивного панкреатита в большинстве случаев осложняется формированием СПОН, сепсисом. Неоправданно раннее хирургическое вмешательство, недостаточный объём операций при панкреонекрозах, а также несвоевременность выполнения необходимого объёма лечения на ранних этапах формирования деструктивного панкреатита, способствует увеличению доли гнойно-септических осложнений и, как следствие, повышению риска летального исхода.
Несмотря на проведение комплексной интенсивной терапии в условиях специализированного учреждения КГСЦ, в группе пациентов с тяжелым ПН наблюдалась стойкая тенденция прогрессирования полиорганной недостаточности, тогда как в группе средней степени тяжести ПН наблюдалась положительная динамика в виде купирования явлений полиорганной недостаточности. Оценку эффективности комплексного лечения или ее отсутствия для максимальной объективности целесообразно проводить по современным шкалам оценки тяжести состояния.
Малоинвазивное лечение панкреонекроза включает в себя чрескожную пункцию отграниченных жидкостных образований ПЖ под УЗИ контролем с последующим дренированием и санацией, а при формировании флегмон забрюшинного пространства необходимо выполнение операции в объёме: лапаротомия, некрсеквестрэктомия, вскрытие, дренирование флегмоны забрюшинного пространства по традиционной методике.
Наиболее частым осложнением у пациентов с тяжелым ПН является формирование тотальной флегмоны забрюшинного пространства. Риск летального исхода существенно повышается при центральном расположении забрюшинной флегмоны.
Читайте также:

