После вирусной и бактериальной инфекции возникает астения
Обновлено: 25.04.2024
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых кли
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых клинических признаков болезни. В этот период происходит мобилизация защитных сил организма, направленных на компенсацию возможных нарушений, на уничтожение болезнетворных агентов и удаление их из организма. Продромальный период представляет собой временной интервал от первых симптомов заболевания до полного проявления. Период выраженных проявлений заболевания характеризуется полным развитием клинической картины. При различных инфекционных заболеваниях может страдать нервная система ребенка, что клинически проявляется синдромом нейротоксикоза. Нейротоксикоз — ответная неспецифическая реакция детского организма на воздействие вирусной, бактериальной или вирусно-бактериальной флоры, характеризующаяся преимущественным поражением центральной (ЦНС) и вегетативной нервной системы. С истощением функциональных возможностей органов и систем в результате перенесенного заболевания, особенно нервной системы при ее перенапряжении, а также вследствие аутоинтоксикации или экзогенного токсикоза связывают возникновение астенического синдрома. Это наиболее частое клиническое проявление периода реконвалесценции. Утомление в течение длительного времени, которое не компенсируется полным восстановлением, вызывает синдром перегрузки, следом за которым развивается состояние истощения. Субъективно ощущаемое чувство утомления — прежде всего сигнал о перегрузке центральных регуляторных систем, неудовлетворительном состоянии энергетических ресурсов организма и аутоинтоксикации продуктами метаболизма. Длительное утомление, приводящее к истощению, по сути своей является результатом стрессорного воздействия на организм, вызывающего нарушение функций регуляторных систем — вегетативной, эндокринной и иммунной. Если стрессорные факторы действуют в течение длительного времени, может развиться реакция организма, при которой возможны функциональные изменения в виде вегетативной дисфункции [1, 6]. Синдром вегетативной дисфункции (СВД) включает в себя проявление всех форм нарушения вегетативной регуляции. Наряду с соматическими проявлениями: головокружением, головными болями, сердцебиением, одышкой, жаждой, булимией, рвотой после еды, непереносимостью отдельных видов пищи, субфебрилитетом неясного происхождения, кожными высыпаниями и др., у пациентов с СВД выявляют эмоциональные расстройства разной степени выраженности в виде тревожности, нарушения сна, беспричинного плача, а также расстройства поведения, в частности, импульсивности, повышенной двигательной активности и возбудимости, дефицита внимания, что клинически определяется как астеновегетативный или психовегетативный синдром [Вейн А. М., 1981].
Интерес и сложность проблемы астеновегетативного синдрома заключается в том, что она является комплексной: медицинской, психологической и педагогической. Однако все специалисты сходятся в том, что такое состояние существует, его необходимо диагностировать и правильно корректировать.
Задачи исследования
Данное исследование посвящено изучению динамики состояния вегетативной нервной системы детей с астеновегетативным синдромом после перенесенных инфекционных заболеваний, а также оценке эффективности препарата Тенотен детский при названной патологии.
Тенотен детский содержит сверхмалые дозы антител к мозгоспецифическому белку S-100, создан по особой технологии специально для детского возраста, оказывает успокаивающее, нормализующее настроение и поведение действие, а также выраженное вегетостабилизирующий эффект [3, 5].
Критерии включения больных в исследование:
Критерии исключения больных из исследования:
Наличие декомпенсированных заболеваний или острых состояний, которые могут влиять на проведение исследования.
Применение вегетотропных и ноотропных препаратов в период исследования и в последние две недели перед исследованием.
Участие в других клинических исследованиях в течение четырех недель перед включением в данное исследование.
Материал исследования
Для исследования методом случайной выборки дети были распределены в две группы. В основной группе (30 человек) дети в периоде реконвалесценции наряду с симптоматической витаминотерапией получали Тенотен детский по 1 таблетке 3 раза в день в течение 4 недель в сочетании со стандартной терапией. В контрольную группу (20 человек) вошли дети, получавшие стандартную витаминотерапию и симптоматическую терапию за исключением препаратов, обладающих вегетотропной активностью.
Достоверных различий по половозрастным показателям между основной и контрольной группами детей не было.
По спектру перенесенных заболеваний, их тяжести, характеру осложнений выделенные группы детей также значительно не отличались. Спектр заболеваний включал вирусные и вирусно-бактериальные инфекции дыхательных путей (этиологически подтвержденные формы гриппа и другие респираторные вирусные инфекции, тяжелые формы бронхитов и пневмоний и др.), острые средние отиты, тяжелые и осложненные формы инфекционного мононуклеоза, висцеральные формы ветряной оспы, протекающие с нейротоксикозом и везикулезными высыпаниями на внутренних органах. Данные о заболеваниях приведены в таблице.
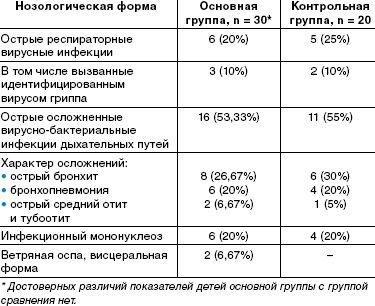
Диагностическое обследование включало в себя клиническую оценку проявлений вегетативной дисфункции, психологическое исследование, неврологическое обследование, электрокардиографию (ЭКГ).
Состояние вегетативной нервной системы определялось по исходному вегетативному тонусу, вегетативной реактивности и вегетативному обеспечению деятельности. Исходный вегетативный тонус, характеризующий направленность функционирования вегетативной нервной системы в состоянии покоя, оценивался по анализу субъективных жалоб и объективных параметров. Оценивалась степень выраженности психопатологических проявлений: утомляемость, тревожность, эмоциональная неустойчивость и др. (модифицированный опросник А. М. Вейна). Определялся внутрисистемный вегетативный тонус по индексу Кердо и межсистемный вегетативный тонус по коэффициенту Хильдебранта. Для оценки вегетативного обеспечения деятельности, отражающего в основном состояние автономной системы регуляции, проводилась клиноортостатическая проба (КОП). Функциональное состояние сердечно-сосудистой системы рассматривалось также на основании данных электрокардиографии.
Уровень внимания оценивался с использованием шкалы SNAP-IV, таблиц Шульте, по результатам модифицированного метода Пьерона–Рузерапо. Выявление расстройств кратковременной и долговременной памяти, косвенно отражающей выраженность астении, проводилось с помощью методики 10 слов и пиктограммы.
Для определения состояния эмоциональной сферы обследуемых (тревоги, депрессии) использовался ахроматический и цветовой тесты Люшера.
После окончания лечения всем детям было проведено повторное комплексное обследование для оценки эффективности терапии. Кроме того, родителям детей предлагалось оценить результаты лечения при помощи десятибалльной аналого-визуальной шкалы, где 0 — это очень плохая оценка, 10 — очень хорошая.
Результаты исследования
Перед началом исследования у всех обследуемых детей (без достоверных различий в обеих группах) с помощью опросника А. М. Вейна определялись умеренно выраженные психопатологические расстройства, в виде неустойчивости эмоционального фона (84%), повышенной тревожности (34%), утомляемости (38%), отвлекаемости (86%), нарушений сна (74%), снижения памяти, а также различные соматические проявления в виде периодических головных болей (52%), головокружения (24%), метеозависимости (12%), снижения аппетита (64%), диспептических нарушений в виде тошноты, рвоты, вздутия живота (44%).
Индекс Кердо позволил определить наличие внутрисистемной дистонии у детей, перенесших тяжелые инфекционные заболевания, он составил в среднем 32,89 ± 0,99 в обеих исследованных группах, что свидетельствовало о превалировании симпатических влияний на организм в покое.
Межсистемный вегетативный тонус, оцениваемый с помощью коэффициента Хильдебранта (средние значения составили 3,98 ± 0,03), имел, в основном, эйтонический характер.
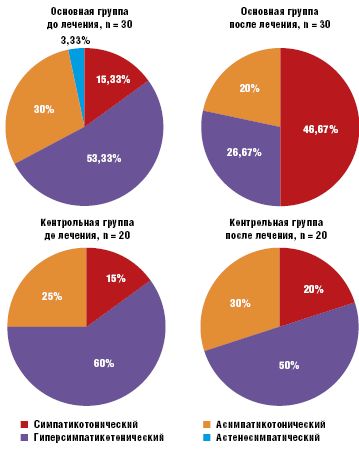
КОП, определяющая вегетативное обеспечение автономной системы регуляции, наряду с нормальным симпатикотоническим вариантом КОП, отражающим устойчивость гемодинамики в ортостазе (14% случаев), выявила и патологические варианты. Гиперсимпатикотонический вариант КОП, характеризующийся резким повышением систолического артериального давления (САД) и диастолического артериального давления (ДАД) и частоты сердечных сокращений (ЧСС) и обусловленный избыточным включением симпатико-адреналовой системы, встречался в преобладающем количестве случаев — у 58% детей. Асимпатикотонический вариант КОП, обусловленный недостаточным подключением симпатического отдела вегетативной нервной системы, при котором САД и ДАД не изменяются или падают, ЧСС остается нормальной или компенсаторно увеличивается, встречался у 28% детей с СВД. Астеносимпатический вариант КОП с падением САД и ДАД и резким увеличением ЧСС в первые минуты ортостаза, с последующей гиперсимпатикотонической реакцией был выявлен в 2% случаев.
Основными психопатологическими проявлениями СВД являлись невнимательность, гиперактивность, импульсивность. Их оценка производилась с помощью шкалы-опросника SNAP-IV (Swanson J., 1992). Показатель невнимательности в двух группах по этой шкале достоверно не отличался и составил в среднем 53,33% (норма (Swanson J., 1992) — 0,40–1,82), средний показатель гиперактивности — 1,96 ± 0,32 (норма (Swanson J., 1992) — 0,27–1,59) и импульсивности 2,13 ± 0,37 (норма (Swanson J., 1992) — 0,26–1,52) (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Выраженность астении косвенно отражается на интеллектуально-мнестических показателях, в частности на оперативной памяти: чем выше утомляемость ребенка в период после перенесенного инфекционного заболевания, тем больше страдает процесс запоминания. Оценка памяти у детей проводилась с помощью методики запоминания десяти слов. Регистрировались следующие показатели: 1) количество повторений, необходимых для воспроизведения 10 слов; 2) количество слов, воспроизведенных через 1 час.
В большинстве случаев обследуемым обеих групп (достоверных различий показателей детей основной группы с группой сравнения нет) для воспроизведения 10 слов требовалось 3 и более повторений, что свидетельствовало о снижении показателей механического запоминания. В то же время количество воспроизводимых слов через час после начала исследования значительно снизилось, что явилось признаком нарушения динамической памяти у детей с вегетативной дистонией.
В качестве методики для исследования опосредованного запоминания использовалась пиктограмма. Регистрировались следующие показатели: 1) количество воспроизведенных понятий; 2) динамика воспроизведенных понятий через 1 час.
Оценка результатов пиктограмм в целом показала, что у детей с СВД дистонией изображаемые образы часто не соответствовали реальным объектам, что впоследствии затрудняло их интерпретацию. Показатели по критерию адекватности (обоснованности связи между предложенным понятием и его пиктограммой) в среднем составили около 50%.
Проведенное по методике Люшера тестирование отразило статистически значимое отклонение преимущественно выбираемой обследуемыми цветовой гаммы от аутогенной нормы. В то же время величина вегетативного показателя не имела столь значимых различий по сравнению с возрастными нормами. Среднестатистические показатели тревожности и напряжения, определенные с помощью теста Люшера, также не имели значительных отклонений от стандартных показателей (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Таким образом, проведенное клиническое обследование детей, перенесших инфекционные заболевания, выявило наличие у них различной степени выраженности проявлений СВД. Безусловно, такие психовегетативные нарушения отражались на периоде реконвалесценции, ухудшали качество жизни и требовали их адекватной коррекции.
В качестве альтернативного препарата для коррекции проявлений СВД был использован Тенотен детский с успокаивающим и выраженным вегетостабилизирующим действием (Лобов М. А., 2008). Основная группа детей (30 человек) получала Тенотен в дозе 3 таблетки/сутки курсом 1 месяц в сочетании со стандартной витаминотерапией. Контрольная группа детей (20 человек) получала стандартную терапию с применением лекарственных средств, не обладающих психотропной и вегетотропной активностью. По окончании курса лечения были проведены повторные клинические исследования.
Прием препарата Тенотен детский в течение месяца обеспечил достоверное (в сравнении с контрольной группой) улучшение показателей психовегетативного статуса и снижение частоты соматоневрологических расстройств у детей, принимавших Тенотен детский, тогда как в контрольной группе детей эти показатели оставались практически на прежнем уровне (рис. 1, 2).
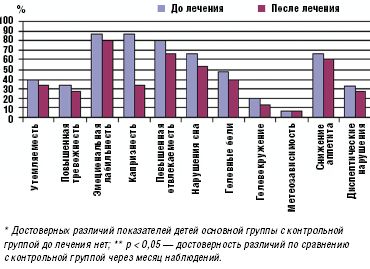
Улучшение показателей вегетативного тонуса отмечалось не только в его психоэмоциональной (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна), но и соматоневрологической (головные боли, головокружение, снижение аппетита, диспептические нарушения) составляющей. Полученные данные отражены на рис. 1.
Качественно изменились результаты КОП. У детей, принимавших Тенотен детский, отмечалась нормализация показателей вегетативного обеспечения (симпатикотонический вариант КОП) с 15,33% детей в начале терапии до 46,67% (p < 0,05), у остальных наметилась четкая тенденция к улучшению. В контрольной группе показатели КОП остались практически на прежнем уровне. Данные отражены на рис. 3.
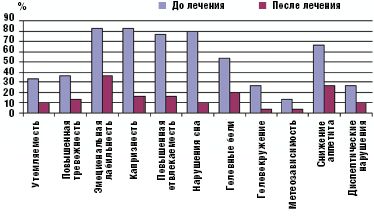
Была выявлена положительная динамика в отношении патопсихологических проявлений. После курсового применения препарата уменьшение выраженности мнестических и поведенческих симптомов (невнимательность, гиперактивность, импульсивность) отмечалось в среднем у 85% детей. Все показатели шкалы SNAP-IV у детей основной группы после лечения Тенотеном достоверно снизились (p < 0,05). Показатели гиперактивности и невнимательности снизились до нормальных значений, абсолютные показатели импульсивности также значительно уменьшились в наблюдаемой группе.
По данным психометрического исследования у пациентов с СВД основной группы были выявлены достоверные положительные изменения при проведении тестов на память и внимание в сравнении с контрольной группой. Данные тестирования выявили отчетливое улучшение показателей механической и динамической памяти у 30% детей (p < 0,05), а также опосредованной памяти в тестах с пиктограммой — повышение показателя адекватности до 75% (p < 0,05).
Динамическая оценка результатов цветового теста Люшера выявила относительную стабилизацию психоэмоционального состояния у детей основной группы, что отразилось на предпочитаемой цветовой гамме и приближении ее к аутогенной норме (по коэффициенту суммарного отклонения от аутогенной нормы — p < 0,05). У детей контрольной группы определяемые показатели не имели статистически значимых изменений.
По окончании исследования родители оценили результаты лечения при помощи десятибалльной аналого-визуальной шкалы. В среднем успешность лечения в основной группе была оценена на 7–8 баллов, в контрольной — на 4–5 баллов.
Выводы
Проведенное исследование показало, что у детей, перенесших инфекционные заболевания, имеются в различной степени выраженные симптомы астеновегетативного синдрома (СВД) в виде психоэмоциональных (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна) и соматоневрологических (головные боли, головокружение, снижение аппетита, диспепсия) нарушений.
Астеновегетативные нарушения отрицательно влияют на процесс реконвалесценции у детей после перенесенных тяжелых инфекционных заболеваний, удлиняя этот период и ухудшая качество жизни пациентов.
Применение препарата Тенотен детский после перенесенных инфекционных заболеваний в дозе 1 таблетка 3 раза в день приводит к нормализации показателей вегетативного тонуса и обеспечения, уменьшает частоту соматоневрологических проявлений вегетативной дисфункции, что способствует более быстрому завершению периода восстановления.
Тенотен детский устраняет проявления астении, стабилизирует психоэмоциональное состояние детей: улучшает настроение, успокаивает, способствует снижению раздражительности и капризности, облегчает процессы обучения (запоминание, концентрацию внимания, усидчивость).
Препарат Тенотен детский безопасен у пациентов старшего дошкольного и младшего школьного возраста. Побочных эффектов во время применения препарата не было отмечено.
Доказанное успокаивающее, выраженное вегетотропное и антиастеническое действие препарата Тенотен детский позволяет рекомендовать его для применения у детей с различными проявлениями вегетососудистой дисфункции после перенесенных инфекционных заболеваний.
По вопросам литературы обращайтесь в редакцию.
Е. В. Михайлова, доктор медицинских наук, профессор
Т. Ильичева
Cаратовская областная детская инфекционная клиническая больница,
Саратовский государственный медицинский университет, Саратов
При острых респираторно-вирусных инфекциях (ОРВИ) зачастую на смену катаральным явлениям приходит астеническое состояние, которое характеризуется слабостью, адинамией, полным безразличием к окружающей обстановке и близким людям. Астеническим синдром может являться вследствие разных заболеваний, в том числе возникать и после перенесенных респираторных инфекций. Значимость астении после перенесенных ОРВИ для клинической практики подтверждается тем, что в Международной классификации болезней 10-го пересмотра отдельно выделен синдром G93.3 – синдром усталости после перенесенной вирусной инфекции. Обращаемость по поводу астенического симптома высока и достигает 64%. Наличие астенических расстройств у детей способствует ухудшению качества жизни, сложностям адаптации в дошкольных и школьных учреждениях, нарушению обучения, снижению коммуникативной активности, проблемам в межличностных взаимодействиях и напряженности во внутрисемейных отношениях.
Когда мы говорим об астении после перенесенного ОРВИ, речь идет о реактивной астении, которая возникает у исходно здоровых лиц в результате напряжения адаптации в условиях стресса, а также в периоде реконвалесценции. Наиболее подвержены астеническим реакциям дети со сниженными адаптивными возможностями организма. Причины астенического синдрома очень многообразны. Наряду с астенией, обусловленной физиологическими и психоэмоциональными причинами, выделяют астению, связанную с реконвалесценцией после инфекционных заболеваний, травм и операций.
- этиопатогенетическая терапия;
- неспецифическая общеукрепляющая, иммунокоррегирующая терапия;
- симптоматическая терапия.
Важным компонентом лечения астении являются соблюдение режима дня, пребывание на свежем воздухе, физические упражнения, рациональное питание.
Учитывая ведущую роль нарушения функции ретикулярной формации в развитии астении, большой интерес вызывает нейроспецифический белок S100, выделенный из нервной ткани. Этот белок синтезируется и локализуется исключительно в клетках ЦНС и чрезвычайно важен для их нормального функционирования, поскольку осуществляет нейротрофические функции, регулирует гомеостаз кальция в клетках ЦНС и участвует в регуляции синаптической передачи. Экспериментально установлено, что релиз-активные формы антител к белку S100 обладают достаточно широким спектром психотропной, нейротропной и вегетомодулирующей активности.
Благодаря тому, что препарат Тенотен содержит антитела к белку S100 в релиз-активной форме, он модифицируют его функциональную активность самого белка S 100.
Изучение динамики астеновегетативных проявлений после инфекционных заболеваний у детей на фоне Тенотена (Е.В.Михайлов, Саратовский государственный медицинский университет) показало, что препарат устраняет проявления астении, улучшает вегетативный гомеостаз, снижает проявления тревожности у детей, улучшает настроение, облегчает процессы обучения и стабилизирует общее состояние (рис. 1).

Рис. 1
Динамика астеновегетативных проявлений после инфекционных заболеваний на фоне препарата Тенотен детский (Е.В.Михайлов, Саратовский ГМУ)

Рис. 2
Динамика cимптомов у детей на фоне приема препарата Тенотен детский (М.Ю.Галактионова, Красноярский ГМУ)
По окончании курса лечения у большинства обследованных больных обеих групп отмечались уменьшение числа и интенсивности жалоб астеноневротического характера, снижение выраженности болевого синдрома (головных болей, кардиалгий, болей в животе). При этом у 80% больных основной группы положительная динамика наблюдалась уже к концу 2-й недели от начала лечения (на 10–14-й день). Улучшение психоэмоционального фона, исчезновение тревожности, значительное повышение работоспособности, концентрации внимания и нормализация сна отмечали к 14–17-му дню у 73,3% пациентов основной группы, что указывало на ноотропный эффект действия Тенотена. В то же время динамика изложенных клинических симптомов у больных группы сравнения отмечалась лишь в 43,3% случаев на момент выписки из стационара.
В исследовании А.П.Рачина на фоне приема препарата Тенотен наблюдалось улучшение концентрации и продуктивности внимания по сравнению с контрольной группой.
В качестве антиоксидантных средств при астеническом синдроме возможно курсовое применение Коэнзима Q10 – витаминоподобного вещества, которое непосредственно участвует в синтезе аденозинтрифосфата, антиоксидантной защите и способствует восстановлению других антиоксидантов (витамин Е). Важно помнить, что существенным нейрометаболическим воздействием обладают омега-3-полиненасыщенные жирные кислоты, основным пищевым источником которых служат рыба и некоторые продукты растительного происхождения.
Д.м.н., проф. Г.М. ДЮКОВА
Первый МГМУ им. И.М. Сеченова, кафедра нервных болезней
Астенический синдром является одним из наиболее часто встречающихся нарушений в практике врача. Однако на сегодняшний день не существует общепринятых определений и классификаций, а также концепций патогенеза этого синдрома. В статье описаны главные симптомы, клинические формы, этиологические факторы и принципы лечения астенического синдрома. Важное значение в терапии имеет применение нейрометаболических препаратов, таких как Пантогам и Пантогам актив.
В клинической практике наиболее часто встречаются следующие варианты астении:
1) астения как один из симптомов самых различных заболеваний: соматических, инфекционных, эндокринных, психических и т.д.;
2) астенический синдром в виде временного и преходящего состояния, обусловленного влиянием различных факторов, среди которых могут быть физические и психические перегрузки, инфекционные заболевания, оперативные вмешательства, прием некоторых лекарственных препаратов и пр. В подобных случаях речь идет о реактивной и/ или вторичной астении. Обычно устранение причины, вызвавшей астению, приводит к купированию астенических проявлений;
3) хроническая патологическая утомляемость, или синдром хронической усталости, как отдельное клиническое проявление. В структуре этого синдрома ведущими симптомами болезни являются постоянное ощущение слабости и патологическая утомляемость, которые приводят к физической и социальной дезадаптации и не могут быть объяснены другими причинами (инфекционными, соматическими и психическими заболеваниями).
Астения является полиморфным синдромом. Помимо слабости и утомляемости, как правило, отмечаются и другие расстройства, так называемые симптоматические, коморбидные или физические. Их спектр достаточно широк и включает:
В критериях синдрома хронической усталости, предложенных Центром по контролю и профилактике заболеваний США (CDC), определяющими симптомами являются слабость и утомление, не проходящие после отдыха и длящиеся более 6 месяцев, снижение работоспособности (более чем на 50%) в сочетании с когнитивными и психо-вегетативными расстройствами. В то же время в критерии включены и такие симптомы, как субфебрильная температура; частые боли в горле; увеличенные и болезненные шейные, затылочные и/или подмышечные лимфоузлы, миалгии, артралгии, то есть авторы акцентируют внимание на признаках, свидетельствующих о возможном инфекционном процессе или иммунной недостаточности.
Помимо психосоциальной концепции астении обсуждаются и инфекционно-иммунные (поствирусный синдром утомляемости, синдром хронической усталости и иммунной дисфункции). В результате многочисленных и детальных исследований, проведенных за полвека, были установлены различные иммунологические нарушения при астении, преимущественно в виде снижения функциональной активности естественных и натуральных киллерных клеток. При этом было отмечено, что ни один из известных вирусов напрямую не связан с возникновением АС, а характерный иммунологический профиль АС пока не составлен [1, 6].
Принципы лечения астении
Основными задачами терапии астенического синдрома являются:
Терапия астении в значительной степени зависит от этиологических факторов и основных клинических проявлений. Прежде всего, необходимо определить, носит ли астения вторичный характер. В этих случаях тактика врача должна быть направлена на лечение основного заболевания или купирование токсическо-метаболических расстройств, которые обусловливают развитие астении. При реактивном характере астении основное внимание необходимо уделить коррекции факторов, приведших к срыву. Целесообразно объяснить пациенту механизмы возникновения его симптомов. В этих случаях, прежде всего, следует рекомендовать больному сменить деятельность, нормализовать режим труда и отдыха, сна и бодрствования. Хороший эффект наблюдается у пациентов, участвующих в специальных группах социальной поддержки, систематических образовательных программах, психологических тренингах с применением различных методов: от релаксационной до рациональной и когнитивно-поведенческой психотерапии. В терапии первичной астении (неврастении или синдрома хронической усталости) приоритетным является многомерный подход к лечению, который включает физические тренинги, психотерапевтические методы и применение различных фармакологических препаратов [11].
I. Немедикаментозные методы терапии
Большинство современных исследователей считают, что приоритетным методом лечения астении является физическая нагрузка. Хотя ключевым симптомом астении считается непереносимость нагрузок [12], тем не менее эмпирические данные и анализ рандомизированных контролируемых исследований показывают, что 12-недельная терапия дозированной физической нагрузкой, особенно в сочетании с образовательными программами для пациентов, приводит к достоверному уменьшению чувства утомляемости и усталости. Строго контролируемые исследования показывают, что после проведения 1316 сессий физическое функционирование улучшается у 70% пациентов с СХУ по сравнению с 20-27% больных, получающих медикаментозную терапию. Полезным может быть сочетание программы ступенчатой физической нагрузки с когнитивно-поведенческой терапией [13]. Хороший эффект дает гидротерапия (плавание, контрастные души, душ Шарко). Эффективны лечебная гимнастика и массаж, физиотерапия, иглорефлексотерапия, комплексное лечение термо-, одоро-, свето- и музыкальным воздействием, проводимым в специальной капсуле. В случае коморбидных депрессивных расстройств хороший эффект дает фототерапия.
Психотерапевтические подходы в лечении астении условно можно разделить на 3 группы:
1) симптоматическая психотерапия;
2) терапия, направленная на патогенетические механизмы;
3) личностно-ориентированная (реконструктивная) психотерапия.
Симптоматическая психотерапия включает методики, целью которых является воздействие на отдельные невротические симптомы и общее состояние пациента. Это могут быть аутотренинг (в индивидуальном или групповом режиме), гипноз, внушение и самовнушение. Подобные методики позволяют снять тревожное напряжение, улучшить эмоциональный настрой, усилить мотивацию больного к выздоровлению.
Ко второй группе можно отнести когнитивно-поведенческую психотерапию, условно-рефлекторные техники, телесно-ориентированные методы, нейро-лингвистическое программирование. Основная цель когнитивно-поведенческой терапии - помочь больному изменить патологическую перцепцию и интерпретацию болезненных ощущений, поскольку эти факторы играют значительную роль в поддержании симптомов астении [14]. Когнитивная поведенческая терапия также может быть полезна для обучения больного более эффективным копинг-стратегиям, что, в свою очередь, может привести к повышению адаптивных возможностей.
Третью группу составляют методы, воздействующие непосредственно на этиологический фактор. Суть этих методик - личностно-ориентированная психотерапия с реконструкцией базовых мотиваций личности. Их целью является осознание больным взаимосвязи феномена астении с нарушением в системах отношений личности и искаженными паттернами поведения. Данные методики направлены на выявление ранних детских конфликтов или разрешение актуальных проблем личности; основной их целью является реконструкция личности. К этой группе методов можно отнести психодинамическую терапию, гештальт-терапию, семейную психотерапию.
II. Фармакотерапия
Если в отношении эффективности физической нагрузки и психотерапии в лечении астении мнения клиницистов единодушны, то вопрос о целесообразности фармакотерапии и выборе лекарственных средств по-прежнему вызывает множество дискуссий. Именно этим обусловлено большое количество препаратов, используемых в лечении АС. Так, анкетирование 277 врачей показало, что для лечения астении используется более 40 различных средств. Этот список включает самые различные группы препаратов: психотропные (преимущественно антидепрессанты), психостимуляторы, иммуностимулирующие и противоинфекционные, общеукрепляющие и витаминные препараты, пищевые добавки и т.д. В этом контексте ключевыми препаратами являются антидепрессанты (АД). Анализ публикаций, посвященных применению препаратов этого класса при СХУ, показывает противоречивость и неоднозначность результатов лечения. Однако связь астении с депрессией, хронической тревогой, фибромиалгией, при которых эффективность антидепрессантов доказана, обосновывает целесообразность применения этих препаратов при астенических расстройствах [15]. Механизм их действия направлен на увеличение метаболизма моноаминов (серотонина и норадреналина) в головном мозге. Используют следующие группы антидепрессантов:
1) производные лекарственных трав (например, зверобоя);
2) обратимые ингибиторы МАО;
3) трициклические АД;
4) четырехциклические и атипичные АД;
5) селективные ингибиторы обратного захвата серотонина (СИ-ОЗС);
6) селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН).
При назначении антидепрессантов больным с АС целесообразно ориентироваться на выраженность астении и наличие коморбидных расстройств (депрессии, тревоги, болевого синдрома). Степень выраженности астено-депрессивных расстройств определяет выбор АД. При не резко выраженных расстройствах целесообразно назначить более мягкие АД (Гелариум, Азафен, тразодон), в случае выраженной астении и выявляемой депрессии - АД с более сильным действием: трициклические антидепрессанты (имипрамин, кломипрамин, амитриптилин), препараты СИОЗС и СИОЗСН.
При астении с преобладанием сниженного настроения, вялости, элементами апатии целесообразно назначать антидепрессанты активизирующего и стимулирующего действия, в частности имипрамин, кломипрамин, флуоксетин. В тех случаях, когда астения сочетается с симптомами тревоги, панических расстройств, целесообразен выбор АД с анксиолитическими свойствами (амитриптилин, леривон, миртазапин, пароксетин, флувоксамин). Сочетание астении с фибромиалгией определяет выбор антидепрессантов из группы СИОЗСН (дулоксетин, венлафаксин).
Результаты исследований Пантогама и Пантогама актив показали, что оба препарата оказывают достоверно более выраженный антиастенический, активизирующий, вегетотропный эффект по сравнению с плацебо.
Необходимо отметить, что выраженные побочные эффекты, характерные для некоторых АД, в частности трициклических АД (имипрамина, амитриптилина), существенно сужают возможности их применения, особенно в амбулаторной практике. Сегодня чаще используются препараты СИОЗС, тианептин или обратимые ингибиторы МАО. Показано, что среди препаратов СИОЗС активирующим действием обладает флуоксетин, седативный эффект отмечен у пароксетина и флувоксамина. Наиболее сбалансированным действием обладают сертралин и циталопрам.
Нередко требуется сочетанное назначение АД с транквилизаторами, особенно если астения сопровождается симптомами внутренней напряженности, тревоги, панических расстройств, при выраженных нарушениях сна. Спектр седативных и противотревожных препаратов действия включает:
1) мягкие седативные средства, преимущественно растительного происхождения (экстракт валерианы, Новопассит, Персен);
2) транквилизаторы небензодиазепинового и бензодиазепинового ряда, (Грандаксин, Фенибут, Атаракс, диазепам, мезепам, клоназепам, лоразепам, альпразолам).
При сочетании астении с очевидными истерическими, фобическими или сенсопатически-ипохондрическими проявлениями в качестве базовой фармакотерапии используют антидепрессанты, при этом дополнительно в схему лечения включают небольшие дозы нейролептиков (Меллерил, Терален, Эглонил, Сероквель).
Поскольку большинство пациентов с астенией плохо переносят медикаменты, особенно воздействующие на ЦНС, лечение психоторопными препаратами следует начинать с низких доз и постепенно повышать дозу в процессе лечения. При всех типах астении, независимо от этиологии, существенное место в лечении занимает неспецифическая медикаментозная терапия [16]. Она включает применение препаратов, оказывающих антистрессовый и адаптогенный эффект, улучшающих энергетические процессы, обладающих антиоксидантными свойствами. При иммунной недостаточности целесообразно включение в схему лечения веществ, повышающих резистентность организма и стимулирующих иммунные механизмы защиты. К группе неспецифических средств следует также отнести ряд препаратов, улучшающих и стимулирующих общий обмен веществ и метаболизм мозга. Абсолютно оправданным является назначение витаминов и макро- и микроминералов. При астении назначаются большие дозы витамина С, комплексы витаминов группы В (В1, В6, В12 ). Антиоксидантный эффект отмечен при приеме витаминов А и Е. При лечении астении большое значение имеет прием препаратов кальция и магния. Сочетание этих минералов в препарате Берокка Са+Mg оказалось эффективным в лечении различных форм астенического синдрома.
В случае астенического синдрома положительный эффект отмечается при применении препаратов, улучшающих мозговой метаболизм, -это группа ноотропов: пирацетам, пиритинол, аминомасляная кислота (Аминалон, Гаммалон), Глиатилин, Инстенон, ципрогептадин (Перитол), Пикамилон, Фенибут, Пантогам, Семакс, Когитум, Церебролизин, препараты липоевой кислоты (Тиоктацид, Эспалипон), Глицин, Кортексин, препараты гинкго билоба.
Следует особо отметить препарат Пантогам, который создавался еще в середине прошлого века в России и Японии. Действующим веществом является гопантеновая кислота, которая представляет собой соединение кальциевой соли пантотеновой кислоты (витамина В5) и гамма-аминомасляной кислоты (ГАМК). Являясь агонистом ГАМК-В-рецептора, препарат участвует в модулировании высвобождения нейромедиаторов, что обусловливает его уникальные терапевтические свойства. Пантогам актив -модификация препарата Пантогам (D-гопантеновой кислоты) -занимает особое место среди нейрометаболических препаратов. Его активное начало - это рацемат D- и S-изомеров гопантеновой кислоты. За счет присутствия S(L)-изомера улучшается взаимодействие препарата с рецептором и повышается его эффективность. В экспериментальных и клинических исследованиях было показано, что Пантогам актив относится к группе нейропротекторов с ноотропным действием, влияющим на систему ГАМК и дофамина [17]. Его фармакологические эффекты включают улучшение памяти, повышение умственной и физической работоспособности, уменьшение двигательного беспокойства и агрессивности, умеренное седативное действие с мягким стимулирующим эффектом, анальгетический эффект, стимуляцию процессов тканевого метаболизма в нейронах и повышение устойчивости мозга к гипоксии и воздействию токсических веществ, а также легкий противотревожный и антидепрессивный эффекты, отличающие его от других нейрометаболических препаратов.
ЛИТЕРАТУРА
В статье освещены современные аспекты диагностики и лечения постинфекционных астенических состояний у детей и подростков с применением нового высокоэффективного ноотропного препарата комплексного действия – деанола ацеглумата (Нооклерин). Показано, что использование Нооклерина в комплексной терапии способствует уменьшению выраженности симптомов астении с улучшением сна, когнитивного статуса, редукцией головных болей, отчетливой положительной динамикой показателей качества жизни и повседневной активности пациентов.
Ключевые слова: астения, лечение, дети, инфекция, грипп, деанола ацеглумат, Нооклерин.
Одной из наиболее распространенных жалоб при обращении пациентов к врачу является повышенная утомляемость. Частой причиной этого симптома могут быть астенические расстройства, которыми, по данным различных исследователей, страдают до 15–45% людей [1–3]. Астения характеризуется патологической усталостью после нормальной активности, сопровождается недостатком энергии, необходимой для обеспечения нормальной жизнедеятельности и внимания, а также резким снижением работоспособности. Признаки астении отмечаются у 1,3% подростков, причем у девочек данная патология встречается достоверно чаще [3, 4].
В происхождении астении большинство исследователей указывает на значимость как цереброгенных, так и соматогенных факторов, при этом подчеркивается, что соматогенные факторы могут снижать порог чувствительности к психогении [5–8].
Классификация астенических состояний предполагает выделение следующих форм:
1. Органическая форма встречается у 45% пациентов и связана с хроническими соматическими заболеваниями или прогрессирующими патологиями (неврологическими, эндокринными, гематологическими, неопластическими, инфекционными, гепатологическими, аутоиммунными и др.);
2. Функциональная форма возникает у 55% больных и считается обратимым, временным состоянием. Такое расстройство также называют реактивным, так как оно является реакцией организма на стресс, переутомление или перенесенное острое заболевание (в т.ч. ОРВИ, грипп и др.) [1].
По типу различают гиперстеническую астению, для которой характерна сверхвозбудимость сенсорного восприятия, и гипостеническую астению, для которой характерно снижение порога возбудимости и восприимчивости к внешним стимулам с вялостью и дневной сонливостью [1].
В МКБ-10 астенические состояния представлены в нескольких разделах: астения БДУ (R53), состояние истощения жизненных сил (Z73.0), недомогание и утомляемость (R53), психастения (F48.8), неврастения (F48.0), а также слабость: врожденная (P96.9), старческая (R54), истощение и усталость (вследствие) (при): нервной демобилизации (F43.0), чрезмерного напряжения (T73.3), опасности (T73.2), теплового воздействия (T67.), беременности (O26.8), старческой астении (R54), синдром усталости (F48.0), синдром утомляемости после перенесенной вирусной болезни (G93.3).
Постинфекционный астенический синдром:
- возникает в результате перенесенного заболевания инфекционного характера (ОРВИ, гриппа, ангины, гепатита и др.), встречается у 30% пациентов, которые обращаются с жалобами на физическую утомляемость;
- первые симптомы появляются через 1–2 недели после инфекционной болезни и сохраняются в течение 1–2 месяцев, при этом, если первопричина имела вирусное происхождение, то возможны периоды колебания температуры тела;
- преобладают ощущения общего утомления, усталости, усиливающиеся при физических нагрузках, слабости, раздражительности, нарушения сна, беспокойство, напряжение, трудности с концентрацией внимания, эмоциональная неустойчивость, обидчивость, плаксивость, вспыльчивость, капризность, впечатлительность, снижение аппетита, потливость, ощущение перебоев в сердце, нехватки воздуха, снижение порога переносимости различных раздражителей: громких звуков, яркого света, вестибулярных нагрузок [8–13].
Выделяются два основных типа постгриппозной астении:
- гиперстенического характера: этот вид астении бывает на ранних этапах при легких формах течения гриппа, и главными симптомами становятся внутреннее ощущение дискомфорта, повышенная раздражительность, неуверенность в себе, снижается работоспособность, появляются суетливость и несобранность;
- гипостенического характера: эта разновидность астении характерна для тяжелых форм гриппа, при этом прежде всего снижается активность, появляются сонливость и мышечная слабость, возможны кратковременные вспышки раздражительности, пациент не чувствует в себе силы для активной деятельности [8, 11].
- повышенная истощаемость психических и физических функций, при этом ведущими симптомами будут повышенная утомляемость, усталость и слабость, при этом нет возможности полноценно отдохнуть, что приводит к неспособности к длительному умственному и физическому напряжению.
- эмоциональная неустойчивость, которая чаще всего выражается в частой смене настроения, нетерпеливости, неусидчивости, чувстве тревоги, раздражительности, беспокойстве, внутреннем напряжении, неспособности расслабиться;
- вегетативные или функциональные нарушения в виде частых головных болей, потливости, ухудшения аппетита, ощущения перебоев в сердце, одышки;
- когнитивные нарушения в виде снижения памяти и внимания;
- повышенная чувствительность к внешним раздражителям, например скрипу двери, шуму телевизора или стиральной машины;
- нарушение сна (появляются дневная сонливость, трудности засыпания ночью, после ночного отдыха пропадает чувство бодрости).
Исследование психоэмоциональных расстройств у больных Эпштейна–Барра вирусным инфекционным мононуклеозом и паротитной инфекцией с серозным менингитом показало, что нарушения представлены в виде трех основных синдромов: астенического, астено-ипохондрического и астено-депрессивного, при этом разнообразие и частота встречаемости психоэмоциональных нарушений зависят от длительности и выраженности синдрома поствирусной астении и состояния вегетативной регуляции [20].
Результаты исследований, посвященных изучению катамнеза у больных с поражениями нервной системы после гриппа и энтеровирусной инфекции, выявили функциональные нарушения в виде астении, вялости, снижения аппетита, рассеянности, вегетативной лабильности (в форме сердечно-сосудистой дисфункции и изменения электрокардиограммы) и эмоциональной неуравновешенности, при этом частота возникновения указанных синдромов стояла в прямой зависимости от тяжести течения заболевания в острый период и преморбидных особенностей организма [20, 22, 24]. Преморбидному состоянию ребенка в развитии постгриппозных остаточных явлений со стороны нервной системы придается очень существенное значение [13, 14]. Установлена важная роль преморбидного состояния в особенностях острого периода заболевания, исхода болезни и в формировании резидуальных явлений [20]. Усугубляют неблагоприятное течение постгриппозного репарационного периода ранняя церебральная недостаточность в анамнезе (судороги, рахитическая гидроцефалия, повышенная возбудимость, черепные травмы в анамнезе), а также наследственная отягощенность. С целью изучения функционального состояния ЦНС у больных с постгриппозными осложнениями некоторыми авторами проводились электроэнцефалографические исследования, и полученные при этом результаты чаще всего указывали на явления торможения в ЦНС у пациентов с постинфекционной астенией [11, 20].
Наиболее крупное катамнестическое исследование состояния здоровья и особенностей развития 200 детей, переболевших гриппом и аденовирусной инфекцией, на протяжении 1–7 лет после выписки из стационара [9] показало, что в дальнейшем нормально развивались 63% пациентов, а у 37% обнаружены нарушения функционального характера в виде астении, эмоциональной и вегетативной лабильности, легких неврологических синдромов (высокие сухожильные рефлексы, клонус стоп и др.), при этом частота и выраженность патологических изменений зависели от тяжести поражения нервной системы в острую фазу болезни, а также от преморбидной отягощенности. Характер нервно-психических нарушений в катамнезе был различен, наиболее часто отмечалась церебральная астения (у 49 детей из 74 с остаточными явлениями), которая проявлялась разнообразными симптомами (резкая истощаемость, вялость, легкая утомляемость, неспособность к длительному сосредоточенному напряжению, беспричинные капризы, рассеянность, изменение поведения).
У школьников наблюдались снижение успеваемости, медлительность в приготовлении уроков, плохое запоминание прочитанного. У детей в возрасте до 3–5 лет имелись определенные особенности в проявлениях этого синдрома (повышенная раздражительность, возбудимость, излишняя подвижность, частые капризы). Вторым по частоте синдромом были эмоциональные нарушения, которые заключались в быстрой смене настроения, обидчивости, излишней впечатлительности, приступах агрессивности, злости, сменявшихся угнетенностью и плаксивостью. На третьем месте оказались выраженные вегетативные нарушения (лабильность пульса, колебания артериального давления, бледность, гипергидроз, холодные конечности, длительный субфебрилитет при отсутствии каких-либо воспалительных процессов), а также плохой аппетит, склонность к рвоте при насильственном кормлении [9]. Все эти симптомы косвенно указывали на поражение диэнцефальной области, при этом длительность указанных нарушений составляла 1–3 месяца, реже до 4–6 месяцев. Частота остаточных явлений была значительно ниже в той группе детей, у которых дома соблюдался правильный режим и выполнялись все указания, данные родителям перед выпиской. При церебральной астении важное значение придавалось созданию необходимого режима: удлинение ночного и дневного сна, длительное пребывание на воздухе, уменьшение школьной нагрузки (дополнительный свободный день в неделю), временное освобождение от усиленных занятий физкультурой с рекомендацией ежедневной утренней гимнастики, назначение витаминов, особенно группы В, препаратов, содержащих фосфор, усиленное, полноценное питание. При выраженной эмоциональной лабильности и вегетативной неуравновешенности, помимо общеукрепляющего лечения, применялись препараты валерианы, брома. Всех детей, перенесших грипп и другие респираторные вирусные инфекции с неврологическими расстройствами, на 6 месяцев освобождали от профилактических прививок. Также поставлен вопрос о целесообразности создания санаториев, специальных лесных школ и дошкольных учреждений для детей, перенесших респираторно-вирусные и другие заболевания с поражением ЦНС [8].
Таким образом, лечение астении предполагает полноценный восстановительный период после перенесенной инфекции, при этом обязательным являются укрепление иммунной системы, полноценное питание, здоровый сон и отдых, рациональная фармакотерапия [8, 24, 25].
Использование психостимуляторов для лечения больных с постинфекционной астенией нежелательно. Достижение психостимулирующего эффекта для подобных пациентов возможно препаратами нейрометаболического ряда, ноотропами, которые в настоящее время выделяют в группу антиастенических средств (нооклерин, беметил, пантогам, клережил, клерегил), а также использованием адаптогенов и витаминных комплексов.
Препарат прошел широкое и многоплановое изучение в крупных медицинских центрах России (8 клиник на 800 больных), и полученные при этом результаты свидетельствовали о значительном положительном влиянии Нооклерина на астенические (прежде всего, вялость, слабость, истощаемость, рассеянность, забывчивость) и адинамические расстройства [29–31]. Показано, что наиболее выраженную терапевтическую эффективность Нооклерин оказывает при астении (100%), астенодепрессивных состояниях (75%) и при адинамических депрессивных расстройствах (88%), повышая активность поведения в целом и улучшая общий тонус и настроение [29]. Деанола ацеглумат включен в стандарты специализированной медицинской помощи РФ и может применяться при органических, включая симптоматические, психических расстройствах, депрессивных и тревожных расстройствах. Результаты многочисленных исследований свидетельствуют, что Нооклерин является эффективным и безопасным препаратом для лечения астенических и астенодепрессивных состояний, а также когнитивных и поведенческих расстройств различного генеза у детей.
При оценке качества жизни у этих пациентов проведенное исследование выявило снижение уровня качества жизни через 2 месяца после перенесенного серозного менингита у детей, получавших только базовую терапию в остром периоде заболевания, в то время как у детей, получавших вместе с базовой терапией серозного менингита в течение 2 месяцев Нооклерин, качество жизни оставалось на первоначальном уровне. Данные, полученные при ЭЭГ-обследовании в остром периоде заболевания и в катамнезе через 2 месяца после выписки из стационара, полностью коррелировали с клиническими наблюдениями и данными, полученными при анкетировании больных. Авторами сделано предположение, что Нооклерин как препарат, по своей химической структуре близкий к естественным веществам, оптимизирующим деятельность мозга (гамма-аминомасляная и глутаминовая кислоты), при применении у детей, больных серозными менингитами, облегчая процесс передачи нервного импульса, улучшая фиксацию, консолидацию и воспроизведение памятных следов, стимулируя процессы тканевого обмена, способствует оптимизации нейрометаболических процессов, что предупреждает формирование органического дефицита. В целом, полученные в исследовании результаты показали высокую терапевтическую эффективность Нооклерина, а также подтвердили его психостимулирующее, нейрометаболическое и церебропротективное действие, наряду с хорошей переносимостью, что позволило рекомендовать его к включению в стандарт оказания помощи детям, переносящим серозный менингит, для профилактики и лечения постинфекционной астении с целью улучшения исходов заболевания [37].
Таким образом, проведенные исследования свидетельствуют, что Нооклерин является высокоэффективным и безопасным средством для лечения широкого круга состояний, сопровождающихся явлениями астении. К этим состояниям относятся повышенная хроническая утомляемость, слабость, хронические органические неврологические, психические, соматические и инфекционные заболевания. Препарат Нооклерин вызывает достаточно быстрое уменьшение астенических нарушений у большинства пациентов, при этом достоинством препарата является отсутствие у него отрицательных свойств и осложнений, характерных для других психостимуляторов. Все перечисленное позволяет рекомендовать Нооклерин в качестве эффективного и безопасного средства в терапии астенических состояний у детей и подростков, в т.ч. постинфекционной астении.
В комплексной фармакотерапии астении после гриппа и ОРВИ также широко используются поливитамины и растительные общеукрепляющие препараты – экстракт элеутерококка (Extractum Eleutherococci), настойка лимонника (Tinctura fructuum Schizandrae) или женьшеня (Tinctura Ginseng). Если усталость сочетается с повышенной раздражительностью, рекомендованы седативные препараты растительного или комбинированного состава, – персен, нерво-флукс, ново-пассит, настойка валерианы, пустырника, экстракт пассифлоры, а также средства, содержащие магний (Магне В6).
Конфликт интересов: исследование никем не спонсировалось, конфликта интересов нет.
Контактная информация:
Литература
Читайте также:

