Повышенный пульс при гепатите
Обновлено: 11.05.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Боль или тяжесть в правом подреберье: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
В правом подреберье находятся печень, желчный пузырь, печеночный угол ободочной кишки, также в эту область могут проецироваться раздутые петли тонкой кишки. Перечисленные органы относятся к органам пищеварительной системы.
Печень представляет собой паренхиматозный (губчатый) орган с очень хорошим кровоснабжением. Снаружи печень покрыта капсулой, в которой располагаются нервные окончания. Печень участвует в обмене белков, жиров, углеводов, витаминов, играет важнейшую роль в дезинтоксикации организма.
Помимо этого клетки печени вырабатывают желчь, необходимую для переваривания пищи, в первую очередь жиров. Желчь поступает в желчный пузырь, находящийся на нижней поверхности печени, где происходит накопление желчи, которая выбрасывается из него в двенадцатиперстную кишку во время очередного приема пищи.
Сверху печень прилежит к диафрагме – своеобразной мышечной перегородке между брюшной и грудной полостями. Снизу, со стороны брюшной полости, диафрагма выстлана брюшиной (которая покрывает изнутри всю брюшную полость и органы, расположенные в ней), а сверху, со стороны легких, – плеврой, которая выстилает плевральную полость изнутри и покрывает легкие снаружи. И плевра, и брюшина имеют хорошую иннервацию, что важно знать для понимания причин возникновения боли и тяжести в правом подреберье. Также брюшиной покрыты и желчный пузырь, и петли кишок.
Разновидности боли или тяжести в правом подреберье
Болевой синдром может быть спонтанным, а может провоцироваться приемом пищи, алкоголя, физической нагрузкой, сменой положения тела и т.д.
Возможные причины боли или тяжести в правом подреберье
Механизм развития болевого синдрома один: возбуждение болевых рецепторов. Как было упомянуто выше, брюшина имеет хорошую иннервацию. Также большое количество нервных окончаний локализовано в стенке полых органов (кишечника, желчного пузыря). Поэтому воспалительные процессы в этих органах закономерно проявляются болью.
Боль возникает также при растяжении капсулы печени. Это может произойти из-за увеличения объема органа (что в большинстве случаев связано с отеком ткани), по причине накопления какой-либо жидкости (чаще всего крови) под капсулой (при травматическом разрыве печени), при повреждении капсулы.
Неприятные ощущения в области правого подреберья вызывает чрезмерное растяжение петель кишок кишечным содержимым или газами. Кроме того, поскольку органы грудной клетки расположены близко к области правого подреберья, в случае развития плеврита (воспаления плевры) болевой синдром может локализоваться также в области правого подреберья и имитировать заболевания органов брюшной полости.
Заболевания, при которых появляются боль или тяжесть в правом подреберье
Среди острых заболеваний, сопровождающихся болью в правом подреберье, стоит назвать в первую очередь те, которые требуют неотложного хирургического вмешательства.
К ним относится острый калькулезный холецистит и печеночная колика. И то, и другое состояние являются следствием желчнокаменной болезни. Воспаление желчного пузыря (холецистит) развивается на фоне уже запущенного процесса камнеобразования или, наоборот, является причиной образования камней. При печеночной колике происходит вклинение конкремента (камня) в узкие сегменты желчевыводящих путей, что сопровождается резкой болью, нарушением оттока желчи, в более тяжелых случаях – желтухой (пожелтением склер и кожи).
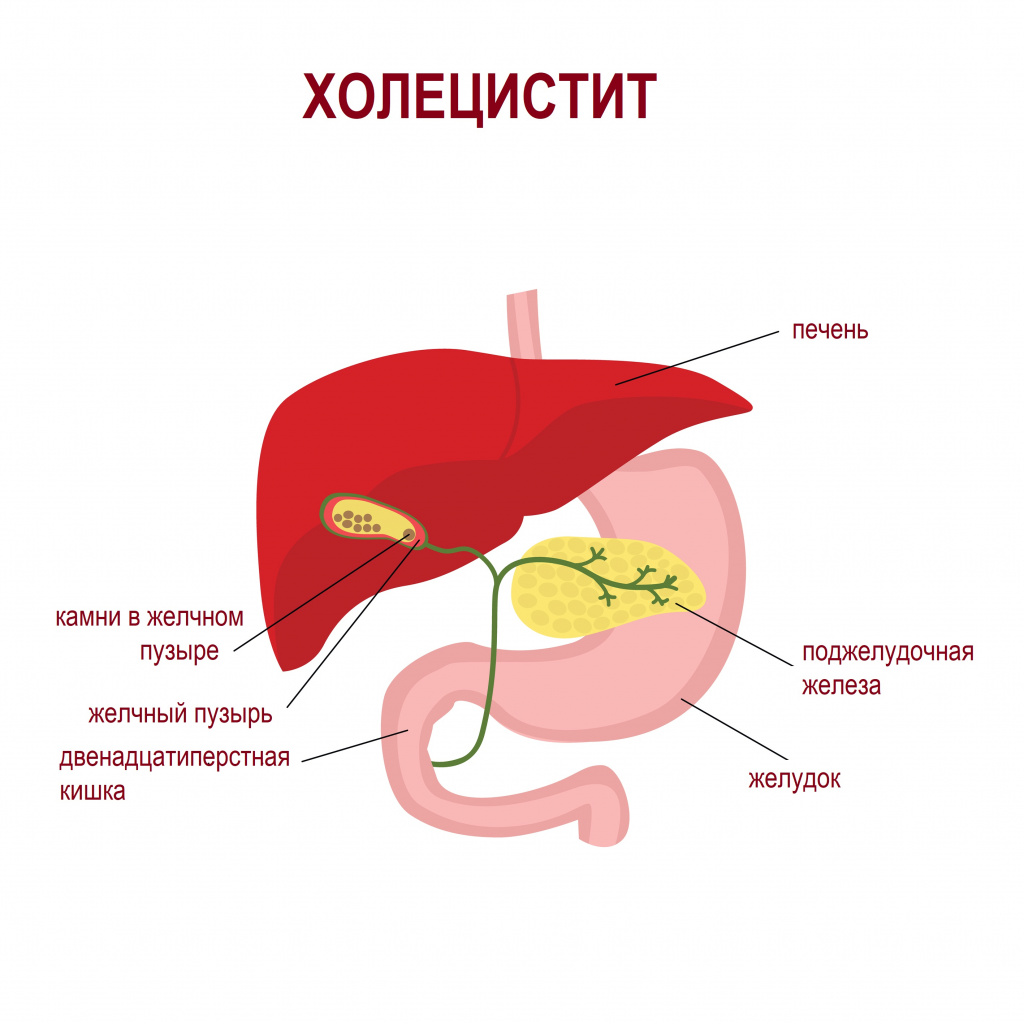
Другие заболевания желчных путей, например дискинезия желчных путей, хронический холецистит, вызывают рецидивирующую боль в правом подреберье, обычно это связано с погрешностью в диете.
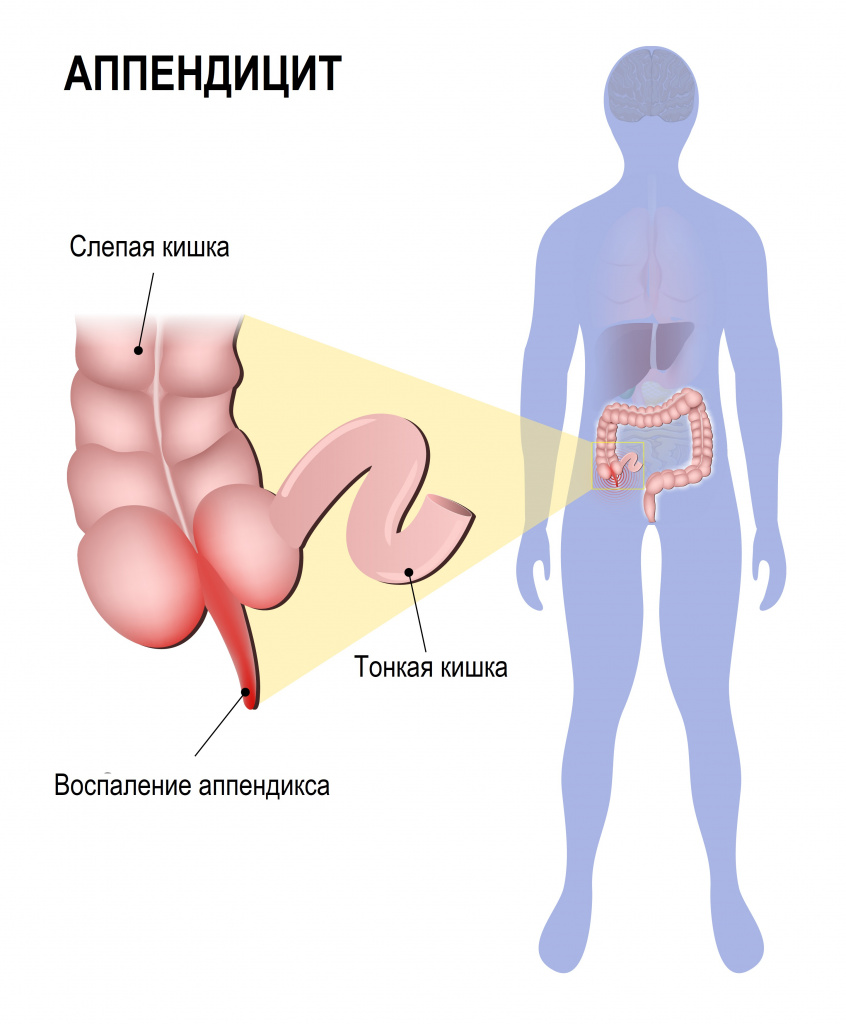
Несмотря на то, что классическое положение червеобразного отростка соответствует правой подвздошной области, достаточно часто встречается аномальное положение отростка в области правого подреберья, особенно у детей.
Перерастяжение петель кишок может развиваться в рамках кишечной непроходимости.
Отек ткани печени характерен для гепатитов (воспаления печеночной паренхимы). Гепатит может иметь самое различное происхождение: вирусный гепатит А, В, С и т.д., аутоиммунный, токсический, в т.ч. алкогольный. Эти заболевания, как правило, сопровождаются болевым синдромом, а также слабостью, тошнотой и рвотой, пожелтением кожи и склер, изменением цвета мочи и кала.
Подкапсульные гематомы печени (накопление крови между тканью печени и ее капсулой), равно как и разрывы печеночной капсулы, носят, как правило, травматический характер.
Среди заболеваний грудной клетки, которые могут вызвать боль в правом подреберье, стоит сказать о плевропневмонии (воспалении легочной ткани и плевры), сердечной недостаточности, межреберной невралгии и опоясывающем лишае. Последний характеризуется появлением кожных высыпаний по типу пузырьков, которым предшествует выраженный болевой синдром.
К каким врачам обращаться при появлении боли или тяжести в правом подреберье
При появлении внезапной, прогрессивно нарастающей боли в области правого подреберья нужно обратиться к хирургу для исключения острой хирургической патологии. Если боль не носит острый характер, обследование можно начать у терапевта или педиатра . При необходимости пациент может получить консультацию гастроэнтеролога , гепатолога (специалиста по болезням печени) и других узких специалистов.
Диагностика и обследования при боли или тяжести в правом подреберье
После подробного опроса и всестороннего клинического исследования врачу, как правило, необходимо лабораторно-инструментальное подтверждение поставленного диагноза. С этой целью применяются следующие исследования:
-
Клинический анализ крови с определением лейкоцитарной формулы, по результатам которого можно заподозрить наличие воспалительного процесса в организме и определить его остроту.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.

Актуальность. На сегодняшний день вирусные заболевания печени занимают одно из ведущих мест в патологии человека. Вирусные гепатиты с парентеральной передачей инфекции остаются серьезной проблемой во всем мире, в том числе в республике Узбекистан. Среди хронически протекающих вирусных гепатитов лидирующее положение в Центрально-Азиатском регионе занимает НВV инфекция, в связи с высоким уровнем заболеваемости, тяжестью осложнений, приводящих к значительной инвалидизации и летальности [1, 2].
По данным ВОЗ треть населения мира инфицирована различными видами гепатотропных вирусов. В настоящее время в мире насчитывается около 200 млн. носителей вируса гепатита С, более 2 млрд. человек в мире являются носителями HBV-инфекции [1, 8].
Установлено, что в патогенез вирусных заболеваний печени вовлекается не только печень, но и другие органы, что обуславливает неблагоприятное течение и исход заболевания, создает препятствия при лечении, и как правило снижает эффективность последнего [2, 3, 7].
В настоящее время доказана тесная взаимосвязь поражений печени и сердечно-сосудистых заболеваний. Связь этих изменений рассматриваются с двух точек зрения: во-первых, в печени наступают изменения, обусловленные изначально поражением миокарда и связанные с этим расстройствами гемодинамики, кислородным голоданием, а с другой стороны, патология печени может явится причиной для возникновения или ухудшения уже имеющихся сердечно-сосудистых нарушений. Механизм возникновения сердечных осложнений объясняется нарушением сосудистой регуляции, также нарушается циркуляция медиаторов регуляции кровообращения, замедляется скорость инактивации альдостерона.
Целью исследования:изучить частоту и характер поражения сердца при хронических вирусных патологиях печени.
Материал и методы. Исследования проведены у 42 больных хроническим гепатитом (ХГ) вирусной этиологии (HBV, HCV, HBV+HCV), 28 мужчин (66,6 %) и 14 женщин (33,3 %), в возрасте от 20 до 67 лет. Диагноз и клиническая форма ХГ устанавливались в соответствии с приказом МЗ РУз № 5 от 05.01.2012г. В соответствии с заболеванием больные были разделены на 2 группы: ХГ умеренной степени лабораторной активности (ХГ II ст. акт.) — 20 (47,6 %), ХГ высокой степени лабораторной активности (ХГ III ст. акт.) — 22 (52,3 %).
Наряду с этим изучалось влияние курсовой дозы ингибитора ангиотензин превращающего фермента периндоприла (престариум) на динамику функциональных изменений сердца у 21 больного. Периндоприл назначался по 2 мг 1 раз в сутки в течение 120 дней, сначала в стационаре, затем в амбулаторных условиях.
Результаты исследования и их обсуждение. Результаты проведенных исследований показали, что у больных ХГ отмечается четкая тенденция функциональных изменений в миокарде.
У больных ХГ в патологический процесс вовлекались как правые, так и левые отделы сердца. В группе с ХГ II ст. акт. (n=20) после проведения УЗДКГ после поступления в стационар было отмечено повышение КДР-5,24±0,08; КСР-3,41±0,07; КДО-136,0±1,9; КСО-56,58±2,3; УО-73,29±0,22; ТЗСЛЖд,-1,2±0,053; ТМЖПд.-1,31±0,45. Изменение этих эхокардиографических параметров было статистически достоверно выше, по сравнению с показателями в контрольной группе (Р≤0,05). Наряду с изменениями в ЛЖ в патологический процесс вовлекались правые отделы — ТСПЖ-5,87±0,3; а также некоторое снижение ИС-0,24±0,56, что отражает процесс изменения геометрии ПЖ по типу концентрического ремоделирования (при этом индекс миокардиального стресса оставался в пределах нормы). Данные результаты указывают на развитие концентрического ремоделирования сердца.
Анализ результатов больных с ХГ III ст. акт. (n=22) позволил отметить нарастание систолической и диастолической перегрузок ЛЖ и ПЖ. Для некоторых параметров изменения были незначительными по сравнению с предыдущей группой — КДР-6,03±0,09; КДО-136,01±1,9, ТЗСЛЖ-1,32±0,03, ОТСЛЖ — 0,56±0,05 (Р≥0,05). Для других параметров — КСР-4,28±0,04. КСО-59,02±1,32, ИС-0,41±0,2 и МС-11,4 изменения были статистически достоверно больше, чем у больных ХГ II ст. активности (Р≤0,05). Миокард больных ХГ III ст. активности имел тенденцию к развитию концентрической гипертрофии ЛЖ. Также как у больных умеренной степени лабораторной активности наблюдались изменения правых отделов сердца. Были утолщение стенки ПЖ, увеличение индекса относительной толщины стенки ПЖ, ИС и повышение МС выше нормы (Р≤0,05). Как отмечалось выше, ЭхоКГ проводилось у подавляющего числа больных дважды до и после лечения, а также на 120 день амбулаторного наблюдения и лечения.
Анализ результатов повторного исследования на 14 день на фоне комплексного метаболического лечения показал, что в целом отмечалось незначительное улучшение работы сердца (Р≥0,05). Регистрировалось снижение КДО, КСО, ИС и МС; некоторое увеличение УО. В группе больных ХГ II ст. акт. КДО-130,01±0,9; КСО-51,23±1,3; ИС-0,27±0,026; МС-4,6±0,2. В группе ХГ III ст. акт. КДО-136,41±0,36; КСО-58,0±0,09; ИС-0,39±0,018; МС-12,2±2,1. УО-80,1±0,3.
Регистрировалось снижение КДО, КСО, ИС и МС практически до контрольных цифр (Р≤0,05). Наблюдалось некоторое недостоверное увеличение УО (Р≥0,05). В группе больных ХГ II ст. акт. КДО-127,0±0,4; КСО — 44,82±0,9; ИС-0,45±0,07; МС — 0,98±0,9. В группе ХГ III ст. акт. КДО-134,11±0,21; КСО-48,0±0,05; ИС-0,49±0,02; МС — 5,9±0,8, УО — 77,10±0,3.
Таким образом, ремоделирование сердечно-сосудистой системы при поражении печени является мультифакторным процессом и результатом взаимодействия гемодинамических и гуморальных составляющих, процессов адаптации и дезадаптации, на него оказывает влияние медикаментозная терапия. При изучении влияния препарата из группы и-АПФ (периндоприла) на гемодинамику сердца показал, что на фоне метаболической терапии в стационаре и лечения в течение 120 дней и-АПФ периндоприлом в группах больных наблюдалась отчетливая положительная динамика с клинически значимым изменением параметров функциональной перестройки.
- У больных ХГ с умеренной активностью воспаления изменения сердца характеризуются развитием концентрического ремоделирования, а у больных с высокой активностью -концентрической гипертрофией левого желудочка.
- Курсовое в течение 120 дней назначение больным хроническими гепатитами комплексного лечения с включением ингибитора АПФ лизиноприла, способствует улучшению структурно-функциональных изменений сердца и кардиогемодинамики.
Основные термины (генерируются автоматически): III, левый желудочек, акт, больной, группа больных, лабораторная активность, относительная толщина стенки, контрольная группа, концентрическая гипертрофия, патологический процесс.
ПВТ — противовирусная терапия
СН — сердечная недостаточность
ХГС — хронический гепатит С
HCV — вирус гепатита С
NT-pro-BNP — N-концевой предшественник мозгового натрийуретического пептида
Хронический гепатит С (ХГС) — актуальная междисциплинарная проблема. Хорошо изучены различные внепеченочные проявления ХГС, такие как смешанная криоглобулинемия, гломерулонефрит, поздняя кожная порфирия, красный плоский лишай, синдром Шегрена и др. Однако существует целый ряд системных проявлений, которые нуждаются в более тщательном изучении, в частности поражение сердца. При ХГС описаны миокардит, гипертрофическая (ГКМП) и дилатационная (ДКМП) кардиомиопатии, коронарит вследствие криоглобулинемического васкулита мелких сосудов сердца, аритмогенная дисплазия правого желудочка, аневризма левого желудочка, раннее развитие атеросклероза и ишемической болезни сердца [1—6]. Возможно развитие цирротической кардиомиопатии (КМП), которая наблюдается при циррозах печени различной этиологии, в том числе вирусной. Развивается диастолическая дисфункция миокарда и синдром удлиненного интервала Q—T, выраженность которого увеличивается по мере нарастания декомпенсации функции печени [7—11]. Наконец, широко используемая противовирусная терапия (ПВТ) ХГС может сопровождаться кардиотоксичностью интерферона (ИФН), имеющей клинические особенности и нередко проявляющейся развитием декомпенсации деятельности сердца.
Миокардит является одним из мало изученных внепеченочных проявлений ХГС [3, 4]. В клинике им. Е.М. Тареева описана серия наблюдений из 22 больных хроническим гепатитом вирусной этиологии с миокардитом, у 13 из которых диагностирован цирроз печени. Поражение сердца у 4 больных стало причиной летального исхода. В 3 наблюдениях на аутопсии выявлена картина хронического активного миокардита: обширные очаги лизиса кардиомиоцитов (КМЦ) с очаговой лимфогистиоцитарной инфильтрацией; многочисленные продуктивные и продуктивно-деструктивные эндофлебиты; диффузный фиброз стромы; лимфогистиоцитарная инфильтрация стромы. В одном случае диагностированы диффузный кардиосклероз, миокардиофиброз, диффузный склероз эндокарда. Особенностью двух других наблюдений явились выраженные изменения в проводящей системе сердца: волокна проводящей системы замурованы в грубоволокнистую фиброзную ткань, отмечены резко выраженная дистрофия и некробиоз КМЦ. У этих больных наблюдались различные нарушения проводимости [4].
Первичные КМП представляют собой гетерогенную группу заболеваний миокарда различной этиологии. Наибольший интерес к проблеме миокардитов и КМП, ассоциированных с HCV-инфекцией, отмечен у исследователей из Японии. Выявлена высокая распространенность HCV-инфекции у больных ГКМП, ДКМП и миокардитом [17—20]. При многоцентровом исследовании по программе Комитета по изучению идиопатических КМП в Японии, антитела HCV в сыворотке выявлены у 74 (10,6%) из 697 больных ГКМП и у 42 (6,3%) из 633 больных ДКМП, значительно превышая частоту обнаружения антител HCV у сопоставимых по возрасту доноров крови (2,4%) [20].
По данным A. Matsumori [1], у 113 больных ГКМП, HCV-инфекция диагностирована у 16 (14,1%), причем ни у одного из них не было семейного анамнеза по ГКМП. В 4 наблюдениях имелись указания на гемотрансфузии в анамнезе, у 10 больных определялся повышенный уровень трансаминаз в сыворотке, у 7 выявлен гепатоцеллюлярный рак. При морфологическом исследовании отмечены умеренная или выраженная гипертрофия правого и левого желудочков, фиброз различной степени и умеренная клеточная инфильтрация миокарда. РНК HCV генотипа 1b выявлена в сыворотке у 7 больных, РНК HCV в ткани миокарда — у 6, минус-цепи РНК HCV обнаружены в биоптатах сердца у 2 больных. Другая группа исследователей выявила антитела HCV у 18 (22,5%) из 80 больных ГКМП [21].
Многоцентровое исследование, проводимое научным комитетом по изучению КМП Всемирной федерации заболеваний сердца, ставило задачу выявления вирусных геномов энтеровирусов, аденовируса, цитомегаловируса и HCV в формалиновых срезах ткани сердца. Геном HCV выявлен в 2 (18%) из 11 биоптатов больных ДКМП и миокардитом в Италии и у 4 (36%) из 11 больных в США, у 2 из них выявлен миокардит и у 2 — аритмогенная дисплазия правого желудочка. Несмотря на то что метод выявления генома HCV в парафиновых (фиксированных в формалине) срезах менее чувствительный, чем в замороженных образцах, предполагается, что HCV-инфекция может быть более частой причиной ряда заболеваний миокарда, в первую очередь миокардита [22]. Показано также, что частота развития КМП, обусловленных HCV, варьирует в различных регионах мира и различных популяциях. Среди больных КМП в Канаде (Ванкувер) РНК HCV не обнаружена ни в одном из 24 образцов ткани сердца. Ряд европейских исследователей также высказываются против связи HCV-инфекции и заболеваний сердца [23].
В последние годы также изучается вопрос о взаимосвязи ХГС и уровня натрийуретических пептидов. Так, в крупном ретроспективном исследовании антитела к HCV выявлены у 59 (4,4%) из 1355 больных с СН неясной этиологии, что значительно превышало частоту НCV-инфекции в общей популяции (1,8%). Уровень N-концевого предшественника мозгового натрийуретического пептида (NT-pro-BNP) в сыворотке у больных с СН и ХГС достоверно выше, чем у больных с СН без маркеров HCV (р<0,0001) [24]. Интересным представляется исследование А. Antonelli и соавт. [25], которые выявили повышенный уровень NT-pro-BNP у 34% больных ХГС, в то время как в группе неинфицированных, сопоставимых по полу и возрасту, повышение данного лабораторного показателя отмечалось лишь в 6% наблюдений. Это может свидетельствовать в пользу субклинического поражения сердца у некоторых больных ХГС.
Генетические факторы и патогенетические звенья поражения сердца при HCV. Несмотря на то что в последнее время в литературе описываются клинические наблюдения ДКМП и ГКМП, ассоциированных c HCV [1, 6, 18, 21]; механизм, посредством которого HCV приводит к их развитию, полностью не изучен. У ряда пациентов с ассоциированной с HCV КМП идентифицированы HLA- и не-HLA-гаплотипы, которые дают основание полагать, что фактором развития данного вида поражения сердца является генетическая предрасположенность. Так, в развитии ДКМП участвует α-фактор некроза опухоли (α-ФНО) — один из ключевых цитокинов, усиление синтеза которого наблюдается при HCV-инфекции [26].
Причиной миокардита, приводящего к ДКМП и СН, могут быть некоторые вирусы, обладающие тропизмом к миокарду [27, 28]. Считается, что в основе развития вирусного миокардита и прогрессирования его в КМП лежат механизмы смерти клетки в результате апоптоза, а также индуцированные вирусами иммунные реакции [29]. Предполагаемым иммунным механизмом является постоянное обновление иммунокомпетентных клеток и продуцируемых ими цитокинов [30, 31]. Среди всех цитокинов, участвующих в развитии и прогрессировании миокардита, наиболее важную роль играет α-ФНО [32—34]. Отдельные исследования показали, что имеется связь как между сниженной функцией миокарда и повышенной экспрессией α-ФНО, так и между концентрацией α-ФНО в плазме и миокарде у больных миокардитом [35] и ДКМП [36]. С помощью иммуногистохимического анализа установлено, что α-ФНО продуцируется КМЦ при вирусных миокардитах, ассоциированных с аденовирусом, цитомегаловирусом, вирусом Эпштейна—Барр, вирусами гриппа, А и B, а также HCV [35, 37]. Отрицательный инотропный эффект α-ФНО обусловлен связыванием α-ФНО со специфическими рецепторами TNFR1 и TNFR2, которые экспрессируются на мембране КМЦ [38]. Также вероятно, что α-ФНО ингибирует кальциевые каналы L-типа, что приводит к снижению систолической функции миокарда [39]. Другим механизмом, посредством которого α-ФНО влияет на миокард, является стимулирование продукции оксида азота (NO), который оказывает отрицательное инотропное действие на миокард, действуя как эндогенный ингибитор и фактически уменьшая положительный инотропный ответ на β-адренергическую стимуляцию [40].
Некоторые гены, например гены системы HLA, причастны к клиренсу и персистенции HCV-инфекции [41]. В нескольких исследованиях сообщалось, что ДКМП и ГКМП ассоциируются с некоторыми аллелями системы HLA. Так, у инфицированных HCV пациентов, у которых развивается ДКМП, более часто выявляются гаплотипы HLA-DPB1*0901 и HLA-DRB1*1201, а у инфицированных HCV пациентов с ГКМП — гаплотипы HLA DRB1*0901 и DQB1*0303 [1, 42]. По данным других авторов, развитие ДКМП, ассоциированной с HCV, наиболее отчетливо коррелирует с аллелями не-HLA-генов, чем с генами системы HLA [43]. Таким образом, пилотные исследования демонстрируют, что имеется генетическая предрасположенность к развитию поражения миокарда у пациентов с ХГС (рис. 1).

Рис. 1. Генетическая предрасположенность к поражению миокарда при HCV-инфекции.
По данным N. O’Garra и соавт. [44], в печени развивается выраженный CD4+ Th1 клеточный ответ, наиболее вероятно индуцируемый интерлейкином (ИЛ) 12, ИФН-α и ИФН-β, которые продуцируются моноцитами, нейтрофилами и макрофагами после стимуляции Toll-like-рецепторов HCV производными продуктами. Если определенные гаплотипы кодируют молекулы главного комплекса гистосовместимости (ГКГ) II класса с более высоким сродством к производным пептидам HCV, то их функция как молекул, презентирующих антигены клеткам Th1 CD4+, повышается. После активации клетки Th1 CD4+ продуцируют ИФН-γ, который активирует макрофаги к продукции провоспалительных цитокинов [44]. Главными цитокинами, продуцируемыми макрофагами, являются ИЛ-1 и α-ФНО [45], которые могут приводить к обновлению иммунных клеток и высокой концентрации α-ФНО в миокарде.
Другим механизмом, посредством которого гаплотипы HLA могут влиять на развитие ДКМП, ассоциированной с HCV, в контексте α-ФНО является так называемая неклассическая функция клеток ГКГ II класса, т. е. их роль в качестве сигнальных трансдукционных молекул, активируемых суперантигенами в клетках некоторых типов [46, 47]. Суперантигены являются протеинами бактериального или вирусного происхождения, которые активируют до 20% Т-клеточной популяции путем одновременного связывания Т-клеточных рецепторов и молекул ГКГ II класса, что приводит к массивному высвобождению цитокинов, которые секретируются как Т-клетками, так и антигенпрезентирующими клетками [48—50]. В контексте полиморфизма HLA предполагалось, что они принимают непосредственное участие в исходе, к которому приводит продукция цитокинов, стимулируемая суперантигенами [51, 52]. Можно предположить, что определенные гаплотипы HLA кодируют эпитопы молекул ГКГ II класса с высоким сродством к производным HCV суперантигенам или антителам, а это ведет к чрезмерной продукции цитокинов, в частности α-ФНО. Более активное обновление иммунных клеток может привести у генетически предрасположенных инфицированных HCV пациентов к развитию миокардита и впоследствии к ДКМП. Следует отметить, что часто при ассоциированном с HCV хроническом активном миокардите у пациентов отмечался нормальный уровень активности печеночных трансаминаз в сыворотке крови вплоть до формирования терминальной стадии СН [53].
Развитие и прогрессирование вирусного миокардита, в том числе у больных ХГС, осуществляется через различные патогенетические звенья (рис. 2): 1) прямое действие вируса на миокард; 2) непрямое (иммунологическое) действие; 3) смерть клеток в результате апоптоза.

Рис. 2. Механизмы поражения миокарда при HCV-инфекции. АФК — активные формы кислорода.
Воздействие HCV на миокард. Ряд исследователей указывают на возможность прямого воздействия HCV на миокард. Показано, что HCV реплицируется в миокарде, о чем свидетельствует выявление там негативных цепей РНК [53—55]. Механизм, посредством которого протеин HCVcorе вызывает повреждение миокарда, остается неясным; однако он может быть сходным с механизмом поражения печени. Показано, что изменения в структуре рецепторов TNFR1, вызываемых протеином HCVcorе, повышают чувствительность клеток к цитолизу, опосредованному α-ФНО [56]. Кроме того, протеин HCVcorе вызывает дисфункцию митохондрий, что приводит к развитию окислительного стресса клеток печени [57, 58]. Фактически, протеин HCVcore ограничивает свое действие в митохондриях, в частности он взаимодействует с наружной мембраной митохондрий, повышает поглощение кальция митохондриями и вызывает окисление глутатиона, что приводит к дальнейшему повышению продукции АФК [59, 60]. Повышение образования АФК инициирует продукцию α-ФНО [61], который, как отмечено ранее, оказывает отрицательное инотропное действие на миокард. В некоторых ранее проводимых исследованиях продемонстрировано, что у пациентов с острой и хронической СН, развившихся в исходе КМП, в миокарде определяется повышение выработки АФК [62, 63].
К тому же ряд исследований на животных подтверждают роль протеина HCVcore в развитии КМП. В частности, развитие КМП наблюдалось у трансгенных мышей, носителей гена HCVcore, в возрасте 12 мес. Гистологический анализ миокарда этих мышей выявил гипертрофию КМЦ, кардиальный фиброз, дезорганизацию, дефицит и лизис миофибрилл, вакуолизацию и деформацию ядер, повышенное количество митохондрий неправильной формы [55], что убедительно подтверждает определяющие действие протеина HCVcore на развитие КМП, ассоциированной с HCV.
Непрямой иммунологический механизм поражения миокарда включает вовлечение в патологический процесс В-клеток, Т-клеток и макрофагов. Участие В-клеток в КМП, ассоциированной с HCV, предположено в результате обследования 3 пациентов с ассоциированным с HCV миокардитом, ответивших на иммуносупрессивную терапию. В сыворотке крови этих больных выявлены антитела к миокарду, что дало основание предполагать иммунологический механизм повреждения клеток. В дальнейшем подтверждение иммуноопосредованного механизма КМП, ассоциированной с HCV, было основано на эффективности иммуносупрессивных препаратов (преднизолон и азатиоприн), терапия которыми привела к нормализации размеров камер сердца и регрессу признаков СН, несмотря на продолжающуюся персистенцию HCV [54].
Прямой и непрямой механизмы развития ДКМП, ассоциированной с HCV, связаны со смертью клеток через апоптоз. Благодаря способности повышать продукцию АФК, протеин HCVcore может инициировать митохондриальный путь апоптоза. АФК могут вызывать диссоциацию цитохрома С на внутренней мембране митохондрий, что приводит к активации каспаз, результатом чего является фрагментация геномной ДНК и смерть клетки [64]. В результате связывания лигандов с внеклеточными рецепторами суперсемейства рецепторов α-ФНО происходит активация рецепторзависимого сигнального пути апоптоза [65]. Наиболее важными лигандами этих рецепторов являются α-ФНО и Fas-лиганд (FasL). Высокий уровень α-ФНО в миокарде у пациентов с ассоциированным с HCV миокардитом может активировать данный механизм смерти клеток путем взаимодействия с рецепторами ФНО [66].
Заключение
Имеются убедительные доказательства того, что поражение сердца служит одним из внепеченочных проявлений HCV-инфекции. Механизм, посредством которого HCV может приводить к поражению миокарда у генетически предрасположенных пациентов, является многофакторным и включает прямое повреждающее действие вируса, аутоиммунный механизм и апоптоз.
Поражение миокарда при ХГС может прогрессировать в хронический персистирующий миокардит через прямой (вирусный) и непрямой (иммунный) механизмы повреждения, которые приводят к активации зависимой от рецепторов смерти КМЦ, результатом чего является развитие фиброза миокарда с возможной трансформацией в ДКМП. Кроме того, описаны случаи взаимосвязи HCV и ГКМП.
До настоящего момента HCV-инфицированным больным с вовлечением сердца ПВТ, как правило, не проводилась из-за побочных эффектов ИФН. Однако за последние несколько лет в ПВТ вирусного гепатита С произошли кардинальные изменения. Длительное изучение механизмов репликации HCV привело к созданию ингибиторов протеаз HCV (NS¾A, NS5A, NS5B), которые позволяют достичь элиминации вируса у 90—99% пациентов за существенно более короткий срок (как правило, 12 нед) без применения препаратов ИФН (так называемая безинтерфероновая терапия). Это делает данную терапию гораздо более безопасной и хорошо переносимой, в том числе в отношении миокарда [67—69].
Нуждается в отдельном изучении вопрос эффективности и безопасности ПВТ у пациентов с ХГС и ассоциированного с ним поражения сердца, включая сравнение только ПВТ и сочетания ПВТ с сердечно-сосудистыми препаратами и/или иммуносупрессорами. Выявление антител к миокарду и определение уровня α-ФНО в сыворотке крови во время терапии может быть использовано для оценки влияния терапии на данные маркеры.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гепатит С: причины появления, классификация, симптомы, диагностика и способы лечения.
Определение
Гепатит С – это вирусное инфекционное заболевание, которое вызывает воспаление печени, зачастую приводя к ее серьезным повреждениям. Вирус гепатита С распространяется через зараженную кровь.
До недавнего времени лечение гепатита С требовало еженедельных инъекций и приема пероральных препаратов, которые многие люди, инфицированные вирусом, не могли использовать из-за других проблем со здоровьем или серьезных побочных эффектов.
Сегодня ситуация изменилась – разработаны лекарства нового поколения, и с их помощью хронический гепатит С поддается терапии.
Тем не менее около половины людей с гепатитом С не подозревают о том, что инфицированы, поскольку часто болезнь протекает бессимптомно.
Поэтому скрининг гепатита С необходимо проходить регулярно, особенно при наличии факторов риска заражения.
Причины появления гепатита С
Заболевание обычно распространяется, когда кровь человека, зараженного вирусом гепатита С, попадает в организм незараженного. Особенно часто это происходит в среде наркоманов.
В группе риска находятся люди, которым часто переливают кровь, и длительное время находящиеся на гемодиализе.
Заражению подвержены новорожденные дети, если их мать больна гепатитом С.
Кроме того, существуют редкие, но все же возможные ситуации инфицирования вирусом:
- Совместное использование предметов личной гигиены, которые могли соприкасаться с кровью больного человека (бритвы, ножницы или зубные щетки).
- Половой контакт с человеком, зараженным вирусом гепатита С.
- Татуировки или пирсинг, выполненные в ненадлежащих санитарных условиях.
Вирус гепатита С не передается при совместном использовании столовых приборов, кормлении грудью, объятиях, поцелуях, при держании за руку, кашле или чихании, через укусы насекомых. Также он не распространяется через еду или воду.
- Острый гепатит С – это ранняя стадия, когда гепатит длится менее шести месяцев.
- Хронический гепатит С – это долгосрочный тип, когда заболевание длится больше шести месяцев.
- Минимальная активность (печеночные трансаминазы (АЛТ и АСТ) в биохимическом анализе крови повышены не более, чем на 3 нормы)).
- Умеренная активность (3–10 норм печеночных трансаминаз).
- Высокая активность (> 10 норм).
В течение первых 6 месяцев от начала заболевания человек может даже не подозревать, что болен, ощущая лишь необъяснимую усталость, плохой аппетит, тяжесть в правом подреберье, регулярную головную боль и головокружение.
В этот же период может меняться цвет кала (от светлого вплоть до белого) и мочи (от темно-желтой до коричневой). Некоторые пациенты говорят, что у них болят суставы.
По мере прогрессирования заболевания к первоначальным симптомам присоединяются спонтанные кровотечения (носовые, маточные, кровотечения из десен), желтушность кожных покровов, склонность к образованию гематом, зуд, накопление свободной жидкости в брюшной полости (асцит), отеки ног. Кроме того, пациенты начинают терять вес, снижается память, появляются проблемы со зрением, на коже формируются сосудистые звездочки.
У мужчин может отмечаться гинекомастия (увеличение грудных желез), снижение либидо, уменьшение размера яичек.
Симптомы острого гепатита С включают желтуху, усталость, тошноту, жар и мышечные боли. Они появляются через 1-3 месяца после инфицирования вирусом и продолжаются от двух недель до трех месяцев.
Диагностика гепатита С
Диагноз ставится на основании жалоб больного и анамнеза. При подозрении на вирусный гепатит С врач обязательно выясняет, были ли в течение жизни переливания крови, хирургические манипуляции, не употреблял ли пациент инъекционные наркотики, делал ли татуировки и пирсинг, имели ли место незащищенные половые контакты.
Для уточнения диагноза могут понадобиться следующие обследования:
-
Клинический анализ крови с развернутой лейкоцитарной формулой.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Тахикардия: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Тахикардия – состояние, при котором частота сердечных сокращений составляет более 100 ударов в минуту. Тахикардия не является самостоятельным заболеванием, а представляет собой симптом (проявление) некоторых заболеваний. Кроме учащенного сердцебиения это состояние характеризуется одышкой, слабостью, болью в груди, иногда потерей сознания.
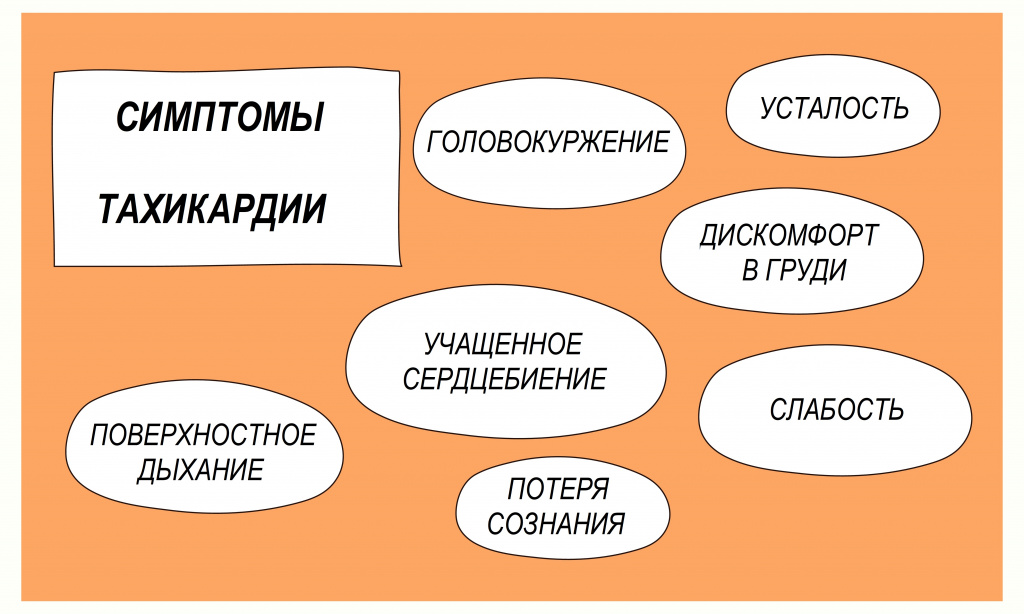
Разновидности тахикардии
Одна из классификаций разделяет тахикардию на физиологическую и патологическую.
Для физиологической тахикардии характерно отсутствие поражения сердечной мышцы и проводящих путей сердца. Такой вид тахикардии можно назвать компенсаторным, так как развиваются она в ответ на повышение потребности организма в кислороде, например, во время занятий спортом, психоэмоционального напряжения, нахождения на высокогорье и т.д.
Для физиологической тахикардии характерны следующие проявления:
- изменения частоты сердечных сокращений носят преходящий характер (не являются постоянными);
- присутствует очевидная связь с провоцирующим фактором (стрессом, сильным волнением, физическими нагрузками);
- по завершении действия провоцирующего фактора частота сердечных сокращений постепенно приходит в норму;
- отсутствуют патологии со стороны сердечно-сосудистой системы (например, врожденные пороки сердца, перенесенные инфаркты, поражения клапанного аппарата сердца и прочих нарушений ритма сердца).
- Гиперфункция щитовидной железы (гипертиреоз, тиреотоксикоз, диффузный токсический зоб).
- Заболеваний надпочечников с их гиперфункцией и, как следствие, повышенным выбросом адреналина в кровь.
- Поражения проводящих путей сердца вследствие перенесенного инфаркта, врожденной патологии клапанного аппарата сердца.
- Наличие анемии (снижения уровня гемоглобина крови).
- Поражения сердечной мышцы (например, миокардит, перикардит).
- Гормональная перестройка организма (беременность, климактерический период).
Дисфункция коры надпочечников, или болезнь Аддисона, при которой надпочечники не могут вырабатывать достаточное количество гормонов. Их дефицит приводит к тому, что почки начинают быстро выводить с мочой натрий и воду, возникает обезвоживание организма, нарушается водно-электролитный баланс, загущается кровь, замедляется циркуляция и кровоснабжение периферических тканей. На фоне этих изменений происходят патологические изменения сердечно-сосудистой системы.
При анемии увеличение числа сердечных сокращений обусловлено необходимостью поддерживать необходимый уровень кислорода в крови в условиях дефицита гемоглобина.
При подозрении на развитие анемии вследствие острой кровопотери необходимо незамедлительно обратиться за медицинской помощью.
Тахикардии беременных обусловлены как увеличением потребности организма матери и плода в кислороде, так и ростом потребления сывороточного железа, фолатов, цианокобаламина.
Тахикардия может развиться на фоне приема некоторых лекарственных препаратов, употребления кофе и кофеинсодержащих продуктов, энергетических напитков, содержащих таурин, табакокурения.
К каким врачам обращаться
При подозрении на патологию щитовидной железы или надпочечников нужно обратиться к эндокринологу. Для лечения состояний, связанных с нарушением работы сердца, – к кардиологу. При наличии анемии - к терапевту или гематологу. Беременные женщины наблюдаются в женской консультации, где врач – акушер-гинеколог может своевременно выявить патологию и назначить лечение.
Диагностика и обследования при тахикардии
При обращении пациента с симптомами, характерными для тахикардии, необходимо выяснить, является ли тахикардия первопричиной ухудшения самочувствия, побудившей пациента обратиться к врачу, или она вторична и имеется основное заболевание.
При наличии подозрений на патологию щитовидной железы определяют в крови уровень гормонов щитовидной железы (Т3 – трийодтиронин, Т4 – тироксин и их свободные фракции) и уровень тиреотропного гормона.
Синонимы: Свободный трийодтиронин. Free T3. Краткое описание исследуемого вещества Трийодтиронин свободный Трийодтиронин свободный (Т3св.) относится к тиреоидным гормонам и является не связанной с белками биологически активной фракцией общего трийодтиронина (Т3общ.), который секретируется клетка.
Читайте также:

