Препараты влияющие на днк вирусов натуральной оспы
Обновлено: 24.04.2024
Поражение натуральной оспой. Диагностика, лечение
В 1980 г. Всемирная организация здравоохранения объявила о ликвидации заболевания натуральной оспой. Интерес к натуральной оспе возобновился в связи тем, что оспа потенциально может быть использована в качестве оружия массового поражения; в связи с этим в 2003 г. была начата программа активной вакцинации основного медицинского персонала и военных.
Также они утверждали о попытках советских ученых создать рекомбинантные штаммы вируса, обладающие еще большей вирулентностью. Факт существования и доступности вируса натуральной оспы не может не вызывать серьезной обеспокоенности.
В качестве биологического оружия вирус натуральной оспы должен рассматриваться в первую очередь, и связано это вот с чем: значительная часть населения не обладает иммунитетом к этому заболеванию, запасов вакцины окажется недостаточно, вирус может быть распространен в большом количестве в виде аэрозоля, а его инокуляция в большинстве случаев приведет к развитию заболевания, а передача его от человека к человеку станет неконтролируемой.
Возбудитель натуральной оспы, острого и высококонтагиозного заболевания, принадлежит семейству Poxviridae. Вирус натуральной оспы (вируса Variola) — это ДНК-содержащий вирус. Человеческого резервуара этого вируса, как и его носителей из числа людей, не выявлено. Натуральная оспа может клинически проявляться в двух формах: это variola major, характеризующаяся 20-40% летальностью в группе непривитых лиц, и variola minor, уровень летальности среди непривитых при которой составляет 1%. Существуют и другие вирусы оспы, однако только вирус натуральной оспы способен передаваться от человека человеку.
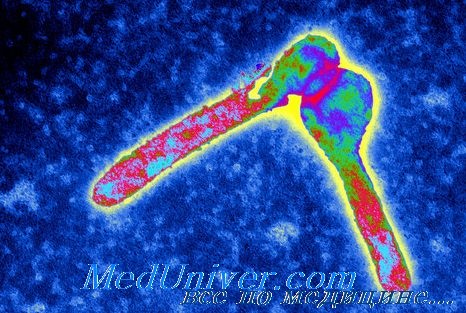
Вирус натуральной оспы легко передается от человека к человеку воздушно-капельным путем. Во внешней среде вирус способен сохранять жизнеспособность до 7 дней. Первичные симптомы заболевания возникают остро и обычно через 7-17 дней после заражения, они включают лихорадку, ознобы, головную боль, боль в спине и общее недомогание. Это продромальная фаза, которая может продолжаться 2-3 дня. Высыпания обычно появляются через 48 часов после начала заболевания и начинаются с полости рта, языка и ротоглотки, примерно через 24 часа после этого появляются высыпания на коже.
Сыпь быстро распространяется на кистях и предплечьях, после чего она возникает на ногах и туловище; первичными элементами сыпи являются везикулы и пустулы, на месте которых образуются корки и струпья, заканчивающиеся формированием втянутого рубца. Некоторые формы натуральной оспы могут приводить в развитию тяжелых вторичных инфекций и нарушению функции органов и систем: поражению ЖКТ с развитием желудочно-кишечных кровотечений, пневмонии и бронхопневмонии, почечной недостаточности и даже энцефалиту. Смерть наступает обычно к концу первой недели или в начале второй недели заболевания в результате выраженной токсемии, обусловленной неконтролируемой вирусной инфекцией.
Больной натуральной оспой заразен для окружающих в течение всей первой недели заболевания, то есть с тех пор, как появляются первые симптомы. Он продолжает оставаться заразным, пока не заживет последний элемент сыпи. При вспышке заболевания потенциально заразившийся человек во избежание распространения инфекции должен быть изолирован.
В фазу везикулярных высыпаний сыпь может напоминать таковую, встречающуюся при ветряной оспе, однако, существуют два важных отличия. Сыпь при натуральной оспе развивается синхронно, тогда как при ветряной оспе она развивается асинхронно; сыпь при натуральной оспе концентрируется на лице и конечностях, тогда как при ветряной — в основном на туловище. Пустулы при натуральной оспе имеют характерные втяжения (умбиликации) в центральной части. При подозрении на натуральную оспу необходимо немедленно сообщить об этом в органы здравоохранения, поскольку такое событие является ни много ни мало, чрезвычайным происшествием международного масштаба.
Лечение натуральной оспы симптоматическое, каких-либо специфических препаратов, одобренных Управлением по продовольствию и медикаментам (FDA), не существует. В ряде исследований были получены многообещающие результаты применения Цидофовира для профилактики заболеваний, вызываемых ортопоксвирусами. Также в течение первой недели после контакта рекомендуется вакцинация против натуральной оспы. В условиях эпидемии натуральной оспы немедленно должен быть вакцинирован весь медицинский персонал, пациенты должны содержаться в помещениях с отрицательным давлением, персонал должен использовать стандартные меры предосторожности, заключающиеся в ношении перчаток, масок и закрытой одежды.
Ключевым фактором при возникновении эпидемий является изоляция больных и предотвращение дальнейшего распространения инфекции.
Видео урок эпидемий оспы и их значение в истории
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Натуральная оспа (лат. Variola, Variola vera) или, как её ещё называли ранее, чёрная оспа - высококонтагиозная (заразная) вирусная инфекция, которой страдают только люди. Её вызывают два вида вирусов: Variola major (смертность 20-40 %, по некоторым данным - до 90 %) и Variola minor (смертность 1-3 %). Люди, выживающие после оспы, могут частично или полностью терять зрение, и практически всегда на коже остаются многочисленные рубцы в местах бывших язв.
Натуральной оспой болеют только люди, экспериментальное заражение лабораторных животных удается с трудом. Возбудителем натуральной оспы является фильтрующийся вирус, антигенно родственный вакцинии, вирусу коровьей оспы, тонкое строение и закономерности размножения которого хорошо изучены. Инкубационный период при натуральной оспе продолжается от 8 до 14 дней, чаще ок. 11–12. Больные заразны для окружающих в течение всего периода высыпания и, по-видимому, даже за несколько дней до появления сыпи, в общей сложности около трех недель. Вирус выделяется из разрывающихся и подсыхающих пузырьков на коже, из ротовой полости и обнаруживается в моче и кале больного. Возбудитель инфекции передается путем непосредственных контактов, воздушно-капельным способом, от здоровых носителей и животных, и может сохранять жизнеспособность на одежде и постельном белье. Все невакцинированные люди восприимчивы к заражению; естественного иммунитета к натуральной оспе не бывает. Хотя заболевание возможно в любом возрасте, дети до четырех лет особенно уязвимы.
Что провоцирует / Причины Натуральной оспы:
Возбудитель оспы относится к вирусам семейства Poxviridae, подсемейства Chordopoxviridae, рода Orthopoxvirus; содержит ДНК, имеет размеры 200-350 нм, размножается в цитоплазме с образованием включений. Вирус натуральной оспы имеет антигенное родство с эритроцитами группы А крови человека, что обусловливает слабый иммунитет, высокую заболеваемость и смертность соответствующей группы лиц. Он устойчив к воздействию внешней среды, особенно к высушиванию и низким температурам. Он может длительное время, в течение ряда месяцев, сохраняться в корочках и чешуйках, взятых с оспин на коже больных, в замороженном и лиофилизированном состоянии остается жизнеспособным несколько лет.
Патогенез (что происходит?) во время Натуральной оспы:
В типичных случаях оспа характеризуется общей интоксикацией, лихорадкой, своеобразными высыпаниями на коже и слизистых оболочках, последовательно проходящими стадии пятна, пузырька, пустулы, корочки и рубца.
Натуральная оспа относится к антропонозам и представляет собой высококонтагиозную, особо опасную инфекцию. К оспе восприимчивы все люди, если у них нет иммунитета, полученного в результате перенесенного ранее заболевания или вакцинации. Натуральная оспа была широко распространена в Азии и Африке. Является воздушно-капельной инфекцией, однако возможна инокуляция вируса при непосредственном соприкосновении с пораженной кожей больного или инфицированными им предметами. Заразность больного наблюдается на протяжении всего заболевания - от последних дней инкубации до отторжения корочек. Трупы умерших от оспы также сохраняют высокую заразность.
При вдыхании зараженного воздуха вирусы попадают в респираторный тракт. Возможно заражение через кожу при вариоляции и трансплацентарно. Вирус поступает в ближайшие лимфатические узлы и далее в кровь, что приводит к виремии. Гематогенно инфицируется эпителий, здесь происходит размножение вируса, с чем связано появление энантемы и экзантемы. Ослабление иммунитета ведет к активации вторичной флоры и превращению везикул в пустулы. Вследствие гибели росткового слоя эпидермиса, глубоких нагноительных и деструктивных процессов формируются рубцы. Может развиться инфекционно-токсический шок. Для тяжелых форм характерно развитие геморрагического синдрома.
Симптомы Натуральной оспы:
Начальный период характеризуется ознобом, повышением температуры тела, сильными рвущими болями в пояснице, крестце и конечностях, сильной жаждой, головокружением, головной болью, рвотой. Иногда начало болезни мягкое.
На 4-й день наблюдается снижение температуры тела, ослабляются клинические симптомы начального периода, но появляются типичные оспины на коже головы, лица, туловища и конечностей, которые проходят стадии пятна, папулы, пузырька, пустулы, образования корочек, отторжения последних и образования рубца. Одновременно появляются оспины на слизистой оболочке носа, ротоглотки, гортани, трахеи, бронхах, конъюнктивах, прямой кишке, женских половых органов, мочеиспускательного канала. Они вскоре превращаются в эрозии.
Изменение крови характеризуется лейкоцитозом, при тяжелых формах имеется резкий сдвиг влево с выходом в кровь миелоцитов и юных клеток.
К тяжёлым формам относятся сливная форма (Variola confluens), пустулезно-геморрагическая (Variola haemorrhagica pustulesa) и оспенная пурпура (Purpura variolosae).
У привитых противооспенной вакциной оспа протекает легко (Varioloid). Основными её особенностями являются продолжительный инкубационный период (15-17 дней), умеренные явления недомогания и других признаков интоксикации; истинная оспенная сыпь необильная, пустулы не образуются, рубцов на коже не остается, выздоровление наступает через 2 недели. Встречаются лёгкие формы с кратковременной лихорадкой без сыпи и выраженных расстройств самочувствия (Variola sine exanthemate) или только в виде необильной сыпи (Variola afebris).
К возможным осложнениям относятся энцефалиты, менингоэнцефалиты, пневмонии, панофтальмиты, кератиты, ириты, сепсис.
Диагностика Натуральной оспы:
Клинические проявления болезни являются основанием для специфических исследований. Для анализа берут содержимое везикулы, пустулы, корочки, мазки слизи из полости рта, кровь. Присутствие вируса в образцах определяют с помощью электронной микроскопии, микропреципитации в агаре иммунофлюоресцентным методом, с помощью ПЦР. Предварительный результат получают через 24 часа, после дальнейшего исследования - выделение и идентификацию вируса.
Лечение Натуральной оспы:
Для лечения данного заболевания применяются противовирусные препараты (метисазон по 0,6 г 2 раза в день курсом 5-6 сут), противооспенный иммуноглобулин 3-6 мл внутримышечно. Для профилактики присоединения бактериальной инфекции на пораженные участки кожи наносятся антисептические препараты. При наличии бактериальных осложнений больным назначаются антибиотики широкого спектра действия (полусинтетические пенициллины, макролиды, цефалоспорины). Проводятся мероприятия направленные на детоксикацию организма, к ним относятся введение коллоидных и кристаллоидных растворов, в некоторых случаях проводится ультрафильтрация и плазмофорез.
Прогноз зависит от клинической формы болезни, возраста и преморбидного состояния. Летальность колеблется от 2% до 100%. При легком течении и у привитых прогноз благоприятный. Реконвалесценты выписываются из госпиталя после полного клинического выздоровления, но не раньше чем через 40 дней от начала заболевания. После легких форм больные выписываются без изменения категории годности. После тяжелых форм годность к военной службе решается ВВК в зависимости от резидуальных явлений (нарушение зрения и другие) или им предоставляется отпуск по болезни сроком до 1 мес.
Профилактика Натуральной оспы:
Вариоляция (вакцинация ранней, небезопасной вакциной) была известна на Востоке по крайней мере с раннего Средневековья: в Индии о ней сохранились записи VIII века, а в Китае X века. В Европу данная техника вакцинации была впервые привезена из Турции супругой британского посла в Стамбуле Мэри Уортли Монтегю в 1718 году, после чего была привита британская королевская семья.
В России вариоляция была введена после смерти от оспы 14-летнего императора Петра II.
В конце XVIII века английский врач Эдвард Дженнер изобрёл прививку от оспы на основе вируса коровьей оспы, которая была привита в Европе массово.
Первыми привитыми от оспы в России были Екатерина II Великая, Великий князь Павел Петрович, Великая княгиня Мария Фёдоровна, а через несколько дней и внуки Екатерины Александр и Константин Павловичи. Крестьянскому мальчику Маркову, от которого была привита оспа императрице, было присвоено дворянство, фамилия Оспенный и герб.
В Америке, Азии и Африке оспа держалась ещё почти двести лет. В XVIII веке от натуральной оспы в России умирал каждый 7-ой ребенок. В XX веке вирус унес жизни 300-500 миллионов человек. В конце 1960-х оспа поражала 10-15 млн непривитых людей.
В 1967 г. ВОЗ принимает решение об эрадикации натуральной оспы с помощью массовой вакцинации человечества.
Последний случай заражения натуральной оспой естественным путем был описан в Сомали в 1977 г. В 1978 г. зафиксирован и последний случай лабораторного заражения. Официально об искоренении оспы было объявлено в 1980 г. на Ассамблее ВОЗ, чему предшествовало соответствующее заключение комиссии специалистов, вынесенное в декабре 1979г.
Натуральная оспа относится к особо опасным инфекциям. Больные и подозрительные на эту инфекцию подлежат строгой изоляции, клиническому обследованию и лечению в специальных стационарах. Медицинский персонал работает в противочумной одежде III типа с маской. Проводят тщательную текущую и заключительную дезинфекцию помещения, где находится (находился) больной, предметов обихода и мест общего пользования 5% раствором лизола. Посуду замачивают 3% раствором хлорамина, затем кипятят. Весь мусор и отходы сжигаются.
Карантин для лиц, находившихся в контакте с больным (подозрительным) натуральной оспой, устанавливают на 17 дней. Все они вакцинируются против оспы независимо от срока предыдущей прививки. Им вводят однократно донорский гамма-глобулин в количестве 3 мл и назначают внутрь метисазон: взрослым 0,6 г 2 раза в сутки, детям — разовая доза из расчета 10 мг на 1кг массы тела ребенка 4—6 дней подряд.
К каким докторам следует обращаться если у Вас Натуральная оспа:
Интересные факты о болезни Натуральная оспа:
Прекращение вакцинации против натуральной оспы могло спровоцировать рост заражений ВИЧ-инфекцией. По мнению иммунологов, вакцина против оспы понижала вероятность проникновения в клетки вируса иммунодефицита.
Авторы исследования, американские ученые из Университета Калифорнии и еще нескольких научных центров, описали на страницах журнала результаты экспериментов на культуре клеток, взятых у людей, прошедших вакцинацию. Исследователи обнаружили, что в клетках людей, ранее привитых от оспы, ВИЧ размножался медленнее, чем в таких же клетках у людей, не проходивших вакцинацию.
Осторожность не повредит
Не следует, впрочем, считать, что вакцина от оспы защищает от ВИЧ, и немедленно бежать делать прививку: ученые подчеркивают, что эксперимент проведен на культуре клеток, а не на целом организме и пятикратное снижение скорости распространения вируса получено не для любой разновидности ВИЧ, а только для определенных штаммов. Эти штаммы довольно распространенные и играют важную роль в развитии эпидемии, но далеко не единственные. Да и замедление распространения вируса впятеро все-таки неравносильно его полному уничтожению.
Другое дело, что вплоть до 1970-х годов, когда прививки от оспы ставились массово, риск заражения мог быть меньше, и долгое время вирус просто не мог выйти за пределы ограниченной территории в Центральной Африке. Даже сейчас вероятность передачи ВИЧ при сексуальных контактах не превышает десятых долей процента и снижение этой величины в несколько раз вкупе со слабым развитием транспорта вполне могло не дать разгуляться пандемии. Сейчас, когда число носителей вируса составляет около 40 млн человек во всем мире, рассчитывать на искоренение ВИЧ не приходится, даже если результаты предварительных экспериментов полностью подтвердятся. Но любой мало-мальски перспективный подход к снижению риска передачи вируса, безусловно, заслуживает рассмотрения.
Как это работает?
Ключевую роль в потенциальном защитном механизме играют рецепторы типа CCR5 – белковые молекулы, расположенные внутри клеточной мембраны. Именно с этими молекулами взаимодействует ВИЧ при проникновению в клетку, и вирусологам известно, что люди с мутантной формой CCR5-рецепторов для ВИЧ уязвимы в гораздо меньшей степени.
Окна и двери
CCR5 – не единственная молекула, которой пользуется вирус для попадания в клетки. Столь же важны рецепторы класса CD4. Проводя аналогию, можно сравнить рецепторы с "окнами" и "дверьми" клетки. Злоумышленники проникают как через двери, так и через окна, поэтому установка ударопрочных стекол или надежных замков по отдельности лишь снижает, но не сводит на нет риск кражи.
Кстати, аналогия между рецепторами и окнами примечательна еще и тем, что рецепторы нужны самой клетке для избирательного взаимодействия с другими клетками.
Вирус же vaccinia, который и является основой вакцины (сходство в названиях не случайно, вирус назван именно за свою благородную функцию) от натуральной оспы, может менять экспрессию гена CCR5. Это означает, что ген, отвечающий за синтез белков рецептора, может "выключаться", и со временем у привитого пациента CCR5 рецепторы просто исчезают.
Как именно это происходит, насколько долго длится эффект (ученые вели опыты на клетках от людей, привитых за три и шесть месяцев до эксперимента) и можно ли его еще и усилить, пока неясно. Но очевидно то, что прививки от оспы достаточно безопасны для массового применения: их в свое время делали каждому ребенку на планете, и у многих на плече остался крохотный шрам.
Лишь в 1980-х, когда оспа исчезла с лица Земли и осталась только в нескольких микробиологических лабораториях, от прививок отказались, так как риск побочных последствий стал многократно превышать риск заражения оспой как таковой. Но если будет доказано, что прививки от оспы помогают и против ВИЧ (пусть даже не абсолютно), к осповакцинации вернуться будет несложно.
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Натуральной оспы, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Для терапии таких заболеваний, как астма, атеросклероз, системная красная волчанка, псориаз, ревматоидный артрит, рассеянный склероз и другие, такие как вирус натуральной оспы, используются человеческие антитела, блокирующие белковые факторы воспаления. Оказалось, что для этих целей можно использовать и белки инфекционных микроорганизмов, которые эволюционно адаптированы к преодолению защитных систем организма.
Особый интерес для медицинской биотехнологии представляют высоко патогенные вирусы, для которых человек является единственным хозяином. И сегодня на основе белков вируса натуральной оспы, столетиями являвшегося настоящим бичом цивилизаций, создаются препараты для коррекции тяжелейших патологических состояний неинфекционной, в том числе аутоиммунной, природы
Микроорганизмы обитают везде: в воздухе и в воде, в почве и в наших собственных телах… По сравнению с человеком и животными размножаются они чрезвычайно быстро, и их сообщества неизмеримо многочисленнее. Так, если человечество перевести в масштаб микромира, то все 7 млрд человек легко уместились бы в стандартной микробиологической колбе.
Специфическая защита организма против конкретного инфекционного агента – адаптивный или приобретенный иммунитет, развивается медленнее и представляет собой сложное взаимодействие иммунных клеток разного типа, регулируемое специальными белками.
ИММУННАЯ ОБОРОНА
Задача иммунной системы организма – защищать его от любых внешних и внутренних угроз.
Врожденный иммунитет неспецифичен – он обеспечивает защиту от любых инфицирующих агентов: вирусов, бактерий, а также макромолекул.
Одной из первых (возможно, и одной из самых древних) линий такой неспецифической защиты является апоптоз – программируемое самоубийство клетки. В случае вирусной инфекции апоптоз, индуцируемый в результате молекулярного распознавания специфичных молекул патогена, предотвращает размножение вируса и инфицирование других клеток организма хозяина.
Важную роль в ранней неспецифической защите организма от вирусной инфекции играет воспаление, возникающее в первые часы и дни после инфицирования и направленное на ограничение распространения вируса. Клетки врожденной иммунной системы млекопитающих – макрофаги, дендритные клетки и натуральные киллеры, в ответ на инфекцию продуцируют так называемые провоспалительные цитокины, такие как интерлейкин-1β(IL-1β), интерлейкин-18 (IL-18), фактор некроза опухолей (TNF) и гамма-интерферон (γ-IFN). В развитии воспалительной реакции участвуют белки и другого класса – хемокины, которые регулируют перемещение и функции лейкоцитов.
К дополнительным механизмам врожденного иммунитета можно отнести комплемент – многокомпонентный набор сложных белков сыворотки крови, которые являются протеолитическими ферментами, участвующими в инактивации инфекционных агентов и зараженных ими клеток.
Специфическая защита организма против конкретного инфекционного агента – адаптивный или приобретенный иммунитет, развивается медленнее реакций врожденного иммунитета. Он осуществляется в результате сложного взаимодействия клеток разного типа, контролируемого цитокинами TNF, IL-1β и γ-IFN. Его результат – появление B-лимфоцитов, синтезирующих специфичные противовирусные антитела, и вирусоспецифических цитолитических T-лимфоцитов. Специфичные антитела могут взаимодействовать с вирусными частицами и их компонентами индивидуально либо в комплексе с комплементом, инактивируя их.
Таким образом, интерлейкин-1β, фактор некроза опухолей и гамма-интерферон являются важнейшими цитокинами, которые, наряду с регулированием воспалительных реакций, контролируют развитие адаптивного иммунного ответа организма на инфекцию.
Но что если использовать для этих целей белки патогенных микроорганизмов, таких как вирусы, эволюционно-адаптированных к преодолению защитных систем организма, обернув, образно говоря, зло во благо?
Патогенный и антропонозный
Царство вирусов было открыто более ста лет назад выдающимся русским ученым Д. И. Ивановским, однако изучить эти мельчайшие организмы удалось лишь в последние десятилетия благодаря бурному развитию инструментальных методов исследований.
Разные вирусы млекопитающих отличаются не только по размеру генома и самих вирусных частиц, но и по стратегии своего развития в организме хозяина. Вирусы различных семейств демонстрируют удивительное разнообразие в механизмах преодоления систем врожденного и адаптивного иммунитета млекопитающих. Поэтому изучение этих особенностей вирусов позволяет выявить новые закономерности организации и функционирования защитных систем животных и человека, обеспечивающих выздоровление после инфицирования болезнетворным агентом.
Удивительный пример высокой патогенности для человека и строгой антропонозности представляет собой вирус натуральной оспы. Этот вирус, предположительно, исходно имел широкий круг хозяев, однако в процессе эволюции утратил способность размножаться в организме других млекопитающих, сохраняясь в эндемичном (т. е. свойственном только данной местности) состоянии в течение многих столетий в густонаселенных районах, прежде всего, Индийского субконтинента (Щелкунов, 2012).
Оружие против воспаления
Как уже упоминалось, главной причиной аутоиммунных заболеваний является разбалансировка иммунитета, в том числе сверхсинтез веществ, провоцирующих воспалительные реакции.
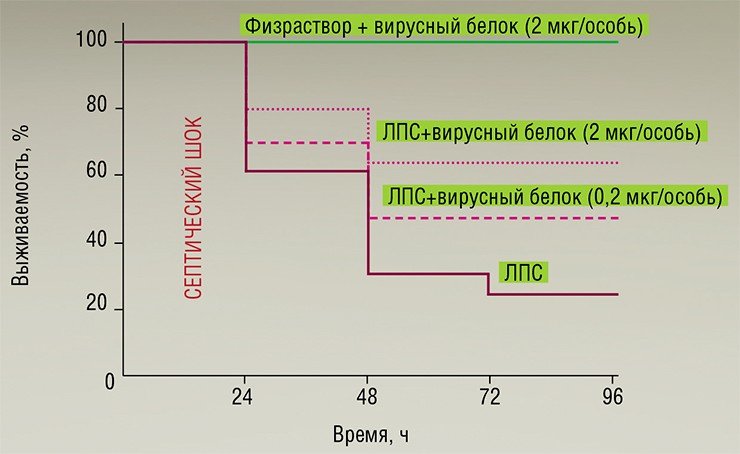
Одним из ключевых цитокинов иммунного воспалительного ответа является фактор некроза опухолей (TNF) – именно его повышенная продукция приводит к таким болезням аутоиммунной природы, как псориаз, болезнь Крона, ревматоидный артрит и т. п. Высокий уровень продукции TNF обусловливает и тяжелую патологию, часто завершающуюся летальным исходом – септический или эндотоксический шок.
Воспрепятствовать связыванию TNF с его белковыми рецепторами, зафиксированными на клеточных мембранах, можно с помощью соответствующих моноклональных антител либо так называемых растворимых форм его рецепторов, которые представляют собой внеклеточные домены (участки) рецепторных белков и обычно обнаруживаются в сыворотке и других биологических жидкостях. Присоединение подобных молекул к TNF должно инактивировать этот цитокин и уменьшить вызванный им воспалительный процесс.
Действительно, в модельных лабораторных экспериментах было доказано терапевтическое действие анти-TNF антител при лечении ряда патологий, обусловленных повышенной продукцией TNF. Однако попытки использовать для этих целей напрямую растворимые клеточные TNF-рецепторы не дали положительных результатов. Успеха удалось добиться лишь с помощью методов генетической инженерии, когда были созданы так называемые химерные белки, состоящие из TNF-связывающей части клеточных рецепторов и фрагмента иммуноглобулина человека.
Однако клинические исследования показали, что пациенты, страдающие ревматоидным артритом или другим воспалительным или аутоиммунным заболеванием, оказываются избирательно чувствительны лишь к одному из этих анти-TNF препаратов. Кроме того, поскольку все эти препараты имеют белковую природу, они сами по себе являются мишенью для иммунной системы больных, поэтому при длительной терапии их эффективность может снижаться. Это означает, что при потере чувствительности к одному препарату его требуется заменить на другой.
РЕВМАТОИДНЫЙ АРТРИТ — системное аутоиммунное заболевание соединительной ткани, проявляющееся главным образом хроническим воспалением суставов: голеностопных, лодыжек, коленей и кистей рук.
Сегодня от этой болезни страдает каждый сотый житель Земли, т. е. более 70 млн человек. Женщины болеют в несколько раз чаще, чем мужчины. Болезнь обычно развивается после 30 лет. В 70 % случаев ревматоидный артрит приводит к инвалидности, которая наступает довольно рано.
Причины возникновения этой болезни точно не установлены, но известно, что толчком к ее развитию служит сбой в иммунной системе в результате переохлаждения, стрессов, травм суставов и инфекции, в том числе ОРЗ, ангины и гриппа. При ревматоидном артрите наблюдается избыточный синтез таких провоспалительных цитокинов, как фактор некроза опухолей и гамма-интерферон
Методами генетической инженерии здесь были созданы рекомбинантные бакуловирусы, способные продуцировать в клеточной культуре TNF-связывающий белок (CrmB), характерный для вирусов оспы коров, оспы обезьян и натуральной оспы. Однако на экспериментальной модели эндотоксического шока было показано, что существенным терапевтическим эффектом обладает лишь белок CrmB вируса натуральной оспы (Gileva et al., 2006). Именно этот белок или его реконструированные варианты могут стать действующим началом новых средств анти-TNF терапии (Гилева и др., 2009).
На сегодня имеется много данных о том, что воспалительный процесс и гистопатологические изменения при ряде воспалительных и аутоиммунных заболеваний нервной системы, артрите, гломерулонефрите, системной красной волчанке и других болезнях во многих случаях обусловлены активацией системы комплемента крови, представляющей собой еще одну из систем неспецифического иммунитета. Комплемент играет важную роль и в реакции отторжения трансплантата.
Поксвирусы кодируют особый белок (КСБ), способный ингибировать активацию комплемента, причем наиболее эффективно с белками комплемента человека взаимодействует белок того же вируса натуральной оспы. Сегодня считается, что именно этот вирусный белок может стать перспективным препаратом для лечения болезни Альцгеймера, синдрома мультиорганной дисфункции и отторжения ксенотрансплантатов (Jha, Kotwal, 2003). Так, на лабораторных животных было показано, что рекомбинантный КСБ способствует восстановлению функций мозга после средней и тяжелой черепно-мозговой травмы. Этот белок оказался эффективен и при травмах спинного мозга: при его применении значительно уменьшались гистопатологические изменения, вызванные воспалительными реакциями.
В патогенезе воспалительных и аутоиммунных заболеваний важную роль играют и хемокины – обширное семейство небольших белков, имеющих очень сходную третичную структуру. Поксвирусы кодируют хемокинсвязывающие белки, по аминокислотной последовательности не имеющие гомологов среди известных белков позвоночных. Их высокий терапевтический потенциал был показан на ряде лабораторных моделей воспалительных и аутоиммунных заболеваний (Непомнящих, Щелкунов, 2008).
Таким образом, предположение ученых, что вирусные белки, являющиеся антагонистами иммунных белков-регуляторов, можно использовать в терапевтических целях, полностью подтвердилось. Сегодня на их основе с помощью методов генетической инженерии уже разрабатываются препараты нового поколения для коррекции патологических состояний человека, связанных с избыточной активацией белков-медиаторов защитных систем организма.
И с этой точки зрения, мы можем по-новому взглянуть на смертельно опасный для человека вирус натуральной оспы: результаты лабораторных исследований и доклинических испытаний свидетельствуют о большой перспективности препаратов для лечения тяжелейших воспалительных и аутоиммунных заболеваний человека, созданных на основе белков этого вируса, на протяжении столетий бывшего настоящим бичом цивилизаций.
Непомнящих Т. С., Щелкунов С. Н. Иммуномодулирующие белки поксвирусов как новые средства иммунокорректирующей терапии // Молекуляр. биология. 2008. Т. 42, №. 5. С. 904–912.
Щелкунов С. Н. Вирус натуральной оспы – источник новых медицинских препаратов // Соросовский образовательный журнал. 1995. № 1. С. 28—31.
Щелкунов С. Н. Генетическая инженерия: Учеб.-справ. пособие. 3-е изд., испр. и доп. Новосибирск: Сиб. универ. изд-во, 2008. 514 с.
Щелкунов С. Н. Преодоление ортопоксвирусами защитных систем организма млекопитающих // Молекуляр. биология. 2011. Т. 45, № 1. С. 30—43.
Щелкунов С. Н. Оспа – дамоклов меч цивилизаций // Наука из первых рук. 2012. № 6 (48). С. 96—109.
Shchelkunov S. N. Orthopoxvirus genes that mediate disease virulence and host tropism // Advances in Virology. 2012. Vol. 2012, Article ID 524743, 17 p. doi:10.1155/2012/524743.
Работа выполнена при финансовой поддержке РФФИ (грант 12-04-00110а)

Обзор
Автор
Редактор
ДНК-вакцины относятся к типу принципиально новых биологических препаратов. С их разработкой связывают большие надежды на повышение эффективности профилактики не только заболеваний бактериальной, вирусной и паразитарной природы, но и аллергических, аутоиммунных и даже онкологических болезней. Более двадцати лет назад возникла идея использовать гены возбудителей заболеваний для активации защитных механизмов. Конструкция ДНК-вакцин гениально проста: главные компоненты в ней — вектор и целевой иммуноген. Но, несмотря на это, ДНК-вакцины не стоят на страже нашего здоровья: их не вводят пациентам в поликлиниках, они не продаются в аптеках.
За 200 лет форма и содержание прививок претерпели существенные изменения: Дженнер инфицировал царапины содержимым оспинных пустул, Пастер облагородил процедуру, вводя ослабленных агентов шприцем, затем научились создавать вакцины из убитых и даже растерзанных возбудителей (сплит- и субъединичные вакцины), недавно начали использовать рекомбинантные вакцины, содержащие один или несколько антигенов (обычно белковых), синтезированных генно-инженерным путем. И вот в двери ВОЗ робко стучится новый плод, порожденный слиянием науки с фарминдустрией, — вакцина из нуклеиновых кислот [2].
Начало ДНК-вакцинологии связывают с работами Д. Танга (1992 г.), в которых была показана способность плазмидной ДНК, экспрессирующей гормон роста человека, индуцировать выработку антител.
В классическом варианте такие вакцины состоят из плазмидных ДНК, содержащих гены возбудителей инфекционных заболеваний (целевые гены, или иммуногены). Продукты данных генов способны вызывать развитие защитных реакций организма, выступая в этом случае в роли антигенов. Доставку ДНК в макроорганизм первоначально осуществляли в комплексе с катионными липидами, однако эффект от введения препарата чистой нуклеиновой кислоты оказался более выраженным. Введенная в организм ДНК проникает в клеточное ядро, превращая клетку в завод по производству вакцины. Такая ДНК длительное время существует вне хромосом без репликации, транскрибируется за счет ферментов хозяйской клетки и экспрессирует соответствующие гены, продукты которых вызывают формирование иммунитета (рис. 1).

ДНК-вакцины сохраняются в организме 3–4 недели. За это время они успевают индуцировать Т- и В-клеточный иммунитет (рис. 2). Однако, несмотря на кажущуюся простоту, многие механизмы развития иммунного ответа на ДНК-вакцины остаются малоизученными [3].

Более чем 20-летняя эволюция ДНК-вакцин продолжается и сегодня. Прогресс в дизайне кодирующих антигены нуклеотидных последовательностей, в оптимизации состава (в том числе включение молекулярных адъювантов), в совершенствовании форм и физических методов доставки позволил второму поколению ДНК-вакцин преодолеть такие проблемы первого поколения, как низкий уровень трансфекции и недостаточная иммуногенность.
Сейчас разработки в области генетических вакцин проводятся во многих странах мира. В настоящее время сконструированы экспериментальные ДНК-вакцины для профилактики инфекционных заболеваний паразитарной (шистосомоз, лейшманиоз), бактериальной (хламидиоз, сибирская язва, микоплазмозы) и вирусной (бешенство, лихорадки Западного Нила и Эбола) природы. На разных стадиях доклинических и клинических испытаний находятся генетические вакцины против вирусов гриппа, гепатитов А и В, герпеса, кори, геморрагических лихорадок, ВИЧ, собачьей чумы, ящура, папилломавирусов, цитомегаловирусов. Столь интенсивное развитие данного направления вакцинологии, вероятно, уже в ближайшей перспективе обеспечит реальный выход в виде эффективных и безопасных вакцинных препаратов, рекомендованных для применения в здравоохранении и ветеринарии.
Чем же ДНК-вакцины хороши?
Но. всё хорошее имеет свои недостатки
- более низкая по сравнению с живыми вакцинами эффективность, особенно по отношению к крупным млекопитающим и человеку, и потому необходимость многократной иммунизации;
- отсутствие эффективной доставки в антигенпрезентирующие клетки;
- формирование иммунитета только в отношении протеиновых компонентов болезнетворных микроорганизмов, поскольку целевые гены кодируют белки. ДНК-вакцины не могут заменить препараты, действие которых основано на использовании антигенных молекул другой природы, например капсульных антигенов, представленных полисахаридами (полисахаридные пневмококковые, менингококковые, брюшнотифозные вакцины и др.);
- вероятность атипического процессинга и биохимических изменений (например, гликозилирования) антигенов в эукариотических клетках;
- возможность ослабления иммунного ответа на целевой антиген из-за иммуногенности вирусных компонентов (при использовании вирусных систем доставки);
- отсутствие данных о безопасности таких вакцин, т.к. не изучены последствия, к которым приводит длительная экспрессия в макроорганизме чужеродной генетической информации;
- возможность развития нежелательных иммунологических реакций в виде хронических воспалительных процессов или генерализованной иммуносупрессии из-за пролонгированной экспрессии антигена в макроорганизме.
Конструкция ДНК-вакцин
Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного белка, необходимо встроить в вектор, роль которого выполняют бактериальная плазмида или вирус [4]. Вектор не должен реплицироваться в клетках макроорганизма, поэтому может содержать только прокариотические сайты инициации репликации.
Для создания ДНК-вакцин используются хорошо изученные плазмиды грамотрицательных бактерий (в основном E. coli), в частности многокопийная pUC19 или pBR322 и их производные. Разработаны специальные векторы для ДНК-вакцин — pcDNA3 и pcDNA3.1 (Invitrogen), которые содержат цитомегаловирусный (ЦМВ) промотор и сигнал полиаденилирования гена гормона роста быка. Также к коммерчески доступным плазмидам, которые чаще всего используются в качестве векторов для ДНК-вакцин, относятся: pVAX1 (Invitrogen), pCI, VR1012 DNA, pJW4303, pVAC1-mcs и pVAC2-mcs (InvivoGen). Последние две применяются для усиления гуморального иммунного ответа и содержат антигены к поверхностным структурам мышечных клеток [5].
Из числа вирусных векторов, обеспечивающих более высокий уровень экспрессии целевого антигена, чаще всего используются: дефектный по репликации аденовирус серотипа 5 (AD5), ортопоксвирусы и модифицированные вирусы осповакцины, альфавирусы. Аденовирусный вектор обладает высокой эффективностью трансфекции — до 100 %, в него можно включать до 8 т.п.н. ДНК. Отрицательный момент — синтез собственных белков, способных индуцировать иммунный ответ. Самые используемые осповакцинные модификации — Ankara (MVA) и New York Vaccinia strain (NYVAC). Первая получена в результате 56-кратного пассирования вируса в куриных эмбриональных фибробластах. В геноме NYVAC удалено 18 открытых рамок считывания, ассоциированных с диапазоном хозяев и вирулентностью. В каждый из перечисленных векторов можно встроить до 50 т.п.н. ДНК [6].
Элементы конструктора

Рисунок 3. Конструкция ДНК-вакцины на основе вектора pVAX1 с химерным геном (Rat cDNA, Human cDNA). Pcmv — цитомегаловирусный промотор; MCS — сайт для множественного клонирования генов; BGH pA — терминатор с сигналом полиаденилирования гена гормона роста быка; Kanamycin — ген устойчивости к канамицину; pUC ori — участок начала репликации плазмид группы pUC; HindIII, BstEII, XbaI — сайты рестрикции. Рисунок из [5].
Чтобы пригодиться для создания ДНК-вакцин, каждый уважающий себя вектор должен содержать необходимые конструкционные элементы (рис. 3).
- Структуры, обеспечивающие репликацию плазмиды (используются ori pUC19, pMB1), и сайты рестрикции.
- Селективные маркеры: гены устойчивости к антибиотикам (но не к пенициллину и другим β-лактамным антибиотикам) [5].
- СpG-мотивы бактерий, которые из-за отсутствия метилирования способны усиливать иммунную реакцию. Данный принцип лежит в основе разработки универсальной вакцины и подразумевает использование не генов, кодирующих белки-антигены микробов, а бактериальных последовательностей CG в качестве активного компонента вакцины [7]. — консенсусная последовательность, окружающая старт-кодон (GCC(A/G)CCAUGG), которая играет важную роль в инициации трансляции у эукариот.
- Промотор для экспрессии целевого гена в клетках эукариот. Наиболее часто используют промоторы вируса SV40, цитомегаловируса (часто вместе с интроном А), промотор бета-актина, промоторы, специфичные для определенных видов ткани (например, промотор гена десмина для экспрессии в миоцитах, промотор гена гидроксилазы витамина D3 — в кератиноцитах, альбуминовый — в гепатоцитах). Применение промотора и системы синтеза бактериофага Т7 позволяет осуществлять экспрессию целевого гена без участия транскрипционной системы клеток макроорганизма и, соответственно, без перемещения вектора в ядро [8].
- Целевой ген, кодирующий белок патогена. Он также может содержать дополнительные нуклеотидные последовательности, кодирующие лиганды для рецепторов антигенпредставляющих клеток. Такими последовательностями могут выступать гены маркерного белка CD40, внеклеточного домена Fms-подобной тирозинкиназы-3 или антигена-4 Т-киллеров. Облегчение деградации антигена в протеасоме или лизосоме также будет стимулировать иммунную реакцию. Поэтому для усиления протеолитического расщепления антигена в его последовательность встраивают сигнал убиквитинирования [9, 10].
- После целевого гена следуют сигналы полиаденилирования, например, вируса SV40, гена β-глобина кролика или гормона роста быка.
- Замыкают эту цепочку стоп-кодоны, причем часто используются двойные или тройные терминирующие последовательности (TAGTGATGA).
Службы доставки
Способам введения ДНК-вакцин в организм уделяется не меньше внимания, чем созданию самих конструкций, так как от этого зависит успех иммунизации в целом. Поэтому разработаны различные, порой весьма хитроумные, методы доставки таких вакцин в организм.

Самый простой — это парентеральный способ введения, который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно). При этом бόльшая часть ДНК поступает в межклеточное пространство и только потом включается в клетки.
Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки.
Микроконтейнеры из полиматериалов. Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Если микросферы в полимерной оболочке поместить в подкисленный раствор, карбонат кальция внутри растворится и уйдет через полимерную мембрану. Внутри останется только ДНК, подлежащая транспортировке. Подобных микроконтейнеров для доставки ДНК разработано не так много. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1–2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Если в микрочастицу вместе с ДНК или лекарством поместить фермент, расщепляющий оболочку капсулы изнутри, то высвобождением лекарства можно управлять: чем меньше фермента, тем медленнее рушится оболочка.
Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке.
ДНК-вакцины можно вводить перорально с использованием бактериальных носителей. Для этих целей применяются, например, модифицированные бактерии Shigella flexneri с делецией в гене asd. Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, так как отсутствует упомянутая кислота, а продуцируют закодированные в плазмиде антигены [6]. Для перорального введения создан вектор на основе ослабленного штамма Salmonella, который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. Для этого бактерию модифицировали таким образом, что ее выживание стало зависеть от наличия искусственных сахаров, не встречающихся в условиях организма. После того как в клетках, зараженных генно-инженерным штаммом Salmonella, заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели [11].
Разработана технология доставки ДНК-вакцин с использованием бактериофагов [12]. В данном случае вакцинная ДНК встраивается в геном вектора-бактериофага, которым затем иммунизируют макроорганизм [13].
Нужно учитывать, что разные методы доставки ДНК-вакцин в организм обеспечивают развитие различных клеточных реакций, при этом важные иммунологические пути могут быть стимулированы или, наоборот, не задействованы в ходе развития защитного ответа. Способы и места введения ДНК-вакцин варьируют для разных видов организмов. Например, уши свиньи — отличное место для инъекций, а вот введение препарата в уши овец или коров неэффективно.
Помощники генетических вакцин
Для усиления иммунного ответа, вызванного ДНК-вакцинами, совместно с ними вводят различные адъюванты, например, плазмиды, кодирующие синтез цитокинов, гранулоцитарно-макрофагального колониестимулирующего фактора и других костимуляторных молекул (B7.1 (CD80), B7.2 (CD86) и CD40) [14].
Для ДНК-вакцины против ВИЧ создана конструкция, которая обеспечивает получение более высокого титра антител и его сохранность в течение более длительного времени по сравнению с обычной ДНК-вакциной. Эта молекулярная вирусоподобная конструкция представляет собой частицы диаметром 25-30 нм, содержащие в центре полинуклеотидный комплекс — рекомбинантную плазмиду pGEX-2T-TBI с генами инфекционного агента ВИЧ-1 или двухцепочечную РНК, которая является стимулятором неспецифической резистентности организма. На поверхности конструкции располагаются гибридные белки, содержащие эпитопы ВИЧ-1 и фермент (например, глутатион-S-трансферазу или галактозидазу). Связь между полинуклеотидным комплексом и гибридными белками осуществляется посредством конъюгата: спермидин (для связи конъюгата с полинуклеотидным комплексом) — полиглюкин — субстрат для фермента (например, глутатион или галактопиранозид; для аффинной сорбции гибридных белков на конструкцию).
Современное состояние ДНК-вакцинологии
В настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии как человека, так и животных.
Разработке способов вакцинотерапии онкологических заболеваний при помощи рекомбинантных ДНК большое внимание уделяют и другие организации. Хорошую эффективность показала ДНК-вакцина против лейкемии, созданная в Саутгемптонском университете (но вводимая с помощью электропоратора всё той же Inovio). Вакцина направлена на подавление в организме активности гена WT1 (Wilms tumor gene). Именно повышенная активность этого гена отмечается в опухолевых клетках различных видов. В ходе I фазы клинических испытаний у пациентов наблюдалось развитие иммунного ответа, в том числе активация Т-киллеров и выработка антител; была также доказана безопасность новой вакцины. Испытания перешли в фазу II, однако из-за проблем с финансированием организаторы пока не могут увеличить число участников [16].
Животные нуждаются в такой же защите, как и люди. В связи с этим для ветеринарии разрабатываются ДНК-вакцины против бычьего и лошадиного герпесвирусов, собачьего вируса чумы, вируса классической свиной лихорадки, кроличьей папилломы, ящура, вируса инфекционного гемопоэтического некроза, вируса гриппа, вируса японского энцефалита, вируса бешенства, вируса везикулярного стоматита и т.д. [13]. Много ДНК-вакцин создается для борьбы с вирусными, бактериальными и эукариотическими патогенами рыб [17].
Активно разрабатываются ДНК-вакцины для повышения иммунитета птиц. Многокомпонентные ДНК-вакцины могут сократить количество прививок, необходимых во время короткой жизни птиц и позволят избежать риска увеличения вирулентности некоторых патогенов. В случае птицеводства проблема связана с тем, что вакцины вводятся в амниотическую жидкость яиц, которая обладает ДНКазной активностью, поэтому свойства ДНК-вакцины могут ухудшиться. Заключение ДНК в катионные липосомы, скорее всего, поможет решить эту проблему.
Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, причем повезло в этом плане только животным (табл. 1).
Диагностика вируса натуральной оспы. Лечение натуральной оспы. Профилактика натуральной оспы.
Диагностика вируса натуральной оспы включает вирусоскопические, вирусологические и серологические методы. Материал для исследований — содержимое пузырьков и отделяемое пустул.
• Наиболее эффективный метод диагностики вируса натуральной оспы — электронная микроскопия материала. При отсутствии соответствующего оборудования можно проводить световую микроскопию окрашенных мазков для выявления телец Пашена-Гварнери (ацидофильные овальные структуры, располагающиеся около ядра). Для экспресс-диагностики проводят определение вирусных Аг в мазках-отпечатках с помощью РНИФ. В отделяемом пузырьков и пустул вирусные Аг определяют в реакциях иммунодиффузии, РСК или ИФА.
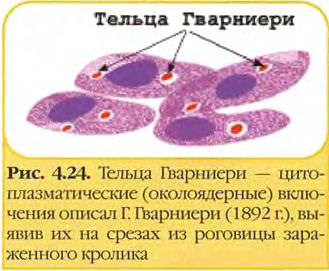
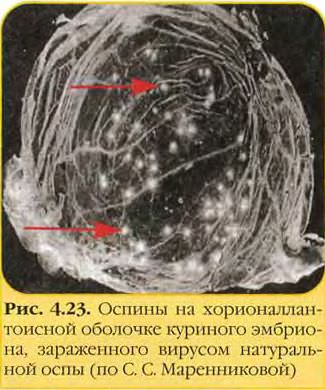
• Выделение возбудителя натуральной оспы проводят заражением хорион-аллантоисной оболочки куриных эмбрионов, где вирус образует белёсые бляшки. Также можно использовать культуры фибробластов эмбриона человека или клеток почек обезьян и оценивать цитопатический эффект (изменение морфологии и гибель клеток). Характер повреждений, а также предельная температура размножения вируса помогают дифференцировать возбудителя натуральной оспы от вирусов оспы животных (обезьян, верблюдов, коров и т.д.).
• Идентификацию возбудителя натуральной оспы проводят в РН, РТГА и РПГА.
Лечение и профилактика натуральной оспы
Средство этиотропной химиотерапии натуральной оспы — метисазон. В большинстве случаев также проводят симптоматическое лечение, сочетая его с введением противооспенного овечьего или человеческого иммуноглобулина и обработкой антисептиками поражений на коже и слизистых оболочках.
Для иммунопрофилактики натуральной оспы использовали живые вакцины. Невосприимчивость развивается через 7-10 дней после вакцинации.
Вакцинопрофилактика натуральной оспы обеспечивает невосприимчивость к заболеванию в течение 3-5 лет. На эффективность вакцинации указывает факт ликвидации заболевания во всём мире. В связи с декларацией ВОЗ в настоящее время вакцинацию не проводят.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

