При токсическом гепатите вызванном парацетамолом антидотом является
Обновлено: 19.04.2024
АЦЦ при отравлении парацетамолом как антидот
АЦЦ (N-ацетилцистеин) представляет собой N-ацетилированное производное природной аминокислоты L-цистеина.
Пероральная биодоступность АЦЦ низка, возможно, вследствие интенсивной метаболизации согласно эффекту первого прохождения. В стационарном состоянии объем распределения составляет 0,6 л/кг. Период полувыведения при внутривенном применении близок к 6 ч.
Удаляется антидот из организма к основном с мочой в виде неорганического сульфата, несколько меньшего количества таурина и исходного АЦЦ. Фармакокинетические исследования показывают, что средняя максимальная концентрация АЦЦ в плазме равна 554 мг/л после внутривенного введения первой ударной дозы 150 мг/кг. В это время наиболее вероятно развитие отрицательных реакций.
Показания. АЦЦ (N-ацетилцистеин) показан при лечении передозировки ацетаминофена в следующих случаях.
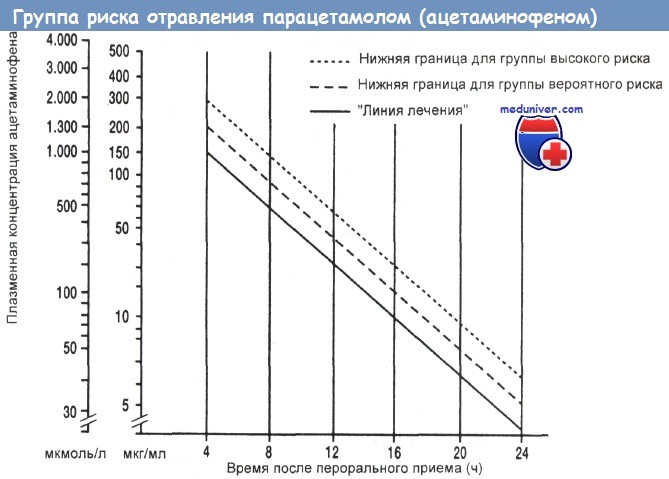
1. Плазменная концентрация ацетаминофена через 4— 12 ч после его перорального приема находится выше "линии лечения", показанной на рисунке ниже.
2. Принята внутрь однократная доза ацетаминофена более 100 мг/кг, а его плазменную концентрацию определить невозможно.
3. Налицо или весьма вероятна острая индуцированная ацетаминофеном печеночная недостаточность.

Пероральный АЦЦ — единственный официально утвержденный в США антидот для всеобщего применения при передозировках ацетаминофена. Он отнесен к категории экспериментальных лекарств с ограниченной доступностью. АЦЦ обеспечивает максимальную защиту от гепатотоксичности, если его вводят до истечения 8—10 ч после передозировки ацетаминофена.
Затем эффективность его применения снижается, хотя даже при использовании не более чем через 16 ч после передозировки не отмечено ни одного летального исхода. По поводу пользы АЦЦ через 14—36 ч после нее данные противоречивы. Исследования в гепатологическом отделении больницы Королевского колледжа в Лондоне показали, что внутривенное введение АЦЦ в период до 72 ч после передозировки снижает риск прогрессирования печеночной энцефалопатии до III/IV степени этого расстройства и смертность от молниеносной печеночной недостаточности.
Поздняя АЦЦ-терапия не связана с повышенной опасностью отрицательных эффектов. Вероятно, при раннем применении посредством АЦЦ можно защитить как печень, так и почки. По-видимому, при вызванной ацетаминофеном гепатотоксичности введение этого антидота оправдано вне зависимости от того, сколько времени прошло после приема последней дозы лекарства.
Начало и продолжительность лечения отравления парацетамолом ацетилцистеином (АЦЦ). Если, исходя из анализа номограммы, принято решение начать АЦЦ-терапию, ее курс следует провести независимо от дальнейшего снижения уровня ацетаминофена, т. е. даже при его плазменных уровнях ниже "линии лечения" прекращать введение антидота не стоит. Пациенты с подозрением на слабую передозировку могут ждать уточнения концентрации ацетаминофена в плазме в течение 10—12 ч после его перорального приема без введения АЦЦ, если таковое вообще потребуется.
В качестве пероральной ударной дозы 140 мг/кг дают 5 % раствор АЦЦ. Концентрация имеющихся в продаже препаратов 10 и 20 %, поэтому их необходимо разводить. Для этого подходит обычная вода и даже газированный ароматизированный напиток. Затем через каждые 4 ч пациенту дают еще 17 доз по 70 мг/кг в виде аналогичного 5 % раствора. В результате за 72 ч суммарная доза составит 1330 мг/кг.
Внутривенное введение АЦЦ (N-ацетилцистеина). В Великобритании и Канаде АЦЦ применяют как перорально, так и внутривенно. К преимуществам внутривенной АЦЦ-терапии относится возможность лечения больных с тошнотой и рвотой, а также одновременного использования активированного угля без снижения плазменного уровня антидота.
Хотя катамнестических клинических испытаний по сравнению пероральной и внутривенной эффективности АЦЦ не проводилось, судя по данным одного ретроспективного контролируемого исследования, не исключено, что при позднем начале терапии (спустя более 16 ч после передозировки) ее первый способ дает лучшие результаты. Показания к внутривенному применению АЦЦ такие же, как и для назначения антидота внутрь.
20-часовая схема. Этот подход заключается во внутривенном введении 150 мг/кг в 200 мл 5 % раствора декстрозы в течение 15 мин, затем 50 мг/кг в 500 мл 5 % раствора декстрозы за 4 ч, а после этого — еще 100 мг/кг в 1 л 5 % раствора декстрозы в течение 16 ч. Таким образом, суммарную дозу 300 мг/кг вливают за 20 ч. Эта схема эффективно предупреждает поражение печени, почечную недостаточность и летальный исход, если лечение начато в течение 8 ч после передозировки, а при более позднем начале эффективность быстро снижается. В Великобритании АЦЦ вводят внутривенно в 5 % растворе глюкозы. Если во время вливания у пациента появляются стридор, приливы или гипотензия, терапию прерывают и проводят симптоматическое лечение вероятной аллергической реакции.
Внутривенное введение АЦЦ в течение 20 ч снижает смертность при использовании даже через 24—36 ч после передозировки. Позднее (через 36 ч после нее) начало такой терапии безопасно.
Доза АЦЦ (ацетилцистеина) при отравлении парацетамолом. Выпускаемый сейчас препарат АЦЦ (Mucomyst) разработан для ингаляционного применения и может содержать примеси. Возможность удалить их с помощью миллипоровых фильтров не изучалась. Минимальная эффективная доза не установлена, хотя внутривенно вводят меньше АЦЦ, чем перорально. Средняя стационарная концентрация АЦЦ после 12 ч 20-часового курса составляет 35 мг/л. Эффективность АЦЦ, по-видимому, сходна при обоих способах введения. Оптимизация терапии по дозировкам и продолжительности для пациентов из групп высокого риска, которых лечат через 16 ч после передозировки, требует проведения дальнейших клинических испытаний.
Нежелательные эффекты применения АЦЦ при отравлении парацетамолом:
а) Пероральная форма. АЦЦ (ацетилцистеин) не гепатотоксичен. Его неприятный запах сводится к минимуму, если пить препарат через соломинку. Если пациент не переносит пероральной формы АЦЦ, альтернативой является введение его через назогастральную или дуоденальную трубку (фирм Miller-Abbort, Cantor) с внутривенной инъекцией метоклопрамида в дозе 1 мг на 1 кг массы тела. Внутривенные дозы ондансетрона 0,15 мг/кг через каждые 8 ч (всего три раза) также повышают переносимость перорального АЦЦ. Системных анафилактических реакций при таком способе введения антидота не отмечалось. Изредка наблюдается сульфгемоглоби-немия (цианоз с сердечно-дыхательной недостаточностью, повышением уровня сульфгемоглобина и нормальным насыщением крови О2).
б) Внутривенная форма. Примерно в 3—9 % случаев спустя приблизительно 15—60 мин после начала внутривенного введения АЦЦ наблюдаются анафилактоидные реакции (тромбоцитопения, сыпь, приливы, боль в груди, тахикардия, лихорадка, гипотензия, ангионевротиче-ский отек, бронхоспазм). Они зависят от сывороточной концентрации антидота (обычно начинаются, когда последняя превышает 500 мкг/л) и, вероятно, обусловлены неиммунологическим механизмом выделения гистамина. В большинстве случаев такие реакции слабые и обычно купируются антигистамин-ными агентами, адреналином или снижением скорости вливания АЦЦ.
АЦЦ при отравлении парацетамолом (ацетаминофеном) пролонгированного действия
Эта пероральная форма, по-видимому, сходна с таблетками в пленочной оболочке Tylenol Extra Strength (500 мг). Назначают по 2 таблетки (в сумме 1300 мг) каждые 8 ч взрослым и детям в возрасте от 12 лет. Рекомендуемая доза не должна превышать 6 таблеток (3900 мг) за 24 ч. Время до достижения пика уровня в крови после приема 1300 мг составляет около 1—2 ч. Клинических и токсикологических контролируемых исследований передозировки не проводилось. Лечение острых случаев, если с момента приема прошло не более 8 ч, предусматривает стандартные процедуры по очистке пищеварительного тракта, определение начального уровня ацетаминофена в крови и его уровней через 4 ч и позже.
Если они соответствуют области выше линий номограммы, назначают АЦЦ. Уровни ниже 10 мкг/мл, по-видимому, не токсичны. Если они ниже линии вероятной токсичности, но выше 10 мкг/мл, надо начать АЦЦ-терапию и повторно определять уровень ацетаминофена через 4—6 ч. Если пациент поступил поздно или принял высокую дозу ацетаминофена, антидот начинают вводить еще до получения первых результатов анализа. Если после вливания стандартных 17 доз уровни ацетаминофена еще выявляются, можно подумать о продлении АЦЦ-терапии.
Douglas и соавт. считают, что после однократной передозировки токсикокинетика пролонгированной и обычной форм парацетамола (ацетаминофена) примерно одинакова, т. е. первый случай не требует альтернативного диагностического подхода. Однако, по мнению Graudins и соавт., измерение уровня ацетаминофена после массивной передозировки его пролонгированной формы может привести к недооценке важности антидота, если пользоваться номограммой, основанной на применении обычных препаратов парацетамола.
Потенциально еще сильнее ограничивает роль таких номограмм позднее всасывание лекарства. Нетоксичные уровни парацетамола (ацетаминофена) на этих графиках не исключают последующей гепатотоксичности. Temple и Mrazik полагают, что при передозировке пролонгированной формы ацетаминофена его плазменные уровни надо измерить как минимум через 4 ч после приема, а затем еще через 4—6 ч. Если какое-либо из полученных значений выше линии потенциальной токсичности на номограмме Рамэка— Метью, необходимо провести полный курс ацетилцистеиновой терапии. Если они ниже этой линии, токсичность маловероятна. Однако если второе значение выше первого или находится рядом с областью потенциальной токсичности, желательно дополнительно измерить концентрации ацетаминофена и начать или продолжить введение антидота.
Если тип принятого ацетаминофенового препарата точно не известен, целесообразно лечить как в случае передозировки формы с пролонгированным действием. Номограмма необходима при передозировке ацетаминофена пролонгированного действия, когда первоначальные уровни вещества в плазме не находятся в потенциально токсичных пределах.
Передозировка АЦЦ (N-ацетилцистеина)
Самые тяжелые реакции на внутривенное введение АЦЦ связаны с применением его избыточных доз. Признаки передозировки сходны с анафилактоидными реакциями, но симптомы тяжелее. Сердечно-сосудистый коллапс и смерть ребенка в возрасте 4 лет совпали по времени с внутривенным введением ему АЦЦ при плазменном уровне ацетаминофена ниже "токсичной" линии. С внутривенной АЦЦ-терапией связано несколько летальных исходов, однако потенциальная роль в этих случаях молниеносной почечной недостаточности не позволяет сделать окончательные выводы о значении АЦЦ с точки зрения причины гибели больных.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Токсический гепатит – поражение печени промышленными, сельскохозяйственными и бытовыми химическими веществами, гепатотропными ядами, приводящее к воспалительной реакции и некрозу гепатоцитов, изменению реактивности печени. Клинически проявляется гепатомегалией и болью в правом подреберье, желтухой, диспепсическими явлениями, энцефалопатией, асцитом, анорексией. Диагностика включает клинический и биохимический анализы крови, УЗИ, КТ либо МРТ печени и допплерометрию ее сосудов, биопсию, радиоизотопное исследование. Лечение направлено на прерывание контакта с токсическим веществом, выведение его из организма, проведение симптоматической терапии, трансплантации печени.
Общие сведения
Токсический гепатит – поражение печени острого, подострого либо хронического характера, развивающееся в результате попадания в организм токсических веществ, которые губительно воздействуют на клетки печени, вызывая их некроз. Токсическое поражение печени встречается не так уж часто – не более 1-2 случаев на 100 тысяч населения в год. Среди всех госпитализированных в отделения гастроэнтерологии в РФ токсические гепатозы, вызванные приемом гепатотропных ядов, выявляются примерно у 3% пациентов. Среди причин формирования печеночной недостаточности данная патология занимает второе место после алкогольного гепатита. Изучением гепатотоксичности различных химических веществ занимаются ведущие гепатологи, гастроэнтерологи и токсикологи всего мира.

Причины токсического гепатита
В зависимости от строения все гепатотоксичные химические вещества подразделяются на несколько групп. К первой группе относят хлорированные углеводороды – хлороформ, дихлорэтан, четыреххлористый углерод, хлористый метил, этилхлорид и другие. Эти вещества применяются в производстве автомобилей, самолетов, огнетушителей, в машиностроении, при пошиве обуви, в химчистках, для дезинфекции, дезинсекции и дегельминтизации, в качестве растворителей жиров. В организм проникают через кожу, при дыхании и употреблении внутрь. Выделяются легкими, почками, кишечником. Четыреххлористые углеводороды воздействуют на эндоплазматический ретикулум, разрушая ферментативные системы гепатоцита; усиливают переокисление ненасыщенных жирных кислот в клеточных мембранах.
Вторая группа веществ включает дифенилы и хлорированные нафталины – они используются в оболочках электропроводов, в электроконденсаторах, могут применяться в качестве аналогов воска, смолы, каучука. Третья группа состоит из бензола и его производных: анилина, толуола, тринитротолуола и др. Эти соединения в последние годы активно эксплуатируются в промышленности при производстве взрывчатых веществ, органических красок. В кровоток попадают после контакта с кожей, слизистыми оболочками, при приеме внутрь.
В четвертой группе находятся металлоиды и металлы – золото, фосфор, мышьяк, олово, ртуть, свинец. В настоящее время данные химические элементы в промышленности используются редко, производители стараются найти им более безопасную замену. Тяжелые металлы связываются с сульфгидрильными группами, блокируя активность печеночных ферментов. В отдельную группу выносят природные гепатотропные яды (ядовитые грибы, семена гелиотропа опушенного), сельскохозяйственные и бытовые инсектициды.
Все химические вещества, попадающие в организм, подвергаются разрушению либо связыванию. Основную роль в этих процессах играет печень. Некоторые вещества и их производные, образующиеся при биотрансформации, могут оказывать токсическое действие на гепатоциты. При этом гепатотоксичность может быть истинной (возникает у всех людей при введении определенной дозы вещества в организм) либо проявляться идиосинкразией (индивидуальная гиперчувствительность организма к данному соединению). Механизм действия гепатотропного яда зависит от его химического строения и дозы, однако результатом в любом случае будет разрушение клеток печени и сбой обменных процессов в ней.
Разрушающее влияние перечисленных токсических веществ значительно усиливается, если в прошлом гепатоциты подвергались воздействию больших доз алкоголя, гепатотоксичных лекарственных препаратов, вирусов и бактерий. Также токсический гепатит быстрее развивается у людей, страдающих истощением и дефицитом белка в организме.
Симптомы токсического гепатита
Для всех токсических гепатитов характерно наличие двух групп симптомов: признаков поражения непосредственно печени (желтуха, гепатомегалия, боли в правом подреберье) и признаков токсического воздействия на другие органы (зависят от химического строения отравляющего вещества).
Острое поражение четыреххлористыми углеводородами манифестирует симптомами повреждения головного мозга: угнетение сознания вплоть до комы в пределах одних-двух суток, головная боль, выраженная слабость. Затем присоединяются желтуха, тошнота, рвота, понос, повышение температуры до субфебрильных цифр, затрудненное дыхание, синюшный цвет кожи, желудочно-кишечные кровотечения. Смерть от острой печеночной недостаточности может наступить в течение нескольких дней – двух недель (в зависимости от дозы токсина). Хроническое отравление данными химическими веществами проявляется головной болью, болью в области печени, диспепсическими явлениями, слабостью. Постоянный контакт с четыреххлористыми углеводородами может привести к развитию цирроза печени на протяжении нескольких месяцев.
Для отравления производными бензола характерен токсический гепатит, которому сопутствуют апластическая анемия, поражение головного мозга, катаракта. Постоянный контакт с бензолом приводит к развитию хронического токсического гепатита, сопровождающегося геморрагическим синдромом, асцитом, циррозом печени.
Отравление мышьяком клинически проявляется желтухой, увеличением размеров печени, нарушением функции почек и периферических нервов. Для поражения фосфором, кроме симптомов токсического гепатита, характерны повышенная кровоточивость, гипогликемия. Токсический гепатит при воздействии меди развивается только в случае попадания в организм более одного грамма этого химического элемента, смерть – при превышении дозы в 10 грамм. Симптомы отравления медью – острая боль в области желудка, тошнота, рвота, профузный понос, кровотечения, уменьшение объема мочи. Смерть наступает от фульминантной почечной и печеночной недостаточности. Токсическое поражение печени железом напоминает отравление медью.
При употреблении ядовитых грибов клиническая картина токсического гепатита развивается в течение ближайших двадцати часов. Также поражаются почки, центральная нервная система. Пациенты предъявляют жалобы на желтушность кожных покровов, тошноту, рвоту, сильные боли в животе, диарею. Выраженная дегидратация и дисэлектролитемия приводят к сбоям в работе сердечно-сосудистой системы (нарушения ритма вплоть до остановки сердца) и головного мозга (судорожный синдром, угнетение сознания). Острый некроз печени приводит к прекращению ее белково-синтезирующей функции, что проявляется массивным геморрагическим синдромом. Каждый второй больной погибает от печеночной энцефалопатии, уремии, сердечно-сосудистых нарушений; у остальных формируется цирроз печени.
Употребление злаков, зараженных семенами гелиотропа, чаще всего приводит к хронической интоксикации, проявляющейся симптомами токсического поражения печени и вено-окклюзионной болезни (желтуха, гепатомегалия, боли в правом подреберье, асцит, ожирение).
При отравлении инсектицидами данные химические соединения накапливаются в жировых клетках печени и других органов, что ведет к формированию полиорганной недостаточности: токсического гепатита, миокардита, нефрита, поражения центральной нервной системы, развития агранулоцитоза. При хроническом поражении инсектицидами, помимо клинической картины токсического поражения печени, пациент отмечает появление полирадикулопатий, болей в сердце, нарушения функций почек; в анализах выявляют анемию и лейкопению. После прекращения воздействия инсектицида на организм данные патологические изменения быстро регрессируют.
Диагностика
Лабораторная диагностика токсического гепатита не позволяет выявить специфичные признаки данной патологии. Следует помнить, что у 3% здоровых людей печеночные пробы могут быть изменены, еще примерно у 5% их изменение никак не связано с поражением печени. И наоборот, примерно в 10% случаев токсического гепатита лабораторные показатели будут находиться в границах нормы. Оценка тяжести поражения печени проводится на основании исследования уровней общего билирубина и его фракций, трансаминаз, ферментов (ЩФ, ГГТП, ЛДГ), альбумина и протромбина. Для выявления некоторых гепатотоксичных веществ возможно проведение специальных лабораторных тестов. Обязательно проводят исследования на вирусные гепатиты, ВИЧ.
Из инструментальных методов в диагностике токсического гепатита используют УЗИ, КТ и МРТ печени, допплерометрию печеночных сосудов, эластографию, радиоизотопное исследование гепатобилиарной системы. Перечисленные методики не дают возможности определить этиологию гепатита, но позволят подтвердить поражение печени. Наиболее точным способом оценки морфологических изменений при токсическом гепатите является биопсия печени с последующим гистологическим исследованием биоптатов.
Токсический гепатит следует дифференцировать с поражением печени алкоголем, медикаментами, бактериями, вирусами и паразитами; с желчнокаменной болезнью, раком печени и другими опухолями данной локализации, аутоиммунным гепатитом, пороками развития печени и ЖВП, болезнями обмена веществ, острым панкреатитом, реактивным гепатитом.
Лечение токсического гепатита
Основное направление лечения токсического гепатита любой этиологии – прекращение контакта с химическим агентом, обезвреживание и быстрое выведение его из организма. При отравлении тяжелыми металлами антидотами являются унитиол, тиосульфат натрия (для ртути, мышьяка, свинца); дефероксамин (для железа); бензиламин, глюкокортикостероиды (для меди). Всем пациентам обязательно назначают витамины группы В, фолиевую, никотиновую и аскорбиновую кислоты. Если на фоне токсического гепатита развилась тяжелая печеночная и/или почечная недостаточность, проводят гемодиализ. При формировании фульминантной печеночной недостаточности может потребоваться трансплантация печени.
Прогноз и профилактика
В большинстве случаев проявления токсического гепатита регрессируют после прекращения контакта с ядовитым веществом, наступает полное выздоровление. После тяжелого токсического поражения печени с массивным некрозом гепатоцитов развивается цирроз печени, в редких случаях – рак печени.
Профилактика токсического гепатита заключается в строгом соблюдении техники безопасности при контакте с токсичными веществами, проведении регулярных медицинских осмотров всего контингента контактирующих с токсинами рабочих (для своевременного выявления лиц с патологией печени и недопущения их к работе с токсическими химическими соединениями), налаживании здорового питания с достаточным количеством белка, борьбе с алкоголизмом.
Лекарственная гепатотоксичность — это появление структурно-функциональных поражений печени, вызванных приемом фармацевтических препаратов. Заболевание проявляется дискомфортом и болями в области правого подреберья, желтухой, диспепсическими расстройствами. Зачастую развивается интоксикационный синдром, присоединяется неврологическая симптоматика. Для диагностики проводятся лабораторные исследования (гемограмма, печеночные пробы, определение маркеров вирусных гепатитов) и инструментальные методы (УЗИ, биопсия). Лечение предполагает отмену провоцирующих лекарственных средств, назначение гепатопротекторов и инфузионной терапии.
МКБ-10
Общие сведения

Причины
Вызывать поражение печени могут более 1200 видов лекарственных препаратов, около 200 из которых имеют доказанный гепатотоксический эффект. Наиболее часто негативные реакции вызваны приемом нестероидных противовоспалительных средств, антибиотиков и медикаментов, влияющих на ЦНС. Это обусловлено не только их потенциальной гепатотоксичностью, но и повсеместным бесконтрольным использованием. Развитию состояния способствуют:
Факторы риска
К факторам риска относят генетические особенности работы печеночных ферментов, которые отвечают за метаболизм ксенобиотиков. Лекарственные поражения чаще отмечаются у пациентов пожилого возраста, что обусловлено полиморбидностью и замедленным выведением медикаментов из организма. Вероятность лекарственной гепатотоксичности возрастает у людей с избыточной массой тела, что связано со способностью жировой ткани задерживать химические вещества.
Патогенез
Высокая чувствительность печеночной паренхимы к действию лекарств объясняется тем, что этот орган является первым на пути метаболизма ксенобиотиков. В гепатоцитах происходят реакции биотрансформации большинства лекарственных препаратов. Биохимические реакции сопряжены с риском образования свободных радикалов, других потенциально токсичных соединений, которые повреждают гепатоциты.
Патофизиологи различают 2 основных механизма повреждающего действия медикаментов. Специфическое поражение основано на непосредственном влиянии химических веществ на гепатоциты, сопровождающемся их разрушением. При неспецифической гепатотоксичности происходит общее отравление организма и нарушение показателей гомеостаза. Эти изменения провоцируют вторичное повреждение паренхимы органа.
Классификация
Все реакции гепатотоксичности по направленности действия систематизируют на 2 группы: цитотоксические (стеатоз, некроз, канцерогенез) и холестатические (задержка желчевыделения, желтухи). Для постановки диагноза и определения рациональных подходов к лечению применяется классификация по морфологическим признакам лекарственных поражений. Согласно ей выделяют следующие варианты:
- Гепатит. Острые и хронические воспалительные процессы в печеночной паренхиме занимают около 40% в структуре гепатотоксичности. Они развиваются при назначении ряда лекарственных средств: противотуберкулезных антибиотиков, цитостатиков, гипотензивных и антиаритмических лекарств.
- Жировая дистрофия. Специфические изменения в паренхиме, сопровождающиеся некрозом гепатоцитов, в основном обусловлены лечением цитостатиками и антибиотиками. Реже стеатогепатит вызывают НПВС, противоэпилептические препараты.
- Веноокклюзионная болезнь. Обструкция печеночных венул становится результатом длительного использования иммунодепрессантов и цитостатиков. Такой вид гепатотоксичности чаще наблюдается у пациентов онкологических стационаров.
- Фиброз. Склероз паренхимы с последующей портальной гипертензией — типичное последствие иммуносупрессивной терапии. Реже патологическое состояние связано с употреблением жирорастворимых витаминов, препаратов железа, противоподагрических средств.
- Холестазы. По характеру повреждения различают каналикулярную (преходящую дозозависимую желтуху) и стойкую дуктулярную форму. Холестатическая гепатотоксичность проявляется как осложнение приема нейролептиков, гормонов, иммуносупрессантов.
Симптомы лекарственной гепатотоксичности
Для заболевания характерны разнообразные клинические признаки, которые определяются морфологическим вариантом поражения и тяжестью основной патологии. Симптомы острого поражения появляются спустя 4-5 дней от начала лечения препаратом. При хроническом повреждении печени состояние ухудшается после нескольких месяцев лечения. Типичным симптомом является тяжесть и дискомфорт справа в подреберье.
Общие симптомы гепатотоксичности представлены слабостью, головной болью, повышением температуры тела. Иногда на коже образуются сосудистые звездочки, синяки. Системная токсичность лекарственных препаратов проявляется неврологическими симптомами. Отмечается беспричинное возбуждение или, наоборот, угнетенное состояние больного. При тяжелых токсических поражениях нарушается ориентация в пространстве, возникает тремор.
Осложнения
Вовремя не диагностированная лекарственная гепатотоксичность осложняется серьезными структурными поражениями органа. Патология лежит в основе около 25% случаев фульминантной печеночной недостаточности. В США и странах Европы лекарственные реакции на фармацевтические препараты являются основной причиной трансплантации печени. Общая смертность при осложненных формах гепатотоксичности составляет 5-11%.
Диагностика
Постановка диагноза лекарственной гепатотоксичности представляет сложности даже для опытных гепатологов, поскольку четкие критерии этого состояния отсутствуют. Принципы диагностического поиска базируются на исключении альтернативной причины поражения печени. Для обследования подбирается комплекс лабораторных и инструментальных методов:
- Анализы крови. В гемограмме обнаруживают умеренный лейкоцитоз, повышение СОЭ. При длительном течении заболевания наблюдается анемия, тромбоцитопения. В биохимическом анализе крови выявляют гипопротеинемию, гипоальбуминемию, реже — увеличение острофазовых белков.
- Печеночные пробы. Для лекарственных форм поражения гепатоцитов характерен лабораторный синдром цитолиза — повышение уровней ферментов АЛТ, АСТ, ГГТП в 2-3 раза и более. Типично увеличение показателей обеих фракций билирубина. На синдром холестаза указывает рост щелочной фосфатазы и холестерина.
- Анализы на маркеры гепатитов. Для исключения вирусной этиологии процесса проводится ИФА для определения антител и антигенов HAV, HBV, HCV. У некоторых больных медикаментозное поражение сочетается с гепатитами, поэтому для оценки активности процесса рекомендована реакция ПЦР.
- УЗИ печени. К ультразвуковым критериям диагностики лекарственной гепатотоксичности относят увеличение размеров органа и неоднородную структуру паренхимы. Для хронических процессов патогномонично уплотнение глиссоновой капсулы, периваскулярный фиброз. Реже отмечается расширение внутрипеченочных желчных ходов.
- Биопсия печени. Инвазивный метод применяется в сложных случаях, когда нельзя исключить вирусное, сосудистое или аутоиммунное повреждение гепатоцитов. При микроскопическом исследовании биоптатов определяют перипортальные или ступенчатые некрозы, мононуклеарную инфильтрацию, признаки фиброза.
Лечение лекарственной гепатотоксичности
Первым шагом в лечении клинических проявлений гепатотоксичности является отмена или замена препарата, вызвавшего симптомы. В ряде случаев медикаментозная терапия является жизненно необходимой, поэтому врач должен тщательно взвесить все плюсы и минусы назначенного лечения. Традиционно используются патогенетические схемы, которые включают следующие группы лекарственных средств:
- Гепатопротекторы. Препараты повышают функциональную способность органа, стабилизируют мембраны гепатоцитов и стимулируют клеточную регенерацию. Чаще всего рекомендуют средства на основе эссенциальных фосфолипидов, метионина, растительных экстрактов.
- Урсодезоксихолевая кислота. Показана при гепатотоксичности, протекающей с выраженным синдромом холестаза. УДХК нормализует процессы желчеобразования и желчевыделения, обладает иммуномодулирующими свойствами. Лекарство ускоряет выздоровление при любом морфологическом типе заболевания.
- Инфузионные растворы. Кристаллоиды и синтетические коллоиды вводятся при выраженной желтухе, токсической энцефалопатии. Для быстрого связывания и выведения лекарственных метаболитов применяют растворы альбумина.
Прогноз и профилактика
Вероятность полного выздоровления определяется формой и длительностью состояния. При остро возникшей гепатотоксичности не успевают произойти необратимые изменения печеночной ткани, поэтому у большинства пациентов происходит полный регресс клинической симптоматики. Менее благоприятный прогноз при прогрессирующем фиброзе или веноокклюзионной болезни, когда возникает стойкое снижение функций органа.
Первичная профилактика лекарственной гепатотоксичности предполагает подбор рациональных комбинаций медикаментов, исключение фармацевтических средств с высоким риском побочных эффектов. При необходимости одновременного применения более 5 лекарств требуется консультация клинического фармаколога. На фоне длительной массивной медикаментозной терапии целесообразно превентивный прием гепатопротекторов.
1. Лекарственная гепатотоксичность в клинической практике/ А.Н. Казюлин, Е.В. Переяслова// Медицинский совет. — 2012.
2. Гепатотоксические вещества и современные направления коррекции гепатотоксического действия/ В.А. Мышкин, А.Б. Бакиров, Э.Ф. Репина// Медицинский вестник Башкортостана. — 2011.
3. Лекарственные поражения печени. НПВП-ассоциированные гепатопатии: актуальность проблемы и современные терапевтические подходы/ Т.Д. Звягинцева, А.И. Чернобай// УМЖ. — 2014.
Отравление парацетамолом (ацетаминофеном) - поражение печени
В Великобритании передозировки парацетамола (ацетаминофена) чаще всего наблюдаются у молодых взрослых людей, которым не назначены врачами психотропные препараты. Там это средство используется примерно в 15—30 % случаев умышленных самоотравлений.
В 1993 г. Система надзора за токсической экспозицией при Американской ассоциации центров борьбы с отравлениями провела примерно 60 000 расследований, связанных с парацетамолом (ацетаминофеном). Только у небольшой доли пациентов отмечен риск тяжелого поражения печени, которая демонстрировала замечательную способность к регенерации. Выздоровление даже после тяжелой передозировки обычно быстрое и полное, а общий уровень смертности низок.
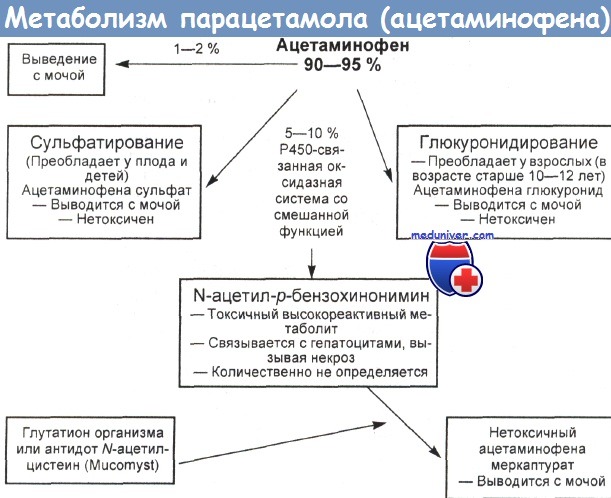
а) Гепатотоксичность парацетамола (ацетаминофена). Хотя точный механизм действия неясен, поражение печени, вероятно, обусловлено в основном токсичным промежуточным соединением, которое, ковалентно связываясь с гепатоцитами, вызывает некроз центральной части печеночных долей. Альтернативное объяснение некроза подразумевает переокисление липидов и окисление тиольных групп ключевых ферментов печени, в частности Са 2+ -транслоказ.
Печень метаболизирует основную часть терапевтических доз парацетамола (ацетаминофена) путем его глюкуронидной и сульфатной конъюгации. Лишь небольшое его количество превращается в высокореактивное производное N-ацетил-р-бензохинонимин (АБХИ) посредством цитохром Р450-зависимой оксидазной системы со смешанной функцией. Глутатион быстро обезвреживает это вещество, преобразуя его в цистеиновый или меркаптуриновый конъюгат. Одно из объяснений гепатотоксичности ацетаминофена предполагает насыщение сульфатного пути метаболизации при приеме внутрь слишком высокой дозы лекарства, что могло бы повысить количество его токсичного производного.
Когда содержание глутатиона в печени опускается ниже критического уровня (примерно 30 % нормального запаса), АБХИ ковалентно связывается с макромолекулами гепатоцитов, обусловливая некротизацию тканей.
Существует значительная индивидуальная изменчивость чувствительности к гепатотоксичности парацетамола (ацетаминофена): как минимум у 20 % лиц с токсическим уровнем этого лекарства в плазме поражение печени отсутствует.
В случайной выборке пациентов с передозировкой тяжелая некротизация печени развивается без применения антидота только у 8 %, несмотря на то что плазменные концентрации ацетаминофена соответствуют токсическому диапазону примерно у 15 %. Летальная печеночная недостаточность наблюдается лишь у 1—2 % больных, не получивших специфического лечения. Одно только истощение гепатоцитарного запаса восстановленного глутатиона не объясняет индуцируемой парацетамолом (ацетаминофеном) гепатотоксичности, поскольку аналогичное экспериментальное снижение его уровня другими лекарствами (например, йодметаном) не приводит к некрозу печени.
По-видимому, на активность цитохром Р450-зависимой оксидазы со смешанной функцией и чувствительность печени к интоксикации влияют возраст, рацион питания, алиментарный и метаболический статус организма, а также прием различных лекарств.
Вещества, индуцирующие Р450-ферменты печени (например, фенобарбитал, 3-метилхолантрен), способны усилить ацетаминофеновую гепатотоксичность. У пациентов, выживших после острой передозировки, хронический гепатит и цирроз развиваются редко.
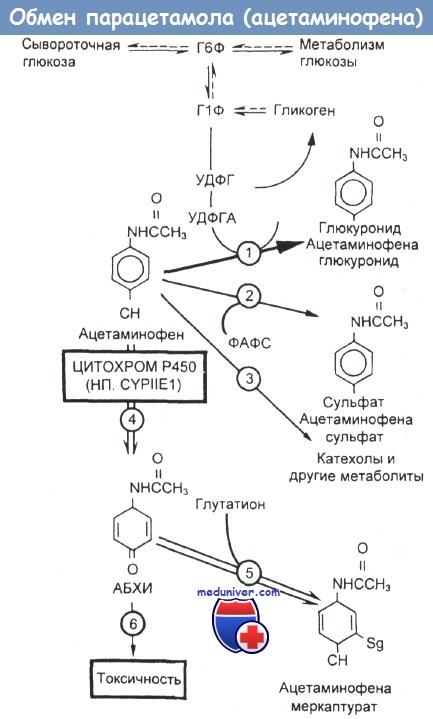
Схема метаболизации ацетаминофена в печени и последствия голодания и потребления алкоголя.
Парацетамол (ацетаминофен) метаболизируется несколькими главными и второстепенными путями (цифры в кружочках).
Путь 1 — это превращение в ацетаминофеновый глюкуронид, катализируемое глюкуронозилтрансферазой.
Парацетамол (ацетаминофен) конъюгирует с глюкуронидом, который предоставляется уридин(дифосфо)ацетилглюкозамином (УДФГА). Этот глюкуронид образуется из глюкозо-1-фосфата (Г1Ф), а последний — либо из гликогена, либо из глюкозо-6-фосфата (Г6Ф). При катаболическом обмене веществ (голодании) печеночные метаболические пути ориентированы на глюконеогенез (пунктирные линии), сокращающий количество предшественников глюкозы, доступных для глюкуронидирования.
Путь 2 соответствует сульфатированию и зависит от фосфоаденилилсульфата (ФАФС) и печеночных запасов серы.
Путь 3 — второстепенный, дающий лишь небольшую долю метаболитов ацетаминофена. Путь 4 ведет к оксидазной системе со смешанной функцией, включающей в себя цитохром Р450, главным образом его фракцию 2E1[CYPIIE1]. Этот фермент образует высокореактивное производное ацетаминофена N-ацетил-р-бензохинонимин (АБХИ).
Количество исходного лекарства, метаболизирующегося таким способом, может увеличиваться (серые стрелки) в результате индукции CYPIIE1 недавним приемом алкоголя или голоданием, а также при ослаблении глюкуронидирования. Путь 5 соответствует главному пути детоксикации АБХИ. Это производное конъюгирует с глутатионом и выводится из организма, пока запасы глутатиона и серы в печени не уменьшатся ниже критического уровня. Путь 6 показывает судьбу неконъюгированного АБХИ.
Он связывается с жизненно важными молекулами внутри клеток печени и в конечном итоге приводит к интоксикации и гибели последних. Недавнее потребление алкоголя индуцирует ферменты главным образом четвертого пути, а голодание подавляет метаболизацию по первому и, возможно, четвертому путям, увеличивает активность ферментов четвертого пути и снижает доступность предшественников для детоксикации АБХИ по пятому, в результате направляя больше ацетаминофена по пути 6.
УДФ — уридинфосфат; УДФГ — УДФ-глюкоза.
б) Факторы риска поражения печени парацетамолом (ацетаминофеном). К факторам риска, предрасполагающим к поражению печени после передозировки парацетамола (ацетаминофена), относятся алкоголизм и хроническое потребление агентов, индуцирующих микросомные ферменты печени (например, изониазида, противосудорожных средств). Голодание истощает запас глутатиона.
У пациентов, неоднократно принимающих парацетамол (ацетаминофен) в избыточном количестве, уровень этого лекарства обычно соответствует токсичному диапазону. Клинический анамнез зачастую неточен.
Примерно в одном из каждых 500 случаев передозировки парацетамола (ацетаминофена) речь идет о поддающемся терапии отравлении, что не отражено в анамнезе и не выявляется у пациентов с печеночной дисфункцией.
Номограмма для определения групп риска на основе исходной плазменной концентрации ацетаминофена.
в) Токсичная доза парацетамола (ацетаминофена). У взрослых пороговое значение однократной дозы, приводящей к острому тяжелому поражению печени, составляет 150—250 мг/кг. Дети в возрасте до 10 лет, похоже, намного устойчивее взрослых. Vale и Proudfoot отмечают, что риск тяжелого и потенциально летального поражения печени при передозировке, учитывая количество принятого внутрь ацетаминофена или симптомы, наблюдаемые в период максимального защитного действия антидота, достаточно надежно оценить нельзя.
1. Взрослые: 5—15 г (15—45 таблеток по 325 мг).
2. Взрослые: менее 125 мг/кг (печень не страдает);
250 мг/кг (тяжелое поражение печени [50 %]);
350 мг/кг (тяжелое поражение печени [100 %]).
3. Подростки: 125—150 мг/кг (гепатотоксичная доза).
4. Летальная доза: 13—25 г (46—75 таблеток по 325 мг).
в) Печеночный глутатион и отравление парацетамолом (ацетаминофеном). Лекарственные средства могут влиять на токсичность ацетаминофена, сокращая запасы глутатиона или снижая масштабы конъюгации. Судя по фармакокинетическим данным, печеночные резервы восстановленного глутатиона начинают истощаться у человека после перорального приема 0,5—3,0 г ацетаминофена, причем это истощение можно компенсировать введением N-ацетилцистеина.
В метаболизации парацетамола (ацетаминофена) существуют определенные межэтнические различия. Например, одно исследование показывает, что организм индийцев выделяет чуть больше глюкуронидных и несколько меньше сульфатных конъюгатов, чем организм китайцев. В обеих этих группах экскретируется меньше (6 % против 9 %) производных глутатиона, чем у европейцев шотландского происхождения.
Образование окисленных метаболитов и почечная экскреция, по-видимому, происходят в соответствии с кинетикой первого порядка (т. е. скорость линейно зависит от концентрации); сульфатная и глюкуронидная конъюгация следуют уравнению Михаэлиса—Ментена, т. е. кинетике нулевого или первого порядка в зависимости от концентрации субстрата.
Скорость образования токсичного метаболита после приема ацетаминофена внутрь зависит от темпов всасывания последнего, масштабов глюкуронидной и сульфатной конъюгации, а также от микросомной ферментативной активности. Ни табакокурение, ни предшествовавший прием циметидина не изменяют направлений метаболизации парацетамола (ацетаминофена). Печень биотранс-формирует его почти полностью путем конъюгации, а не Р450-зависимого окисления.
Таким образом, циметидин вряд ли влияет на судьбу терапевтических доз парацетамола (ацетаминофена), поскольку главным образом ингибирует микросомное окисление в печени.
Терапевтические дозы кодеина не изменяют ни клиренса ацетаминофена, ни его метаболизации. Высокие дозы ранитидина не влияют на метаболическое выведение терапевтических количеств ацетаминофена у человека. Основными ферментами, катализирующими его окисление до реактивных метаболитов, являются цитохромы Р4501А2 и Р4502Е1. Активность первого из них снижается при конкурентном ингибировании теофиллином, что может ослабить ацетаминофеновую интоксикацию при одновременном применении двух этих лекарств.
г) Парацетамол (ацетаминофен) и СПИД. У больных СПИДом возможно связанное с питанием истощение запасов глутатиона. Вероятно, множественные дозы ацетаминофена противопоказаны при лечении зидовудином лиц с подозрением на пониженный уровень глутатиона вследствие плохого питания, СПИДа или потребления алкоголя, а также при дополнительном применении средств, стимулирующих Р450-зависимые ферменты, например противосудорожных лекарств. Судя по результатам исследований на животных, адренергические агонисты сокращают печеночные запасы глутатиона и могут потенцировать гепатотоксичность ацетаминофена.
д) Парацетамол (ацетаминофен) при беременности. При передозировке парацетамола (ацетаминофена) и будущая мать, и плод подвергаются риску гепатотоксичности, поскольку это лекарство (но не его конъюгаты) легко диффундирует через плаценту как человека, так и подопытных животных. Однако четких указаний на тератогенность ацетаминофена и N-ацетилцистеина нет. Лечение беременных пациенток с передозировкой должно вестись по стандартной схеме. Само по себе отравление ацетаминофеном не служит показанием к прерыванию беременности.

Обмен парацетамола у плода и новорожденного ребенка
Уже на ранних этапах развития плода его гепатоциты могут окислять ацетаминофен до его токсичного метаболита, а способность конъюгировать лекарство с глутатионом достигает взрослого уровня по мере полового созревания человека. Интенсивность сульфатной конъюгации возрастает по мере созревания плода, а глюкуронидирование у плода почти не выявляется. Пониженное отношение цистеиновых и меркаптуриновых конъюгатов к сульфатным и глюкуронидным наводит на мысль о слабой активности соответствующего варианта цитохрома Р450 у новорожденного.
Низкая скорость образования (детоксикации) токсичного метаболита цистеиновым и меркаптуриновым способами может означать меньшую, чем у взрослых, чувствительность новорожденных к индуцируемой ацетаминофеном гепатотоксичности. У новорожденных, матери которых страдали от передозировки ацетаминофена, степень поражения печени ниже, чем у детей старшего возраста и взрослых; однако, если высокая доза ацетаминофена проникает через плацентарный барьер, опасность для плода сохраняется, поскольку его печень окисляет лекарство до токсичного метаболита. Хотя у плода и в раннем возрасте преобладает сульфатирование, начиная с 10 лет на первый план выходит глюкуронизирование. Схему метаболизации ацетаминофена у разных возрастных групп представил Roberts.
Молниеносная печеночная недостаточность
При тяжелом отравлении парацетамолом (ацетаминофеном) молниеносная печеночная недостаточность может развиться на третий — шестой день. Для нее характерны прогрессирующая желтуха, энцефалопатия, повышение внутричерепного давления, сильное нарушение гемостаза с диссеминированным внутрисосудистым свертыванием и кровотечением, гипервентиляция, ацидоз, гипогликемия и почечная недостаточность. Прогноз очень неблагоприятный.
Острая печеночная недостаточность во всех возрастных группах может также наблюдаться при инфекционном гепатите (вирусы гепатитов А, В, С и D, ветряной оспы, герпеса, Коксаки, ECHO, Эпштейна—Барр, аденовирус), синдроме Рейе (характеризующемся неукротимой рвотой в сочетании с аномальной гистологией печени), при обострении хронической патологии печени (болезни Вильсона, хронического активного гепатита), токсическом гепатите (отравлении бледной поганкой Amanita phalloides, пирролизидиновыми алкалоидами, четыреххлористым углеродом, хлорданом) и ятрогенном поражении печени (изониазидом, p-аминосалициловой кислотой, тетрациклином, вальпроевой кислотой, салицилатами, галотаном).
Если у ребенка повышены сывороточные уровни аланин- и аспартатрансаминазы (1500—10 000 ЕД/л), лактатдегидрогеназы и общего билирубина, увеличено протромбиновое и частичное тромбопластиновое время, наблюдаются гипопротеинемия и гипогликемия, а сывороточная концентрация аммония в 2 раза выше нормы, следует заподозрить отравление ацетаминофеном, поскольку это лекарство часто дают детям без назначения врача. Тяжесть нарушения печеночной функции не может служить надежным прогностическим критерием.
У пациентов с концентрацией парацетамола (ацетаминофена) в плазме выше линии на полулогарифмическом графике, соединяющей точки 1,32 ммоль/л (200 мг/л) и 0,20 ммоль/л (30 мг/л) через 4 и 15 ч после его перорального приема соответственно ("лечебная линия"), шансы на развитие тяжелого и часто летального поражения печени, характеризующегося повышением плазменных активностей аланин- и аспартаттрансаминазы выше 1000 МЕ/л, близки к 60 %. Если концентрация ацетаминофена выше параллельной линии на номограмме, соединяющей 2 ммоль/л (300 мг/л) и 0,33 ммоль/л (50 мг/л) в 4 и 15 ч соответственно, эта вероятность повышается до 90 %.
Впрочем, пациенты с концентрациями выше этой линии часто не страдают от поражения печени, тогда как сильная гепатотоксичность изредка отмечается даже при уровне ацетаминофена всего 0,83 ммоль/л (125 мг/л) через 4 ч после приема. В США антидот N-ацетилцистеин назначают при концентрации выше линии, проходящей через точку 1 ммоль/л (150 мг/л) через 4 часа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

