Применение актовегина при гепатитах
Обновлено: 22.04.2024
Форма выпуска, упаковка и состав препарата Актовегин ®
Таблетки, покрытые оболочкой зеленовато-желтого цвета, блестящие, круглые, двояковыпуклые.
| 1 таб. | |
| компоненты крови: депротеинизированный гемодериват крови телят | 200.0 мг, |
| в виде Актовегин ® гранулята* | 345.0 мг |
* Актовегин ® гранулят содержит: активное вещество: компоненты крови: депротеинизированный гемодериват крови телят - 200.0 мг; вспомогательные вещества: повидон-К 90 - 10.0 мг, целлюлоза микрокристаллическая - 135.0 мг.
Вспомогательные вещества: магния стеарат - 2.0 мг, тальк - 3.0 мг.
Состав оболочки: акации камедь - 6.8 мг, воск горный гликолевый - 0.1 мг, гипромеллозы фталат - 29.45 мг, диэтилфталат - 11.8 мг, краситель хинолиновый желтый лак алюминиевый - 2.0 мг, макрогол-6000 - 2.95 мг, повидон-К 30 - 1.54 мг, сахароза - 52.3 мг, тальк - 42.2 мг, титана диоксид - 0.86 мг.
50 шт. - флаконы темного стекла (1) - пачки картонные.
Фармакологическое действие
Антигипоксант, оказывающий три вида эффектов: метаболический, нейропротекторный и микроциркуляторный. Актовегин ® повышает поглощение и утилизацию кислорода; входящие в состав препарата инозитол фосфо-олигосахариды положительно влияют на транспорт и утилизацию глюкозы, что приводит к улучшению энергетического метаболизма клеток и снижению образования лактата в условиях ишемии.
Рассматривается несколько путей реализации нейропротекторного механизма действия препарата.
Актовегин ® препятствует развитию апоптоза, индуцированного бета-амилоидом (Аβ25-35).
Актовегин ® модулирует активность ядерного фактора каппа В (NF-kB), играющего важную роль в регуляции процессов апоптоза и воспаления в центральной и периферической нервной системе.
Другой механизм действия связан с ядерным ферментом поли(АДФ-рибоза)-полимеразой (PARP). PARP играет важную роль в выявлении и репарации повреждений одноцепочечной ДНК, однако чрезмерная активация фермента может запускать процессы клеточной гибели при таких состояниях, как цереброваскулярные заболевания и диабетическая полиневропатия. Актовегин ® ингибирует активность PARP, что приводит к функциональному и морфологическому улучшению состояния центральной и периферической нервной системы.
Положительными эффектами препарата Актовегин ® , влияющими на процессы микроциркуляции и эндотелий, являются увеличение скорости капиллярного кровотока, уменьшение перикапиллярной зоны, снижение миогенного тонуса прекапиллярных артериол и капиллярных сфинктеров, снижение степени артериоловенулярного шунтирующего кровотока с преимущественной циркуляцией крови в капиллярном русле и стимуляция функции эндотелиальной синтазы оксида азота, влияющей на микроциркуляторное русло.
В ходе различных исследований было установлено, что эффект препарата Актовегин ® наступает не позднее чем через 30 мин после его приема. Максимальный эффект отмечается через 3 ч после парентерального и через 2-6 ч после перорального применения.
Фармакокинетика
С помощью фармакокинетических методов невозможно изучить фармакокинетические параметры препарата Актовегин ® , поскольку он состоит только из физиологических компонентов, которые обычно присутствуют в организме.
М.Д. Дибиров (1), Р.У. Гаджимурадов (1, 2), О.Х. Халидов (1, 2), М.Р. Какубава (1, 2), М.В. Полянский
(1) Кафедра хирургических болезней и клинической ангиологии ГБОУ МГМСУ им. А.И. Евдокимова Минздрава России, Москва; (2) Городская клиническая больница № 81 ДЗ Москвы
Цель работы составила оценка эффектов препарата Актовегин в комплексном лечении хронических ран различной этиологии. Под наблюдением находились 118 пациентов, госпитализированных в отделение сосудистой хирургии и хирургии гнойных осложнений сахарного диабета. Больные были разделены по этиологическому фактору на три группы, включавшие в себя патологические состояния, вызывающие формирование 90% длительно незаживающих раневых дефектов. Каждая из групп была разделена на пациентов получавших только традиционную терапию, и пациентов получавших помимо традиционной терапии Актовегин. Результаты исследования показали: по сравнению с больными которым была назначена только традиционная терапия, у пациентов получавших Актовегин, на 3-4 суток раньше уменьшались размеры хронических ран, на 2-3 суток раньше снижался болевой синдром,. Вышеперечисленное позволяет рекомендовать Актовегин для лечения хронических ран различной этиологии.
Актуальность проблемы
Хронические раны представляют собой серьезную проблему для мирового здравоохранения на протяжении многих лет. Многие российские и зарубежные авторы занимались ее изучением, принимая различные определения этого понятия и предлагая множество методов лечения при данной патологии [1, 3, 6, 9]. Несмотря на массу научных трудов по этой тематике и сотни предложенных инновационных методов лечения, проблема лечения хронических ран и сейчас остро стоит перед хирургами во всем мире [2–4, 11, 12]. Ежегодные затраты на лечение хронических ран достигают 9 млрд долл. США и требуют массу времени и усилий медицинского персонала для организации длительного адекватного наблюдения за этой категорией пациентов [5, 6, 8, 10, 12].

Материал и методы
Под нашим наблюдением находились 118 пациентов в возрасте от 52 до 80 лет, госпитализированных в отделение сосудистой хирургии и хирургии гнойных осложнений сахарного диабета ГКБ № 81. Все пациенты находились на лечении в связи с наличием хронических раневых дефектов. Больные были разделены по этиологическому фактору на три группы, включившие патологические состояния, вызывающие формирование 90% длительно незаживающих раневых дефектов. В 1-ю группу были включены 54 пациента, страдавших длительно незаживающими трофическими язвами нижних конечностей вследствие хронической венозной недостаточности. У всех пациентов при ультразвуковом дуплексном сканировании (УЗДС) вен нижних конечностей диагностирована несостоятельность клапанов подкожных вен и наличие длительно существующих (от 2 до 48 месяцев) незаживающих раневых дефектов в области нижней и средней третях голеней. Всем больным выполнено этиопатогенетическое лечение: после курса антибактериальной терапии с учетом микробного пейзажа и очистки раневых дефектов была проведена кроссэктомия в сочетании с операцией Линтона. В послеоперационном периоде больные были разделены по 27 пациентов на две группы – основную и контрольную, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больным проведена медикаментозная терапия и местное лечение в полном объеме. Пациенты основной группы помимо традиционного лечения получали Актовегин внутривенно (1200 мг 1 раз в сутки в течение 14 дней) и местно в форме геля, мази или крема в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки больным назначен препарат Актовегин по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе местное лечение осуществлено мазевыми повязками (Бетадин, метилурацил, Левосин).
Во 2-ю группу включены 36 пациентов с симптомами хронической артериальной ишемии нижних конечностей, а также длительно незаживающими раневыми дефектами на различных уровнях стоп на фоне облитерирующего атеросклероза и эндартериита. При УЗДС артерий нижних конечностей диагностированы окклюзии бедренно-подколенно-берцового сегмента на различных уровнях. Всем больным по показаниям выполнена коррекция магистрального кровотока: бедренно-дистальные шунтирования аутовенной или синтетическими протезами, проведена консервативная гемореологическая (реополиглюкин, декстран и т.д.), антикоагулянтная (гепарин, Плавикс, Вессел Дуэ Ф), дезагрегантная (пентоксифилин, ацетилсалициловая кислота) терапия в полном объеме. В послеоперационном периоде пациенты были разделены по 18 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больные основной группы помимо стандартного лечения получали Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе Актовегин не применялся, а местное лечение осуществлено раствором Бетадин, мазью Левомеколь, метилурациловой мазью.
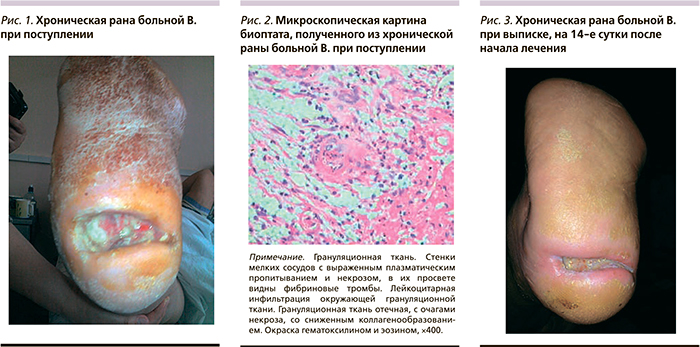
В 3-ю группу включены 28 пациентов, длительное время страдавших сахарным диабетом 2 типа, с клиническими признаками полинейропатии и длительно существующими раневыми дефектами нижних конечностей, не связанными с хронической артериальной или венозной недостаточностью. У этих пациентов проведены коррекция углеводного обмена (инсулинотерапия), местное лечение в объеме некрэктомии (по показаниям), гемореологическая и нейротропная терапия (Октолипен, Берлитион), ультразвуковая кавитация ран в регенерационном режиме через день, перевязки с гелем Hydrosorb, раствором Бетадин. Эти больные также были разделены по 14 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии.
В основной группе больные помимо общепринятого лечения получали препарат Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
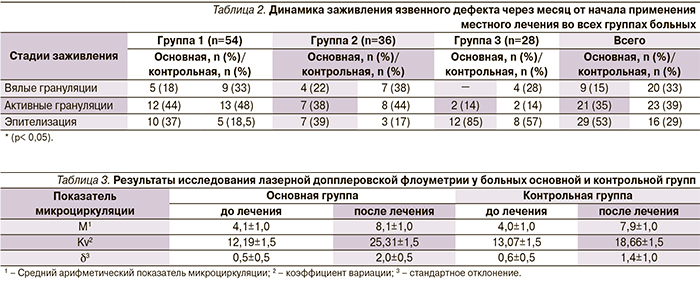
Во всех нозологических группах пациентов до и после курсов комплексной терапии произведен визуальный контроль ран по системе MEASURE [11], а также выполнены исследования микроциркуляции методом лазерной допплеровской флоуметрии. Датчик располагался в дне раневых дефектов. Помимо этого всем больным выполнено гистологическое исследование биоптатов из ран на протяжении всего срока стационарного лечения в динамике. Биоптаты фиксировали в 10%-ном нейтральном формалине и,по общепринятой методике заливали в парафиновые блоки. Изготовленные из парафиновых блоков гистологические срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином.
Результаты и их обсуждение
У пациентов 1-й группы, проходивших лечение по поводу хронических ран, вызванных хронической венозной недостаточностью, уменьшение площади раневых дефектов (высчитывалась из линейных размеров ран) в основной группе отмечено на 4–5-е сутки, в контрольной группе – на 7–9-е послеоперационного периода.
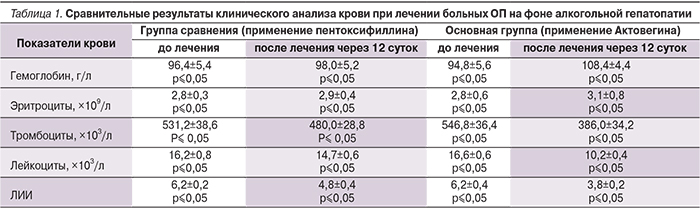
В обеих группах на 3–4-е сутки послеоперационного периода уменьшалось количество экссудата с умеренного до скудного, причем качественно экссудат оценивался нами как серозный или серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е сутки, тогда как в контрольной группе – на 6–7-е. На момент выписки хронические раны полностью зажили у 10 (37%) пациентов основной группы и у 5 (18,5%) – контрольной. Через 3 недели после выписки раны зажили в основной группе у всех (100%) больных, в контрольной группе – у 15 (55,5%) пациентов.
У пациентов 3-й группы, проходивших лечение по поводу хронических ран, на фоне нейропатической формы синдрома диабетической стопы, уменьшение площади раневых дефектов в основной группе отмечено на 2–3-е сутки, в контрольной группе – на 4–5-е сутки после начала лечения. Количество экссудата уменьшалось с умеренного до скудного в основной группе на 1–2-е сутки, в контрольной группе – на 2–3-е сутки, причем качественно экссудат оценивался нами как серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е и на 5–6-е сутки в контрольной группе. На момент выписки хронические раны полностью зажили у 12 (85%) пациентов основной группы и у 8 (57%) пациентов контрольной группы. В течение первых 3 недель после выписки раны зажили у всех пациентов основной группы (100%) и у 12 (85,7%) пациентов контрольной группы.
Особое внимание уделено динамике заживления язвенного дефекта в обследуемых группах как одному из важнейших показателей эффективности терапии. Результаты исследования показали, что при сочетании применения Актовегина для наружного использования и внутривенных инфузий через месяц от начала лечения эпителизация язвенного дефекта наблюдалась более чем у половины (53%) пациентов, что статистически достоверно.
При применении Актовегина наружно в виде геля, крема и мази средние сроки очищения ран от гнойных и некротических масс появление грануляций были в среднем меньше по сравнению со сроками в контрольных группах на 3–4-е суток (табл. 1). Через месяц от начала терапии у 29 пациентов основной группы и у 16 контрольной наблюдали эпителизацию язвенного дефекта. У 9 больных основной группы наблюдались вялые грануляции с отложениями фибрина, в контрольной группе – у 20 больных (табл. 2).
Результаты исследования микроциркуляции методом лазерной допплеровской флоуметрии представлены в табл. 3.
При гистологическом анализе биоптатов из ран после срока стационарного лечения у всех пациентов, получавших Актовегин, по сравнению с пациентами контрольных групп отмечалась нормализация процессов пролиферации и дифференцировки грануляционной ткани (коллагенообразования и новообразования сосудов), менее выраженная лейкоцитарная инфильтрация, активные процессы эпидермизации участков поражения кожи (рост эпителиального пласта на границе с грануляционной тканью).
В качестве иллюстрации эффектов комплексной терапии приводим клинический пример.
В заключение стоит отметить, что назначение препарата Актовегин оказалось не случайным и обусловлено его фармакологическими свойствами: выраженным метаболическим и эндотелиопротекторным действиями на уровне микрососудистого русла. Актовегин улучшает коллатеральный кровоток, трофическое обеспечение кислородом тканей при их хронической ишемии, а также при сосудистых и нейропатических осложнениях сахарного диабета [1–3, 7]. Полученные результаты позволили сделать нам следующие выводы и рекомендации:
В комплексном лечении хронических ран ведущая роль принадлежит патогенетическому лечению.
Для лечения хронических ран различной этиологии применение Актовегина в составе комплексной терапии достоверно позволяет увеличивать ее эффективность. При применении Актовегина на 3–4 суток раньше уменьшаются размеры хронических ран, на 2-3 суток раньше снижается болевой синдром по сравнению с больными контрольной группы.
Назначение Актовегина позволяет достоверно улучшать микроциркуляцию в хронической ране (средний показатель микроциркуляции в среднем выше на 0,2 пФ в группе пациентов, получавших Актовегин).
Мы рекомендуем включать препарат Актовегин в схему комплексного лечения больных с хроническими ранами различной этиологии по следующей схеме: внутривенно по 1200 мг 1 раз в сутки в течение 14 дней. Далее переход на таблетированную форму: по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
Для местного лечения чистых хронических ран различной этиологии мы рекомендуем использовать Актовегин в форме геля 1 раз в сутки до полного заживления.
Литература
Об авторах / Для корреспонденции
М.Д. Дибиров – д.м.н., проф., зав. кафедрой хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, Москва; заслуженный деятель науки РФ, заслуженный врач РФ
Р.У. Гаджимурадов – д.м.н., проф. кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, врач сердечно-сосудистый хирург ГКБ №81 ДЗ Москвы
О.Х. Халидов – д.м.н., проф. кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, зам. глав.врача по хирургии ГКБ №81 ДЗ Москвы
М.Р. Какубава – к.м.н., ассистент кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, врач-хирург отделения гнойной хирургии ГКБ №81 ДЗ Москвы
М.В. Полянский – ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, ГКБ №81 ДЗ Москвы
О.Х. Халидов (1, 2), Р.У. Гаджимурадов (1, 2), В.С. Акопян (1, 2)
(1) Кафедра хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, Москва; (2) Городская клиническая больница № 81, Москва
Представлены результаты исследования применения Актовегина 24 больными острым панкреатитом на фоне алкогольной гепатопатии по сравнению с применением пентоксифиллина 24 больными с аналогичной патологией. Результаты исследования свидетельствуют об эффективности применения препарата Актовегин для коррекции патологии микроциркуляторного русла и функциональных нарушений пораженной алкоголем печени при комплексном лечении больных острым
панкреатитом.
Острый панкреатит (ОП) относится к числу распространенных хирургических заболеваний и составляет в среднем от 3 до 10% случаев всех неотложных заболеваний органов брюшной полости. Возрастающий уровень заболеваемости свидетельствует об актуальности проблемы диагностики и лечения ОП в практическом здравоохранении [24].
Одним из наиболее частых причин развития ОП по праву считают злоупотребление алкоголем, алкогольные эксцессы либо прием суррогатов алкоголя. В настоящее время роль алкоголя как патогенетического фактора поражения поджелудочной железы общепризнанно [2, 4, 6, 7, 22–24, 28, 31]. Подобную причину заболевания выделяют в среднем у 35–50% больных подавляющего большинства стран [22, 24, 28].
Литературные данные и практические наблюдения свидетельствуют о том, что алкогольные панкреатиты относятся к наиболее тяжелым формам ОП [2, 4, 6, 7, 22–24, 28, 31]. ОП развивается на фоне нарушений дренажной функции панкреатических протоков. С алкоголизмом связывают токсическое повреждение поджелудочной железы, нарушение функции печени, извращение синтеза ферментов [6, 7, 22, 31]. Таким образом, прием алкоголя и его суррогатов резко усиливает секреторную активность поджелудочной железы, а длительное употребление алкогольных напитков приводит к дуодениту с отеком большого дуоденального соска, создавая затруднение оттоку панкреатического сока и желчи. Алкоголь в этих обстоятельствах оказывает токсическое действие на экзокринную активность железы, вызывая дегенеративные изменения в ацинарных клетках, способствуя развитию ОП [2, 6, 22–24].
Несмотря на многочисленные исследования, посвященные изучению больных ОП, вопросы клиники, диагностики и тактики лечения этого заболевания, связанные с употреблением алкоголя, изучены недостаточно и порой противоречивы. С одной стороны, это вызвано многосторонним действием алкоголя на организм, с другой – недостаточностью данных о структуре эндотоксикоза при этом заболевании [4, 23, 24]. В зависимости от продолжительности заболевания, времени воздействия, качества и количества принятых алкогольных напитков в паренхиме поджелудочной железы развиваются некроз, атрофия и фиброз клеток. Соответствующие изменения выявляются и в печени. Анатомическая близость печени и поджелудочной железы и тесные функциональные связи между ними создают угрозу повреждения и функциональной недостаточности печени при острых заболеваниях поджелудочной железы [22, 23].
Проблема диагностики и лечения больных ОП на фоне хронической алкогольной интоксикации и алкогольных поражений печени представляет большой интерес и относится к категории особо сложных. Хроническая алкогольная интоксикация и поражения печени значительно увеличивают риск летального исхода [2, 6, 7]. Обусловленная ОП системная воспалительная реакция ухудшает функциональные способности пораженной алкоголем печени и приводит к выраженным нарушениям портального кровотока [10, 12, 13, 15].
При лечении больных ОП и функциональных нарушений печени комплексные мероприятия направлены на коррекцию гиповолемии и электролитного дисбаланса, используют антиферментные препараты, блокаторы желудочной секреции, распираторную и инотропную поддержку, антибиотики, парэнтеральное и ранее энтеральное питание, методы экстракорпоральной детоксикации [23, 24]. Большое внимание выделяют улучшению микроциркуляторных процессов и купированию рассеянного внутрисосудистого свертывания [14, 20, 21, 23].
С этой целью используют различные препараты, включая пентоксифиллин, низкомолекулярные гепарины, а также кровозаменители – ренглюман, Реомакродекс [23]. В последнее время для коррекции патологии сосудистого русла широко используется препарат Актовегин, который обладает эндопротекторным свойством, увеличивает утилизацию кислорода, улучшает энергетический метоболизм, усиливает транспорт глюкозы в клетку за счет переносчиков благодаря наличию изонил-фосфор-олигосахаридов, улучшает метаболическую активность микрососудистого эндотелия [30, 34].
Целью настоящего исследования стало улучшение микроциркуляторных нарушений печени и портального кровотока при лечении больных ОП на фоне алкогольных поражений печени – гепатопатии.
Материал и методы
Под нашим наблюдением находились 24 больных ОП (основная группа) в возрасте 22–55 лет, из них 20 мужчин и 4 женщины. В отношении всех больных в ходе лечения с целью коррекции патологии микроциркуляторного русла и портального кровотока использовали Актовегин по 10 мл 1 раз в сутки на 0,9%-ном физиологическом растворе. Группу сравнения составили 24 больных аналогичной патологией, которым в процессе лечения с целью коррекции микроциркуляторных нарушений и портального кровообращения предлагали препарат пентоксифиллин.
Диагноз ОП устанавливался на основании клинических, лабораторных и инструментальных данных. Комплекс обследования включал клиниколабораторную диагностику с использованием клинических и биохимических методов исследования крови, ультразвукового исследования (УЗИ) органов брюшной полости, эзофагогастродуоденоскопии, лапароскопии; определение концентрации алкоголя в крови по международным стандартам, принятым по Международной классификации болезней 10-го пересмотра. Оценку состояния тяжести больных давали с применением критериев шкалы SAPS (Simplified acute physiology score). У всех больных имелся алкогольный анамнез более 5 лет. Концентрация алкоголя в крови составила при поступлении 1,5±0,3 мг/%. Состояние больных при поступлении оценивалось как тяжелое, что соответствовало по шкале SAPS 8,8±0,59 балла. По ходу хирургического лечения оценивали клинико-морфологическое состояние печени. Наиболее информативными при диагностике поражений печени считались методы УЗИ, УЗ допплерографии, компьютерная томография печени и лапароскопия.
Данные проведенных исследований сопоставлялись с результатами клинических исследований крови, биохимических показателей функционального состояния печени.
Контрольные исследования с применением клинических и биохимических анализов крови применяли ежедневно в отделении реанимации, а после стабилизации состояния больных и перевода в хирургическое отделение через каждые 3 суток.
Результаты исследования и обсуждение
Данные проведенных контрольных исследований подтвердили клиническую эффективность проводимой терапии в основной группе с применением Актовегина для коррекции микроциркуляторных нарушений печени и портального кровотока. Клинический эффект препарата оценивался по срокам разрешения пареза кишечника, сокращения размеров воспалительного инфильтрата брюшной полости при ОП, сокращения размеров печени, улучшения результатов клинико-биохимических показателей крови, лейкоцитарного индекса интоксикации, показателей воротного кровотока.
На фоне проведенной терапии в основной группе отмечали уменьшение явлений интоксикации и устранение пареза кишечника из 24 (100%) у 19 (79,1%) пациентов на третьи сутки применения Актовегина в комплексной терапии. В группе сравнения с использованием пентоксифиллина разрешение пареза кишечника наблюдалось на 5–7-е сутки. Сокращение размеров воспалительного инфильтрата брюшной полости в течение 7 суток наблюдали у 18 (75%) больных основной группы, а в группе сравнения было отмечено у 13 (54,2%) больных. Данные клинических и биохимических исследований крови свидетельствовали о повышении уровня гемоглобина, числа эритроцитов, снижении числа лейкоцитов, тромбоцитов, лейкоцитарного индекса, интоксикации у 22 (91,6%) пациентов основной группы на 12-е сутки, а в группе сравнения – у 18 (75%). Данные проведенных исследований анализов крови проведены в табл. 1.
По мере улучшения показателей анализов крови на 12-е сутки проводимого лечения наблюдали сокращение размеров печени у 21(87,5%) больного основной группы наряду со снижением уровней аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы, билирубина, мочевины и улучшением показателей воротного кровообращения (табл. 2, 3).
Среди больных группы сравнения положительный результат получен в аналогичные сроки у 16 (66,7%) пациентов, у 5 (20,8%) больных анализы существенно не изменились, а у 4 (16,5%) отмечено ухудшение показателей.
Из наблюдаемых 24 (100%) больных основной группы с применением Актовегина у 1 (4,1%) пациента состояние ухудшилось в связи с прогрессированием острой печеночной и полиорганной недостаточности. На 4-е сутки от момента госпитализации больной умер от интоксикации. Среди больных группы сравнения при применении пентоксифиллина для коррекции микроциркуляторных процессов умерли 4 (16,6%) больных в связи с нарастающей смешанной интоксикацией, развитием делирия и полиорганной недостаточности.
Заключение
Проведенные исследования свидетельствуют об эффективности применения препарата Актовегин для коррекции патологии микроциркуляторного русла и функциональных нарушений пораженной алкоголем печени при комплексном лечении больных ОП. Эффект лечения достигается благодаря эндотелиопротективному действию Актовегина, способствующего увеличению скорости капиллярного кровотока, улучшению клеточного и тканевого метаболизма в печени, что сопровождается стимуляцией биоэнергетических процессов и регенераций гепатоцитов.
Литература
Об авторах / Для корреспонденции



Форма выпуска, упаковка и состав препарата Актовегин ®
Раствор для инъекций прозрачный, желтоватый.
| 1 мл | 1 амп. | |
| Актовегин ® концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят)* | 40 мг | 80 мг |
Вспомогательные вещества: вода д/и - до 2 мл.
2 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (1) - пачки картонные × .
2 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (2) - пачки картонные × .
2 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (5) - пачки картонные × .
Раствор для инъекций прозрачный, желтоватый.
| 1 мл | 1 амп. | |
| Актовегин ® концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят)* | 40 мг | 200 мг |
Вспомогательные вещества: вода д/и - до 5 мл.
5 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (1) - пачки картонные × .
5 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (2) - пачки картонные × .
5 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (5) - пачки картонные × .
Раствор для инъекций прозрачный, желтоватый.
| 1 мл | 1 амп. | |
| Актовегин ® концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят)* | 40 мг | 400 мг |
Вспомогательные вещества: вода д/и - до 10 мл.
10 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (1) - пачки картонные × .
10 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (2) - пачки картонные × .
10 мл - ампулы бесцветного стекла (5) - упаковки ячейковые контурные (5) - пачки картонные × .
* В составе концентрата Актовегин ® присутствует натрия хлорид в виде ионов натрия и хлора, являющихся компонентами крови телят. Натрия хлорид не добавляется и не удаляется в процессе производства концентрата. Содержание натрия хлорида составляет около 53.6 мг (для ампул 2 мл), около 134 мг (для ампул 5 мл), около 268 мг (для ампул 10 мл).
× На пачку наклеивают прозрачные защитные наклейки круглой формы с голографическими надписями и контролем первого вскрытия.
Фармакологическое действие
Актовегин ® – антигипоксант, оказывающий три вида эффектов: метаболический, нейропротективный и микроциркуляторный. Актовегин ® повышает поглощение и утилизацию кислорода; входящие в состав препарата инозитол фосфо-олигосахариды положительно влияют на транспорт и утилизацию глюкозы, что приводит к улучшению энергетического метаболизма клеток и снижению образования лактата в условиях ишемии.
Рассматривается несколько путей реализации нейропротективного механизма действия препарата.
Актовегин ® препятствует развитию апоптоза, индуцированного пептидом бета-амилоида (Aβ25-35).
Актовегин ® модулирует активность ядерного фактора каппа В (NF-kB), играющего важную роль в регуляции процессов апоптоза и воспаления в центральной и периферической нервной системе.
Другой механизм действия связан с ядерным ферментом поли(АДФ-рибоза)-полимеразой (PARP). PARP играет важную роль в выявлении и репарации повреждений одноцепочечной ДНК, однако чрезмерная активация фермента может запускать процессы клеточной гибели при таких состояниях, как цереброваскулярные заболевания и диабетическая полиневропатия. Актовегин ® ингибирует активность PARP, что приводит к функциональному и морфологическому улучшению состояния центральной и периферической нервной системы.
Положительными эффектами препарата Актовегин ® , влияющими на процессы микроциркуляции и на эндотелий, являются увеличение скорости капиллярного кровотока, уменьшение перикапиллярной зоны, снижение миогенного тонуса прекапиллярных артериол и капиллярных сфинктеров, снижение степени артериоловенулярного шунтирующего кровотока с преимущественной циркуляцией крови в капиллярном русле и стимуляция функции эндотелиальной синтазы оксида азота, влияющей на микроциркуляторное русло.
В ходе различных исследований было установлено, что эффект препарата Актовегин ® наступает не позднее, чем через 30 мин после его применения. Максимальный эффект отмечается через 3 ч после парентерального и через 2–6 часов после перорального применения.
Как показало исследование ARTEMIDA (NCT01582854), целью которого было изучение терапевтического эффекта препарата Актовегин ® в отношении когнитивных нарушений у 503 пациентов с ишемическим инсультом, терапевтический эффект от использования препарата сохраняется еще как минимум 6 мес после прекращения применения препарата.
Как показало исследование APOLLO (NCT03469349), целью которого было изучение терапевтического эффекта препарата Актовегин ® в отношении дистанции безболевой ходьбы у 366 пациентов с хроническими облитерирующими заболеваниями артерий нижних конечностей IIВ стадии по классификации Фонтейна, терапевтический эффект от использования препарата сохраняется еще как минимум 3 мес после прекращения применения препарата.
Фармакокинетика
С помощью фармакокинетических методов невозможно изучить фармакокинетические параметры препарата Актовегин ® , поскольку он состоит только из физиологических компонентов, которые обычно присутствуют в организме.
Форма выпуска, упаковка и состав препарата Актовегин ®
Таблетки, покрытые оболочкой зеленовато-желтого цвета, круглые, двояковыпуклые, блестящие.
| 1 таб. | |
| компоненты крови: депротеинизированный гемодериват крови телят | 200.0 мг, |
| в виде Актовегин ® гранулята* | 345.0 мг |
* Актовегин ® гранулят содержит: активное вещество: компоненты крови: депротеинизированный гемодериват крови телят - 200.0 мг; вспомогательные вещества: повидон-К 90 - 10.0 мг, целлюлоза микрокристаллическая - 135.0 мг.
Вспомогательные вещества: магния стеарат - 2.0 мг, тальк - 3.0 мг.
Состав оболочки: акации камедь - 6.8 мг, воск горный гликолевый - 0.1 мг, гипромеллозы фталат - 29.45 мг, диэтилфталат - 11.8 мг, краситель хинолиновый желтый лак алюминиевый - 2.0 мг, макрогол-6000 - 2.95 мг, повидон-К 30 - 1.54 мг, сахароза - 52.3 мг, тальк - 42.2 мг, титана диоксид - 0.86 мг.
50 шт. - флаконы темного стекла (1) - пачки картонные × .
× На пачку наклеивают прозрачные защитные наклейки круглой формы с голографическими надписями и контролем первого вскрытия.
Фармакологическое действие
Актовегин ® - антигипоксант, оказывающий три вида эффектов: метаболический, нейропротективный и микроциркуляторный. Актовегин ® повышает поглощение и утилизацию кислорода; входящие в состав препарата инозитол фосфо-олигосахариды положительно влияют на транспорт и утилизацию глюкозы, что приводит к улучшению энергетического метаболизма клеток и снижению образования лактата в условиях ишемии.
Рассматривается несколько путей реализации нейропротективного механизма действия препарата.
Актовегин ® препятствует развитию апоптоза, индуцированного пептидом бета-амилоида (Aβ25-35).
Актовегин ® модулирует активность ядерного фактора каппа В (NF-kB), играющего важную роль в регуляции процессов апоптоза и воспаления в центральной и периферической нервной системе.
Другой механизм действия связан с ядерным ферментом поли(АДФ-рибоза)-полимеразой (PARP). PARP играет важную роль в выявлении и репарации повреждений одноцепочечной ДНК, однако чрезмерная активация фермента может запускать процессы клеточной гибели при таких состояниях, как цереброваскулярные заболевания и диабетическая полиневропатия. Актовегин ® ингибирует активность PARP, что приводит к функциональному и морфологическому улучшению состояния центральной и периферической нервной системы.
Положительными эффектами препарата Актовегин ® , влияющими на процессы микроциркуляции и на эндотелий, являются увеличение скорости капиллярного кровотока, уменьшение перикапиллярной зоны, снижение миогенного тонуса прекапиллярных артериол и капиллярных сфинктеров, снижение степени артериоловенулярного шунтирующего кровотока с преимущественной циркуляцией крови в капиллярном русле и стимуляция функции эндотелиальной синтазы оксида азота, влияющей на микроциркуляторное русло.
В ходе различных исследований было установлено, что эффект препарата Актовегин ® наступает не позднее, чем через 30 мин после его приема. Максимальный эффект отмечается через 3 ч после парентерального и через 2-6 ч после перорального применения.
Как показало исследование ARTEMIDA (NCT01582854), целью которого было изучение терапевтического эффекта препарата Актовегин ® в отношении когнитивных нарушений у 503 пациентов с ишемическим инсультом, терапевтический эффект от использования препарата сохраняется еще как минимум 6 мес после прекращения применения препарата. Как показало исследование APOLLO (NCT03469349), целью которого было изучение терапевтического эффекта препарата Актовегин ® в отношении дистанции безболевой ходьбы у 366 пациентов с хроническими облитерирующими заболеваниями артерий нижних конечностей IIВ стадии по классификации Фонтейна, терапевтический эффект от использования препарата сохраняется еще как минимум 3 мес после прекращения применения препарата.
Фармакокинетика
С помощью фармакокинетических методов невозможно изучить фармакокинетические параметры препарата Актовегин ® , поскольку он состоит только из физиологических компонентов, которые обычно присутствуют в организме.
Читайте также:

