Принципы технологии промышленного культивирования вирусов
Обновлено: 24.04.2024
Культивирование вирусов — выращивание вирусов в искусственных условиях путем заражения животных, культур клеток и тканей. Культивирование вирусов производят в диагностических целях (выделение от больных и носителей), при экспериментальной работе (изучение вирусов), для производства вирусных вакцин и диагностикумов.
Гальтье (V. Galtier) впервые осуществил в 1879 г. культивирование вируса бешенства, заразив кролика мозгом больной собаки. Левенштейн (A. Lowenstein, 1919) первый опубликовал данные об успешной передаче вируса герпеса от человека кролику. Грютер (W. Gruter, 1920) доказал возможность культивирования вируса герпеса на кроликах. Способность вируса вакцины (коровьей оспы) репродуцироваться в тканевой культуре была доказана Паркером и Наем (F. Parker, В. N. Nye) в 1925 г. В 1931 г. Вудрафф (А. М. Woodruff) и Э. Гудпасчер показали возможность К. в. на хорион-аллантоисной оболочке эмбрионов кур (вирус оспы птиц).
Вирусы репродуцируются только в живых клетках, поэтому для их накопления заражают вирусами животных или культуры клеток и тканей. При этом происходит адаптация вируса, полученного из организма больного или носителя, к новым условиям. Чем меньше отличается искусственная система от естественной, тем легче осуществляется адаптация вируса.
Для оптимальной репродукции вируса необходимо использовать наиболее чувствительную систему и проводить заражение сильно разведенным свежим материалом, поскольку инактивированные вирусные частицы могут тормозить размножение инфекционных вирионов. Система, в к-рой вирус проходит полный цикл репродукции, носит название пермиссивной (разрешающей). В непермиссивной (неразрешающей) системе происходит неполный цикл репродукции вируса либо он вообще не репродуцируется. Пермиссивная для данного вируса система может стать для него непермиссивной при изменении условий культивирования, напр, при изменении температуры.
На животных культивируют те вирусы, которые вызывают у них четкую клиническую или патологоанатомическую картину (напр., развитие у мышей параличей при заражении вирусом бешенства или пневмонии при гриппозной инфекции). Многие вирусы лучше растут в мало-дифференцированных тканях эмбрионов птиц и новорожденных млекопитающих, чем в организме взрослых особей.
Для Культивирования вирусов используют мышей, крыс, морских свинок, кроликов, сирийских хомячков, африканских хорьков, обезьян, кур и др. На взрослых мышах культивируют вирусы гриппа, бешенства, многие тогавирусы; мыши-сосунки незаменимы при выращивании ряда вирусов Коксаки и тогавирусов ряда ареновирусов — возбудителей вирусных геморрагических лихорадок.
Сосунков белых крыс и сирийских хомячков часто используют для культивирования онкогенных вирусов. Морские свинки служат для выращивания вирусов ящура, марбургской болезни и др. Из обезьян наиболее часто используют зеленых африканских мартышек и разные виды макаки. Так, изучение вирусов полиомиелита и желтой лихорадки стало возможным после их адаптации к организму макак. Культивирование возбудителей некоторых медленных инфекций (куру, болезни Крейтцфельдта—Якоба), а также вирусов гепатитов А и В впервые удалось при заражении шимпанзе. Чувствительными к вирусу гепатита А также оказались южноамериканские обезьяны мармозеты.
Для получения стандартных результатов животные, используемые для работы с вирусами, должны быть генетически однородными. Этой цели служит инбредное скрещивание лаб. животных — братьев и сестер или родителей и детей, чем достигается возрастающая степень гомозиготности.
Для успешного К. в., помимо вида и возраста животных, имеет значение путь введения материала, что обусловлено тропностью вируса. Поэтому в большинстве случаев для размножения вируса в организме животного необходима его инокуляция в чувствительную ткань. Лишь некоторые вирусы патогенны для животных при любых способах инокуляции (напр., вирус венесуэльского энцефалита лошадей для мышей).
Большинство нейротропных вирусов культивируют путем введения их в полушария головного мозга животных. Этим путем заражают мышей различными тогавирусами, буньявирусами и другими арбовирусами. Вирус бешенства вводят таким же образом мышам, кроликам, овцам и собакам, вирус лимфоцитарного хориоменингита — мышам и морским свинкам. При культивировании вируса полиомиелита на обезьянках его инокулируют в спинной мозг или таламус головного мозга. Часто при культивировании нейротропных вирусов их вводят животным в брюшную полость, однако этот путь инокуляции уступает по чувствительности внутримозговому. Респираторные вирусы культивируют обычно путем интраназального заражения — их закапывают в нос наркотизированным животным или вводят в виде аэрозоля в специальной камере.
Аденовирусы инокулируют сирийским хомячкам подкожно или в слизистую оболочку защечных мешков, вирус герпеса обезьян — кроликам внутрикожно, а оспенные вирусы — на скарифицированную кожу (кроликам, телятам, курам). Вирусы оспы и герпеса можно культивировать на скарифицированной роговице кролика. Введение вирусов в мышцу, внутривенно, через рот и per rectum применяют редко. Внутривенное заражение морских свинок, хомячков и хорьков технически сложно, вместо этого материал чаще вводят в полость сердца.
Культивирование вирусов на животных очень затрудняется наличием в их организме различных бактерий, микоплазм и вирусов, которые могут загрязнить культивируемый вирус. Иногда вирус, находящийся в организме животного, создает иммунитет к культивируемому вирусу, напр, возбудитель эктромелии у мышей к вирусу вакцины.
Для уменьшения риска загрязнения культивируемых вирусов посторонними возбудителями все чаще используют животных, выращенных в условиях изоляции. С этой целью получают животных, свободных от специфических для данного вида патогенных агентов,— SPF (specific pathogen free). У их матерей не должно быть инфекций, передающихся через плаценту. Детенышей извлекают при помощи кесарева сечения, вводят им в кишечник апатогенные бактерии, напр, молочнокислые, после чего они вскармливаются SPF самками. В дальнейшем эти животные размножаются обычным путем. Содержат их в закрытых помещениях, куда подается стерильный воздух, пища, вода и пр.
Животных, свободных от всяких возбудителей, содержат в специальных боксах в условиях еще более строгой изоляции (см. Стерильные животные).
Эмбрионы птиц с их малодифференцированными тканями пригодны для культивирования очень многих вирусов. Для получения оптимальных результатов имеет значение вид и возраст эмбрионов, путь заражения, введенная доза и температура инкубации. Чаще всего используют эмбрионы кур. Они наиболее чувствительны до 13-го дня инкубации. Инокулируют вирусы обычно на хорион-аллантоисную оболочку, в желточный мешок, аллантоисную и амниотическую полость; в мозг эмбрионов и внутривенно (в сосуды оболочек) вирусы вводят редко. В желточном мешке культивируют многие тогавирусы; вирусы гриппа и инфекционного паротита хорошо культивируются в амниотической полости 10 —11-дневных эмбрионов, при этом вирус гриппа размножается не только в клетках амниона, но также в трахее и легких эмбриона. Вирусы оспенной группы и др. культивируют на хорион-аллантоисной оболочке, заражая 10—13-дневные эмбрионы через естественный воздушный мешок или через отверстие на боковой поверхности яйца после создания искусственного воздушного мешка. При заражении любым путем эмбрионы могут быть травмированы, поэтому их гибель в первые 24 часа расценивается как неспецифическая. Оптимальное количество вируса при заражении — 1000 — 10 000 инфекционных доз. К. в. в эмбрионах обычно происходит при t° 36—37°. Некоторые вирусы, напр, вирус вакцины, могут размножаться при температуре выше 40°, в то время как возбудитель натуральной оспы необходимо культивировать при температуре не выше 38,5°. Температурно-чувствительные мутанты вирусов, обладающие, как правило, сниженной патогенностью, культивируют при t° 25—28°.
При размножении в эмбрионах вирусы могут вызвать их гибель (многие арбовирусы, вирус энцефаломиокардита и др.), появление изменений на хорион-аллантоисной оболочке (оспенные вирусы) или в теле эмбриона, накопление в эмбриональных жидкостях гемагглютининов (вирусы гриппа, паротита) и комплементсвязывающего вирусного антигена.
Большинство известных вирусов можно выращивать в культурах клеток и тканей (см.). Чаще всего используют однослойные первичные или перевиваемые клеточные культуры на стекле, реже применяют суспензионные культуры. К первичным культурам клеток вирусы адаптируются легче, чем к перевиваемым. Вирусы человека лучше всего размножаются в культурах человеческих клеток и почечных клеток обезьян.
Оптимальная доза вируса при заражении — 0,1—0,001 50% тканевой цитопатической дозы вируса на клетку. Объем инокулята должен быть небольшим. Адсорбцию вируса проводят в течение 1—2 час. при t° 37°, после чего инокулят удаляют, если он токсичен для клеток. Питательная среда должна иметь pH 6,9 — 7,2. Если к ней прибавлена сыворотка, последняя не должна содержать антител или неспецифических ингибиторов по отношению к культивируемому вирусу. Наиболее интенсивная репродукция большинства вирусов происходит при t 36 — 37°; при более низкой температуре (33°) культивируют риновирусы.
При К. в. с целью их выделения из инфицированных органов весьма эффективно культивирование клеток самой исследуемой ткани после ее трипсинизации (напр., ткани миндалин для выделения аденовирусов).
Размножение большинства вирусов сопровождается цитопатическими изменениями. Максимальное количество вируса в культуре обычно наблюдается при дегенерации 75% клеток. Размножение вирусов, не обладающих цитопатической активностью, можно установить с помощью реакции гемадсорбции (многие миксо- и тогавирусы), методом иммунофлюоресценции, путем исследования культуральной жидкости на наличие гемагглютининов (напр., миксовирусы) или комплементсвязывающего вирусного антигена, а также в опытах на животных (вирус бешенства). Некоторые вирусы можно выявить по их способности подавлять размножение цитопатогенного вируса, т. е. по феномену интерференции (напр., в культурах клеток эмбрионов кур, инфицированных вирусами лейкоза птиц, не размножается вирус саркомы Рауса). Некоторые вирусы образуют в клетках включения.
Большинство вирусов после размножения в клетках выходит в культуральную среду, ряд других остается связанным с клетками (вирусы оспы, аденовирусы), некоторые герпетические вирусы необходимо пересевать вместе с неповрежденными клетками, поскольку при разрушении клеток они инактивируются. Иногда при взаимодействии вируса и клетки развивается хроническая инфекция. Напр., инфицированные вирусом лимфоцитарного хориоменингита перевиваемые человеческие клетки могут продуцировать инф. вирус в продолжение многих поколений.
Для выращивания коронавирусов человека и некоторых других используют тканевые культуры, т. е. культивируемые вне организма тканевые фрагменты. Чаще всего используют ткань трахеи кролика. О размножении вируса в этом случае судят по прекращению движения ресничек культуры ткани.
Следует учитывать возможность присутствия в культурах клеток и тканей различных вирусов и микоплазм. Они могут быть внесены вместе с клетками, если последние взяты из инфицированного организма, попасть из трипсина или используемой в качестве ингредиента питательной среды сыворотки.
Адаптация вируса к искусственным условиям размножения требует проведения нескольких пассажей, быстро следующих друг за другом при заражении небольшой дозой вируса. Обычно интенсивность репродукции вируса при этом значительно возрастает. Иногда вирус после адаптации к одной системе приобретает способность размножаться также в других системах. Свежевыделенные вирусы более пластичны, чем долго культивировавшиеся в каких-либо одних условиях. К. в. в искусственных условиях нередко приводит к снижению их патогенности для естественных хозяев, чем пользуются для получения вакцинных штаммов. В неблагоприятных условиях культивирования (малочувствительных системах или при заражении слишком большой дозой) могут формироваться дефектные вирусные частицы, содержащие лишь часть генома или не имеющие нуклеиновой к-ты. Некоторые вирусы вообще не удается культивировать в искусственных условиях или их репродукция прекращается после нескольких пассажей.
Сохранять вирусы в течение нескольких дней можно при t° 4° в среде с pH ок. 7,0. Устойчивость их возрастает при удалении клеточных фрагментов и прибавлении сыворотки (10%), глицерина (50%) или обезжиренного молока (50%). Все вирусы хорошо сохраняются при t° —70° и ниже в герметически закрытых сосудах; многие остаются жизнеспособными месяцы и даже годы. Оспенные вирусы и энтеровирусы хорошо сохраняются при t° —20°. Замораживание вируса должно происходить быстро. Для повышения устойчивости вируса прибавляют к среде сывороточный белок, куриный желток, пептон, сахарозу или глюкозу. Влияние стабилизаторов на разные вирусы неодинаково. Вирусы могут оставаться жизнеспособными длительное время и после лиофилизации. В качестве стабилизаторов при этом используют пептон (10%), молоко (50%), сахарозу с желатиной или куриным желтком (по 10 %). Лиофилизированный вирус должен сохраняться в вакууме или нейтральном газе (напр., азоте) при t° 4° или —15°.
Библиография: Лабораторная диагностика вирусных и риккетсиозных заболеваний, под ред. Э. Леннета и Н. Шмидт, пер. с англ., М., 1974; Соколов М. И., Синицкий А. А. и Ремезов П. И. Вирусологические и серологические исследования при вирусных инфекциях, Л., 1972; Штарке Г. и др. Практическая вирусология, пер. с нем., М., 1970, библиогр.; Comparative diagnosis of viral diseases, ed. by E. Kurstak a. C. Kurstak, v. 1—2, N. Y. a. o., 1977.
Опыт культивирования вирусов в суспензиях постоянных линий клеток. Технологии в вирусологии.
Вирус трансмиссивного гастроэнтерита свиней (ТГС) выращивали в циклической суспензионной культуре постоянной линии клеток почки поросенка ППК-66. При оптимальных условиях (концентрация клеток 1,5-2,5 млн/мл; множественность заражения 1- 10 ТЦД50/мл; продолжительность культивирования после инфицирования 24-30 ч; содержание сыворотки в среде - 5-10%; рН - 7,2-7,4; скорость перемешивания суспензии 120-200 об/мин и аэрация со скоростью 0,2-1 л/ч на литр среды) вирус накапливался в титре 10 8,5 -10 9,0 ТЦД50/мл и в 100 раз превышал накопление вируса в однослойной статической культуре тех же клеток. Титры антител в крови кроликов, двукратно иммунизированных инактивированной вакциной, были значительно выше при ее приготовлении из вируса, размноженного в суспензионной, чем в однослойной культуре клеток. Установлено, что суспензионная культура клеток ППК-66 является высокопродуктивной системой для крупномасштабного производства вакцинного штамма вируса ТГС.
Аналогичные данные получены при выращивании вируса болезни Ауески в суспензионных культурах клеток ППК-666 и ВНК-21. Накопление вируса в суспензии (10 8,5 - 10 9,0 ТЦД50/мл) было выше, чем в монослое. В обоих случаях для выращивания вирусов трансмиссивного гастроэнтерита и болезни Ауески в суспензии клеток использовали среду с ФГМ и 10% сыворотки крупного рогатого скота.
Накопление вируса венесуэльского энцефаломиелита лошадей в клетках L, выращенных в суспензии, было таким же, как и в однослойной культуре. Однако выход вируса на одну клетку в суспензии был ниже, чем в монослое, и в среднем достигал 1000 ЛД50/мл. Респираторно-синцитиальный вирус размножали в суспензии клеток НЕр2 и МА-160. Вирусную суспензию смешивали с клеточным осадком (М-5), добавляли среду Игла с 10% сыворотки телят до концентрации клеток 2—3x105 мл. Через 48 ч вирус достигал титра 7,0 lg ТЦД50/мл. Высокая иммуногенность препарата, инактивированного формалином (1:2000), явилась основанием для разработки метода выращивания вируса в суспензионной культуре в ферментерах.
Вирусы полиомиелита трех типов хорошо размножались в суспензии лимфобластоидных клеток человека в бессывороточной среде. Данная клеточная система открывает новые возможности получения больших количеств вируса для промышленного изготовления вакцины. Линии лимфоидных клеток (JMV-I и MSB-I), полученные от зараженных вирусом болезни Марека цыплят, поддерживали репликацию вируса ньюкаслской болезни, что сопровождалось цитолитическим действием.
Хемостатные суспензионные культуры представляют возможность для увеличения производительности при репродукции вирусов по сравнению с обычными циклическими суспензионными культурами. Выбор системы непрерывно-проточного культивирования зависит от особенностей вируса и чувствительного клеточного субстрата. Вирусы, реплицирующиеся без цитопатического эффекта и без выраженного снижения скорости роста клеток, могут размножаться в системе одноступенчатого хемостата. Вирусы, вызывающие литическую инфекцию, необходимо культивировать во второй ступени хемостата, а клетки-продуценты — в первой. Преимущество хемостатной системы состоит также в непрерывном удалении образовавшегося продукта. В одноступенчатом хемостате культивировали вирус краснухи в клетках HeLa и ВНК-21. Отмечено, что в течение 40 дней непрерывной работы хемостата поддерживался титр продуцируемого вируса и комплементсвязывающего антигена. С увеличением скорости роста клеток увеличивалась репродукция вируса.
Полиовирус, вызывающий литическую инфекцию, размножали в клетках HeLa в одноступенчатом хемостате (лизостате), а аденовирус — в двухступенчатой системе. Однако эти попытки не дали четких результатов.
Для культивирования клеток в суспензии предложен (1998 г.) качающийся биореактор (Wave bioreactor), представляющий собой пластиковую эластичную емкость (мешок), содержимое которого перемешивается с помощью плавного покачивания в вертикальной плоскости на специальной качалке.
Пластитковый биореактор стерилизуется гамма-лучами. При культивировании клеточной суспензии в объеме > 10 л, используют аэрацию с автоматизированным контролем рН 02 и С02.
Перспектива использования постоянных линий клеток для выращивания вирусов с целью изготовления вакцин привела к необходимости выяснить опасность таких препаратов. Прежде всего, это было связано с клетками ВНК-21 и противоящурной вакциной. Онкогенность клеток ВНК-21 для хомяков хорошо известна. Предстояло выяснить онкогенность их для домашних животных, прививаемых против ящура. Во-первых, было установлено, что у хомяков опухоли вызывают только нативные клетки ВНК-21, тогда как различные культуральные бесклеточные субстраты этой способностью не обладают. Во-вторых, у других видов животных (крупный рогатый скот, овцы, свиньи, крысы, кролики, морские свинки и мыши) клетки ВНК-21 не вызывали опухолей.
Постоянный технический комитет экспертов Европейской комиссии по борьбе с ящуром ФАО рекомендовал клетки ВНК-21 для изготовления вакцины, признав их безопасными для сельскохозяйственных животных. Многолетняя практика применения ВНК-вакцины против ящура подтвердила правильность этой рекомендации. Возможность применения других линий клеток в изготовлении противовирусных вакцин, предназначенных животным, должна основываться на соответствующих экспериментальных данных.
Анализ имеющихся данных показывает, что выращивание вирусов в суспензии постоянных линий перевиваемых клеток все более привлекает внимание исследователей в связи с решением различных научных и практических вопросов. Для некоторых вирусов разработаны технологические режимы массового размножения в клеточных линиях с использованием металлических реакторов большой емкости. Одни и те же клеточные субстраты можно с успехом применять для размножения разных вирусов. Например, технология культивирования клеток ВНК-21, разработанная в связи с изготовлением противоящурной вакцины, имеет прототипное значение и может быть применена для размножения многих вирусов человека и животных. Разработка таких технологий массового культивирования постоянных линий клеток многоцелевого назначения представляет огромный практический интерес. Актуальной задачей является создание банка охарактеризованных постоянных линий клеток, отличающихся высокой ростовой потенцией, стабильностью свойств при серийном суспензионном культивировании в промышленных условиях и высокой продуктивностью для различных вирусов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Культивирование вирусов. Биотехнологии в вирусологии.
Массовое выращивание клеток в культуре является центральным звеном любого технологического процесса, основанного на использовании клеток животных, и, в первую очередь, производства вирусных препаратов. Эта стадия определяет массу и качество клеток и, тем самым, в целом технологию получения вирусного сырья. Выбор способа культивирования вируса в значительной мере определяется способностью клеток размножаться на поверхности плотного субстрата или в суспензионной культуре. Трудно определить верхние и нижние границы крупномасштабного или промышленного выращивания вирусов в клеточных культурах. Все зависит от масштабов производства вирусных препаратов. В одних случаях речь идет о получении сотен литров, в других — десятков и даже сотен тысяч литров культурального вируса в год. Это зависит от вида вакцин и масштабов их применения. Изготовление живых вакцин при прочих равных условиях всегда требует меньших объемов вирусного сырья, нежели приготовление инактивированных, в особенности концентрированных вакцин.
Отсутствие эффективных вакцин для профилактики некоторых заболеваний объясняется, прежде всего, отсутствием экономичного способа получения иммуногенного материала в достаточном количестве.
В отличие от инактивированных вакцин против ящура и полиомиелита, выпускаемых в больших количествах, при многих заболеваниях человека и животных применяют живые вакцины, для изготовления которых не требуется большого количества вирусного сырья. Это, прежде всего, относится к тем вакцинам, которые перед применением разводят. Ежегодно производство таких вакцин, связанное с получением сотен литров культурального вируса, удовлетворяется использованием статических или вращающихся культуральных сосудов. Однако такие методы культивирования вирусов не могут удовлетворить крупномасштабное производство ряда вирусных вакцин. Например, при изготовлении противоящурной вакцины перевиваемые клетки выращивают в суспензии в реакторах с рабочим объемом более 1000 л. Крупные научно-производственные центры Южной Америки ежегодно вырабатывали до 600 млн. доз моновалентной инактивированной противоящурной вакцины. Для этой цели необходимо еженедельно получать около 20 000 л суспензионной культуры клеток ВНК-21.
До недавнего времени производство большинства вирусных препаратов основывалось на использовании первичных культур клеток из нормальных тканей различных видов домашних и лабораторных животных. Кроме того, в качестве клеточных субстратов для производства вакцин, применяемых в медицине, использовали немногие линии диплоидных клеток с ограниченной жизненной потенцией. Широкое применение таких препаратов в медицине и ветеринарной практике дало возможность достичь больших успехов в борьбе со многими опасными вирусными болезнями человека и животных. Однако первичные культуры клеток во многих отношениях не являются перспективными клеточными субстратами. Их приготовление связано с периодическим убоем животных и необходимостью выделения клеток из тканей.
Первичные культуры отличаются нестандартностью, таят в себе опасность в отношении эндогенной контаминации различными вирусами и микроорганизмами. Наконец, их сложно выращивать в условиях крупносерийного производства. Отмеченные трудности значительно возрастают в связи с тенденцией постоянного увеличения масштабов изготовления противовирусных препаратов. Кроме того, в последнее время все более широкое развитие получает разработка концентрированных и субъединичных вакцин, при изготовлении которых требуется большое количество вирусного материала. Естественно, что стоящая задача может быть решена лишь путем использования постоянных (перевиваемых) линий клеток, отличающихся способностью к бесконечной пересеваемости вне организма, высокой стандартностью, низкой стоимостью, относительной простотой трансфекции рекомбинантной ДНК и последующего клонирования высокоэффективных продуцентов, высокой вероятностью правильного посттрансляционного процессинга вновь синтезируемых белков, кодируемых трансфецирующей ДНК.
Ветеринарная наука в течение последней четверти века накопила большой опыт в изготовлении вирусных вакцин с использованием в качестве субстрата для размножения вирусов культур постоянных линий клеток животных. Особый успех достигнут в изготовлении инактивированной противоящурной вакцины. Производство вакцин против ящура имеет наиболее цитируемую технологию. Она основана на использовании линии трансформированных клеток новорожденного хомяка, выращиваемых в суспензии. Эта технология достаточно экономична, ее выполняют в биореакторах большой емкости. Накоплены определенные доказательства безопасности некоторых постоянных клеточных линий, используемых в качестве субстрата в производстве ряда биологических препаратов. Например, инактивированную противоящурную вакцину готовят из вируса, выращенного в культуре постоянной линии клеток почки новорожденного хомяка (линия ВНК-21). Более чем за 20-летний период этой вакциной привито свыше 100 млн. голов крупного рогатого скота и не обнаружено каких-либо нарушений у привитых животных, по крайней мере, в течение 2—4 лет после введения вакцины. Имеется много других примеров безопасности применения инактивированных и даже живых вакцин против ряда болезней животных, приготовленных из вирусов, размноженных в культурах различных постоянных линий клеток. Применение биологических препаратов, полученных на основе перевиваемых клеточных линий, в медицине началось намного позже, чем в ветеринарной практике.
Несмотря на очевидные преимущества постоянных линий клеток, медицинская практика до недавнего времени воздерживалась от их применения в производстве вирусных вакцин. Причина заключалась в том, что, согласно существовавшему мнению, для изготовления медицинских вирусных вакцин можно было использовать клетки из тканей только клинически здоровых животных. Производство таких вакцин ограничивалось использованием первичных и диплоидных культур клеток. В диплоидных линиях клеток человека никогда не были обнаружены латентные вирусы или спонтанная трансформация клеток. Основное возражение против использования постоянных клеточных линий для репликации вирусов и векторных рекомбинатов в производстве вирусных вакцин медицинского назначения заключалось в их возможной онкогенности из-за контаминации вакцин клеточной ДНК или генными продуктами (регуляторными белками). Интеграция гетерогенной ДНК может привести к предзлокачественным изменениям в результате активации протоонкогенов, запуску онкогенов и инактивации генов опухолевой супрессии. В процессе репродукции вакцинных штаммов для живых вакцин с использованием клеточных линий, латентно контаминированных другими вирусами, могут появляться вирусные гибриды с неожиданными свойствами.
Этот вопрос рассматривался неоднократно на различных научных форумах в Европе и Северной Америке. Ценность постоянных клеточных линий в качестве субстратов стала особенно очевидной благодаря успехам, достигнутым в последнее время в области фундаментальных биологических исследований, а также в связи с перспективой их использования в рекомбинантной ДНК-технологии и получении генно-инженерных биопрепаратов. Общая тенденция к применению постоянных клеточных линий в производстве медицинских иммунобиологических препаратов наметилась на рубеже 70—80-х годов. Так, в 1978 г. в Лейк-Плесиде (США) было предложено использовать лимфобластоидные клетки человека для крупномасштабного производства альфа-интерферона. В 1981 г. Комитет экспертов ВОЗ по стандартизации биологических препаратов одобрил применение неопухолевых и неконтаминированных вирусами постоянных клеточных линий для производства инактивированной полиомиелитной вакцины, а затем также для инактивированной вакцины против бешенства. Такое решение дало возможность в короткий срок разработать методы крупномасштабного выращивания вирусов с использованием микроносителей и создать высокоэффективные вирусные вакцины.
В истории создания биологических препаратов ключевая роль всегда принадлежала выбору приемлемо безопасных вариантов. Решение о применении людям биопрепаратов, полученных с использованием постоянных клеточных линий, основывалось на оценке различными комитетами выгод и риска, связанных с созданием новых препаратов, по сравнению с существующими. Важнейшие потенциальные факторы риска, связанные с биологическими препаратами, производимыми на постоянных клеточных линиях, можно разделить на три категории: примесь гетерогенной ДНК, вирусы и трансформирующие белки.
Одним из основных вопросов, требующих самого пристального внимания, является потенциальная долгосрочная опасность, связанная с присутствием в препаратах примесей гетерогенных ДНК, особенно в тех случаях, когда последние могли содержать потенциально онкогенные кодирующие или регуляторные последовательности.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
факторы роста. Клетки чрезвычайно чувствительны к изменению рН среды. Для контроля рН в среды добавляют индикатор. Большинство клеточных:, культур растет в виде монослоя (пласта, состоящего из одного слоя клетк), прочно прикрепляясь к поверхности контейнера для культивирования — пробирки, пластикового планшета или матрас) (флакон 4-гранной формы). Некоторые типы клеток способы расти также в суспензии.
Приготовление первичной культты клеток включает несколько последовательных этапов: измельчение ткани, разъединение клеток путем трипспозиции отмывание полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост (например, среде 199 с добавлением телячьей сыворотки крови). При оседании клетки довольно прочно прикрепляются к стенке пробирки или флакона, по которой распространяются в виде Монослоя. После получения монослоя жизнеспособной культуры клеток ее заражают материалом, содержащим вирусы. Упомянутые микробы проникают внутрь клеток, где и размножаются. В культурах клеток удается культивировать большинство вирусов, вызывающих заболевания человека.
Внутриклеточные паразиты оказывают цитопатическое действие (ЦПД) на клетки, в которых происходит их репродукция. ЦПД может проявляться деструкцией (лизисом) зараженных клеток, изменением их морфологии (изменением размеров и формы самой клетки, появлением вакуолей или включений, представляющих собой внутриклеточные скопления вирусов, образованием ощцития) и нарушением их функций.
Куриные эмбрионы. Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям. Они пригодны для некоторых вирусов, патогенных для человека.
Для получения чистых культур риккетсий, хламидий и ряда вирусов в диагностических целях, а. также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие большого количеству белков и других соединений, затрудняющих последующую очистку возбудителя при изготовлении различных препаратор
Для заражения куриных эмбрионов исследуемый материал вводят в аллантоисную и амниотическую полости, на хорион-аллантоисную оболочку или в желточный мешок куриного эмбриона (рис.). Для заражения в аллантоисную полость в скорлупе над воздушной камерой (границы ее заранее обводят карандашом при просвечивании яйца) проделывают небольшое отверстие с помощью ножниц, скальпеля или специального буравчика. Шприцем вводят 0,1—0,2 мл вируссодержащего материала на глубину 2—3 мм ниже границы воздушной камеры. Отверстие в скорлупе заливают расплавленным парафином. Вскрытие зараженных эмбрионов производят в сроки максимального накопления вируса (через 48—72 ч инкубации при 37 °С). После обработки спиртом и 2 % раствором йода скорлупу рассекают ножницами немного выше очерченной карандашом границы воздушной камеры, наклоняя яйцо так, чтобы избежать попадания скорлупы в полость. Скорлупу отбрасывают, осторожно снимают ее оболочку и рассматривают хорион-аллантоисную оболочку вокруг места заражения, отмечая наличие или отсутствие очагов поражения — геморрагии, бляшек и др. Затем пастеровской пипеткой прокалывают хорион-аллантоисную оболочку в участке, свободном от сосудов, и отсасывают аллантоисную жидкость. После этого извлекают хорион-аллантоисную оболочку, дважды промывают ее изотоническим раствором хлорида натрия, помещают в чашку Петри и отмечают на черном фоне наличие специфических поражений.
Лабораторные животные. Видовая чувствительность животных, их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки к вирусам Коксаки). Преимущество метода культивирования облигатных внутриклеточных паразитов в организме лабораторных животных перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре клеток или эмбрионе. К его недостаткам относятся высокая вероятность контаминации организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой культуры данного вируса, что увеличивает сроки исследования.

Методы индикации вирусов. Для демонстрации присутствия вируса в клеточной культуре используют несколько методов.
I. О размножении (репродукции) вирусов в культуре клеток судят по цитопаттескому действию (ЦПД), которое может быть обнаружено микроскопически по морфологическим изменениям клеток.
а) Часть таких клеток погибает и отслаивается от стенок пробирки. б)Вирусные частицы, освобождающиеся при разрушении одних клеток, инфицируют другие, которые через некоторое время также погибают. В результате вместо сплошного клеточного монослоя остаются лишь отдельные клеточные островки.
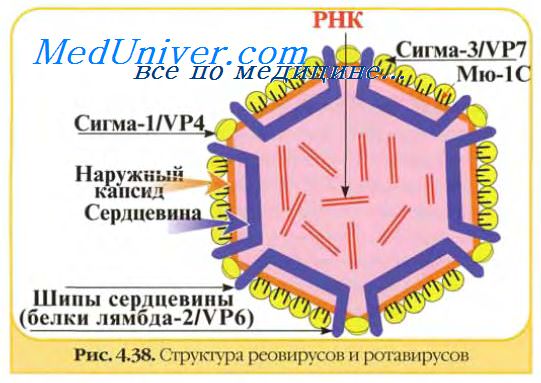
Характер ЦПД, вызванного разными вирусами, неодинаков. При репродукции одних вирусов (парамиксовиру-сы, герпесвирусы) наблюдается слияние клеток с образованием синцития, других (энтеровирусы, реовирусы) — сморщивание и деструкция клеток, третьих (аденовирусы) — агрегация клеток. ЦПД вирусов оценивают в динамике, просматривая культуру клеток под микроскопом в разные сроки после ее заражения вируссодержащим материалом. Некоторые вирусы (энтеровирусы, герпесвирусы) вызывают ЦПД в течение 1—2 сут, другие — в более поздние сроки (на 4^-6-й день). Характер ЦПД используют как для обнаружения вирусов (индикации), так и ориентировочной идентификации, т.е. определения их видовой принадлежности.
Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток. Форма включений различна, а размеры колеблются от 0,25 до 25 мкм. Они представляют собой места скопления вирусных частиц и могут быть выявлены в препаратах, приготовленных из зараженной ткани и окрашенных флюорохромами. В последнем случае используют люминесцентную микроскопию.
Для исследования морфологии контаминированных клеток используют специальный инвертированный микроскоп, у которого осветитель располагается сверху, а объективы — снизу от предметного столика. С помощью такого прибора можно оценивать морфологию клеток, растущих в виде монослоя на поверхности контейнера для культивирования. Морфологические изменения клеток выявляют при микроскопическом исследовании культуры с помощью объектива 8х или 40х. При сравнении клеточного монослоя, инфицированного вирусом, с незараженными клетками в контрольной пробе отмечают полное или островковое разрушение пласта клеток либо другие изменения, которые характеризуют ЦПД вируса. Для более детального изучения ЦПД в контейнер для культивирования помещают покровное стекло, на котором образуется монослой. В дальнейшем стекло извлекают, зараженные клетки фиксируют и готовят микроскопический препарат, который окрашивают флюорохромами и т.д.) и изучают иммерсионным методом.
ЦПД вирусов можно также продемонстрировать с помощью "цветной пробы": метаболически активные клетки культуры в ходе жизнедеятельности выделяют кислые продукты, что вызывает изменение цвета индикатора, присутствующего в культуральной среде. При репродукции вируса клетки утрачивают способность к метаболизму и погибают, поэтому окраска среды с течением времени не меняется.
II. Реакцию гемадсорбции применяют для индикации гемаг-глютинирующих вирусов. Реакция основана на способности поверхности клеток, в которых репродуцируются такие вирусы, адсорбировать эритроциты. Для постановки реакции гемадсорбции в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты.
III. Реакцию гемагглютинации (РГА) применяют для обнаружения гемагглютинирующих вирусов в культуральной жидкости зараженной культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона. Гемагглютинацию — "склеивание" эритроцитов разных видов животных (кур, гусей, морских свинок) — вызывают вирусы, содержащие в оболочке гемагглютинин.Для постановки реакции гемагглютинации к исследуемому материалу добавляют взвесь эритроцитов. В присутствии вирусов происходит агглютинация эритроцитов.
После вскрытия куриного эмбриона аллантоисную жидкость отсасывают и разливают по 0,5 мл в пробирки или лунки плексигласовой пластины (для контроля берут 0,5 мл такой же жидкости незараженного эмбриона). Затем добавляют по 0,2 мл 1 % суспензии отмытых куриных эритроцитов и выдерживают при комнатной температуре. Результаты реакции учитывают через 40 мин после оседания эритроцитов: (++++) — выраженная гемагглютинация — тонкая пленка склеившихся эритроцитов на дне пробирки, имеющая вид зонтика, (+++) — наличие просветов в пленке, (++) — наличие пленки с фестончатыми краями из склеившихся эритроцитов, (+) — хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов, (—) — резко очерченный осадок эритроцитов, неотличимый от контроля. Наличие гемагглютинации в опытных пробирках при ее отсутствии в контрольных указывает на содержание вируса в исследуемой жидкости. Для определения титра РГА ставят реакцию с разведениями вируссодержащей жидкости 10" 1 , 10~ 2 , 10~ 3 и т.д. За титр РГА принимают максимальное разведение, при котором наблюдается гемагглютинация (++). Титр РГА характеризует активность вируса и используется при постановке РТГА.
Для количественного обнаружения вирусных частиц используют методы титрования.Титр вируса можно определить в реакции гемагглютинации с 10-кратными разведениями культуральной среды, или материала из куриного эмбриона, или по ЦПД в культуре клеток. В последнем случае клетки культуры заражают 10-кратными разведениями материала, содержащего вирус. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических (инфекционных) доз (ИД5о)
-Более точным количественным методом учета отдельных вирусных частиц является метод бляшек. Культуру клеток заражают вирусом и покрывают тонким слоем агара. После инкубирования посевов в течение нескольких суток на поверхности агара появляются просветленные участки определенной формы (бляшки), представляющие собой участки погибших клеток в сплошном монослое культуры клеток. Каждая бляшка образуется при размножении одной вирусной частицы и хорошо заметна в виде круглого светлого участка на красном фоне клеток, прижизненно окрашенных нейтральным красным. Титр вируса, установленный этим методом, выражают числом бляшкообразующих единиц (БОЕ) в 1 мл. Размеры, морфология и сроки появления бляшек различаются не только у разных видов вирусов, но и у отдельных штаммов одного и того же вида. Перечисленные признаки используют для селекции штаммов и получения так называемых чистых линий вирусов.
Читайте также:

