Прокариоты и многие вирусы содержат генетическую информацию в молекуле днк
Обновлено: 12.05.2024
• В клетках большинства прокариот присутствует одна кольцевая хромосома
• Генетическая гибкость прокариот и их адаптационные возможности усиливаются при заражении бактериофагами и при переносе плазмид
• Быстрая эволюция генома прокариот обеспечивается транспозонами и другими мобильными элементами
У большинства прокариот присутствует одна кольцевая хромосома, и они являются гаплоидными клетками. В следующем разделе рассмотрены вопросы организации хромосомы в дискретную структуру, нуклеоид. В настоящее время мы располагаем данными секвенирования более 200 геномов прокариот, размеры которых варьируют от 580 кнп (Mycoplasma genitalium) до 9 Мнп (Streptomyces, Myxococcus).
Геном таких хорошо известных бактерий, как Е. coli и В. subtilis, занимает среднее положение (4-5 Мнп). Относительно небольшие размеры прокариотических хромосом, по сравнению с хромосомами высших эукариот, объясняются их компактностью и небольшим количеством некодирующих последовательностей ДНК. В общем, гены, необходимые для постоянного роста и поддержания жизнеспособности прокариот, находятся в хромосоме, а генетическая гибкость микроорганизмов обеспечивается различными мобильными элементами.
У некоторых бактерий хромосома имеет линейную форму, или же в клетке содержится несколько таких хромосом. Встречаются виды, для которых характерны обе эти особенности. Например, клетки Streptomyces содержат линейную хромосому. Концы этой хромосомы замкнуты белковым мостиком, и это объясняет, почему долгое время на генетической карте этих бактерий изображали круговую хромосому.
Бактерии Rhodobacter sphaeroides обладают двумя большими кольцевыми хромосомами (3,0 и 0,9 Мнп), в каждой из которых присутствует много необходимых генов домашнего хояйства. Возбудитель Лайм-боррелиоза, бактерия Воrrelia burgdorferi характеризуется наличием нескольких линейных хромосом.
Стабильные элементы внехромосомной ДНК, которые не несут необходимых генов домашнего хозяйства и поэтому не являются существенными, называются плазмиды. На рисунке ниже перечислены некоторые хорошо изученные плазмиды бактерий. Эти данные дают представление о размерах генов, которые могут нести эти плазмиды. Плазмиды обычно невелики, варьируя по размерам от 2 до 1000 кнп, и обладают кольцевой структурой.
Так же как и в случае хромосом, известны исключения, и некоторые крупные плазмиды достигают размера 1 Мнп или больше, и небольшая их часть обладает линейной структурой. Все плазмиды несут гены, управляющие их репликацией, обычно включающей различные элементы аппарата репликации клетки хозяина. К числу важнейших генов, которые несут плазмиды, относятся гены устойчивости к антибиотикам и обусловливающие патогенные свойства или деградацию необычных источников углерода.
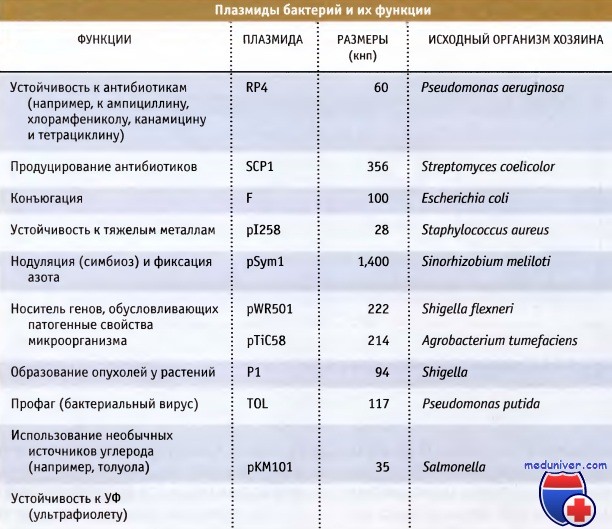
Плазмиды бактерий и их функции.
Плазмиды могут распространяться между организмами различными путями. Конъюгация представляет собой процесс, напоминающий спаривание, при котором присходит прямой перенос ДНК от клетки донора, содержащей плазмиду, в клетку реципиента. В донорской плазмиде закодированы функции, необходимые дляУ большинства прокариот присутствует одна кольцевая хромосома, и они являются гаплоидными клетками. В следующем разделе рассмотрены вопросы организации хромосомы в дискретную структуру, нуклеоид.
В настоящее время мы располагаем данными секвенирования более 200 геномов прокариот, размеры которых варьируют от 580 кнп (Mycoplasma genitalium) до 9 Мнп (Streptomyces, Myxococcus). Геном таких хорошо известных бактерий, как Е. coli и В. subtilis, занимает среднее положение (4-5 Мнп). Относительно небольшие размеры прокариотических хромосом, по сравнению с хромосомами высших эукариот, объясняются их компактностью и небольшим количеством некодирующих последовательностей ДНК. В общем, гены, необходимые для постоянного роста и поддержания жизнеспособности прокариот, находятся в хромосоме, а генетическая гибкость микроорганизмов обеспечивается различными мобильными элементами.
У некоторых бактерий хромосома имеет линейную форму, или же в клетке содержится несколько таких хромосом. Встречаются виды, для которых характерны обе эти особенности. Например, клетки Streptomyces содержат линейную хромосому. Концы этой хромосомы замкнуты белковым мостиком, и это объясняет, почему долгое время на генетической карте этих бактерий изображали круговую хромосому.
Бактерии Rhodobacter sphaeroides обладают двумя большими кольцевыми хромосомами (3,0 и 0,9 Мнп), в каждой из которых присутствует много необходимых генов домашнего хояйства. Возбудитель Лайм-боррелиоза, бактерия Воrrelia burgdorferi характеризуется наличием нескольких линейных хромосом.
Стабильные элементы внехромосомной ДНК, которые не несут необходимых генов домашнего хозяйства и поэтому не являются существенными, называются плазмиды. На рисунке ниже перечислены некоторые хорошо изученные плазмиды бактерий. Эти данные дают представление о размерах генов, которые могут нести эти плазмиды. Плазмиды обычно невелики, варьируя по размерам от 2 до 1000 кнп, и обладают кольцевой структурой.
Так же как и в случае хромосом, известны исключения, и некоторые крупные плазмиды достигают размера 1 Мнп или больше, и небольшая их часть обладает линейной структурой. Все плазмиды несут гены, управляющие их репликацией, обычно включающей различные элементы аппарата репликации клетки хозяина. К числу важнейших генов, которые несут плазмиды, относятся гены устойчивости к антибиотикам и обусловливающие патогенные свойства или деградацию необычных источников углерода.
Плазмиды могут распространяться между организмами различными путями. Конъюгация представляет собой процесс, напоминающий спаривание, при котором присходит прямой перенос ДНК от клетки донора, содержащей плазмиду, в клетку реципиента. В донорской плазмиде закодированы функции, необходимые для обеспечения контакта с клеткой реципиентом, инициации переноса реплицированной ДНК, и самого переноса ДНК в клетку реципиента.
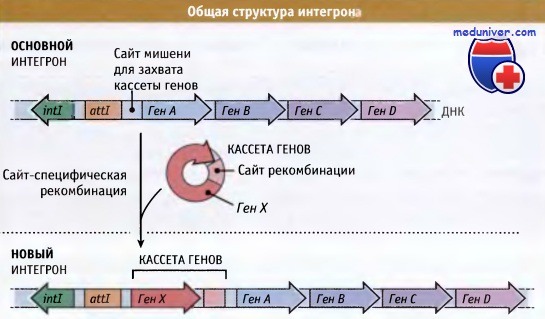
Структура типичного интегрона после накопления нескольких кассет генов.
Плазмиды также могут передаваться при прямом захвате ДНК (трансформация) или с участием бактериофага (трансдукция). Независимо от наличия экстрахромосомных элементов, изменения в бактериальном геноме могут возникать за счет процессов гомологичной и сайт-специфической рекомбинации.
Для многих бактерий важными источниками генетической вариабельности, по-видимому, являются бактериофаги (бактериальные вирусы). Результаты секвенирования показывают, что в геноме многих бактерий присутствуют интегрированные последовательности бактериофага (профаги). Например, у Е. coli их по меньшей мере 9, а у B. subtilis 10. Некоторые из этих профагов обладают дефектами, например у них присутствуют делеции и другие мутации, что делает маловероятным их дальнейшую активацию с образованием инфекционных бактериофагов.
В некоторых случаях профаги несут гены, которые обеспечивают некоторые преимущества клеткам хозяина: это относится к системам рестрикции и модификации, устойчивости к УФ и к таким детерминантом патогенности, как токсины.
Наконец, бактериальный геном также содержит много мобильных генетических элементов, которые распространяются посредством транспозиции. Инсерционные последовательности содержат минимальные элементы, которые, в своей простейшей форме, вместе с фланкирующими последовательностями, обладают только одним геном транспозазы. При инициации транспозиции, фланкирующие последовательности узнаются белком транспозазой.
Затем происходит мобилизация ферментов клетки хозяина, участвующих в репликации и репарации ДНК. Они завершают процесс вставки последовательности в необходимом месте. Более сложные транспозоны несут дополнительные гены, способные обеспечить адаптационные преимущества клеткам хозяина. Наиболее известными примерами транспозонов у бактерий являются гены устойчивости к антибиотикам, однако подобным образом могут переноситься также многие другие гены. Близкие к транспозонам элементы могут катализировать несколько таких типов перегруппировок ДНК, как инверсии и делеции.
Интегроны представляют собой особенно важный инструмент адаптивной перегруппировки генома. Как показано на рисунке ниже, интегроны обычно состоят из гена интегразы, примыкающего к нему сайта мишени для захвата кассеты генов, и сильного промотора, регулирующего экспрессию захваченных генов. В кассетах, часто включающих гены устойчивости к антибиотикам, содержатся последовательности, которые позволяют им включаться на место мишени под действием белка интегразы. Интегроны могут расти за счет последовательного захвата различных кассет генов, что способствует быстрому развитию таких бактерий, которые устойчивы к ряду антибиотиков.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Существуют вирусы, имеющие одно– и двухцепочечные РНК, и вирусы, имеющие одно– и двухцепочечные ДНК, причем обе группы ДНК-содержащих вирусов имеют представителей с линейными и кольцевыми формами. У аденовирусов двухцепочечная ДНК связана с терминальным белком, а у вируса оспы ДНК замкнута на концах ковалентной связью (Льюин Б., 1987).
ДНК-содержащие вирусы, особенно фаги (вирусы бактерий), обычно значительно крупнее РНК-содержащих. Так ДНК фага Т4 содержит 180 000 п. н. и кодирует множество белков. Крупные молекулы ДНК вирусов компактно упакованы внутри капсида благодаря суперспирализации.
Возможны два варианта развития вируса в клетке: либо интеграция с геномом хозяина – лизогения, либо синтез вирусных частиц на основе генетической программы вируса, но с помощью метаболической системы хозяина – лизис. Второй вариант обычно приводит к разрушению клетки-хозяина. Факт регуляции генной активности вируса, его способности существовать в интегрированной форме, был доказан в работах нобелевского лауреата 1965 г., французского микробиолога А. Львова (1902–1994). Интегрированная форма вируса получила название профаг. Под действием внешних факторов (например, УФ-облучение) возможна активация профага и вновь превращение его в фаг.
Вирусы обычно обладают специфичностью в отношении клеток организма хозяина.
Главная особенность организации генома прокариот – это их объединение в группы, или кластеры, с общей регуляцией. Группа структурных генов прокариот, находящихся под контролем одного регуляторного участка, называется опероном (Miller J., Reznikoff W., 1978). Организация генетического материала по типу оперона позволяет бактериям быстро переключать метаболизм с одного субстрата на другой. Бактерии не синтезируют ферменты определенного метаболического пути в отсутствие необходимого субстрата, но способны в любой момент начать их синтез при появлении этого субстрата. Структура и функционирование оперона были показаны в работах знаменитых французских биохимиков Ж. Моно (1910–1976) и Ф. Жакоба, разделивших с А. Львовым Нобелевскую премию 1965 г. Регуляцию по типу оперона мы рассмотрим ниже.
Особый интерес представляют плазмиды – небольшие кольцевые молекулы ДНК внутри бактериальной клетки. Подобно вирусам, плазмиды способны либо интегрироваться с бактериальной ДНК, либо существовать обособленно от нее. Крупные плазмиды присутствуют в клетке в количестве 1–3 копий, мелкие могут быть представлены десятками копий. Хорошо изучена самая первая из обнаруженных плазмид, крупная плазмида F бактерии E. coli. Она представляет собой кольцевую молекулу ДНК величиной в 100 тыс. п. н. и содержит более 60 генов. Плазмида F обеспечивает содержащим ее бактериальным клеткам возможность взаимодействовать с бесплазмидными бактериями и передавать им свою генетическую информацию.
Многие авторы считают, что плазмиды являются одной из разновидностей вирусов и между ними нет принципиальных различий (Жданов В. М., 1988; Кусакин О. Г., Дроздов А. Л., 1994).
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Инфекционная РНК и реконструкция вирусов
Инфекционная РНК и реконструкция вирусов Доказательства того, что РНК вирусов является генетическим материалом, предоставил нам все тот же ВТМ. Прежде всего ученым удалось изменить частицы ВТМ, устранив из их состава белковый компонент. В таком состоянии вирусы
Мутации вирусов в лаборатории
Мутации вирусов в лаборатории Мы говорили о мутантах ВТМ, созданных природой. Сегодня нам известны уже и его лабораторные мутанты. Первые из них увидели свет в лаборатории Г. Шрамма.Шрамм в своих опытах исходил из возможности замены аминогруппы (—NH2) в молекуле цитозина
Угроза вирусов
11. Культивирование вирусов. Противовирусный иммунитет
11. Культивирование вирусов. Противовирусный иммунитет Основные методы культивирования вирусов:1) биологический – заражение лабораторных животных. При заражении вирусом животное заболевает;2) культивирование вирусов в развивающихся куриных эмбрионах. Куриные
2.4. Влияние вирусов на организм человека
2.4. Влияние вирусов на организм человека Большую группу паразитов человека, животных и растений образуют вирусы. Они могут вызывать ряд тяжелых заболеваний, таких как натуральная и ветряная оспа, полиомиелит и др. Вирусы изучаются специальной наукой –
1. Морфология и структура вирусов
1. Морфология и структура вирусов Вирусы – микроорганизмы, составляющие царство Vira.Отличительные признаки:1) содержат лишь один тип нуклеиновой кислоты (РНК или ДНК);2) не имеют собственных белоксинтезирующих и энергетических систем;3) не имеют клеточной
2. Взаимодействие вирусов с клеткой хозяина
2. Взаимодействие вирусов с клеткой хозяина Взаимодействие идет в единой биологической системе на генетическом уровне.Существует четыре типа взаимодействия:1) продуктивная вирусная инфекция (взаимодействие, в результате которого происходит репродукция вируса, а
3. Культивирование вирусов
3. Культивирование вирусов Основные методы культивирования вирусов:1) биологический – заражение лабораторных животных. При заражении вирусом животное заболевает. Если болезнь не развивается, то патологические изменения можно обнаружить при вскрытии. У животных
Глава 5 Сетевая геномика мира прокариот: вертикальные и горизонтальные потоки генов, мобиломы и динамика пангеномов
Глава 5 Сетевая геномика мира прокариот: вертикальные и горизонтальные потоки генов, мобиломы и динамика пангеномов Пер. В. АнисимоваКогда Дарвин писал об эволюции, он имел в виду животных и растения, по крайней мере он использовал эти сложные многоклеточные организмы во
Глава 10 Мир вирусов и его эволюция
Глава 10 Мир вирусов и его эволюция Пер. Г. ЯнусаВирусы были открыты как нечто совсем непримечательное, а именно необычная разновидность инфекционных агентов, а возможно, и особый род токсинов, вызывающих болезни растений, например табачную мозаику. Так как эти агенты
3.2. Генетический материал эукариот
3.2. Генетический материал эукариот Генетический материал эукариот сконцентрирован в ядре и представлен хромосомами, в которых молекула ДНК образует сложный комплекс с различными белками.Каждая клетка любого организма содержит определенный набор хромосом.
6.6. Регуляция экспрессии генов у прокариот
6.6. Регуляция экспрессии генов у прокариот В клетках прокариот процессы транскрипции и трансляции протекают почти одновременно, поэтому весьма сложно внести какие-либо изменения в структуру синтезированной РНК. Регуляция генной активности прокариот практически
Открытие фильтрующихся вирусов
Открытие фильтрующихся вирусов Вирусы… Живые существа, увидеть которые позволил лишь электронный микроскоп при увеличении в десятки тысяч раз, а тонкую структуру — в сто тысяч раз и более. Вирусология — наука о вирусах, расцвет которой стал возможным лишь в наш век
Сколько всего вирусов?
Сколько всего вирусов? Вирусами называют внеклеточные формы жизни, способные проникать в определенные живые клетки и размножаться только внутри них. Вирусы являются внутриклеточными паразитами на генетическом уровне. Впервые их (вирус табачной мозаики) открыл в 1892 году

Обзор
Многообразие мобильных генетических элементов
Автор
Редакторы

Организмы и геномы можно таким образом расценивать как секции биосферы, по которым гены глобально циркулируют с различной интенсивностью, и в которые персональные гены и опероны могут включаться, если они предоставляют достаточные преимущества.
K. Jeon и J. Danielli [1]

Основные сокращения
МГЭ мобильные генетические элементы ГГП горизонтальный генетический перенос ОРС открытая рамка считывания, последовательность нуклеотидов между инициирующим и терминирующим кодонами гена ori T место начала переноса цепи плазмидной ДНК при мобилизации ori V место начала репликации (копирования, воспроизводства) плазмидной ДНК rep ген белка-инициатора репликации многих бактериальных плазмид
Вирусы: суперпаразиты и помощники
В 2012 году охарактеризовали интегрированную в ДНК мимивирусов форму вирофага и даже новый класс МГЭ — трансповироны, способные встраиваться в ДНК и мимимирусов, и вирофагов [7]. Подобно бактериофагам, переносящим гены от одних бактерий к другим, вирофаги могут играть важную роль в ГГП между разными группами вирусов и их хозяевами.
Многие профаги кодируют факторы вирулентности, трансформируя нетоксигенные бактерии в агентов-убийц: профаг CTXphi из Vibrio cholerae кодирует холерный токсин, а упомянутый выше P22 — ферменты конверсии О-антигена сальмонеллы, позволяя ей уходить от иммунного надзора.
В составе фагов обнаруживают другие МГЭ (например, транспозоны, несущие гены антибиотикорезистентности) и их модули (системы репликации и переноса конъюгативных плазмид). Самый известный пример слияния модулей фагового и плазмидного происхождения — фаг Р1, способный реплицироваться и длительно поддерживаться вне хромосомы, ничем не отличаясь от плазмиды. Профаги разных бактерий детально рассмотрены в обзоре [8].
Плазмиды — маленькие гиганты больших процессов
Плазмиды — внехромосомные двуцепочечные молекулы ДНК, способные к длительному автономному существованию в клетках прокариот и некоторых эукариот. Чаще всего плазмидные ДНК суперскручены и ковалентно замкнуты в кольцо, однако у актиномицетов и спирохет встречаются и линейные формы, что обычно сочетается с линейной организацией хромосом. Размер плазмид обычно варьирует от 0,85 т.п.н. (pRKU1 из Thermotoga petrophila) до 600 т.п.н., но у бруцелл и ризобий описаны мегаплазмиды размером более 1 млн п.н., что иногда делает вопрос их дифференцировки от дополнительных хромосом риторическим [9]. Элиминация мегаплазмид, в отличие от хромосом, обычно не вызывает фатальных для бактериальной клетки последствий, однако вместе с плазмидами могут утратиться такие важные функции, как способность к фиксации азота и формированию симбиотических клубеньков (у ризобий).
На долю плазмидной ДНК может приходиться 1–15% наследственной информации бактериальной клетки, однако известны случаи, когда плазмидами контролируется до 25% (у некоторых Archaea) и даже до 40% информации (2 мегаплазмиды размером около 1,4 и 1,6 млн п.н. у Sinorhizobium meliloti).
Плазмидами часто мобилизуются сосуществующие с ними в одной клетке неконъюгативные МГЭ (но обладающие как минимум сайтом начала переноса oriT, а чаще и генами mob) и даже хромосомы. Мобилизация генов хромосомы возможна в случае интеграции в неё конъюгативной плазмиды. Это возможно, когда в обеих молекулах присутствуют одинаковые инсерционные последовательности (IS-элементы), обеспечивающие гомологичную рекомбинацию (типичный пример — F-фактор E.coli). Однако интеграция может быть и RecA-независимой, если плазмида кодирует тирозиновую интегразу (плазмиды стрептомицетов pSE101, pSAM2 и псевдомонад pKLK106). В этом случае интеграция чаще происходит в гены тРНК, но в некоторых хозяевах эта закономерность нарушается [3].
Транспозоны — универсальные генетические челноки
Транспозоны — МГЭ, перемещающиеся как в пределах одной молекулы ДНК, так и между разными репликонами одного генома (конъюгативные транспозоны — и между геномами). Фланкированы инвертированными повторами, а в центральной части содержат гены, ответственные за перемещение. Транспозоны прокариот подразделяют на IS-элементы, Tn-элементы и Mu-подобные фаги [10].
Интегроны — природные системы клонирования и экспрессии
В процессе перемещения от одного интегрона к другому или от одного сайта в интегроне к другому сайту, генная кассета существует как автономная и неспособная к репликации двунитевая кольцевая молекула ДНК. Кассеты, захватываемые интегронами и суперинтегронами, могут содержать гены факторов патогенности, метаболических путей, детерминанты антибиотико- и дезинфектантоустойчивости или гены рестрикционных ферментов. Интеграза IntI катализирует сайт-специфическую рекомбинацию между сайтами attI и attC, в результате чего происходит интеграция или вырезание кассеты. Множество событий интеграции ведет к образованию мультикассетных рядов, в которых все кассеты фланкированы attC-сайтами. Известны хромосомные суперинтегроны, включающие до 179 генных кассет (у Vibrio cholerae), однако среди клинически значимых бактерий большинство интегронов содержит до 5–8 генных кассет. Наиболее эффективно экспрессируются кассеты, расположенные ближе к промотору, но изменение селективного давления может способствовать перестройкам в составе интегрона.

Рисунок 3. Интегрон — ДНК, улавливающая генные кассеты и распространяемая в составе более высокоорганизованных МГЭ. а — Структура интегрона класса 1. Pint — промотор интегразы, Pant — промотор кассет антибиотикорезистентности. Остальные элементы объяснены в тексте; б — Иерархическая организация МГЭ.
Все интегроны, несущие кассеты антибиотикорезистентности, разделяют на 5 классов на основании гомологии последовательностей кодируемых ими интеграз. Большинство интегронов антибиотикорезистентности относится к классу 1 (часто ассоциированы с Tn21-семейством). Они включают два концевых невариабельных региона, называемых константными последовательностями (constant sequences, CS), и высоковариабельный центральный участок. В одном конце интегрона (5’-CS), обычно находятся intI, attI и промотор, от которого экспрессируются гены кассеты. В другом конце (3’-CS), находится часть гена qacEΔ1, который, будучи интактным, несёт устойчивость к четвертичным аммониевым соединениям. За ним расположен ген sul, определяющий резистентность микроорганизма к сульфаниламидам, и 1–2 гена с неустановленной функцией — orf5 и иногда orf6 (рис. 3, а). Интегроны класса 2 ассоциированы с Tn7-семейством, классов 3 и 5 — с плазмидами, класса 4 — с конъюгативным геномным островом SXT Vibrio cholerae.

Рисунок 4. Схематическое изображение структуры геномного острова в составе бактериальной хромосомы. DR — прямые повторы ДНК хромосомы, фланкирующие ГО; IS — инсерционные элементы.
Геномные острова гонококков (GGI) кодируют систему секреции типа IV (T4SS), родственную плазмидным системам конъюгационного переноса. Посредством T4SS распространяется не только сам элемент и его продукты, но секретируется в окружающую среду и хромосома Neisseria gonorrhoeae, которая затем может трансформировать другие бактерии и участвовать в рекомбинационных событиях.
Главные нарушители границ и их мекка
Из обитателей отстойников, а что самое опасное — из бактерий вод, уже прошедших очистку, — в большом количестве выделяют плазмиды IncP-1-группы несовместимости (в системе классификации плазмид псевдомонад) [12]. Эти относительно небольшие молекулы дарят хозяевам массу селективных преимуществ (от множественной резистентности до биодеградации хлорорганики) и способны распространяться не только среди псевдомонад, но и практически всех грамотрицательных и некоторых грамположительных бактерий. Кроме того, они способны мобилизовать неконъюгативные R-плазмиды (например, IncP-4) к переносу в ещё более широкий спектр бактерий, а также в дрожжи и клеточные линии млекопитающих [17].
Биология плазмид в России и за рубежом. Что же можно возвести на крепком фундаменте?

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Читайте также:

