Противовирусные препараты на основе четвертичных аммониевых солей
Обновлено: 24.04.2024
Фармакологическая группа вещества Гиосцина бутилбромид
Нозологическая классификация
Код CAS
Характеристика
Полусинтетическое производное гиосциамина — алкалоида, содержащегося в красавке, белене, дурмане, скополии; четвертичное аммониевое соединение. Белый кристаллический порошок, легко растворим в воде, растворим в спирте. Молекулярная масса — 440,38.
Фармакологическое действие
Фармакология
Блокирует м-холинергические рецепторы. Вызывает атропиноподобные эффекты: расширение зрачков, паралич аккомодации, повышение внутриглазного давления, увеличение ЧСС , ускорение синоатриальной и AV проводимости, стимулирует автоматизм синусного узла и функциональную активность AV узла, расслабляет гладкие мышцы ЖКТ , желче- и мочевыводящих путей, матки, бронхов, замедляет перистальтику, уменьшает секрецию экскреторных желез (слюнных, слизистых, потовых).
После приема внутрь плохо всасывается из ЖКТ . Связывание с белками низкое.
Применение вещества Гиосцина бутилбромид
Спастические состояния ЖКТ , желчного и мочеполового тракта (почечная колика, желчная колика, холецистит, кишечная колика, пилороспазм), спастическая дискинезия желчевыводящих путей и желчного пузыря, язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения (в составе комплексной терапии), альгодисменорея, эндоскопические и функциональные диагностические исследования органов пищеварения (для расслабления гладкой мускулатуры).
Противопоказания
Гиперчувствительность (в т.ч. к другим алкалоидам красавки), закрытоугольная глаукома, миастения gravis, мегаколон, детский возраст до 6 лет.
Ограничения к применению
Подозрение на кишечную непроходимость (в т.ч. стеноз привратника), обструкция мочевыводящих путей (в т.ч. аденома предстательной железы), склонность к тахиаритмиям (в т.ч. мерцательная тахиаритмия).
Применение при беременности и кормлении грудью
Возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода или ребенка.
Побочные действия вещества Гиосцина бутилбромид
Со стороны нервной системы и органов чувств: сонливость, амнезия, нарушение аккомодации, повышение чувствительности глаз к свету, обострение глаукомы.
Со стороны органов ЖКТ: сухость слизистой оболочки полости рта и глотки, запор, тошнота и рвота.
Аллергические реакции: кожные проявления, анафилаксия с эпизодами затрудненного дыхания.
Прочие: сухость кожных покровов, покраснение кожи, тахикардия, затруднение мочеиспускания, уменьшение потоотделения.
Взаимодействие
Усиливает м-холиноблокирующее действие трициклических антидепрессантов (в т.ч. амитриптилина, кломипрамина, имипрамина), H1-антигистаминных средств, хинидина, амантадина, дизопирамида, других м-холинолитиков (в т.ч. ипратропия бромида, тиотропия бромида). Совместное применение гиосцина бутилбромида и антагонистов дофамина (например, метоклопрамида) приводит к ослаблению действия на ЖКТ обоих ЛС. Гиосцина бутилбромид увеличивает риск тахикардии, вызываемой бета-адренергическими средствами.
Передозировка
Симптомы: расширение зрачков и отсутствие реакции на свет, сухость слизистых оболочек, охриплость голоса, затруднение глотания, тахикардия, гипертермия, гиперемия кожи, нарушение сознания, галлюцинации, судороги, сменяющиеся угнетением ЦНС , остановкой дыхания, парезом кишечника и мочевого пузыря.
Лечение: промывание желудка с активированным углем и затем с 15% магния сульфатом, форсированный диурез, повторные введения физостигмина (каждые 0,5–1 ч) или галантамина (каждые 1–2 ч), для устранения пареза кишечника и тахикардии возможно введение неостигмина метилсульфата, при умеренном возбуждении и не тяжелых судорогах — магния сульфата; в тяжелых случаях — натрия оксибат, оксигенотерапия, ИВЛ; при затрудненном мочеиспускании — катетеризация мочевого пузыря. Пациентам с глаукомой — инстилляция пилокарпина, в случае необходимости возможно системное введение холиномиметиков.
Способ применения и дозы
Внутрь, ректально, доза подбирается индивидуально. Взрослым и детям старше 6 лет: внутрь — по 10–20 мг 3–5 раз в сутки или ректально — по 10–20 мг (1–2 супп.) 3 раза в сутки.
Меры предосторожности
Необходимо учитывать значительные различия индивидуальной чувствительности к гиосцину, в т.ч. возможность возникновения возбуждения, галлюцинаций при приеме обычных доз у отдельных пациентов. Риск побочных эффектов возрастает в пожилом возрасте. Запрещается прием алкоголя во время лечения. Следует избегать перегрева при выполнении интенсивных физических нагрузок и в жаркую погоду, а также горячих ванн и сауны. В период терапии не рекомендуется вождение автотранспорта и другие виды деятельности, требующие повышенной скорости реакции. Для уменьшения сухости во рту можно использовать жевательную резинку без сахара, мелкие кусочки льда, заменители слюны. Следует учитывать, что сохраняющаяся более 2 недель сухость во рту повышает риск возникновения заболеваний зубной эмали, десен, грибковых инфекций полости рта. Отмена препарата должна проводиться постепенно (при быстрой отмене возможно возникновение тошноты, потливости, головокружения).
Широкая распространённость средств на основе только ЧАС связана с их относительно низкой токсичностью и отсутствием выраженного коррозионного воздействия на предметы обихода и медицинский инструментарий.
Как правило, в ассортименте каждого производителя дезсредств есть одно или несколько наименований, содержащих в качестве действующего вещества (ДВ) только ЧАС. Это связано с доступностью сырья и его относительно низкой стоимостью. Достаточно сказать, что цена 1 кг субстанции, содержащей 50% ЧАС, стоит примерно 150-250 руб. и зависит от производителя субстанции и вариаций состава ЧАС. Упрощенно говоря, задача производителя дезсредства – разбавить субстанцию и добавить вспомогательные компоненты (ПАВ, соли, кислоты и др.).
Таким образом, средства на основе ЧАС удобны как для потребителей (низкая токсичность, малая коррозионная активность), так и для производителей (доступность сырья и относительно низкая его стоимость).
Для того чтобы среди большого количества торговых марок (более 100 наименований) средств на основе только ЧАС выбрать требуемый дезпрепарат, необходимо обладать знаниями о бактерицидных концентрациях ЧАС в рабочих растворах дезинфектантов.
Нужно отметить, что ответ на вопрос о бактерицидных концентрациях ЧАС в рабочих растворах до сих пор ставит в тупик многих практикующих больничных эпидемиологов. Одни считают, что ЧАС эффективны в крайне малых концентрациях, другие, наоборот, утверждают, что ЧАС не эффективны в малых концентрациях
Для того чтобы досконально разобраться с вопросом эффективных концентраций ЧАС, обратимся к научным исследованиям. Первое что нам необходимо - это разобраться с терминологией. Существует, как минимум, два научных термина, связанных с концентрацией бактерицидных агентов: минимальная ингибирующая концентрация (МИК) и минимальная бактерицидная концентрация (МБК).
Применительно к дезсредствам на основе ЧАС термин минимальная ингибирующая концентрация (МИК) трактуется следующим образом: это минимальная концентрация ЧАС в рабочем растворе дезсредства, которая предотвращает рост бактериальных клеток. Следует отметить, что МИК не обеспечивает полного уничтожения бактериальных клеток, а лишь препятствует размножению бактерий.
Термин минимальная бактерицидная концентрация (МБК) применительно к ЧАС можно сформулировать таким образом – это минимальная концентрация ЧАС в рабочем растворе дезсредства, при которой обеспечивается полное уничтожение клеток бактерий.
МИК и МБК являются параметрами специфическими и часто характеризуют определенный штамм какого-либо бактериального микроорганизма, более того, термин МИК более характерен для исследования активности антибиотиков, но тем не менее, часто используется в научной литературе при исследовании активности дезсредств. В контексте данной статьи МИК - это бактериостатическая концентрация, тем не менее, будем использовать более общий термин - МИК.
Таким образом, для целей бактерицидной дезинфекции необходимо чтобы в рабочем растворе концентрация ЧАС была, по крайней мере, не менее МБК, более того, концентрация ЧАС в растворе не должна быть меньшей МИК.
В сороковых годах прошлого века, когда ученые активно исследовали новую по тем временам дезинфицирующую субстанцию - ЧАС, некоторыми исследователями была сделана методическая ошибка: они приняли МИК за МБК. Далее эта ошибка была исправлена путем введения в методику исследований этапа нейтрализации ДВ и др.
Всё дело в том, что если обработать контаминированные объекты раствором, содержащим ЧАС в концентрациях равных МИК, визуальный контроль эффективности покажет отсутствие роста микроорганизмов на питательной среде. Но этот факт не будет означать, что бактерии уничтожены. Это будет лишь свидетельством того, что живые бактерии находятся в условиях, неблагоприятствующих их размножению. И если, к примеру, в систему, где не наблюдался рост, добавить стерильную воду, через некоторое время можно будет наблюдать рост микроорганизмов, так как концентрация ЧАС в системе стала меньше МИК (за счет разбавления водой) и более не мешает запуску механизмов размножения у бактерий.
Итак, для того чтобы средство на основе ЧАС эффективно уничтожало бактерии, необходимо, чтобы концентрации ЧАС в рабочих растворах были не менее МБК, и уж тем более, не меньшей МИК (бактериостатических концентраций).
В таблице, приведенной ниже, собраны данные о значениях МИК и МБК для ЧАС, полученные исследователями для микроорганизмов в разных лабораториях.

Данные, приведенные в таблице, свидетельствуют, что жесткой границы между МБК и МИК по отношению к ЧАС указать невозможно. Более того, на первый взгляд, приведенные данные кажутся не совсем логичными. Так, например, для некоторых микроорганизмов, минимальные ингибирующие концентрации ЧАС, определенные одними авторами, могут быть выше минимальных бактерицидных концентраций ЧАС, но определенных другими исследователями.
Все это легко объяснимо тем, что в разных работах исследовались различные микроорганизмы с различной устойчивостью к ЧАС. Многие штаммы, описанные в таблице - это не музейные культуры, а реальные микробы, взятые непосредственно с объектов, или выделенные из субстратов.
Можно утверждать, что в большинстве случаев при концентрации ЧАС в растворе 0,01% (по ЧАС) будет проявлять бактерицидное действие на штаммы S. Aureus, E. Coli, но на некоторые устойчивые штаммы – только ингибирующее (бактериостатическое).
В одной из работ 4 , было установлено, что реально существующий штамм сальмонеллы S. Typhimurium оказался устойчив к концентрации ЧАС 0,0256% (МИК).
Таким образом, для бактерий S. Aureus, E. Coli можно определить ограничение на необходимое содержание ЧАС в растворе: оно должно быть не менее 0,01% ЧАС, для того чтобы уничтожить возможные устойчивые штаммы указанных микроорганизмов.
Таким образом, несмотря на большой разброс данных, касающихся бактерицидных и бактериостатических концентраций ЧАС, путем сопоставления и анализа данных можно сделать следующие выводы:
- для предотвращения образования устойчивых штаммов бактерий типа S. Aureus, E. Coli необходимо выбирать такие средства на основе только ЧАС, у которых режимы гарантируют наличие в рабочем растворе 0,01% ЧАС и более;
- для предотвращения образования устойчивых штаммов бактерий сальмонелл необходимо выбирать такие средства на основе только ЧАС, у которых режимы гарантируют наличие в рабочем растворе 0,025% ЧАС и более;
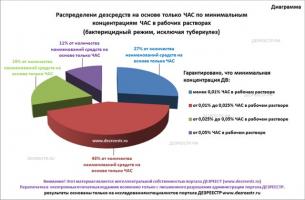
Каково же распределение средств на основе только ЧАС в зависимости от концентраций ЧАС в рабочих растворах в режимах бактерицидной дезинфекции поверхностей? Есть ли на рынке такие средства? Ответы на эти вопросы наглядно представлены на диаграмме, приведенной ниже.

Как видно, 19% от наименований существующих препаратов на основе только ЧАС в бактерицидных режимах гарантированно обеспечат концентрации ДВ в рабочих растворах от 0,025% до 0,05%, и 11% от наименований торговых марок дезинфектантов на основе только ЧАС, в антибактериальных режимах обеспечат концентрацию ЧАС в рабочих растворах не менее 0,05%. Всё это свидетельствует, что на российском рынке существуют средства на основе ЧАС, которые могут оказаться эффективными при бактерицидной (иск. туберкулез) дезинфекции поверхностей.
При использовании этой группы дезсредств необходимо учитывать высокую вероятность образования устойчивых штаммов возбудителей ВБИ, поэтому необходимо обеспечить мониторинг устойчивости бактериальной микрофлоры, циркулирующей в ЛПО, для своевременного проведения ротации дезинфектантов.
В последние десятилетия отмечается значительный рост грибковых заболеваний. Это связано со многими факторами и, в частности, с широким применением в медицинской практике антибиотиков широкого спектра действия, иммунодепрессантов и других групп ЛС.
В связи с тенденцией к росту грибковых заболеваний (как поверхностных, так и тяжелых висцеральных микозов, ассоциированных с ВИЧ-инфекцией, онкогематологическими заболеваниями), развитием устойчивости возбудителей к имеющимся ЛС, выявлением видов грибов, ранее считавшихся непатогенными (в настоящее время потенциальными возбудителями микозов считаются около 400 видов грибов), возросла потребность в эффективных противогрибковых средствах.
Противогрибковые средства (антимикотики) — лекарственные средства, обладающие фунгицидным или фунгистатическим действием и применяемые для профилактики и лечения микозов.
Для лечения грибковых заболеваний используют ряд лекарственных средств, различных по происхождению (природные или синтетические), спектру и механизму действия, противогрибковому эффекту (фунгицидный или фунгистатический), показаниям к применению (местные или системные инфекции), способам назначения (внутрь, парентерально, наружно).
Существует несколько классификаций лекарственных средств, относящихся к группе антимикотиков: по химической структуре, механизму действия, спектру активности, фармакокинетике, переносимости, особенностям клинического применения и др.
В соответствии с химическим строением противогрибковые средства классифицируют следующим образом:
1. Полиеновые антибиотики: нистатин, леворин, натамицин, амфотерицин В, микогептин.
2. Производные имидазола: миконазол, кетоконазол, изоконазол, клотримазол, эконазол, бифоназол, оксиконазол.
3. Производные триазола: флуконазол, итраконазол, вориконазол.
4. Аллиламины (производные N-метилнафталина): тербинафин, нафтифин.
5. Эхинокандины: каспофунгин.
6. Препараты других групп: гризеофульвин, аморолфин, циклопирокс, флуцитозин.
Подразделение противогрибковых препаратов по основным показаниям к применению представлено в классификации Д.А. Харкевича (2006 г.):
I. Средства, применяемые при лечении заболеваний, вызванных патогенными грибами:
1. При системных или глубоких микозах (кокцидиоидомикоз, паракокцидиомикоз, гистоплазмоз, криптококкоз, бластомикоз):
- антибиотики (амфотерицин В, микогептин);
- производные имидазола (миконазол, кетоконазол);
- производные триазола (итраконазол, флуконазол).
2. При эпидермомикозах (дерматомикозах):
- производные N-метилнафталина (тербинафин);
- производные нитрофенола (хлорнитрофенол);
- препараты йода (раствор йода спиртовой, калия йодид).
II. Средства, применяемые при лечении заболеваний, вызванных условно-патогенными грибами (например при кандидамикозе):
- антибиотики (нистатин, леворин, амфотерицин В);
- производные имидазола (миконазол, клотримазол);
- бис-четвертичные аммониевые соли (деквалиния хлорид).
В клинической практике противогрибковые средства делят на 3 основные группы:
1. Препараты для лечения глубоких (системных) микозов.
2. Препараты для лечения эпидермофитий и трихофитий.
3. Препараты для лечения кандидозов.
Выбор ЛС при терапии микозов зависит от вида возбудителя и его чувствительности к ЛС (необходимо назначение ЛС с соответствующим спектром действия), особенностей фармакокинетики ЛС, токсичности препарата, клинического состояния пациента и др.
Грибковые заболевания известны очень давно, еще со времен античности. Однако возбудители дерматомикозов, кандидоза были выявлены только в середине XIX в., к началу XX в. были описаны возбудители многих висцеральных микозов. До появления в медицинской практике антимикотиков для лечения микозов использовали антисептики и калия йодид.
Полиеновые антибиотики — антимикотики природного происхождения, продуцируемые Streptomyces nodosum (амфотерицин В), Actinomyces levoris Krass (леворин), актиномицетом Streptoverticillium mycoheptinicum (микогептин), актиомицетом Streptomyces noursei (нистатин).
Механизм действия полиеновых антибиотиков достаточно изучен. Эти ЛС прочно связываются с эргостеролом клеточной мембраны грибов, нарушают ее целостность, что приводит к потере клеточных макромолекул и ионов и к лизису клетки.
Полиены имеют самый широкий спектр противогрибковой активности in vitro среди антимикотиков. Амфотерицин В при системном применении активен в отношении большинства дрожжеподобных, мицелиальных и диморфных грибов. При местном применении полиены (нистатин, натамицин, леворин) действуют преимущественно на Candida spp. Полиены активны в отношении некоторых простейших — трихомонад (натамицин), лейшманий и амеб (амфотерицин В). Малочувствительны к амфотерицину В возбудители зигомикоза. К полиенам устойчивы дерматомицеты (род Trichophyton, Microsporum и Epidermophyton), Pseudoallescheria boydi и др.Нистатин (крем, супп. ваг. и рект., табл.), леворин (табл., мазь, гран.д/р-ра для приема внутрь) и натамицин (крем, супп. ваг., табл.) применяют и местно, и внутрь при кандидозе, в т.ч. кандидозе кожи, слизистой оболочки ЖКТ, генитальном кандидозе; амфотерицин В (пор. д/инф., табл., мазь) используется преимущественно для лечения тяжелых системных микозов и является пока единственным полиеновым антибиотиком для в/в введения.
Все полиены практически не всасываются из ЖКТ при приеме внутрь, и с поверхности неповрежденной кожи и слизистых оболочек при местном применении.
Общими побочными системными эффектами полиенов при приеме внутрь являются: тошнота, рвота, диарея, боль в животе, а также аллергические реакции; при местном использовании — раздражение и ощущение жжения кожи.
В 80-е годы был разработан ряд новых ЛС на основе амфотерицина В — липид-ассоциированные формы амфотерицина В (липосомальный амфотерицин В — амбизом, липидный комплекс амфотерицина В — абелсет, коллоидная дисперсия амфотерицина В — амфоцил), которые в настоящее время внедряются в клиническую практику. Их отличает существенное снижение токсичности при сохранении противогрибкового действия амфотерицина В.
Липосомальный амфотерицин В (лиоф. пор. д/инф.) — современная лекарственная форма амфотерицина В, инкапсулированного в липосомы (везикулы, формирующиеся при диспергировании в воде фосфолипидов), отличается лучшей переносимостью.
Липосомы, находясь в крови, долгое время остаются интактными; высвобождение активного вещества происходит только при контакте с клетками гриба при попадании в ткани, пораженные грибковой инфекцией, при этом липосомы обеспечивают интактность ЛС по отношению к нормальным тканям.
В отличие от обычного амфотерицина В, липосомальный амфотерицин В создает более высокие концентрации в крови, чем обычный амфотерицин В, практически не проникает в ткань почек (менее нефротоксичен), обладает более выраженными кумулятивными свойствами, период полувыведения в среднем составляет 4–6 дней, при длительном использовании возможно увеличение до 49 дней. Нежелательные реакции (анемия, лихорадка, озноб, гипотензия), по сравнению со стандартным препаратом, возникают реже.
Показаниями к применению липосомального амфотерицина В являются тяжелые формы системных микозов у пациентов с почечной недостаточностью, при неэффективности стандартного препарата, при его нефротоксичности или некупируемых премедикацией выраженных реакциях на в/в инфузию.
Азолы (производные имидазола и триазола) — наиболее многочисленная группа синтетических противогрибковых средств.
Эта группа включает:
- азолы для системного применения — кетоконазол (капс., табл.), флуконазол (капс., табл., р-р в/в), итраконазол (капс., р-р для приема внутрь); вориконазол (табл., р-р в/в);
- азолы для местного применения — бифоназол, изоконазол, клотримазол, миконазол, оксиконазол, эконазол, кетоконазол (крем, мазь, супп. ваг., шампунь).
Первый из предложенных азолов системного действия — кетоконазол — в настоящее время из клинической практики вытесняют триазолы — итраконазол и флуконазол. Кетоконазол практически утратил свое значение ввиду высокой токсичности (гепатотоксичность) и используется преимущественно местно.
Противогрибковое действие азолов, как и полиеновых антибиотиков, обусловлено нарушением целостности мембраны клетки гриба, но механизм действия иной: азолы нарушают синтез эргостерола — основного структурного компонента клеточной мембраны грибов. Эффект связан с ингибированием цитохром P450-зависимых ферментов, в т.ч. 14-альфа-деметилазы (катализирует реакцию превращения ланостерола в эргостерол), что приводит к нарушению синтеза эргостерола клеточной мембраны грибов.
Азолы имеют широкий спектр противогрибкового действия, оказывают преимущественно фунгистатический эффект. Азолы для системного применения активны в отношении большинства возбудителей поверхностных и инвазивных микозов, в т.ч. Candida albicans, Cryptococcus neoformans, Coccidioides immitis, Histoplasma capsulatum, Blastomyces dermatitidis, Paraccoccidioides brasiliensis. Обычно к азолам резистентны Candida glabrata, Candida krucei, Aspergillus spp., Fusarium spp. и зигомицеты (класс Zygomycetes). Препараты для местного применения при создании высоких концентраций в месте действия могут действовать фунгицидно в отношении некоторых грибов.
Азолы для системного применения (кетоконазол, флуконазол, итраконазол, вориконазол) хорошо всасываются при приеме внутрь. Биодоступность кетоконазола и итраконазола может значительно варьировать в зависимости от уровня кислотности в желудке и приема пищи, тогда как абсорбция флуконазола не зависит ни от pH в желудке, ни от приема пищи.
Флуконазол и вориконазол применяют внутрь и в/в, кетоконазол и итраконазол — только внутрь. Фармакокинетика вориконазола, в отличие от других системных азолов, является нелинейной — при повышении дозы в 2 раза AUC увеличивается в 4 раза.
Флуконазол, кетоконазол, итраконазол и вориконазол распределяются в большинство тканей, органов и биологических жидкостей организма, создавая в них высокие концентрации. Итраконазол может накапливаться в коже и ногтевых пластинках, где его концентрации в несколько раз превышают плазменные. Итраконазол практически не проникает в слюну, внутриглазную и спинно-мозговую жидкость. Кетоконазол плохо проходит через ГЭБ и определяется в спинно-мозговой жидкости лишь в небольших количествах. Флуконазол хорошо проходит через ГЭБ (уровень его в ликворе может достигать 50–90% от уровня в плазме) и гематоофтальмический барьер.
Системные азолы отличаются длительностью периода полувыведения: T1/2 кетоконазола — около 8 ч, итраконазола и флуконазола — около 30 ч (20–50 ч). Все системные азолы (кроме флуконазола) метаболизируются в печени и выводятся преимущественно через ЖКТ. Флуконазол отличается от других антифунгальных средств тем, что выводится через почки (преимущественно в неизмененном виде — 80–90%).
Наиболее частые побочные эффекты азолов системного применения включают: боль в животе, тошноту, рвоту, диарею, головную боль, повышение активности трансаминаз, гематологические реакции (тромбоцитопения, агранулоцитоз), аллергические реакции — кожная сыпь и др.
Азолы для местного применения (клотримазол, миконазол и др.) плохо абсорбируются при приеме внутрь, в связи с чем используются для местного лечения. Эти ЛС создают высокие концентрации в эпидермисе и нижележащих слоях кожи. Наиболее длительный период полувыведения из кожи отмечается у бифоназола (19–32 ч).
Поскольку азолы ингибируют окислительные ферменты системы цитохрома Р450 (кетоконазол > итраконазол > флуконазол), эти ЛС могут изменять метаболизм других лекарств и синтез эндогенных соединений (стероиды, гормоны, простагландины, липиды и др.).
Аллиламины — синтетические ЛС. Оказывают преимущественно фунгицидное действие. В отличие от азолов, блокируют более ранние стадии синтеза эргостерола. Механизм действия обусловлен ингибированием фермента скваленэпоксидазы, катализирующей вместе со скваленциклазой превращение сквалена в ланостерол. Это приводит к дефициту эргостерина и к внутриклеточному накоплению сквалена, что вызывает гибель гриба. Аллиламины обладают широким спектром активности, однако клиническое значение имеет только их действие на возбудителей дерматомикозов, в связи с чем основными показаниями к назначению аллиламинов являются дерматомикозы. Тербинафин применяют местно (крем, гель, мазь, спрей) и внутрь (табл.), нафтифин — только местно (крем, р-р наружн.).
Каспофунгин применяется только парентерально, т.к. биодоступность при пероральном приеме составляет не более 1%. После в/в инфузии высокие концентрации наблюдаются в плазме, легких, печени, селезенке, кишечнике.
Применяют каспофунгин для лечения кандидоза пищевода, инвазивных кандидозов (в т.ч. кандидемии у пациентов с нейтропенией) и инвазивного аспергиллеза при неэффективности или непереносимости других видов терапии (амфотерицин В, амфотерицин В на липидных носителях и/или итраконазол).
ЛС других групп. К противогрибковым препаратам других групп относятся средства для системного (гризеофульвин, флуцитозин) и местного применения (аморолфин, циклопирокс).
Гризеофульвин — одно из первых противогрибковых средств природного происхождения — антибиотик, продуцируемый плесневым грибом Penicillium nigricans (griseofulvum). Гризеофульвин до сих пор остается одним из основных средств лечения дерматомикозов, применяется внутрь и местно.
Аморолфин — синтетический антимикотик широкого спектра действия для местного использования (в виде лака для ногтей).
Циклопирокс — синтетическое ЛС для местного применения.
В настоящее время в стадии разработки находятся антимикотики, являющиеся представителями уже известных групп противогрибковых средств, а также относящиеся к новым классам соединений: коринекандин, фузакандин, сордарины, циспентацин, азоксибациллин.
Литература
Антимикробные и противогрибковые лекарственные средства/ Под ред. Ю.В. Немытина.- М.: Ремедиум, 2002.- С. 57-59.
Базисная и клиническая фармакология/ Под ред. Б.Г. Катцунга; пер. с англ. под ред. Э.Э. Звартау: в 2 т.- М.-СПб.: Бином-Невский диалект, 1998.- Т. 2.- С. 290-297, 555-559.
Виноградов В.М., Каткова Е.Б., Мухин Е.А. Фармакология с рецептурой/ Под ред. В.М. Виноградова.- 4-е изд, испр.- СПб.: СпецЛит, 2006.- С. 221-232.
Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология и вирусология: Учебник для мед.вузов.- 3-е изд., испр. и доп.- СПб.: СпецЛит, 2002.- С. 491-511.
Климко Н.Н., Веселов А.В. Новые препараты для лечения инвазивных микозов// Клиническая микробиология и антимикробная терапия.- 2003.- Т. 5.- № 4.- С. 342-353.
Клиническая фармакология по Гудману и Гилману/ Под общей редакцией А.Г. Гилмана. Пер. с англ.- М.: Практика, 2006.- с 996-1010.
Машковский М.Д. Лекарства XX века.- М.: Новая Волна, 1998.- С. 159-161, 250.
Машковский М.Д. Лекарственные средства: в 2 т.- 14-е изд.- М.: Новая Волна, 2000.- Т. 2.- С. 352-366.
Михайлов И.Б. Настольная книга врача по клинической фармакологии: Руководство для врачей.- СПб.: Фолиант, 2001.- с. 119-126.
Митрофанов В.С. Системные антифунгальные препараты// Проблемы медицинской микологии.- 2001. -Т.3, №2. - С.6-14.
Практическое руководство по антиинфекционной химиотерапии/ Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова.- М.: Боргес, 2002.- С. 129-144.
Рациональная фармакотерапия в стоматологии: Рук. для практикующих врачей/ Г.М. Барер, Е.В. Зорян, В.С. Агапов, В.В. Афанасьев и др.; под общ. ред. Г.М. Барера, Е.В. Зорян.- М.: Литтерра, 2006.- С. 74-78. (Рациональная фармакотерапия: Сер. руководство для практикующих врачей; Т. 11).
Рациональная фармакотерапия в офтальмологии: Рук. для практикующих врачей/ Е.А. Егоров, В.Н. Алексеев, Ю.С. Астахов и др.; под общ. ред. Е.А. Егорова.- М.: Литтерра, 2004.- С. 76-80. (Рациональная фармакотерапия: Сер. руководство для практикующих врачей; Т. 7).
Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем: Рук. для практикующих врачей/ А.А. Кубанова, В.И. Кисина, Л.А. Блатун, А.М. Вавилов и др.; под общ. ред. А.А. Кубановой, В.И. Кисиной.- М.: Литтерра, 2005.- С. 145-182. (Рациональная фармакотерапия: Сер. руководство для практикующих врачей; Т. 8).
Федеральное руководство по использованию лекарственных средств (формулярная система)/ Под ред. А.Г. Чучалина, Ю.Б. Белоусова, В.В. Яснецова.- Вып. VIII.- М.: ЭХО, 2007.- С. 705-713.
Харкевич Д.А. Фармакология: Учебник.- 9-е изд., перераб., доп. и испр.- М.: Гэотар-Медицина, 2006.- С. 653-659.
Харкевич Д.А. Фармакология: Учебник.- 9-е изд., перераб., доп. и испр.- М.: Гэотар-Медицина, 2006.- С. 653-659.

Оксана Романова, заведующая кафедрой детских инфекционных болезней БГМУ, доктор мед. наук, профессор Оксана Николаевна, протекает ли коронавирусная инфекция у детей по-разному в зависимости от возраста?
Симптомы COVID-19 у детей и взрослых схожи, наиболее часто это лихорадка и кашель. Фиксируются также миалгия, ринорея, головная боль, тошнота/рвота, боли в животе, диарея, потеря обоняния и/или вкуса, одышка. По сравнению со взрослыми у детей чаще регистрируются желудочно-кишечные симптомы (могут проявляться без наличия респираторных проблем), конъюнктивит, ларингит и фебрильные судороги. Возможны неспецифические кожные высыпания.
У большинства детей заболевание протекает бессимптомно либо в легкой или среднетяжелой форме. Выздоровление наступает в течение 1–2 недель. Тем не менее возможно и тяжелое течение инфекции (тяжесть зависит от возраста и наличия факторов риска).
У детей первого года жизни обычно наблюдаются только вялость, отказ от еды и повышение температуры с легкими респираторными симптомами, характерными и для других ОРВИ, включая грипп.
Для пациентов младше 9 лет характерны более легкие клинические проявления. Одышка, потеря обоняния и/или вкуса регистрируются редко.
У детей 10 лет и старше проявления могут быть более выраженными и продолжительными.
В первую очередь врач должен оценить тяжесть состояния ребенка по внешнему виду, наличию температуры, одышки и ряду других признаков.
Более 70 % случаев инфекции сопровождаются насморком, заложенностью носа и чиханием, способность ощущать запахи и вкусы частично или полностью сохранена. До 60 % пациентов испытывают першение и боли в горле.
Сухой кашель беспокоит около 40–45 % больных с новым вариантом коронавирусной инфекции. В случае проникновения патогенов в легочную ткань присоединяется одышка, усиливается кашель, возникает чувство стеснения и боли в грудной клетке.
Короткий инкубационный период, высокая заразность и тотальное распространение среди населения могут стать причиной коллапса системы здравоохранения. Удвоение числа зараженных происходит за 1,5–2 дня, риск реинфекции составляет 13 %.
После выздоровления сохраняется риск постковидного синдрома, который диагностируется в среднем спустя 3 месяца. В механизме его развития участвуют эндотелиальная дисфункция, аутоиммунный и неврологический компоненты; женщины более подвержены тяжелым остаточным явлениям после коронавируса.
Как отличить ОРВИ, грипп и COVID-19?
Чтобы дифференцировать ОРВИ, грипп и коронавирусную инфекцию, необходимо провести исследование назофарингеального содержимого в мазке методом ПЦР.
Клинические проявления гриппа и COVID-19 у детей могут быть сходны; кроме того, у несовершеннолетних часто развивается коинфекция сразу несколькими респираторными патогенами, в т. ч. возможно сочетание гриппа и COVID-19.
ОРВИ — наиболее частое заболевание в детском возрасте. Грипп — высоко контагиозная ОРВИ с острым началом, подъемом температуры до высоких значений (39–40 °С), ознобом, общей слабостью, разбитостью, мышечными и суставными болями. К концу первых, реже на вторые сутки болезни лихорадка достигает максимума. Дети жалуются на головную боль (обычно в области висков, лба, надбровных дуг, глазных яблок), возможны тошнота, рвота.
Катаральные явления обычно выражены слабо и представлены покашливанием, заложенностью и скудным отделяемым из носа, болями в горле, особенно при глотании. При осмотре можно наблюдать легкую гиперемию лица, выраженную инъекцию склер, умеренную гиперемию и отечность небных миндалин и дужек. Возможны точечные кровоизлияния или мелкая пятнисто-папулезная энантема либо мелкая зернистость на мягком небе.
Рекомендации по противовирусному лечению гриппа у детей во время пандемии COVID-19 остаются неизменными. При наличии показаний (развитие гриппоподобного заболевания, особенно при наличии тяжелого течения или факторов риска тяжелого и осложненного течения) противовирусное лечение гриппа следует начать до получения результатов лабораторных исследований. Терапия может быть прекращена после установления отрицательного результата определения РНК гриппа в назофарингеальном мазке (методом ПЦР).
На чем базируется амбулаторное лечение при COVID-19?
Терапия включает:
- купирование лихорадки с использованием жаропонижающих препаратов (например, парацетамола или ибупрофена);
- обеспечение баланса жидкости и электролитов, включая восполнение перспирационных потерь при лихорадке;
- комплексное лечение ринита или ринофарингита (увлажняющие препараты, назальные деконгестанты);
- комплексное лечение бронхита (мукоактивные средства, при бронхообструктивном синдроме — небулизация бронхолитиков).
При наличии проявлений бронхита, выраженного кашля с вязкой, трудноотделяемой мокротой возможно назначение муколитиков (ацетилцистеин).
Антибактериальная терапия детям с COVID-19, находящимся на амбулаторном лечении, назначается только при наличии клинико-лабораторных признаков бактериальной инфекции.
Жаропонижающие препараты показаны при повышении температуры тела до 38–38,5 °С и выше. Возможно использование жаропонижающих и при более низких значениях температуры: при плохой переносимости лихорадочного синдрома, головных болях, повышении артериального давления и выраженной тахикардии (особенно при наличии ишемических изменений или нарушениях ритма).
В качестве стартовых лекарственных средств используют парацетамол в разовой дозе 10–15 мг/кг (внутрь или ректально) или ибупрофен в разовой дозе 5–10 мг/кг детям старше 6 месяцев (внутрь или ректально). Допускается повторное использование парацетамола не ранее чем через 4–6 часов после первого приема, ибупрофена — не ранее чем через 8 часов.
Что касается НПВП, то избегать их не стоит. Изначальные опасения о том, что прием ибупрофена может утяжелить течение инфекции COVID-19 у детей, не подтвердились исследованиями.
При стойко сохраняющемся гипертермическом синдроме на пятые сутки проводится контроль ОАК, по результатам которого принимается решение о целесообразности назначения антибактериальных препаратов.
В амбулаторных условиях детям с COVID-19 не следует назначать препараты, подавляющие иммунный ответ (в т. ч. системные стероиды), кроме ситуаций, когда имеются специальные показания.
Дети с COVID-19 и тяжелыми или крайне тяжелыми заболеваниями нижних дыхательных путей, если они подвержены риску тяжелого течения из-за сопутствующих заболеваний (например, нарушения иммунитета, неврологические расстройства, нарушения обмена веществ, врожденный порок сердца), и младенцы в возрасте до 30 дней с лихорадкой нуждаются в госпитализации.
Что нужно знать о признаках тяжелой коронавирусной инфекции у детей?
Основные признаки тяжести инфекции COVID-19, на которые следует обращать внимание в динамике наблюдения за ребенком:
- сохранение повышенной температуры тела;
- сохранение и нарастание одышки;
- падение насыщения капиллярной крови кислородом (SpO2);
- нарастание уровней острофазовых маркеров (С-реактивного белка, прокальцитонина, интерлейкина-6, фибриногена, ферритина);
- повышение уровня D-димеров, активности лактатдегидрогеназы;
- абсолютная лимфопения;
- снижение уровня альбумина;
- наличие типичных изменений на рентгенограмме или компьютерной томограмме легких в пользу вирусной пневмонии (билатеральные инфильтраты, матовостекловидные затемнения).
Немедленной госпитализации требуют дети, лихорадящие более 3 дней, при обнаружении у них хейлита, склерита и других кожно-слизистых проявлений. В этом случае следует заподозрить Кавасаки-подобную форму мультисистемного воспалительного синдрома (MIS-C).
Клиническими проявлениями шока являются признаки снижения периферической перфузии: бледная либо мраморная холодная липкая кожа, резкая слабость, угнетение ответа на внешние раздражители, впервые возникшее угнетение сознания, значительное снижение диуреза. Развитие шока и синдрома полиорганной недостаточности характерно для неспецифического фенотипа MIS-C либо для системной бактериальной инфекции, осложнившей течение COVID-19.
Каковы особенности фармакотерапии COVID-19?
Дозирование ремдесивира детям с массой тела 3,5–40 кг: нагрузочная доза 5 мг/кг в 1-й день, в последующие дни — по 2,5 мг/кг. Детям с массой тела >40 кг: нагрузочная доза 200 мг в 1-й день, затем 100 мг в последующие дни.
Ремдесивир вводят внутривенно капельно однократно в сутки. Стандартный курс лечения 5 дней, но может быть продлен до 10 дней у пациентов с иммуносупрессией или с сохраняющейся дыхательной недостаточностью (находящихся на высокопоточной оксигенотерапии, неинвазивной или инвазивной ИВЛ, ЭКМО).
Противовирусная терапия также может быть оправдана для детей с легким или умеренным течением болезни и сопутствующим диагнозом, который увеличивает или может увеличить риск тяжелого течения (например, неврологические, генетические заболевания, врожденные пороки сердца и другие).
Несмотря на показания FDA (Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США) для применения барицитиниба у пациентов в возрасте 2 лет и младше, госпитализированных с COVID-19 и нуждающихся в кислородной или вентиляционной поддержке или ЭКМО, имеется ограниченная информация о преимуществах и рисках барицитиниба у детей с SARS-CoV-2. В идеале его следует использовать в контексте клинических испытаний.
Барицитиниб — ингибитор янус-киназы, используемый для лечения ревматоидного артрита. В дополнение к иммуномодулирующим эффектам считается, что он оказывает противовирусное действие, препятствуя проникновению вирусов. Барицитиниб может обеспечить снижение летальности для отдельных пациентов, в т. ч. тех, кто уже получает глюкокортикоиды.
В исследованиях у пациентов до 18 лет барицитиниб, по-видимому, снижал смертность, а комбинация барицитиниба и ремдесивира, очевидно, незначительно увеличивала время до выздоровления без повышения частоты инфекций, венозной тромбоэмболии или других нежелательных явлений.
Допустимо ли применение глюкокортикоидов у детей?
Хотя специалисты ВОЗ настоятельно рекомендуют применять системные глюкокортикоиды у пациентов с тяжелым или критическим COVID-19, они признают, что дети были недостаточно представлены в клинических испытаниях, подтверждающих пользу.
Тем не менее для некоторых детей с тяжелым или крайне тяжелым течением COVID-19, нуждающихся в ИВЛ либо в дополнительном кислороде и имеющих факторы риска прогрессирования заболевания, применение низких доз глюкокортикоидов может быть оправданно. Продолжительность терапии — до 10 дней.
Предпочтителен дексаметазон, если он доступен. Но режимы приема глюкокортикоидов в низких дозах могут включать и метилпреднизолон, преднизолон, гидрокортизон.
Каковы риски применения иммунодепрессоров?
FDA выпустило показания для тоцилизумаба у госпитализированных пациентов в возрасте ≥2 лет, которые получают системные глюкокортикоиды и нуждаются в дополнительной оксигенации, ИВЛ (неинвазивной или инвазивной) или ЭКМО. Тем не менее информации о преимуществах и рисках этой терапии у детей с COVID-19 недостаточно.
Согласно рекомендациям, тоцилизумаб дозируется в соответствии с весом пациента:
Тоцилизумаб может быть повторен еще один раз спустя ≥8 часов после начальной инфузии, если клинические признаки или симптомы ухудшаются либо не улучшаются после первой дозы.
Использования этого препарата следует избегать:
- у лиц с повышенной чувствительностью к нему;
- при неконтролируемых тяжелых инфекциях (не COVID-19);
- абсолютном количестве нейтрофилов
- при повышенном риске желудочно-кишечной перфорации.
Тоцилизумаб следует применять с осторожностью у лиц с ослабленным иммунитетом, поскольку в рандомизированные исследования было включено очень мало пациентов.
Введение живых вакцин (например, против кори, эпидемического паротита, краснухи, ветряной оспы) следует отложить после окончательной инфузии тоцилизумаба по крайней мере на 2 недели. Некоторые эксперты рекомендуют ждать 4 недели до введения живых вакцин.

Широкая распространённость средств на основе только ЧАС связана с их относительно низкой токсичностью и отсутствием выраженного коррозионного воздействия на предметы обихода и медицинский инструментарий.
Как правило, в ассортименте каждого производителя дезсредств есть одно или несколько наименований, содержащих в качестве действующего вещества (ДВ) только ЧАС. Это связано с доступностью сырья и его относительно низкой стоимостью. Достаточно сказать, что цена 1 кг субстанции, содержащей 50% ЧАС, стоит примерно 150-250 руб. и зависит от производителя субстанции и вариаций состава ЧАС. Упрощенно говоря, задача производителя дезсредства – разбавить субстанцию и добавить вспомогательные компоненты (ПАВ, соли, кислоты и др.).
Таким образом, средства на основе ЧАС удобны как для потребителей (низкая токсичность, малая коррозионная активность), так и для производителей (доступность сырья и относительно низкая его стоимость).
Для того чтобы среди большого количества торговых марок (более 100 наименований) средств на основе только ЧАС выбрать требуемый дезпрепарат, необходимо обладать знаниями о бактерицидных концентрациях ЧАС в рабочих растворах дезинфектантов.
Нужно отметить, что ответ на вопрос о бактерицидных концентрациях ЧАС в рабочих растворах до сих пор ставит в тупик многих практикующих больничных эпидемиологов. Одни считают, что ЧАС эффективны в крайне малых концентрациях, другие, наоборот, утверждают, что ЧАС не эффективны в малых концентрациях
Для того чтобы досконально разобраться с вопросом эффективных концентраций ЧАС, обратимся к научным исследованиям. Первое что нам необходимо - это разобраться с терминологией. Существует, как минимум, два научных термина, связанных с концентрацией бактерицидных агентов: минимальная ингибирующая концентрация (МИК) и минимальная бактерицидная концентрация (МБК).
Применительно к дезсредствам на основе ЧАС термин минимальная ингибирующая концентрация (МИК) трактуется следующим образом: это минимальная концентрация ЧАС в рабочем растворе дезсредства, которая предотвращает рост бактериальных клеток. Следует отметить, что МИК не обеспечивает полного уничтожения бактериальных клеток, а лишь препятствует размножению бактерий.
Термин минимальная бактерицидная концентрация (МБК) применительно к ЧАС можно сформулировать таким образом – это минимальная концентрация ЧАС в рабочем растворе дезсредства, при которой обеспечивается полное уничтожение клеток бактерий.
МИК и МБК являются параметрами специфическими и часто характеризуют определенный штамм какого-либо бактериального микроорганизма, более того, термин МИК более характерен для исследования активности антибиотиков, но тем не менее, часто используется в научной литературе при исследовании активности дезсредств. В контексте данной статьи МИК - это бактериостатическая концентрация, тем не менее, будем использовать более общий термин - МИК.
Таким образом, для целей бактерицидной дезинфекции необходимо чтобы в рабочем растворе концентрация ЧАС была, по крайней мере, не менее МБК, более того, концентрация ЧАС в растворе не должна быть меньшей МИК.
В сороковых годах прошлого века, когда ученые активно исследовали новую по тем временам дезинфицирующую субстанцию - ЧАС, некоторыми исследователями была сделана методическая ошибка: они приняли МИК за МБК. Далее эта ошибка была исправлена путем введения в методику исследований этапа нейтрализации ДВ и др.
Всё дело в том, что если обработать контаминированные объекты раствором, содержащим ЧАС в концентрациях равных МИК, визуальный контроль эффективности покажет отсутствие роста микроорганизмов на питательной среде. Но этот факт не будет означать, что бактерии уничтожены. Это будет лишь свидетельством того, что живые бактерии находятся в условиях, неблагоприятствующих их размножению. И если, к примеру, в систему, где не наблюдался рост, добавить стерильную воду, через некоторое время можно будет наблюдать рост микроорганизмов, так как концентрация ЧАС в системе стала меньше МИК (за счет разбавления водой) и более не мешает запуску механизмов размножения у бактерий.
Итак, для того чтобы средство на основе ЧАС эффективно уничтожало бактерии, необходимо, чтобы концентрации ЧАС в рабочих растворах были не менее МБК, и уж тем более, не меньшей МИК (бактериостатических концентраций).
В таблице, приведенной ниже, собраны данные о значениях МИК и МБК для ЧАС, полученные исследователями для микроорганизмов в разных лабораториях.

Данные, приведенные в таблице, свидетельствуют, что жесткой границы между МБК и МИК по отношению к ЧАС указать невозможно. Более того, на первый взгляд, приведенные данные кажутся не совсем логичными. Так, например, для некоторых микроорганизмов, минимальные ингибирующие концентрации ЧАС, определенные одними авторами, могут быть выше минимальных бактерицидных концентраций ЧАС, но определенных другими исследователями.
Все это легко объяснимо тем, что в разных работах исследовались различные микроорганизмы с различной устойчивостью к ЧАС. Многие штаммы, описанные в таблице - это не музейные культуры, а реальные микробы, взятые непосредственно с объектов, или выделенные из субстратов.
Можно утверждать, что в большинстве случаев при концентрации ЧАС в растворе 0,01% (по ЧАС) будет проявлять бактерицидное действие на штаммы S. Aureus, E. Coli, но на некоторые устойчивые штаммы – только ингибирующее (бактериостатическое).
В одной из работ 4 , было установлено, что реально существующий штамм сальмонеллы S. Typhimurium оказался устойчив к концентрации ЧАС 0,0256% (МИК).
Таким образом, для бактерий S. Aureus, E. Coli можно определить ограничение на необходимое содержание ЧАС в растворе: оно должно быть не менее 0,01% ЧАС, для того чтобы уничтожить возможные устойчивые штаммы указанных микроорганизмов.
Таким образом, несмотря на большой разброс данных, касающихся бактерицидных и бактериостатических концентраций ЧАС, путем сопоставления и анализа данных можно сделать следующие выводы:
- для предотвращения образования устойчивых штаммов бактерий типа S. Aureus, E. Coli необходимо выбирать такие средства на основе только ЧАС, у которых режимы гарантируют наличие в рабочем растворе 0,01% ЧАС и более;
- для предотвращения образования устойчивых штаммов бактерий сальмонелл необходимо выбирать такие средства на основе только ЧАС, у которых режимы гарантируют наличие в рабочем растворе 0,025% ЧАС и более;
Каково же распределение средств на основе только ЧАС в зависимости от концентраций ЧАС в рабочих растворах в режимах бактерицидной дезинфекции поверхностей? Есть ли на рынке такие средства? Ответы на эти вопросы наглядно представлены на диаграмме, приведенной ниже.

Как видно, 19% от наименований существующих препаратов на основе только ЧАС в бактерицидных режимах гарантированно обеспечат концентрации ДВ в рабочих растворах от 0,025% до 0,05%, и 11% от наименований торговых марок дезинфектантов на основе только ЧАС, в антибактериальных режимах обеспечат концентрацию ЧАС в рабочих растворах не менее 0,05%. Всё это свидетельствует, что на российском рынке существуют средства на основе ЧАС, которые могут оказаться эффективными при бактерицидной (иск. туберкулез) дезинфекции поверхностей.
При использовании этой группы дезсредств необходимо учитывать высокую вероятность образования устойчивых штаммов возбудителей ВБИ, поэтому необходимо обеспечить мониторинг устойчивости бактериальной микрофлоры, циркулирующей в ЛПО, для своевременного проведения ротации дезинфектантов.
Читайте также:

