Противовирусные препараты нобелевская премия
Обновлено: 23.04.2024

Вирусный гепатит существует в нескольких формах, но самые распространенные из них – A, B и C. Гепатит А – форма более легкая и передается проще, через воду и еду. Гепатиты B и C передаются вместе с кровью. Гепатит B был изучен ранее: возбудителя выделил Барух Блумберг еще в 60-е годы, Нобелевскую премию за это он получил в 1976 году.
Однако оказалось, что тесты на гепатиты A и B не решили проблему возникновения гепатита у пациентов, которым переливали донорскую кровь. Этот эффект обнаружил американец Харви Олтер еще в 1975 году, он же обнаружил, что этим вирусом, кроме людей, болеют шимпанзе – так были найдены единственные доступные для этой болезни животные модели.

Канадский британец Майл Хьютон работал тогда в фармкомпании Chiron и занялся выделением этого нового вируса. Он экспериментировал на шимпанзе – удалось выяснить, на какие из фрагментов ДНК, выделенных из крови больных животных, реагируют антитела из крови людей с этим гепатитом. Так и удалось выделить искомый РНК-вирус – свою главную работу Хьютон опубликовал в 1989 году.
Третий лауреат – американец Чарльз Райс – доказал, что именно этот вирус вызывает гепатит у получивших донорскую кровь пациентов. Он собрал экспериментальный вирус с характерными для гепатита C участки и ввел его в печень шимпанзе. Те заболели изучаемой болезнью – так в 1997 году была показана непосредственная патогенность вируса.
Нередкая болезнь
Во всем мире, по данным ВОЗ, гепатитом C болеют более 70 млн человек, около 400 000 человек умирают от него каждый год. По данным официального источника , в России гепатитом C болеют более 3,5 млн человек, около 15 000 человек в год умирают от вызываемых им цирроза и рака печени. Если от более легко протекающих вирусов гепатита A и B можно привиться, то прививки от гепатита C пока не существует из-за высокой изменчивости вируса.
Зато существует – что гораздо большая редкость – по-настоящему эффективная терапия. Поэтому так значимы исследования сегодняшних лауреатов – это фундаментальная наука, которая позволила решить практическую задачу создания лекарства.
Как лечат вирусы

Для жизни им необходима клетка хозяина, поэтому и для лечения вирусных инфекций приходится иметь дело не с вирусом как таковым, а с процессом его взаимодействия с клеткой хозяина. Поэтому при всем многообразии вирусных инфекций, лекарства с подтвержденной эффективностью существуют всего от нескольких из них. От полиомиелита, свинки, краснухи, корь могут защитить вакцины, но не лекарства (кстати, отчасти этот ответ на вопрос, почему так далеко продвинулись вакцины от ковид, а терапия – нет). В результате многолетних исследований терапии удалось разработать от ВИЧ, герпеса, ветряной оспа и гриппа (с некоторыми оговорками) – и вирусных гепатитов.
О лауреатах

Премия по физиологии и медицине является одной из пяти премий, учрежденных самим Альфредом Нобелем: премии присуждаются за выдающиеся достижения в химии, физике, литературе, в физиологии или медицине и за вклад в установление мира. Первую Нобелевскую премию по физиологии или медицине вручили в 1901 году. Россияне получали эту премию только дважды – это были Иван Павлов (за работы по физиологии пищеварения) и Илья Мечников (за работы по иммунитету). Обе награды были получены более 100 лет назад.
На этой неделе будут объявлены и другие лауреаты Нобелевской премии 2020 года – во вторник по физике, в среду – по химии, четверг – по литературе, в пятницу – премия мира.
Сейчас, когда закрыто огромное количество СМИ, Правмир продолжает свою работу. Мы работаем, чтобы поддерживать людей, и чтобы знали: ВЫ НЕ ОДНИ.
18 лет Правмир работает для вас и ТОЛЬКО благодаря вам. Все наши тексты, фото и видео созданы только благодаря вашей поддержке.
Поддержите Правмир сейчас, подпишитесь на регулярное пожертвование. 50, 100, 200 рублей - чтобы Правмир продолжался. Мы остаемся. Оставайтесь с нами!


В одной из лабораторий американского Национального института детского здоровья и развития человека (NICHD) в Бетесде выполнена работа, которая может открыть новые перспективы в борьбе со СПИДом. Скажу сразу — она не обещает излечения в смысле полного выведения вируса из организма; более того, есть основания считать, что эта задача сегодня практически неразрешима и останется таковой в обозримой перспективе. Однако вполне возможно, что результаты ученых из Соединенных Штатов, Великобритании, Канады и Бельгии, полученные под руководством вирусолога Леонида Марголиса, обернутся появлением новых методик медикаментозного снижения уровня вирусной нагрузки (то есть концентрации вирионов в плазме крови). Эти результаты представлены в статье, которая 11 сентября появилась в журнале Cell Host & Microbe.
Результаты, о которых идет речь, были получены не то что бы чисто случайно, но всё же благодаря немалому везению (впрочем, то же самое можно сказать о великом множестве других научных открытий). В отделе межклеточных взаимодействий NICHD, который возглавляет Марголис, уже давно изучают последствия совместного инфицирования различных тканей вирусом человеческого иммунодефицита и другими патогенными микробами. Подобные исследования (а они ведутся во многих лабораториях) очень важны как для науки, так и для практической медицины.
Давно известно, что наличие вируса иммунодефицита человека (ВИЧ) не только осложняет течение инфекционных заболеваний, но также увеличивает риск возникновения патологий, вызываемых относительно безвредными микроорганизмами. Чаще всего это происходит благодаря общеизвестному подавлению активности иммунной системы этим вирусом. Однако случается, что ВИЧ отягощает течение других заболеваний и в тех случаях, когда он еще не успевает приступить к уничтожению иммунных Т-клеток (речь, конечно, идет о CD4 + -лимфоцитах, которые являются главным объектом его атаки). С другой стороны, некоторые микробы способны частично подавлять репликацию ВИЧ и тем самым замедлять прогресс СПИДа. Отсюда следует, что ВИЧ в состоянии непосредственно взаимодействовать с другими инфекционными агентами в тех тканях и органах, где он с ними сосуществует. Есть все основания считать, что такие взаимодействия могут приводить к весьма нетривиальным эффектам.
Леонид Марголис и его коллеги занимались, в частности, контактами между ВИЧ и различными разновидностями герпес-вирусов (точнее, вирусов человеческого герпеса, HHV). Их не так уж и мало, в общей сложности восемь. Помимо общеизвестных вирусов простого герпеса первого и второго типов (Herpes simplex virus), которые приводят к появлению сыпи на коже или слизистых оболочках, в эту группу входят вирус Эпштейна–Барра (Epstein–Barr Virus), цитомегаловирус (Cytomegalovirus), вирус ветряной оспы (Varicella zoster virus), а также еще тройка герпес-вирусов, занумерованных цифрами 6, 7 и 8. HHV-8 провоцирует саркому Капоши и еще некоторые злокачественные опухоли, в то время как HHV-6 и HHV-7 чаще всего либо не дают никаких симптомов, либо вызывают у маленьких детей малоопасные кожные раздражения, которые обычно исчезают без лекарственного лечения. По данным медицинской статистики, не менее 95% людей в детстве заражаются этими вирусами, которые продолжают потихоньку размножаться в организме под контролем иммунной системы.
Марголис и его сотрудники сначала изучали сосуществование ВИЧ и вируса простого герпеса второго типа (HHV-2) в культурированных кусочках человеческой лимфоидной ткани, а также ткани шейки матки и ректосигмоидного отдела ободочной кишки (поскольку эти ткани служат входными воротами для ВИЧ). В ходе этих экспериментов они использовали вещества, блокирующие размножение того или иного вируса. Для подавления герпес-вируса они использовали ацикловир (Acyclovir), один из синтетических препаратов, созданных в лаборатории лауреата Нобелевской премии 1988 года Гертруды Элайон (Gertrude B. Elion).
Это лекарство (торговое название зовиракс) вот уже четверть века применяется в клинической практике и прекрасно работает как против обеих разновидностей вируса простого герпеса, так и против вируса ветряной оспы (эта тройка образует альфа-тип вируса герпеса). Ацикловир также замедляет размножение остальных вирусов герпеса (типы бета и гамма), хотя и с меньшей эффективностью. Экспериментаторы ожидали, что он просто выведет из игры HHV-2, но никак не повлияет на динамику ВИЧ. Однако тут-то их и подстерегала неожиданность. В образцах ткани, на которые воздействовали ацикловиром, резко снизилась концентрация обоих вирусов — как герпес-вируса, так и ВИЧ. В этом и состояло первичное открытие.
Сей результат поставил исследователей в тупик. Ацикловир ведь не раз проверяли на ВИЧ-инфицированных культурах СD4 + -лимфоцитов, однако он никак не влиял на размножение вируса. Столкнувшись с этой загадкой, экспериментаторы взяли новые ткани тех же типов, теперь уже по отдельности заразили их обоими вирусами и тогда уже ввели ацикловир. Пролиферация вируса герпеса, как и ожидалось, сразу застопорилась, но то же самое случилось и с вирусом иммунодефицита. Так что ситуация стала еще непонятней. Эти опыты были повторены на клеточных культурах лимфоцитов-хелперов. Там уже всё было по учебнику: ацикловир действовал только против герпеса.
Со временем этот парадокс удалось разрешить. Как оказалось, он непосредственно связан с биохимическим механизмом воздействия ацикловира на герпес-вирус, который еще в начале 80-х годов независимо друг от друга установили Гертруда Элайон и Генри Балфур (Henry H. Balfour). Дело в том, что ацикловир в чистом виде практически никак не влияет на поведение герпес-вируса. Такое воздействие оказывает его трифосфат, то есть ацикловир, к молекуле которого подцеплены три фосфатные группы PO3H2. Трижды фосфорилированный ацикловир встраивается в вирусную ДНК (точнее, его туда вставляет вирусная полимераза) и останавливает ее дальнейший синтез. Этим и объясняется его воздействие на герпес.

В живых клетках процессы фосфорилирования катализируются ферментами из семейства киназ (они же фосфотрансферазы). Правда, те киназы, которые присутствуют в клетках, атакуемых герпес-вирусом, фосфорилируют ацикловир чрезвычайно медленно. Но и сам вирус производит фермент этого же типа — тимидин-киназу. Этот белок присоединяет фосфатную группу к молекуле ацикловира примерно в 3000 раз быстрее, чем клеточные киназы. Так возникает монофосфат ацикловира, который клеточные киназы уже без труда достраивают сначала до дифосфата, а потом и до трифосфата. Так что герпес-вирус фосфорилирует ацикловир себе же на погибель. Стоит отметить, что нефосфорилированный ацикловир практически никак не влияет на внутриклеточные процессы. Поэтому его можно принимать в огромных дозах, не опасаясь побочных эффектов — ведь он действует только на клетки, инфицированные герпесом.
Учет этого обстоятельства оказался ключом к разгадке. Поскольку вирус герпеса инициирует тройное фосфорилирование молекул ацикловира, было естественно предположить, что такие модифицированные молекулы обладают антиспидовым потенциалом. Эта гипотеза оправдалась Оказалось, что трифосфат ацикловира вмешивается в работу фермента, который позволяет вирусу СПИДа копировать свою генетическую информацию в атакованной клетке. В самом вирусе информация записана на молекулах рибонуклеиновых кислот, но, чтобы встроиться в клеточные ядра, вирус должен ее переписать на молекулы ДНК. Такую задачу выполняет обратная транскриптаза, которую и блокирует модифицированный ацикловир. Эта гипотеза была доказана прямыми экспериментами, выполненными соавторами Марголиса — профессором Университета Эмори Раймондом Шинази (Raymond F. Schinazi) и канадским молекулярным биологом Маттиасом Гётте (Matthias Götte).
Подведем итоги. Леонид Марголис и его коллеги экспериментально доказали, что трифосфат ацикловира по своему действию аналогичен противоспидовым препаратам из группы ингибиторов обратной транскриптазы. Это означает, что он может помочь в лечении тех ВИЧ-инфицированных пациентов, которые уже претерпели столкновение с герпес-вирусом — а таких, напомню, абсолютное большинство. Правда, еще предстоит установить, какая степень заражения теми или иными видами герпеса нужна для эффективного запуска фосфорилирования ацикловира и какие его дозы нужны для подавления репликации ВИЧ. На этот вопрос ответят только клинические испытания, которые уже ведутся. Стоит подчеркнуть, что ацикловир стал бы очень дешевым противоспидовым лекарством, ибо он по давности лет уже не защищен патентами.
Но есть и другая возможность. Как я уже отметил, монофосфат ацикловира прекрасно фосфорилируют и клеточные киназы. Для его получения, в принципе, не обязательно обращаться к помощи герпес-вируса. Команда Марголиса синтезировала это вещество и доказала, что оно подавляет размножение ВИЧ в клеточных культурах. Поэтому не исключено, что монофосфат ацикловира окажется самостоятельным антиспидовым лекарством. Однако это вещество, в отличие от собственно ацикловира, клинически не апробировано. Так что для демонстрации его безопасности и проверки терапевтического потенциала потребуются серьезные лабораторные тесты и клинические испытания, которые даже при самом благоприятном исходе растянутся на несколько лет.


Гепатитами называются воспалительные заболевания печени. В большинстве случаев они вызываются вирусами, три из которых особенно широко распространены в человеческой популяции — это вирусы гепатитов A, B и C. Эти возбудители относятся к неродственным группам вирусов и существенно различаются по строению и по поведению в организме хозяина.
Вирус гепатита B был открыт в 1965 году в крови пациента с лейкозом, который несколько раз перенес процедуру переливания крови. Этот вирус попадает в организм больного через кровь и чаще всего вызывает вяло текущее хроническое заболевание (хотя у некоторых людей заболевание может протекать в острой форме, завершаясь самопроизвольным выздоровлением). Геном этого вируса, относящегося к группе гепаднавирусов, представлен молекулами ДНК. Репликация вирусного генома может сопровождаться внедрением его в хромосомы клеток печени зараженного человека. Нобелевская премия за его открытие и исследование была вручена в 1976 году Баруху Бламбергу. Кстати, в день рождения этого ученого, 28 июля, отмечается всемирный день борьбы с гепатитом B. Препаратов, способных вылечить от этой формы гепатита, все еще не существует. Однако и для вируса гепатита A, и для вируса гепатита B разработаны эффективно действующие вакцины, позволяющие предупреждать развитие обеих инфекций в организме.
По своим клиническим проявлениям гепатит C во многом схож с гепатитом B: он тоже иногда (примерно в 30% случаев) протекает в острой и быстро проходящей форме, но гораздо чаще превращается в хроническое заболевание. Признаки недуга появляются не сразу, а спустя несколько месяцев после переливания крови. Как и при гепатите B, со временем у многих пациентов начинается цирроз, а затем и рак печени — примерно у 20% пациентов эти осложнения развиваются в течение 10–20 лет после инфицирования, приводя к скорому летальному исходу. В целом, вирусы гепатита B и C являются первичной причиной 80% случаев рака печени.
Во всех описанных этапах исследования вируса гепатита C и разработки методов лечения от вызываемого им заболевания важнейшую роль играли трое ученых, ставших лауреатами Нобелевской премии по физиологии и медицине в этом году. Их результаты послужили фундаментом для почти полной победы над этой опасной болезнью в развитых странах. Вполне обоснованы надежды, что и скором будущем этот успех распространится на всю планету. Давайте разберемся, какой вклад в исследование гепатита внес каждый из лауреатов.
В 1970-х годах Олтер работал в Клиническом центре (NIH Clinical Center) в Бетесде (штат Мэриленд), входящем в структуру Национальных институтов здравоохранения США. В те годы вероятность получить гепатит при прохождении процедуры переливания крови составляла до 30%. Олтер пытался понять источник заражения. Он проверял образцы из банка крови от доноров, чья кровь вызвала гепатит у пациентов.
С помощью электронной микроскопии удалось выявить в образцах крови пациентов мелкие частички, похожие на вирусы. Возможно, это и есть возбудитель заболевания? Как опознать, что это за вирус? Классический подход обычно предусматривает получение специфических антител. Но в данном случае никак не удавалось выявить антитела, которые бы стабильно давали реакцию с образцами от больных людей, при этом не реагируя на компоненты крови здоровых доноров. Выловить возбудителя гепатита C в итоге не удавалось более 10 лет. Но без результатов Олтера это было бы невозможно. Он сначала показал, что большая часть гепатитов, возникающих после переливания крови обусловлена не теми вирусами, что были ранее известны. А потом предположил и доказал, что речь идет именно об инфекционном агенте, поскольку заболевание можно было вызвать у шимпанзе, вводя сыворотку от больных людей. Фактически он установил само наличие ранее неизвестного возбудителя гепатита, что и позволило затем найти сам вирус.
Суть методики состоит в следующем. Из образцов крови или ткани печени, полученных от больных людей или от инфицированных шимпанзе, выделяли нуклеиновые кислоты (ДНК и РНК). Далее при помощи обратной транскрипции получали копии ДНК, которые встраивали в бактериальные плазмиды. Эти плазмиды размножали в бактериях, получая множество изолированных колоний. Каждая колония в итоге содержала копию какого-то одного вида молекул из всего их множества, присутствовавшего в исходных образцах (то есть либо молекулы клеток хозяина, либо молекулы, происходящие из вируса). Из бактериальных клонов можно было выделять и анализировать собственно ДНК. Также можно было выделить полипептиды, синтезируемые в процессе трансляции на клонированных фрагментах.
Далее ученые из группы Хаутона анализировали фрагменты ДНК методом гибридизации нуклеиновых кислот (проводя гибридизацию ДНК из бактериальных клонов с помеченными радиоактивными метками образцами кДНК из крови пациентов). Успешную гибридизацию можно ожидать, если бактериальный клон содержит в себе нуклеотидную последовательность, схожую с последовательностями, присутствующими в анализируемых образцах крови. Целью при этом было обнаружить в библиотеке клонированных фрагментов вирусные геномы или хотя бы какие-то их части. Однако эти попытки не увенчались успехом: не обнаружилось ни одного клона, который бы стабильно гибридизовался с кДНК из крови больных, но не гибридизовался с кДНК из крови здоровых людей.


Схема эксперимента, который позволил Хаутону идентифицировать вирус гепатита C. Пояснения в тексте. Рисунок из статьи M. Houghton, 2009. The long and winding road leading to the identification of the hepatitis C virus
После этого стало возможным изучить последовательность генома вируса (он ведь был клонирован в соответствующей колонии бактерий) и установить принадлежность его к группе флавивирусов. На основе этой работы в итоге были разработаны чувствительные тесты на вирус гепатита C, включающие как серологические тесты, позволяющие выявить специфические антитела, так и тесты на основе ПЦР, выявляющие присутствие генетического материала вируса. Надежнее всего, конечно, сочетание обоих методов. Скрининговые тесты начали применять с 1990 года. В результате частота заражений при переливании резко упала до 1,1%, а после дальнейшего усовершенствования методик в 1992–1995 годах, частота заражений опустилась до 1 на 2 миллиона переливаний. Таким образом за последние 30 лет тесты, разработанные на основе работ Хаутона и его коллег, сберегли миллионы жизней.
Флавивирусы — это группа вирусов, общими особенностями которых является наличие генома в виде одноцепочечной РНК, сферическая форма и небольшие размеры (40–60 нм) вирусных частичек. Снаружи вирусные частички одеты в оболочку — липидную мембрану. Репродукция вируса проходит в цитоплазме зараженной клетки — флавивирусы не проникают в ядро. На видео наглядно показан весь жизненный цикл вируса гепатита С.
Интересная и важная особенность флавивирусов — непрерывная трансляция: на матрице вирусной РНК синтезируется длинный пептид, который затем при помощи вирусной протеазы (NS3) разрезается на 10 отдельных белков, выполняющих различные функции в репродукции вируса.
Механизм некоторых применяемых сегодня лекарств прямого действия как раз основан на блокировании активности вирусной протеазы. Другие лекарства действуют как блокаторы вирусной РНК-полимеразы, обеспечивающей создание копий вирусного генома.


Заслуга Чарльза Райса (Charles Moen Rice) состоит в том, что он сумел организовать исследование вируса гепатита C в лаборатории с использованием модельных животных и модельных клеточных линий. Сначала единственным видом животных, которые поддавались инфицированию человеческим вирусом HCV были шимпанзе — вирус вызывал у них развитие воспаления печени (ключевой диагностический признак — является повышение уровня аланинтрансферазы в крови), а в крови наблюдали длительное присутствие вирусных частиц.
Но использование шимпанзе в качестве модельных животных накладывает серьезные ограничения: их дорого содержать, к исследованиям на них предъявляются очень жесткие этические ограничения. Поэтому экспериментальные группы не могут включать большое число животных, а это затрудняет получение статистически достоверных результатов. В 2000 году команда Райса сообщила об успешном опыте репликации вируса в модельной клеточной линии рака печени человека. Также успешным оказалось применение в качестве модельных объектов для исследования вируса химерных гуманизированных мышей. Их получают путем прививания человеческих гепатоцитов в эмбрионы генномодифицированных мышей, у которых отключены некоторые гены, необходимые для нормального развития собственных клеток печени. В итоге печень у этих мышей строится из человеческих гепатоцитов, восприимчивых к человеческому вирусу гепатита. Чтобы не происходило отторжения чужеродных клеток, используют мышей с отключенным иммунитетом.
История развития терапевтических подходов к лечению гепатита C подробно и увлекательно изложена в статье Гепатит C: решенная проблема?. Есть тут, к сожалению, один досадный нюанс: препараты, о которых идет речь, весьма дорогостоящие и не всем по карману, так что терапия интерфероном, хоть он дает более тяжелые побочные эффекты и не так эффективен, все еще достаточно широко применяется при лечении гепатита C.
С другой стороны, одной из важных задач, стоящих перед современными исследователями, является создание вакцины, которую можно было бы применять для защиты людей, попадающих в группы риска. Эта задача, хоть над ней и бьются достаточно давно, пока не поддается ученым. Следует отметить, что все трое новоиспеченных нобелевских лауреата принимали и продолжают принимать участие в исследованиях, нацеленных на создание такой вакцины.

Харальд цур Хаузен родился в 1936 году в Гельзенкирхене (Германия). Он учился в Боннском, Гамбургском и Дюссельдорфском университетах. В Дюссельдорфском университете он получил степень доктора медицины и несколько лет работал в подчиненном университету Институте медицинской микробиологии. В середине шестидесятых цур Хаузер переехал в Филадельфию (США), где вначале работал в Лаборатории вирусологии знаменитой Детской больницы, а впоследствии преподавал в Пенсильванском университете. В 1969 году он вернулся в Германию и стал профессором в Вюрцбургском университете, затем работал в университетах в Эрлангене и Нюрнберге и во Фрайбурге в Брайсгау, а с 1983 года — в Германском центре исследования рака, который он возглавлял в течение 20 лет (1983–2003).
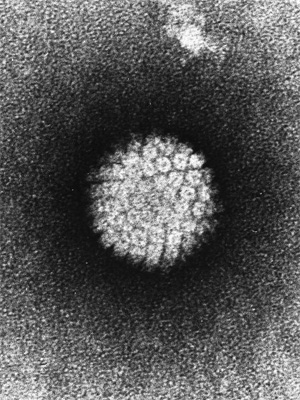
Вирусы папилломы человека (ВПЧ) передаются от человека к человеку. Некоторые разновидности ВПЧ безвредны, некоторые вызывают образование бородавок на коже, некоторые поражают половые органы (передаваясь половым путем). В середине семидесятых Харальд цур Хаузен обнаружил, что женщины, страдающие раком шейки матки, неизменно заражены ВПЧ. В то время многие специалисты полагали, что рак шейки матки вызывается вирусом простого герпеса (Herpes simplex virus), но цур Хаузен нашел в раковых клетках не вирусы герпеса, а вирусы папилломы, и предположил, что развитие рака происходит в результате заражения именно вирусом папилломы. Впоследствии ему и его коллегам удалось подтвердить эту гипотезу и установить, что большинство случаев рака шейки матки вызваны одним из двух типов этих вирусов: ВПЧ-16 и ВПЧ-18. Зараженные такими вирусами клетки с довольно большой вероятностью рано или поздно становятся раковыми, и из них развивается злокачественная опухоль.
В середине восьмидесятых годов были начаты исследования, благодаря которым на сегодня уже получены и запущены в производство несколько вакцин, инъекция которых позволяет, по крайней мере на несколько лет, свести к нулю риск заражения определенными типами ВПЧ (в том числе 16 и 18). Таким образом, благодаря открытию цур Хаузена были разработаны высокоэффективные средства для предотвращения рака шейки матки.
Теперь первоочередная задача — внедрение этих средств. Около 5% всех случаев заболевания раком в мире приходится на рак шейки матки, и больше двухсот тысяч женщин умирают каждый год от этой болезни. Широкое распространение вакцинации от ВПЧ позволит спасти сотни тысяч женщин. Решение Нобелевского комитета наверняка принесет пользу делу: присужденная цур Хаузену премия, вероятно, поможет привлечь внимание людей во всём мире к проблеме предотвращения рака шейки матки и будет способствовать распространению спасительной вакцинации.
Люк Монтанье родился в 1932 году в коммуне Шабри в департаменте Эндр (Франция). Он учился в Пуатье и в Париже, некоторое время работал в Париже, а затем стажировался в ведущих вирусологических лабораториях Великобритании, где изучал, в частности, механизм репликации РНК-содержащих вирусов. Вернувшись в Париж, он вначале исследовал ретровирусы в Институте Кюри, а в 1972 году был приглашен Жаком Моно (Jaques Monod), выдающимся исследователем механизмов регуляции работы генов, в новообразованное отделение вирусологии Института Пастера, где Монтанье организовал и возглавил группу вирусной онкологии, которая проводила исследования, посвященные механизмам возникновения злокачественных опухолей в результате вирусных инфекций. Сотрудниками этой группы и был впервые выделен возбудитель СПИДа. В 1993 году Люк Монтанье и генеральный директор ЮНЕСКО Федерико Майор (Federico Mayor) учредили Всемирный фонд исследования и предупреждения СПИДа. Монтанье возглавил этот фонд и по сей день руководит им.
В 1982 году группа Люка Монтанье начала исследования с целью выявить возможного возбудителя недавно описанного необычного заболевания — синдрома приобретенного иммунодефицита, характеризующегося прогрессирующим ослаблением жизненно важной иммунной системы. В 1983 году вирус был выделен (поначалу он получил другое название, но сегодня он известен как ВИЧ — вирус иммунодефицита человека). Вскоре после открытия ВИЧ в Институте Пастера его выделили и в США, в группе Роберта Галло (Robert Gallo), сотрудничавшей с группой Монтанье, из образцов, полученных от французской группы. Претензия Роберта Галло на первенство в открытии и полученный им патент на методику анализа крови на ВИЧ вызвали многолетние споры между американской и французской сторонами. Эти споры в конечном итоге разрешились признанием приоритета группы Монтанье. К сожалению, споры о приоритете отняли у исследователей много времени и немало помешали работе в области изучения ВИЧ и поиска и внедрения средств, позволяющих выявлять, предупреждать и лечить ВИЧ-инфекцию.

С 1981 года, когда был впервые описан СПИД, от этой болезни умерло больше 25 миллионов человек. Больше 33 миллионов живущих сегодня людей заражены ВИЧ, и каждый год болезнь уносит новые миллионы жизней. СПИД называли чумой XX века. Давно наступил XXI век, а число людей, зараженных ВИЧ, продолжает расти, и порядка двух миллионов зараженных, значительную долю которых составляют дети, ежегодно умирают от СПИДа. К счастью, уже разработаны методы лечения, позволяющие на десятилетия отодвинуть смерть зараженного СПИДом человека. Но к сожалению, это лечение стоит дорого, и позволить его себе могут в основном лишь достаточно состоятельные люди. При этом СПИД более всего распространен как раз на самом бедном континенте — в Африке. Кроме того, до сих пор не удалось разработать, и неизвестно, удастся ли, ни способов полного выведения ВИЧ из зараженного организма, ни вакцины, прививка которой сводила бы к нулю (или хотя бы существенно уменьшала) риск заражения СПИДом. Но продолжаются интенсивные исследования, и в будущем меры борьбы со СПИДом наверняка станут доступнее и действеннее.
Открытие группой Люка Монтанье вируса, вызывающего СПИД, было сделано вскоре после открытия самой болезни. Быстрое выявление возбудителя СПИДа очень помогло последовавшей затем разработке способов борьбы с этим заболеванием.
Премия, по традиции, будет вручена лауреатам 10 декабря, в день смерти Альфреда Нобеля, в его родном городе — Стокгольме. В прошлом году Нобелевскую премию по физиологии и медицине получили Марио Капекки (Mario R. Capecchi) из Университета Юты (США), Оливер Смитис (Oliver Smithies) из Университета Северной Каролины (США) и Мартин Эванс (Sir Martin J. Evans) из Кардиффского университета (Великобритания) за изобретение метода нокаута генов (gene knockout).
Источники:
1) Nobel prize for viral discoveries // BBC News. 6 October 2008.
2) Alison Abbott. Virus discoveries secure Nobel prize in medicine // Nature News. Published online 6 October 2008.
О том, что препарат "Ивермектин" практически полностью уничтожает коронавирус за 48 часов с момента начала применения, сообщили ученые из университета Монаша и Королевского госпиталя в Мельбурне (информация об этом вышла в медицинском журнале Antiviral Research).
Оказалось, что этот антипаразитарный препарат, давно применялся для лечения человека, свиней, крупного рогатого скота, лошадей и овец от гельминтов и прочих паразитов.
Иногда препарат назначали пациентам для избавления от вшей и чесотки, однако, заметив ряд сильных побочных действий, для людей с ослабленным иммунитетом его предложено было запретить.
С 1997 года "Ивермектин" начал применяться для лечения у людей инфекционного заболевания стронгилоидоза, вызванного круглыми червями. При этом заболевании, кроме желудочно-кишечных и кожных симптомов, наблюдаются также и легочные проявления, обусловленные передвижением личинок червя через альвеолы. Первичная инфекция проявляется хрипами в лёгких и небольшим кашлем, а дальше могут развиваться симптомы, напоминающие бронхиальную астму и пневмонию.
Возможно это последнее сходство с COVID-19 и натолкнуло ученых на мысль попробовать противопаразитарное средство, за основу которого было взято вещество, производимое определенными микроорганизмами, в борьбе с коронавирусом.
Австралийские исследователи проверяли "Ивермектин" на культуре клеток, инфицированных коронавирусом. Они сообщают, что спустя 24 часа после введения препарата в клетки доля вирусных РНК в них сократилась на 93%, еще через двое суток вируса стало меньше на 99 процентов.
Средство вводилось в культуру клеток через 2 часа после их заражения. Кроме эффективности в борьбе с вирусом оно оказалось не токсичным для клеток. В связи с этим ученые предложили начать клинические испытания по перепрофилированию препарата на лечение COVID-19.
Как поведут себя старые препараты, испытываемые австралийскими и нашими учеными не in vitro, а в живом человеческом организме, инфицированным коронавирусом, еще большой вопрос, считают при этом инфекционисты. И в любом случае предостерегают любителей прочесть нформацию о каком-то новом "средстве от коронавируса" заниматься самолечением - тем более препаратами, которые еще совершенно не доисследованы в связи с коронавирусом.
Между тем в России уже начались клинические испытания по лечению COVID-19 другим известным медикам препаратом - мефлохином. На прошлой неделе руководитель Федерального медико-биологического агентства Вероника Скворцова рассказала, что это противомалярийное средство, известное медикам с 70- х годов прошлого века, показало свою эффективность в борьбе с коронавирусом.
Читайте также:

