Противовирусный иммунитет в ветеринарии
Обновлено: 24.04.2024
У животных иммунитет определяется генетически обусловленными факторами. Иммунная реакция бывает как к инфекционным, так и неинфекционным факторам. В создании иммунитета принимает участие весь организм, все защитные механизмы которого тесно между собой взаимосвязаны. При иммунитете наряду с факторами специфической защиты (антитела, аллергия) принимают участие многочисленные неспецифические факторы (слизистые, кожа, лимфатическая система, ферменты крови, секреты, выделяемые пищеварительной системой и другие средства защиты). Все защитные реакции в организме осуществляются под воздействием нейро-гормональной регуляции.
Виды иммунитета.
Принято различать два вида иммунитета: видовой (наследственный) и приобретенный. При видовом иммунитете происходит передача иммунитета по наследству, от одного поколения другому, является весьма стойким в естественных условиях. При данном виде иммунитета животные одного вида не болеют инфекционными заболеваниями другого вида (крупный рогатый скот не болеет африканской чумой свиней, а свиньи не болеют чумой крупного рогатого скота). Приобретенный иммунитет возникает у животных в результате естественного переболевания – естественно приобретенный иммунитет или в результате искусственной иммунизации – искусственно приобретенный. Приобретенный иммунитет в свою очередь может быть активным или пассивным. Активным он будет в случае естественного переболевания той или иной инфекционной болезнью, по наследству не передается и длится месяцы и более.
В некоторых случаях он может быть пожизненным (оспа у человека, чума у собак). Искусственно приобретенный иммунитет мы получаем при вакцинации животных, когда подкожно или внутримышечно вводим ослабленных или инактивированных возбудителей инфекционных болезней или продуктов их жизнедеятельности; наступает через две недели после вакцинации и продолжается, если вакцина была живая, от нескольких месяцев до года.
Искусственно приобретенный иммунитет может быть пассивным — это когда животному вводят в кровь или подкожно иммунную или гипериммунную сыворотку, которая содержит готовые антитела против определенных возбудителей инфекционной болезни. Такой иммунитет длиться у животного 2-3 недели, причем применением гамма-глобулина длительность пассивного иммунитета можно увеличить. Этим видом иммунитета обладают и новорожденные животные, получающие готовые антитела с молозивом и молоком матери (колостральный иммунитет), он длиться несколько месяцев.
Стерильный и нестерильный иммунитет.
При некоторых инфекционных заболеваниях, когда состояние невосприимчивости связано с присутствием в организме возбудителя (туберкулез, бруцеллез и т.д.), устойчивость к новому заражению продолжается до тех пор, пока в организме животного сохраняется возбудитель данной инфекции. Такой иммунитет называется инфекционным, нестерильным или премуницией.
Данное положение используется в практике при вакцинации организма маловирулентными живыми возбудителями против туберкулеза (вакцина БЦЖ), бруцеллеза (штамм 19) и др. Состояние нестерильного иммунитета длиться иногда годами.
Иммунитет, образующийся после переболевания или вакцинации и сохраняющийся при отсутствии в организме возбудителя болезни называют стерильным.
У специалистов принято различать иммунитет в зависимости от того, на что направлено действие защитных механизмов организма – непосредственно на микробы или на их продукты. При антимикробном иммунитете происходит обезвреживание (разрушение или ингибиция) возбудителя. При антитоксическом иммунитете бактерии не разрушаются, а идет активная нейтрализация вырабатываемых ими токсинов (столбняк, ботулизм). Бывает иммунитет противогельминтный и неинфекционный.
Антимикробный иммунитет включает в себя невосприимчивость к бактериям, вирусам, риккетсиям, микоплазмам, грибам и простейшим. При антибактериальном иммунитете введенные в неиммунизированый организм авирулентные или слабовирулентные бактерии захватываются клетками ретикулоэндотелиальной системы, а также лейкоцитами крови, в результате чего организм быстро очищается от них, при введении же вирулентных бактерий в иммунный организм происходит заметная задержка в проникновении их в кровь и лимфатическую систему с места внедрения.
Противовирусный иммунитет основан, как и противобактериальный и антитоксический, на тех же механизмах защиты, но имеет ряд особенностей. При таких вирусных болезнях, как оспа, чума собак, приобретается длительный и напряженный иммунитет, однако, например, при гриппе человека или гриппе лошадей и др. вирусных болезнях иммунитет бывает непродолжительным и недостаточно напряженным.
Неспецифические факторы иммунитета.
Они многочисленны и взаимосвязанно действуют в целостной системе организма. В естественных условиях заражению организма препятствуют следующие группы защитных приспособлений:
1. Кожные и слизистые барьеры. Неповрежденные кожа и слизистые оболочки непроходимы для большинства микроорганизмов. Кожа и слизистые оболочки являются не только механическим барьером, но и стерилизующим в отношении многих микробов. Бактерицидные свойства кожи обусловлены молочной и жирной кислотами, содержащимися в секрете потовых и сальных желез. Антимикробным действием обладает секрет желез слизистых оболочек, содержащийся в слюне, слезах, носовом секрете, молоке ( лизим-белковое вещество типа энзима, растворяет бактерии, преимущественно из группы кокков). Секреты желез пищеварительного тракта оказывают бактерицидное действие на бактерии. Высокую бактерицидность имеет слюна и желудочный сок, а также желчь, обладающая способностью обезвреживать ряд вирусов.
2. Лимфатические барьеры. Те микробы, которые сумели пройти кожу и слизистые оболочки, встречаются с новым барьером — лимфатическими узлами (при попадании микробов через глотку барьером становится окологлоточное лимфатическое кольцо). Попав в лимфатические узлы, микробы захватываются клетками ретикулоэндотелиальной системы и подвергаются фагоцитозу. Барьерная функция лимфоузлов возрастает после проведенной вакцинации.
3. Фагоцитоз и воспаление. Борьба с проникшими в организм микробами, в месте внедрения которых организм отвечает воспалением, проводиться лейкоцитами (макрофагами), которые поглощают микробные клетки и своими ферментами разрушают их.
4. Гуморальные факторы. Попав в кровь, микробы встречаются с рядом защитных механизмов. Кровь и ее сыворотка обладает бактерицидной и бактериостатической активностью в отношении многих микробов (сибирской язвы, рожи свиней, стафилококков), имеющимся в ней бактериолизином. К гуморальным факторам относиться также комплемент, пропердин, термостабильный β-лизин, лизоцим и лейкины.
Все явления иммунитета регулируются нейро-гуморальным путем. При этом особое значение имеют гормоны, снижающие реактивность соединительной ткани — противовоспалительные и повышающие ее реактивность воспалительные. К противовоспалительным относятся адренокортикотропный гормон и кортизон, к воспалительным -соматотропный и гормон типа дезоксикортикостерона. Противовоспалительные гормоны угнетают выработку антител, воспалительные гормоны усиливают.
Тканевой иммунитет.
В процессе взаимодействия вируса с клеткой, наряду с гибелью одних клеток, в других происходит образование противовирусных антител -интерферона, происходит перестройка метаболизма клеток организма, не позволяющая вирусным частицам и дальше проникать в клетки и размножаться в них. Нейтрализующие вирус антитела в клетках появляются на второй день, как попал вирус в организм. В результате появления внутриклеточных антител, происходит нейтрализация вируса, без развития патологических изменений в органах.
Функциональный иммунитет.
Защитные реакции организма на действие возбудителя инфекционной болезни возникает не изолированно, а во взаимосвязи всех систем и органов. Взаимосвязь в организме осуществляет нервная система, и от типа нервной системы и ее тонуса целиком зависит уровень и качество защитных механизмов. Центральная нервная система во время болезни обеспечивает восстановление функций, нарушенных попавшим в организм возбудителем инфекции. Лихорадка, являющаяся характерным клиническим симптомом инфекционной болезни, является результатом реакции организма в целом. Она носит неспецифический, но в то же время защитный характер. Повышением температуры тела организм усиливает окислительные процессы, губительно действует на микроорганизмы, разрушая их. Проявлением данного вида иммунитета является усиление выделительной функции кишечника, почек, дыхательных путей на токсические продукты микробов и вирусов попавших в организм.
Аллергия.
При инфекционной болезни происходит повышение чувствительности организма к попавшему возбудителю и продуктам его жизнедеятельности. Такое состояние организма называется инфекционной аллергией. Она легко выявляется при хронических инфекционных болезнях, сопровождающихся премуницией (сап, туберкулез, бруцеллез и др.).
Данный факт широко используется в практической деятельности при проведении диагностических исследований на сап, туберкулез, бруцеллез.
Большое значение в регулирование иммунитета имеет нервная система. Тяжесть течения инфекционной болезни определяется функциональным состоянием высших отделов нервной системы. Перенапряжение нервной системы ослабляет противомикробную защиту организма животного. Длительный медикаментозный сон в определенных условиях резко снижает реактивность организма на некоторые токсины и виды микроорганизмов, в то же время при сибирской язве, столбняке, когда охранительное торможение отсутствует, течение болезни ухудшается.
Новорожденные животные в молозивный период обладают чувствительностью к ряду инфекционных болезней, несвойственных в дальнейшем для данного вида. Так, молодняк сельскохозяйственных животных часто переболевает колибактериозом, ягнята особенно чувствительны к столбняку и оспе. В то же время в раннем возрасте телята не болеют эмфизематозным карбункулом, поросята до 2-3 месяцев редко болеют рожей, щенята в молозивный период — чумой. Ряд инфекционных болезней поражают животных в определенном возрастном диапазоне(эмфизематозный карбункул у КРС бывает в возрасте от 3мес. до 4лет, рожа у свиней от 3 до 12месяцев и т.д.).
У взрослых животных возможен иммунитет в результате скрытой иммунизации. Если в организм систематически попадают дозы возбудителя инфекции меньше той, которая может вызвать заболевание, то происходит малозаметная иммунизация (так называемая иммунизирующая субинфекция, например отсутствие заболеваемости эмкаром у животных старше 4лет). Иммунологическая реактивность организма (антителообразование и аллергия) с возрастом нарастает.
Неинфекционный иммунитет.
Первооткрываетелем неинфекционного иммунитета является великий русский ученый И.И.Мечников, установивший общебиологический характер реакций иммунитета против клеток любой категории. Группа крови животных является постоянной генетической характеристикой организма, используется в племенной работе при селекции, генетическом контроле, в ветеринарии при переливании крови, пересадке тканей и органов, применении тканевых препаратов, биопрепаратов и др. В медицине особо актуальное значение имеют вопросы трансплантационного иммунитета и т.д.
Иммунитет при паразитарных болезнях.
К настоящему времени данный вид иммунитета находиться в стадии активного изучения. Иммунопрофилактика при паразитарных болезнях находиться в стадии разработки. Так, идет активный поиск иммунопрофилактики заболеваний, вызываемых клещами – бабезиоз, пироплазмоз. Разработан и применяется для профилактики пироплазмоза у собак ряд вакцин – Нобивак Piro, Pirodog.
Условия кормления и содержания.
Особенно данные факторы важны для малышей. Полноценное кормление и создание оптимальных условий содержания ведет к повышению общей и специфической резистентности организма. В результате неполноценного кормления (недостаток белков, авитаминоз и др.) снижается устойчивость животных к заболеваниям, уменьшается синтез в организме белков, иммунных глобулинов, ослабляется лейкоцитарная реакция. При неполноценном кормлении и нарушении зоогигиенических условий содержания, при проведении вакцинации у животных наблюдаются поствакцинальные осложнения, иммунитет у таких животных не будет достаточно напряженным.
Система органов и клеток, осуществляющая реагирование против чужеродных субстанций, получила название иммунной системы организма. Она распределена по всему организму, ее клетки постоянно рециркулируют по всему телу через кровоток, она обладает способностью вырабатывать сугубо специфические молекулы антител, различные по своей специфике в отношении каждого антигена.
По происхождению различают два вида иммунитета: врожденный и приобретенный.
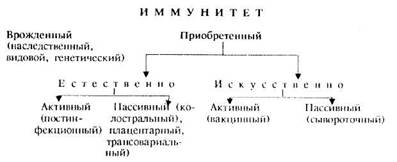
Врожденный (видовой, наследственный, генетический) иммунитет — это невосприимчивость к инфекционным агентам, детерминированная в геноме и проявляемая количеством и порядком расположения ганглиозидов определенного типа на поверхности мембран клеток. Этот вид иммунитета свойственен животным определенного вида к определенному возбудителю инфекции и передается из поколения в поколение. Например, лошади не болеют ящуром, крупный рогатый скот — сапом, собаки — чумой свиней, животные — сифилисом и т. д. В основе механизмов врожденного иммунитета к определенным возбудителям лежат отсутствие в клетках организма рецепторов и субстратов, необходимых для адгезии и размножения возбудителя, наличие веществ, блокирующих размножение патогенных микробов. Последние не могут размножаться в организме, и заболевание не возникает. Например, Brucclla abortus будет размножаться в плаценте только тех видов животных, которые содержат углевод эритритол.
Врожденный иммунитет весьма прочный, но не абсолютный. Так, в естественных условиях куры не болеют сибирской язвой, однако Пастер заразил курицу сибиреязвенной бациллой после искусственного понижения температуры тела погружением ее конечностей в холодную воду. Мечникову удалось вызвать экспериментальный столбняк у лягушки (весьма устойчивой к столбнячному токсину) путем согревания ее в термостате. Врожденной резистентностью в основном обладают взрослые животные. У новорожденных во многих случаях видовая устойчивость отсутствуют. Например, кролики-сосуны и мышата чувствительны к заражению вирусом ящура. Весьма чувствительны к заражению вирусами и бактериями развивающиеся куриные эмбрионы, что в практике используют для получения вакцин.
Следует учитывать, что животные, не заболевая определенной инфекционной болезнью, могут быть носителем возбудителя и представлять опасность для других видов. Например, человек может быть носителем вируса чумы собак.
Важно отметить, что естественная невосприимчивость является не только видовым признаком, среди восприимчивых к определенным микробам видов существуют породы, популяции и линии, животных, отличающиеся высокой устойчивостью к данному возбудителю. Так, при высокой чувствительности овец к сибирской язве алжирские овцы отличаются высокой к ней устойчивостью. Свиньи йоркширской породы по сравнению с другими породами устойчивее к роже свиней. Куры породы белый леггорн более устойчивы к пуллорозу, чем птицы пород красный род-айленд и плимутрок.
Характерная особенность приобретенного иммунитета — его специфичность, т. е. устойчивость организма только к определенному возбудителю болезни. Приобретенный иммунитет подразделяют на естественный и искусственный. Естественно приобретенный иммунитет, в свою очередь, делят на активный и пассивный. Активный (постинфекционный) образуется после естественного переболевания животного. Естественно приобретенный иммунитет не обязательно должен быть связан с клинически выраженным переболеванием. Во многих случаях в организм животного систематически попадают дозы возбудителя меньше той, которая может вызвать заболевание. В этом случае происходит скрытая иммунизация, которая у животных, достигших определенного возраста, создает активный иммунитет к определенному возбудителю. Такое явление называют иммунизирующей субинфекцией.
Естественно приобретенный пассивный иммунитет — иммунитет новорожденных, приобретенный ими за счет поступления плоду от матери антител через плаценту (трансплацентарный) либо уже после рождения через кишечник с молозивом (колостральньш, или молозивный). У птиц (например, кур) материнские антитела передаются с лецитиновой фракцией желтка (трансовариальный). Важно отметить, что насыщение кровотока иммунными фракциями новорожденных жвачных, лошадей, свиней происходит в основном колостральным путем. В этой связи различают естественно и искусственно вызванный колостральный иммунитет. В первом случае иммунитет обусловлен антителами, естественно выработанными в организме матери под воздействием различных антигенов окружающей среды. Во втором случае путем направленной иммунизации организма матери определенными антигенами вырабатываются специфические антитела против определенного возбудителя болезни.
Молозиво неиммунизированных коров обладает бактериостатическими и антитоксическими свойствами в отношении многих патогенных микроорганизмов — кишечной палочки, сальмонелл, стафилококков и др. Так, в молозиве в среднем при первой дойке содержится в 100 мл Ig — 900 мг, IgG — 200, IgM — 400, IgA — 300 мг, а в том же количестве молока уже соответственно 50, 2, 5 и 8 мг. Воспринятые с молозивом иммуноглобулины (антитела) в кишечнике, например новорожденных телят, абсорбируются и неизмененными проходят через стенку кишечника в лимфатическую систему, а затем в кровеносное русло. Следует знать, что у домашних животных кишечник проницаем для молозивных антител лишь первые 24—36 ч, поэтому молозиво новорожденный должен получить как можно раньше с момента рождения.
Естественно приобретенный активный иммунитет может сохраняться 1—2 года, но в некоторых случаях — пожизненно (например, у собак, переболевших чумой, у овец, переболевших оспой). Естественно приобретенный пассивный иммунитет обеспечивает состояние невосприимчивости от нескольких недель до нескольких месяцев.
Искусственно приобретенный иммунитет также подразделяют на активный и пассивный. Активный (поствакцинальный) возникает в результате иммунизации животных вакцинами. Вакцинный иммунитет развивается через 7—14 дней и сохраняется от нескольких месяцев до одного года и более. Пассивный иммунитет создается при введении в организм иммунной сыворотки, содержащей специфические антитела против определенного возбудителя болезни. Пассивный иммунитет можно создать и при введении сывороток крови животных-реконвалесцентов (переболевших данной болезнью), например при ящуре. Пассивный иммунитет, как правило, не превышает 15 дней.
Иммунитет также принято классифицировать по направленности действия защитных механизмов организма на микроорганизмы или их продукты. Различают антибактериальный иммунитет, когда защитные механизмы направлены против патогенного микроба, в результате предотвращается размножение и распространение в нем микроба.
Противовирусный иммунитет обусловливается выработкой организмом противовирусных антител и механизмами клеточной защиты.
Антитоксический иммунитет, при образовании которого бактерии не разрушаются, но вырабатываются антитела, эффективно нейтрализующие токсины в организме больного животного.
Иммунитет при протозойных и гсльминтозных заболеваниях направлен на обезвреживание и уничтожение возбудителей болезней.
Если после перенесенной болезни организм освобождается от возбудителя, сохраняя при этом состояние невосприимчивости, то такой иммунитет называют стерильным. Однако при многих инфекциях иммунитет сохраняется только до тех пор, пока в организме находится возбудитель болезни. В этом случае говорят об инфекционном или нестерильном иммунитете (премуниция).
В зависимости от механизмов зашиты организма различают также гуморальный и клеточный иммунитет. Гуморальный иммунитет обусловливается выработкой в зараженном организме специфических антител, клеточный иммунитет — за счет образования специфически реагирующих с возбудителем (антигеном) Т-лимфоцитов.
В инфекционной патологии собак вирусы играют важную роль. Они являются внутриклеточными паразитами и вызывают такие контагиозные болезни, как: чума, бешенство, инфекционный гепатит, инфекционный трахеобронхит, парвовирусный и коронавирусный энтериты.
Иммунитет к вирусным болезням в основном зависит от индукции иммунного ответа к поверхностным белкам вирусов. Главная цель противовирусного иммунного ответа – нейтрализация внеклеточного вируса и разрушение зараженных клеток, продуцирующих вирус. Антитела не проникают через клеточную мембрану, и вирус внутри клетки надежно от них защищен.
Различают неспецифический (врожденный) и специфический (приобретенный, адаптационный) иммунитет. Под неспецифическим иммунитетом подразумевают систему предсуществующих защитных факторов организма, которые условно подразделяют на четыре типа: физические (анатомические – кожа и слизистые оболочки); физиологические (лизоцим, интерферон, комплемент); клеточные (фагоциты, натуральные киллеры) и воспаление. Факторы естественной резистентности антигеннеспецифичны, включаются в защиту сразу после преодоления возбудителем кожи или слизистой оболочки и не способны сохранять память от первичного контакта с возбудителем. Они действуют в течение всего периода борьбы организма с инфекцией, но наиболее эффективно – в первые 4 суток после внедрения вируса, пока не начнут работать факторы специфического иммунитета.
Главными защитниками организма от вирусов, находящихся внутри клеток, на стадии неспецифического иммунитета являются натуральные киллеры (НК), или большие зернистые лимфоциты, и интерфероны альфа и бета (ИФα, ИФβ). НК распознают и разрушают инфицированные клетки с помощью секретируемых цитотоксинов – перфорин, лимфотоксин, гранзимы. Цитотоксины индуцируют запрограммированную гибель клеток (апоптоз). Инфицированные вирусом клетки синтезируют интерфероны, которые индуцируют синтез белков в незараженных клетках, обеспечивающих их устойчивость к заражению.
Специфический иммунитет представляет собой более мощный эшелон защиты организма. Он начинает развиваться через 4 суток после инфицирования и реализуется через синтез специфических антител и образование антигенспецифических Т-лимфоцитов. При специфическом иммунитете создается иммунологическая память, которая обусловлена образованием Т- и В-клеток памяти на конкретный возбудитель. Иммунологическая память длительно сохраняется и служит основой вторичного иммунного ответа, более эффективного, чем первичный. Она лежит в основе вакцинопрофилактики инфекционных болезней.
Клеточный иммунный ответ осуществляется Т-системой иммунитета и заключается в активации популяции антигенспецифических Т-лимфоцитов и их дифференцировки в цитотоксические Т-лимфоциты, способные распознать инфицированные вирусом клетки и разрушить их с помощью секретируемых цитотоксинов.
В защите от вирусных инфекций респираторного и желудочно-кишечного трактов ведущая роль принадлежит секреторному иммуноглобулину класса А, который нейтрализует вирусы в просвете кишечника и бронхов и препятствует их проникновению в эпителиальные клетки (местный иммунитет). Секреторный компонент, синтезированный в эпителиальных клетках, предохраняет антитела от расщепления протеолитическими ферментами.
Сила иммунного ответа на вирусы контролируется генами иммунного ответа, расположенными в главном комплексе гистосовместимости.
Иммунная система у щенков созревает примерно к 6-недельному возрасту, и с этого периода их можно вакцинировать против вирусных болезней. В случае применения живых противовирусных вакцин щенкам более раннего возраста есть риск возникновения поствакцинальных осложнений.
При вакцинации щенков имеется критический период (“окно уязвимости”) – это когда материнские специфические антитела нейтрализуют вакцинный вирус, но не предохраняют от заражения вирулентным вирусом. Этот период может продолжаться от 2 до 5 недель. Неэффективность вакцинации является результатом инфицирования животного в этот период. Использование живых вакцин с высокой активностью позволяет преодолевать нейтрализующее действие материнских антител и обеспечивать создание напряженного иммунитета.
Иногда после иммунизации у отдельных собак могут развиваться поствакцинальные осложнения – гиперчувствительность или аутоиммунитет (разрушение собственных клеток и тканей организма). Предрасположенность к гиперчувствительности и аутоиммунитету у собак генетически детерминирована (предопределена) и связана с генами главного комплекса гистосовместимости.
Summary
Orlyankin B.G. Antiviral immunity and specific prophylactic strategy for dogs. NARVAC R&D, Moscow
The types and stages of antiviral immunity of dogs have been shown. The problems of specific prevention of viral canine diseases with different vaccines are discussed.
Применение нормализующих иммунитет препаратов и кормовых добавок в условиях промышленного животноводства способствует не только сокращению затрат на ветеринарный сервис, но также реализации генетического потенциала производителей, что проявляется в повышении сохранности и продуктивности поголовья.
Иммуномодуляторы — лекарственные средства, обладающие иммунотропной активностью, которые в терапевтических дозах восстанавливают функции иммунной системы и обеспечивают ее тонкую подстройку к воздействию различных неблагоприятных факторов.
Россия является ведущим производителем и разработчиком иммуномодуляторов для ветеринарии и медицины в мире. Отечественные ветеринарные препараты признаны в ряде стран, в том числе Украине, Белоруссии, Грузии, Казахстане, Монголии, Киргизии, Молдавии, а также Чехии.
Исследованиями и производством препаратов этой категории занимаются также компании из Белоруссии, Испании, Китая, Кореи и некоторых других стран. В Америке схожие по действию препараты для ветеринарного применения продвигаются в основном в качестве пищевых добавок и регенеративных средств.
К сожалению, регистрацию иммуномодуляторов в западных странах тормозят несколько барьеров, связанных с несовершенством методов исследований и оценки действующих веществ, а также с тем, что ряд иммунологических процессов в организме животных еще недостаточно изучен. Для промышленной ветеринарии внедрение в практику иммуномодуляторов интересно с точки зрения терапии и профилактики бактериальных и вирусных заболеваний животных.
В настоящее время Россельхознадзор под влиянием опыта развитых стран добивается значительного уменьшения списка противобактериальных препаратов для лечения животных в целях сокращения рисков возникновения антибиотикорезистентности. Запрещено продавать антибактериальные субстанции для профилактических обработок животных хозяйствам. Недопустимо назначать противобактериальные вещества в качестве стимуляторов роста (кормовых антибиотиков).
С вирусной и бактериальной нагрузкой в стадах необходимо бороться не антибиотиками, а иными методами, в том числе при помощи вакцинации, улучшения условий кормления и содержания. В связи с этим во всем мире у фермеров возрастает интерес к таким группам веществ, как ферменты, подкислители, пробиотики, а также иммуномодуляторы (чего нет в западных странах, но есть в России!). Перспективными являются разработки, учитывающие, при помощи каких эндогенных и экзогенных веществ органической природы можно повысить устойчивость продуктивных животных к экотоксикантам и другим негативным факторам внешней среды. В связи с особыми потребностями продуктивных и непродуктивных животных иммуномодуляторы получили в ветеринарии более обширное применение, чем в медицине.
Согласно классификации, разработанной медиками, иммуномодуляторы делятся на цитокины, иммунорегуляторные пептиды, препараты антител, нуклеиновые кислоты, иммуномодуляторы синтетического происхождения, препараты бактериального происхождения, растительные средства, а также иммунодепрессанты. В медицине иммунотерапия наиболее широко применяется для лечения онкологических и аутоиммунных заболеваний, в составе терапии вирусных и бактериальных инфекций. Для лечения аутоиммунных заболеваний мелких домашних животных в России продаются иммунодепрессанты Атопика и Оптиммун (действующее вещество циклоспорин).
Из фундаментальной медицины в ветеринарию перешли многие уникальные разработки. Для лечения мелких домашних и продуктивных животных созданы такие ветеринарные препараты, как Азоксивет, Гликопин, Форвет, Ронколейкин, препараты на основе рибавирина.
Еще раз оговоримся, что в ветеринарной практике иммуномодуляторы могут использоваться более широко, чем в медицине, и позволяют глубже изучить модулирование регуляторных процессов в условиях промышленного содержания животных.
Внедрение данных средств в ветеринарию интересно прежде всего с позиций повышения эффективности лечения и профилактики ряда инфекционных заболеваний, носительство которых широко распространено в стадах, а также хронических инфекций.
К сожалению, без антибиотиков, вакцин, противопаразитарных и противовирусных препаратов при высокой концентрации животных в промышленных комплексах обойтись невозможно, но при включении иммуномодуляторов в традиционные терапевтические схемы лечения возможно сократить сроки болезни, уменьшить риск возникновения резистентности патогенов к лекарственным препаратам, улучшить иммунный ответ на вакцинацию и тем самым добиться сокращения затрат на ветеринарный сервис, сократить падеж и улучшить привесы.
Тема промышленного разведения и выращивания скота и птицы тесно сопряжена с технологическими стрессами. В данных условиях особенно важно повышать сопротивляемость животных инфекции.
Многие российские производители иммуномодуляторов сфокусировались на решении проблем, возникающих при выращивании и разведении животных. Неслучайно в ветеринарии применяется более широкий диапазон активных веществ, чем в медицинской практике, так как в поддержке иммунитета нуждаются животные всех возрастов и технологических групп. Среди препаратов, благоприятно воздействующих на иммунную систему и обмен веществ, в ветеринарии используются также тканевые препараты, препараты бутафосфана (помимо гепатопротекторного эффекта и регуляции обмена фосфора в организме в конце прошлого века учеными был выявлен ряд благоприятных эффектов бутафосфана на иммунную систему животных).
При выращивании животных возможно использование не только ветеринарных препаратов, но и кормовых добавок, которые благотворно влияют на повышение уровня естественной резистентности животных, способствуют реализации их генетического потенциала без применения гормональных стимуляторов роста. Также перспективно использовать для этой цели такой препарат, как Гамавит, способствующий усиленной выработке собственного гормона роста у телят, поросят и ягнят.
Пробиотики — первый шаг на пути стимулирования естественной резистентности животных
Пробиотические препараты вызывают сдвиг баланса микрофлоры в сторону полезных (нормальных) микроорганизмов. Важной их функцией является профилактика заболеваний кишечника у молодняка. Противобактериальный эффект пробиотиков связан с производством антимикробных веществ, таких как бактериоцины, и адгезией пробиотических микробов к кишечному эпителию, которые конкурируют за субстрат или индуцируют ответ иммунной системы. В частности, ферменты клеточных стенок грамположительных бактерий (пептидогликаны) регулируют иммунный статус животных, индуцируют выработку специфических антител, активируют систему комплемента, митоз клеток.
Выраженный иммуномодулирующий эффект наблюдается у отдельных штаммов пробиотических бактерий (Bacillus amyloliquefaciens, Bacillus subtillis, Bacillus licheniformis, Enterococcus faecium, Lactobacillus plantarum, Lactobacillus casei и др.), которые применяются в составе ветеринарных препаратов.
Терапия и профилактика вирусных заболеваний, сопровождаемых иммуносупрессией
Стрессовым фактором для организма молодняка является отъем, перевод на новый корм, перегруппировка, транспортировка, хирургические процедуры (кастрация, купирование хвостов, подрезание клювов и др.), профилактические курсы химиотерапевтических препаратов.
В результате длительного воздействия факторов стресса возникает иммуносупрессия. В итоге снижается иммунный ответ на вакцинацию, активизируются процессы размножения в организме животного многих вирусов и бактерий, носительство которых распространено в стадах.
Отмечено, что вирусы служат одним из основных спусковых механизмов развития пневмоний у молодняка.
Так как ряд возбудителей болезней дыхательной и пищеварительной систем свиней и скота (в том числе РНК-вирусы) уже сами по себе являются иммуносупрессорами, применение иммуномодуляторов в составе противобактериальной и противовирусной терапии, а также при вакцинации является весьма актуальным.
В борьбе с инфекциями животных, вызванными РНК-вирусами, перспективна разработка иммуномодуляторов на основе синтетической низкомолекулярной рибонуклеазы, таких как Тривирон. Этот фермент катализирует процесс разрушения вирусных структур. Природным щитом иммунитета животных является выработка цитокинов, к которым относятся интерлейкины и интерфероны.
Интерфероны вырабатываются всеми клетками организма и обладают широким спектром действия, в том числе оказывают противовирусный эффект, подавляют размножение бактерий, простейших, микоплазм и других микроорганизмов; повышают бактерицидную активность сыворотки крови, усиливают фагоцитоз, увеличивают продукцию антител, активизируют Т-киллеры, обладают противоопухолевым действием.
В ветеринарной практике актуально использование рекомбинантных видовых интерферонов, в том числе γ-интерферонов, подавляющих синтез вирусных белков уже на ранних стадиях развития заболевания. Видоспецифичные интерфероны (бычий, свиной, птичий) обычно хорошо переносятся животными и могут применяться в составе терапии вирусных заболеваний. Для уменьшения трудозатрат на ветеринарный сервис и сокращения стресс-факторов на основе интерферонов производятся комплексные препараты с противобактериальными веществами (линкомицином, гентамицином, тилозином, энрофлоксацином и др.). Терапия интерферонами является достаточно дорогостоящей, что ограничивает ее массовое применение.
Для усиления противовирусной защиты возможно применять не только сами интерфероны, но и их индукторы, в частности Максидин, используемый для этой цели у телят и других видов сельскохозяйственных животных.
Доказанным противовирусным эффектом обладает ветеринарный препарат Фоспренил (активный компонент — динатриевая соль фосфата полипренолов). Он также улучшает показатели естественной резистентности (бактерицидная активность сыворотки крови и фагоцитоз), усиливает гуморальный иммунный ответ на вакцины, благодаря чему повышается устойчивость организма к инфекциям, активизируются метаболические процессы в клетках. Доказано, что Фоспренил обладает противовирусной активностью против парамиксовирусов, ортомиксовирусов, тогавирусов, герпесвирусов, коронавирусов и некоторых других вирусов.
Биогенные стимуляторы в ветеринарии
Тканевая терапия в ветеринарии имеет многолетнюю историю. При консервировании тканей животных образуются так называемые биогенные стимуляторы (в том числе фенолы, амиды, карбоновые и другие органические кислоты, пептиды), которые стимулируют иммунитет и продуктивность животных. Тканевые препараты в ветеринарной практике назначаются как для лечения и профилактики болезней, так и в качестве натурального стимулятора роста при откорме.
Данная группа препаратов представлена средствами на основе гидролизатов и денатуратов плаценты, а также продуктами сухой перегонки тканей животных (фракции АСД).
В ветеринарной практике могут применяться синтетические пептиды, в том числе гексапептид тимуса (Иммунофан),которыйоказываетиммунорегулирующий эффект, усиливает реакции фагоцитоза, регулирует окислительно-восстановительные реакции, снижает синтез медиаторов воспаления, способствует более длительной циркуляции специфических антител, нормализует продукцию медиаторов иммунитета, вследствие чего способствует восстановлению клеточного и гуморального иммунитета, повышает естественную резистентность организма, активность ранней противоопухолевой защиты.
Фрагменты клеточных стенок бактерий, дрожжей и растений могут проявлять иммуномодулирующий и противоопухолевый эффекты. Глюкозаминилмурамилдипептид, входящий в состав препарата Гликопин, представляет собой минимальный фрагмент пептидогликана клеточной стенки бактерий. Гликопин стимулирует эффекторные функции фагоцитов (фагоцитоз, синтез активных форм кислорода, активность лизосомальных ферментов) и продукцию провоспалительных цитокинов, в свою очередь, индуцирующих пролиферацию, активацию и дифференцировку клеток адаптивного (приобретенного) иммунитета ― Т- и В-лимфоцитов. Усиливая продукцию колониестимулирующих факторов, индуцирует лейкопоэз. В результате действия препарата происходит активация всех звеньев иммунной системы с усилением противоинфекционного и противоопухолевого иммунитета.
Иммуномодуляторы и детоксикация организма
Высокопродуктивные животные в условиях промышленного выращивания испытывают значительные нагрузки на печень. Поражение клеток печени у животных происходит под действием внутренних и внешних факторов: различных метаболитов организма, испорченных и низкокачественных ингредиентов корма (в том числе прогоркших жиров), при недостатке в рационе аминокислот, микроэлементов и витаминов, поступлении микотоксинов с кормом. Перерождение гепатоцитов происходит под действием инфекционных агентов и паразитов, которые вырабатывают токсические вещества, в том числе пирогены.
В научных работах, посвященных медицине, ряд воспалительных заболеваний паренхимы печени рассматривается как последствия нарушений иммунных механизмов и требует дальнейшего изучения. Отмечается, что при этом происходит снижение гуморального и клеточного иммунитета.
Иммуномодуляторы с гепатопротективным эффектом актуальны для высокопродуктивных молочных коров, а также при выращивании бройлеров. В частности, есть исследования, что при профилактическом и лечебном приеме иммуномодулятора на основе пробиотика Ветом 1.1 при экспериментальном заражении гриппом птиц развитие поражений печени не выражено и наблюдается активация иммунной защиты органа.
Комбинированный иммуномодулирующий препарат Гамавит, действующими веществами которого являются нуклеинат натрия и денатурированный экстракт плаценты, обладает выраженной способностью к детоксикации (применяется при различных отравлениях, нейтрализации паразитарных токсинов), проявляет синергизм с иммуномодуляторами на основе полипренолов, что усиливает антитоксическое, антиоксидантное действие и улучшает функцию гепатоцитов. Препарат повышает устойчивость животных к экотоксикантам.
Доказательная ветеринария
Ряд российских иммуномодуляторов уже прошел данные исследования. В частности, в плацебо- контролируемых исследованиях подтверждены свойства Гамавита как детоксиканта и доказана его способность стимулировать эритропоэз, устраняя анемии различного генеза.
Некоторые иммуномодуляторы и иммунобиологические препараты для продуктивных животных, в том числе противовирусные средства
Вирусы распространены на Земле повсеместно. Они являются неклеточными формами жизни, способными размножаться в клетках прокариот (безъядерные организмы) и эукариот (ядерные организмы), используя их биосинтетический аппарат. В настоящее время известен 2321 вирус позвоночных, беспозвоночных, простейших, растений, грибов, водорослей, бактерий и архей, из которых 2284 агента классифицированы и распределены в 349 родов, 19 подсемейств, 87 семейств и 6 порядков [20].
К клеткам, обеспечивающим врожденный противовирусный иммунитет, относятся естественные киллеры, моноциты, макрофаги и дендритные клетки. Естественные киллеры − лимфоидные клетки, составляющие 5 – 15% лимфоцитов крови. Они имеют общего лимфоидного предшественника и развиваются в костном мозге. Важную роль в их созревании играют ретикулярные клетки стромы, образующие цитокины. Зрелые естественные киллеры покидают костный мозг и мигрируют во вторичные лимфоидные органы (печень , селезенку, кишечник и лимфатические узлы), ориентируясь по градиенту хемокинов, распознаваемых специфическими рецепторами [5, 15].
Моноциты циркулируют в крови и составляют 5 – 10% лейкоцитов. В течение 1 – 2 суток они переходят в ткани, превращаясь в макрофаги, продолжительность жизни которых составляет месяцы и даже годы. Моноциты и макрофаги формируют мононуклеарную фагоцитирующую систему [12].
Выделяют 2 основные формы макрофагов – резидентные и воспалительные. Первые образуются в результате спонтанной миграции моноцитов из кровотока в ткани, а вторые – в процессе экстренного перехода из крови в очаги воспаления. Воспалительные макрофаги обладают высокой фагоцитарной и бактерицидной активностью, являясь эффекторными (исполнительными ) клетками врожденного иммунитета. Резидентные макрофаги выполняют в основном гомеостатическую и регуляторную функции, а также выступают в роли антиген-представляющих клеток (АПК ).
Большинство резидентных макрофагов имеют специальные обозначения: в печени их называют клетками Купфера, в костях – остеокластами, в легких – перитонеальными, а в почках – мезангиальными клетками [5, 7, 12].
Дендритные клетки занимают особое место среди факторов врожденного иммунитета. Они являются самыми мощными антиген-представляющими клетками и основным связующим звеном врожденного и адаптивного иммунитета. Только они способны индуцировать первичный адаптивный иммунный ответ [8, 12]. Свое название ( dendron – дерево) эти клеточные элементы получили из-за характерной морфологии – наличия многочисленных длинных и подвижных цитоплазматических отростков, которые образуются в процессе активации и дифференцировки. Важную роль в физиологии дендритных клеток играют Тoll-подобные рецепторы, способные распознавать практически все основные патогены, включая бактерии, вирусы, грибы, простейших и паразитов [12, 17].
Рецепторы вирусных нуклеиновых кислот. Основным механизмом обнаружения системой врожденного иммунитета вирусных инфекций является идентификация вирусных нуклеиновых кислот рецепторами, расположенными в эндосомах и лизосомах, а также цитозоле клеток. Вслед за этим включаются гуморальные и клеточные факторы врожденного иммунитета – первой линии защиты организма [5, 17].
Вирусные нуклеиновые кислоты распознаются с помощью Toll-, RIG- и NOD-подобных рецепторов. TLR − трансмембранные белки, N-концевая последовательность которых обогащена лейцином и выявляет патогенные паттерны на поверхности патогенов, а также нуклеиновые кислоты вирусов. У мышей обнаружили 11 TLR (1 – 7, 9, 11 – 13), у человека −10 (1 – 10). В клеточных эндосомах и лизосомах локализуются TLR-3, -7, -8, -9, распознающие вирусные нуклеиновые кислоты. Остальные TLR расположены на поверхности клеток и идентифицируют бактерии, грибы и простейших [2, 12].
TLR, реагирующие на вирусные нуклеиновые кислоты, синтезируются на мембранах эндоплазматического ретикулума и с помощью клеточного белка UNC-93В транспортируются в эндосомы, где активируются протеазами. Цитоплазматический домен TLR взаимодействует с адапторными молекулами сигнальных путей и приводит к активации различных генов, в том числе обеспечивающих синтез интерферонов I типа и провоспалительных цитокинов [14, 15].
У человека и мыши TLR-3 выявили в разных клетках, включая фибробласты, В-лимфоциты, лимфоидные дендритные и эпителиальные клетки. В плазмоцитоидных дендритных клетках он не образуется. После взаимодействия с лигандом (вирусной двунитевой РНК) происходят конформационные изменения N-концевой части рецептора, передающиеся на внутриклеточный домен TIR. В передаче сигнала участвует адапторный белок TRIF, запускающий экспрессию генов интерферона-β (ИФН -β).
TLR-7 обнаружили в плазмоцитоидных дендритных клетках и В-лимфоцитах, а TLR-8 – в миелоидных дендритных клетках и моноцитах. TLR-7 и TLR-8 имеют аналогичный сигнальный путь (через адапторный белок MyD88). В результате каскада ферментативных реакций активируется транскрипционный фактор IRF-7 и индуцируется экспрессия генов интерферонов I типа. TLR-7 и TLR-8 взаимодействуют с однонитевыми вирусными РНК.
TLR-9 экспрессируется в плазмоцитоидных дендритных клетках и В-лимфоцитах. Он взаимодействует в эндосомах с двунитевыми ДНК вирусов простого герпеса 1 и 2 [15].
В неструктурированной части клеток (цитозоле ) локализованы рецепторы 2 семейств: RLR и NLR. К первому из них относятся рецепторы RIG-I и MDA-5, которые состоят из С-концевого РНК-хеликазного, ответственного за распознавание вирусных РНК, и двух N-концевых сигнальных доменов. RIG-I идентифицирует однонитевые вирусные РНК, несущие на 5’-конце трифосфат и обогащенные на протяжении более 23 нуклеотидов уридином и аденозином. Этот рецептор также распознает короткие двунитевые РНК без 5’-трифосфата. Рецептор RIG-I выявляет РНК вирусов гриппа, японского энцефалита, везикулярного стоматита, Сендай и гепатита С [2, 15].
Рецептор MDA-5 реагирует на длинные (около 2000 пар нуклеотидов) двунитевые РНК, образующиеся при репликации пикорнавирусов. Геномная РНК реовирусов, состоящая из разных по длине фрагментов двунитевой РНК, распознается обоими рецепторами (RIG -I и MDA-5). RLR при контактах с вирусной РНК индуцируют синтез интерферонов I типа.
Представители семейства NLR состоят из 3 доменов: сигнального N-концевого, олигомеризационного центрального и С-концевого, ответственного за узнавание РНК вируса гриппа, ДНК аденовируса и вируса вакцины. NLR при встрече с вирусными нуклеиновыми кислотами активируют превращение неактивной прокаспазы-1 в активный фермент. Активированная каспаза расщепляет молекулы-предшественники ИЛ-1β и ИЛ-18 с образованием зрелых цитокинов, секретируемых клеткой [12, 15].
Гуморальные факторы врожденного противовирусного иммунитета представлены в основном интерферонами I и III типов, которые продуцируются через несколько часов после инфицирования. К ИФН I типа, обладающих выраженной противовирусной активностью, относят ИФН-&alpha, ИФН-&beta, ИФН-κ и ИФН-ω. Они представляют собой небольшие белковые молекулы, скрепленные дисульфидной связью. Гомология аминокислотной последовательности среди ИФН I типа составляет 30 – 60%. Ранее предполагалось, что ИФН-α синтезируется преимущественно лейкоцитами, а ИФН-β – фибробластами. Однако оказалось, что при соответствующей индукции эти ИФН могут продуцировать различные типы клеток [4, 5, 12].
ИФН-ω сходен по структуре с ИФН-α/β и является главным компонентом человеческого лейкоцитарного ИФН, обладающего мощной антивирусной активностью в отношении различных ДНК- и РНК-содержащих вирусов. ИФН-κ синтезируется в неактивированных кератиноцитах и участвует в защите от различных вирусов, хотя уровень его противовирусной активности относительно ниже, чем других ИФН I типа. Биологическая активность ИФН видоспецифична.
Основными продуцентами ИФН являются плазмоцитоидные дендритные клетки. При вирусных инфекциях они образуют в 200 – 1000 раз больше ИФН-α и ИФН-&beta, чем другие клетки крови. Вирусы стимулируют синтез ИФН I типа у всех эукариотов [5, 12].
ИФН III типа – новое семейство цитокинов, они структурно сходны с ИФН I типа и белками семейства интерлейкинов-10 (ИЛ -10). Три представителя нового семейства цитокинов называют ИФН-λ1 (ИЛ -29), ИФН- λ2 (ИЛ -28А) и ИФН-λ3 (ИЛ -28В). Аминокислотная последовательность ИФН-λ и ИФН-α идентична на 15 – 19% [10].
Образование ИФН III типа наиболее выражено при инфекциях, вызываемых вирусами с однонитевой РНК. Однако, вирусы с двунитевыми ДНК и РНК также способны индуцировать их синтез.
ИФН I и III типов (особенно первые) обладают противовирусной активностью. Полагают, что ИФН I типа играют важную роль в системном противовирусном иммунитете, а ИФН III типа являются ключевыми факторами местного противовирусного иммунитета.
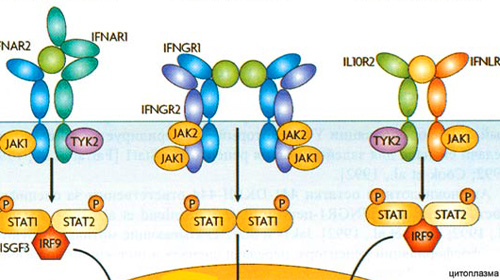
Рецептор для ИФН III типа состоит из двух белковых цепей – IFNLR1 и IL10R2 (общий с рецептором ИЛ-10). Молекула ИФН III типа взаимодействует с обеими цепями рецептора, образуя 3-компонентный комплекс, передающий сигнал в клетку [12, 13].
Противовирусное действие ИФН реализуется активацией различных защитных факторов в неинфицированных клетках. Наиболее изученными из них являются протеинкиназа R, 2’-5’-олигоаденилатсинтетаза и белки Мх (рис . 2). Протеинкиназа R (серинтреониновая киназа) образуется во всех клетках в небольшом количестве. Под влиянием ИФН синтез протеинкиназы R резко возрастает, но она не обладает активностью, поскольку является проферментом. Протеинкиназа R взаимодействует с двунитевой вирусной РНК и активируется. Затем она фосфорилирует α-субъединицу эукариотического инициирующего фактора трансляции 2α (eIF2 α), и он теряет свою активность. В результате блокируется синтез вирусных белков. Кроме того, протеинкиназа R индуцирует апоптоз зараженных клеток. Мыши с дефектным геном протеинкиназы R проявляют повышенную чувствительность к заражению рабдо-, ортомиксо- и ортобуньявирусами [3, 18].
Другой механизм противовирусного действия ИФН связан с активацией генов, кодирующих 2’-5’-олигоаденилатсинтетазу. Этот фермент обеспечивает полимеризацию аденозинтрифосфатов с образованием 2’-5’-олигоаденилатов. Последние связываются неактивной мономерной рибонуклеазой L, стимулируя формирование гомодимера, способного расщеплять однонитевые вирусные РНК. Мыши с дефектным геном рибонуклеазы L обладают повышенной чувствительностью к заражению пикорна-, рео-, тога-, парамиксо-, ортомиксо-, флави- и ретровирусами.
Третий путь реализации противовирусного действия ИФН связан с активацией синтеза белков Мх, относящихся к диаминам и проявляющим активность гуанозинтрифосфатазы. Они участвуют в защите от ортомиксо-, парамиксо-, рабдо-, тога- и буньявирусов [12, 15].
Существуют и другие, менее изученные механизмы ИФН-индуцированной защиты от вирусов, в частности белки, кодируемые ИФН-стимулированными генами семейств ISG15, ISG 56 и P200. ИФН-индуцированные белки тетхерин и виперин препятствуют размножению ортомиксо-, альфа-, ретро- и аренавирусов.
ИФН-ω в некоторых случаях превосходит по антивирусной активности ИФН-α и ИФН-β. Он является мощным ингибитором репликации вируса иммунодефицита человека. ИФН-α и ИФН-β активируют макрофаги и естественные киллеры, стимулируют экспрессию молекул МНС-I и МНС-II на поверхности клеток. Регулируют синтез ИФН-α и ИФН-β сами ИФН I типа посредством позитивной обратной связи. Это позволяет усиливать иммунный ответ против тех вирусов, которые являются слабыми индукторами ИФН [5, 13].
ИФН-γ (II тип) первоначально синтезируется естественными киллерами в период врожденного иммунного ответа, а также Т – лимфоцитами и другими клетками во время адаптивного иммунного ответа. Рецептор ИФН-γ отличается от таковых ИФН I и III типов. Он состоит из 4 белковых цепей (2 гетеродимеров IFNGR1 и IFNGR2), не взаимодействующих между собой (рис . 1). В результате связывания димера ИФН-γ с 2 гетеродимерами рецептора активируются тирозинкиназы JAK1 и JAK2. Эти ферменты фосфорилируют транскрипционный фактор STAT1, который димеризуется и мигрирует в ядро, где взаимодействует с участком GAS и инициирует транскрипцию ИФН-зависимых генов. Всего при действии ИФН-γ в клетках активируется свыше 200 генов [13]. Основными мишенями для ИФН-γ в период врожденного иммунитета являются моноциты и макрофаги. Последние продуцируют активные формы кислорода и азота, которые разрушают вирусы в фаголизосомах.
Противовирусной активностью обладает комплемент. Однако он не является главным фактором защиты против вирусов, поскольку многие из них ускользают от его действия. Например, герпесвирусы и вирусы оспы синтезируют белки, которые сходны с клеточными ингибиторными белками системы комплемента. Некоторые вирусы для проникновения в клетки используют рецепторы и мембранные регуляторные белки комплемента [3, 5].
Вирусы могут разрушаться внутри клеток в процессе аутофагии – заключения их внутри вакуолей. Эти вакуоли, сливаясь с лизосомами, образуют аутофаголизосомы, в которых вирусы разрушаются ферментами.
К основным клеточным факторам врожденного противовирусного иммунитета относятся естественные киллеры, дендритные клетки и макрофаги.
Естественные киллеры способны обнаруживать и уничтожать зараженные вирусами клетки и продуцировать гамма-интерферон (ИФН - γ), индуцирующий остальные противовирусные механизмы. На их поверхности имеются активирующие и ингибирующие рецепторы. Лиганды последних постоянно формируются на нормальных незараженных клетках. Важнейшими ингибирующими лигандами являются молекулы МНС-I, которые имеются практически на всех ядросодержащих клетках. Лиганды активирующих рецепторов на поверхности интактных клеток отсутствуют или образуются в небольшом количестве, но их число резко возрастает при вирусных инфекциях и стрессе [1, 5].
В очаге инфекции активированные естественные киллеры быстро размножаются. Под влиянием ИЛ-15 происходит пролиферация практически всех их субпопуляций. Замедление пролиферации естественных киллеров совпадает с развитием адаптивного иммунного ответа. Возможно, активированные Т-лимфоциты продуцируют цитокины, регулирующие данный процесс.
Дендритные клетки (Лангерганса , миелоидные и плазмоцитоидные) происходят от кроветворных стволовых клеток и проходят несколько стадий развития. Незрелые дендритные клетки циркулируют в крови и составляют менее 0,5% лейкоцитов. Не достигнув зрелости, они мигрируют в ткани, где их подразделяют на резидентные и воспалительные. Первые присутствуют в основном в барьерных тканях (коже и слизистых оболочках), вторые − в очагах воспаления. После созревания дендритные клетки концентрируются преимущественно в Т-зонах региональных лимфатических узлов [15, 16]. Только незрелые дендритные клетки проявляют фагоцитарную активность, но они плохо представляют антиген и слабо активируют Т-лимфоциты. Созревание дендритных клеток сопровождается синтезом протеолитических ферментов, расщепляющих вирусные белки на пептиды, которые представляются МНС-I.
Основную часть плазмоцитоидных дендритных клеткок составляют предендритные клетки, являющиеся основными продуцентами ИФН I типа при вирусных инфекциях. Зрелые плазмоцитоидные дендритные клетки интенсивно экспрессируют молекулы МНС и костимуляции, но прекращают секретировать ИФН I типа. Плазмоцитоидные дендритные клетки играют двойную роль в иммунной системе: на предендритной стадии являются важнейшим компонентом врожденного противовирусного иммунитета, а в зрелом состоянии активируют Т-лимфоциты.
Макрофаги экспрессируют на мембране 9 семейств рецепторов, участвующих во взаимодействии с поврежденными клетками и микроорганизмами. Распознавание антигенов макрофагами сопровождается изменением экспрессии поверхностных молекул, усилением фагоцитарной активности и продукцией цитокинов. Они способны продуцировать и секретировать свыше 100 различных молекул. Большинство из них являются индуцибельными. Важнейшие продукты секреции макрофагов – воспалительные (ИЛ -1&beta, ИЛ-6, ИЛ-12, ИЛ-18, ФНО-&alpha, ГМ-КСФ) и противовоспалительные (ИЛ -10, ТФР-β) цитокины, а также ряд хемокинов. ИФН-γ служит основным активатором макрофагов.
Активированные макрофаги убивают инфицированные клетки, фагоцитируют их и вирусы, а также образуют противовирусные факторы – ИФН-&gamma, фактор некроза опухолей α (ФНО - α) и окись азота. В фаголизосомах вирусы разрушаются посредством кислородзависимых (активные формы кислорода и галоидсодержащие соединения) и кислороднезависимых (локальное закисление, бактерицидные пептиды, катионные белки, ферменты) механизмов [3, 5, 6].
Пути преодоления вирусами защитных механизмов врожденного иммунитета. В процессе длительной эволюции вирусы приобрели способность противодействовать механизмам врожденного иммунитета посредством различных стратегий.
Подавлять синтез ИФН могут продукты многих вирусных генов. Продукт открытой рамки считывания С вируса гепатита В ингибирует индукцию образования ИФН-β. Матриксный белок вируса везикулярного стоматита препятствует транскрипции промотора ИФН-β (участка ДНК, ответственного за связывание РНК-полимеразы). Вирус африканской чумы свиней, размножающийся в макрофагах, подавляет синтез ИФН-γ и ФНО- α. Онкопротеин Е6 вируса папилломы человека 16 блокирует транскрипционную функцию ИФН-регуляторного фактора 3 (IRF -3). В присутствии онкопротеина Е6 вирус Сендай не индуцирует образование ИФН-β. Герпесвирус человека типа 8 кодирует аналог клеточных ИФН-регуляторных факторов. Интерференция продуктов транскрипции вирусов с последними блокирует экспрессию ИФН [15, 19].
Блокировка передачи сигнала. Цитомегаловирус, аденовирусы, многие парамиксовирусы, вирусы Эбола, полиомы мышей и везикулярного стоматита и ряд других агентов способны подавлять передачу активирующего сигнала после взаимодействия ИФН с рецептором на поверхности клетки [5, 15].
Нарушение функций ИФН-индуцированных белков. Многие вирусы подавляют функции ИФН-индуцированных белков. Вирус энцефаломиокардита разрушает связь 2'-5'–олигоаденилатов с рибонуклеазой L, в результате чего вирусная РНК не расщепляется. Аналоги 2'-5'–олигоаденилатов, препятствующие активации рибонуклеазы L, синтезируются в клетках, инфицированных вирусом простого герпеса и SV40.
Наиболее часто ИФН-индуцированная защита от вирусов опосредована активацией протеинкиназы R двунитевой вирусной РНК. В клетках, зараженных аденовирусами, синтезируется большое количество низкомолекулярной вирусассоциированной РНК (VAI ), которая связывается с протеинкиназой R, но не обладает активирующей способностью. Аналогично действуют РНК вируса Эпштейна-Барр и ТАR РНК вируса иммунодефицита человека 1. Белки Е3L вируса вакцины, NS1 вируса гриппа и сигма 3 реовируса предотвращают активацию протеинкиназы R двунитевой РНК. Механизмы деградации протеинкиназы R полиовирусом и вирусом иммунодефицита человека не известны. Вирус гепатита С кодирует 2 белка, интерферирующие с протеинкиназой R. Белок US11 вируса простого герпеса 1 и белок NS1 вируса гриппа блокируют активацию протеинкиназы R двунитевой РНК. Эти белки непосредственно связываются с протеинкиназой R [15, 16].
Заключение. Врожденный иммунитет основан на распознавании различных молекул патогенов и уничтожении их посредством фагоцитоза. Защита от вирусов происходит в результате подавления размножения их интерферонами и разрушения инфицированных клеток естественными киллерами и макрофагами. В процессе эволюции вирусы приобрели способность противодействовать механизмам врожденного иммунитета.
Читайте также:

