Размер молекулы вируса гриппа
Обновлено: 18.04.2024
Штаммы вируса гриппа. Антигены вируса гриппа. Строение вируса гриппа.
Вирулентные штаммы вируса гриппа, в отличие от невирулентных, обязательно активизируются за счет расщепления протеазами. Гемагглютинины вируса гриппа расщепляются внутриклеточно и потому способны инфицировать клетки различных тканей и вызывать системную инфекцию. Ортомиксовирусы с нерасщепленным НА имеют низкую инфекционную активность. Инфекционная форма вируса с расщепленным НА в организме млекопитающих образуется только в клетках, выстилающих дыхательный тракт. При отсутствии трипсина в культуре клеток расщепляется НА только вирулентных штаммов вируса. Для вируса гриппа птиц установлена строгая корреляция между расщепляемостью НА, способностью размножаться в культуре клеток и патогенностью для кур. Расщепление НА на субъединицы не является обязательным для сборки и выхода вирионов из клетки и проявления гемагглютинирующей активности. Полагают, что фактором, детерминирующим патогенность вируса гриппа птиц, является чувствительность НА к протеолитическому расщеплению.
В сайте расщепления НА у вирулентных штаммов вируса гриппа содержится несколько основных аминокислот, а у невирулентных — только один остаток аргинина. Таким образом, только участок из нескольких основных аминокислот у С-конца НА образует сайт узнавания для ферментов, ответственных за расщепление.

Основные функции НА: гемагглютинирующая активность вируса; прикрепление вирионов к клеткам-мишеням путем связывания с сиалосодержащими рецепторами; слияние вирусной и клеточной мембран. НА является основным специфическим антигеном вируса, определяющим (наряду с NA) подтип и вызывающим образование антител, нейтрализующих инфекционность вируса и его ГА-активность. НА играет главную роль в индукции протективного иммунитета при гриппе. В молекуле НА имеются 3-4 антигенных домена, изменения в которых определяют антигенный дрейф. NA является ферментом, катализирующим отщепление сиаловой кислоты от субстрата. Удаление сиаловой кислоты с НА облегчает его расщепление клеточными протеазами. Антитела к белку NA имеют вспомогательное значение в защите и нейтрализуют вирус лишь при высоком титре. Матриксный белок М - самый низкомолекулярный структурный белок. Он принимает участие в морфогенезе вириона и стабилизации его структуры. Нуклеопротеид (NP) - основной внутренний белок, формирующий субъединицы капсида. Белки NP и М являются типоспецифическими антигенами, общими для всех вирусов гриппа одного типа, и в этом отношении резко отличаются от высокодивергентных поверхностных белков. Они не вызывают образования протективных антител. Однако нуклеопротеин вируса гриппа — основной антиген, узнаваемый цитотоксическими Т-лимфоцитами. Аминокислотные последовательности 260—283 нуклеопротеина вируса гриппа А являются индукторами Т-клеточного ответа. Изменение антигенных свойств вируса гриппа — результат двух генетических процессов: антигенных дрейфа и шифта. Антигенный дрейф происходит в основном через накопление аминокислотных замен (точечных мутаций) в НА1. Замена одного аминокислотного остатка в эпитопе нарушает его связывание с соответствующими МАТ. Основные механизмы антигенного шифта — реассортация отдельных генов, возвращение в популяцию старых генов, прямые мутации, изменяющие специфичность к хозяину. NA может измениться независимо от НА. Вариабельность НА вируса гриппа А значительно выше вариабельности НА вируса гриппа В.
В процессе адаптации вируса гриппа к различным системам наблюдают изменение антигенной структуры НА, в основе которой лежит селекция мутантов с измененной рецепторсвязывающей специфичностью. Вирусы гриппа А и В человека, размноженные в КЭ, могут изменяться антигенно и претерпевать мутации в ГА (замена трех аминокислот в ГА). Вирус, размноженный в КЭ или в культуре клеток, защищает против культурального вируса более эффективно, чем против полевого вируса, выделенного от человека.
Один и тот же клинический изолят вируса гриппа при размножении в культуре клеток животных (МДСК) или в КЭ имеет разные антигенные свойства, что связано с заменой одной-двух аминокислот в разных участках молекулы НА. Особенно заметные изменения антигенности в молекуле НА наблюдали при замене аминокислотных остатков 187 и 189 в процессе адаптации вируса к КЭ. Изменение сайта гликозилирования может сопровождаться изменением антигенности и вирулентности вируса. Состав углеводов гемагглютинина вирусов и гриппа птиц может изменяться в различных хозяйских клетках даже в течение одного пассажа. У вирусов гриппа птиц типа А идентифицировано девять нейраминидазных N-антигенов, обозначенных 1-9, и 13 гемагглютинирующих антигенов Н, обозначенных 1-13. Состав Н- и N-антигенов полевых изолятов зависит от вида птиц, места и времени вспышек гриппа. Свиньи восприимчивы к различным подтипам вируса гриппа А и, возможно, вместе с водоплавающей птицей являются главным резервуаром вируса гриппа в природе.
В пермиссивных клетках вирусный НА активируется путем расщепления на две части НА1 и НА2, которые остаются связанными дисульфидными связями. Вирионы прикрепляются к клеткам, активированным НА, соединяются с рецепторами сиаловой кислоты плазматической мембраны и входят в клетку эндоцитозом. После сплавления оболочки вируса и эндоплазматической мембраны транскрипционный комплекс освобождается и транспортируется в ядро, где происходит транскрипция и репликация РНК.
Так же, как у всех других вирусов с негативно-полярным РНК-геномом, геном ортомиксовирусов выполняет две функции: 1) матричную для синтеза мРНК и 2) матричную для синтеза позитивно-полярной промежуточной формы РНК, которая служит матрицей для синтеза потомства геномной РНК. Из 8 первичных транскриптов, синтезированных на 8 генных сегментах вирусов гриппа А и В, 6 являются моноцисторными и транслируются прямо в белки. Два других — подвергаются сплайсингу с образованием двух мРНК, которые транслируются с различных рамок считывания с образованием двух белков. Вирусные белки синтезируются, используя клеточный механизм трансляции. Ортомиксовирусы используют несколько механизмов для увеличения кодирующей способности: сплайсинг мРНК, спаренную стоп-старт-трансляцию тандемных генов и сдвиг рамки считывания.
Репликация геномных РНК сегментов требует синтеза полноразмерных, положительной полярности РНК посредников, которые, в отличие от соответствующих мРНК транскриптов, не имеют КЭП-структуры на 5'-конце и поли (А) последовательности на З'-конце. Вновь синтезированный нуклеопротеин присоединяется к этим РНК, облегчая их использование в качестве матрицы для синтеза геномной РНК. Вирионы формируются почкованием, включая М белок и нуклеокапсид, которые встроены на плазматической мембране, в которую включены НА и NA. Механизмы копирования каждого РНК сегмента и включение их в каждый вирион неизвестны.
Хотя в результате реассортации генов теоретически могут возникать вирусы с любой комбинацией Н и N генов, однако только ограниченное число вирусов с определенной комбинацией Н и N генов оказались важными патогенами, имеющими право на существование. В том числе вызывающие респираторную патологию у людей: H1N1, H2N2, H3N2, H5N1 и, возможно, H3N8; у лошадей H7N7 и H3N8; у норок H10N4; у котиков H7N7 и H4N5; вирусы, часто выделяемые от свиней - H1N1 и H3N2. Главными возбудителями гриппа птиц являются вирусы с H5N2 и H7N1, хотя встречаются и другие варианты вируса гриппа А. Так как установлена резистентность диких видов птиц к вирусу гриппа А, им отводили роль резервуара вируса, прежде всего для домашней птицы. При экспериментальном заражении вирусом H1N5 дикие утки, как правило, не проявляли клинических признаков болезни, хотя вирус в их организме размножался и выделялся во внешнюю среду. Латентное инфицирование вирусом гриппа может иметь место у других домашних и диких животных.
Эпидемиология гриппа. Распространенность гриппа. Морфология вирусов гриппа.
Грипп [от фр. gripper, хватать], или инфлюэнца [от итал. influenza di freddo, влияние холода], — острая инфекция, проявляющаяся поражениями дыхательного тракта, непродолжительной лихорадкой, упадком сил, головной болью, миалгиями и др.
Резервуар гриппа — инфицированный человек (больные и бессимптомные носители). Больной становится заразным за 24 ч до появления основных симптомов и представляет эпидемическую опасность в течение 48 ч после их исчезновения.
Грипп регистрируют повсеместно, рост заболеваемости наблюдают в холодные месяцы. Эпидемии гриппа развиваются с интервалом 2-3 года.
Передача возбудителя гриппа происходит воздушно-капельным путём. Наиболее восприимчивы дети и лица преклонного возраста. Вирусы гриппа чувствительны к действию высоких температур, высушиванию, инсоляции и УФ-облучению. Также они лабильны к действию эфира, фенола, формальдегида и других веществ, денатурирующих белки.

Морфология вирусов гриппа
Суперкапсид вируса гриппа образован липидным бислоем, который пронизывают гликопротеиновые шипы (спикулы), определяющие гемагглютинирующую (Н) либо нейраминидазную (N) активность. Репликация ортомиксовирусов первично реализуется в цитоплазме инфицированной клетки; синтез вирусной РНК происходит в ядре.
• Гемагглютинин обусловливает проникновение вирусов гриппа в клетки в результате слияния с мембраной клетки и мембранами лизосом. AT к нему обеспечивают защитный эффект. Нейраминидаза распознаёт и взаимодействует с рецепторами, содержащими N-ацетилнейраминовую кислоту, то есть приводит к проникновению вируса, а также, отщепляя нейраминовую кислоту от дочерних вирионов и клеточной мембраны, к выходу вирусов из клеток.
• Семь сегментов вирусного генома кодируют структурные белки, восьмой — неструктурные белки NS1 и NS2 вируса гриппа, существующие только в инфицированных клетках. Основные из них — матриксный (М) и нуклеопротеидный (NP) белки. В меньших количествах присутствуют внутренние белки (P1, P2, Р3), участвующие в этапах транскрипции и репликации вируса гриппа.
• М-белок вирусов гриппа играет важную роль в морфогенезе вирусов и защищает геном, окружая нуклеокапсид. Белок NP выполняет регуляторные и структурные функции. Внутренние белки являются ферментами: Р1 — транскриптаза, Р2 — эндонуклеаза, Р3 — репликаза.
Острые вирусные респираторные инфекции. Грипп у детей
Острые вирусные респираторные инфекции (ОВРИ) или острые респираторные заболевания (ОРЗ) представляют собой группу заболеваний, разнообразных по этиологии, но сходных по клиническим и морфологическим признакам.
В прошлом все они объединялись под общим названием гриппа, или инфлюэнцы. В настоящее время методом иммунофлюоресценции выяснено, что в группу ОВРИ, кроме гриппа, входят заболевания, вызываемые вирусом парагриппа, аденовирусами, риновирусом, реовирусом и респираторно-синцитиальным вирусом.
По данным Всемирной организации здравоохранения [Булла А., Хитце К., 1978], ОВРИ представляют собой одну из основных причин заболеваемости и смертности во многих странах мира. Наивысшая смертность от ОВРИ наблюдается в группах детей младшего возраста и среди пожилых лиц.
Грипп (от французского слова gripper — схватить, охватить), или инфлюэнца (от латинского influere — вторгаться), впервые стал известен в конце XVI века.
В настоящее время известно, что грипп вызывается группой родственных РНК-содержащих вирусов (myxovirus influenzae), состоящей из самостоятельных типов А, В и С, различающихся по антигенным свойствам и не дающих перекрестного иммунитета. Имеются серологические разновидности — А1, А2, В и В1.
Источником заражения является больной человек, который опасен для окружающих с первых часов заболевания и до 3—5 сут болезни. Передается грипп воздушно-капельным путем. Быстрому распространению гриппа способствуют высокая восприимчивость к гриппу, непродолжительность приобретенного иммунитета и непрерывная изменчивость вируса. Последняя приводит к тому, что к появляющимся новым вариантам вируса население оказывается полностью неиммунным.
Кроме воздушно-капельного пути передачи инфекции, существуют пути внутриутробной передачи вируса гриппа. В литературе имеются указания о внутриутробной гибели плода, рождении недоношенных, функционально незрелых детей и детей с врожденными аномалиями от матерей, перенесших во время беременности грипп, однако этот вопрос остается дискуссионным. Кроме этого, имеются данные о высокой перинатальной смертности детей, родившихся от матерей, переболевших гриппом. Н. А. Максимович и соавт. (1979), М. Б. Чистякова (1977) указывают на развитие внутриутробных пневмоний у новорожденных при наличии у матерей даже инаппарантной гриппозной инфекции.
В. В. Ритова (1973) выявила смертные случаи и виремию у новорожденных от матерей, переболевших гриппом.
В патологический процесс вовлекается подлежащая ткань и сосудистая сеть, что сопровождается расстройствами кровообращения и деструкцией сосудистых стенок.
Проникая в ток крови (первичная виремия), вирус оказывает общетоксическое действие на организм, повышает сосудистую проницаемость, особенно сосудов микроциркуляторного русла, что обусловливает капилляростазы и диапедезные кровоизлияния.
Циркуляторным расстройствам принадлежит одно из главных мест в патогенезе гриппа. Развивающаяся виремия приводит к диссеминации вируса в организме, и при таком пути инфицирования поражение легких является вторичным. Однако в настоящее время на основании изучения гриппа в эксперименте методами флюоресцирующих антител и электронной микроскопии [Максимович Н. А. и др., 1979] показано, что с первых минут после заражения вирус гриппа проникает в альвеолярные клетки, что обеспечивает в дальнейшем восходящий характер гриппозной инфекции.
G. Lemercier и R. Fontanges (1974), изучавшие легкие в первые минуты после инфицирования, показали, что интратрахеально введенный вирус гриппа уже на 7—12-й минуте адсорбируется эпителием бронхиол и большими альвеолярными клетками и в это же время обнаруживается в просвете легочных капилляров и в их эндотелии.
В результате длительной виремии (первичной и вторичной) вирус гриппа может размножаться в различных органах, имеющих эпителий и эндотелий, в том числе и в мягких мозговых оболочках.

Новость
Вирионы вируса гриппа штамма H1N1
Автор
Редактор
Возможность предсказывать эволюционную динамику вируса гриппа A чрезвычайно важна для здравоохранения: разработанная в соответствии с предсказаниями вакцина, применяющаяся во время сезонных вспышек заболевания, должна обеспечивать эффективную защиту от этой тяжелой инфекции, чреватой серьезными осложнениями. Аминокислотные замены в двух ключевых белках вируса гриппа A, взаимодействующих с иммунной системой, — нейраминидазе и гемагглютинине — происходят довольно часто и помогают вирусу избегать противодействия иммунной системы хозяина. Ученые из Сколковского института науки и технологий и других российских научно-исследовательских институтов показали, что для частоты таких аминокислотных замен характерна любопытная особенность: чем больше времени прошло с момента возникновения очередного варианта участка белка с антигенными свойствами, тем больше вероятность, что он будет заменен другим вариантом. Результаты этого биоинформатического анализа недавно были опубликованы в журнале PNAS.
Вирус гриппа A очень изменчив и постоянно подстраивается под иммунную систему хозяина с помощью аминокислотных замен в двух поверхностных белках, обладающих свойствами антигенов, — гемагглютинине (HA) и нейраминидазе (NA). Эти два белка уже стали классическими примерами, иллюстрирующими адаптивную эволюцию (рис. 1–3). Названия штаммов вируса гриппа также происходят от вариантов этих белков: так, название H1N1 означает, что вирусные частицы содержат гемагглютинин первого типа и нейраминидазу первого типа.

Рисунок 1. Общий вид вириона вируса гриппа A в разрезе

Рисунок 2. Молекула нейраминидазы, заякоренная в мембране вириона

Рисунок 3. Молекула гемаглютинина в мембране вириона
В гемагглютинине и нейраминидазе постоянно происходят несинонимичные аминокислотные замены, которые подхватываются или отбраковываются отбором. Но от чего зависит скорость эволюционирования определенных аминокислотных позиций? Как сообщается в недавней статье российских ученых, вышедшей в PNAS, важным фактором является время возникновения новой аллели (варианта гена): чем больший срок прошел с момента ее возникновения, тем выше вероятность появления в ней новых мутаций [1].
Стоит, однако, отметить, что предложенный авторами статьи подход имеет ряд ограничений. В частности, для правильных оценок времени возникновения варианта белка необходимо иметь достоверное филогенетическое дерево и восстановленный предковый вариант белка, что можно получить далеко не всегда. Тем не менее можно надеяться, что разработанный подход поможет улучшить наше понимание эволюционной динамики патогенов и принимать соответствующие меры по предотвращению вспышек и эпидемий, улучшая качество предсказаний при разработке вакцин.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

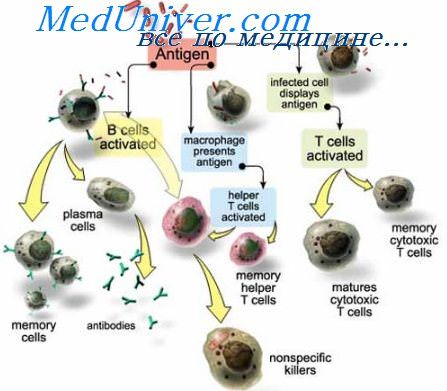
Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

