Ребенок при вирусной инфекции постоянно спит
Обновлено: 18.04.2024
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых кли
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых клинических признаков болезни. В этот период происходит мобилизация защитных сил организма, направленных на компенсацию возможных нарушений, на уничтожение болезнетворных агентов и удаление их из организма. Продромальный период представляет собой временной интервал от первых симптомов заболевания до полного проявления. Период выраженных проявлений заболевания характеризуется полным развитием клинической картины. При различных инфекционных заболеваниях может страдать нервная система ребенка, что клинически проявляется синдромом нейротоксикоза. Нейротоксикоз — ответная неспецифическая реакция детского организма на воздействие вирусной, бактериальной или вирусно-бактериальной флоры, характеризующаяся преимущественным поражением центральной (ЦНС) и вегетативной нервной системы. С истощением функциональных возможностей органов и систем в результате перенесенного заболевания, особенно нервной системы при ее перенапряжении, а также вследствие аутоинтоксикации или экзогенного токсикоза связывают возникновение астенического синдрома. Это наиболее частое клиническое проявление периода реконвалесценции. Утомление в течение длительного времени, которое не компенсируется полным восстановлением, вызывает синдром перегрузки, следом за которым развивается состояние истощения. Субъективно ощущаемое чувство утомления — прежде всего сигнал о перегрузке центральных регуляторных систем, неудовлетворительном состоянии энергетических ресурсов организма и аутоинтоксикации продуктами метаболизма. Длительное утомление, приводящее к истощению, по сути своей является результатом стрессорного воздействия на организм, вызывающего нарушение функций регуляторных систем — вегетативной, эндокринной и иммунной. Если стрессорные факторы действуют в течение длительного времени, может развиться реакция организма, при которой возможны функциональные изменения в виде вегетативной дисфункции [1, 6]. Синдром вегетативной дисфункции (СВД) включает в себя проявление всех форм нарушения вегетативной регуляции. Наряду с соматическими проявлениями: головокружением, головными болями, сердцебиением, одышкой, жаждой, булимией, рвотой после еды, непереносимостью отдельных видов пищи, субфебрилитетом неясного происхождения, кожными высыпаниями и др., у пациентов с СВД выявляют эмоциональные расстройства разной степени выраженности в виде тревожности, нарушения сна, беспричинного плача, а также расстройства поведения, в частности, импульсивности, повышенной двигательной активности и возбудимости, дефицита внимания, что клинически определяется как астеновегетативный или психовегетативный синдром [Вейн А. М., 1981].
Интерес и сложность проблемы астеновегетативного синдрома заключается в том, что она является комплексной: медицинской, психологической и педагогической. Однако все специалисты сходятся в том, что такое состояние существует, его необходимо диагностировать и правильно корректировать.
Задачи исследования
Данное исследование посвящено изучению динамики состояния вегетативной нервной системы детей с астеновегетативным синдромом после перенесенных инфекционных заболеваний, а также оценке эффективности препарата Тенотен детский при названной патологии.
Тенотен детский содержит сверхмалые дозы антител к мозгоспецифическому белку S-100, создан по особой технологии специально для детского возраста, оказывает успокаивающее, нормализующее настроение и поведение действие, а также выраженное вегетостабилизирующий эффект [3, 5].
Критерии включения больных в исследование:
Критерии исключения больных из исследования:
Наличие декомпенсированных заболеваний или острых состояний, которые могут влиять на проведение исследования.
Применение вегетотропных и ноотропных препаратов в период исследования и в последние две недели перед исследованием.
Участие в других клинических исследованиях в течение четырех недель перед включением в данное исследование.
Материал исследования
Для исследования методом случайной выборки дети были распределены в две группы. В основной группе (30 человек) дети в периоде реконвалесценции наряду с симптоматической витаминотерапией получали Тенотен детский по 1 таблетке 3 раза в день в течение 4 недель в сочетании со стандартной терапией. В контрольную группу (20 человек) вошли дети, получавшие стандартную витаминотерапию и симптоматическую терапию за исключением препаратов, обладающих вегетотропной активностью.
Достоверных различий по половозрастным показателям между основной и контрольной группами детей не было.
По спектру перенесенных заболеваний, их тяжести, характеру осложнений выделенные группы детей также значительно не отличались. Спектр заболеваний включал вирусные и вирусно-бактериальные инфекции дыхательных путей (этиологически подтвержденные формы гриппа и другие респираторные вирусные инфекции, тяжелые формы бронхитов и пневмоний и др.), острые средние отиты, тяжелые и осложненные формы инфекционного мононуклеоза, висцеральные формы ветряной оспы, протекающие с нейротоксикозом и везикулезными высыпаниями на внутренних органах. Данные о заболеваниях приведены в таблице.
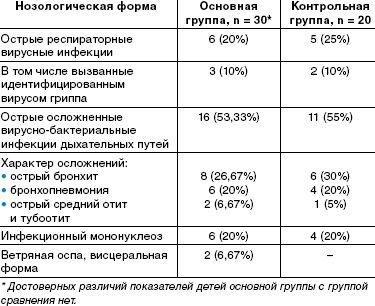
Диагностическое обследование включало в себя клиническую оценку проявлений вегетативной дисфункции, психологическое исследование, неврологическое обследование, электрокардиографию (ЭКГ).
Состояние вегетативной нервной системы определялось по исходному вегетативному тонусу, вегетативной реактивности и вегетативному обеспечению деятельности. Исходный вегетативный тонус, характеризующий направленность функционирования вегетативной нервной системы в состоянии покоя, оценивался по анализу субъективных жалоб и объективных параметров. Оценивалась степень выраженности психопатологических проявлений: утомляемость, тревожность, эмоциональная неустойчивость и др. (модифицированный опросник А. М. Вейна). Определялся внутрисистемный вегетативный тонус по индексу Кердо и межсистемный вегетативный тонус по коэффициенту Хильдебранта. Для оценки вегетативного обеспечения деятельности, отражающего в основном состояние автономной системы регуляции, проводилась клиноортостатическая проба (КОП). Функциональное состояние сердечно-сосудистой системы рассматривалось также на основании данных электрокардиографии.
Уровень внимания оценивался с использованием шкалы SNAP-IV, таблиц Шульте, по результатам модифицированного метода Пьерона–Рузерапо. Выявление расстройств кратковременной и долговременной памяти, косвенно отражающей выраженность астении, проводилось с помощью методики 10 слов и пиктограммы.
Для определения состояния эмоциональной сферы обследуемых (тревоги, депрессии) использовался ахроматический и цветовой тесты Люшера.
После окончания лечения всем детям было проведено повторное комплексное обследование для оценки эффективности терапии. Кроме того, родителям детей предлагалось оценить результаты лечения при помощи десятибалльной аналого-визуальной шкалы, где 0 — это очень плохая оценка, 10 — очень хорошая.
Результаты исследования
Перед началом исследования у всех обследуемых детей (без достоверных различий в обеих группах) с помощью опросника А. М. Вейна определялись умеренно выраженные психопатологические расстройства, в виде неустойчивости эмоционального фона (84%), повышенной тревожности (34%), утомляемости (38%), отвлекаемости (86%), нарушений сна (74%), снижения памяти, а также различные соматические проявления в виде периодических головных болей (52%), головокружения (24%), метеозависимости (12%), снижения аппетита (64%), диспептических нарушений в виде тошноты, рвоты, вздутия живота (44%).
Индекс Кердо позволил определить наличие внутрисистемной дистонии у детей, перенесших тяжелые инфекционные заболевания, он составил в среднем 32,89 ± 0,99 в обеих исследованных группах, что свидетельствовало о превалировании симпатических влияний на организм в покое.
Межсистемный вегетативный тонус, оцениваемый с помощью коэффициента Хильдебранта (средние значения составили 3,98 ± 0,03), имел, в основном, эйтонический характер.
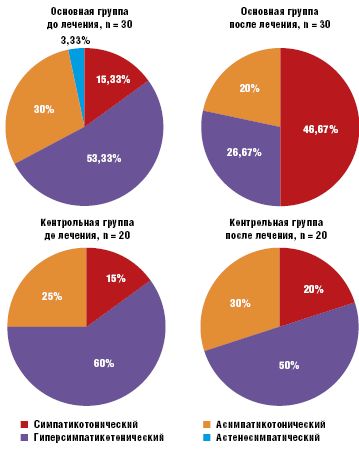
КОП, определяющая вегетативное обеспечение автономной системы регуляции, наряду с нормальным симпатикотоническим вариантом КОП, отражающим устойчивость гемодинамики в ортостазе (14% случаев), выявила и патологические варианты. Гиперсимпатикотонический вариант КОП, характеризующийся резким повышением систолического артериального давления (САД) и диастолического артериального давления (ДАД) и частоты сердечных сокращений (ЧСС) и обусловленный избыточным включением симпатико-адреналовой системы, встречался в преобладающем количестве случаев — у 58% детей. Асимпатикотонический вариант КОП, обусловленный недостаточным подключением симпатического отдела вегетативной нервной системы, при котором САД и ДАД не изменяются или падают, ЧСС остается нормальной или компенсаторно увеличивается, встречался у 28% детей с СВД. Астеносимпатический вариант КОП с падением САД и ДАД и резким увеличением ЧСС в первые минуты ортостаза, с последующей гиперсимпатикотонической реакцией был выявлен в 2% случаев.
Основными психопатологическими проявлениями СВД являлись невнимательность, гиперактивность, импульсивность. Их оценка производилась с помощью шкалы-опросника SNAP-IV (Swanson J., 1992). Показатель невнимательности в двух группах по этой шкале достоверно не отличался и составил в среднем 53,33% (норма (Swanson J., 1992) — 0,40–1,82), средний показатель гиперактивности — 1,96 ± 0,32 (норма (Swanson J., 1992) — 0,27–1,59) и импульсивности 2,13 ± 0,37 (норма (Swanson J., 1992) — 0,26–1,52) (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Выраженность астении косвенно отражается на интеллектуально-мнестических показателях, в частности на оперативной памяти: чем выше утомляемость ребенка в период после перенесенного инфекционного заболевания, тем больше страдает процесс запоминания. Оценка памяти у детей проводилась с помощью методики запоминания десяти слов. Регистрировались следующие показатели: 1) количество повторений, необходимых для воспроизведения 10 слов; 2) количество слов, воспроизведенных через 1 час.
В большинстве случаев обследуемым обеих групп (достоверных различий показателей детей основной группы с группой сравнения нет) для воспроизведения 10 слов требовалось 3 и более повторений, что свидетельствовало о снижении показателей механического запоминания. В то же время количество воспроизводимых слов через час после начала исследования значительно снизилось, что явилось признаком нарушения динамической памяти у детей с вегетативной дистонией.
В качестве методики для исследования опосредованного запоминания использовалась пиктограмма. Регистрировались следующие показатели: 1) количество воспроизведенных понятий; 2) динамика воспроизведенных понятий через 1 час.
Оценка результатов пиктограмм в целом показала, что у детей с СВД дистонией изображаемые образы часто не соответствовали реальным объектам, что впоследствии затрудняло их интерпретацию. Показатели по критерию адекватности (обоснованности связи между предложенным понятием и его пиктограммой) в среднем составили около 50%.
Проведенное по методике Люшера тестирование отразило статистически значимое отклонение преимущественно выбираемой обследуемыми цветовой гаммы от аутогенной нормы. В то же время величина вегетативного показателя не имела столь значимых различий по сравнению с возрастными нормами. Среднестатистические показатели тревожности и напряжения, определенные с помощью теста Люшера, также не имели значительных отклонений от стандартных показателей (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Таким образом, проведенное клиническое обследование детей, перенесших инфекционные заболевания, выявило наличие у них различной степени выраженности проявлений СВД. Безусловно, такие психовегетативные нарушения отражались на периоде реконвалесценции, ухудшали качество жизни и требовали их адекватной коррекции.
В качестве альтернативного препарата для коррекции проявлений СВД был использован Тенотен детский с успокаивающим и выраженным вегетостабилизирующим действием (Лобов М. А., 2008). Основная группа детей (30 человек) получала Тенотен в дозе 3 таблетки/сутки курсом 1 месяц в сочетании со стандартной витаминотерапией. Контрольная группа детей (20 человек) получала стандартную терапию с применением лекарственных средств, не обладающих психотропной и вегетотропной активностью. По окончании курса лечения были проведены повторные клинические исследования.
Прием препарата Тенотен детский в течение месяца обеспечил достоверное (в сравнении с контрольной группой) улучшение показателей психовегетативного статуса и снижение частоты соматоневрологических расстройств у детей, принимавших Тенотен детский, тогда как в контрольной группе детей эти показатели оставались практически на прежнем уровне (рис. 1, 2).
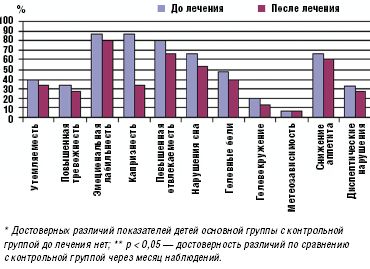
Улучшение показателей вегетативного тонуса отмечалось не только в его психоэмоциональной (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна), но и соматоневрологической (головные боли, головокружение, снижение аппетита, диспептические нарушения) составляющей. Полученные данные отражены на рис. 1.
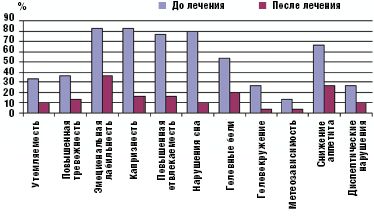
Качественно изменились результаты КОП. У детей, принимавших Тенотен детский, отмечалась нормализация показателей вегетативного обеспечения (симпатикотонический вариант КОП) с 15,33% детей в начале терапии до 46,67% (p < 0,05), у остальных наметилась четкая тенденция к улучшению. В контрольной группе показатели КОП остались практически на прежнем уровне. Данные отражены на рис. 3.
Была выявлена положительная динамика в отношении патопсихологических проявлений. После курсового применения препарата уменьшение выраженности мнестических и поведенческих симптомов (невнимательность, гиперактивность, импульсивность) отмечалось в среднем у 85% детей. Все показатели шкалы SNAP-IV у детей основной группы после лечения Тенотеном достоверно снизились (p < 0,05). Показатели гиперактивности и невнимательности снизились до нормальных значений, абсолютные показатели импульсивности также значительно уменьшились в наблюдаемой группе.
По данным психометрического исследования у пациентов с СВД основной группы были выявлены достоверные положительные изменения при проведении тестов на память и внимание в сравнении с контрольной группой. Данные тестирования выявили отчетливое улучшение показателей механической и динамической памяти у 30% детей (p < 0,05), а также опосредованной памяти в тестах с пиктограммой — повышение показателя адекватности до 75% (p < 0,05).
Динамическая оценка результатов цветового теста Люшера выявила относительную стабилизацию психоэмоционального состояния у детей основной группы, что отразилось на предпочитаемой цветовой гамме и приближении ее к аутогенной норме (по коэффициенту суммарного отклонения от аутогенной нормы — p < 0,05). У детей контрольной группы определяемые показатели не имели статистически значимых изменений.
По окончании исследования родители оценили результаты лечения при помощи десятибалльной аналого-визуальной шкалы. В среднем успешность лечения в основной группе была оценена на 7–8 баллов, в контрольной — на 4–5 баллов.
Выводы
Проведенное исследование показало, что у детей, перенесших инфекционные заболевания, имеются в различной степени выраженные симптомы астеновегетативного синдрома (СВД) в виде психоэмоциональных (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна) и соматоневрологических (головные боли, головокружение, снижение аппетита, диспепсия) нарушений.
Астеновегетативные нарушения отрицательно влияют на процесс реконвалесценции у детей после перенесенных тяжелых инфекционных заболеваний, удлиняя этот период и ухудшая качество жизни пациентов.
Применение препарата Тенотен детский после перенесенных инфекционных заболеваний в дозе 1 таблетка 3 раза в день приводит к нормализации показателей вегетативного тонуса и обеспечения, уменьшает частоту соматоневрологических проявлений вегетативной дисфункции, что способствует более быстрому завершению периода восстановления.
Тенотен детский устраняет проявления астении, стабилизирует психоэмоциональное состояние детей: улучшает настроение, успокаивает, способствует снижению раздражительности и капризности, облегчает процессы обучения (запоминание, концентрацию внимания, усидчивость).
Препарат Тенотен детский безопасен у пациентов старшего дошкольного и младшего школьного возраста. Побочных эффектов во время применения препарата не было отмечено.
Доказанное успокаивающее, выраженное вегетотропное и антиастеническое действие препарата Тенотен детский позволяет рекомендовать его для применения у детей с различными проявлениями вегетососудистой дисфункции после перенесенных инфекционных заболеваний.
По вопросам литературы обращайтесь в редакцию.
Е. В. Михайлова, доктор медицинских наук, профессор
Т. Ильичева
Cаратовская областная детская инфекционная клиническая больница,
Саратовский государственный медицинский университет, Саратов
С наступлением осенне-зимнего сезона у врачей-педиатров заболеваемость их пациентов острыми респираторными вирусными инфекциями (ОРВИ) приобретает исключительную актуальность.
Постинфекционный астенический синдром
Врачам хорошо известна структура вирусов, провоцирующих это заболевание: на 65‒90% в ней представлены вирусы гриппа и парагриппа, аденовирусы и респираторно-синцитиальный вирус. В половине случаев (52%) педиатры имеют дело с вирусной моноинфекцией, в 36% выявляется ассоциация из 2 (и более) вирусов. 1
У каждого ребенка ОРВИ протекает с разной степенью тяжести. Сказывается не только разнообразие патогенов, но и возраст, состояние иммунитета, наличие неблагоприятного преморбидного фона (аденоиды, аллергия), врожденные патологии.
Тем не менее алгоритмы ведения маленьких пациентов с ОРВИ хорошо отработаны. В общей педиатрической практике детям назначается симптоматическая противовирусная терапия, проводится санация очагов хронической инфекции. 2 Вот только нередко бывает, что на смену катаральным явлениям приходит иная клиническая картина – астенический синдром, проявления которого – утомляемость, слабость, раздражительность, плаксивость – наблюдаются у 55‒64% пациентов. 3,4
И это вполне объяснимо: на борьбу с вирусной инфекцией организм тратит много сил и энергии. Даже при повышении температуры лишь на один градус потребность организма в энергии возрастает на 13%. 5 Свою роль играют лекарственная нагрузка и вирусная интоксикация, которые приводят к изменениям в обмене веществ, к ухудшению аппетита (организм недополучает необходимых веществ, ответственных за выработку энергии и восстановление), снижению защитных сил организма.
И это серьезно, потому как астенические расстройства значительно ухудшают качество жизни, усложняют адаптацию в дошкольных и школьных учреждениях, нарушают процесс обучения, снижают коммуникативную активность.
Надо заметить, специалисты рассматривают ощущение утомления и усталости как побуждение к прекращению активности, деятельности, любых усилий и т.д. Если анализировать этот феномен с позиций базовых биологических реакций: нападение – бегство и сохранение – отказ, то астения может рассматриваться как активация системы сохранения энергии посредством отказа и прекращения как физической, так и умственной деятельности. Снижение активности – это универсальный психофизиологический механизм сохранения жизнедеятельности системы в случае любой угрожающей ситуации, который действует по принципу: меньше активности – меньше потребности в энергии. Таким образом, астения – это общая реакция организма на любое состояние, угрожающее истощением энергетических ресурсов. 5
Постинфекционный астенический синдром:
- возникает в результате перенесенного заболевания инфекционного характера (ОРВИ, гриппа, ангины и др.);
- первые симптомы появляются через 1–2 недели после инфекционной болезни и сохраняются в течение 1–2 месяцев;
- преобладают: общее утомление, усталость, усиливающаяся при физических нагрузках, слабость, раздражительность, нарушение сна, беспокойство, напряжение, трудности с концентрацией внимания, эмоциональная неустойчивость, обидчивость, плаксивость, вспыльчивость, капризность, впечатлительность, снижение аппетита, потливость, ощущение перебоев в сердце, нехватки воздуха, снижение порога переносимости различных раздражителей: громких звуков, яркого света, вестибулярных нагрузок.
На важное значение астении после перенесенных ОРВИ для клинической практики указывают не только многочисленные научные изыскания, но и тот факт, что в Международной классификации болезней 10-го пересмотра среди других астенических состояний отдельно выделен синдром G93.3 – синдром усталости после перенесенной вирусной инфекции. 6
Астенический синдром (синдром хронической усталости в англоязычной литературе) весьма многолик. В классификации этого состояния постинфекционный астенический синдром относится к классической вторичной (или реактивной) астении, возникающей у исходно здоровых лиц как реакция на напряжение адаптации в условиях стресса, а также в периоде реконвалесценции (после окончания болезненного процесса и продолжающееся до полного восстановления нормального питания и функционирования всех органов) после инфекционных заболеваний. Наиболее подвержены астеническим реакциям дети со сниженными адаптивными возможностями организма.
Астения, без сомнения, представляет серьезную опасность повышенной истощаемости психических и физических функций организма. В реальной клинической картине ее механизмы могут проявляться не только эмоционально-поведенческими расстройствами (эмоциональной лабильностью, неусидчивостью, чувством тревоги, раздражительностью, беспокойством, внутренним напряжением, неспособностью расслабиться и пр.), но и соматическими проявлениями – нарушениями терморегуляции, респираторными, гастроинтестинальными, вегетативными или функциональными расстройствами (головными болями, потливостью, ухудшением аппетита, перебоями в сердце, одышкой, нарушениями сна). 4
Отмечено, длительно протекающая астения может стать причиной обострения хронического заболевания или реинфекции. Потому это состояние, вне зависимости от причины, вызвавшей его, требует коррекции. Тактика ведения пациентов с постинфекционным астеническим синдромом предполагает комплексный подход, предусматривающий прежде всего полноценный восстановительный период и рациональную фармакотерапию. Ее целью должны быть устранение энергодефицита и гипоксии, церебропротекция и нормализация метаболизма. При этом использование психостимуляторов для лечения больных с постинфекционной астенией нежелательно. 4
L-карнитин в комплексной терапии астенического синдрома
Более 100 лет назад (1905 г.) русскими учеными Р. Кримбергом и В.С. Гулевичем из мышечных тканей животных было выделено витаминоподобное вещество – карнитин. Позже выяснилось, что биологической активностью обладает только L-стереоизомер карнитина (L-карнитин, левокарнитин). Более полувека ушло на то, чтобы его синтезировать. И еще десятилетия – на изучение основных функций карнитина в организме: участие в биоэнергетическом обмене веществ, связывание и выведение из тканей органических кислот – промежуточных продуктов окислительных процессов и др. Столь важное значение карнитина в метаболизме жиров, глюкозы, аминокислот и энергообразовании позволило отнести его к незаменимым веществам.
Карнитин содержится во всех органах, особенно в больших количествах в тканях, нуждающихся в высоком энергетическом обеспечении, – мышцах, миокарде, мозге, печени, почках. Потребность в карнитине индивидуальна (в среднем 200‒500 мг в сутки для взрослого человека) и возрастает в 4‒20 раз при умственных, физических и эмоциональных нагрузках, заболеваниях и функционально особых состояниях (стресс, беременность, спорт и т.п.). Эндогенный синтез у взрослого человека обеспечивает только около 10% потребности организма в карнитине и требует участия витаминов С, В3, В6, фолиевой кислоты, железа, ряда аминокислот и ферментов; при дефиците хотя бы одного из компонентов развивается недостаточность карнитина с ее многообразными системными проявлениями. У детей раннего возраста эндогенный синтез L-карнитина практически не осуществляется, что делает их более уязвимыми к дефициту экзогенного поступления карнитина с продуктами питания (особенно животного белка). Обычный пищевой рацион покрывает потребность в карнитине в лучшем случае наполовину. Все это обусловливает необходимость использования его дополнительных источников. 7
Являясь важным компонентом энергообеспечения клетки, L-карнитин воздействует на многие процессы жизнедеятельности организма, повышает его выносливость к нагрузкам – физическим и интеллектуальным, а его дефицит, сопровождающийся снижением концентрации вещества в сыворотке крови и тканях, может приводить к разнообразным нарушениям. Принимая во внимание это, а также то, что естественное поступление этого биологического вещества в организм и его эндогенный синтез (особенно при инфекционных заболеваниях) не покрывают всех потребностей, необходим дополнительный прием препаратов L-карнитина. 7
Особенно очевидным это становится при рассмотрении функций L-карнитина. Основная из них – биоэнергетическая: L-карнитин обеспечивает транспорт длинноцепочечных жирных кислот из цитоплазмы через внутреннюю мембрану в матрикс митохондрий, где осуществляется процесс β-окисления с последующим образованием АТФ, регулирует интенсивность митохондриального энергообмена путем конъюгации ацильного радикала и высвобождения КоА. 7 Доказано значение L-карнитина для связывания высокореакционных органических кислот (уксусной и др.), а также участие в процессе гликолиза, обмене кетоновых тел и холина.
L-карнитин обладает антигипоксантным, антиоксидантным действием, предотвращает дегенеративное поражение клеток нервной системы, способствуя восстановлению их целостности и функций. 7
Витаминоподобное вещество L-карнитин участвует в переносе жирных кислот в митохондрии, где они используются для образования энергии (АТФ). Окисление жиров при участии L-карнитина дает до 75% внутриклеточной энергии. Это больше, чем в процессе окисления глюкозы.
L-карнитин, помимо биоэнергетической, выполняет ряд важных метаболических функций: 8
- усиливает процесс детоксикации, удаляя избыток органических кислот и чужеродных для организма соединений из клеток, предупреждая их гибель;
- оказывает антиоксидантное действие: выводит из клетки свободные радикалы, способствует их нейтрализации;
- угнетает образование кетокислот и анаэробный гликолиз, уменьшает степень лактатацидоза;
- восполняет щелочной резерв крови, способствует восстановлению ауторегуляции церебральной гемодинамики и увеличению кровоснабжения пораженной области;
- ускоряет репаративные процессы в очаге поражения и оказывает анаболическое действие.
Два десятилетия наблюдений, многочисленных исследований и клинического применения препарата Элькар® при лечении различных заболеваний и патологических состояний у детей и взрослых показали высокую эффективность, безопасность и открыли широкие возможности его применения для лечения пациентов в кардиологии, эндокринологии, неврологии, гастроэнтерологии, спортивной медицине. В педиатрии препарат применяют при заболеваниях и состояниях, сопровождающихся снижением аппетита, уменьшением массы тела, истощением; у детей с самыми разными патологиями с рождения (недоношенные, дети с ослабленными пищевыми рефлексами, с гипотрофией, гипотонией и адинамией, перенесшие асфиксию и родовую травму); при заболеваниях, сопровождающихся недостатком карнитина или его повышенной потерей; в составе комплексной терапии ряда кожных болезней, при интенсивных спортивных тренировках и, конечно же, в период реконвалесценции после заболеваний, в том числе и ОРВИ.
Так, в исследовании С.О. Ключникова (2005) у часто болеющих детей, помимо иммунной патологии, был установлен клеточный энергодефицит. Для его устранения детям с ЛОР-патологией назначались энерготропные препараты, включая левокарнитин. Нормализация показателей фагоцитарной активности нейтрофилов, активности ферментов энергообмена лейкоцитов крови (СДГ, ЛДГ, ГФДГ, ГДГ) и восстановление ферментативной активности лимфоцитов (от 18 до 27%) привели к снижению заболеваемости ОРВИ у детей после приема курсового приема энерготропной терапии. 9 При этом у детей с дисбалансом вегетативной регуляции на фоне приема комплексной терапии с включением препарата левокарнитина в 100% случаев отмечено улучшение вегетативной реактивности, что привело к уменьшению жалоб, нормализации сна и аппетита, повышению физической выносливости. 9
Авторы исследования отметили отсутствие каких-либо побочных эффектов препарата левокарнитина даже у детей с отягощенным аллергоанамнезом и признаками поражения ЦНС. 10
Позже, в сравнительном плацебо-контролируемом исследовании по оценке эффективности применения Элькар® в лечении детей с хроническими бронхолегочными заболеваниями, сопровождающимися нарушениями гемодинамики в системе малого круга кровообращения (хронический бронхит, бронхоэктатическая болезнь, пороки развития легких, гиперчувствительный пневмонит, бронхиальная астма), Л.И. Агапитовым и Ю.М. Белозеровым (2010) 11,12 были продемонстрированы антиоксидантные свойства левокарнитина. После курса лечения у детей с хроническими бронхолегочными заболеваниями, получавших препарат Элькар в течение 4 недель (50 мг/кг в сутки), увеличились максимальная и тотальная эндотелий-зависимая вазодилатация (p 11,12
Оценку эффективности левокарнитина (Элькар®) у детей с бронхиальной астмой физического напряжения дали исследования Г.А. Новика (2009, 2012). Пациенты основной группы (с подтвержденным постнагрузочным бронхоспазмом) получали Элькар в течение 2 месяцев, дети группы сравнения препарат не получали (обе группы пациентов были сопоставимы по клиническим и лабораторным показателям). При динамическом наблюдении показатели внешнего дыхания и величина просвета бронхов у детей обеих групп существенно не изменились, но у детей основной группы, в отличие от контрольной, повысилась толерантность к физической нагрузке (р 13
Влияние Элькара на состояние вегетативной регуляции и повышение устойчивости к нагрузкам показано в исследовании С.Л. Морозова (2015). Так, при оценке показателей вариабельности сердечного ритма у детей отмечались нормализация состояния вегетативной нервной системы и, как следствие, повышение адаптации. 2
Улучшение адаптации, а также обмена веществ и энергообеспечения тканей при применении Элькар®, но уже у юных спортсменов доказало и исследование Л.А. Балыковой и соавт. 14,15 Дети со стрессорной кардиомиопатией принимали препарат курсом 1,5 месяца в лечебной дозе 75‒100 мг/кг/сут, спортсмены без признаков поражения сердца ‒ в профилактической дозе 30‒50 мг/кг/сут.
Прием левокарнитина (Элькар®) показал изменения в эффекторных и иммунорегуляторных звеньях врожденного и адаптивного иммунитета. У большинства юных спортсменов при приеме Элькар® показатели гуморального иммунитета достигли нормы, что в сочетании с улучшением показателей клеточного иммунитета (увеличение абсолютного количества нейтрофилов и их метаболической активности) способствовало повышению противоинфекционной резистентности организма и снижению заболеваемости ОРВИ. Кроме того, лечение способствовало возрастанию уровня физической работоспособности, оптимизации гемодинамики в области сердца и уменьшению уровня биохимических, психологических и других маркеров стресса. 14,15
Эффекты препарата Элькар ® при восстановлении после болезни:
- улучшает обмен веществ и энергообеспечение тканей;
- способствует лучшему усвоению из пищи белков, витаминов и других полезных веществ;
- очищает клетки от токсинов;
- способствует укреплению иммунитета;
- улучшает работу сердца.
Таким образом, приведенные данные исследований, а также многие другие, не вошедшие в этот обзор, свидетельствуют о сочетании метаболических, нейропротекторных и иммунокоррегирующих свойств левокарнитина и эффективности отечественного лекарственного препарата на его основе Элькар® (L-карнитин) в терапии и профилактике обширного круга состояний и заболеваний, сопровождающихся явлениями астении, в том числе и после ОРВИ.
Применение Элькара позволяет существенно улучшить состояние здоровья детей, нормализуя механизмы вегетативной регуляции, стабилизируя клеточный энергообмен, что, в свою очередь, способствует возрастанию их физической активности и повышению иммунитета.
Для современных родителей, когда болеет ребёнок, диагноз ОРВИ уже почти как закономерность. Полистав, медицинскую карту в осенне-зимний период в любом случае раз-два промелькнёт это неприятное слово из четырёх букв. И это если детский иммунитет сильный, у некоторых деток это уже не диагноз, а способ жизни в холодный период года. Помимо неприятностей ввиду пропуска школы, детского сада и проблемы с кем оставить болеющего малыша, более существенная угроза таится в осложнениях после вируса.
Возникает вопрос: если диагноз один и тот же, почему симптомы на каждый случай болезни, разные? А вся суть вопроса в том, что один вирус другому вирусу, рознь. Существуют несколько видов, которые педиатры грозно пишут, одним словом, острая респираторная вирусная инфекция (ОРВИ). В зависимости от вида, вирус нацелен на определённую группу органов, хотя это не мешает ему при тяжёлом протекании болезни негативно влиять и на другие органы. Основные виды: риновирус, вирус парагриппа, аденовирус, респираторно-синцитиальная инфекция. Сам по себе вирус не требует лечения антибактериальными препаратами, но часто течение болезни осложняется общей интоксикацией и присоединением бактериальной инфекции (например, пневмококки или стрептококки). Важно, что определить точно какую природу имеет болезнь, может, только врач и анализ крови, поэтому желательно показать ребёнка специалисту, особенно если возраст менее трёх лет. Температура при ОРВИ длиться 3-5 дней, с третьего дня идёт на спад, при гриппе лихорадка держится до 39-40 градусов 4-5 дней.
Ввиду маленького возраста, педиатры практически всегда госпитализируют младенцев и деток до трёх лет, если заболевание было подтверждено. Это объясняется тем, что у них специфическая анатомическая особенность органов дыхания и очень быстро развиваются осложнения, например, обструктивный бронхит или воспаление лёгких.
Нужно помнить, что легче предупредить, чем бороться с последствиями болезни. В сезон вирусных заболеваний укреплять иммунитет, при посещении школы или детского сада можно применять мазь виферон или оксолиновую мазь, а если всё-таки вирус пробрался в организм малыша, вовремя обратится за помощью к специалисту. Будьте здоровы!
На сервисе СпросиВрача доступна консультация педиатра онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!


После перенесенной инфекции,ребенок может долго спать,но лучше вызовите врача пусть посмотрит.
Как с аппетитом?

Ребенок восстанавливается,если нет никаких жалоб,все хорошо с аппетитом и самочувствием то поводов для беспокойства нет.

Мария, с этим тоже всё как обычно всё хорошо, без изменений.Много пьём,правда обычную воду(другого не пьёт)



Добрый день. Да, это даже хорошо! Организм восстанавливается после заболевания. Зубы не проявляются стойкой лихорадкой, нужно быть бдительными. Вероятнее, у ребенка была вирусная инфекция, хорошо, что был назначен Виферон. На будущее перед началом курса антибиотика старайтесь сдавать общий анализ крови, так как зачастую процесс вирусный и из-за длительности лихорадки ( более 3-х дней) врачи назначают антибиотики во избежание осложнений, но если инфекция вирусная, то смысла в этом нет.
Читайте также:

