Рга для идентификации вирусов
Обновлено: 18.04.2024
Выявление противовирусных антител ( AT ) в сыворотке крови. РТГА. РСК. РИФ. Иммуносорбционные методы выявления противовирусных антител.
Более простой и доступный подход — выявление противовирусных антител ( AT ) в сыворотке. Образцы крови необходимо отбирать дважды: немедленно после появления клинических признаков и через 2~3 нед. Чрезвычайно важно исследовать именно два образца сыворотки. Результаты однократного исследования нельзя считать окончательными из-за невозможности связать появление AT с настоящим случаем. Вполне возможно, что эти AT циркулируют после предшествующей инфекции. В подобной ситуации роль исследования сыворотки, полученной в период рекон-валесценции, трудно переоценить. На наличие заболевания в период отбора первой пробы указывает не менее чем четырёхкратное увеличение титра AT, выявленное при исследовании второй пробы.
Перечисленные ниже методы не позволяют дифференцировать антитела ( AT ), образующиеся во время болезни и циркулирующие после выздоровления (продолжительность этого периода вариабельна для различных инфекций). Поскольку для адекватной диагностики необходимо подтвердить достоверное увеличение титров AT в двух пробах, то первую пробу исследуют в острой фазе, а вторую — в период выздоровления (через 2-3 нед). Полученные результаты носят ретроспективный характер и более пригодны для проведения эпидемиологических обследований.
РТГА выявляет AT, синтезируемые против гемагглютининов вирусов (например, вируса гриппа). Метод позволяет легко выявлять подобные антитела ( AT ) в сыворотке больного.
РСК — основной метод серодиагностики вирусных инфекций (среди доступных). Реакция выявляет комплементсвязывающие IgM и IgG, но не дифференцирует их; для оптимизации получаемых результатов постановка реакции требует определённых навыков персонала.
РИФ. При возможности получить биоптат инфицированной ткани и доступности коммерческих наборов AT, меченных флюоресцеином, диагноз может подтвердить реакция прямой иммунофлюоресценции. Постановка реакции включает инкубацию исследуемой ткани с AT, их последующее удаление и люминесцентную микроскопию образца.
Иммуносорбционные методы выявления противовирусных антител
Иммуносорбционные методы (например, ИФА и РИА) более информативны, поскольку выявляют IgM и IgG по отдельности, что позволяет делать определённые выводы о динамике инфекционного процесса или состоянии реконвалесценции. Для выявления AT известный Аг сорбируют на твёрдом субстрате (например, на стенках пробирок, пластиковых микропланшетах, чашках Петри) и вносят различные разведения сыворотки пациента. После соответствующей инкубации несвязавшиеся AT удаляют, вносят антисыворотку к Ig человека, меченную ферментом, повторяют процедуру инкубирования и отмывания несвязанных AT и вносят какой-либо хромогенный субстрат (чувствительный к действию фермента). Поскольку изменение окраски пропорционально содержанию специфических AT, то вполне возможно определение их титра спектрофотометрическим способом. В диагностике ВИЧ-инфекции наи- большее распространение нашёл метод иммуноблотннга.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В основе реакции гемагглютинации лежит способность некоторых вирусов склеивать эритроциты при адсорбции на них. Этой способностью обладают лишь сложно устроенные вирусы, в суперкапсидной оболочке которых имеется белок гемагглютинин (вирусы гриппа, ПГ и другие).
Для обнаружение гемагглютинирующего вируса в исследуемом материале;
Для определение гемагглютинирующего титра вируса
1% взвесь эритроцитов. Выбор эритроцитов зависит от гемагглютинирующих свойств предполагаемого вируса.
Для получения взвеси эритроцитов берут кровь при убое животного или птицы с антикоагулянтом (гепарин, лимонно-кислый натр, жидкость Альсевера. Эритроциты отмывают физраствором с последующим центрифугированием. Надосадочная жидкость должна быть прозрачной. Её удаляют, а из осадка делают 1% взвесь (на 1 кубик эритроцитов берут 100мл физраствора).
Методика постановки РГА.
Капельная РГА. На предметное стекло наносят каплю испытуемого ВСМ и каплю 1% взвеси эритроцитов, перемешивают. При наличии гемагглютинирующего вируса появятся красные хлопья в результате склеивания эритроцитов. Метод ориентировочный.
2 метод. Реакцию ставят на плексиглазовых пластинках с лунками. В 1 ряду 12 лунок, 6 рядов. В ряду лунок готовят ряд последовательных двукратных разведений. Для этого вносят в каждую лунку по 0,5мл физраствора. Затем в первую лунку добавляют 0,5мл ВСМ, из 1й после перемешивния (3хкратного) во вторую, из 2й в 3ю и так далее, из последней в дезраствор. Т.о. получают разведение 1:2, 1:4, 1:8, 1:16, 1:32 и т.д. в контрольной лунке смешивают равные объемы физраствора и эритроцитов, а в остальные добавляют по 0,5мл 1% взвеси эритроцитов.
Пластинки слегка встряхивают и оставляют на ровном месте на 35-40 минут.
Учет РГА. Если реакция положительная – на дне лунки образуется осадок в виде перевернутого раскрытого зонтика из склеенных эритроцитов. Значит, в исследуемом материале содержится гемагглютинирующий вирус. При отрицательной реакции и в контроле на дне лунки образуется осадок в виде красной пуговки (склеивания не наблюдается).
Реакцию учитывают в крестах.
+++ - 100% гемагглютинация; ++ - 50% гемагглютинация; + - 25% гемагглютинация; - - реакция отрицательная, 0% гемагглютинация.
Наибольшее разведение ВСМ, вызывающее гемагглютинацию не менее, чем на ++ называется гемагглютинирующим титром вируса и соответствует 1й гемагглютинирующей единице. (ГАЕ).
Если 1 ГАЕ = 1:32, то 4 ГАЕ = 1:8
Вид вируса с помощью РГА не определяют. РГА - не серологическая реакция, так как в ней не участвуют антитела.
82 Реакция торможения гемагглютинации (ртга) и её практическое использование в вирусологии, достоинства и недостатки.
В основе РТГА лежит взаимодействие антител с антигенами, причем антитела (антигемагглютинины) блокируют гемагглютинин вируса, и он утрачивает способность склеивать эритроциты. Эту реакцию используют:
Для идентификации вирусов (определяют антиген по заведомо известным антителам)
Для прижизненной серологической диагностики (исследуют сыворотку крови на наличие антител по заведомо известному антигену) – у реконвалесцентов, вакцинированных животных определяют таким образом напряженность иммунитета.
Принцип РТГА
В реакции торможения гемагглютинации выделяют 2 фазы:
Специфическая. В эту фазу смешивают сыворотку с антигеном. Если в сыворотке содержатся антитела, гомологичные антигену, то образуется комплекс антиген + антитело, и вирус утрачивает гемагглютинирующие свойства;
Индикаторная. Роль индикатора выполняет 1% взвесь эритроцтов, при добавлении которой гемагглютинации не наблюдается (если антитела и антиген гомологичны) – положительная реакция (осадок в виде пуговки). При отрицательной реакции, если антиген и антитела гетерологичны, блокировки вируса не происходит, на дне образуется осадок в виде зонтика.
Компоненты реакции
Испытуемый вируссодержащий материал или стандартный вирус (диагностикум)
Иммунная специфическая сыворотка или испытуемая сыворотка
Методика постановки РТГА
РТГА для идентификации вируса
Реакцию ставят на плексиглазовых пластинках с лунками. В ряду лунок готовят ряд последовательных двукратных разведений иммунной специфической сыворотки к предполагаемому вирусу. Для этого разливают по 0,25мл физраствора, а затем в первую вносят 0,25мл сыворотки и переносят в последующие, из последней в дезраствор. Таким образом, получают разведения 1:2, 4, 8, 16 и так далее.
В каждую лунку добавляют по 0,25мл ВСМ в количестве 4 ГАЕ (см. РГА) и выдерживают 20 минут при комнатной температуре или в термостате.
Во все лунки добавляют по 0,5мл 1% взвеси эритроцитов. Выбор эритроцитов такой же, как для РГА,
В контрольных лунках (2х) смешивают сыворотку с эритроцитами и физраствор с эритроцитами (по 0,5 каждого компонента). Выдерживают 20 минут при комнатной температуре и учитывают реакцию.
Если реакция положительная – на дне луно образуется осадок в виде красной пуговки, в контрольных лунках также должны быть пуговки. По антителам сыворотки определяют вид вируса.
Реакция нейтрализации (РН) основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки. Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН - отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку. Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 37 0 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН - 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН - ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
96) . Вирусы, их строение, биологические свойства, размножение вирусов, культивирование в живых системах. Классификация вирусов. Вирусы – доклеточные формы жизни, которые являются облигатными внутриклеточными паразитами, т. е. могут существовать и размножаться только внутри организма хозяина. Основные свойства вирусов (и плазмид), по которым они отличаются от остального живого мира. 1.Ультрамикроскопические размеры (измеряются в нанометрах). Крупные вирусы (вирус оспы) могут достигать размеров 300 нм, мелкие- от 20 до 40 нм. 1мм=1000мкм, 1мкм=1000нм. 2.Вирусы содержат нуклеиновую кислоту только одного типа- или ДНК (ДНК- вирусы) или РНК (РНК- вирусы). У всех остальных организмов геном представлен ДНК, в них содержится как ДНК, так и РНК. 3.Вирусы не способны к росту и бинарному делению. 4.Вирусы размножаются путем воспроизводства себя в инфицированной клетке хозяина за счет собственной геномной нуклеиновой кислоты. 5.У вирусов нет собственных систем мобилизации энергии и белок- синтензирующих систем, в связи с чем вирусы являются абсолютными внутриклеточными паразитами. 6.Средой обитания вирусов являются живые клетки- бактерии (это вирусы бактерий или бактериофаги), клетки растений, животных и человека. Все вирусы существуют в двух качественно разных формах: внеклеточной- вирион и внутриклеточной- вирус. Таксономия этих представителей микромира основана на характеристике вирионов- конечной фазы развития вирусов.
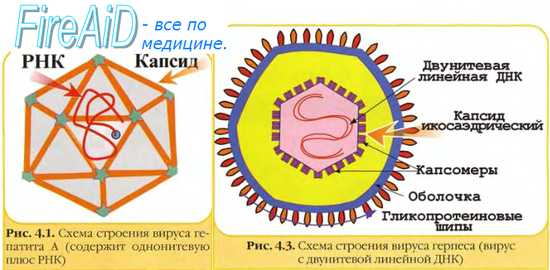
Строение (морфология) вирусов. 1.Геном вирусов образуют нуклеиновые кислоты, представленные одноцепочечными молекулами РНК (у большинства РНК- вирусов) или двухцепочечными молекулами ДНК (у большинства ДНК- вирусов). 2.Капсид — белковая оболочка, в которую упакована геномная нуклеиновая кислота. Капсид состоит из идентичных белковых субъединиц- капсомеров. Существуют два способа упаковки капсомеров в капсид- спиральный (спиральные вирусы) и кубический (сферические вирусы). 3.Просто устроенные вирусы имеют только нуклеокапсид, т.е. комплекс генома с капсидом и называются “голыми”. 4. У других вирусов поверх капсида есть дополнительная мембраноподобная оболочка, приобретаемая вирусом в момент выхода из клетки хозяина- суперкапсид. Такие вирусы называют “одетыми”. Кроме вирусов, имеются еще более просто устроенные формы способных передаваться агентов — плазмиды, вироиды и прионы.
При внедрении вируса внутрь клетки-хозяина происходит освобождение молекулы нуклеиновой кислоты от белка, поэтому в клетку попадает только чистый и незащищенный генетический материал. Если вирус ДНК, то молекула ДНК встраивается в молекулу ДНК хозяина и воспроизводится вместе с ней. Так появляются новые вирусные ДНК. Все процессы, протекающие в клетке, замедляются, клетка начинает работать на воспроизводство вируса. Так как вирус является облигатным паразитом, то для его жизни необходима клетка-хозяин, поэтому она не погибает в процессе размножения вируса. Гибель клетки происходит только после выхода из нее вирусных частиц.
Ретровирус, обеспечивающие обратную транскрипцию: на матрице РНК строится одноцепочечная молекула ДНК. Из свободных нуклеотидов достраивается комплементарная цепь, которая и встраивается в геном клетки-хозяина. С полученной ДНК информация переписывается на молекулу и-РНК, на матрице которой затем синтезируются белки ретровируса. Основные методы культивирования вирусов: 1) биологический – заражение лабораторных животных. 2) культивирование вирусов в развивающихся куриных эмбрионах.
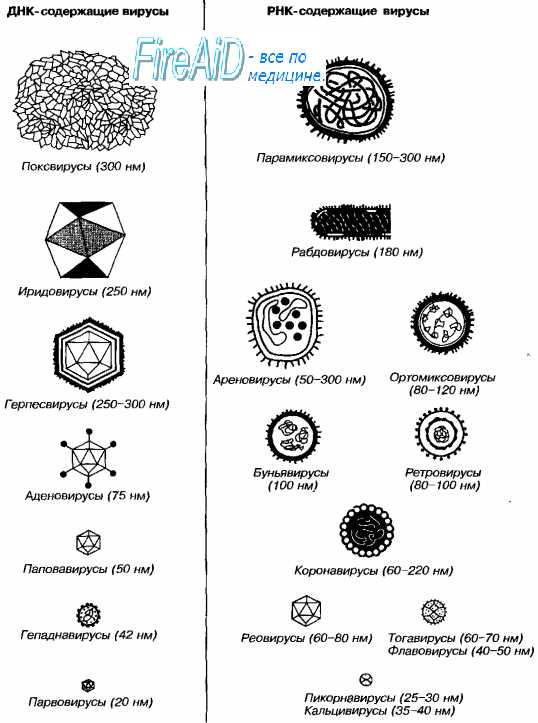
КЛАССИФИКАЦИЯ ВИРУСОВ
ДЕЗОКСИВИРУСЫ
1. ДНК двухнитчатая
2. ДНК однонитчатая
1. РНК двухнитчатая
2. РНК однонитчатая
1.1. Кубический тип симметрии: 1.1.1. Без внешних оболочек:аденовирусы 1.1.2. С внешними оболочками:герпес-вирусы1.2. Смешанный тип симметрии:Т-четные бактериофаги 1.3. Без определенного типа симметрии:оспенные вирусы
2.1. Кубический тип симметрии:
2.1.1. Без внешних оболочек:
крысиный вирус Килхама, аденосателлиты
1.1. Кубический тип симметрии:
1.1.1. Без внешних оболочек:
реовирусы, вирусы раневых опухолей растений
2.1. Кубический тип симметрии: 2.1.1. Без внешних оболочек:вирус полиомиелита, энтеровирусы, риновирусы 2.2. Спиральный тип симметрии: 2.2.1. Без внешних оболочек:вирус табачной мозаики 2.2.2. С внешними оболочками:вирусы гриппа, бешенства, онкогенные РНК-содержащие вирусы
97) . Вирусологический метод исследования. Средства индикации и идентификации вируса. Вирусологические методы исследования используются также с целью идентификации вирусов, изучения их биологии и способности воздействовать на клетки животных и человека, что в дальнейшем помогает понимать патогенез вирусных заболеваний и правильно выбирать методы их лечения. Кроме установления этиологии заболевания и мониторинга эффективности терапии, вирусологические методы исследования имеют большое значение в определении и проведении противоэпидемических мероприятий. ПРЯМЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ В ВИРУСОЛОГИИ Прямые вирусологические методы исследования позволяют обнаружить вирус, вирусную нуклеиновую кислоту или вирусный антиген непосредственно в клиническом материале и являются, таким образом, наиболее быстрыми (экспресс-методы – до 24 ч). Данные методы менее информативны и требуют лабораторного подтверждения непрямыми методами диагностики в связи с нередким получением ложноотрицательных или ложноположительных результатов. К прямым относятся следующие методы исследования: • электронная микроскопия с окрашиванием вирусов методом негативного контрастирования • иммунная электронная микроскопия, основанная на взаимодействии специфических антител с вирусами с образованием комплексов, которые легче обнаруживаются при негативном контрастировании, нежели вирусы отдельно; • твердофазный иммуноферментный анализ (ИФА) с использованием меченных ферментами антител, • реакция иммунофлюоресценции (РИФ) – прямая или непрямая – основана на применении антител, связанных с флюоресцентным красителем; • радиоиммунный анализ (РИА) основан на использовании меченных радиоизотопами антител и гамма-счётчиков; • цитологические методы основаны на микроскопическом исследовании окрашенных мазков, биоптатов, материалов аутопсии; • молекулярные методы – молекулярная гибридизация нуклеиновых кислот и полимеразная цепная реакция.
НЕПРЯМЫЕ ВИРУСОЛОГИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ Данные методы основаны на выделении и идентификации вируса. Материалом для таких исследований может быть содержимое везикул, соскобы (при ветряной оспе, герпетическом поражении кожи и слизистых оболочек), носоглоточный смыв (при респираторных инфекциях), кровь и ликвор (при арбовирусных инфекциях), фекалии (при энтеровирусных инфекциях), смывы (при кори, краснухе и др.). В связи с тем, что вирусы способны размножаться только в живых клетках, культивирование вируса осуществляют в культуре ткани, курином эмбрионе или в организме животного. Индикацию вируса проводят по цитопатическому действию, в реакции гемадсорбции, по цветной пробе, по результатам реакции торможения гемагглютинации, по изменениям или их отсутствию в куриных эмбрионах или культурах ткани, по выживаемости чувствительных животных. СЕРОЛОГИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ, ПРИМЕНЯЕМЫЕ В ВИРУСОЛОГИИ Под серологической диагностикой подразумеваются вирусологические методы исследования, основанные на реакции антиген-антитело. При этом чаще всего используются парные сыворотки крови, которые берутся с интервалом в несколько недель. При нарастании титра антител в 4 и более раз реакция считается положительной. Для определения типоспецифичности вирусов применяется реакция вируснейтрализации, с целью определения группоспецифичности – реакция связывания комплемента. Также широко применяются реакции пассивной гемагглютинации, торможения гемагглютинации, обратной пассивной гемагглютинации, РИФ и различные варианты иммуноферментного анализа. Методы индикации и идентификации вирусов в клеточных культурах При заражении вирусами клеточных культур можно получать различные видимые проявления действия вируса:
Окончательная идентификация выделенного вируса проводится с помощью реакции нейтрализации с диагностическими вируснейтрализующими сыворотками. Определяют их родовую и видовую принадлежность Реакция нейтрализации — реакция торможения гемагглютинации (РТГА). РТГА применяется: -для серотипирования вирусов; -для серодиагностики инфекций..
РТГА. Цель: серотипирование вируса гриппа А Компоненты: 1. Исследуемый материал — аллантоисная жидкость куриного эмбриона, 2. Диагностические противогриппозные типоспецифиче-ские сыворотки, 3. 5 % взвесь куриных эритроцитов. 4. Физиологический раствор. Реакция ставится на стекле капельным способом. На стекло наносят по 1 капле диагностических сывороток и исследуемого материала, перемешивают, затем добавляют 1 каплю взвеси эритроцитов. При положительной реакции наблюдается гомогенное покраснение, а при отрицательной выпадение хлопьев красного цвета (гемагглютинация). Реакция торможения гемагглютинации (РТГА) В основе РГА лежит способность эритроцитов склеиваться при адсорбции на них определенных антигенов.В качестве исследуемого материала при гемагглютинации используют аллантоисную, амниотическую жидкость. РГА не является серологической, поскольку происходит без участия иммунной сыворотки и используется для выбора рабочего разведения антигена для постановки РТГА или наличия антигена (вируса) в исследуемом материале (например, при гриппе). В реакции используются эритроциты животных, птиц, человека I (0) группы крови.
Для постановки ориентировочной РГА на предметное стекло наносят каплю 5% взвеси эритроцитов и каплю испытуемого материала, тщательно смешивают. При положительном результате через 1-2 минуты макроскопически наблюдают появление хлопьевидной агглютинации эритроцитов. Для постановки РГА в развернутом ряду в лунках полистероловых планшетов готовят двукратно возрастающие разведения исследуемого материала на физиологическом растворе в объёме 0,5 мл. Во все пробирки вносят по 0,5 мл 0,25 - 1% взвеси эритроцитов. Результаты учитывают после полного оседания эритроцитов в контроле (эритроциты + физиологический раствор). Реакцию учитывают по характеру осадка эритроцитов. В положительных случаях степень агглютинации отмечают плюсами. Резко очерченный осадок эритроцитов, неотличимый от контроля показывает отсутствие агглютинации. При положительном результате РГА исследование продолжают, определяя тип выделенного вируса с помощью реакции торможения гемагглютинации типоспецифическими сыворотками.
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

