Ритонавир и гепатит с
Обновлено: 22.04.2024
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Владелец регистрационного удостоверения:
Произведено:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Ритонавир
Капсулы твердые желатиновые, №0, белого цвета; содержимое капсул - смесь порошка и гранул белого или почти белого цвета.
| 1 капс. | |
| ритонавир | 100 мг |
Вспомогательные вещества: крахмал прежелатинизированный - 77 мг, лактозы моногидрат - 50 мг, тальк - 5 мг, магния стеарат - 3 мг.
Капсула твердая желатиновая: титана диоксид - 2%, желатин - до 100%.
10 шт. - упаковки ячейковые контурные (3) - пачки картонные.
10 шт. - упаковки ячейковые контурные (6) - пачки картонные.
60 шт. - банки - пачки картонные.
Фармакологическое действие
Противовирусное средство. Обладает селективным сродством к аспарил-протеазе ВИЧ и поэтому оказывает слабое ингибирующее действие на соответствующую протеазу человека.
В исследованиях in vitro показано, что ритонавир оказывает выраженное ингибирующее действие на репликацию как лабораторных, так и клинических штаммов ВИЧ.
Ритонавир почти полностью метаболизируется в печени.
Показания активных веществ препарата Ритонавир
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
При приеме внутрь взрослым - по 600 мг 2 раза/сут. Для уменьшения побочного действия в первый день можно применять по 300 мг 2 раза/сут с последующим постепенным увеличением дозы на 100 мг до достижения рекомендуемой дозы.
У детей рекомендуется применять в комбинации с противовирусными аналогами нуклеозидов. Рекомендуемая доза составляет по 400 мг/м 2 2 раза/сут. Для уменьшения побочного действия можно начинать прием с дозы 250 мг/м 2 , с дальнейшим увеличением через каждые 2-3 дня на 50 мг/м 2 на прием до тех пор, пока не будет достигнута доза 400 мг/м 2 2 раза/сут. Определение дозы для детей рекомендуется проводить по специальной таблице-номограмме.
Побочное действие
Со стороны пищеварительной системы: часто - анорексия, тошнота, рвота, диарея, сухость во рту, язвенные поражения слизистой оболочки полости рта, отрыжка, метеоризм, нарушения функциональных проб печени; увеличение печеночных и пищеварительных ферментов.
Со стороны ЦНС и периферической нервной системы: часто - страх, бессонница, парестезии вокруг рта и на периферии, головокружение, сонливость.
Со стороны дыхательной системы: возможны ларингит, кашель, фарингит.
Со стороны системы кроветворения: снижение гемоглобина, снижение гематокрита, снижение числа эритроцитов, снижение числа лейкоцитов, снижение числа нейтрофилов, повышение числа эозинофилов.
Со стороны обмена веществ: увеличение мочевой кислоты, гиперлипидемия, потеря массы тела, уменьшение содержания калия, увеличение триглицеридов.
Дерматологические реакции: кожная сыпь, зуд, повышенное потоотделение.
Прочие: расширение периферических сосудов, миалгии.
Противопоказания к применению
Повышенная чувствительность к ритонавиру.
Одновременное применение с амиодароном, астемизолом, итраконазолом, кетоконазолом, бепридилом, цизапридом, бупропионом, клозапином, дигидроэрготамином, эрготамином, энкаинидом, флекаинидом, меперидином, пимозидом, пироксикамом, пропафеноном, пропоксифеном, хинидином, рифабутином, терфенадином, натрия клоразепатом, флуразепамом, диазепамом, эстазоламом, мидазоламом, триазоламом, золпидемом, алпразоламом.
Применение при беременности и кормлении грудью
Применение при нарушениях функции печени
С осторожностью применяют у пациентов с заболеваниями печени.
В период лечения необходимо регулярно контролировать показатели функции печени у пациентов с предшествующим повышением уровня ферментов печени и при гепатите, а также при длительном лечении и у пациентов пожилого возраста.
Применение у детей
Применение у пожилых пациентов
В период лечения необходимо регулярно контролировать показатели функции печени у пациентов пожилого возраста.
Особые указания
С осторожностью применяют у пациентов с заболеваниями печени.
В период лечения необходимо регулярно контролировать показатели функции печени у пациентов с предшествующим повышением уровня ферментов печени и при гепатите, а также при длительном лечении и у пациентов пожилого возраста.
У пациентов с гемофилией A и B типов в отдельных случаях повышается вероятность развития кровотечения (появление кожных и суставных гематом).
Лекарственное взаимодействие
Рифампин, рифабутин, а также курение уменьшают действие ритонавира.
При одновременном применении с ритонавиром требуется уменьшение доз следующих препаратов (вследствие снижения интенсивности их метаболизма): кларитромицин у пациентов с почечной недостаточностью, дезипрамин, саквинавир.
При одновременном применении с ритонавиром следует увеличить дозы гормональных контрацептивов для приема внутрь, теофиллина.
Ритонавир увеличивает средние значения AUC силденафила в 11 раз, кларитромицина и триметоприма на 77% и 20% соответственно; AUC рифабутина и его метаболита возрастает в 4 и 35 раз соответственно.
Ритонавир уменьшает средние значения AUC зидовудина (26%), теофиллина (45%), этинилэстрадиола (41%), сульфаметоксазола (20%); при этом указанные препараты не оказывают существенного влияния на фармакокинетику ритонавира.
Цель исследования - изучить эффективность и безопасность комбинации препаратов прямого противовирусного действия нарлапревир/ритонавир и софосбувир у пациентов с хроническим гепатитом C.
Материал и методы. В исследование были включены пациенты с хронической инфекцией, вызванной вирусом гепатита С (ВГС) генотипа 1, ранее не получавшие противовирусную терапию, без цирроза печени. Пациенты получали терапию комбинацией препаратов: нарлапревир (200 мг 1 раз в сутки), ритонавир (100 мг 1 раз в сутки) и софосбувир (400 мг 1 раз в сутки). Длительность терапии составила 12 нед в группе А и 8 нед в группе В. Представлены предварительные результаты исследования, включающие показатель устойчивого вирусологического ответа через 12 нед после лечения (УВО12) и основные данные по безопасности и переносимости исследуемой комбинации для всех пациентов группы А.
Ключевые слова: хронический гепатит С, вирус гепатита С, нарлапревир, ритонавир, софосбувир
Финансирование . Проведение исследования спонсирует компания АО "Р-Фарм"; создание основных документов, проведение исследования, обработка полученных данных, статистический анализ, написание отчета осуществляет контрактная исследовательская организация "АЛМЕДИС".
Конфликт интересов . Авторы заявляют об отсутствии конфликта интересов.
Противовирусная терапия препаратами прямого противовирусного действия (ПППД) привела к качественным изменениям в лечении хронической инфекции, вызванной вирусом гепатита С (ВГС). Высокие показатели излечения с использованием современных схем терапии ПППД с высоким профилем безопасности позволяют искоренить проблему на глобальном уровне, в связи с этим Всемирная организация здравоохранения (ВОЗ) выступила с призывом к ликвидации вирусного гепатита как угрозы для общественного здравоохранения к 2030 г. [1, 2].
Вопрос "кого лечить?", обсуждаемый при определении показаний к терапии хронического гепатита С (ХГС), потерял свою актуальность, поскольку в настоящее время терапию должны получать все пациенты с инфекцией ВГС, при любой стадии поражения печени [3]. Пациенты, которым раньше лечение откладывали в связи с незначительным поражением печени, считаются приоритетной группой, как и пациенты со стадией фиброза III и IV 4. Достижение целевых показателей ВОЗ по элиминации ВГС на территории РФ станет возможно, если всем больным со стадией фиброза I и половине больных без признаков фиброза (F0) также будет назначено лечение высокоэффективными и безопасными ПППД [4]. В России у большинства обследованных с ХГС (75,5%) выявлен фиброз слабой и умеренной степени выраженности (F0-F2) [6], поэтому отечественные разработки схем противовирусной терапии для данной категории больных имеют особое значение.
Цель работы - изучить эффективность и безопасность терапии ХГС, вызванного генотипом 1 ВГС, с применением комбинации ПППД, включающей нарлапревир, ритонавир и нуклеотидный NS5В-ингибитор полимеразы ВГС софосбувир.
Материал и методы
Эффективность и безопасность комбинации нарлапревира/ритонавира и софосбувира, применяемой в течение 12 или 8 нед (группа А и В соответственно), у пациентов с хронической инфекцией, вызванной ВГС генотипа 1, изучали в многоцентровом открытом клиническом исследовании II фазы.
Проведение данного исследования было разрешено Минздравом России, одобрено Советом по этике Минздрава России, а также независимыми этическими комитетами всех клинических центров, принимавших участие в исследовании. Данное исследование проводили согласно действующему российскому законодательству в соответствии с принципами надлежащей клинической практики (QinicaLTriaLs. gov ID: NCT04246723).
В исследование включали пациентов обоего пола от 18 до 70 лет с хронической инфекцией, вызванной ВГС генотипа 1, ранее не получавших противовирусной терапии, с показателями РНК ВГС в плазме крови ≥10 000 МЕ/мл на момент скрининга и без цирроза печени. Отсутствие цирроза подтверждали данными биопсии печени, выполненной в течение 2 лет до скрининга, либо данными эластометрии с помощью аппарата Fibroscan® (показатели ≤12,5 кПа в течение 6 мес до исходной оценки/дня 1), либо результатами исследования с использованием шкал FibroTest® ≤0,48 и APRI ≤1 на этапе скрининга. В исследование включены пациенты с соответствующими протоколу клинико-лабораторными показателями, без клинически значимых отклонений электрокардиограммы, с клиренсом креатинина по формуле Кокрофта-Голта ≥60 мл/мин.
К основным критериям исключения из исследования отнесены признаки декомпенсированного поражения печени, сопутствующие инфекции вирусом гепатита В и ВИЧ.
Данное исследование включало 3 периода: скрининга, терапии и наблюдения. Длительность периода скрининга составляла около 2 нед, в течение которых проводили обследование больных в соответствии с протоколом и подтверждали их соответствие критериям включения в исследование.
Прошедшие скрининг пациенты получали терапию комбинацией препаратов: нарлапревир 200 мг 1 раз в сутки, ритонавир 100 мг 1 раз в сутки и софосбувир 400 мг 1 раз в сутки.
В соответствии с дизайном исследования длительность терапии в группе А составила 12 нед, в группе В - 8 нед; в группу А требовалось включить 60 пациентов, в группу В -25 пациентов.
По протоколу набор пациентов в группу В осуществляли после завершения набора в группу А, при этом критерием включения пациентов в группу В была исходная вирусная нагрузка РНК ВГС
Длительность периода наблюдения в обеих группах исследования после окончания терапии составит 24 нед, включая первичную точку эффективности: количество пациентов, достигших устойчивого вирусологического ответа через 12 нед после лечения (УВО12), и дополнительный период наблюдения, также длительностью 12 нед, соответствующий показателю устойчивого вирусологического ответа через 24 нед после лечения (УВО24).
В настоящее время оба показателя (УВО12 и УВО24) приняты в качестве показателей достижения эффекта терапии регуляторными органами Европы и США с учетом того, что их соответствие между собой >99% [3, 11].
Помимо первичной точки эффективности (УВО12), в исследовании также определяется количество пациентов, достигших неопределяемого уровня РНК ВГС в разные сроки противовирусной терапии, на момент ее окончания, а также спустя 4, 12 и 24 нед. Кроме того, регистрируют случаи неэффективности терапии: вирусологический прорыв и рецидив заболевания.
Вирусологический прорыв определяют как повышение уровня РНК ВГО по крайней мере на 1 Log10 выше минимального значения либо выявляемый уровень РНК ВГС после снижения его менее порога обнаружения (15 МЕ/мл).
В ходе исследования проведена оценка профиля безопасности и переносимости исследуемой комбинации. Общепринятые критерии оценки нежелательных явлений по шкале токсичности Common Terminology Criteria for Adverse Events (CTCAE) использованы для оценки выраженности выявленных на фоне проводимой терапии отклонений лабораторных показателей.
Статистический анализ демографических и исходных характеристик пациентов, показателей эффективности терапии проводили в анализируемой когорте, включавшей всех пациентов, получивших по крайней мере 1 дозу препаратов исследуемой схемы терапии. Описательная статистика для непрерывных переменных представлена с указанием среднего значения, медианы, стандартного отклонения, минимального и максимального значения, количества имеющихся наблюдений.
Категориальные данные анализировали с использованием абсолютных и относительных частот для каждой категории. Анализ эффективности основан на измерениях уровня РНК ВГС (по отношению к пределу обнаружения).
В ходе статистического анализа будет оценено, превосходит ли частота УВО12 в группе А (12-недельная терапия ранее не получавших лечения пациентов) соответствующий показатель в контрольной группе. Заданное контрольное значение основано на 95% доверительном интервале (ДИ) для обобщенного показателя УВО12, рассчитанного с помощью метаанализа устойчивого вирусологического ответа у ранее не получавших противовирусной терапии пациентов с ХГС и генотипом 1 вируса при применении схемы терапии с пегилированным интерфероном и рибавирином: 53% (95% ДИ 46-59) для пегилированного интерферона альфа-2а и 45% (95% ДИ 39-53) для пегилированного интерферона альфа-2Ь [12].
В статье приведены материалы промежуточного анализа для группы пациентов, завершивших 12 нед терапии (группа А) и прошедших 12-недельный период наблюдения, соответствующий первичной конечной точке эффективности.
Результаты и обсуждение
Предварительные результаты исследования включают первичную конечную точку эффективности (УВО12) для всех пациентов группы А, а также основные данные по безопасности и переносимости исследуемой комбинации.
Пациентов в исследование набирали в 5 клинических центрах Москвы и Санкт-Петербурга. Этап скрининга прошел 71 пациент, подписавший информированное согласие; из них 60 пациентов, соответствующих критериям включения/исключения, получили лечение препаратами (нарлапревир/ритонавир и софосбувир) и закончили период наблюдения, соответствующий точке УВО12. Медиана времени до постановки диагноза ХГС у данных пациентов составила 7,86 года.
В табл. 1 представлена исходная демографическая характеристика пациентов группы А. В данной группе преобладали женщины (66,7%), возраст пациентов варьировал от 22 до 69 лет (медиана возраста - 40 лет). Большинство женщин из группы терапии А (n=24) были способны к деторождению и использовали надлежащие методы контрацепции для предупреждения беременности в ходе исследования.
До начала исследования у большей части пациентов из данной группы определили слабовыраженный фиброз печени F0-F1 (75,0%) по шкале METAVIR, у 9 (15,0%) пациентов выявлена стадия фиброза F3. Исходная вирусная нагрузка в данной группе изменялась в диапазоне от 5150 до 9 050 000 МЕ/мл. Случаев досрочного прекращения терапии и выбывания пациентов из исследования по каким-либо причинам у пациентов группы А не было. Все 60 пациентов группы А достигли УВО12 (100%; 95% ДИ 94-100).
Через 2 нед терапии неопределяемый уровень РНК ВГС установлен у 45 (75,0±5,6%) пациентов (95% ДИ 62,1-85,3); на 4-й неделе - у 58 (96,7%) пациентов (95% ДИ 88,5-99,6). В последующие недели терапии, на момент окончания лечения и в период наблюдения у всех пациентов данной группы достигнут неопределяемый уровень РНК ВГС. Доля пациентов, достигших неопределяемого уровня РНК ВГС на различных сроках терапии и наблюдения, представлена на рис. 2.
Результаты лабораторных исследований, проведенных в рамках данного протокола, были систематизированы в соответствии с классификацией CTCAE (версия 4.03). Подавляющее большинство НЯ были легкой или умеренной степени тяжести и соответствовали степени I или II по шкале токсичности CTCAE. Отдельно взятые нежелательные явления встречались с частотой менее 10%. С наибольшей частотой регистрировали диарею (8,3%), головную боль (8,3%) и сонливость (6,7%).
Направления в области разработки отечественных схем противовирусной терапии гепатита С приближаются к международным: применяются ПППД с укорочением длительности курса терапии, эффективность которых близка к 100% [3, 13]. Схема терапии ХГС с применением отечественного ингибитора протеазы ВГС нарлапревира в комбинации с ритонавиром и софосбувиром продемонстрировала высокую эффективность при хорошем профиле безопасности.
Литература
1. WHO Global health sector strategy on viral hepatitis 2016-2021. WHO/HIV/2016.06. who.int/hepatitis
3. Pawlotsky J.M., Negro F., Aghemo A., Berenguer M., Dalgard O., Du-sheiko G. et al. EASL Recommendations on treatment of hepatitis C 2018. J. Hepatol. 2018. Vol. 69, Is. 2. P 461-511. doi: 10.1016/j.jhep.2018.03.026.
4. Климова Е.А., Бурневич Э.З., Чуланов В.П. и др. Эффективность и безопасность безинтерфероновой комбинации нарлапревир/рито-навир и даклатасвир в популяции российских пациентов с хроническим гепатитом С // Терапевтический архив. 2019. Т. 91, № 8. С. 67 - 74. doi: 10.26442/00403660.2019.08.000384
5. Рекомендации по диагностике и лечению взрослых больных гепатитом С / под ред. В.Т. Ивашкина, Н.Д. Ющука. М. : ГЭОТАР-Медиа, 2017.
6. Пименов Н.Н., Комарова С.В., Карандашова И.В., Цапкова Н.Н., Волчкова Е.В., Чуланов В.П. Гепатит С и его исходы в России: анализ заболеваемости распространенности и смертности до начала программы элиминации инфекции // Инфекционные болезни. 2018. Т. 16, № 3. С. 37-45.
7. Arasappan A., Bennett F., Bogen S.L. et al. Discovery of narlaprevir (SCH 900518): a potent, second generation HCV NS3 serine protease inhibitor // ACS Med. Chem. Lett. 2010. Vol. 1, 2. P. 64-69. doi:10.1021/ml9000276
10. Маевская М.В., Ивашкин ВТ.. Знойко О.О., Климова ЕА., Абдурахманов Д.Т., Бакулин И.Г и др. Эффективность и безопасность отечественного ингибитора протеазы нарлапревира у первичных и ранее леченных пациентов с хроническим гепатитом С, вызванным вирусом 1-го генотипа, без цирроза печени (результаты исследования PIONEER) // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017. Т. 27, № 6. С. 41-51.
11. Martinot-Peignoux M., Stern C., Maylin S., Ripault M.P., Boyer N., Leclere L. et al. Twelve weeks posttreatment follow-up is as relevant as 24 weeks to determine the sustained virologic response in patients with hepatitis C virus receiving pegylated interferon and ribavirin // Hepatology. 2010. Vol. 51. P. 1122-1126.
12. Thorlund K., Druyts E., Mills E.J. SVR12 is higher than SVR24 in treatment-naive hepatitis C genotype 1 patients treated with peginterferon plus ribavirin // Clinical Epidemiology 2014. Vol. 6. P. 49-58.
13. Wang X., Fan X., Deng H., Zhang X., Zhang K., Li N. et al. Efficacy and safety of glecaprevir/pibrentasvir for chronic hepatitis C virus genotypes 1-6 infection: A systematic review and meta-analysis // Int. J. Antimicrob. Agents. 2019. Vol. 54, Is. 6. P 780-789. doi: 10.1016/j.ijantimicag.2019.07.005
Климова Е.А. 1 , Знойко О.О. 1 , Чуланов В.П. 2 ,3 , Гусев Д.А. 4 , Исаков В.А. 5 , Жданов К.В. 6 , Бацких С.Н. 7,8 , Кижло С.Н. 4 , Мамонова Н.А 7 , Козлов К.В. 6 , Сукачев В.С. 6 , Тархова Е.П. 9 , Красавина Э.Н. 9 , Самсонов М.Ю. 9 , Ющук Н.Д. 1
Narlaprevir, ritonavir, and sofosbuvir in non-cirrhotic chronic hepatitis C genotype 1 infected patients
Klimova E.A. 1 , Znoyko O.O. 1 , Chulanov V.P. 2,3 , Gusev D.A. 4 , Isakov V.A. 5 , Zhdanov K.V. 6 , Batskikh S.N. 7,8 , Kizhlo S.N. 4 , Mamonova N.A. 7 , Kozlov K.V. 6 , Sukachev V.S. 6 , Tarkhova E.P. 9 , Krasavina E.N. 9 , Samsonov M.Yu. 9 , Yushchuk N.D. 1
1 A.I. Evdokimov Moscow State University of Medicine and Dentistry of the Ministry of Healthcare of the Russian Federation, 127473, Moscow, Russian Federation
2 I.M. Sechenov First Moscow State Medical University of the Ministry of Healthcare of the Russian Federation (Sechenov University), 119991, Moscow, Russian Federation
3 National Medical Research Center of Phthisiopulmonology and Infectious Diseases, Ministry of Healthcare of the Russian Federation, 127473, Moscow, Russian Federation
4 Centre for the Prevention and Control of AIDS and Infectious Diseases, 190103, Saint Petersburg, Russian Federation
5 Federal Research Center of Nutrition, Biotechnology and Food Safety, 109240, Moscow, Russian Federation
6 Kirov Medical Military Academy of the Ministry of Defense of Russian Federation, 194044, Saint Petersburg, Russian Federation
7 Central Research Institute of Epidemiology, 111123, Moscow, Russian Federation
8 Moscow Clinical Research Center named after A.S. Loginov оf the Moscow Department of Health, 111123, Moscow, Russian Federation
9 JSC R-Pharm, 119421, Moscow, Russian Federation
Aim of investigation - to estimate efficacy and safety of combination of direct-acting antivirus agents narlaprevir/ritonavir and sofosbuvir in patients with chronic hepatitis C.
Material and methods. Treatment naive, non-cirrhotic patients with chronic HCV infection (GT1) were enrolled at the study. Patients received therapy with the combination of narlaprevir 200 mg QD, ritonavir 100 mg QD and sofosbuvir 400 mg QD. Treatment duration was 12 weeks in group A and 8 weeks in group B. Preliminary results with rate of sustained virological response 12 weeks after treatment (SVR12) and main data of safety and tolerability of the investigating combination for all group A patients are presented.
Results and discussion. All 60 patients from group A reached SVR12 (100%; 95% CI 94-100%). Adverse events (AEs) during treatment period were registered in 28 (46.7%) patients. No serious AEs occurred. In total, treatment of narlaprevir/ritonavir and sofosbuvir combination during 12 weeks demonstrated high efficacy with good safety profile.
Keywords: chronic hepatitis C, hepatitis C virus, narlaprevir, ritonavir, sofosbuvir
Funding. The study is sponsored by the company R-Pharm JSC; the creation of basic documents, conducting research, processing the obtained data, statistical analysis, writing a report is carried out by the Contract Research Organization ALMEDIS.
Conflict of interests. The authors declare no conflict of interests.
For citation: Klimova E.A., Znoyko O.O., Chulanov V.P., Gusev D.A., Isakov V.A., Zhdanov K.V., Batskikh S.N., Kizhlo S.N., Mamonova N.A., Kozlov K.V., Sukachev V.S., Tarkhova E.P., Krasavina E.N., Samsonov M.Yu., Yushchuk N.D. Narlaprevir, ritonavir, and sofosbuvir in non-cirrhotic chronic hepatitis C genotype 1 infected patients. Infektsionnye bolezni: novosti, mneniya, obuchenie [Infectious Diseases: News, Opinions, Training]. 2020; 9 (1): 50-6.
Противовирусная терапия препаратами прямого противовирусного действия (ПППД) привела к качественным изменениям в лечении хронической инфекции, вызванной вирусом гепатита С (ВГС). Высокие показатели излечения с использованием современных схем терапии ПППД с высоким профилем безопасности позволяют искоренить проблему на глобальном уровне, в связи с этим Всемирная организация здравоохранения (ВОЗ) выступила с призывом к ликвидации вирусного гепатита как угрозы для общественного здравоохранения к 2030 г. [1, 2].
Цель работы - изучить эффективность и безопасность терапии ХГС, вызванного генотипом 1 ВГС, с применением комбинации ПППД, включающей нарлапревир, ритонавир и нуклеотидный NS5В-ингибитор полимеразы ВГС софосбувир.
Материал и методы
Эффективность и безопасность комбинации нарлапревира/ритонавира и софосбувира, применяемой в течение 12 или 8 нед (группа А и В соответственно), у пациентов с хронической инфекцией, вызванной ВГС генотипа 1, изучали в многоцентровом открытом клиническом исследовании II фазы.
Проведение данного исследования было разрешено Минздравом России, одобрено Советом по этике Минздрава России, а также независимыми этическими комитетами всех клинических центров, принимавших участие в исследовании. Данное исследование проводили согласно действующему российскому законодательству в соответствии с принципами надлежащей клинической практики (ClinicalTrials. gov ID: NCT04246723).
В исследование включали пациентов обоего пола от 18 до 70 лет с хронической инфекцией, вызванной ВГС генотипа 1, ранее не получавших противовирусной терапии, с показателями РНК ВГС в плазме крови ≥10 000 МЕ/мл на момент скрининга и без цирроза печени. Отсутствие цирроза подтверждали данными биопсии печени, выполненной в течение 2 лет до скрининга, либо данными эластометрии с помощью аппарата Fibroscan® (показатели ≤12,5 кПа в течение 6 мес до исходной оценки/дня 1), либо результатами исследования с использованием шкал FibroTest® ≤0,48 и APRI ≤1 на этапе скрининга. В исследование включены пациенты с соответствующими протоколу клинико-лабораторными показателями, без клинически значимых отклонений электрокардиограммы, с клиренсом креатинина по формуле Кокрофта-Голта ≥60 мл/мин.
К основным критериям исключения из исследования отнесены признаки декомпенсированного поражения печени, сопутствующие инфекции вирусом гепатита В и ВИЧ.
Данное исследование включало 3 периода: скрининга, терапии и наблюдения. Длительность периода скрининга составляла около 2 нед, в течение которых проводили обследование больных в соответствии с протоколом и подтверждали их соответствие критериям включения в исследование.
Прошедшие скрининг пациенты получали терапию комбинацией препаратов: нарлапревир 200 мг 1 раз в сутки, ритонавир 100 мг 1 раз в сутки и софосбувир 400 мг 1 раз в сутки.
В соответствии с дизайном исследования длительность терапии в группе А составила 12 нед, в группе В - 8 нед; в группу А требовалось включить 60 пациентов, в группу В -25 пациентов.
По протоколу набор пациентов в группу В осуществляли после завершения набора в группу А, при этом критерием включения пациентов в группу В была исходная вирусная нагрузка РНК ВГС
Рис. 1. Дизайн исследования
НВР - нарлапревир; РТВ - ритонавир; СОФ - софосбувир; УВО12 - устойчивый вирусологический ответ через 12 нед после лечения; УВО24 - устойчивый вирусологический ответ через 24 нед после лечения.
Длительность периода наблюдения в обеих группах исследования после окончания терапии составит 24 нед, включая первичную точку эффективности: количество пациентов, достигших устойчивого вирусологического ответа через 12 нед после лечения (УВО12), и дополнительный период наблюдения, также длительностью 12 нед, соответствующий показателю устойчивого вирусологического ответа через 24 нед после лечения (УВО24).
В настоящее время оба показателя (УВО12 и УВО24) приняты в качестве показателей достижения эффекта терапии регуляторными органами Европы и США с учетом того, что их соответствие между собой >99% [3, 11].
Помимо первичной точки эффективности (УВО12), в исследовании также определяется количество пациентов, достигших неопределяемого уровня РНК ВГС в разные сроки противовирусной терапии, на момент ее окончания, а также спустя 4, 12 и 24 нед. Кроме того, регистрируют случаи неэффективности терапии: вирусологический прорыв и рецидив заболевания.
Вирусологический прорыв определяют как повышение уровня РНК ВГС по крайней мере на 1 log10 выше минимального значения либо выявляемый уровень РНК ВГС после снижения его менее порога обнаружения (15 МЕ/мл).
В ходе исследования проведена оценка профиля безопасности и переносимости исследуемой комбинации. Общепринятые критерии оценки нежелательных явлений по шкале токсичности Common Terminology Criteria for Adverse Events (CTCAE) использованы для оценки выраженности выявленных на фоне проводимой терапии отклонений лабораторных показателей.
Статистический анализ демографических и исходных характеристик пациентов, показателей эффективности терапии проводили в анализируемой когорте, включавшей всех пациентов, получивших по крайней мере 1 дозу препаратов исследуемой схемы терапии. Описательная статистика для непрерывных переменных представлена с указанием среднего значения, медианы, стандартного отклонения, минимального и максимального значения, количества имеющихся наблюдений.
Категориальные данные анализировали с использованием абсолютных и относительных частот для каждой категории. Анализ эффективности основан на измерениях уровня РНК ВГС (по отношению к пределу обнаружения).
В ходе статистического анализа будет оценено, превосходит ли частота УВО12 в группе А (12-недельная терапия ранее не получавших лечения пациентов) соответствующий показатель в контрольной группе. Заданное контрольное значение основано на 95% доверительном интервале (ДИ) для обобщенного показателя УВО12, рассчитанного с помощью метаанализа устойчивого вирусологического ответа у ранее не получавших противовирусной терапии пациентов с ХГС и генотипом 1 вируса при применении схемы терапии с пегилированным интерфероном и рибавирином: 53% (95% ДИ 46-59) для пегилированного интерферона альфа-2а и 45% (95% ДИ 39-53) для пегилированного интерферона альфа-2Ь [12].
В статье приведены материалы промежуточного анализа для группы пациентов, завершивших 12 нед терапии (группа А) и прошедших 12-недельный период наблюдения, соответствующий первичной конечной точке эффективности.
Результаты и обсуждение
Предварительные результаты исследования включают первичную конечную точку эффективности (УВО12) для всех пациентов группы А, а также основные данные по безопасности и переносимости исследуемой комбинации.
Пациентов в исследование набирали в 5 клинических центрах Москвы и Санкт-Петербурга. Этап скрининга прошел 71 пациент, подписавший информированное согласие; из них 60 пациентов, соответствующих критериям включения/ исключения, получили лечение препаратами (нарлапревир/ ритонавир и софосбувир) и закончили период наблюдения, соответствующий точке УВО12. Медиана времени до постановки диагноза ХГС у данных пациентов составила 7,86 года.
В табл. 1 представлена исходная демографическая характеристика пациентов группы А. В данной группе преобладали женщины (66,7%), возраст пациентов варьировал от 22 до 69 лет (медиана возраста - 40 лет). Большинство женщин из группы терапии А (n=24) были способны к деторождению и использовали надлежащие методы контрацепции для предупреждения беременности в ходе исследования.
Таблица 1.
Исходные характеристики пациентов группы А
Основные характеристики (n=60)*
Исходные показатели стадии фиброза печени по шкале METAVIR, n (%)
Примечание. * - 59 пациентов относились к европеоидной расе, у 1 пациента этническая принадлежность не определена; ** - возраст рассчитывали как число полных лет со дня рождения до даты подписания информированного согласия.
До начала исследования у большей части пациентов из данной группы определили слабовыраженный фиброз печени F0-F1 (75,0%) по шкале METAVIR, у 9 (15,0%) пациентов выявлена стадия фиброза F3. Исходная вирусная нагрузка в данной группе изменялась в диапазоне от 5150 до 9 050 000 МЕ/мл. Случаев досрочного прекращения терапии и выбывания пациентов из исследования по каким-либо причинам у пациентов группы А не было. Все 60 пациентов группы А достигли УВО12 (100%; 95% ДИ 94-100).
Через 2 нед терапии неопределяемый уровень РНК ВГС установлен у 45 (75,0±5,6%) пациентов (95% ДИ 62,1-85,3); на 4-й неделе - у 58 (96,7%) пациентов (95% ДИ 88,5-99,6). В последующие недели терапии, на момент окончания лечения и в период наблюдения у всех пациентов данной группы достигнут неопределяемый уровень РНК ВГС. Доля пациентов, достигших неопределяемого уровня РНК ВГС на различных сроках терапии и наблюдения, представлена на рис. 2.
Рис. 2. Доля пациентов, достигших неопределяемого уровня РНК вируса гепатита С в различные сроки наблюдения
УВО4 - устойчивый вирусологический ответ через 4 нед после лечения; УВО12 - устойчивый вирусологический ответ через 12 нед после лечения.
Таблица 2.
Характер и частота развития нежелательных явлений у пациентов группы А
По меньшей мере одно
Результаты лабораторных исследований, проведенных в рамках данного протокола, были систематизированы в соответствии с классификацией CTCAE (версия 4.03). Подавляющее большинство НЯ были легкой или умеренной степени тяжести и соответствовали степени I или II по шкале токсичности CTCAE. Отдельно взятые нежелательные явления встречались с частотой менее 10%. С наибольшей частотой регистрировали диарею (8,3%), головную боль (8,3%) и сонливость (6,7%).
Направления в области разработки отечественных схем противовирусной терапии гепатита С приближаются к международным: применяются ПППД с укорочением длительности курса терапии, эффективность которых близка к 100% [3, 13]. Схема терапии ХГС с применением отечественного ингибитора протеазы ВГС нарлапревира в комбинации с ритонавиром и софосбувиром продемонстрировала высокую эффективность при хорошем профиле безопасности.
ЛИТЕРАТУРА
REFERENCES
Цель исследования - изучение эффективности и безопасности препаратов прямого противовирусного действия нарлапревир/ритонавир и софосбувир у пациентов с хроническим гепатитом C без цирроза печени.
Материал и методы. В исследование были включены пациенты с хронической инфекцией, вызванной вирусом гепатита С (ВГС) генотипа 1, ранее не получавшие противовирусную терапию (ClinicalTrials.gov ID: NCT04246723). Пациенты получали комбинацию препаратов: нарлапревир 200 мг 1 раз в сутки, ритонавир 100 мг 1 раз в сутки и софосбувир 400 мг 1 раз в сутки. Длительность терапии составила 12 нед в группе А и 8 нед в группе В. Первичная конечная точка исследования - устойчивый вирусологический ответ через 12 нед после терапии (УВО12). Представлены результаты исследования для группы В.
Ключевые слова: хронический гепатит С, вирус гепатита С, нарлапревир, ритонавир, софосбувир
Финансирование. Проведение исследования спонсирует компания АО "Р-Фарм"; создание основных документов, проведение исследования, обработку полученных данных, статистический анализ, написание отчета осуществляет контрактная исследовательская организация "АЛМЕДИС".
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Концепция и дизайн исследования - Гусев Д.А., Климова Е.А., Знойко О.О., Исаков В.А., Жданов К.В., Кижло С.Н., Козлов К.В., Сукачев В.С., Бацких С.Н., Тархова Е.П., Красавина Э.Н., Самсонов М.Ю., Ющук Н.Д.; сбор и обработка материала - Гусев Д.А., Климова Е.А., Знойко О.О., Исаков В.А., Кропочев В.С., Жданов К.В., Кижло С.Н., Козлов К.В., Сукачев В.С., Бацких С.Н.; статистическая обработка - контрактная исследовательская организация "АЛМЕДИС"; написание текста - Красавина Э.Н., Исаков В.А.; редактирование - Гусев Д.А., Климова Е.А., Знойко О.О., Исаков В.А., Кижло С.Н., Бацких С.Н.; утверждение окончательного варианта статьи - Красавина Э.Н., Самсонов М.Ю.; ответственность за целостность всех частей статьи - Красавина Э.Н.
В сложной эпидемиологической ситуации, обусловленной пандемией новой коронавирусной инфекции, вызванной SARS-CoV-2, завершилось исследование эффективности и безопасности комбинации препаратов прямого противовирусного действия (ПППД) с отечественным ингибитором протеазы ВГС для лечения хронического гепатита С (ХГС). При анализе исходов COVID-19 к значимым факторам, связанным со смертностью пациентов в стационаре, исследователями были отнесены не только сердечно-сосудистые заболевания, ожирение, сахарный диабет, но и хронические заболевания печени [1]. Таким образом, в свете последних событий, актуальность достижения высоких показателей излечивания у большего пула пациентов с ХГС приобретает особое значение. Поскольку в Российской Федерации у 75,5% больных ХГС выявлен фиброз слабой и умеренной степени выраженности (F0-F2) [2], важна доступность эффективной и безопасной противовирусной терапии, включающей препараты отечественной разработки. Наряду с удобством применения (таблетированные формы, однократный прием в сутки) значима также длительность терапии ХГС с тенденцией к ее сокращению до 8 нед без компромисса по отношению к достижению показателей излечивания 4.
Отечественный ингибитор NS3-протеазы ВГС нарлапревир, применяемый совместно с ингибитором изофермента CYP3A4 ритонавиром и другими противовирусными препаратами, прошел обширную программу клинических исследований 6. Еще одной ступенью в создании новой оптимальной схемы противовирусной терапии ХГС стало исследование результатов лечения с использованием комбинации нарлапревира, бустированного ритонавиром, в сочетании с софосбувиром.
Цель работы - изучение эффективности и безопасности терапии ХГС, вызванного ВГС генотипа 1, с применением комбинации ПППД, включающей нарлапревир, ритонавир и нуклеотидный NS5В-ингибитор полимеразы ВГС софосбувир.
Материал и методы
В данном многоцентровом открытом клиническом исследовании II фазы изучали эффективность и безопасность терапии ПППД (нарлапревир/ритонавир и софосбувир) у пациентов с хронической инфекцией, вызванной ВГС генотипа 1. Длительность лечения ХГС составил 12 нед в группе А и 8 нед в группе В соответственно.
Проведение исследования было разрешено Минздравом России, одобрено Советом по этике Минздрава России, независимыми этическими комитетами клинических центров, принимавших участие в исследовании.
Исследование проводили согласно действующему российскому законодательству, в соответствии с принципами надлежащей клинической практики (QinicaLTriaLs.gov ID: NCT04246723). Набор пациентов в исследование осуществляли в 5 клинических центрах Москвы и Санкт-Петербурга.
В исследование включены пациенты с хронической инфекцией, вызванной ВГС генотипа 1, ранее не получавшие противовирусную терапию ХГС, без цирроза печени.
В исследовании участвовали пациенты обоего пола в возрасте от 18 до 70 лет с соответствующими протоколу клинико-лабораторными показателями, с клиренсом креатинина по формуле Кокрофта-Голта ≥60 мл/мин и без клинически значимых отклонений электрокардиограммы.
Критерии исключения: сопутствующие инфекции вирусом гепатита В и ВИЧ, признаки декомпенсированного поражения печени.
Данное исследование состояло из нескольких периодов: скрининга, лечения исследуемой комбинацией ПППД, наблюдения.
В течение периода скрининга длительностью 2 нед проведено обследование пациентов согласно протоколу, подтверждено их соответствие критериям включения в исследование.
В период лечения пациенты получали терапию комбинацией ПППД: нарлапревир (НВР) 200 мг 1 раз в сутки, ритонавир (РТВ) 100 мг 1 раз в сутки и софосбувир (СОФ) 400 мг 1 раз в сутки. Длительность лечения у 60 пациентов в группе А составила 12 нед, у 25 пациентов в группе В - 8 нед соответственно.
После окончания терапии длительность периода наблюдения пациентов в обеих группах составила 24 нед. Первичная конечная точка по оценке эффективности лечения изучаемой комбинацией препаратов соответствовала количеству пациентов, достигших устойчивого вирусологического ответа через 12 нед после терапии (УВО12). Также в периоде наблюдения определяли вторичные конечные точки: доля пациентов, достигших устойчивого вирусологического ответа на неделе 4 после окончания терапии (УВО4), а также показатель устойчивого вирусологического ответа через 24 нед после лечения (УВО24).
Статистический анализ демографических и исходных характеристик пациентов, показателей эффективности терапии проведен в анализируемой когорте, включавшей всех пациентов, получивших по крайней мере 1 дозу препаратов исследуемой схемы терапии. Описательная статистика для непрерывных переменных представлена с указанием среднего значения, медианы, стандартного отклонения, минимального и максимального значения, количества имеющихся наблюдений. Категориальные данные анализировали с использованием абсолютных и относительных частот для каждой категории. Анализ эффективности основан на измерениях уровня РНК ВГС (по отношению к пределу обнаружения).
Результаты исследования для всех пациентов группы А, включающие данные по УВО4, УВО12, по безопасности и переносимости исследуемой комбинации были опубликованы ранее [11].
Результаты и обсуждение
Анализ результатов проведен для всех пациентов, завершивших 8 нед терапии (группа В) и прошедших полный период наблюдения, включая первичную и вторичные конечные точки эффективности.
Информированное согласие на участие в исследовании подписали 49 пациентов из группы В, из них 24 пациента выбыли на этапе скрининга, в основном по причине несоответствия критериям отбора в исследование. По протоколу 25 пациентов, соответствующих критериям включения/ исключения, получили лечение исследуемой комбинацией препаратов в течение 8 нед (нарлапревир/ритонавир и софосбувир), завершили период наблюдения.
В группе В оцениваемую терапию получали пациенты обоего пола в возрасте от 20 до 59 лет, медиана возраста составила 43 года. Медиана времени до постановки диагноза ХГС у данных пациентов составила 8,71 года. До начала исследования у всех пациентов выявлен фиброз печени F0-F2 по шкале METAVIR (см. таблицу).
Исходные характеристики пациентов группы В
Примечание . * - все пациенты относились к европеоидной расе; ** - возраст определяли как число полных лет со дня рождения до даты подписания информированного согласия.
Большинство (72,7%) пациентов женского пола были способны к деторождению, все они использовали эффективные методы контрацепции для предупреждения беременности в ходе исследования. У 16 (64,0%) пациентов с низким уровнем исходной вирусной нагрузки отмечены сопутствующие заболевания. С наибольшей частотой (8,0%) выявлены хронический панкреатит и холелитиаз.
Известных факторов риска рецидива у этого пациента [женщина 1993 г.р. с выявленной в 2011 г. при диспансеризации инфекции ВГС генотипа 1 с нормальной активностью аланинаминотрансферазы (АЛТ) в сыворотке крови и фиброзом печени F1 - 4,6 кПа, IQR 0,9 по данным эластографии] не наблюдалось. Исходная вирусная нагрузка была низкой - 773 000 МЕ/мл, что соответствовало критериям включения протокола исследования. Ко 2-й неделе лечения вирусная нагрузка снизилась до 59 МЕ/мл, на 4-й неделе лечения РНК ВГС не обнаружена, на 6-й неделе лечения РНК ВГС
Через 24 нед наблюдения неопределяемый уровень РНК ВГС был выявлен у 23 (95,8%) пациентов (95% ДИ 78,9-99,9), с учетом 1 случая рецидива и 1 случая досрочного прекращения участия пациента в исследовании по причине неблагоприятной эпидемиологической ситуации, обусловленной распространением новой коронавирусной инфекции.
Доля пациентов, достигших неопределяемого уровня РНК ВГС на различных сроках терапии и наблюдения, представлена на рисунке.
Доля пациентов, достигших неопределяемого уровня РНК вируса гепатита С в различные сроки наблюдения
* - у 1 пациента развился рецидив: на 4-й неделе наблюдения вирусная нагрузка - 15 МЕ/мл, на 12-й неделе наблюдения - 697 000 МЕ/мл; ** - 1 пациент отказался от продолжения участия в исследовании; НТ - неделя терапии; УВО - устойчивый вирусологический ответ.
У 2 (8,0%) пациентов были диагностированы энтеровирусная инфекция и инфекция дыхательных путей. Другие НЯ: эндокринные нарушения (гипотиреоз), нарушения со стороны желудочно-кишечного тракта (вздутие живота), травмы и интоксикации (перелом костей стопы с повреждением связки), нарушения со стороны мышечной, скелетной и соединительной ткани (полиартрит), нарушения со стороны нервной системы (сонливость), а также со стороны кожи и подкожной клетчатки (алопеция) были выявлены по 1 случаю (4,0% для каждого НЯ).
Результаты лабораторных исследований были систематизированы в соответствии с классификацией CTCAE (версия 4.03): НЯ были легкой или умеренной степени тяжести и соответствовали I или II степени по шкале токсичности CTCAE.
Заключение
Схема терапии ХГС с применение отечественного ингибитора протеазы ВГС нарлапревира в комбинации с ритонавиром и софосбувиром длительностью 8 нед продемонстрировала высокую эффективность при хорошем профиле безопасности.
Применение эффективных, безопасных и удобных схем терапии, в том числе с хорошо изученными лекарственными составляющими отечественного производства, такими как нарлапревир, увеличит охват терапией всех категорий больных ХГС и позволит снизить как риск развития осложнений, характерных для декомпенсированного заболевания печени, так и риск неблагоприятного исхода, связанного с коморбидным фоном, при таких заболеваниях, как COVID-19.
Литература
1. Docherty A.B., Harrison E.M., Green C.A., et al. Features of 20 133 UK patients in hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study // BMJ. 2020. Vol. 369, m1985. DOI:10.1136/bmj.m1985
3. WHO Global health sector strategy on viral hepatitis 2016-2021. WHO/HIV/2016.06. URL: who.int/hepatitis
4. EASL Recommendations on Treatment of Hepatitis C 2018 // J. Hepatol. 2018. Vol. 69, N 2. P. 461-511. DOI: 10.1016/j.jhep.2018.03.026
5. Рекомендации по диагностике и лечению взрослых больных гепатитом С / под ред. В.Т. Ивашкина, Н.Д. Ющука. Москва : ГЭОТАР-Медиа, 2017.
6. Arasappan A., Bennett F., Bogen S.L. et al. Discovery of narlaprevir (SCH 900518): a potent, second generation HCV NS3 serine protease inhibitor // ACS Med. Chem. Lett. 2010. Vol. 1, N 2. P. 64-69. DOI: 10.1021/ml9000276
7. Климова Е.А., Бурневич Э.З., Чуланов В.П. и др. Эффективность и безопасность безинтерфероновой комбинации нарлапревир/ритонавир и даклатасвир в популяции российских пациентов с хроническим гепатитом С // Терапевтический архив. 2019. Т. 91, № 8. С. 67-74. DOI: 10.26442/00403660.2019.08.000384
Изучение эффективности и безопасности оте чественного ингибитора NS3-протеазы нарлапревира/ритонавира в комбинации с NS5A-ингибитором даклатасвиром у первичных больных хроническим гепатитом С без цирроза печени, инфицированных вирусом гепатита С (HCV) генотипа 1b.
Материалы и методы
В многоцентровое открытое исследование II фазы (NCT03485846) включали мужчин и женщин в возрасте от 18 до 70 лет с хроническим гепатитом С, ранее не получавших противовирусную терапию и инфицированных HCV генотипа 1b. Все пациенты получали нарлапревир 200 мг один раз в сутки, ритонавир 100 мг один раз в сутки и даклатасвир 60 мг один раз в сутки в течение 12 недель. Уровень HCV RNA измеряли с помощью TaqMan HCV Quantitative Test, версия 2.0 (Roche Diag nostics), c нижним порогом количественного определения и обнаружения 15 МЕ/мл. В статье приводятся промежуточные результаты исследования.
Результаты промежуточного анализа исследования продемонстрировали высокую эффективность и безопасность нарлапревира/ритонавира в комбинации с даклатасвиром.
Хронический гепатит С (ХГС) остается важной медицинской проблемой в мире, несмотря на снижение в последнее десятилетие числа инфицированных до 71 млн [1]. В настоящее время оптимальным методом противовирусной терапии (ПВТ) ХГС считают лечение без применения препаратов интерферонового ряда 3. Одним из вариантов комбинированной ПВТ является сочетание ингибиторов NS3-протеазы и ингибиторов NS5A-репликативного комплекса. Примерами могут служить асунапревир + даклатасвир [6], симепревир + даклатасвир 7, равидасвир + данопревир/ритонавир [10], омбитасвир + паритапревир/ритонавир (2D-терапия) [11].
Даклатасвир – прямой ингибитор NS5A-белка HCV – мультифункционального протеина, играющего клю чевую роль как в репликации HCV RNA, так и в сборке вирионов [21]. Даклатасвир в пикомолярных концентрациях обладает активностью в отношении вируса всех генотипов. Препарат является субстратом CYP3A4 P450, поэтому его концентрация может повышаться при применении сильных ингибиторов CYP3A4, например, ритонавира. Однако при сочетании с ритонавиром снижение дозы даклатасвира до 30 мг/сут не требуется; препарат может применяться в стандартной дозе 60 мг/сут [22]. Даклатасвир обладает синергетическим эффектом при совместном применении с ингибитором NS3-протеазы асунапревиром. Результаты клинического исследования HALLMARK-DUAL по изучению эффективности комбинации даклатасвир + асунапревир послужили теоретическим обоснованием проведения исследования по оценке эффективности и безопасности применения нарлапревира/ритонавира в комбинации с даклатасвиром для лечения больных ХГС, инфицированных HCV генотипа 1b [23]. При планировании настоящего исследования были учтены и уроки исследования HALLMARK-DUAL [23]. В первую очередь это касается зависимости эффективности лечения от исходного полиморфизма в аминокислотных позициях 31 и/или 93 белка NS5A HCV. При наличии аминокислот "дикого" типа (L31 и Y93) частота стойкого вирусологического ответа (СВО) была близка к 100%, тогда как в случае аминокислотных замен, связанных с лекарственной устойчивостью, снижалась в 2-3 раза [24]. В связи с этим в клиническое исследование комбинации нарлапревир/ритонавир + даклатасвир не включали пациентов, имеющих такие аминокислотные замены.
Важные данные были получены в исследовании COMMIT по изучению эффективности и безопасности комбинации симепревира с даклатасвиром при лечении больных ХГС, инфицированных HCV генотипа 1b [9]. У больных компенсированным циррозом печени (ЦП) эффективность ПВТ была ниже, чем у пациентов с F3 стадией фиброза по METAVIR, а случаи вирусологической неудачи чаще встречались именно среди больных с ЦП. Соответственно, пациентов с F4 стадией фиброза печени по METAVIR не включали в настоящее исследование.
При разработке дизайна исследования учитывали также результаты исследования LEAGUE-1 по изучению эффективности и безопасности комбинации симепревира с даклатасвиром у больных ХГС, инфицированных HCV генотипа 1 [7]. Во-первых, эффективность 12- и 24-недельной терапии оказалась сходной, в связи с чем срок лечения схемой нарлапревир/ритонавир + даклатасвир составил 12 недель. Во-вторых, у больных с ЦП наблюдалось снижение эффективности комбинации симепревир + даклатасвир (особенно в группе пациентов с "нулевым" ответом на "двойную" терапию), что подтверждало нецелесообразность включения в настоящее исследование таких пациентов. В-третьих, случаи вирусологической неэффективности в основном отмечались у пациентов, инфицированных HCV генотипа 1а, поэтому в исследование нарлапревира/ритонавира + даклатасвира включали только пациентов с HCV генотипа 1b. Наконец, в-четвертых, в очередной раз была показана зависимость эффективности лечения от исходного полиморфизма L31 и/или Y93 в области NS5A-региона HCV.
Целью настоящего исследования было изучение эффективности и безопасности отечественного ингибитора NS3-протеазы нарлапревира, применяемого с ритонавиром, в комбинации с NS5A-ингибитором даклатасвиром у не получавших ранее ПВТ больных ХГС без ЦП, инфицированных HCV генотипа 1b.
Материал и методы
Критерии отбора. В исследования включали мужчин и женщин в возрасте от 18 до 70 лет с подтвержденным диагнозом ХГC, ранее не получавших ПВТ и инфицированных HCV генотипа 1b. Критериями включения в исследования были: концентрация HCV RNA на момент скрининга ≥10000 МЕ/мл; отсутствие признаков ЦП (биопсия печени в течение 2 лет до скрининга, указывающая на отсутствие ЦП, эластометрия с помощью аппарата Fibroscan® с результатом ≤12,5 кПа в течение 6 месяцев до начала лечения или FibroTest® ≤0,48 и APRI ≤1 на скрининге); соответствие лабораторным критериям на скрининге (АЛТ≤10 верхних границ нормы, Hb ≥12 г/дл у мужчин и ≥11 г/дл у женщин, количество тромбоцитов ≥50000 клеток/мм3, МНО ≤1,5 верхних границ нормы за исключением пациентов с гемофилией, сывороточный альбумин ≥3 г/дл, прямой билирубин ≤1,5 верхних границ нормы, HbA1c ≤10%, клиренс креатинина по формуле Кокрофта-Голта ≥60 мл/мин); отсутствие клинически значимых отклонений ЭКГ на скрининге. Все женщины и мужчины, способные иметь детей, использовали приемлемые методы контрацепции для предупреждения беременности в ходе исследования.
Критериями невключения в исследование были: предшествовавший опыт противовирусной терапии ХГС; сопутствующие HBV- или ВИЧ-инфекция; трансплантация в анамнезе; наличие онкологических, тяжелых психических и других заболеваний, которые не позволяли пациенту принять участие в исследовании. Из исследования исключали также пациентов, у которых на этапе скрининга выявлялись аминокислотные замены в NS5A-белке, связанные с лекар ственной устойчивостью: Y93C/H/N/S и/или L31F/M/V/I.
Схема лечения. Все больные, соответствовавшие критериям отбора в исследование, в течение 12 недель получали нарлапревир 200 мг один раз в сутки, ритонавир 100 мг один раз в сутки и даклатасвир 60 мг один раз в сутки. После завершения лечения всех пациентов наблюдали в течение 24 недель (рис. 1).

Рис. 1. Дизайн исследования НВО – непосредственный вирусологический ответ, СВО – стойкий вирусологический ответ
Уровень HCV RNA измеряли с помощью TaqMan HCV Quantitative Test, версия 2.0 (Roche Diagnostics), c нижнимпорогом количественного определения и обнаружения 15 МЕ/мл.
Оценка эффективности. За первичную конечную точку эффективности была принята частота СВО через 12 недель после завершения терапии (СВО12). К вторичным конечным точкам эффективности отнесены частота вирусологического ответа на момент окончания терапии, или непосредственного вирусологического ответа (НВО), СВО через 4 недели (СВО4) и 24 недели после завершения терапии (СВО24), вирусологического прорыва, рецидива. По протоколу при наступлении вирусологического прорыва исследуемую терапию следовало полностью прекратить. Вирусологический прорыв определяли как увеличение уровня HCV RNA на 1 log10 и более по сравнению с самым низким показателем или определяемый уровень HCV RNA во время лечения после первоначального снижения ниже предела обнаружения.
Оценка безопасности. Оценивали частоту нежелательных явлений (НЯ), серьезных НЯ, а также частоту любых НЯ, которые привели к отмене изучаемых препаратов, частоту существенных изменений показателей жизненно важных функций и клинико-лабораторных показателей.
Статистический анализ. Статистический анализ данных проводили в выборке всех включенных в исследование пациентов, получивших по крайней мере одну дозу исследуемой терапии (Full Analysis Set – FAS). Для описательной статистики непрерывные переменные представлены с указанием среднего значения, медианы, перцентилей 25 и 75, стандартного отклонения, минимального и максимального значения, количества имеющихся наблюдений. Кате гориальные данные представлены в виде абсолютных и относительных частот в каждой категории.
Результаты
В статье приводятся промежуточные результаты исследования по состоянию на 31 марта 2018 г. (исходная демографическая характеристика первой половины пациентов, n=51) и 25 мая 2018 г. (102 пациента, завершившие терапию, из которых у 79 доступны показатели CВО4). Выборка оценки безопасности включала всех пациентов, получивших по крайней мере одну дозу исследуемой терапии; в промежуточный анализ безопасности включена первая половина пациентов (n=51; по состоянию на 31 марта 2018 г.).
Характеристика пациентов. В исследовании комбинированной схемы терапии нарлапревир/ритонавир + даклатасвир было скринировано 140 больных. Этап скрининга не прошли 35 пациентов по следующим причинам: наличие аминокислотных замен в NS5A-белке, связанных с лекарственной устойчивостью: Y93C/H/ N/S и/или L31F/M/V/I, генотип HCV не 1b (n=7), изменения лабораторных показателей (n=10), HCV RNA
Как указано выше, в статье приводятся исходные клинико-демографические показатели у 51 пациента, включенного в исследование до 31 марта 2018 г. Доли мужчин и женщин среди них были практически одинаковыми – 47,1% и 52,9%, соответственно (табл. 1). Возраст пациентов варьировался от 26 до 69 лет (в среднем 42,5±10,6 года). Все пациенты принадлежали к европеоидной расе. Длительность анамнеза ХГС составляла от 6 мес до 21,5 лет, медиана – 6,4 лет. Более половины больных (66,7%) на момент включения в исследование имели сопутствующие заболевания. Чаще всего (у 19,6%) диагностировали заболевания гепатобилиарной системы. Сопутствующую терапию получали 14 (27,5%) пациентов, в основном L-тироксин и антагонисты рецепторов ангиотензина II (валсартан, лозартан и олмесартан с гидрохлоротиазидом).
| Показатели | Значения |
|---|---|
| Примечание: *на момент подписания информированного согласия, **только для женщин | |
| Возраст, лет* | 42,5±10,6 |
| Диапазон | 26-69 |
| Медиана | 41,0 |
| Q1-Q3 | 36,0-48,0 |
| Европеоидная раса, n (%) | 51 (100,0) |
| Мужчины/женщины, n (%) | 24 (47,1)/27 (52,9) |
| Способность иметь детей, n (%)** | 19 (70,4) |
| Используют эффективные методы контрацепции, n (%) | 19 (100,0) |
| Время с момента постановки диагноза, лет | 7,50±5,57 |
| Диапазон | 0,5-21,5 |
| Медиана | 6,43 |
| Q1-Q3 | 4,12-10,45 |
| Рост (см) | 171,8±10,1 |
| Диапазон | 149-196 |
| Медиана | 172,0 |
| Q1-Q3 | 164,0-178,0 |
| Масса тела, кг | 77,44±16,71 |
| Диапазон | 48,9-121,9 |
| Медиана | 74,10 |
| Q1-Q3 | 64,00-90,80 |
Динамика вирусной нагрузки. Во время приема комбинации нарлапревир/ритонавир + даклатасвир отме чалась быстрая динамика вирусной нагрузки (табл. 2.): через 2 недели терапии HCV RNA не определялась более чем у половины пациентов (52,9%), через 4 недели – у 94,1%, а через 6 и 8 недель – у 100%.
Частота вирусологического ответа. НВО был достигнут у 100 (98%) из 102 пациентов, завершивших лечение. В двух случаях наблюдался вирусологический прорыв (рис. 2). Среди пациентов, которых наблюдали в течение 4 недель после завершения лечения, частота СВО4 составила 92% (73/79). У 4 пациентов развился рецидив вирусной инфекции (рис. 2).
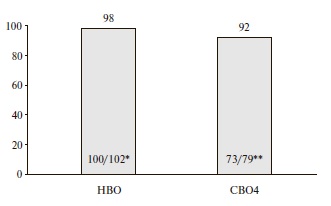
Рис. 2. Частота непосредственного (НВО) и стойкого вирусологического ответа (СВО) через 4 недели наблюдения (выборкаFAS). *2 случая "вирусологического прорыва", **4 случая рецидива
Среди НЯ, связанных, по мнению исследователя, с приемом нарлапревира/ритонавира, наличие определенной причинно-следственной связи было отмечено в 3 (5,9%) случаях: дисгевзия у двух пациентов и бессонница у одного. По мнению исследователей, у 16 (31,4%) пациентов НЯ могли быть связаны с приемом даклатасвира. Чаще всего они относились к категории "изменения со стороны крови и лимфатической системы": по крайней мере одно НЯ из этой группы наблюдалось у 7 (13,7%) пациентов.
В Российской Федерации расчетное число число инфи цированных HCV достигает 4-5 млн человек, причем основной пик заболеваемости приходится на людей трудоспособного возраста (20-49 лет) [26]. В настоящее время у трети инфицированных (1-2 млн человек) имеются показания для безотлагательного начала ПВТ, однако ежегодно лечение получают не более 10000 пациентов. При этом 70-80% применяемых схем ПВТ основаны на препаратах пегилированного интерферона-α [27]. В аспекте стратегии ВОЗ по эрадикации HCV-инфекции к 2030 г. доступность в Российской Федерации для пациентов с ХГС высокоэффективных и безопасных безинтерфероновых схем лечения, в том числе на основе отечественных препаратов, становится крайне актуальной [28].
Комбинация нарлапревир/ритонавир + даклатасвир является сочетанием ингибиторов NS3- и NS5A-регионов HCV первого поколения. Подобное сочетание препаратов прямого противовирусного действия в настоящее время представлено комбинациями даклатасвир + асунапревир и даклатасвир + симепревир. Эффективность 24-недельной комбинированной терапии даклата свиром и асунапревиром у первичных больных, инфицированных HCV генотипа 1b, составила 91% [23], а эффективность 12- и 24-недельной терапии даклатасвиром и симепревиром – 81% и 89%, соответственно [7]. В обоих исследованиях показана зависимость частоты СВО от наличия аминокислотных замен в 31 и/или 93 положениях NS5A-белка, связанных с лекарственной устойчивостью. В исследовании COMMIT среди первичных пациентов с F3-F4 стадиями фиброза печени, у которых отсутствовали указанные аминокислотные замены, частота СВО при применении комбинации даклатасвир + симепревир в течение 12-24 недель составила 86% [9].
Промежуточные результаты настоящего исследования показали, что 12-недельная терапия нарлапревиром/ритонавиром + даклатасвиром обеспечивает высокую частоту НВО (98%) с очень низкой частотой вирусологических прорывов (у 2 из 102 больных). Этот факт отличает изученную схему от комбинации даклатасвир + симепревир. Низкая частота вирусологических прорывов, скорее всего, объясняется "бустирующим" эффектом ритонавира. На данном этапе частоту СВО4 оценивали примерно у 3/4 пациентов, получавших нарлапревир/ритонавир + даклатасвир. В этой выборке она составила 92% и не уступала таковой в исследованиях HALLMARK-DUAL, COMMIT и LEAGUE-1 [7,9,23]. Тем не менее, в настоящее время нет данных о частоте СВО12, поэтому сравнивать эффективность схемы нарлапревир/ритонавир + даклатасвир с "историческим" контролем преждевременно.
Заключение
Результаты промежуточного анализа многоцентрового открытого исследования II фазы у ранее не получавших ПВТ больных ХГС без ЦП, инфицированных HCV генотипа 1b, продемонстрировали высокую эффективность и безопасность отечественного препарата нарлапревир, применяемого совместно с ритонавиром, в комбинации с даклатасвиром.
Читайте также:

