Рнк вирусы чем лечить
Обновлено: 18.04.2024
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около 50 млн инфекционных заболеваний, из которых до 90% случаев приходится на ОРВИ и грипп.
Почти 90% населения как минимум один раз в году переносят одну из респираторных инфекций вирусной этиологии, что в целом предопределяет высокую заболеваемость и даже влияет на показатель смертности [2].
Столь высокая частота заболеваний респираторного тракта объясняется многообразием этиологических факторов (вирусы гриппа, парагриппа, аденовирусы, риновирусы, реовирусы, респираторно-синцитиальные (РС) вирусы, микоплазмы, хламидии, бактериальные агенты), а также легкостью передачи возбудителя и высокой изменчивостью вирусов.
Дифференциальная диагностика гриппа и ОРВИ затруднена из-за сходства клинической картины этих заболеваний, но вполне возможна. Основными отличиями можно считать начальные признаки заболевания, симптомы интоксикации, характер катаральных явлений и лихорадки, тип развивающихся осложнений и др. Клинический диагноз, подтвержденный данными лабораторных анализов, и определяет выбор терапии.
Клиническая картина ОРВИ и гриппа зависит от вируса-возбудителя (см. таблицу).
Следует отметить, что осложнения при ОРВИ, особенно в период эпидемии, регистрируются в 20–30% случаев. Основными причинами осложнений являются нарушения иммунной защиты, приводящие к длительной недостаточности в работе иммунной системы. Снижение антибактериальной резистентности организма приводит к затяжным периодам реконвалесценции и обусловливает возможность осложнений в течение длительного времени. Особое место среди осложнений занимает так называемый синдром послевирусной астении (СПА), который может развиваться у 65% больных в течение 1 мес от начала заболевания. Ведущими симптомами СПА являются усталость, эмоциональные нарушения и различные психические расстройства.
Круг препаратов, используемых при лечении ОРВИ и гриппа, широк и разнообразен. Он включает живые и инактивированные вакцины, химиопрепараты этиотропного действия, а также средства, применяющиеся для иммунокорригирующей и патогенетической терапии.
Тем не менее течение гриппа и других ОРВИ по-прежнему плохо поддается контролю. Это связано не только с полиэтиологичностью данных заболеваний, но и с уникальной изменчивостью вирусов и глобальным характером эпидемий. Распространение ОРВИ в значительной степени зависит от экологической, социально-экономической ситуации, наличия у пациентов аллергических заболеваний и ряда других факторов.
Противовирусные препараты
Химиопрепараты
Механизм действия этой группы препаратов основан на избирательном подавлении отдельных звеньев репродукции вирусов, без нарушения жизнедеятельности клетки макроорганизма. При респираторных инфекциях используются две группы препаратов — блокаторы М2-каналов и ингибиторы нейроаминидазы, а также рибавирин, активный против РС-вируса.
Блокаторы М2-каналов
В 1961 г. был синтезирован симметричный амин — амантадин, а затем и ряд его производных (римантадин, мидантан, дейтифорин). В нашей стране получил широкое применение римантадин, который используется для лечения и профилактики гриппа, вызванного вирусом типа А. Эффективность этого средства составляет 70–90%.
Противовирусный эффект реализуется путем блокирования особых ионных каналов (М2) вируса, что сопровождается нарушением его способности проникать в клетки и высвобождать рибонуклеопротеид. Тем самым ингибируется важнейшая стадия репликации вирусов. Примерно в 30% случаев может развиваться резистентность к римантадину [6].
Римантадин выпускается в форме ремантадина в таблетках по 50 мг и сиропа для детей от 1 до 7 лет альгирем—2 мг/мл. С лечебной целью препарат назначается с момента регистрации первых симптомов. Длительность терапии не должна превышать 5 дней во избежание появления резистентных форм вируса. Профилактически римантадин необходимо принимать не менее 2 нед.
Ингибиторы нейроаминидазы
Препараты этой группы эффективны не только против вирусов гриппа типа А, но и против вирусов типа В.
Нейроаминидаза (сиалидаза) — один из ключевых ферментов, участвующих в репликации вирусов гриппа. При ингибировании нейроаминидазы нарушается способность вирусов проникать в здоровые клетки, снижается их устойчивость к защитному действию секрета дыхательных путей и таким образом тормозится дальнейшее распространение вируса в организме. Ингибиторы нейроаминидазы способны уменьшать продукцию цитокинов (ИЛ-1 и фактора некроза опухоли), препятствуя развитию местной воспалительной реакции и ослабляя такие системные проявления вирусной инфекции, как лихорадка, боли в мышцах и суставах, потеря аппетита [7].
Предварительные исследования показали, что эффективность такого ингибитора в качестве профилактического средства составляет 70–80%. Прием этих препаратов позволяет сократить длительность болезни на 1–1,5 дней (если препарат начать принимать не позднее, чем через 36–48 ч с момента появления первых симптомов). В начале заболевания и на ранних его стадиях средняя продолжительность репликации вируса сокращается в среднем на 3 дня, а число тяжелых форм ОРВИ и гриппа, характеризующихся повышенной температурой, — на 85%. Препараты не оказывают вредного воздействия на центральную нервную систему. Однако следует отметить, что далеко не всегда представляется возможность их применения в первые 48 ч: из-за сложностей, связанных с дифференциальной диагностикой гриппа и других ОРВИ.
Представителями ингибиторов нейроаминидазы являются озельтамивир и занамивир.
Озельтамивир (тамифлю) назначается по 75–150 мг 2 раза в день в течение 5 дней. Для профилактики — по 75 мг 1 или 2 раза в день в течение 4–6 нед. У пациентов с клиренсом креатинина менее 30 мл/мин доза снижается в 2 раза.
Занамивир (реленца) является структурным аналогом сиаловой кислоты — естественного субстрата нейроаминидазы вирусов гриппа — и, следовательно, обладает способностью конкурировать с ней за связывание с активным центром. Ингалируется с помощью специального устройства — дискхалера. С лечебной целью назначается по 10 мг 2 раза в день (с интервалом 12 ч) в течение 5 дней, для профилактики — по 10 мг 1 раз в день в течение 4–6 нед. Ингаляционный способ введения имеет преимущество, так как обеспечивает достаточно быстрый противовирусный эффект в зоне первичного очага инфекции.
Побочные реакции данной группы препаратов составляют не более 1,5% случаев. Чаще всего это головная боль, головокружение, тошнота, диарея, явления синусита. У пациентов с обструктивными бронхолегочными заболеваниями возможно развитие бронхоспазма.
Препараты, активные против других вирусов
Рибавирин (виразол, ребетол), действующий на многие РНК- и ДНК-содержащие вирусы, в аэрозольной лекарственной форме используется при лечении инфекций, вызванных РС-вирусом. Предполагается, что препарат ингибирует ранние этапы вирусной транскрипции, нарушая синтез рибонуклеопротеидов, информационной РНК, блокируя РНК-полимеразу. Применяется ингаляторно с помощью небулайзера только в условиях стационара.
При приеме рибавирина могут отмечаться бронхоспазм, сыпь, раздражение глаз, причем не только у пациентов, но и у медперсонала. В редких случаях наблюдаются лейкопения, бессонница, раздражительность. Существует риск кристаллизации препарата в дыхательных путях и интубационных трубках. Обладает тератогенным действием.
Перспективным противовирусным препаратом является недавно разработанный в США пленоконарил. В исследованиях in vitro и в экспериментах на животных выявлена его активность против энтеровирусов и риновирусов. Данные первых плацебо-контролируемых исследований свидетельствуют об эффективности препарата при респираторных инфекциях и энтеровирусном менингите [8].
В России применяются оригинальные противовирусные препараты, созданные на основе отечественных разработок. Наиболее широко известный из них — арбидол. Он оказывает ингибирующее действие на вирусы гриппа типа А и В и другие респираторные вирусы, механизм которых до конца не выяснен. Предполагают, что подобное воздействие связано и с интерферониндуцирующими и с иммуномодулирующими свойствами препарата. В частности, арбидол стимулирует активность фагоцитарных клеток. Выпускается в таблетках по 0,1 г. В лечебных целях назначается по 0,2 г 3–4 раза в день в течение 3–5 дней. С профилактической целью применяется по 0,2 г/сут в течение 10–14 дней.
Интерфероны
Интерфероны (ИФН) относятся к числу регуляторов иммуногенеза. Они продуцируются различными клетками и не только реализуют противовирусный ответ, но и регулируют иммунологические реакции. Основные эффекты интерферонов можно подразделить на антивирусные, антимикробные, антипролиферативные, иммуномодулирующие и радиопротективные.
Несмотря на разнообразие генетического материала вирусов, ИФН подавляют их репродукцию на стадии, обязательной для всех вирусов: они блокируют начало трансляции, т. е. синтез вирусспецифических белков. Этим можно объяснить универсальность антивирусного действия интерферона. Под воздействием интерферона в организме усиливается активность естественных киллеров, Т-хелперов, цитотоксических Т-лимфоцитов, фагоцитарная активность, интенсивность дифференцировки В-лимфоцитов, экспрессия антигенов МНС I и II типа [1].
Для лечения вирусных инфекций применяются α- и β-интерфероны. Хороший эффект при лечении дает комбинированное применение химиопрепаратов и препаратов ИФН.
β-интерферон (бетаферон) выпускается в форме порошка, во флаконах, содержащих по 9,5 млн ЕД ИФН. При гриппе его закапывают или распыляют в носовые ходы не менее 4–5 раз в сутки [2].
Человеческий лейкоцитарный интерферон представляет собой смесь интерферонов, синтезируемых лейкоцитами донорской крови в ответ на воздействие вирусного индуктора. Препарат вводят ингаляторно или закапывают в носовые ходы водный раствор, приготавливаемый из сухого вещества в ампуле или флаконе.
Виферон — рекомбинантный интерферон-α 2b — выпускается в форме ректальных свечей и применяется при лечении ОРВИ и гриппа. Повреждение клеточных мембран, наблюдаемое в ходе развития инфекционного процесса, является причиной снижения противовирусной активности интерферона. Токоферола ацетат и аскорбиновая кислота, входящие в состав виферона, являются мембраностабилизирующими компонентами, антиоксидантами, в сочетании с которыми противовирусная активность рекомбинантного интерферона-α 2b возрастает в 10–14 раз [1].
Особенности введения лекарственной формы обеспечивают длительную циркуляцию в крови интерферона-α 2b.
Препарат применяется как у новорожденных детей, так и у взрослых больных при ОРВИ и гриппе в возрастных дозировках. Детям до 7 лет назначается виферон-1, детям старше 7 лет и взрослым — виферон-2.
Индукторы интерферона
Амиксин — низкомолекулярный синтетический индуктор эндогенного интерферона ароматического ряда, относящийся к классу флуоренонов. Основными структурами, продуцирующими интерферон в ответ на введение амиксина, являются клетки эпителия кишечника, гепатоциты, Т-лимфоциты, гранулоциты. В лейкоцитах человека амиксин индуцирует образование интерферона, уровень в крови которого составляет 250 ЕД/мл. После приема амиксина внутрь максимум интерферона у человека определяется последовательно в кишечнике, печени, крови через 4–24 ч [2].
При лечении гриппа и ОРВИ амиксин назначается в первые часы заболевания, на курс достаточно 5–6 таблеток. С целью профилактики назначается 1 раз в неделю в течение 4–6 нед.
Циклоферон является низкомолекулярным индуктором ИФН-α , что определяет широкий спектр его биологической активности. Он быстро проникает в клетки, накапливаясь в ядре и цитоплазме. Циклоферон интеркалирует ДНК клетки, с чем связан механизм его интерферониндуцирующей активности [3].
Циклоферон быстро проникает в кровь. Отмечается низкое связывание его с белками крови и в то же время широкое распространение в различных органах, тканях, биологических жидкостях организма.
Ввиду того что циклоферон является низкомолекулярным препаратом, он легко преодолевает гематоэнцефалический барьер, вызывая образование ИФН в мозге. Циклоферон быстро выводится из организма: 99% введенного препарата элиминируется почками в неизмененном виде в течение 24 ч.
Циклоферон хорошо переносится больными и назначается с первого дня от начала заболевания в виде таблетированной формы или парентерально [4].
Ридостин — высокомолекулярный индуктор ИФН природного происхождения. Ридостин представляет собой двуспиральную РНК, полученную из лизата киллерных дрожжей Saccharamyces cervisiae.
Системное введение ридостина стимулирует продукцию раннего ИФН. Максимальное накопление ИФН в сыворотке отмечается через 6–8 ч после инъекции; через 24 ч в кровотоке не определяется [1].
Препарат проявляет выраженный иммуномодулирующий эффект. Он стимулирует Т-клеточное и гуморальное звенья иммунитета, пролиферацию стволовых клеток костного мозга и фагоцитарную активность макрофагов и нейтрофилов периферической крови. Ридостин повышает уровень кортикостероидных гормонов; применяется для лечения и профилактики гриппа и других ОРВИ.
В настоящее время незаслуженно забывают препарат дибазол, применяемый для лечения и профилактики гриппа и ОРВИ. Дибазол обладает иммуномодулирующей активностью и индуцирует выработку эндогенного интерферона. Для профилактики назначается по 1 таблетке (0,02–0,05 г) 1 раз в день — 3–4 нед, для лечения — по 1 таблетке 3 раза в день — 5 дней.
Незаменимы в лечении гриппа и ОРВИ такие комплексные препараты, как гриппостад, ринза, терафлю, фервекс, а также препараты для наружного и местного применения — мазь от простуды доктор Мом, туссамаг бальзам от простуды.
Несмотря на многообразие препаратов, представленных для лечения ОРВИ и гриппа на современном этапе, выбор лекарственного препарата остается актуальной задачей для практикующего врача. Выбор тактики назначения и ведения больного с ОРВИ или гриппом напрямую связан с тяжестью течения инфекционного процесса, формой заболевания и наличием осложнений. Успех лечения зависит от правильной оценки состояния больного и раннего начала лечения.
И это неудивительно хотя бы потому, что вирусы — штука довольно непонятная. Неясно даже, считать их живыми или нет. С одной стороны, это просто хрупкий набор молекул, который не может существовать автономно, без живой клетки. Он не производит и не накапливает энергии, а также не поддерживает постоянства внутренней среды — ее попросту нет. Но когда вирус попадает в клетку, он проходит жизненный цикл, копирует себя и эволюционирует. Невидимое глазу нечто существует в огромном количестве, постоянно меняется, переходит от одних хозяев к другим и причиняет страдания разной степени тяжести всему человечеству.
Как устроены вирусы?
РНК-содержащие вирусы можно разделить на собственно РНК-вирусы и ретровирусы. Первые — это вирусы гриппа, бешенства, гепатита С, а также коронавирусы и вирус Эбола. Они содержат РНК и используют для размножения РНК-зависимую РНК-полимеразу, с ее помощью на исходной молекуле РНК сразу синтезируется новая. А к ретровирусам относится, например, ВИЧ. Он содержит РНК, но в ходе жизненного цикла она превращается в ДНК и встраивается в геном клетки-хозяина. После чего новая РНК синтезируется уже на основе молекулы ДНК — то есть так же, как у нас.
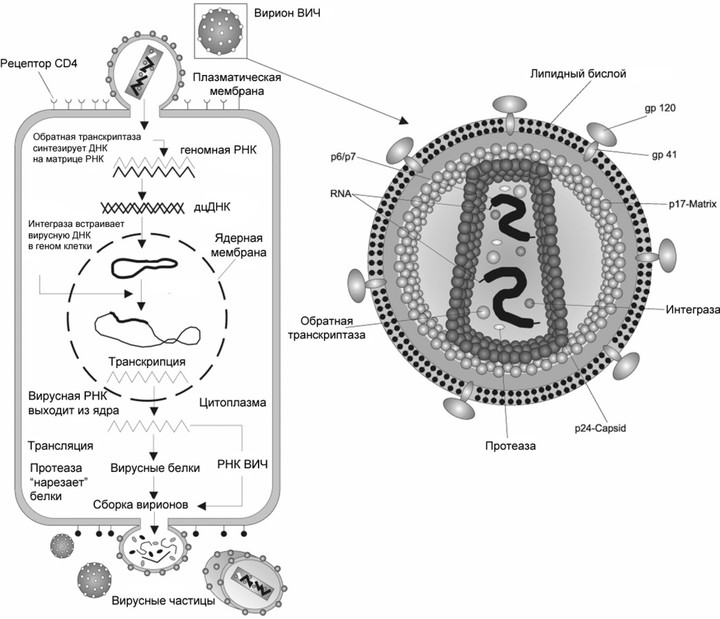
Жизненный цикл вируса, на примере вируса иммунодефицита
Как с ними бороться?
Еще одна стратегия — активная и пассивная иммунопрофилактика. Активная — это простая и всем знакомая вакцинация. Человеку вводят неактивную форму вируса или его кусочек, в организме срабатывает иммунный ответ и синтезируются антитела, которые защитят человека в будущем, если он когда-нибудь встретится с настоящим живым вирусом. Но вакцину не всегда можно создать, да и уже существующие порой не работают на все сто. Так, вакцина от гриппа защищает только от нескольких — самых распространенных в текущем сезоне — штаммов (видов) вируса. Пассивная иммунопрофилактика — это введение готовых антител тем, кто уже встретился с вирусом или с большой вероятностью сделает это. Такие лекарства существуют для респираторно-синцитиального вируса (рекомендованы недоношенным младенцам) и ветряной оспы (для людей с подавленным иммунитетом).
И, наконец, последняя стратегия на случай, если ничто не помогло и человек заболел, — антивирусные препараты. Их развитие подстегивали научный прогресс и насущные проблемы. Чтобы придумать противовирусный препарат, нужно сначала изучить вирус и его жизненный цикл и выбрать возможные мишени для атаки. Причем такие, чтобы они как можно сильнее отличались от человеческих аналогов. Иначе лекарство будет бороться и с вирусами, и с невинными человеческими клетками, вызывая сильные побочные эффекты.
В 80-е произошло другое громкое открытие — вирус иммунодефицита человека. Это породило шквал научных работ, посвященных разработке новых противовирусных лекарств. К тому времени связанный с ним СПИД уже распространился по миру, а в США началась эпидемия.
Какие бывают антивирусные препараты?
Их можно разделить на 13 групп, причем к шести относятся различные лекарства против ВИЧ. Это ингибиторы входа вируса в клетку, вирусных ферментов интегразы и протеазы, а также три вида ингибиторов вирусного фермента обратной транскриптазы, или ревертазы. Все они действуют на разные этапы жизненного цикла вируса:
1. Проникновение в клетку
Это первое, что должен сделать вирус, попав в организм. То, какую клетку он поразит, определяется рецептором на ее поверхности. У ВИЧ это рецептор CD4, который есть у Т-хелперов, макрофагов, а также некоторых других видов клеток. Кроме него в связывании вируса и его проникновении участвуют: рецепторы CXCR4 и CCR5 со стороны клетки и поверхностные гликопротеины gp120 и gp41 — со стороны вируса.
Сейчас FDA (американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) одобряет четыре лекарства, работающие на этой стадии. Каждый связывается с каким-то из участников процесса и мешает его работе. Например, к этой группе принадлежит самый новый препарат против ВИЧ — фостемсавир, его одобрили в США в июле 2020 года. В организме он превращается в активную форму темсавир, соединяется с вирусным гликопротеином gp120 и мешает ему связаться с клеточным рецептором CD4. Другой препарат — ибализумаб — связывается с самим CD4, причем так, что рецептор не может участвовать в проникновении вируса, но выполняет свою нормальную иммунную функцию — связывает и узнает антигены на поверхности антигенпрезентирующих клеток.
Подобные препараты также используются для лечения респираторно-синцитиального вируса, вирусов ветряной оспы и простого герпеса. Они тоже действуют на вирусные гликопротеины и их связывание с клеточными рецепторами. К этой же группе можно отнести препараты для пассивной иммунопрофилактики антителами.
2. Подготовка к размножению, часть 1
Когда вирус попал в клетку, он должен в ней размножиться, то есть создать копии себя, используя ресурсы самой клетки. Так как ВИЧ — ретровирус, его генетический материал — РНК, которая должна достроиться до двухцепочечной ДНК и встроиться в ДНК клетки. Процесс достраивания называется обратной транскрипцией, и для него необходим вирусный фермент обратная транскриптаза, ее еще называют ревертазой. Это самая популярная мишень препаратов против ВИЧ, которые делятся на две группы: нуклеозидные и ненуклеозидные.
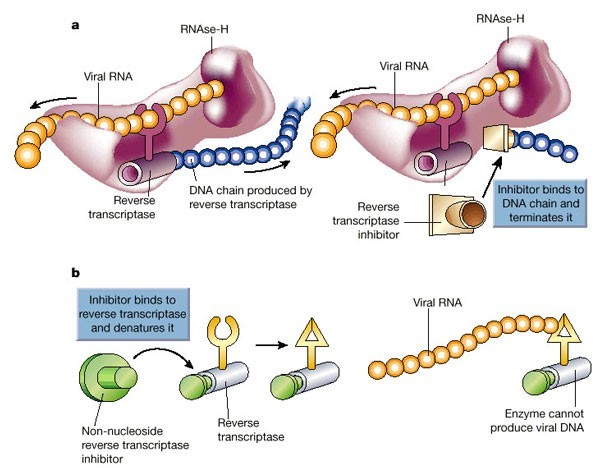
Механизм дейсвтия ингибиторов обратной транскриптазы
3. Подготовка к размножению, часть 2
Чтобы наконец размножиться, ВИЧ, уже в виде молекулы ДНК, необходимо встроиться в геном клетки-хозяина. В этом участвует другой вирусный фермент — интеграза. Ее ингибируют несколько одобренных лекарств, причем они часто используются вместе с другим препаратом — кобицистатом. Он никак не действует на вирус, но ингибирует некоторые ферменты печени и увеличивает биодоступность самих антивирусных препаратов.
4. Созревание
Другие препараты
Есть три группы антивирусных препаратов, которые мы еще не упоминали. Во-первых, это ингибиторы белков NS5A и NS5B вируса гепатита С, которые играют важную роль в репликации РНК вируса. Во-вторых, лекарства против вируса гриппа: три ингибитора вирусного белка нейраминидазы и один ингибитор РНК-полимеразы вируса. И, наконец, сборная солянка препаратов, которые не действуют прицельно на вирусные компоненты. Это интерфероны, а также иммуностимуляторы и ингибиторы митоза клеток.
Первые заслуживают особого внимания из-за обилия отечественных лекарств против гриппа и простуды на их основе. FDA одобряет инъекции (!) интерферонов только для лечения гепатита B и С, причем на практике они используются очень осторожно из-за серьезных побочных эффектов. Отечественные противовирусные препараты с интерферонами, которые выпускаются в форме мазей, спреев и суппозиториев, вряд ли работают. И слава богу. Иммуностимуляторы и ингибиторы митоза клеток выпускаются в виде мазей и используются для лечения генитальных бородавок, то есть папилломавируса человека.
Наука не стоит на месте, и разработка противовирусных препаратов продолжается, подстегиваемая новыми вирусами, эпидемиями, а также развитием резистентности к существующим лекарствам. Но по-прежнему самыми изученными и многочисленными препаратами остаются ингибиторы вирусных обратной транскриптазы или ДНК-полимеразы и протеазы. Для разработки других стратегий борьбы ученым еще предстоит изучить детали работы вирусов — как давно известных, так и совершенно новых.
Да, вирусы остаются источником зловещих идей в популярной культуре. Но существующих препаратов и методов уже достаточно, чтобы мы могли избежать заражения, быстро вылечиться или свести негативные последствия болезни к нулю.
Одни вирусы способны интегрироваться в геном клетки-мишени и таким образом оставаться во всех дочерних клетках, которые будут в будущем получены после ее деления. К таким вирусам относятся гаммаретровирусы и лентивирусы. Другие делать этого не умеют (например, адено- и аденоассоциированные вирусы). Но для производства белков и репликации (размножения) все они используют клетку и ее синтетический аппарат.
Как это работает?
Для того чтобы вирус мог проникнуть в клетку, белки его оболочки должны связаться с мембранными белками клетки-мишени. Важно отметить, что проникает вирус только в те клетки, которые могут в дальнейшем помочь его репликации. Вирус ВИЧ живет в клетках иммунной системы, вирус гепатита С — в клетках печени. Есть особые вирусы, которые поражают только растения или даже только бактерии.
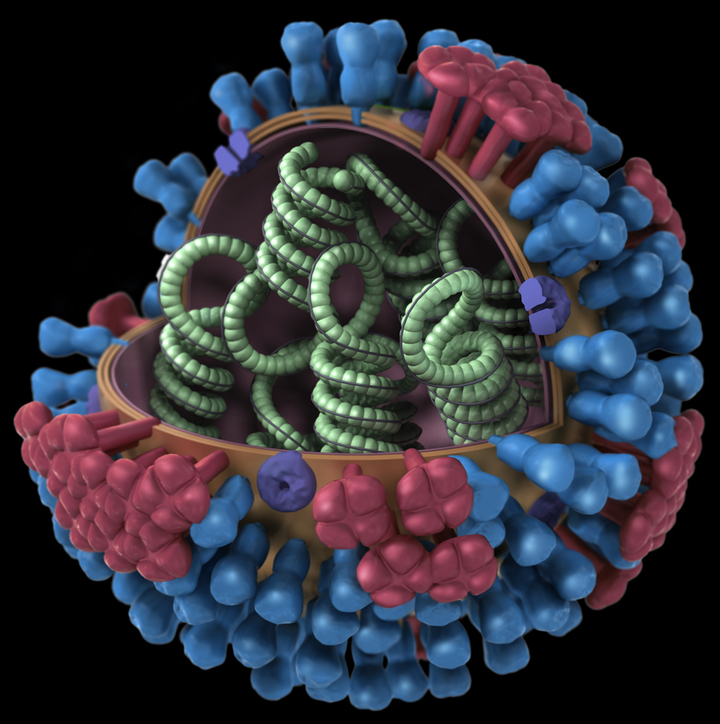
Строение вируса гриппа. Под оболочкой вириома - генетический материал вируса, необходимый для его воспроизводства в клетке.
Содержащие неактивный вирус и оставшиеся в живых клетки иногда сохраняют возможность нормального функционирования. В этом случае клетки могут быть заражены, но вирус проявит себя спустя длительный период времени. Так устроен герпес.
В зависимости от того, каким типом нуклеиновой кислоты представлен генетический материал, выделяют ДНК-содержащие вирусы и РНК-содержащие вирусы. И тут стоит остановиться на классификации.
Типы вирусов. Коротко о главном
Современная типология вирусов содержит 7 классов и была предложена Дэвидом Балтимором еще в 1971 году. С тех пор, впрочем, она была уточнена и расширена, в том числе советскими учеными. И выглядит в настоящее время таким образом:
Вирусы, содержащие двухцепочечную ДНК
Описание
Для репликации вирусу необходимо попасть в ядро клетки-мишени и воспользоваться ее ДНК-полимеразой. Иногда вирус вызывает незапланированное деление самое клетки, то есть становится онкогенным. Эти вирусы хорошо изучены.
Пример: Вирус герпеса, адено- и папилломавирусы
Вирусы, содержащие одноцепочечную ДНК
Описание
Попадая в ядро клетки, вирусы образуют двухцепочечную ДНК, после чего реплицируются так же, как вирусы класса I.
Пример: Парво- и цирковирусы
Вирусы, в которых РНК способна к репликации (редупликации)
Описание
Вирусы этого класса могут размножаться в цитоплазме клетки, им не нужна молекула ДНК. Каждый ген, находящийся в РНК вируса, кодирует только один вирусный белок.
Пример: Бирна- и реовирусы
Вирусы, содержащие одноцепочечную (+) РНК
Описание
Из геномной (+) РНК на рибосомах хозяина создаются вирусные белки. В одном фрагменте РНК могут быть закодированы разные белки, что увеличивает сложность вируса без удлинения генов.
Пример: Пикорнавирусы (полиомиелит, гепатит А) и коронавирусы
Вирусы, содержащие одноцепочечную (–) РНК
Описание
(–) РНК этих вирусов предварительно должна быть транскрибирована в (+) РНК вирусными РНК-полимеразами, после чего может начаться синтез вирусных белков. Вирусы этого класса делятся еще на две группы, в зависимости от их генома и места его репликации (цитоплазма или ядро).
Пример: Филовирусы, аренавирусы (геморрагическая лихорадка Ласса), ортомиксовирусы (вирусы гриппа) и так далее.
Вирусы, содержащие одноцепочечную (+) РНК, реплицирующиеся через стадию ДНК
Описание
Такие вирусы используют фермент обратную транскриптазу для превращения (+) РНК в ДНК, которая встраивается в геном хозяина ферментом интегразой. Дальнейшая репликация происходит при помощи полимераз клетки хозяина.
Пример: Ретровирусы (в том числе ВИЧ)
Вирусы, содержащие двухцепочечную ДНК, реплицирующиеся через стадию одноцепочечной РНК
Описание
Молекула ДНК замкнута в кольцо и является матрицей для синтеза мРНК и дополнительных молекул РНК, которые используются при репликации вирусного генома обратными транскриптазами.
Пример: Колимовирусы (вызывают инфекции растений) и гепаднавирусы (например, гепатит В)
Вакцинация и лечение
Как правило, организмы умеют бороться с паразитирующими на них вирусами. На примере млекопитающих и человека мы обычно говорим о главном инструменте — врожденном иммунитете.
Впрочем, наиболее эффективен этот вид защиты в отношении бактериальных инфекций и не может обеспечить продолжительную и надежную защиту, особенно от инфекций вирусных.
Именно поэтому огромное значение имеет приобретенный иммунитет, в результате которого клетки иммунной системы обучаются вырабатывать специфические к вирусу антитела, способные уничтожать как саму вирусную частицу, так и зараженные ею клетки.
Еще одна врожденная система борьбы с вирусными инфекциями — внутриклеточная. Как правило, клетка способна распознать чужеродную РНК в своей цитоплазме, куда ее сперва и доставляют многие вирусы, и имеет специальные комплексы для ее деградации. Но часть вирусов научились обходить и эту ловушку. К примеру, ротавирусы, которые даже внутри клетки сохраняют капсид с геномной РНК.
Миссия: уничтожить
Основная сложность в лечении вирусных заболеваний заключается в том, что они используют естественные функции клеток-мишеней для своего размножения, поэтому ученым зачастую оказывается не так-то просто придумать препарат, который будет токсичен для вируса и безопасен для самой клетки. Если такой безопасности достичь не удастся, лекарство будет иметь слишком много побочных эффектов, повреждающих сам организм, что окажется нецелесообразно для использования.

Сравнение жизненных циклов ВИЧ и вируса гриппа. Если первый использует обратную транскрипцию и живет в клетках иммунной стистемы, вирион второго, проникая в эпительные клетки дыхательных путей целиком - а именно там он и обитает - распадается уже внутри клетки, а репликация вирусной РНК происходит в ядре с помощью вирусных полимераз PA, PB1 и PB2 путем комплементарного копирования.
По принципу действия противовирусные препараты подразделяются на две группы: стимулирующие иммунную систему атаковать вирусы (например, за счет индукции синтеза белков-интерферонов) и атакующие вирусы напрямую. Препараты второй группы различаются по этапу жизненного цикла вируса, на котором они активны: это препараты, препятствующие проникновению вируса в клетку, препятствующие размножению вируса внутри клетки и препятствующие выходу копий вируса из клетки.
Еще один класс противовирусных препаратов блокирует ферменты, необходимые для создания и модификаций белков вируса. Такие лекарства называют протеазными ингибиторами.
Вместо заключения: а могут ли вирусы приносить пользу?
Безусловно, да. Несмотря на то, что вирусы ассоциируются у большинства людей с однозначным вредом, они могут приносить и пользу — если речь идет о так называемых вирусных векторах и терапевтических подходах на их основе.
Исследователи давно научились помещать в белковую оболочку вируса интересующие их нуклеиновые кислоты, чтобы доставлять нужный ген в клетки, а также убирать те гены, которые делают вирус опасным для организма.
Это позволило сделать возможной генную терапию, помогающую бороться с заболеваниями, вызванными известными генетическими мутациями. Создание вирусных векторов — достаточно непростая задача, к тому же ограниченная свойствами самих вирусных частиц: количеством помещающейся генетической информации, местом ее вставки, стабильностью. Кроме того, вирусный вектор, используемый в медицине, не должен вызывать иммунного ответа или критично влиять на жизнедеятельность клетки. Тем не менее эти сложности решаются, поэтому уже одобрен ряд вполне успешных и безопасных генных терапий. А в качестве основы для вирусных векторов чаще всего используются ретро-, ленти-, адено- и аденоассоциированные вирусы.
— Новый коронавирус — SARS-Cov-2 — представитель одного из многочисленных семейств РНК-содержащих вирусов человека и животных. Вирус — это упакованная молекула нуклеиновой кислоты (ДНК или РНК). Для размножения вирус должен попасть в клетки хозяина, а он, в свою очередь, сопротивляется и вырабатывает механизм защиты, который вирус пытается обойти.
— Причем вирусы эволюционируют быстрее, чем клеточные организмы.
— Да. В этом их преимущество. Организм хозяина (например, человека) так быстро эволюционировать не может, потому что устроен сложнее. Каждый раз, когда появляется новый вирус или новая разновидность уже известного вируса, организму нужно время, чтобы выработать защиту.
Вирус заразил клетку — клетка выработала защиту против вируса — вирус накопил определенное количество ошибок в геноме, и какие-то из них позволили вирусу обойти защиту клетки — вирус размножается дальше. Эволюция, с точки зрения вирусологии, — это история войны клеточных организмов с вирусами, в результате которой и те и другие меняются и приспосабливаются друг к другу.

Андрей Васин, вирусолог, исполняющий обязанности директора Института биомедицинских систем и биотехнологий Политехнического университета имени Петра Великого, Санкт-Петербург.
— Если вирусы такие классные, почему мы, люди, до сих пор живы?
— Спрошу сразу: когда нам ожидать лекарство от нового коронавируса?
— Разрабатывать новое лекарство очень сложно и долго. Если не говорить о препаратах, созданных методами генной инженерии, а о традиционных низкомолекулярных лекарствах — на это может уйти около десяти лет и несколько миллиардов долларов.
Поэтому вместо изобретения нового лекарства от COVID-19 исследователи делают repurposing of the drugs — испытывают против нового коронавируса уже известные препараты. На первых этапах проводят скрининг с помощью биоинформатики и компьютерного моделирования. Дальше — экспериментальная проверка.
Так можно пропустить целый этап проверки безопасности и токсичности. Ученым остается лишь доказать, что препарат эффективен при этом заболевании и именно при этом заболевании не вызовет побочных эффектов.

Сейчас испытывается множество таких лекарств — четыре наиболее перспективных выбрала ВОЗ, но, вообще, их гораздо больше. Китай испытывает все подряд, от новейших разработок до традиционной китайской медицины, — вдруг сработает? У них есть такая возможность.
— А как вообще лекарство от одного вируса может победить другой вирус?
— Пациенты — неоднородная масса людей, и у всех заболевание протекает по-разному. Опасность исследования с маленькой выборкой в том, что в него теоретически могли попасть именно те люди, для которых препарат оказался малоэффективным. Или наоборот. А большая выборка может показать, что для другой группы пациентов препарат сработает. Поэтому нужно больше исследований.
— Как работает Ремдезивир — еще одно потенциальное лекарство от коронавируса? Читаю, что это ингибитор РНК-зависимой РНК-полимеразы, но не понимаю, что это значит.
— Цепочка РНК вируса состоит из нуклеотидов: A, C, U и G. РНК-полимераза — вирусный фермент, который эту цепочку распознает и копирует. Если мы добавляем модифицированное основание, оно распознается полимеразой и автоматически добавляется к цепочке как обычный нуклеотид. Но новый нуклеотид к этой цепочке присоединиться уже не может. Или свойства этой цепочки нарушаются. Так мы блокируем РНК-полимеразу, и вирус больше не реплицируется.
— Это дает надежду, но выводы делать рано. Нужны исследования с большей выборкой. Разница между эффективностью плацебо и препарата оказалась достоверной, но в исследовании участвовали всего 36 человек. Эти препараты успешно лечат малярию, но как они себя поведут и какие побочные действия дадут при лечении коронавируса — пока неизвестно.
— Есть еще терапия антителами. Как она работает и когда ее ждать?
— Что такое антитело? Это молекула, которая вырабатывается клетками иммунной системы и нейтрализует вирус. Можно сделать его искусственно и ввести человеку, остановив тем самым распространение вируса. Подход старый: на заре вирусологии брали кровь переболевшего человека и вводили больному — иногда помогало, но давало много побочных эффектов. Сейчас антитела находят, выделяют, очищают и делают из них препарат.
Антитело, которые мы получаем в лаборатории, может эффективно нейтрализовать вирус. Но это большая белковая молекула, и она может быть токсичной, дать серьезные побочные эффекты или просто потерять активность. Можно не синтезировать антитело в лаборатории, а сделать так, чтобы сам организм его синтезировал.
Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Но можно предположить, что пожизненного иммунитета к нему не будет.
До конца пандемии разработать эффективную антительную терапию от COVID-19, а тем более на основе мРНК точно не получится. Но есть надежда, что пандемия SARS-CoV-2 ускорит развитие противовирусных иммунобиотехнологий и произойдет технологический рывок. И это позволит человечеству подойти к новой пандемии более подготовленным, чем к пандемии SARS-CoV-2.
—Насколько, вообще, часто появляются новые вирусы?
— Дело, скорее, в биологических свойствах конкретного вируса, а не в свойствах популяции. Чтобы вирус широко распространился, у него должно одновременно совпасть несколько характеристик: специфичность к рецептору на клетке, распространенность этого рецептора, эффективность репликации в данном типе клеток и многое другое.
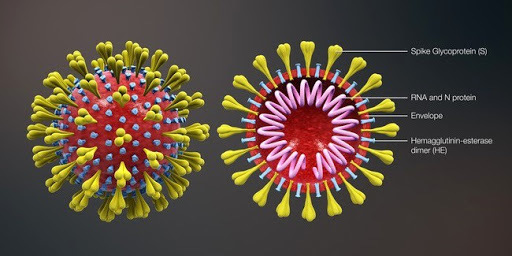
Строение коронавируса COVID-19, модель.
— Можно ли предсказать пандемию?
— Какой из вирусов станет пандемическим и как он будет распространяться — нет, это процесс стохастический. Вирус быстро накапливает мутации, происходит изменение его характеристик и свойств. Это абсолютно случайный процесс, хотя и подверженный действию отбора. При этом было известно, что коронавирусы обладают пандемическим потенциалом, можно было ожидать, что один из них приведет к пандемии. Но невозможно было предсказать, когда это случится.
— Как определить, что вирус обладает пандемическим потенциалом?
Возьмем птичий грипп: высокопатогенный вирус гриппа птиц H5N1 преодолел межвидовой барьер. Но, к счастью, от человека к человеку не передавался. Вот если бы он мутировал так, что смог бы передаваться от человека к человеку, мы получили бы пандемию с очень высокой степенью летальности. Поэтому изучению гриппа птиц уделяют много внимания.
Так что есть постоянная угроза пандемии. Мы не можем предсказать ни время начала, ни источник, ни летальность. Это как с землетрясениями: может быть? Да. Повлиять или предсказать можем? Нет. Пандемия с высокой летальностью может случиться раз в сто лет, а может — раз в шестьсот. Или, может, через год будет новая.
— Будет ли иммунитет у тех, кто переболел новым коронавирусом?
— Коронавирусы человека не очень хорошо изучены: среди людей до настоящего времени встречались всего шесть представителей семейства. Четыре (OC43, HKU1, NL63 и 229E) вызывают обычные легкие респираторные инфекции и не были особо интересны исследователям. Еще два, SARS и MERS — вирусы атипичной пневмонии и ближневосточного респираторного синдрома, — изучались, но инфекции были ограниченными. Из-за того, что данных мало, утверждать, какой будет длительность иммунитета от SARS-CoV-2, нельзя. Можно предположить, что раз этот вирус РНК-содержащий, то он является вариабельным, то есть быстро изменяющимся, — и пожизненного иммунитета к нему не будет. Скорее, длительность иммунитета будет как к гриппу, относительно короткой.
— Что будет, если те, кто переболел и выздоровел, заболеют снова? Статистика смертности от нового коронавируса значительно выше, чем от гриппа.
— Есть вероятность, что новый коронавирус станет сезонным и будет, как грипп, циркулировать и создавать ежегодные эпидемические вспышки. При этом чем дольше вирус будет циркулировать в популяции, чем больше людей переболеют им в первый раз, тем легче он будет переноситься. И тем ниже будет вероятность осложнений и смерти в результате заражения. Тогда уже можно будет сравнивать смертность от сезонного гриппа и сезонного коронавируса SARS-CoV-2.
Разработать вакцину быстро невозможно. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
— Как быстро появится вакцина от SARS-CoV-2?
Но то, что создано in silico и получено в лаборатории, нужно испытать на животных. Такие испытания по самой сокращенной схеме занимают около полугода. Обычно — два-три года.
Антитела (или иммуноглобулины) — это особые белковые молекулы, вырабатываемые иммуной системой организма, для того, чтобы бороться с вирусами.
На этом этапе вакцину испытывают по двум направлениям. Первое — безопасность. Второе — насколько она защищает от вируса. Для этого нужно использовать релевантную животную модель вирусной инфекции — то есть сначала адаптировать новый вирус к организму подопытного животного. Иногда адаптировать вирус получается быстро и легко, иногда нет. При этом развитие инфекции в животном должно имитировать человеческое. Если вирус респираторный — то и у лабораторного животного болезнь должна поражать органы дыхания.
— Как разрабатывается сама вакцина, ее формула? Тот самый первый этап, который теперь можно сделать за месяц.
— Можно ослабить или инактивировать вирус — это традиционный подход, но сейчас мало кто так делает — все делают генно-инженерные вакцины (векторные, рекомбинантные, ДНК, РНК). Для этого нужна только последовательность генома вируса. Имея ее, мы понимаем, какие белки этот геном кодирует, что вот этот белок, например, — поверхностный, и на него должны образовываться антитела, и т.д. Берем фрагмент гена/ген целиком/несколько генов вируса, синтезируем и вставляем в генетическую конструкцию. Она будет кодировать вакцинный антиген и/или саму вакцину. Дальше — испытываем на животных.
— Хорошо, мы создали вакцину в пробирке. Потом адаптировали вирус под животное, ввели ему вакцину, заразили, вакцина подействовала. Это заняло 7 месяцев. Что дальше? Уже можно вакцинировать людей?
— Пока нет. Следующая стадия — проверка безопасности на людях: находим здоровых добровольцев и вводим им вакцину. Если побочных реакций нет, испытываем вакцину на людях, которые могут заразиться этим вирусом. Стадия клинических исследований может длиться год, два, три… Но и это не все.
Изучены частота, характер и продолжительность внекишечных проявлений в зависимости от проводимой терапии у детей с норовирусной инфекцией. Установлено, что при норовирусной инфекции у детей, помимо гастроинтестинальных симптомов, нередко отмечаются и друг
Features of the clinical course and approaches to the therapy of norovirus infection in children R. V. Popova, T. A. Ruzhentsova
The frequency, nature and duration of extra-intestinal manifestations depending on the therapy in children with norovirus infection were studied. It was found that in norovirus infection in children, in addition to gastrointestinal symptoms, there are often other symptoms that affect the upper respiratory tract, pancreas, hepatobiliary and urinary systems and heart. An effective drug that relieves the symptoms of norovirus infection, prevents the development of extra-intestinal manifestations and complications, is colloidal silicon dioxide.
Острые кишечные инфекции (ОКИ) продолжают занимать одно из ведущих мест по распространенности среди других заболеваний. В последние десятилетия анализ их этиологической структуры и характера свидетельствует о существенных изменениях, происходящих как за счет появления новых лабораторных методов диагностики, так и за счет модификации возбудителей. Важную роль играет и трансформация иммунного ответа организма человека под влиянием неблагоприятной экологической обстановки, резкого снижения количества натуральных продуктов питания с увеличением употребления консервантов и стабилизаторов.
По данным исследователей, в настоящее время во многих странах, несмотря на достижения здравоохранения, отмечается рост числа вирусных ОКИ [1–6].
Ведущими возбудителями по-прежнему остаются ротавирусы. Наряду с ними в последние годы отмечается значительный рост частоты регистрации норовирусной инфекции с 2–5% из всех случаев секреторных диарей до 10–26,5% от всех выявленных эпизодов ОКИ [1, 7–10]. Пик заболеваемости, по данным различных авторов, приходится на период с января по апрель [1, 2, 9]. Болеют преимущественно дети в возрасте от рождения до 3 лет, среди которых чаще регистрируются среднетяжелые формы заболевания [1].
Наиболее вероятно, что частота норовирусной инфекции существенно выше, поскольку многие взрослые и подростки к врачам не обращаются из-за нетяжелого течения с преобладанием легких форм. В то же время, по результатам исследований проб питьевой воды, норовирусы нередко опережают ротавирусы по частоте их выявления, выходя на второе место после аденовирусов [11].
Активизации эпидемического процесса норовирусной инфекции может способствовать и длительный период выделения вируса после купирования симптомов ОКИ, составляющий в среднем 28 суток и достигающий 182 дня у иммуноскомпрометированных пациентов [12]. В связи с этим, в соответствии с действующими на сегодняшний день рекомендациями, при отсутствии клинической симптоматики дети могут посещать организованные коллективы вне зависимости от результатов лабораторной диагностики, что сопровождается неуточненным в настоящее время риском распространения инфекции. В то же время норовирусная инфекция отличается высокой контагиозностью: всего 10 частиц вируса достаточно для передачи ее от больного к восприимчивому организму [13]. Возбудитель сохраняет свою жизнеспособность в окружающей среде, на различных поверхностях до 4 недель, устойчив к физическим и химическим воздействиям. Как показали исследования, среди пациентов с подтвержденной норовирусной этиологией ОКИ преобладают дети из организованных коллективов (61%) с моноинфекцией — 93% [1]. Помимо того, в ходе изучения особенностей возбудителя была доказана высокая скорость молекулярной эволюции норовирусов, приводящая к частому возникновению и быстрому глобальному распространению его новых эпидемических вариантов [14]. Все это диктует необходимость своевременного выявления и адекватного лечения больных.
При лабораторном исследовании в копрограмме может быть непереваренная клетчатка, нейтральный жир, зерна крахмала, лейкоциты [1]. В анализе крови у большинства пациентов отмечается лимфоцитоз при нормальном количестве лейкоцитов, при выраженной клинической симптоматике возможны нейтрофильный лейкоцитоз, увеличение скорости оседания эритроцитов и повышение концентрации мочевины. Проявления ОКИ нередко не ограничиваются желудочно-кишечным трактом. Помимо гастроэнтеритического синдрома, почти у всех пациентов отмечается интоксикация, проявляющаяся вялостью, слабостью, адинамией, снижением аппетита, бледностью кожных покровов [1].
Лечение норовирусной инфекции проводится по принятым в Российской Федерации стандартам терапии ОКИ, включающим регидратационные растворы, энтеросорбенты, пробиотики, при необходимости жаропонижающие [15, 17]. Отечественными авторами рекомендуется назначение противовирусной терапии, хотя этот вопрос по-прежнему, учитывая зарубежные данные, остается дискутабельным. В опубликованных ранее работах было показано возможное появление катаральных изменений верхних дыхательных путей: насморка, кашля, признаков ринофарингита при норовирусной инфекции [5, 15, 16].
В литературе есть единичные указания на возможность развития у пациентов, больных норовирусной инфекцией, пневмоний, отитов, цистита, кардиомиопатии, менингита [17–19]. Зарубежные авторы отмечают, что при норовирусной этиологии чаще, чем при ротавирусной, отмечается судорожный синдром [18]. Однако подробного анализа распространенности, факторов риска развития, особенностей течения, характера и длительности внекишечных проявлений и связанных с этим осложнений не проводилось. Не было оценено влияние различных подходов к терапии норовирусной инфекции на формирование той или иной симптоматики у пациентов.
Целью данного исследования было изучить частоту, характер и продолжительность внекишечных проявлений в зависимости от проводимой терапии у детей с норовирусной инфекцией.
Материалы и методы исследования
В исследование включили 80 детей в возрасте от 8 месяцев до 6 лет, госпитализированных в инфекционное отделение для детей ГБУЗ МО МГКБ г. Мытищи. У всех пациентов норовирусная этиология ОКИ была подтверждена лабораторно методом полимеразно-цепной реакции. Преобладали дети в возрасте от одного года до трех лет (42 ребенка — 52%), 27 пациентов (34%) относились к возрастной группе от трех до 6 лет и 11 (14%) — от 8 месяцев до одного года. Большинство пациентов (94%) имели среднетяжелую форму ОКИ. Продолжительность заболевания от момента начала до включения в исследование составила от 1 до 3 суток включительно. Выявление какой-либо другой этиологии относилось к критериям исключения.
При поступлении в стационар, помимо клинического осмотра, всем детям были проведены лабораторные и инструментальные обследования для уточнения состояния органов брюшной полости, сердечно-сосудистой и мочевыделительной систем. Оценивали выраженность гастроэнтерологических, респираторных и интоксикационных проявлений, результаты клинического анализа крови, общего анализа мочи, уровни МВ-креатинкиназы, лактатдегидрогеназы, аспарагиновой трансаминазы, аланиновой трансаминазы в сыворотке крови. Детям проводили электрокардиографию (ЭКГ), а также ультразвуковое исследование (УЗИ) органов брюшной полости и почек. Этиологию ОКИ определяли при помощи полимеразно-цепной реакции.
Пациентов с наличием в анамнезе заболеваний сердечно-сосудистой, мочевыделительной и панкреатогепатобилиарной систем в исследование не включали.
Повторные клинические осмотры до купирования симптомов осуществляли ежедневно и, при необходимости, чаще, оценивали длительность каждого из проявлений. При наличии отклонений по результатам лабораторного и/или инструментального обследования или выявлении показаний в последующие дни нахождения в стационаре через 3–5 дней оценивали показатели повторно, а при отсутствии нормализации — еще раз, на 18–25 день от начала заболевания.
Все пациенты получали стандартную, рекомендуемую при ОКИ, безлактозную диету. Детям первого года жизни, находящимся на грудном вскармливании, его рекомендовали продолжить. Базисная терапия состояла из регидратационных глюкозосолевых растворов, назначенных только перорально — в 39%, парентерально — в 25% и парентерально, а затем перорально — в 36%. Энтеросорбенты получали 81% детей, пробиотики — 89%, жаропонижающие (ибупрофен и/или парацетамол) при температуре более 38–39 °C — 64%.
В зависимости от особенностей стартовой терапии, которая в большинстве случаев начиналась на дому, пациенты были распределены на три группы. В 1?ю группу было отнесено 24 ребенка, получавших с первого дня проявлений заболевания энтеросорбенты и регидратационную терапию, во 2?ю группу вошел 41 больной, которым комплексная терапия была назначена позднее, на вторые или третьи сутки, в 3?ю было включено 15 пациентов, не принимавших энтеросорбенты. Эти препараты не были назначены врачами в большинстве случаев из-за отсутствия диареи, иногда — из-за отказа или негативной реакции у детей.
Статистическая обработка всех полученных данных осуществлялась на персональном компьютере с использованием программы Statistica, версия 6.1 (StatSoft Inc., США). Различия между рассчитанными показателями в группах оценивали по двустороннему Z-критерию, статистически значимыми считали при вероятности > 95% (p < 0,05).
Результаты и обсуждение
Среди основных клинических симптомов у всех пациентов были выделены: рвота от 1 до 25 раз в сутки, отсутствие аппетита, вялость, бледность и повышение температуры тела. Диарея наблюдалась у 81% детей, чаще с конца первых или на вторые сутки. На боли в животе жаловались 48% (13 детей) пациентов из возрастной группы от 3 до 6 лет. У детей более раннего возраста болевой синдром не оценивали из-за высокой вероятности неправильного определения.
У наблюдавшихся пациентов регистрировали разнообразные внекишечные проявления, представленные на рис. Из них лечащие врачи в первую очередь отмечали признаки ринита с заложенностью носа, умеренными водянистыми выделениями, гиперемией и отечностью носовых ходов в сочетании с незначительно или умеренно выраженным фарингитом (у 34% — 27 детей).
По данным дополнительных исследований, среди детей с норовирусной инфекцией в 71,25% (у 57 детей) были выявлены те или иные отклонения на ЭКГ: нарушения реполяризации (у 54% — 43 детей), снижение вольтажа (у 20% — 16 детей), суправентрикулярная или вентрикулярная экстрасистолия (у 7,5% — 6 детей). У 8 детей было отмечено сочетание изменений. Повышение уровней активности МВ?креатинкиназы изолированно или одновременно с увеличением значений лактатдегидрогеназы и/или соотношения аспарагиновой и аланиновой трансаминаз регистрировали у 36% детей.
По результатам УЗИ органов брюшной полости, изменения печени и/или поджелудочной железы были выявлены у 42 детей (53%). Нарушения структуры почек, чаще — уплотнения стенок чашечно-лоханочной системы, было выявлено у 30 детей (38%).
Основные симптомы ОКИ у всех пациентов были купированы в течение 2–4 суток от момента начала адекватной терапии.
Отклонения, выявленные по данным ЭКГ и лабораторного обследования, у 64% при повторной оценке показателей, через 3–5 дней, не выявлялись. Однако у 7,5% пациентов сохранялись нарушения реполяризации, снижение вольтажа и повышение МВ?креатинкиназы сохранялись, несмотря на отсутствие основных симптомов ОКИ, что позволило подозревать вероятный миокардит у этих детей. Через 18–25 дней отклонения сохранялись у 2 пациентов (3,5% из группы детей с выявленными нарушениями на ЭКГ).
По данным УЗИ, через 3 недели купировались изменения поджелудочной железы у 81% (34 детей), печени — у 74% (у 31 ребенка), почек — в 100%. Симптомы инфекции мочевыводящих путей также не отмечались ни в одном случае.
Анализ результатов лабораторного и инструментального обследования в группах, различавшихся по особенностям терапии энтеросорбентами, показал, что в 1?й группе, у детей, получавших с первых суток Полисорб МП, не было случаев сохранения симптоматики внекишечных проявлений более 3 недель. Нарушения на ЭКГ, полностью купировавшиеся к моменту повторного обследования через 3–5 суток, были выявлены у 2 детей (8%). У 3 пациентов (12,5%) были выявлены изменения поджелудочной железы и у 2 из них — печени. Инфекций мочевыводящих путей и уплотнений чашечно-лоханочной системы, по данным УЗИ, в этой группе пациентов не выявляли. У 2 детей (8%) была отмечена анемия легкой степени.
Как видно из табл., частота длительно сохраняющихся внекишечных изменений была выше в группе, не получавшей энтеросорбенты. Очевидно, что отсутствие диареи во многих случаях было связано как с преимущественным поражением верхних отделов желудочно-кишечного тракта, так и, возможно, с обезвоживанием, что также усугубляло внекишечную симптоматику и не могло служить поводом для отказа от энтеросорбирующей терапии. Назначение энтеросорбентов на 2–3 сутки от начала заболевания приводило к снижению частоты внекишечных проявлений по сравнению с группой, которым энтеросорбирующие препараты назначены не были.
Анализ терапии показал, что применение диоксида кремния коллоидного (Полисорб МП) с первых суток у 12 детей прерывало симптомы ОКИ. На фоне терапии диарея ограничивалась неоформленным стулом 2–5 раз в течение одного дня или не проявлялась вовсе, температура тела снижалась до нормальных значений. Изменения поджелудочной железы, выявленные у 1 ребенка, были незначительны и купировались вместе с основными проявлениями ОКИ. Случаев отказа от терапии диоксидом кремния коллоидным из-за органолептических свойств, индивидуальной непереносимости или нежелательных явлений не было.
Выбор данного препарата обусловлен его доказанной безопасностью, а также высокой эффективностью (с высокой удельной поверхностью сорбции частиц более 300 м 2 /г), а также отличными протеонектическими свойствами, всеми прочими свойствами современных энтеросорбентов и длительным постклиническим опытом применения (более 20 лет). Протеонектическими свойствами Полисорба МП объясняется его способность связывать значительные количества микроорганизмов — до 10 млрд микробных тел на 1 г препарата и более, независимо от видовой принадлежности, а также различные эндо и экзотоксины [20].
Таким образом, полученные результаты подчеркивают разнообразие проявлений ОКИ, не ограничивающихся только желудочно-кишечным трактом. Выявленные изменения печени, поджелудочной железы, мочевыделительной системы, сердца у некоторых пациентов сохраняются длительно, более 3 недель с момента появления первых симптомов норовирусной инфекции.
Выводы
- При норовирусной инфекции у детей помимо гастроинтестинальных симптомов нередко отмечаются и другие, затрагивающие верхние дыхательные пути, поджелудочную железу, гепатобилиарную и мочевыделительную систему, сердце.
- Комплексная терапия, соответствующая стандартам лечения ОКИ вирусной этиологии, должна проводиться с первого дня заболевания.
- Эффективным лекарственным препаратом, купирующим симптомы норовирусной инфекции, препятствующим развитию внекишечных проявлений и осложнений, является Полисорб МП.
Литература
Р. В. Попова
Т. А. Руженцова 1 , доктор медицинских наук
ФБУН ЦНИИЭ Роспотребнадзора, Москва
Особенности течения и подходы к терапии норовирусной инфекции у детей/ Р. В. Попова, Т. А. Руженцова
Для цитирования: Лечащий врач № 11/2018; Номера страниц в выпуске: 44-48
Теги: вирусная инфекция, дети, внекишечные проявления
Читайте также:

