Рпга при гепатите в
Обновлено: 22.04.2024
Выявление в сыворотке крови специфических антител к бледной трепонеме (Treponemapallidum), используемое для подтверждения результатов неспецифических тестов на сифилис, скрининга сифилиса, обследования контактных лиц и доноров крови.
Синонимы русские
Люэс, бледная трепонема.
Синонимы английские
Syphilis, passive hemagglutination test; Syphilis, indirect hemagglutination test; Treponema Pallidum Hemaglutination Assay, TPHA.
Метод исследования
Реакция непрямой гемагглютинации (РНГА).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до сдачи крови.
Общая информация об исследовании
Как правило, результат РПГА остается положительным даже после лечения сифилиса. Исключение составляет ситуация, когда терапия была проведена в самом начале заболевания. Так как результат сохраняется положительным пожизненно, РПГА не предназначена для дифференциальной диагностики раннего и позднего сифилиса. По этой же причине данное исследование не используют, чтобы оценивать эффективность лечения заболевания.
При добавлении сыворотки больных сифилисом к реагенту РПГА происходит агглютинация (склеивание) и выпадение в осадок эритроцитов. Степень агглютинации зависит от концентрации антител в сыворотке, поэтому РПГА позволяет не только выявить присутствие антител, но и определить их количество. Результат анализа представлен в виде титра антител. Любой положительный титр указывает на возможную инфекцию T. pallidum, однако возможны ложноположительные реакции. Значительно повышенные показатели характерны для вторичного и скрытого раннего сифилиса.
Ложноположительные результаты РПГА наблюдаются в 0,05-2,5 % случаев и чаще всего обусловлены наличием в сыворотке пациента аутоантител (при системных заболеваниях соединительной ткани, например при системной красной волчанке), антител к другим возбудителям, схожим по антигенной структуре с T. pallidum (Borrelia burgdorferi, сапрофитные трепонемы полости рта и гениталий), а также другими физиологическими и патологическими состояниями (беременность, онкологические заболевания, острый инфаркт миокарда). Как правило, титр ложноположительной реакции РПГА низкий. Исключение составляют результаты РПГА у пациентов с диффузными заболеваниями соединительной ткани и злокачественными новообразованиями, когда титр антител может достигать очень высоких значений. Ложноположительные реакции негативируются спонтанно и бесследно в течение 4-6 месяцев (острая ложноположительныя реакция, часто на фоне беременности) или более длительного периода (хроническая ложноположительная реакция).
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата:
- первичный, вторичный, третичный, а также скрытый сифилис (приобретенный и врожденный);
- беременность; ;
- гепатиты В и С;
- употребление инъекционных наркотиков;
- острый инфаркт миокарда;
- диффузные заболевания соединительной ткани;
- возвратный тиф;
- лептоспироз;
- клещевой боррелиоз;
- тропические трепонематозы (фрамбезия, беджель, пинта);
- воспалительные процессы, обусловленные сапрофитными трепонемами полости рта и гениталий;
- злокачественные новообразования;
- обширная травма и переломы;
- бактериальный эндокардит;
- туберкулез;
- инфекционный мононуклеоз;
- поствакцинальная реакция.
Причины отрицательного результата:
- отсутствие сифилиса;
- первые 2-4 недели после инфекции T. pallidum;
- неправильное взятие материала на исследование.
Что может влиять на результат?
- Результат анализа может быть ложноотрицательным в течение первых 2-4 (до 6) недель после заражения.
Важные замечания
- Исследование не позволяет дифференцировать;
- сифилис (T. pallidum) и другие трепонематозы (T. pallidumsubspeciespertenue, endemicum, carateum);
- ранний и поздний сифилис.
Также рекомендуется
Кто назначает исследование?
Дерматовенеролог, невролог, врач общей практики, эпидемиолог.
Литература
- French P, Gomberg M, Janier M, Schmidt B, van Voorst Vader P, Young H; IUST. IUSTI: 2008 European Guidelines on the Management of Syphilis. Int J STD AIDS. 2009 May;20(5):300-9.
- Seña AC, White BL, Sparling PF. Novel Treponema pallidum serologic tests: a paradigm shift in syphilis screening for the 21stcentury. Clin Infect Dis. 2010 Sep 15;51(6):700-8.
- Luger A. Diagnosis of syphilis. Bull World Health Organ. 1981;59(5):647-54.
- Holmes K.K. Sexually Transmitted Diseases / K.K. Holmes, P.F. Sparling, W.E. Stamm; 4th ed. — McGraw-Hill, 2008.
Диагностика гепатитов В и С у гематологических больных - анализы, особенности
Современная этиологическая диагностика вирусных гепатитов основана на обнаружении специфических маркеров соответствующих вирусов. Один из методов их выявления — тестирование различных антигенов вируса и антител к ним в ИФА. Наиболее прогрессивна и информативна так называемая генная диагностика: обнаружение вирусной РНК или ДНК с помощью ПЦР.
Для диагностики гепатита В в ИФА исследуют:
1) HBsAg-поверхностный антиген гепатита В, ранее называвшийся австралийским. Он указывает на факт инфицированности гепатитом В;
2) HbeAg — антиген инфекционности, свидетельствующий об активной вирусной репликации;
3) анти-НВс —антитела к ядерному антигену вируса гепатита В: класса IgM—ранние антитела острого периода, класса IgG—поздние антитела к ядерному антигену;
4) анти-НВе — антитела к HBeAg, чаще всего характеризующие прекращение активной репликации вируса (так называемая сероконверсия);
5) анти-HBs—антитела к HBsAg, обеспечивающие протективный иммунитет.С помощью ПЦР для диагностики гепатита В тестируют ДНК вируса гепатита В — основного маркера репликации вируса.
Для диагностики гепатита С исследуют:
1) с помощью ИФА наличие анти-HCV-антител к вирусу гепатита С (для их выявления желательно использовать тест-системы второго — третьего поколения, отличающиеся большей специфичностью). Они указывают только на инфицированность вирусом гепатита С;
2) с помощью ПЦР наличие РНК вируса гепатита С — основного маркера репликации вируса.Говоря о специфической диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями (ОГЗ), следует рассмотреть вопрос о применимости стандартных подходов к выявлению различных маркеров этих вирусов у данного контингента в связи с возможным нарушением процесса антителообразования на фоне глубокой иммуносу-прессии, развивающейся в ходе полихимиотерапии (ПХТ).
Исследования, в которых сделана попытка подтвердить или опровергнуть роль антительных маркеров у пациентов с онкологическими гематологическими заболеваниями, пока единичны.
Так, в отдельных работах сообщается, что при гепатите В иммуносупрессия нарушает обычную последовательность обнаружения в сыворотке крови антигенов и антител: у больных, которые до начала ПХТ были анти-НВs-позитивными, в процессе лечения могут вновь определяться HBsAg и HBeAg, свидетельствуя о несостоятельности анти-HBs в качестве протективных антител. Угнетение механизмов, ограничивающих вирусную репликацию, ведет к тому, что виремия нередко достигает высокого уровня.
![вирусы гепатитов]()
Если антитела к столбняку, дифтерии и полиомиелиту сохраняются во время и после ПХТ, то титры антител к вирусам (ветряной оспы, кори и гепатита В) резко снижаются. Это в большей мере относится к детям с лейкозами, чем с солидными опухолями. Снижение или отсутствие выработки анти-HBs отметили также R. Repp и соавт. и R. Rokicka-Milewska и соавт.. Если при гепатите В эта особенность может отразиться только на ретроспективной диагностике, то для распознавания гепатита С, основанного чаще всего на обнаружении анти-HCV с помощью ИФА, такое положение может иметь принципиальное значение, препятствуя полному и своевременному выявлению всех инфицированных.
Антитела к вирусу гепатита С (анти-HCV) вообще образуются медленно, в течение 8—15 нед от момента инфицирования, но у иммунокомпетентных лиц персистируют в организме длительно и в большинстве случаев пригодны для выявления гепатита С, являясь в настоящее время рутинным и скрининговым маркером.
Некоторые авторы, проводившие немногочисленные и небольшие по объему исследования у иммунокомпрометированных пациентов, указывают на возможность отсроченного образования антител к вирусу гепатита С и считают недостаточным использование только ИФА для диагностики данного заболевания у этого контингента пациентов. В частности, С. Cornu и соавт. обнаружили, что у 5 из 6 обследованных ими иммунокомпрометированных пациентов анти-HCV начали обнаруживаться лишь спустя 14 мес и более от момента инфицирования, установленного с помощью ПЦР.
По данным М. Arico и соавт., антительная диагностика позволяет выявить около 70 % детей с ОЛЛ, инфицированных вирусом гепатита С. Значение ПЦР в выявлении пациентов, инфицированных вирусами гепатитов В и С, продемонстрировано при обследовании турецких детей: у 13,9 % больных с онкологическими гематологическими заболеваниями диагноз гепатита В установлен только при обнаружении ДНК вируса гепатита В, а 5,8 % анти-HCV-негативных детей оказались инфицированными вирусом гепатита С при тестировании РНК.
В то же время синтез анти-НВс IgM, сопутствующий в иммунокомпетентном организме вирусной репликации и являющийся одним из ее маркеров, у пациентов с онкологическими гематологическими заболеваниями почти отсутствует, а у пациентов без онкологических гематологических заболеваний происходит их активная наработка (7,7 % против 78,6 %).
С общебиологической точки зрения, выявленные феномены ждут объяснения, а в прикладном плане они демонстрируют особенности специфической диагностики инфицированности вирусом гепатита В у больных с онкологическими гематологическими заболеваниями и необходимость поиска других подходов к распознаванию болезни. Этой цели служит использование ПЦР, которая позволяет существенно повысить выявляемость пациентов с онкологическими гематологическими заболеваниями, инфицированных вирусом гепатита В: в 16 % случаев обнаружение ДНК этого вируса было единственным маркером инфицирования.
Более того, у 50 % детей, находившихся на полихимиотерапии и позитивных по каким-либо маркерам вируса гепатита В, вирусная ДНК выявлялась в отсутствие HBeAg, т. е. была единственным показателем репликации вируса, в то время как среди детей без онкологических гематологических заболеваний подобная ситуация встречалась лишь в 14,5 % случаев, т. е. в 3,5 раза реже.
При гепатите С также не обнаружено параллелизма между выявлением анти-HCV и РНК вируса гепатита С. Весьма демонстративным было преимущество тестирования РНК перед антительной диагностикой: у 44,4 % детей с онкологическими гематологическими заболеваниями РНК вируса гепатита С оказалась единственным маркером инфицирования.
Как и при гепатите В, диагностическая значимость генных и антительных маркеров зависит от фазы ПХТ. Период интенсивного и поддерживающего лечения онкологического гематологического заболевания при гепатите С — это время абсолютной репликативной активности и резкого снижения антителообразования, способность к которому частично восстанавливается по завершении полихимиотерапии. В наших наблюдениях у 74,9 % детей это сопровождалось продолжением вирусной репликации.
Практические выводы о специфической диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями сводятся к следующему:
1) рутинные подходы недостаточны для распознавания инфицированности пациентов с онкологическими гематологическими заболеваниями вирусами гепатитов В и С;
2) необходимо комплексное исследование всего известного спектра маркеров;
3) ведущую, определяющую роль в диагностике гепатитов В и С у пациентов с онкологическими гематологическими заболеваниями играет тестирование ДНК вируса гепатита В и РНК вируса гепатита С в ПЦР;
4) только путем внедрения ПЦР-диагностики в учреждениях для больных с онкологическими гематологическими заболеваниями можно обеспечить полную и своевременную диагностику гепатитов В и С;5) обязательность обследования всех пациентов с помощью современных маркеров:
— при поступлении;
— при повышении активности АЛТ на этапах ПХТ;
— каждые 3—6 мес в ходе и в течение года после ПХТ.Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
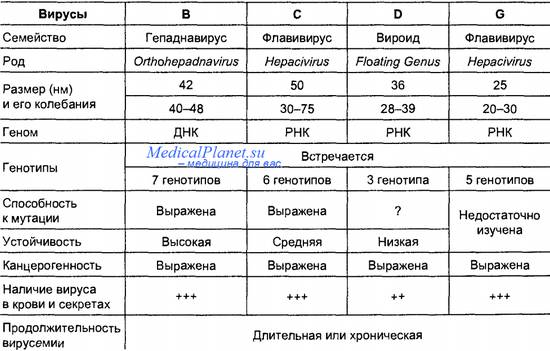
Гепатит В – острое или хроническое заболевание печени, вызываемое вирусом гепатита В (HBV), протекающее в различных клинических вариантах: от бессимптомных форм до злокачественных (цирроз печени, гепатоцеллюлярная карцинома). На долю ГВ приходится около 15% всех регистрируемых в РФ острых гепатитов и не менее 50% хронических.
Схематично строение вирусной частицы гепатита В можно изобразить так:
Рис.1. Структура вируса гепатита В.
Вирусные частицы гепатита В размером 42 - 45 нм (частицы Дейна) имеют достаточно сложное строение и включают ДНК, ДНК - полимеразу и антигены: поверхностный (HBs Ag ), сердцевинный - ядерный или коровский (HBc Ag или cor Ag), антиген инфекционности (HBe Ag, выявляемый в крови при активной репликации HBV-инфекции.
Белок внешней оболочки ВГВ является его поверхностным антигеном – HBsAg. HBsAg – это основной маркёр ГВ. При остром гепатите HBsAg может быть выявлен в крови обследуемых уже в инкубационный период в первые 4–6 недель от начала клинического периода. Присутствие HBsAg более 6 мес рассматривается как фактор перехода болезни в хроническую стадию.
Следует отметить, что только часть HBsAg, образующегося при размножении вируса, используется для построения новых вирусных частиц, основное же его количество поступает в кровь инфицированных лиц, где и определяется HBsAg- антиген.
HBc антиген - сердцевинный антиген, выявляемый только в ядрах клеток печени - гепатоцитов, но отсутствующий в крови. Большое диагностическое значение имеет определение в крови антител к нему класса М - антиHBc-IgM. Эти антитела при остром гепатите выявляются раньше, чем антитела к другим вирусным антигенам. АнтиHBc -IgM выявляют у 100% больных острым гепатитом В. Анти HBc суммарные (М+G ) антитела могут быть единственным маркером вируса гепатита В в фазу “окна”, когда в крови не удается выявить ни HBs- антиген, ни антитела к нему. Именно поэтому их определяют на станциях переливания крови при тестировании донорской крови и плазмы.
HBeAg представляет собой измененный HBсоrеAg. HBcoreAg и HBeAg обладают структурным родством и имеют общие эпитопы - центры связывания.
Это четвертый маркер активной репликации вируса наряду с ДНК, HBs Ag и антиHBc –IgM.
HBe Ag - антиген инфекционности, циркулирует только при наличии HBs антигена. Длительность циркуляции HBe антигена - важный прогностический признак. Его выявление через два месяца с начала заболевания - признак вероятного развития хронического гепатита. В большинстве случаев происходит смена (сероконверсия) HBe Ag на антиHBe - антитела, что является маркером завершенной репликации вируса гепатита В и прогностически благоприятным признаком. На ранней стадии сероконверсии оба эти маркёра могут обнаруживаться одновременно.
Исчезновение HBeAg и быстрое нарастание титра анти-HBе у больного практически исключает угрозу хронизации ГВ. Отсутствие такой динамики и выявление монотонно низких концентраций анти-НВе, наоборот, может свидетельствовать о развитии хронического ГВ с невысокой активностью (HBeAg-негативный хронический ГВ).
анти-HBs определяют для оценки течения инфекционного процесса и благоприятности его исхода. Факт появления анти-HBs рассматривается как надежный критерий развития постинфекционного иммунитета, т.е. выздоровления после гепатита В. Хотя при хроническом гепатите В HBsAg и анти-HBs могут иногда обнаруживаются одновременно.
Анти-HBs могут сохраняться пожизненно. Анти-HBs обладают протективными (защитными) свойствами. Этот факт лежит в основе вакцинопрофилактики. В настоящее время в качестве вакцины против ГВ, в основном, применяют препараты рекомбинантного HBsAg. Эффективность иммунизации оценивают по концентрации антител к HBsAg у вакцинированных лиц. Согласно данным ВОЗ, общепринятым критерием успешной вакцинации считается концентрация антител, превышающая 10 мМЕ/мл.
Важное диагностическое значение для определения прогноза и тактики лечения больных гепатитом В имеет выделение двух качественно различных фаз развития HBV - репликативной и интегративной.
При репликативной фазе (т.е. массовом размножении вируса) наблюдается репликация ДНК HBV и всех белков, а соответственно, и антигены копируются в большом количестве. Характерно выявление ДНК HBV, HBe Ag и (или) анти - HBc - IgM, HBs Ag
При интегративной фазе развития (т.е. когда вирусные частицы не подвергаются дальнейшей репликации) геном HBV встраивается в геном гепатоцита. Основную роль играет фрагмент, несущий ген, кодирующий HBs антиген Поэтому при этой фазе идет преимущественное образование HBs Ag и антител к коровскому белку и анти- HBe Ag.
Treponema pallidum (бледная спирохета) - спиралевидная бактерия семейства Spirochaetaceae, которая вызывает сифилис, а также другие заболевания - беджель, или эндемический сифилис, пинта (патология кожи) и фрамбезия (тропическая инфекция кожи, костей и суставов).
Известны 4 подвида Treponema pallidum, среди которых наиболее распространена Treponema pallidum pallidum - возбудитель сифилиса.Инкубационный период заболевания длится от 3 до 90 дней, в среднем - около трех недель. Первые симптомы заболевания - появление кожных поражений (твердого шанкра) в месте входных ворот бактерии. Шанкр представляет собой твердое, безболезненное изъязвление диаметром до 3 см. Через 7-10 дней после появления шанкра в 80% случаев увеличиваются лимфатические узлы в районе заражения.
Вторичный сифилис развивается через 4-10 недель после первичной инфекции. Чаще всего поражаются кожные покровы, слизистые оболочки и лимфатические узлы. Основная симптомы - появление розовой сыпи на туловище и конечностях, лихорадки, боли в горле, головной боли. Общее недомогание, усталость, потеря веса, выпадение волос также сопутствуют вторичному сифилису. Через 3-6 недель симптоматика исчезает, хотя у 25% инфицированных появляются рецидивы вторичного сифилиса.
Третичный сифилис проявляется спустя 3-15 лет после первичного инфицирования, и принимает различные формы - гуммозный сифилис (15%), поздний нейросифилис, кардиоваскулярный сифилис.
Ранний и поздний латентный сифилис протекают бессимптомно, а диагноз можно установить только с помощью лабораторных исследований.
Трепонемные антитела (специфические антитела к антигену Treponema pallidum) появляются в сыворотке крови через 4 недели после инфицирования, достигая максимального уровня в период вторичного сифилиса. Титр трепонемных антител снижается после успешной терапии, но остаточный уровень определяется в течение всей жизни. Трепонемные антитела вырабатываются только к Treponema pallidum, поэтому их выявление свидетельствует о текущем или перенесенном инфицировании, и ложноположительные крайне маловероятны.
Данный анализ позволяет выявить и определить количество антител к Treponema pallidum, возбудителю сифилиса в сыворотке крови. Анализ помогает диагностировать текущий или перенесенный ранее сифилис. Метод РПГА обладает высокой специфичностью при всех формах сифилиса (первичном, латентном, вторичном, третичном). Данный метод используют для подтверждения результатов полученных при проведении реакции микропреципитации (и ее разновидностей - VDRL, RPR) и для исключения ложноположительных случаев, полученных в этих скрининговых тестах. Для РПГА характерна высокая чувствительность, с ее помощью можно обнаружить очень небольшое количество антител в сыворотке. Тест после лечения негативируется очень медленно, он может показывать слабоположительные результаты многие годы после выздоровления.
Читайте также: