С какого возраста у ребенка формируются собственные антитела к вирусам
Обновлено: 12.05.2024
Иммунологическая память при вирусной инфекции. Антитела после вирусной инфекции.
Вслед за праймированием антигеном и клональной экспансией лимфоцитов образуется популяция долгоживущих клеток иммунологической памяти, персистирующей неопределенно долго без деления до стимуляции последующей реинфекцией или реиммунизацией. Т-клетки памяти характеризуются особыми поверхностными маркерами (СД4/5RO) и хоминг-молекулами, связанными с определенным путем рециркуляции. При повторной встрече с тем же антигеном, даже много лет спустя, Т- и В-клетки отвечают более быстро и более интенсивно, чем при первичной встрече.
Клетки памяти на повторное введение того же антигена также реагируют анамнестическим (вторичным) ответом с продукцией большого количества специфических антител.
Немного известно о механизме продолжительной иммунологической памяти Т- и В-лимфоцитов в отсутствии выраженной хронической инфекции. Возможной причиной иммунологической памяти является продолжительная антигенная индукция, исходящая от фолликулярных дендритных клеток-ловушек в терминальных центрах лимфатических узлов, где происходит индукция В-клеток памяти. Опыты на кроликах, вакцинированных против бешенства, убеждают, что соматическая мутация В-клеток является результатом антигенспецифического иммунного ответа.
Так как соматические мутации не происходят в генах, кодирующих Т-клеточные рецепторы, а роль персистенции вирусного антигена не подтверждена, развитие иммунологической памяти Т-клеток зависит от размера клональной экспансии на первую встречу с антигеном. В этой связи при разработке новых, более эффективных вакцин следует обращать внимание на длительное поддержание Т-клеточной памяти.
Важно знать возникновение памяти у различных компонентов иммунной системы, а также ее персистенцию после иммунизации инактивированными и живыми вирусными вакцинами при различных путях введения.
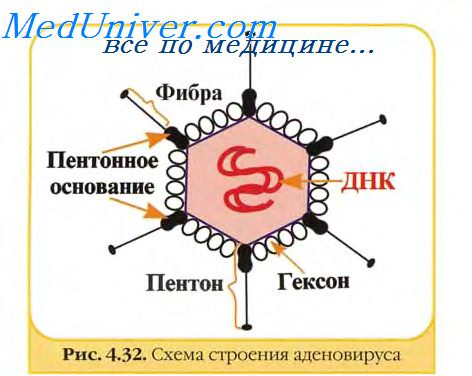
Известны примеры, когда Тц-клетки памяти способны длительно персистировать в организме иммунизированных животных. После энтеральной иммунизации мышей реовирусом Тц-лимфоциты и клетки памяти, продуцирующие IgA, способны длительное время персистировать в лимфоидной ткани, особенно в пейеровых бляшках. В легких мышей, инфицированных вирусом гриппа, клетки, секретирующие специфические IgG и IgA, сохранялись в течение 11 мес, а время полужизни Тц клеток иммунологической памяти при гриппе человека составляет 2—3 года. Введение повышенной дозы вирусных антигенов способствовало ранней индукции Тц-клеток, оказывающих протективный эффект in vivo при бешенстве и ускоренному наступлению иммунитета при гепатите В.
Клон Тц-клеток памяти, способных реагировать на повторную иммунизацию, формируется к 30-му дню после введения антигена вируса бешенства. У мышей-реконвалесцентов Тц-клетки могут сохраняться в течение года, а у человека—в течение нескольких лет. Антитела к вирусу гепатита В после буферизации сохраняются в течение трех лет, а после иммунизации вакциной 17D против желтой лихорадки нейтрализующие антитела сохранялись 30—35 лет.
Существует мнение, что живые и инактивированные вакцины индуцируют В- и Тц-лимфоциты и клетки иммунологической памяти не столь эффективно, как естественное инфицирование. Так, иммунитет у переболевших корью людей сохраняется пожизненно, а после первичной иммунизации живой вакциной — около 15 лет.
Хотя инактивированные вирусные вакцины обычно индуцируют выработку антител и В-клеток памяти, тем не менее, они по-разному влияют на индукцию двух типов эффекторных клеток. Препараты инактивированного вируса гриппа вызывали у мышей длительную память Т-хелперов, но слабовыраженную память цитотоксических клеток. В то же время инактивированные препараты вируса парагриппа-1 типа Сендай, антигены которого эффективно включаются в структуру клеточных мембран, индуцируют образование Тц-клеток.
При одних заболеваниях (оспа человека, оспа животных, полиомиелит, чума крупного рогатого скота, классическая чума свиней) имеются живые вакцины, создающие длительный или пожизненный иммунитет, при других — разработаны высокоэффективные инактивированные или компонентные вакцины (ящур, болезнь Ауески, гепатит В и др.). Вакцинальный иммунитет во многих случаях по всем или основным компонентам иммунного ответа практически не уступает или немногим уступает состоянию реконвалесценции.
Таким образом, можно констатировать, что время появления, интенсивность образования антиген-стимулированных В- и Тц-клеток и персистенция клеток иммунологической памяти при прочих равных условиях зависит не столько от вида примененной вакцины (живой или инактивированной), сколько от ее антигенного воздействия на различные компоненты иммунной системы привитого организма. Реализация потенциальной антигенной активности вакцинных препаратов в значительной мере может зависеть от способа их введения, схемы применения, а в случае использования инактивированных вакцин также и от качества иммунологических адъювантов.
В зависимости от степени устойчивости вакцинированных особей к заражению вирулентным штаммом соответствующего возбудителя, следует различать клинический и биологический иммунитет. В первом случае, вирус проникает и размножается в организме без манифестации признаков болезни. Во втором -организм противостоит инфицированию, то есть способен остановить размножение вируса в воротах инфекции.
Характерным примером, демонстрирующим индукцию клинического иммунитета, могут служить вакцинные препараты против простого герпеса, предотвращающие заболевание, но не персистентную вирусную инфекцию. Указанная особенность присуща вакцинальному иммунитету при ряде других инфекций и, прежде всего, вызванных герпесвирусами.
Трехкратная парентеральная иммунизация обезьян инактивированной вакциной против полиомиелита предотвращала заболевание и экскрецию вируса с фекалиями после контрольного заражения. Однако у таких обезьян в ответ на введение вируса наблюдали бустерный антительный ответ, свидетельствующий о приживляемости вируса на вакцинальном фоне. У поросят с материнским иммунитетом ротавирус размножался в кишечнике и выделялся с фекалиями при отсутствии клинических признаков болезни. Подобные явления имеют место в случаях, когда переболевание, а тем более вакцинация, сопровождаются развитием относительно слабовыраженного иммунитета. Инфекции, при которых ре-конвалесценция сопровождается напряженным и длительным иммунитетом, теоретически могут контролироваться биологическим вакцинальным иммунитетом.
К ним, прежде всего, относятся остропротекающие инфекции, с выраженным системным иммунитетом, такие как корь, классическая чума свиней, чума крупного рогатого скота и др. Поросята, вакцинированные живой культуральной вакциной против классической чумы свиней, вскоре после парентерального контрольного заражения были свободны от вирулентного штамма вируса. При контакте с больными у вакцинированных животных не отмечали появления вторичных антител.
В заключение следует сказать, что эффективный гуморальный или клеточный иммунитет имеет поликлональную природу. В подтверждение сказанного можно привести два примера. Адоптивный перенос 4х107 Т-лимфоцитов двух субпопуляций (CD4 и CD8) от иммунизированных вирусом Раушера мышей полностью защищал реципиентов от виремии и спленомегалии после заражения вирусом. Перенос клеток одной из этих субпопуляций обеспечивал лишь частичную защиту мышей. Протективный иммунитет к вирусу японского энцефалита у мышей, коз и обезьян значительно усиливался после смешивания различных моноклональных вируснейтрализующих антител.
Существуют тесные взаимоотношения между резистентностью, клеточным и гуморальным иммунитетом. В реакциях клеточного иммунитета принимают участие как Тц-лимфоциты, так и антитела (например, в зависимой от антител клеточной цитотоксичности). Главные эффекторы резистентности — макрофаги — также играют важную роль эффекторов клеточного иммунитета. Активность их в известной мере зависит от комплемента, антител и лимфокинов.
Следует отметить, что иммунокомпетентные клетки не всегда играют положительную роль. Способность цитотоксических лимфоцитов разрушать зараженные вирусом клетки также может быть причиной развития иммунопатологических поражений органов и тканей. Кроме того, дендритные и макрофагальные клетки способны захватывать иммунные комплексы и сохранять их длительное время, что способствует развитию персистентной инфекции, обусловленной лентивирусами и вирусом алеутской болезни норок. А лимфоциты, являясь местом первичной латентной инфекции вирусом Эпштейн-Барр, способствуют распространению его в организме.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

— Валерия Максимовна, что такое иммунитет и есть ли он у новорожденных?
— Иммунитет — это способность противостоять агрессивным воздействиям внешней среды. На ребенка действуют совершенно разные факторы: от патогенных микроорганизмов и вирусов до аллергенов. Могут влиять на иммунитет грудничка и факторы внешней среды.
Раньше бытовало мнение, что ребенок рождается совсем без иммунитета, так как все девять месяцев находится в стерильной среде и ему незачем вырабатывать собственные иммунные клетки. Исследования последних лет доказывают, что формирование иммунитета новорожденного начинается еще внутриутробно.
Каким может быть иммунитет новорожденного ребенка
Врожденный иммунитет
- Иммунные клетки неспецифичны и воздействуют на любой чужеродный антиген, который попал в организм. Это звено подключается моментально при первых признаках болезни.
Приобретенный иммунитет
- Специфические клетки-антитела образуются в ответ на попадание в организм антигена и формируются с первых секунд внеутробной жизни, когда ребенок встречается с какой-то проблемой. Антитела остаются в организме продолжительное время, иногда на всю жизнь, и могут помочь иммунной системе, если ребенок столкнется с той же проблемой повторно.
Формирование иммунитета у новорожденных происходит постепенно. Поддержать здоровье малышам помогают их мамы — сначала внутриутробно, затем с грудным молоком мать передает ребенку факторы иммунной защиты. Так происходит, пока иммунитет малыша не сформируется окончательно и он не будет готов к самостоятельному противостоянию окружающей среде.

— Каков иммунитет новорожденного ребенка и чем он отличается от иммунитета взрослого? Как формируется иммунитет у тех, кто только появился на свет?
— Иммунитет новорожденного отличается даже от иммунитета пятилетнего ребенка. Он еще незрелый, и для формирования иммунных реакций требуется время. Сначала мама передает малышу антитела для защиты через плаценту и грудное молоко, и как только ребенок становится способен вырабатывать собственные антитела, мамины перестают работать. У взрослого человека нет таких процессов: для возникновения иммунитета к заболеванию нужно им переболеть или пройти вакцинацию.
У новорожденных детей также существуют критические периоды — самые важные для формирования иммунитета. Прежде всего это первые месяцы жизни. Для малыша это настоящее испытание.
1 период — с рождения до одного месяца
Ребенок защищен мамиными антителами. Происходит знакомство с огромным количеством факторов окружающей среды (перемена среды обитания означает активное обсеменение микрофлорой, патогенными микроорганизмами).
2 период — три-четыре месяца
Мамины антитела перестают защищать малыша, происходит перестройка организма, и детскому иммунитету приходится справляться с угрозами самостоятельно.
3 период — взрослый ребенок и возраст 18+
В старшем возрасте критические периоды есть, но после 3 лет они связаны обычно со сменой привычной среды обитания (садик, школа и так далее), воздействием внешних факторов, а не перестройкой иммунитета.
— Когда у новорожденного появляется иммунитет?
— Иммунитет появляется еще внутриутробно, но полноценно начинает функционировать к 4—6-месячному возрасту. Конечно, все индивидуально и зависит от того, например, как протекала беременность, какое питание получала мама во время кормления грудью и кормит ли она грудью вообще.
Формирование иммунитета идет с первых секунд после рождения вплоть до 18 лет, да и в более старшем возрасте. На мой взгляд, иммунитет постоянно развивается, потому что сталкиваться с разными условиями внешней среды, которые стимулируют иммунную систему, можно беспрерывно.
— От чего зависит иммунитет у новорожденных детей на грудном вскармливании и какие факторы могут сказаться негативно на его формировании?
— По отношению к новорожденным факторы можно разделить на две группы, но в целом иммунитет напрямую зависит от нас самих, от окружающей среды.
Внутриутробные факторы
- состояние беременной, наличие токсикоза, гестоза
- питание, физическая активность беременной
- наличие/отсутствие у мамы вакцинаций
- состояние маминого иммунитета: наличие/отсутствие хронических, аллергических заболеваний, частота простудных заболеваний, особенности восприятия внешней среды
Внеутробные факторы
- кесарево сечение или естественные роды
- было ли выкладывание на живот, прикладывание к груди, получил ли ребенок молозиво сразу после рождения
- питание мамы при грудном вскармливании, достаточность макро- и микроэлементов, витаминов
- излишне теплая или не по погоде одежда новорожденного
- излишняя стерильность
- наличие/отсутствие вакцинации
— Правда ли, что новорожденные часто болеют ОРВИ? Как родителям определить, что болезнь протекает в пределах нормы и нет поводов для беспокойства?
— Новорожденные болеют ОРВИ независимо от вида питания, но чаще это действительно случается на искусственном вскармливании. Младенцы на грудном вскармливании получают фактор иммунозащиты от мамы. Поэтому тяжесть и продолжительность заболевания у грудничков могут быть разными.
Врачи всегда проявляют особую настороженность в случаях ОРВИ у маленьких детей. Поводов для беспокойства много, поэтому с появлением первых признаков заболевания нужно проконсультироваться с врачом и ни в коем случае не заниматься самолечением:
- ОРВИ часто протекает с катаральными явлениями, что у младенцев чревато проблемами;
- новорожденные во время болезни дышат ртом — процесс кормления становится невозможным, что приводит к осложнениям, которые трудно лечить;
- заболевание из легкой формы быстро переходит в тяжелую, когда присоединяется вторичная бактериальная инфекция.
— Как ухаживать за ребенком до того, как у него начнет формироваться собственный иммунитет?
— Особенностей в уходе нет. На начальных этапах нужна стерилизация того, что попадает в рот ребенку (не нужно держать соски и пустышки в свободном доступе). Но и фанатизм проявлять не стоит, иммунитет этого явно не оценит. Ребенок должен сталкиваться с патогенной микрофлорой в дозированных небольших количествах, чтобы выработать к ним устойчивость и собственные антитела — и не болеть в будущем.
Также ребенка необходимо одевать по погоде, соблюдать правила простой гигиены, смотреть за его питанием, весо-ростовыми прибавками. Тогда не будет и проблем с иммунитетом.
Как укрепить иммунитет малыша
- Закаливание. Закаливание повышает сопротивляемость организма инфекциям. Его можно начинать с первых дней жизни и сопровождать водными процедурами: первые купания устраивать в воде температурой 37 °C. Потом ее можно постепенно понижать до 25—26 °C.
- Грудное вскармливание. Чтобы укрепить иммунитет ребенка через грудное молоко, для мамы нет специального рациона. Она просто должна питаться здоровой правильной пищей — разнообразно, полноценно, без диет типа гречки с куриной грудкой, чтобы получать все белки, жиры, углеводы, витамины и минералы. Витаминно-минеральный дефицит восполняют эндогенным путем под наблюдением специалиста.
- Народные средства. Чеснок, лук содержат природные фитонциды, которые обладают обеззараживающим эффектом. Но в больших количествах и постоянно к ним прибегать не совсем комфортно. Проще поставить дома различные дизсредства и обеззараживатели воздуха.
- Фармпрепараты, витамины при грудном вскармливании. По последним рекомендациям кормящим женщинам не назначают поливитаминные комплексы, хотя многие мамы любят накупить массу пилюль разного назначения (и с идентичными составами). В итоге ребенок съедает огромные дозы ненужных витаминов. Вопрос о витаминах должен решаться с врачом после сдачи анализов. При дефиците какого-либо вещества врач определяет, будет ли ребенок получать его эндогенно либо восполнять недостаток с пищей.
- Искусственное вскармливание. Ребенок-искусственник получает необходимые витамины и минералы из смеси. Современные адаптированные смеси сбалансированы по витаминно-минеральному составу и дневной норме, поэтому дополнительные препараты ребенку не требуются. В период болезни или патологии, при которой конкретный макро-, микроэлемент или витамин нужен в большем количестве, он отдельно назначается врачом. Среднестатистическому здоровому малышу ничего принимать не нужно.
- Психологический комфорт и отсутствие стресса. Стресс — один из мощнейших факторов подрыва иммунозащиты. Нервная система затрачивает много ресурсов на восстановление стабильного состояния, от чего страдают другие органы и системы, в том числе иммунная. Важно, чтобы стресса не было не только у ребенка, но и у мамы, а в доме сохранялась благоприятная обстановка. Если мама получает адекватное количество минералов и витаминов, но находится в постоянном стрессе и возбуждении, не факт, что полезные вещества дойдут до грудничка.
— Валерия Максимовна, какие ошибки допускают родители, когда начинают укреплять детский иммунитет?
— Фанатизм — самая огромная проблема. Бывает, что в доме для укрепления иммунитета стоит 1000 и 1 баночка, и ребенок получает огромные дозы витаминов. Все должно быть в меру, ведь проблемы возникают не только из-за недостатка, но и из-за избытка определенных веществ. Витаминные препараты и иммуномодуляторы принимаются в крайнем случае и только по рекомендации врача, а приоритетным будет правильное питание. Все рекомендации по физическим методам укрепления иммунитета также нужно выполнять аккуратно.

— Скажется ли на иммунитете младенца искусственное вскармливание?
— Некоторые факторы защиты малыш получит внутриутробно, но потом на искусственном вскармливании ему придется сложнее, чем малышу, получающему грудное питание. Вероятность заболеть у ребенка-искусственника выше, так как иммунитет еще несовершенен, и ему сложно вырабатывать нужные антитела. Болезнь может протекать более длительно и тяжело.
Дети ежедневно сталкиваются с массой всего нового. С грудным молоком им передаются не только специфические антитела к вирусам и бактериям, которые мама получила, пережив заболевания, но также факторы неспецифического иммунитета — те первые иммунные клетки, которые являются барьером между внешней и внутренней средой организма. У малышей на искусственном вскармливании такого не будет.
— Каким должен быть состав детской смеси для становления крепкого иммунитета?
— Этим вопросом озабочены все компании по производству детских смесей. В смесях нет специфических иммуноглобулинов, но присутствует адекватный состав витаминов и минералов, что очень важно для формирования иммунитета, а также лакто- и бифидофлора (кишечник — один из самых больших и важных иммунных органов).
Если состав молочной смеси максимально совпадает с грудным молоком, при формировании кишечника не запускаются аллергические механизмы. Ребенку такое питание будет комфортным, несмотря на чужеродный белок смеси.
При выборе смеси нужно учитывать:
- состав витаминов, минералов в физиологичной концентрации, которая соответствует дневной норме;
- наличие Омега-кислот, бифидо- или лактофлоры;
- отсутствие факторов (стабилизаторы, консерванты), вызывающих аллергические реакции в виде расстройства пищеварения, потому что при проблемах с кишечником возникнут проблемы и с иммунитетом.
Состав смеси МАМАКО ® Premium очень хорошо подобран по возрастной норме, имеет нужные ребенку минералы, Омега-3 и Омега-6 жирные кислоты (для иммунитета, головного мозга), пре- и пробиотики (для формирования микрофлоры кишечника), а также козье молоко в основе (для профилактики аллергических реакций и питания детей с повышенной чувствительностью).
Иммунитет формируется во внутриутробный период, после рождения и на протяжении всей жизни. Основные механизмы, которые обеспечивают защиту малыша, вырабатываются к трехмесячному возрасту. До этого времени грудное молоко помогает организму сопротивляться болезням, микроорганизмам и вирусам. Для того чтобы укрепить иммунитет малыша на грудном вскармливании, кормящей маме достаточно сбалансированно и правильно питаться. Ребенок на искусственном вскармливании получает необходимые для иммунитета нутриенты из адаптированной молочной смеси. Если вы обеспокоены иммунитетом новорожденного, важно проконсультироваться с педиатром и ни в коем случае не применять поливитамины и комплексы для поддержки иммунной системы без назначения врача.
*Идеальным питанием для грудного ребенка является молоко матери. ВОЗ рекомендует исключительно грудное вскармливание в первые 6 мес. МАМАКО ® поддерживает данную рекомендацию. Перед введением в рацион малыша новых продуктов проконсультируйтесь со специалистом.
Синтез иммуноглобулинов плодом. Иммунная реактивность иммунитета ребенка
R. Van Furth и соавт. (1966) наблюдали без выраженной инфекции синтез IgM и IgG в клетках периферической крови и пиронинофильных клетках селезенки начиная с 20-й недели внутриутробного развития. Затем синтез этих иммуноглобулинов быстро увеличивается и к 40 нед содержание их соответствует цифрам в сыворотке матери [Fulgeniti V., Sieber О., 1973]. Однако, хотя продукция антител и возможна, количество клеток, способных синтезировать антитела, недостаточно и уровень циркулирующих антител у плода остается низким. Данные Л. С. Лозовской (1973) о повышении содержания IgG в крови здорового доношенного новорожденного по сравнению с кровью матери подтверждает возможность самостоятельного синтеза антител плодом. Интересны данные Ю. М. Резникова (1975), который показал, что у новорожденных с очень высокой степенью недоношенности концентрация IgG в сыворотке крови пупочного канатика не снижалась, как это происходит у здоровых доношенных новорожденных, что связано с катаболизмом материнских иммуноглобулинов.
Следовательно, у таких маленьких детей весь IgG — результат собственного синтеза.
По данным различных авторов, уровень IgM у здоровых новорожденных повышается в первые недели жизни, особенно выраженный подъем отмечается па 9—14-с сутки жизни, в возрасте 1 мес происходит некоторое снижение содержания IgM, а к 2—4 годам концентрация его достигает уровня взрослого.
IgA в сыворотке крови здоровых доношенных новорожденных отсутствует в течение 1-го месяца жизни. В дальнейшем уровень IgA в крови медленно нарастает, достигая к концу 1-го года жизни 28% уровня взрослых, а к 8—15 годам достигает этого уровня [Vivell О., 1970]. Секреторный IgA, синтезируемый эпителиальными клетками слизистых оболочек органов, соприкасающихся с внешней средой, появляется к 5—7-м суткам жизни, а максимальных значений достигает к 10—11 годам [Стефани Д. В. и др., 1977]. IgD появляется на 6-й неделе жизни и, постепенно нарастая, достигает уровня взрослых к 5 или 10—15 годам [Vivell О., 1970]. IgE также практически не определяется у новорожденных, а уровня взрослых достигает к 11—12 годам [Berg Т., Johanson G., 1969].
Таким образом, новорожденный способен к синтезу антител, но невосприимчивость его к инфекции связана с передачей от матери к плоду антител, комплемента и других факторов, обусловливающих специфическую и неспецифическую реактивность ребенка, особенно в первые сутки его жизни. У человека плод получает антитела от матери только до рождения.
Рядом исследований показано, что плацентарный барьер обладает избирательной проницаемостью для IgG, который содержит основную массу антител, обеспечивающих пассивный иммунитет. Переход IgG начинается с 13 нед беременности, но наилучшие условия для трансплацентарной передачи создаются во второй половине беременности, когда слои плаценты наиболее тонки, а сосудистая система хорошо развита, поэтому содержание IgG у недоношенных тем ниже, чем больше срок недонашивания.
Сразу же после рождения начинается катаболизм пассивно полученного IgG, содержание которого максимально снижается к 6—9 мес.
При развитии инфекционных заболеваний вирусного и бактериального происхождения мобилизуются неспецифические факторы защиты (вначале) и специфический иммунитет.
Изучение иммунологической реактивности ребенка в возрастном аспекте показало, что существенная часть антител, обнаруживаемая у детей первого полугода жизни, так же как и у старших детей, синтезируется в организме в связи с его инфицированием, причем прежде всего происходит повышение IgM. Исследуя противовирусный иммунитет, Л. С. Лозовская (1973) показала высокую регулярность иммунного ответа на инфекцию у детей первых 4 мес жизни и в то же время обнаружила недостаточность антителообразования у этих детей. Это объясняется как относительно низкой продуктивностью лимфоидной ткани, так и интенсивным катаболизмом антител. В настоящее время доказана продукция IgA, IgM и IgG в организме новорожденных на фоне инфекции, но она слабо выражена вследствие незрелости иммунной системы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Иммунная система ребенка начинает формироваться еще во время внутриутробного развития, когда между его организмом и организмом матери устанавливаются крепкие связи. В первые месяцы жизни ребенка защищают материнские антитела, так как синтезировать собственные иммуноглобулины организм малыша практически не способен. Нужное количество антител приближается к взрослым показателям только к 3-5 годам жизни ребенка.
Выделяют пять критических периодов в жизни детей, которые влияют на процесс формирования иммунной системы:
1. Период новорожденности (до 28 дня жизни ребенка).
Малыш находится под защитой материнского иммунитета, в то время, как его собственная иммунная система еще только начинает формироваться. Организм ребенка восприимчив к воздействию различного рода вирусных инфекций, особенно, к тем, от которых мама не передала малышу свои антитела. В это время крайне важно наладить и сохранить грудное вскармливание, так как грудное молоко – лучшая защита для малыша.
2. Период с 3 по 6 месяц жизни ребенка.
В это время в организме малыша разрушаются материнские антитела, формируется активный иммунитет. В этот период особенно активно начинают действовать вирусы ОРВИ. Кроме того, малыши легко могут подхватить кишечную инфекцию и перенести воспалительные заболеваниями органов дыхания. Малыш может не приобрести от матери антител к таким болезням, как коклюш, краснуха, ветрянка, если у нее нет прививок или она не переболела ими в детстве. Тогда велик риск того, что эти болезни могут протекать у малыша в довольно тяжелой форме. Велика вероятность повторения болезни, потому что иммунологическая память младенца еще не оформилась. Также велик риск возникновения аллергии у ребенка, прежде всего на пищевые продукты.
3. Период со 2 по 3 год жизни малыша.
Ребенок активно познает окружающий его мир, но в работе его иммунитета по-прежнему преобладает первичный иммунный ответ, а система местного иммунитета и выработка антител типа А остается довольно незрелой. Дети в этот период наиболее подвержены бактериальным, а не вирусным инфекциям, которые могут повторяться неоднократно.
4. Возраст 6-7 лет.
В этот период у ребенка уже есть багаж с накопленным активным иммунитетом. Тем не менее, родителям стоит беспокоиться о том, что болезнь может принять хронический характер. Кроме того, велик риск появления аллергических реакций.
5. Подростковый возраст.
У девочек он начинается в 12-13 лет, у мальчиков чуть позже – в 14-15 лет. В это время происходит бурный рост и гормональная перестройка организма, которые сочетаются с уменьшением лимфоидных органов. Хронические заболевания дают о себе знать с новой силой. Кроме того, иммунная система ребенка проходит испытания, если подросток сталкивается с вредными привычками.
Слабый иммунитет: основные признаки
Признаки пониженного иммунитета у детей:
- Диатез в раннем возрасте.
- У ребенка часто наблюдаются затяжные острые отиты, а насморк непременно преобразуется в синусит или гайморит. Возникают проблемы с аденоидами, а также небными миндалинами.
- Постоянная плаксивость и раздраженность, плохой недолговременный сон.
- Плохой аппетит.
- Бледная кожа.
- Плохая работа кишечника. Стул нерегулярный или слишком частный, либо жидкий, либо малышу трудно опорожнить кишечник.
- Ребенок восстанавливается очень долго после того, как переболел.
- Частое появление грибковых инфекций.
Факторы, снижающие детский иммунитет
Причины пониженного иммунитета у грудных детей:
- Травма во время прохождения по родовым путям.
- Тяжелое течение беременности.
- Плохая наследственность и предрасположенность к инфекционным заболеваниям.
- Малыш отказался от грудного молока, не достигнув и шестимесячного возраста.
- Неправильный прикорм с избытком или недостатком необходимых пищевых элементов.
- Сбой в работе ЖКТ.
- Передозировка лекарствами.
- Тяжелая психологическая травма.
- Плохая экология, особенно, в районах с повышенной радиацией.
Причины снижения иммунитета у детей школьного возраста:
- Повторяющиеся болезни уха, горла, носа.
- Неправильное питание, включая употребление в пищу продуктов, в которых превышено содержание нитратов или пестицидов.
- Стресс и постоянное нервное напряжение.
- Возникновение конфликтов, приводящих к непониманию и неприятию в коллективе.
- Злоупотреблением телевизором, компьютером, другими современными гаджетами.
- Минимальное количество времени ребенок проводит на улице, не отдыхает. Усталость и непосильные нагрузки: школа плюс множество дополнительных кружков и секций.
- Весной и осенью ежегодно обостряется аллергия.
Если иммунитет у ребенка слабый, то необходимо его укреплять.
Как укрепить иммунитет детей без лекарств?
Каждый родитель нацелен на то, чтобы защитить своего ребенка от простуд и болезней. Поэтому мам и пап интересует вопрос о том, как укрепить иммунитет своего малыша.
Но, более важный вопрос состоит в том, как не прибегая к лекарственным препаратам, улучшить работу иммунной системы ребенка.
Для укрепления иммунитета родителям следует приучить ребенка к правильному режиму, здоровому питанию и закаливанию. Ниже рассмотрим, как это можно сделать.
Чтобы ребенок рос здоровым и сильным, он не должен переутомляться и истощаться, иначе организм будет слабым и подверженным к инфекциям. В этом важную роль играет дневной и ночной сон.
Зарядка
Без физических нагрузок иммунитет укрепить не получится. Поэтому обязательно следует разминать все мышцы тела после ночного сна. Зарядка должна занимать в день не менее 15-ти минут. Благодаря упражнениям в тонус приходят не только мышцы, но и внутренние органы, а также ЖКТ.
Прогулки на свежем воздухе
Без свежего воздуха ребенок не может чувствовать себя бодро, поэтому важно ежедневно выходить с ребенком на прогулку.
Закаливание
Закаливание – идеальный метод для выработки крепкого иммунитета у малыша. Рекомендуется начинать закаливать ребенка с года, когда он более-менее окреп физически.
Питание
Для повышения иммунитета следует большое внимание уделить питанию , так как главным условием для формирования сильного иммунитета является кишечник.
Для укрепления иммунитета в меню ребенка надо включать:
Белки. Самое большое количество белка содержится в мясе. Малышам и детям до 7 лет рекомендуется готовить блюда из легкоусвояемого мяса индейки, курицы и телятины.
Овощи. Особенно полезны брокколи и патиссоны. Они содержат большое количество хлорофилла, который защищает организм от внешней агрессии среды. Не менее благотворно влияют на работу иммунитета блюда из свежей моркови, в которой содержится огромное количество кератина. Любые овощи полезны для растущего организма. Важно умеренно кормить детей картофелем, ведь в нем много крахмала, а для детского желудка это не очень полезно.
Фрукты. В цитрусовых содержатся витамин С и каротин. При отсутствии у ребенка аллергии на апельсины, мандарины, грейпфруты, их стоит включать в меню ребенка в умеренных количествах. Железо, кальций, калий, фосфор, витамин А и В можно найти в яблоках, вишнях, бананах, киви.
Молочные продукты. Кефир, молоко, ряженка, сыр. Эти продукты источник кальция и микроэлементов.
Заместитель главного врача по поликлиническому разделу работы КГБ №3 - Чернявская Л. В.
Статья посвящена актуальной проблеме современной медицины – течению инфекции вируса Эпштейн – Барр у детей. Была обследована группа детей (n=10) в возрасте от 5 до 10 лет с субфебрилитетом неясного генеза и проявлениями герпеса на губах с положительным ИФА на вирус Эпштейна – Барр (IgG-VCA в высоких титрах, IgG-EBNA, IgG-EA) и положительным ПЦР на ВЭБ. Выявлено, что при ЭБВИ существует два типа изменений иммунного статуса: повышение его активности (увеличение уровня иммуноглобулинов сыворотки IgA, IgM, повышение ЦИК, повышение CD16+ – натуральных киллеров, повышение или Т-хелперов CD4+, или Т-супрессоров CD8+) -1 вариант, иммунная дисфункция или недостаточность (повышение IgM, снижение CD25+ лимфоцитов, уменьшением CD16+, CD4+, CD8) – второй вариант.

1. Дидковский Н.А., Малашенкова И.К., Тазулахова Э.Б. Индукторы интерферона — новый перспективный класс имммуномодуляторов // Аллергология. – 1998. – № 4. – С. 26-32.
2. Егорова О. Н., Балабанова Р. М., Чувиров Г. Н. Значение антител к герпетическим вирусам, определяемых у больных с ревматическими заболеваниями // Терапевтический архив. – 1998. – № 70(5). – С. 41-45.
3. Малашенкова И.К., Дидковский Н.А., Говорун В.М., Ильина Е.Н., Тазулахова Э.Б., Беликова М.М., Щепеткова И.Н. К вопросу о роли вируса Эпштейна – Барр в развитии синдрома хронической усталости и иммунной дисфункции.
4. Christian Brander and Bruce D Walker Modulation of host immune responses by clinically relevant human DNA and RNA viruses // Current Opinion in Microbiology 2000, 3:379-386.
5. Cruchley A. T., Williams D. M., Niedobitek G. Epstein – Barr virus: biology and disease // Oral Dis 1997 May; 3 Suppl 1: S153-S156.
6. Glenda C. Faulkner, Andrew S. Krajewski and Dorothy H. CrawfordA The ins and outs of EBV infction // Trends in Microbiology. 2000, 8: 185-189.
7. Jeffrey I. Cohen The biology of Epstein – Barr virus: lessons learned from the virus and the host // Current Opinion in Immunology. 1999. 11: 365-370.
8. Epstein M.A., Achong B.G., Barr Y.M. Virus particles in cultured lymphoblasts from Burkitt’s lymphoma.// Lancet 1964; 1: 702-3.
9. Henle G, Henle W, Clifford P. et al. Antibodies to Epstein – Barr virus in Burkitt’s lymphoma and control group.// J. Natl. Cancer Inst. 1969; 43: 1147-57.
Эпштейн – Барр вирусная инфекция (ЭБВИ), является одним из самых распространенных заболеваний человека. По данным ВОЗ вирусом Эпштейн – Барр инфицировано около 55–60 % детей раннего возраста (до 3х лет), подавляющее большинство взрослого населения планеты (90–98 %) имеют антитела к ВЭБ.
Заболеваемость в разных странах мира колеблется от 3-5 до 45 случаев на 100 тыс. населения и является довольно высоким показателем. ЭБВИ относится к группе неуправляемых инфекций, при которых нет специфической профилактики (вакцинации), что, безусловно, влияет на уровень заболеваемости 2.
Эпштейн – Барр вирусная инфекция – острое или хроническое инфекционное заболевание человека, вызываемое вирусом Эпштейн – Барр из семейства герпетических вирусов (Herpesviridae), обладающим излюбленной особенностью поражения лимфоретикулярной и иммунной систем организма.
При первичном заражении после активного увеличения количества вирионов в эпителиальной ткани они попадают в кровь и разносятся по всему организму. Большое количество их помимо слюнных желез обнаруживается также в клетках шейки матки, печени и селезёнки. Главной мишенью их становятся В-лимфоциты, клетки иммунной системы.
Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение клеток, а наоборот – стимулирует их клонирование. В результате в острой фазе заражения количество лимфоцитов лавинообразно увеличивается, они заполняют лимфатические узлы, вызывая их набухание и уплотнение.
Поскольку В-лимфоциты сами по себе являются защитными клетками организма, заражение их вирусом приводит к подрыву иммунитета. Однако сами заражённые лимфоциты достаточно быстро и эффективно уничтожаются клеточными системами защиты — Т-лимфоцитами, Т-супрессорами и NK-лимфоцитами. При этом сами эти типы клеток вирусом Эпштейна – Барр не поражаются, и потому в любом случае играют важную роль в борьбе с вирусом. Однако при иммунодефиците их количество столь мало, что сдержать развитие инфекции они не могут.
Хроническая ВЭБ-инфекция формируется не ранее, чем через 6 месяцев после перенесенной острой инфекции, а при отсутствии острого мононуклеоза в анамнезе – через 6 и более месяцев после инфицирования. Нередко латентная форма инфекции при снижении иммунитета переходит в хроническую инфекцию.
Хроническая ВЭБ инфекция может протекать в виде: хронической активной ВЭБ-инфекции, гемофагоцитарного синдрома, ассоциированного с ВЭБ, атипичных форм ВЭБ (рецидивирующие бактериальные, грибковые и другие инфекции пищеварительной системы, дыхательных путей, кожи и слизистых оболочек) 7.
Хроническая активная ВЭБ-инфекция характеризуется длительным течением и частыми рецидивами. Больных беспокоит слабость, повышенная утомляемость, чрезмерная потливость, длительная небольшая температура до 37,2–37,5°, кожные высыпания, иногда суставной синдром, боли в мышцах туловища и конечностей, тяжесть в правом подреберье, чувство дискомфорта в области горла, небольшой кашель и заложенность в носу, у некоторых пациентов неврологические расстройства – беспричинные головные боли, нарушения памяти, нарушения сна. Нередко пациенты жалуются на увеличение одного или группы лимфоузлов, возможно увеличение внутренних органов (селезенка и печень) 6. Наряду с такими жалобами при расспросе больного выясняется наличие в последнее время частых простудных инфекций, грибковых заболеваний, присоединение других герпетических болезней (например, простой герпес на губах).
Цель исследования: изучить особенности иммунитета у детей с хроническим течением ( cубфебрилитет неясного генеза) инфекции вируса Эпштейна – Барр.
Материалы и методы
Была обследована группа детей (n=10) в возрасте от 5 до 10 лет с субфебрилитетом неясного генеза и проявлениями герпеса на губах с положительным ИФА на вирус Эпштейна – Барр (IgG-VCAв высоких титрах, IgG-EBNA,IgG-EA) и положительным ПЦР на ВЭБ (табл 1). Также была обследована группа здоровых детей (n=10), сравниваемые группы детей сопоставимы по возрасту.
Всем детям проведено обследование иммунного статуса (CD3+,CD4+, CD8+, CD16+, CD22+, IgA, IgG, IgM, IgE) на базе Национального центра медицины Республики Саха (Якутия).
У всех детей с хроническим течением ЭВБИ отмечалась субфебрильная температура, головная боль, рецидивы ОРВИ, ангин, фарингитов, повышенную потливость, утомляемость, раздражительность.
Определение антител к антигенам вируса Эпштейна – Барр является важным методом диагностики данной инфекции. Наиболее важные в диагностическом плане антитела представлены ниже:
Читайте также:

