Щадящие хирургические вмешательства и интерактивные повязки в лечении инфицированных ран
Обновлено: 24.04.2024
Инфекция - от латинского слова inficio (заражать). Он означает угрозу организму, которую представляют другие организмы (бактерии, вирусы, различные паразиты) вступающие с ним во взаимодействие.
Микроорганизмы живут на коже и даже в коже человека (в потовых железах, волосяных фоликулах). Их огромное количество (до 10 миллионов на 1кв сантиметр кожи). В обычных условиях они безвредны и даже полезны, так как защищают нас от других опасных микроорганизмов. Они питаются продуктами обмена веществ выделяюмися через кожу. Но бывает, при повреждении кожи, они проникают внутрь, и начинают слишком быстро размножаться. Инфекция может привезти к нагноению. Практика показала, что наиболее эффективна в борьбе с инфекцией повязка Acticoat. Купить ее можно в специализированном разделе каталога.
Если вы столкнулись с необходимостью лечить инфицированную рану, то в этой статье мы опишем, как сделать это в домашних условиях. Также вы найдете ответы на такие вопросы: как очистить рану от инфекции, какие современные средства применяются для очистки раны от некротических тканей, как вылечить незаживающие раны (в том числе раны при диабете стопы).
Основные термины
РАНА - нарушение целостности кожи или слизистых на всю их толщину (возможно также повреждение подлежащих тканей; ссадины – это НЕ раны, т.к. повреждение кожи поверхностное).
- Асептическаие раны - наносятся хирургическим инструментом в стерильных условиях.
- Контаминированные (обсемененные) – любые раны, нанесенные в нестерильных условиях.
Инфицированными считаются те раны, количество микроорганизмов в которых представляет опасность (превышает критический уровень 10 в 5 степени на грамм ткани). Со временем, разрушенные клетки тканей, лейкоциты, живые и мёртвые микроорганизмы смешиваются с выделяющейся в рану жидкостью, таким образом появляется гной, такую инфицированную рану называют гнойная рана.
Тут важно заметить, что даже асептические (хирургические) раны могут в определенных условиях стать контаминированными и даже инфицированными (и гнойными). Дело в том, что простерилизовать кожу невозможно, какими бы средствами вы не пользовались. И если происходит разрыв или разрез кожи (даже скальпелем хирурга), то какая-то часть микроорганизмов попадает внутрь: в место скопления огромного количества питательных веществ. И, конечно, микроорганизмы сразу начинают быстро размножаться. Они и могут стать причиной возникновения инфицированной раны.
Повязки для лечения инфицированных ран






Как понять, что рана инфицирована
Инфицированная рана отличается от других по внешнему виду. Вокруг неё и в ней присутствуют, так называемые, признаки воспаления: покраснение, местное повышение температуры (кожа вокруг раны горячая на ощупь), отёк (припухлость вокруг раны) и боль. Часто из раны выделяется гной (мутная жидкость, состоящая из лимфы, остатков погибших клеток, бактерий и лейкоцитов). Все эти симптомы, в том числе и боль, не враги, а помощники.
Безусловно, контроль врача во многих случаях очень важен, так как (и мы говорили об этом выше) наличие таких ран, может быть опасным, и, если у Вас нет достаточного опыта, то Вы можете недооценить серьезность ситуации (!). Врач, оценит можно ли лечить инфицированную рану в домашних условиях, и, если можно, то назначит антибиотики, чтобы подавить размножение бактерий в ране, и повязки, пропитанные различными лекарствами, в том числе гормональными препаратами. Так лечат раны много лет, однако здесь может возникнуть проблема: такое лечение может не оказать должного эффекта. мы потребляем много антибиотиков в пищу. Какую бы еду вы не еду вы не ели (если только вы не выращиваете ее сами), вы неизбежно потребляете антибиотики, которые попали туда при её выращивании и/или приготовлении. Поэтому бактерии, которые попали в рану с нашей кожи, в большинстве случаев, уже стали устойчивы к антибиотикам. В этом случае вылечить гнойную рану, заполненную такими невосприимчивыми к лекарствам микроорганизмами, будет трудно даже врачам. Поэтому, чтобы наверняка вылечить рану, мы рекомендуем вместе совместно с антибиотикотерапией использовать СОВРЕМЕННЫЕ средства для лечения ран.
Говоря слово "современные" имеются ввиду качественные, высокоэффективные лечебные повязки, способные влиять на ход раневого процесса, дать нашим клеткам то, что им нужно, или устранить из раны то, что мешает их развитию.
Антисептические повязки
Пока рана не очистится, заживать она не будет. Начав лечить гнойную рану, для начала постарайтесь её очистить от нагноения при помощи хлоргексидина или перекиси водорода только после этого можно накладывать лечебные повязки.
- сухих инфицированных ран (сухая, покрасневшая, горячая, болезненная рана);
- ран с небольшим количеством выделяемой жидкости (экссудата) и для профилактики инфицирования чистых ран.
Очищая от микроорганизмов, FIBROTUL AG (Фибротюль) не прилипнет к ране. Для этого она специально пропитана мягким парафином, кроме того, в ней много геля, который передаст необходимую для начала заживления влагу. Закрепить повязку можно обычным бинтом, а можно специальной медицинской плёнкой (не всякую плёнку можно накладывать на рану) типа Opsite Flexigrid (Опсайт Флексигрид) или IV3000 (Ай Ви 3000). Бинт немного промокает из-за геля, плёночная же повязка, всю необходимую влагу в ране сохранит, и как бинт обеспечит доступ кислорода (в этом уникальность медицинской плёнки Reactic). Через 2 дня повязку FIBROTUL AG (Фибротюль) нужно заменить. По состоянию раны вы увидите, нужно ли наложить ту же повязку. Если рана перестала быть воспаленной (инфицированной), начала заживать то дальнейшее применение антисептических повязок может быть полезным как дополнительная для профилактика инфицирования. Есть повязка повязка Bactigras (Бактиграс), которая подобна по действию FIBROTUL AG (Фибротюль), но в её составе присутствует не серебро, а хлоргексидином. Как и FIBROTUL AG (Фибротюль) её можно применять на сухих инфицированных ранах, но это ещё и самая лучшая повязка для комплексного лечения ран с обильным отделяемым. Она представляет собой крупноячеистую сетку (кстати, тоже пропитанную мягким парафином, чтобы не прилипать к ране), и её можно использовать как прокладку между раной и другими повязками. Хлоргексидин будет выделяться из сетки и подавлять рост бактерий в ране, а лишняя жидкость из раны (экссудат) будет проходить сквозь ячейки во впитывающую повязку. В качестве впитывающей, можно использовать как марлевые, так и другие повязки, например, Melolin.
Если же вы хотите полного удобства, то возьмите готовую повязку-пластырь со впитывающей подушечкой Primapor. Её края легко приклеятся к здоровой коже вокруг раны, и Вам не нужно будет думать о дополнительной фиксации, как в случае с дезинфицирующей повязки Bactigras (Бактиграс).
Самая мощная повязка от инфекции - "Актикот с серебром"
Правила наложения повязок Актикот
- Промойте рану хлоргексидином или перекисью водорода.
- Выньте повязку Актикот или Актикот-7 из индивидуальной упаковки и положите её на рану (любой стороной).
- Теперь нужно убедиться, что повязка достаточно смочена. Дело в том, что для выхода ионов серебра из нанокристаллов, необходима влажная среда. То есть, В СУХОМ СОСТОЯНИИ АКТИКОТ НЕ РАБОТАЕТ! Тут может быть 2 варианта: либо рана сама по себе влажная, из неё течёт (тогда можно на Актикот положить повязку с впитывающей подушечкой типа Melolin или готовой повязки Primapore (Примапор)), либо рана недостаточно влажная и тогда Актикот нужно смочить.
- ВАЖНО:смачивать Актикот нужно стерильной водой, но ни в коем случае не физ. раствором (не хлорида натрием), или Вы испортите повязку, и она не сработает.
- Смоченную повязку, если нет обильно отделяющейся жидкости накройте плёночной повязкой типа Opsite Flexigrid (Опсайт Флексигрид - специальная плёнка) или Opsite Post Op (Опсайт Пост Оп - плёночная повязка с впитывающей подушечкой, на случай появления экссудата). и Актикот-7 может находиться на ране без замены до 3 и 7 дней, непрерывно очищая рану.
Победа над инфекцией, это первая, но самая важная победа в лечении инфицированных ран. Результат Вы увидите: организм перестал бить тревогу, кожа вокруг раны уже не красная, и все признаки воспаления, которые мы описывали выше, сошли на нет. Лечение раны ещё займет время, но рана уже перестала быть инфицированной и организму теперь будет легче восстановить повреждённые ткани.
Хронические раны (незаживающие раны) и их лечение
Некоторые раны появляются быстро (например, хирург, делая операцию, разрезает кожу – это острая рана; укус собаки – острая рана; и т.п.), а некоторые постепенно и потом долго не заживают. Такие раны называют хроническими.
Представьте себе железную дорогу, по которой постоянно курсируют поезда с продовольствием снабжая всем необходимым жителей города. Пока поставки регулярны, город живёт и процветает, но стоит сократить поставки в несколько раз и в городе начнётся голод. То же самое с питанием клеток: если сосуды не в состоянии пропускать через себя достаточное количество крови, богатой питательными веществами и кислородом, то сначала клетки начнут голодать, а после гибнуть. На месте некогда живой, здоровой ткани возникает поле мёртвых клеток (некроз), не только бесполезных, но и несущих вред организму. Эти мёртвые клетки не связаны между собой так, как живые, они разрушаются, становясь питательной средой для микроорганизмов и, как следствие постоянным источником инфекции.
Пока в ране находятся мёртвые ткани, она не заживёт. Погибшие клетки больше не выполняют своих функций, но занимают место, мешая развитию живой ткани. Очищение раны от некроза трудная задача для организма, часто непосильная, ему нужна помощь. Таким образом, удалить некроз из раны – Ваша первоочередная задача.
Очищение раны от некроза
Pico (Пико) - инновационная система для создания отрицательного давления в ране, в домашних условиях.
Теперь о том, как работает система Pico (Пико)
Подводя итог:
Как видите, современные средства помогут вылечить инфицированные раны, гнойные раны, в том числе при сахарном диабете.
При возникновении сомнений - звоните. Имейте ввиду, что у всех лечебных средств, в том числе и лечебных повязок, есть противопоказания, и для хорошего результата важен правильный их подбор.
Для цитирования: Чадаев А.П., Климиашвили А.Д. Современные методики местного медикаментозного лечения инфицированных ран. РМЖ. 2002;26:1211.
Российский государственный медицинский университет
ГКБ № 4, Москва
Н аложение лекарственных средств на раневую поверхность применялось испокон веков для лечения ран. Но время, разумеется, вносило свои коррективы: менялись взгляды на течение раневого процесса, появлялись новые лекарственные препараты, совершенствовались методы лечения.
Основные принципы деления процесса заживления ран на фазы или стадии течения были разработаны И.Г. Руфановым (1954), С.С. Гирголавом (1956), R. Ross (1968), В.И. Стручковым (1975) и М.И. Кузиным (1990). По современным представлениям, определяющим патогенетическую направленность лечебных мероприятий, раневой процесс разделяют на 3 фазы: воспаления, регенерации и реорганизации рубца с эпителизацией. В фазе воспаления вначале преобладают сосудистые реакции, характеризующие механизм воспаления, а затем происходит очищение раны от погибших тканей. Вторая фаза связана с образованием грануляционной ткани. Реорганизация рубца и эпителизация являются основными компонентами, завершающими течение раневого процесса.
Принцип подбора лекарственных средств и применения методов лечения, эффективных в той или иной фазе раневого процесса, практически отработан и традиционно не пересматривается в течение длительного времени. Медикаментозные средства используют в зависимости от конкретной фазы течения раневого процесса. Лекарственные средства, применяемые в фазе воспаления, должны оказывать антимикробный, дегидратирующий и некролитический эффекты. Препараты, используемые в фазах регенерации и реорганизации рубца с эпителизацией, должны обладать иными свойствами: стимулировать регенеративные процессы, способствуя росту грануляций и ускорению эпителизации, защищать грануляционную ткань от вторичной инфекции и подавлять рост вегетирующей в ране микрофлоры.
Совершенствование местного лечения направлено в основном на применение самых современных эффективных препаратов, и сложность подбора этих препаратов заключается в динамичном и многогранном течении процесса в зависимости от индивидуальных особенностей конкретного пациента.
В последнее время получило развитие новое направление в совершенствовании местного лечения – разработка носителей лекарственных средств. Положительное значение носителей лекарств было обнаружено еще в отношении иммобилизованных на них протеиназ (П.И. Толстых и др., 1985; В.К. Гостищев и др., 1986). На первых этапах внедрения в практику раневых покрытий использовались марлевые салфетки. Впоследствии при лечении различных по своей патогенетической природе ран применялись покрытия с самыми разнообразными фиксирующими материалами: от фильтровальной бумаги до различных многослойных многофункциональных материалов и перевязочных средств (И.А. Ерюхин, 1995; L. Flint, 1996).
Материал и методы
Левомеколь – мазь на водорастворимой основе полиэтиленоксида, содержащая левомицетин и метилурацил. Мазь обладает выраженной осмотической активностью и оказывает антимикробное и противовоспалительное действие. Метилурацил – пиримидиновое производное, стимулирует рост и размножение клеток за счет активации обменных процессов и, в частности, нуклеинового обмена. Изготовленный в виде 10% мази на жировой основе, препарат оказывает противовоспалительное действие, ускоряет заживление ран, не повреждая грануляций, но не обладает прямой противомикробной активностью. В фазе воспаления раневого процесса мы применяли левомеколь, а по мере формирования грануляций, то есть в фазе регенерации, заменяли ее 10% метилурациловой мазью.
Лечение проведено больным при открытом течении гнойных ран после вскрытия и хирургической обработки разнообразных заболеваний мягких тканей или вялотекущих гнойных процессов, так как главной задачей исследования являлось выяснение воздействия препаратов на раневой процесс независимо от причин их возникновения (табл. 2).
Результаты и обсуждение
Результаты лечения ран оценивали по клинической эффективности местного применения препаратов. В комплекс клинической оценки эффективности лечения были включены следующие параметры:
- сроки очищения ран;
- время появления грануляций;
- время появления эпителизации;
- индекс Поповой (СЗР) в процентном выражении.
Планиметрию раны для оценки скорости ее заживления проводили с помощью нанесения контуров раны на миллиметровую бумагу до начала лечения, а далее на 5, 7, 9, 11 и 15 дни в зависимости от объективных и субъективных факторов. Скорость заживления раны (СЗР) или индекс Поповой, выраженный в процентах, рассчитывали следующим образом:
ИП = (S – Sn) x 100/S x t
При этом S – величина площади раны при предшествующем измерении, Sn – величина площади раны в настоящий момент, t – число дней между первым и последующим измерением.
Результаты сравнительной оценки эффективности местного лечения гнойных ран при вторичном их заживлении в основной и контрольной группах представлены в табл. 3.
Изучен ассортимент препаратов местного применения для лечения ран в аптеках Новгородской области и рассмотрены принципы фармацевтической опеки. Было отмечено наличие широкого ассортимента препаратов с преимущественно антимикробным действием. В клинической практике мази на полиэтиленоксидной основе с антимикробными препаратами являются препаратами первого выбора для лечения гнойных заболеваний мягких тканей. Результаты исследования показали, что в 48% случаях врачами назначается мазь Левомеколь без учета патогенетической стадии раневого процесса. Продолжает широко применяться глазная тетрациклиновая мазь. Существует большой ассортимент безрецептурных препаратов, поэтому реализуется фармацевтическая опека для правильного выбора и рационального использования лекарственных препаратов. Также провизор должен уметь определять степень тяжести поражения у пациентов и контингент лиц с повреждениями, которые нуждаются в обязательной помощи врача.

1. Багирова В.Л., Демина Н.Б., Кулиниченко Н.А. Мази. Современный взгляд на лекарственную форму // Фармация. – 2002. – № 2. – С. 24–26.
2. Блатун Л.А. Местное медикаментозное лечение ран. Проблемы и новые возможности их решения // Сonsilium-medicum. – 2007. – №1. –Т. 9. – С. 9–16.
3. Блатун Л. А. Клинико-лабораторное изучение разных лекарственных форм банеоцина при лечении раневой инфекции / Л.А. Блатун, А.О. Жуков, Ю.А. Амирасланов, Р.П. Терехова и др. // Хирургия. Журнал им. Н.И. Пирогова. – 2009. – № 9. – С. 59–65.
5. Гундорова Р.А., Нероев В.В., Кашников В.В. Травмы глаза / Под ред. Р.А. Гундоровой, В.В. Нероева, В.В. Кашникова. – М.: ГЭОТАР-Медиа, 2009. – 560 с.
6. Кашников, В.В. Современные аспекты реабилитации пострадавших в чрезвычайных ситуациях // Офтальмохирургия и терапия. – 2001. – № 1. – С. 38–41.
7. Кузнецов Н.А. Щадящие хирургические вмешательства и интерактивные повязки в лечении инфицированных ран / Н. А. Кузнецов, В. Г. Никитин // Consilium medicum. Хирургия. − 2006. − Т. 8. − № 2. – С. 39–46.
8. Салахов, Э.Р., Какорина Е.П. Травмы и отравления в России и за рубежом // Проблемы социальной гигиены, здравоохранения и истории медицины. – 2004. – № 2. – С. 13–20.
9. Хирургические инфекции кожи и мягких тканей. Российские национальные рекомендации / Руководство под редакцией В.С. Савельева. М. – 2009. – 89 с.
10. Pulgar S., Mehra M., Quintana A. et al. The epidemiology of hospitalised cases of skin and soft tissue infection in Europe. 18th European Congress of Clinical Microbiology and Infectious Diseases. 2008, Barcelona, Spain, Abstr. P. 821.
Современные условия характеризуются повышенным травматизмом в результате различных чрезвычайных ситуаций, социальных конфликтов, экологических причин.
В структуре смертности населения травматизм занимает 3-е и 4-е место после сердечно-сосудистых заболеваний, злокачественных новообразований, болезней органов дыхания и инфекционных заболеваний [8]. Частота поражения органа зрения в общей структуре травматических повреждений у пострадавших достигает 15% [6]. При травмах органа зрения недостаточный контроль за динамикой посттравматических изменений [5] может привести к развитию гнойной инфекции в глазнице - одному из самых тяжелых осложнений, ведущих к потере зрительных функций.
Лечение больных с гнойными заболеваниями мягких тканей является актуальной задачей медицины. Количество больных с острыми гнойными заболеваниями мягких тканей достигает 30-35% среди всех хирургических больных [10]. Это связано с необоснованным применением антибактериальных препаратов, повышением агрессивности возбудителя.
В своем развитии раневой процесс проходит три фазы: первая фаза (гнойно-некротическая) характеризуется наличием некротических тканей и гнойного содержимого в ране. В фазе грануляции происходит очищение раны от гнойно-некротического содержимого. В третьей, заключительной, фазе эпителизируется раневая поверхность и формируется рубец [4, 9].
Использование лекарственных препаратов (ЛП) для наружного применения (мазей, гелей, порошков) позволяет проводить лечение путем воздействия на ту или иную стадию раневого процесса [2, 7].
Целью работы явилось изучение широты ассортимента мазей для лечения инфицированных ран мягких тканей и микротравм передней глазной поверхности, назначаемых врачами поликлиник и имеющихся в продажах в аптечных сетях Новгородской области, а также принципов фармацевтической опеки больных с данной патологией.
Средний возраст обратившихся был 57 ± 2,4 лет. Самый молодой больной был в возрасте 28 лет, самый старший - 92 года. Среди них мужчин было 18 человек, женщин - 32. Средние сроки лечения составили 23 ± 1,9 дней. Минимальное количество дней лечения - 5 дней, максимальное - 70. Также были изучены 15 амбулаторных карт больных, обратившихся в экстренном порядке к офтальмологу Новгородской клинической областной больницы с микротравмами передней глазной поверхности. В основном это молодые люди в возрасте от 16 до 35 лет, среди них 8 мужчин и 7 женщин.
Изучен ассортимент мазей в различных аптечных сетях Новгородской области.
Результаты и их обсуждение. Противовоспалительным действием обладают мази, содержащие серебро (Аргосульфан, Дермазин); мази с антибиотиками широкого спектра действия (Левомеколь, Левосин, Гентамицин и др.), а также ЛП, содержащие сильный антисептик (Мирамистин). При лечении ран применяется стандартный алгоритм (рис. 1).
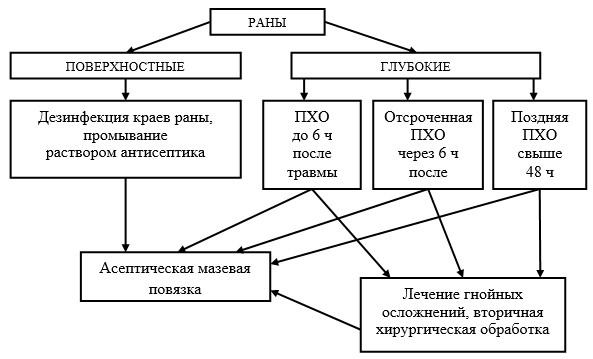
Рис. 1. Алгоритм лечения ран (ПХО - первичная хирургическая обработка)
Известен широкий ассортимент мазей на жировой и гидрофильной основе для использования на первом этапе раневого процесса. Большинство из них обладает противомикробным, противовоспалительным, ранозаживляющим действием. Это Аргосульфан, Мирамистин, Бактробан, Гентамицин, Стрептоцид, Диоксиколь, Ируксол-моно, Синтомицин, Левомиколь.
Основными недостатками мазей на жировой основе являются: плохое высвобождение лекарственной субстанции и проникновение ее вглубь тканей, нарушение оттока раневого содержимого и герметизация раны (Ируксол, Спасатель и др.). При лечении обширных (или глубоких) ран необходимо эти препараты комбинировать с системными средствами лечения. Мази на гидрофильной основе, монопрепараты (Аргосульфан, Дермазин, Бетадин) и комбинированные (Левомеколь, Левосин) имеют то преимущество, что они создают осмотическое равновесие между ЛП и поврежденной тканью, которое предотвращает обезвоживание тканей раны; обеспечивает хорошее высвобождение активных компонентов из основы и их глубокое проникновение в ткани. Недостатком монопрепаратов является однонаправленное действие (например, только антимикробное), поэтому необходимо применять дополнительные ЛП.
В настоящее время показано, что использование устаревших препаратов для местного лечения ран: мази Вишневского, стрептоцидовой, гентамициновой мази на жировой основе малоэффективно [3]. Поэтому в клинической практике для лечения гнойных ран в I фазе раневого процесса используют мази на полиэтиленоксидной основе [9].
В состав мазей на полиэтиленоксидной основе введены те или иные антимикробные препараты: левомицетин (Левосин, Левомеколь); диоксидин (5%-ная диоксидиновая мазь, Диоксиколь); йод с поливинил-пирролидоном (Повидон-йод, Бетадин); метронидазол и левомицетин (Метрокаин); нитазол (Стрептонитол); хинифурил (0,5%-ная мазь хинифурила); мафенид ацетат (10% мазь мафенида ацетата). В состав некоторых из этих мазей введены тримекаин с целью обезболивающего эффекта мази и метилурацил - с целью стимуляции процессов регенерации. Мази на полиэтиленоксидной основе отличаются продолжительностью осмотического эффекта, усиливают антимикробную активность ЛП.
Таким образом, комбинированные ЛП местного применения одновременно воздействуют на разные звенья раневого процесса (например, мазь Левомеколь обладает противомикробным, противовоспалительным, обезболивающим, ранозаживляющим, гиперосмолярным эффектом).
Наверное, поэтому, учитывая все преимущества мазей на полиэтиленоксидной основе, в качестве препарата первого выбора для местного лечения врачом-хирургом поликлиники в 48% случаев был назначен Левомеколь. Кроме всего, стоимость этого препарата в аптеке по сравнению с другими мазями на полиэтиленоксидной основе значительно ниже. В 1,5% случаев для лечения поверхностных ожоговых ран был назначен Олазоль.
Однако по мере очищения раны от гноя, т.е. в результате перехода раневого процесса во вторую и третью стадию раневого процесса, ни в одном случае не была проведена замена мази Левомеколь, хотя известно, что во второй стадии рекомендуют такие мази, как Бетадин, Аргосульфан, Вулнузан, Прополисная мазь, Стрептонитол, 5%-ный или 10%-ный Биопин. Способы лечения гнойных ран в III фазе совпадают со способами лечения гнойных ран в фазе регенерации (II фаза раневого процесса) [1]. Также обращает на себя внимание тот факт, что при затяжном течении и при наличии глубокого гнойного процесса всего 3 пациентам назначалась общая антибиотикотерапия, совсем не применялись иммуномодулирующие препараты и ферменты для промывания ран.
В случае присутствия травм в сочетании с поражениями глаз при санации первичного очага воспаления (обработка инфицированных ран орбиты, удаление инородных тел, дренирование пораженных пазух носа) в комплексе с антибиотикотерапией нежелательные явления быстро уменьшаются.
Нами был изучен ассортимент мазей в различных аптечных сетях Новгородской области. В структуре ассортимента преобладают препараты, отпускаемые без рецепта врача, поэтому они могут быть рекомендованы в рамках фармацевтического консультирования.
В аптеках имеются Аргосульфан, Бетадин, Повидон-йод, Дермазин, Мирамистин, Бактробан, гентамициновая, стрептоцидовая и синтомициновая мази, Левомеколь, Левосин, Метилурацил, Вулнузан, Прополисная мазь, Актовегин, Бепантен. Не оказалось в наличии таких мазей, как Диоксиколь, Ируксол, Стрептонитол, Метрокаин, Мафенида ацетат. Со слов аптечных работников, эти мази, как минимум, в течение последних двух лет не заказывают, поскольку на них практически нет спроса.
Глазные мази представляют собой однородные стерильные мази, кремы или гели, содержащие одно или более действующих веществ, растворенных или диспергированных в подходящей основе и предназначенные для нанесения на конъюнктиву глаза. Глазные мази должны быть стерильными, поэтому соблюдение асептических условий необходимо на всех стадиях производства для предотвращения контаминации исходного сырья и полупродуктов. Процесс изготовления ЛП должен завершаться стерилизацией готового продукта, либо в случае асептического производства все используемые компоненты должны быть стерильны. Основа для глазных мазей должна быть нейтральной, а также наряду с отсутствием раздражающего действия должна обладать хорошей распределяющей способностью и гидрофильностью, обеспечивающей совместимость со слезной жидкостью, не должна содержать каких-либо посторонних примесей.
На российском рынке ассортимент глазных мазей с антибактериальным действием не отличается широтой, присутствуют такие препараты, как: эритромициновая мазь 10 000 ЕД в 1 г (Россия), тетрациклиновая 1%-ная мазь (ОАО МПЗ, Россия), Флоксал - мазь 0,3%-ная (Германия), Офлоксацин (ОАО Синтез, Россия), Колбиоцин (С.И.Ф.И. С.п.А., Италия), Неттависк 0,3%-ная мазь нетилмицина (С.И.Ф.И. С.п.А., Италия).
Сразу после применения глазных мазей может возникнуть кратковременное нарушение остроты зрения, приводящее к замедлению психических и физических реакций, что, вероятно, ограничивает их применение в дневное время. В основном глазные мази с антибактериальным действием назначаются на ночь для усиления действия глазных капель.
Среди больных, обратившихся за неотложной медицинской помощью к офтальмологу в Новгородскую областную клиническую больницу, 9 человек были с инородными телами роговицы (окалина). Всем им после удаления инородного тела были назначены глазные капли антибактериального действия (ципрофлоксацин) и на ночь - глазная тетрациклиновая мазь. У 4 человек диагностирована эрозия роговицы, в комплексной терапии которой применен Корнерегель. В 2 случаях имелись рваные раны век, на которые после ПХО наложена асептическая повязка с тетрациклиновой мазью и больные направлены в поликлинику по месту жительства под наблюдение окулиста.
В аптеках Великого Новгорода широким спросом пользуются только эритромициновая мазь 10000 ЕД в 1 г, 1%-ная тетрациклиновая мазь и Корнерегель.
Важное место в репаративной терапии при травмах передней поверхности заняли мягкие глазные мази и гели (Вит-А-ПОС, Видисик, Корнерегель, Систейн-Баланс, Систейн-Гель, Офтагель, Визмед гель, Солкосерил), которые стимулируют репаративные процессы в роговице и имеются в аптеках Новгородской области.
Учитывая, что большое количество мазей отпускается без рецепта, большое значение приобретает фармацевтическая опека.
Фармацевтическая опека - это комплексная программа взаимодействия врача, провизора и пациента с момента отпуска ЛП до полного окончания его действия. Фармацевтическая опека пациента осуществляется в аптеке при отпуске безрецептурных препаратов. Выбор и рациональное использование указанных лекарств возможны только при условии, если работник аптеки владеет сведениями о характерных особенностях каждого из препаратов. В то же время провизор должен уметь определять степень тяжести поражения у пациентов, обращающихся в аптеку, определять контингент лиц с повреждениями, которые нуждаются в обязательной помощи врача.
Кроме того, необходимо помнить: если больной сказал, что его оцарапало или укусило животное или причина травмы - грязный предмет (ржавый гвоздь), следует обязательно напомнить посетителю о необходимости противостолбнячной прививки.
Фармацевтическая опека при применении мазей
При отпуске мази, содержащей антибактериальный препарат, провизор должен уточнить у пациента наличие повышенной чувствительности к антибиотикам.
- Не допускать сочетанного применения антибиотиков местного и системного действия из-за возможной их кумуляции.
- Обязательно следует рассказать пациенту, сколько раз в день следует применять данную мазь. При развитии аллергии или суперинфекции мазь следует отменить и обратиться к врачу.
- При лечении длительно незаживающей раны с обильным выделением отделяемого больному необходимо посоветовать применение витаминов группы В и особенно А и Е.
- При применении мазей, содержащих йод, возможно развитие аллергической реакции. Лицам с заболеваниями щитовидной железы мази, содержащие йод, можно применять только под контролем врача.
- Глазные мази следует использовать только на ночь во время ночного перерыва в ношении контактных линз. Большинство глазных капель и мазей противопоказано применять во время ношения контактных линз из-за опасности кумуляции как активного компонента, так и консервантов, входящих в состав препарата.
- После применения глазных мазей может возникнуть кратковременное нарушение остроты зрения. Поэтому не рекомендуется применять их непосредственно перед работой с механизмами и вождением автотранспорта.
- При назначении нескольких препаратов для лечения глаз необходимо напомнить пациенту о соблюдении интервала между закапываниями глазных капель не менее 15 мин во избежание снижения лечебного эффекта. Глазные гели и мази следует закладывать после закапывания глазных капель.
- При обработке ран спиртовые растворы антисептиков следует наносить на кожные покровы, избегая попадания в глубь раны, особенно при глубоком порезе. Не следует большие участки кожи обрабатывать раствором кислоты борной - возможны абсорбция через поврежденную кожу и системное токсическое действие. Всасывание борной кислоты через кожу и слизистые поверхности особенно велико у детей - возможно острое или хроническое отравление (тошнота, рвота, диарея, кожные высыпания, нарушение функции почек).
- У детей для обработки кожи вокруг раны предпочтительно использование водных растворов антисептических веществ. Применение мазей в педиатрии проводится по показаниям, аналогичным таковым у взрослых, и только после назначения педиатром или хирургом.
Рецензенты:
Сулиманов Р.А. д.м.н., профессор, заведующий кафедрой госпитальной хирургии заместитель директора института медицинского образования НовГУ, г. Великий Новгород.
В данной статье представлены результаты исследования растворимости современного антисептика октенидина дигидрохлорида в сочетании с различными поверхностно-активными веществами и полигексанидом. Было исследовано противомикробное влияние как отдельно взятых веществ, так и их смеси. Октенидин и полигексанид представляют собой антисептики нового поколения, характеризующиеся широким спектром действия и одновременно низкой цитотоксичностью. При этом известно, что октенидин действует быстрее, чем полигексанид. Согласно нашей гипотезе, совмещение этих двух веществ могло бы обладать ещё большим противомикробным действием, чем отдельно взятые вещества. Результаты, полученные в лаборатории, подтвердили, что смесь октенидина и полигексанида обладает более сильной противомикробной активность. Данная смесь может быть использована в различных медицинских продуктах и прежде всего в сочетании с раневыми повязками для борьбы с микроорганизмами в хронических ранах.

4. Кузнецов Н.А., Никитин В.Г. Щадящие хирургические вмешательства и интерактивные повязки в лечении инфицированных ран // Хирургия. – 2006. –Т. 8. – № 2. – С. 45.
5. Wolcott R.D, Rhoads D.D., Bennett M.E. Chronic wounds and the medical biofilm paradigm // J. Wound Care. – 2010. – № 19. – P. 45–53.
6. Sen C.K.; Gordillo, G.M., Roy S., Kirsner R., Lamber L., Hunt T.K., Gottrup F., Gurtner G.C., Longaker M.T. Human skin wounds: a major and snowballing threat to public health and the economy // WoundRepair Regen. – 2009. – № 17. – Р. 763–771.
7. Eigener U., Behrens U. Untersuchungsmethode zur Prüfung der Nachwirkung von Hautdesinfektionsmitteln // HygMed. – 1985. – № 10 (11). – P. 475–478.
8. Malinovskií N.N., Reshetnikov E.A., Rubashnaia I.E., Mal’nikova GN, Mitiukov AP. Antiseptics on the base of Octenidine Hydrochloride (russ) // Khirurgiya. – 1997. – № 8. – P. 8–10.
9. Koburger T., Hübner N.O., Braun M., Siebert J., Kramer A. Standardized comparison of antiseptic efficacy of triclosan, PVP-iodine, octenidine hydrochloride, polyhexanide and cyclohexidinedigluconate // J Antimicrob Chemother. – 2010. – № 65. – P. 1712–1719.
10. Bischoff M., Kinzl L., Schmelz A.. The complicatedwound // Unfallchirurg. – 1999. – № 102. – P. 797–804.
11. Kramer A., Adrian V., Rudolph P., Wurster S., Lippert H. Explantationstest mit Haut und Peritoneum der neonatalen Ratte als Voraussagetest zur Verträglichkeit lokaler Antiinfektiva für Wunden und Körperhöhlen // Chirurg. – 1998. – № 69. – P. 840–845.
12. Kramer A., Adrian V., Rudolph P., Kühl H. In-Vitro-Prüfung der Verträglichkeit ausgewählter antiseptischer Wirkstoffe bzw. Präparate. In: Kramer A., Wendt M., Werner H.P. (Hrsg): Möglichkeiten und Perspektiven der Klinischen Antiseptik. Wiesbaden. – 1995. – P. 41–48.
13. Kramer A., Müller G. Octenidinhydrochlorid. In: Kramer A., Assadian O.: Wallhäußers Praxis der Sterilisation, Desinfektion, Antiseptik und Konservierung – Qualitätssicherung der Hygiene in medizinischen und industriellen Bereichen. – Thieme Verlag, Stuttgart, 2008. – P. 799–805.
14. Hirsch T., Jacobsen F., Rittig A., Goertz O., Niederbichler A., Steinau H.U., Seipp H.M., Steinstraesser L. A comparative in vitro study of cell toxicity of clinically used antiseptics. Hautarzt. – 2009. – № 60. – P. 984–91.
15. Heyer K., Augustin M., Protz K., Herberger K., Spehr C., Rustenbach S.J. Effectiveness of Advanced versus Conventional Wound Dressings on Healing of Chronic Wounds: Systematic Review and Meta-Analysis. Dermatology. 2013 May 22 [Epub ahead of print].
Антисептики используются людьми со времён становления цивилизации. Широко известно, что древние египтяне бальзамировали мумии и таким образом предупреждали их гниение, а в Древнем Риме использовали мёд и вино для предотвращения нагноения ран. Современное развитие и широкое применение различных антисептических средств было положено такими выдающмимся учёными, как Листер, Склифосовский, Пирогов и многими другими. Современные успехи органической химии создали базу для дальнейшего развития и внедрения антисептиков в медицину [1].
К сожалению, необходимо отметить, что не все существующие антисептики могут быть использованы в борьбе с микроорганизмами, инфицирующими послеоперационные и прежде всего хронические раны. Среди недостатков многих современных антисептиков можно указать интенсивный собственный цвет продукта (поливинилпирролидон-иод, красители с противомикробным действием, такие как кристаллический фиолетовый или бриллиантовый зеленый), токсикологическую неприемлемость или ограниченный диапазон действия (например, триклозан) [2, 3, 4].
В настоящий момент наиболее безопасными и хорошо себя зарекомендовавшими антисептиками являются полигексанид и октенидин дигидрохлорид, обладающие широким спектром действия [2].
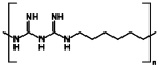
Полигексанид является по своей химической структуре олигомерным бигуанидом и имеет следующее химическое строение:
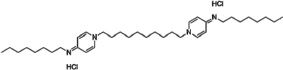
В отличие от полигексанида октенидина дигидрохлорид не является поли- или олигомером, а представляет собой молекулу со следующим строением:
Целью данного исследования являлось экспериментальное доказательство лучшей способности подавления роста бактерий смесью полигексанида и октенидина дигидрохлорида по сравнению с этими отдельно взятыми веществами с целью применения этой смеси при обеззараживании прежде всего хронических ран.
Материалы и методы исследования
Подготовка тестируемых веществ
Растворителем полигексанида и октенидина выступал 0,5 % раствор NaCl, созданный в лаборатории с использованием высокоочищенной воды (Ultra Pure Water, Biochrom, Kat. No.: L0040) и хлорида натрия (Merck Millipore, Kat. No.: 567440). Для создания различных смесей полигексанида и октенидина были использованы 20 %-й водный раствор полигексанида (Полигексаметиленбигуанид, CAS: 27083-27-8, ARCHBiocidesltd.) и октенидин (Октенидина дигидрохлорид, твёрдая форма, CAS: 70775-75-6, Dishman Pharmaceuticalsand Chemicalsltd.).
Для растворения октенидина в 0.5 % растворе хлорида натрия были опробованы следующие поверхностно-активные вещества (ПАВ):
Pluriol P 600 (ORICA Chemicals), Pluriol P 900 (ORICA Chemicals), Pluriol P 2000 (BASF SE), Pluriol P 4000 (BASF SE), Emulphor FAS 30 (BASF SE), Pluronic PE 6800 (BASF SE), Pluronic L62 (BASF SE) Pluronic PE 7400 (BASF SE), Lutensol AT 25 Powder (BASF SE), Sokalan PA 20 (BASF SE), Pluriol E 9000 Pulver (BASF SE), Cremophor RH 40 (Caelo), Moviol 40-88 (Sigma-Aldrich). Вышеуказанные, а также другие, не использованные в данных экспериментах ПАВы, были пронумерованы. Для упрощения нумерация была сохранена, хотя ряд веществ не был использован по причине их плохой растворимости в воде.
1) Pluriol P 600
2) Pluriol P 900
3) Kollidon 30 (40.000 mw)
4) Pluriol P 2000
5) Pluriol P 4000
6) Emulphor FAS 30
7) Pluronic PE 6800 (80 % Ethylenoxid, 20 % PPO)
8) Pluronic PE 7400 (40 % ET-O 60 % PPO)
10) Lutensol AT 25 Powder (C16-C18, 25 EO, 1360 mw)
11) Sokalan PA 20
12) Pluriol E 9000 Pulver (PEG MW 9000)
16) CremophorRH 40
Кроме вышеуказанных поверхностно-активных веществ был использовано ПАВ L62 (Pluronic L 62, BASF), необходимое для технического процесса, в котором должны найти своё применение октенидин и полигексанид. Исходя из этих соображений, данное вещество тестировалось в смеси с октенидином и полигексанидом.
Микроорганизмы и питательный раствор
E.coli (DSM-11250), Staphylococcusaureussubsp. aureus (DSM-799) и Pseudomonasaeruginosa (DSM-939) были культивированы в бульоне при pH 7,2 из 0,75 г казеина, 0,25 г пептона сои, 0,25 г хлорида натрия, 50 мл дистиллированной воды и 30 мкл 5 н натрия гидроксида (Appli Chem) минимум 12 часов при 37 °С при скорости перемешивания 200 rpm. Для тестирования противомикробных свойств полигексанида, октенидина и ПАВов были использованы нанесенные на агар (0,75 г агар от AppliChem и 50 мл бульон) бактерии с учётом коэффициента разведения 1:10.
Противомикробная активность обоих веществ и ПАВов была протестирована на вышеуказанных микроорганизмах. Каждая проба (тройное измерение)тестировалась на десяти различных концентрациях микроорганизмов каждого вида. Подсчет колоний производился через 24 ч с помощью Colony Counter Pens/eCount).
Тест на клеточную токсичность
L929 (линия фибробластов) и HaCaT (линия кератиноцитов) клетки были культивированы в среде DMEM (Dulbecco’smodifiedEagle’smedium; Biochrom) при добавлении 10 % фетальной сыворотки телёнка (Sigma), 1 % ХЕПЕС, 1 % Пенициллин/Стрептомицин, 1 % Канамицин (Biochrom), при 5 % CO2 и 37 °C. Питательный раствор заменяется на раствор DMEM с веществами, подвергающимися проверке. После 30-минутной инкубации производится интерпретация процента выживания клеток с помощью МТТ-теста согласно описанию производителя (Sigma). Сбор данных проводился с помощью фотометра при длине волны 570 нм. Оценка цитотоксичности производилась согласно нормам, принятым в ЕС: ISONorm 10993/5.
Результаты исследований и их обсуждение
В связи с гораздо худшей растворимостью октенидина по сравнению с полигексанидом были проведены исследования, направленные на выявление оптимального поверхностно-активного вещества или веществ а также их концентраций, способных растворить и стабилизировать октенидин в 0,5 % водном растворе NaCl.
Экспериментально было установлено, что именно ПАВ 11 и ПАВ 18 в различных концентрациях содействуют наиболее полному растворению октенидина.
Далее было проведено исследование растворимости октенидина при варьировании концентрации ПАВ L62. Концентрации L62 варьировались от нуля до 0,8 %. Значения экстинкции соответствовали помутнению растворов, указывающему на плохую растворимость. Более низкое значение означало хорошую растворимость (рис. 1).
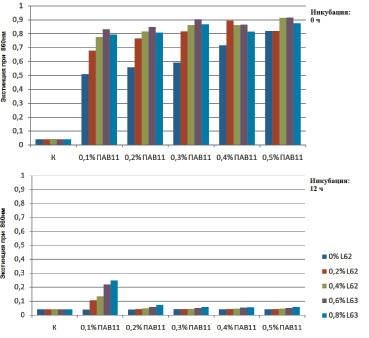
Рис. 1. Сравнение растворимости октенидина при разных концентрациях ПАВ 11 и L62 непосредственно после смешивания (сверху) и после 12-часовой инкубации (снизу)
Было отмечено, что растворимость октенидина с ПАВ 11 при различных концентрациях L62 изменялась во времени, причём наблюдалась лучшая растворимость после 12-часовой инкубации. Согласно результатам, представленным на графике, вне зависимости от концентрации L62 наблюдалась плохая растворимость октенидина во всех растворах ПАВ 11.
Однако через 12 часов инкубации было обнаружено, что практически любая комбинация L62 и ПАВ 11 обладала хорошей растворимостью, чьи значения экстинкции соответствовали контролю.
Следующим шагом стало выяснение возможности применения вышеуказанных поверхностно-активных веществ для растворения смеси октенидина и полигексанида. Нижеследующий график (рис. 2)представляет растворимость смеси 0,1 % октенидина и 0,01 % полигексанида в зависимости от выбранного ПАВ и времени инкубации.
Показаны результаты измерения экстинкции сразу после растворения компонентов.
Результаты данного исследования указывают на то, что ПАВ 10 и 16 способствуют наилучшему растворению всех необходимых компонентов (ПАВы, октенидин и полигексанид вместе).
Описанный выше эксперимент также был повторён с учётом 12-часовой инкубации. Результаты эксперимента показали значительное изменение растворимости. Наилучшей растворимости смеси L62, 0,1 % октенидина и 0,01 % полигексанида удалось достигнуть с помощью ПАВ 10, 11 и 16.
Следующим этапом исследований стало выяснение цитотоксичности исследуемых веществ и их смеси. Европейская норма проверки медицинских продуктов на цитотоксичность (ISONorm 10993) устанавливает нижний порог нетоксичности на уровне 70 % [5]. Как видно из графика, только полигексанид является с этой точки зрения нецитотоксичным. В случае смерти не более 50 % клеток вещества могут рассматриваться как слабо и легко токсичные. Если этот уровень находится между 50 и 70 %, то проверяемые активные вещества обладают средней токсичностью. Закономерно, что при снижении концентрации вещества, как правило, обладают меньшей цитотоксичностью.
Расположенный ниже график (рис. 3) представляет цитотоксичность октенидина, полигексанида и их смеси с ПАВ L62.
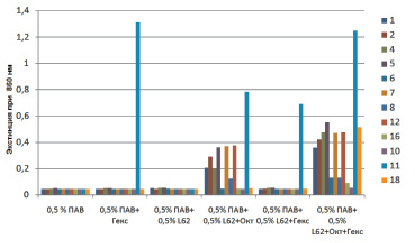
Рис. 2. Сравнение растворимости октенидина, полигексамида и их смеси в присутствие различных ПАВ
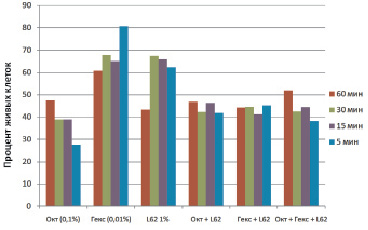
Рис. 3. Сравнение цитотоксичности октенидина, полигексамида и их смеси
Бактерицидные свойства полигексанида, октенидина и их смесей исследовались на E.coli, Staphylococcusaureus и Pseudomonasaeruginosa. На рис. 4 представлена микробиологическая активность различных концентраций активных веществ в разных временных промежутках.
Эксперименты с E.coli показали, что растворы, содержащие как полигексанид, так и октенидин, гораздо эффективнее, чем отдельно взятые вещества. Аналогичные эксперименты с Staphylococcusaureus и Pseudomonasaeruginosa при концентрации полигексанида 0,05 и 0,01 % октенидина с ПАВ 11 (L62: 0,6 %, PE6800: 0,01 % , ПАВ 11: 1 %) показали уменьшение количества бактерий как минимум на 1⋅108.
Уже низкие концентрации полигексанида (0,0025 %) и октенидина (0,0125 %) показали в комбинации друг с другом сильную противомикробную активность. Данная смесь не была до настоящего момента стандартизированно протестирована ни in vitro на бактериальных культурах ни in vivo на пациентах. Как октенидин, так и полигексанид являются хорошо зарекомендовавшими себя средствами для дезинфекции кожи и ран. Для октенидина характерно быстрое наступление эффекта [7], а также бактерицидное и цитопатогенное действие [8, 9], в то время как полигексанид обладает более поздним наступлением эффекта, являющимся в то же время более продолжительным [9].
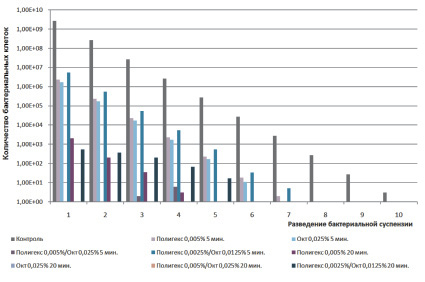
Рис. 4. Сравнение бактерицидных свойств по отношению к E. coli различных концентраций октенидина, полигексамида и их смеси при разном времени выдержки и разных плотностях исходной бактериальной суспензии
Комбинация обоих веществ оказывает синергичное влияние. Данная комбинация могла бы оказать положительное влияние на лечение инфицированных хронических ран, чьё деконтаминирование производится в интервале 48–72 часов.
Демографические изменения и обусловленное ими возросшее количество случаев диабета (тип 2), закупорка артериальных сосудов и хроническая венозная недостаточностью ведут к повторяющимся дефектам кожных покровов, ярко выраженным на нижних конечностях и области таза и ведущим к увеличению заболеваний, ампутаций и смертности [5, 6]. Стоимость лечения хронических ран оценивается в мире примерно в 25 триллионов долларов США в год [5]. В результате улучшения раневых повязок, как содержащих, так не содержащих активных ингредиентов (серебро, альгинаты, асептики и т.д.), лечение хронических ран значительно улучшилось, хотя ещё и далеко от оптимального [15]. Рецидивы инфекций требуют зачастую хирургического вмешательства, избежать которого можно посредством целенаправленного применения противомикробных препаратов.
Комбинация антисептиков октенидин и полигексанид показало наличие синергичного действия, создающего возможность для применения этих компонентов в низких дозах. Учитывая схожий спектр влияния относительно патогенных для человека бактерий, является целесообразной именно комбинация вышеуказанных веществ, т.к. октенидин прекрасно дополняет медленнее но долговременнее действующий полигексанид посредством своего быстродействия. Вопрос относительно высокой токсичности октенидина in vivo остаётся открытым, т.к. наблюдения пока не подтвердили данного факта.
Рецензенты:
Читайте также:

