Шансы разработать вакцину от вич
Обновлено: 23.04.2024
Общая модель разработки вакцин применима и к разработке вакцины от ВИЧ. Возможно, с небольшими вариациями из-за специфики вируса.
Чтобы было понятнее, мы можем начать с небольшой истории разработки ВИЧ-вакцин. Над вакцинами начали работать практически сразу, как только вирус идентифицировали и поняли, что он вызывает СПИД. Исследования начались очень быстро, и также быстро ученые столкнулись с рядом проблем.
Первая проблема с ВИЧ-вакцинами в том, что у нас нет в природе примера, когда человек переболел ВИЧ и у него выработался иммунитет. Используя такие примеры, мы могли бы узнать, какой иммунный ответ защищает от последующей инфекции. В результате у нас нет возможности предположить, какие аспекты иммунного ответа защищают от ВИЧ.
Нужно еще понимать, что в человека вирус попал примерно в начале 20 века и довольно долго распространялся в Африке практически незамеченный. За это время он эволюционировал в несколько подтипов, которые сильно отличаются друг от друга. В силу разных исторических причин эти подтипы по-разному распространились по миру. Например, подтип В распространен в основном в Америке и Европе. И мы не знаем никаких биологических причин, почему именно подтип В так распространился.
Возможно, так получилось, что носители этого подтипа быстрее попали в Европу и Америку и данный подтип успел там распространиться. Поэтому в разных частях мира существуют разные подтипы вируса, и они довольно сильно отличаются друг от друга. В Африке самое большое разнообразие, поскольку он там и появился. Особенно в центральной Африке. Там самое большое разнообразие ВИЧ в мире.
Может быть такое, что один человек заражен разными подтипами одновременно?
Да. В принципе, человек может быть заражен разными подтипами. Были сделаны исследования, в которых наблюдали за уже зараженными людьми, чтобы посмотреть, защищает ли эта инфекция от последующей. Было выявлено, что уже инфицированные люди заражаются ВИЧ с примерно такой же вероятностью, как и неинфицированные люди. Это добавляет сложности к тому, что у нас нет возможности попытаться измерить какой-то иммунный ответ, который бы защищал. Поэтому повторно человек может заразиться другим вирусом, того же самого подтипа или другого, этому ничего не мешает.
Хорошо, давайте вернемся к проблемам ВИЧ-вакцин.
- у нас большое разнообразие вирусов;
- у нас нет модели для того, чтобы посмотреть, какие иммунные ответы защищают от вируса;
- и у нас нет хорошей животной модели.
Эти три больших блока говорят о том, что мы ведем самолет вслепую. То есть мы пытаемся разработать вакцину от ВИЧ, не имея точного представления о том, что именно нам нужно разработать.
Все разрабатываемые вакцины проходят первую и вторую стадию испытаний. На этих стадиях мы еще не тестируем эффективность, но смотрим на иммунный ответ: какие механизмы иммунного ответа были активированы и насколько сильно. Другие вакцины мы можем оптимизировать на этих стадиях, если знаем, что искать. Для ВИЧ мы не знаем, что мы ищем. Мы оптимизируем иммунные ответы, но все это догадки, что может сработать, а что не сработает. В итоге основной тест происходит на третьей стадии, когда мы смотрим, предотвращает вакцина инфекции или нет.
Вначале, когда выбирается тип вакцины, получается, что ослабленные вирусы иммунодефицита не могут быть использованы для создания вакцины?
Такое ослабление называется аттенуацией: его делают, вводя в геном вируса мутации, которые нарушают функции его белков и делают вирус менее патогенным. Были ранние попытки сделать вакцину на основе ослабленного вируса, Тогда какие технологии используют для создания ВИЧ-вакцины?
Практически все остальные. Например, инактивированный вирус: многие исследователи считают, что это тоже слишком опасно, но есть компания в Канаде, называется А как инактивируют вирус?
Нарабатывается живой вирус в культуре клеток, и потом его инактивируют химикатом, который просто убивает вирус, но не разрушает его полностью, поэтому белки вируса остаются в той форме, в которой они были. И на такой вирус может выработаться иммунный ответ.
Понятно. Какие еще технологии применяют?
На основе вирусоподобных частиц, но такие вакцины пока не так далеко продвинулись. Много вакцин на основе рекомбинантных бактерий, рекомбинантных вирусных векторов и рекомбинантных вирусных белков, ДНК- и РНК-вакцин тоже достаточно много. Пептидные вакцины тоже делают.
Исторически так сложилось, что первое крупное испытание ВИЧ-вакцин было с рекомбинантными белками. Ученые надеялись, что они вызовут у организма антитела к вирусу. То есть это была вакцина, основанная исключительно на антителах. Рекомбинантные белки вводили и показали, что антитела появляются, но не защищают. Все разочаровались в антителах.
К этому времени накопились данные о том, что организмы по-разному реагируют на ВИЧ. У некоторых людей очень быстро развивается СПИД, у некоторых довольно долго. Выяснилось, что у людей, у которых СПИД развивается медленнее, существуют особые клеточные ответы. И все внимание перешло на Т-клеточные вакцины. Начали делать вирусные векторы. Провели испытание одной такой вакцины — и она не сработала. И более того, результат указывал на то, что в небольшой группе людей такая вакцина, возможно, даже усиливала инфекцию.
Первый подход не работает, второй подход не работает — пришла идея их объединить. Сделали стимуляцию иммунного ответа вирусным вектором, а потом усиление белком. Получился и Т-клеточный ответ, и выработка антител. Объединить вместе две провалившихся вакцины — был очень спорный подход, который вызвал возмущение многих ученых. Но тем не менее он частично сработал.
Да, все наиболее продвинутые подходы основаны на этом принципе. Я бы сказал, что подавляющее большинство ученых считают это многообещающим подходом.
К примеру, мы создали такую комбинированную вакцину. С чего начинаются испытания?
Как и остальные вакцины: сначала идет первая стадия, затем вторая и потом уже третья.
На первой стадии проводят маленькое испытание: набирают здоровых волонтеров, смотрят на безопасность вакцины для человека и на иммунный ответ.
На второй стадии испытание побольше: увеличивается количество людей, тестируются вариации иммунизации (разные дозы, последовательность доз, методы введения вакцины), и мы снова смотрим иммунный ответ и безопасность.
На третьей стадии обычно уже пытаются получить лицензию для вакцины. Но поскольку с ВИЧ-вакциной мы до конца не знаем, что сработает, а что нет, то используют стадию 2b или 2+. Это уже не вторая стадия, но еще и не третья, а что-то посередине. То есть мы не пытаемся получить лицензию на эту вакцину, а только смотрим эффективность.
Каким образом тестируют эффективность? Специально же заразить нельзя?
Да. ВИЧ никто специально заражать не будет. Вакцинируют большие группы людей: дают кому-то плацебо, кому-то вакцину, и они возвращаются к обычной жизни. И каждые несколько недель или месяцев они возвращаются и их тестируют на инфекцию ВИЧ, и постепенно набирают данные, в какой группе больше инфекций.
Давайте поговорим про SIV (вирус иммунодефицита обезьян) и SHIV (искусственно созданный вирус).
SIV — это коллекция самых разных вирусов. Около 30 видов обезьян известно в Африке, у которых есть свои вирусы SIV. Они с ними живут довольно давно, миллионы лет, вирусы адаптировались каждый к своему виду обезьян и поэтому очень сильно отличаются друг от друга, и также сильно отличаются от ВИЧ. Но при этом по генетической структуре видно явное родство.
Поскольку среди обезьян этот вирус циркулирует уже миллионы лет, то они, видимо, друг к другу адаптировались — вирус к обезьянам, а обезьяны к вирусу. Поэтому у естественных хозяев он практически не вызывает СПИДа. То есть они являются носителями, вирус активно размножается, но болезни не вызывает.
Когда переносишь вирус в вид обезьян, которые до этого с ним не сталкивались, то часто очень быстро развивается СПИД. Быстрее чем у человека, буквально за пару месяцев или пару лет, в зависимости от вируса. Это часто используется как модель для исследований. Например, часто используют азиатскую резус-макаку (Macaca mulatta), поскольку их много, существуют очень большие колонии, и ученые знают, как их размножать. Азиатских макак можно заражать вирусом SIV африканских обезьян, и у них развивается СПИД.
Это хорошая модель для изучения разных аспектов передачи ВИЧ и его патогенеза, но существует и ряд серьезных ограничений. Для начала — само заражение. Изначально макакам вводили большую дозу вируса интервенно — в кровь. Это отлично подходит для демонстрации того, что происходит, когда развивается СПИД. Но для предотвращения заражения эта модель подходит разве что для людей, которые заразились через переливание крови или при использовании общих шприцев, и даже они не получают такую большую дозу вируса. Но такой подход совершенно не отражает передачу сексуальным контактом, поскольку вирус попадает сразу в кровь в большой дозе.
Попытки сделать вакцину от такой инфекции в макаках провалились полностью. Через некоторое время сложилось мнение, что таким образом слишком высоко подняли планку, пытаясь разработать защиту от вируса, когда вводится огромная доза прямо в вену. Поэтому стали использовать подходы, которые лучше отражают биологию полового контакта. Одной из основных моделей стало введение большой дозы вируса ректально. Постепенно стали также вводить вирус вагинально. Ректально вводят, как правило, самцам, потому что в колониях самцы не настолько нужны, как самки, которые нужны для того, чтобы разводить новое потомство. Поэтому многие эксперименты в биологии до последнего времени делаются на самцах, хотя недавно NIH ввели правило, по которому следует либо балансировать пол используемых животных, либо представлять научные основания того, почему используется лишь один пол. Позже стали вводить вагинально, чтобы посмотреть реакцию у самок и вагинальную передачу вируса. Такие эксперименты более сложны, потому что половой тракт самок разделяется на несколько зон, отличающихся друг от друга биологическими свойствами, и к тому же претерпевает большие изменения в ходе менструального цикла.
И в случае ректального и вагинального заражения была показана возможность предотвратить инфекцию с помощью вакцинации. При этом если мы посмотрим на то, как распространяются инфекции среди людей, то риск заражения на один половой контакт довольно низкий — от 0,5 до 2%. Если мы будем вводить дозы, которые соответствуют такому заражению в обезьянах, это эксперименты растянутся на много лет. Поэтому вводят достаточно большие дозы, чтобы гарантировать заражение. Но даже на таких испытаниях защитные эффекты вакцин были видны.
Но сейчас я бы сказал, что в основном используют модель, когда вводят такую дозу, чтобы заразить 10–15% животных из группы. От 6 до 10 введений такой дозы дают практически полное заражение группы. Такая доза больше, чем доза ВИЧ при половом контакте у людей. Но в сравнении с остальными моделями такой подход лучше отражает биологию того, что происходит в реальной жизни.
А сами вакцины от SIV и ВИЧ тоже кардинально различаются?
Да. Разработанную вакцину для SIV при переходе к тестированию на людях приходится делать заново, вирус обезьян хоть и похож, но все-таки это другой вирус. Например, если мы используем технологию рекомбинантных белков, то рекомбинантный белок оболочки SIV бесполезно использовать, потому что он недостаточно похож на белок оболочки вируса человека.
Может ли понимание принципов создания вакцины от SIV как-то помочь созданию вакцины для человека?
Это зависит от того, кого вы спросите. Мнения на этот счет очень сильно расходятся. Есть масса людей, которые занимаются такими моделями. Они, естественно, считают, что основные принципы вакцинации от ВИЧ необходимо сначала исследовать на обезьянах, а потом идти на людей. Есть люди, которые считают, что пользы от обезьяньих испытаний нет в принципе, потому что различия с обезьянами слишком велики, чтобы дать полезную информацию о том, что будет или нет работать в людях.
Наша компания находится где-то посередине. Когда-то давно было сделано испытание нашей вакцины на обезьянах. Это были небольшие группы животных, примерно по 6-7 в каждой. В группе плацебо заразились все семь животных, в вакцинированной группе заразилось всего две из шести. В общем, цифры были довольно маленькими, но принцип был показан, а дальше мы решили, что пытаться оптимизировать это все на обезьянах бесполезно.
SHIV, искусственно созданный вирус, как и зачем его сделали?
Идея в том, чтобы взять SIV и встроить в него белок оболочки от ВИЧ. Получается гибридный вирус, который приспособлен все еще к обезьянам, но его белок оболочки от ВИЧ. Тогда этот вирус с точки зрения вакцин, которые нацелены на выработку антител, выглядит как ВИЧ. И таким образом этот вирус позволяет тестировать человеческие вакцины на макаках.
Какие типы вакцины разрабатываются в вашей компании?
Лет 15–20 назад обнаружилось, что если просто ввести ДНК вируса в мышцу, то она каким-то образом попадает в клетки и там транскрибируется в РНК, которая транслируется в белок и т. д., выходят белки, которые были закодированы в этой ДНК, и на них возникает иммунный ответ. Сначала был огромный энтузиазм по этому поводу, до сих пор существуют компании, которые были основаны для разработки ДНК-вакцин. Но быстро стало понятно, что ДНК сама по себе не очень иммуногенна, то есть иммунный ответ есть, но он не очень сильный.
Однако мы обнаружили что иммунный ответ на ДНК хоть и слабый, но что-то происходит при этой вакцинации, что готовит иммунную систему к последующему ответу на рекомбинантный белок. Поэтому мы сначала вводим ДНК, а потом даем рекомбинантный белок, и в ответ на рекомбинантный белок титры антител получаются сразу очень высокие, гораздо выше чем если сразу давать рекомбинантный белок.
А помимо антител есть клеточный ответ?
Клеточный ответ появляется. Есть два основных типа Т-клеток. Есть Т-клетки, которые убивают зараженные клетки, а есть Т-клетки, которые помогают и Т-клеткам, которые убивают, и В-клеткам, которые вырабатывают антитела. Наша вакцина вызывает сильный ответ помогающих Т-клеток. Возможно, поэтому мы наблюдаем настолько высокий ответ антител. Получается, это вакцина, в основном основанная на антителах.
Хотелось бы узнать про будущее ВИЧ-вакцины. Какие испытания проходят сейчас или планируются?
Недавно пытались повторить подход исследования в Тайланде, о котором говорили ранее. На этот раз пробовали в Южной Африке. Хоть испытание и называлось повторением, в вакцине многое поменяли: пришлось изменить подтипы вируса, изменили популяцию, в которой проводилось тестирование, и т. д. Вакцина не сработала, почему — пока что не понятно. Сейчас будут активно исследовать иммунный ответ и сравнивать с тем, что был получен в Тайланде, чтобы понять, в чем была принципиальная разница.
А сколько примерно времени может занимать прохождение вакциной всех стадий испытаний?
Это зависит от очень многих факторов. Верхнего предела нет, а нижний может быть примерно лет 8.
А если Johnson & Johnson вернулись к разработке вакцины, значит, в этом есть экономический смысл? Зачем вообще кому-то разрабатывать вакцину от ВИЧ?
Экономический смысл для фармкомпаний — это, конечно, важно. Но это далеко не единственный фактор. Люди, которые работают в фармкомпаниях, идут туда, потому что они хотят разрабатывать вакцины и лекарства для того, чтобы помогать людям. Экономический смысл важен, потому что, если у тебя нет денег, то ничего нового ты разработать не сможешь, а разработка лекарств и вакцин это очень дорогой процесс. Johnson & Johnson нашли кандидатную вакцину, которая, по их мнению, может сработать, и руководство приняло решение инвестировать в ее разработку. Это дорого и рискованно, но для большой компании вроде Johnson & Johnson, возможно, эти деньги не такие большие в процентном отношении. Однако в случае успеха это будет огромным вкладом в здравоохранение во всем мире, а также прекрасный PR для компании.
То есть это работа на репутацию?
Да, с одной стороны, это работа на репутацию и на общие стремления разработать нечто, что поможет огромному количеству людей во всем мире. С другой стороны, как я сказал, у них есть два подхода: один они делают для Африки, другой для Америк и Европы. В принципе, это подход многих фармкомпаний: они продают лекарства или вакцины за большие деньги в развитых странах, чтобы субсидировать продажи в развивающихся. В итоге это нужно сбалансировать, чтобы компания получала прибыль. Такая модель работает практически везде, у всех компаний цены на вакцины плавающие, гораздо выше для развитых стран, и гораздо ниже для развивающихся.
А данные, которые получаются при испытаниях, вами и вашими коллегами открыто публикуются? То есть делитесь ли вы данными друг с другом?
Подавляющее большинство работ по разработке ВИЧ-вакцин делаются в академических центрах и лабораториях, и они активно публикуют свои результаты. В случае коммерческой компании всегда решается, какие данные публиковать, какие не публиковать и в каких масштабах, по разным причинам. Но в целом да, большинство данных известны.
И последний вопрос. Что разработка ВИЧ-вакцины может дать миру? Не в смысле того, что мы будем защищены от ВИЧ, а что еще это может дать науке и академическому сообществу?
Сами исследования, которые велись в разработке ВИЧ-вакцин, уже дали огромное количество технологий, которые сейчас используются для других вакцин, в том числе и для коронавируса. Многие люди, которые занимались разработкой вакцины против ВИЧ, сейчас занимаются разработкой вакцины против коронавируса.
Например, технологии по разработке рекомбинантных вирусных белков лучше всего разработаны именно для ВИЧ. И эти технологии могут помочь в разработке других вакцин на основе рекомбинантных белков. И люди, которые этим занимались, сейчас помогают делать рекомбинантные белки для коронавируса. Все технологии, наработанные для ВИЧ, распространяются и на другие исследования.
Егор Воронин — нью-йоркский вирусолог, специалист в области вакцинопрофилактики. Более двадцати лет он занимался исследованиями ВИЧ, его эволюцией и репликацией. С 2018 по 2020 год он возглавлял биотехнологическую компанию Worcester HIV Vaccine, занимающуюся разработкой вакцины от ВИЧ. В своем блоге shvarz Егор публикует массу интересных фактов о вакцинах, ВИЧ, о вирусах в целом, а в последние полтора года и о новом коронавирусе: он умеет рассказывать простым языком о сложном.
— Наверное, тот факт, что сейчас все следят за вакцинами, позволит объяснить это проще.
— Это единственная проблема?
— Нет. Вторая проблема: как мы все уже знаем в отношении коронавируса — созданные против него вакцины хорошо предотвращают тяжелое течение болезни и смерть, но гораздо хуже защищают от заражения. Для COVID-19, как все же быстротечной болезни, это нормально: даже если вирус попадет в привитый организм, он не вызовет тяжелую болезнь, организм силами иммунной системы быстро его поборет, и человек скоро выздоровеет, вирус исчезнет.
С ВИЧ же совершенно другая ситуация. Он приспособлен к тому, чтобы жить в организме очень долго и ускользать от иммунной системы годами. Если мы не предотвратили его попадание в организм, то без терапии он будет в нем реплицироваться и в конце концов вызовет СПИД. Будучи привитыми от коронавируса, вы можете все равно им заразиться, но лишь чуть-чуть поболеете или даже не заметите, что вирус был, организм его вычистит, — а с ВИЧ это не работает. На ранних этапах разработки вакцин пытались измерять их эффективность именно по способности предотвращать не заражение ВИЧ, а последующее развитие СПИДа, но сейчас уже ясно, что если ВИЧ попал в организм, то без терапии СПИД неизбежно разовьется. Значит, в отношении ВИЧ нам нужна вакцина, которая будет полностью предотвращать само попадание вируса в организм, а это гораздо более высокая планка.
— Но с точки зрения обывателя все кажется просто: есть вирус ВИЧ, он выделен и хорошо известен. Так возьмите его, убейте, и убитый, обезвреженный вирус введите человеку — пусть организм вырабатывает иммунный ответ. Ведь так делались все классические вакцины. На каком этапе оказалось, что с ВИЧ это не работает?
— Над вакциной от ВИЧ работают уже не первый десяток лет. При этом были сделаны какие-то побочные открытия, которые можно применять в других областях? Например, в нынешней борьбе с коронавирусом?
— Попытки создать вакцины от ВИЧ начались сразу же, как только вирус был впервые выделен. Пытались сделать вакцины на основе убитого вируса, на основе рекомбинантных белков, продолжают активно работать над векторными вакцинами. А когда появился COVID-19, практически все мои коллеги, кто занимался вакцинами от ВИЧ, перекинулись в область коронавируса. Я смотрю на научные статьи о коронавирусе — там все знакомые имена.
Я уже упоминал, что технология стабилизации спайкового белка была разработана для ВИЧ, это был один из главных прорывов в вакцинологии за последние десять лет, и она нашла отличное применение в вакцинах от COVID-19.
Известный вирусолог Барни Грэм, который занимался именно стабилизацией вирусного белка у ВИЧ и у респираторно-синцитиального вируса, сыграл важную роль в разработке одной из самых популярных в мире вакцин от COVID-19 компании Moderna.
Мишель Нуссенцвайг, который выделил нейтрализующие антитела к коронавирусу, разработал технологию выделения этих антител в ходе многолетних исследований антител к ВИЧ и вирусу иммунодефицита обезьян. Памела Бьоркман, ведущий специалист Caltech по структуре вирусных белков, раньше изучала в том числе и ВИЧ.
— Это известные имена, но применяются ли отработанные на ВИЧ методики?
— Сами методы тестирования на нейтрализующие антитела были разработаны для ВИЧ, а теперь применяются для COVID-19. В области тестирования вакцин существует огромная сеть клинических центров и лабораторий и в США, и в Африке, и по миру — она была создана для ВИЧ-инфекции, после начала пандемии ее просто взяли и перепрофилировали под коронавирус, а заведуют ею те же самые ученые.
С другой стороны, технологии, нашедшие применение в вакцинах от COVID-19, сейчас интересуют и исследователей ВИЧ: технология мРНК вакцин разрабатывалась и для ВИЧ, но сейчас работы в этой области существенно активизировались.
— Кто-нибудь из российских ученых занимается разработками вакцины от ВИЧ?
— В России разработки вакцин от ВИЧ ведутся, но их немного. Есть три исследовательские группы: в Москве, Петербурге и в Новосибирске. У них есть определенные наработки, но пока они не прошли дальше первой фазы испытаний.
Вопрос в большей мере этический. Раз уж существуют эффективные методы предотвращения ВИЧ-инфекции, то нельзя не делать их доступными участникам клинических испытаний. Но если мы предоставляем их всем участникам клинических испытаний (и плацебо-группе, и группе, получающей вакцину), то количество новых инфекций будет чрезвычайно мало в обеих группах, и эффективность вакцины будет невозможно измерить. Или придется делать испытания еще обширнее и еще длинней, что еще больше повысит их стоимость.
Перспективы разработки вакцины от ВИЧ тают с каждым днем именно потому, что сложно их тестировать, не подвергая людей риску заразиться в ситуации, когда есть готовые способы избежать этого риска. Но нельзя сказать, что ученые полностью потеряли надежду. Уже ведутся активные обсуждения новых подходов к проведению клинических испытаний ВИЧ-вакцин в будущем.
Перед тем как говорить о вакцине против ВИЧ, стоит начать с более общего вопроса: что мы понимаем под прививками и вакцинами с научной точки зрения?
По механизму возникновения иммунитет делится на два вида: врожденный и приобретенный. Первый есть у каждого человека с рождения, он выработан эволюционно. Благодаря нему человек не болеет многими болезнями, которыми, например, страдают животные.
Второй возникает в течение жизни и у каждого может отличаться в зависимости от того, с какими возбудителями человеку довелось встретиться.
по теме
Лечение
Как устроен иммунитет: Объясняем по пунктам
Приобретенный иммунитет может быть активным (он возникает вследствие реакции организма на перенесенную болезнь, присутствие возбудителя в организме), а может быть пассивным, когда антитела, например, передаются от матери ребенку во время беременности.
Именно по этим антителам, как правило, и ставится диагноз, если мы пользуемся экспресс-тестами. В случае с ВИЧ существует и пассивный иммунитет. Но при передаче вируса от матери ребенку, к сожалению, он не обладает достаточным защитным эффектом.
Еще одно направление — это искусственный иммунитет. Он тоже бывает активным и пассивным. Пассивный — это иммуноглобулины, выработанные либо у лабораторных животных, либо у других иммунизированных лиц, и сыворотки. Активный же достигается собственно путем вакцинации.
Вакцины бывают профилактические (защитные) и лечебные. Они различаются по типу воздействия на организм и по своим результатам.
Пассивный иммунитет возникает быстрее, сразу после того, как в организм ввели чужие антитела. Однако он бывает совсем недолговременным. Активный иммунитет держится долго, чаще — пожизненно, но и возникает не сразу.
Иммунный ответ: как это все работает?
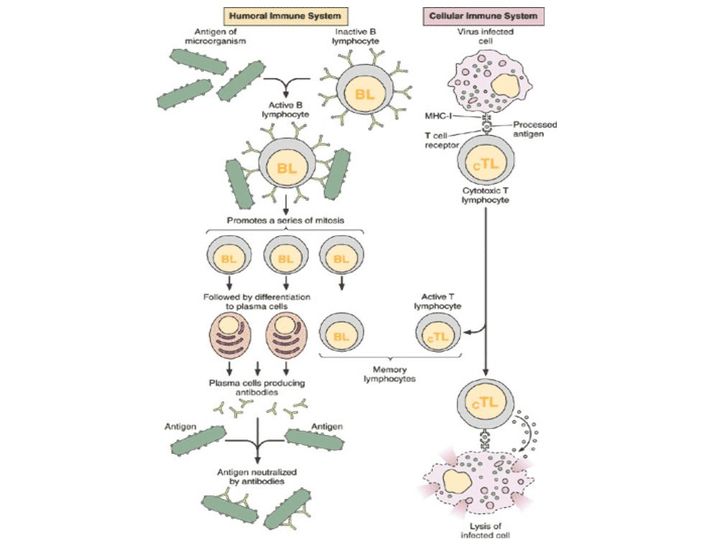
Ученые обычно говорят о гуморальном и клеточном иммунитете. Принцип работы гуморального заключается в следующем: в нашем организме есть специальные клетки — лимфоциты. Они постоянно циркулируют в крови и проверяют все, что попадается им на пути, по принципу свой/чужой.
по теме

Лечение
Гид по вакцинам. Когда и какую прививку сделать? А главное: надо ли вообще прививаться? (Спойлер: конечно, надо)
Например, антитела к ВИЧ-инфекции появляются где-то через месяц после заражения, соответственно, все это время вирус может циркулировать в организме. Почему они неэффективны? Во-первых, потому что появляются слишком поздно.
Во-вторых, потому что вирус, с которым мы имеем дело, очень изменчив. Если даже В-клетки обнаружили его антиген, выработали к нему антитела, способные нейтрализовать заразу, то за время, которое ушло на все это, сам вирус успевает мутировать и оказаться неуязвимым для выработанного организмом оружия.
Когда мы говорим о клеточном иммунитете, речь идет об уничтожении тех вирусов, которые преодолели гуморальный барьер и успели забраться в саму клетку.
Клетки CD4 частично регулируют весь процесс и выполняют функцию клеток памяти. Их принято называть хелперами. CD8 — собственно занимаются уничтожением, за это их зовут киллерами.
ВИЧ — единственный вирус, который поражает не просто клетки организма, а собственно клетки иммунной системы. Той самой, которая с вирусом должна, по идее, бороться.
Именно поэтому против ВИЧ-инфекции иммунитет не может сработать так, как это было бы с любым другим вирусом.
Какие возникают трудности при создании вакцины против ВИЧ?
На данный момент в рамках более ста испытаний уже протестировано более сорока видов вакцин с участием тысяч добровольцев, и есть целая система, в которой регистрируются все исследования по вакцинации от ВИЧ.
Последнее время в разного рода СМИ регулярно появляется информация, что той или иной компанией разрабатывается новая вакцина против ВИЧ. Однако обнадеживающих результатов не так уж и много. Почему?
Инфекционные болезни, приводящие к долгосрочному ухудшению здоровья, были неизменной угрозой человечеству, но благодаря вакцинации многие из них остались лишь в истории. Такие вирусы как полиомиелит, гепатиты B и С, папилломавирус человека могут приводить к хроническим заболеваниям, но современная медицина позволяет эффективно от них предохраниться. Но когда речь заходит о вирусе иммунодефицита человека (ВИЧ), который, по мнению многих эпидемиологов, достиг уровня пандемии, исследователям не удается добиться такого успеха.
ВИЧ проходит через три стадии (по классификации Центров по контролю и профилактике заболеваний США, в России выделяют четыре стадии — прим. ред.). Острый ВИЧ проявляется в виде симптомов, напоминающих грипп, которые возникают спустя несколько дней или недель после инфицирования. За ним следует хронический ВИЧ, бессимптомная стадия, которая может затянуться на несколько лет. Если не лечиться, хронический ВИЧ рано или поздно переходит в синдром приобретенного иммунодефицита (СПИД).
СПИД постепенно вызывает отказ иммунной системы, позволяя развиваться оппортунистическим инфекциям и дефектным клеткам, от которых тело обычно избавляется. У человека со СПИДом обычная простуда может вызвать отказ легких, а скопление мутировавших клеток может развиться в опухоль куда вероятнее, чем у здорового человека.
Азидотимидин был представлен в 1987 году в качестве первого средства от ВИЧ, но только в 1997 году новым стандартом лечения стала высокоактивная антиретровирусная терапия (АРТ), которая привела к 47-процентному снижению уровня смертности. АРТ не может избавить тело от ВИЧ, но эффективное лечение способно снизить вирусную нагрузку до такой степени, что она становится неопределяемой. Это означает, что стандартный тест на ВИЧ не сможет выявить наличие вируса, он не может быть передан другому человеку и не разовьется в СПИД.
Почему так сложно создать вакцину от ВИЧ?
После того как в 1984 году исследователи из Национальных институтов здравоохранения США и Института Пастера подтвердили, что ВИЧ-инфекция приводит к СПИДу, Маргарет Хеклер, министр здравоохранения и социальных служб США, объявила, что вакцина станет доступна в течение двух лет. Но сама природа ВИЧ существенно усложнила задачу ее создания.
Задача вакцин состоит в том, чтобы тренировать иммунную систему защищаться от инфекций, используя мертвые или ослабленные патогены или их производные, такие как антигены или ДНК. Эти мертвые или ослабленные патогены вызывают иммунную реакцию, и учат организм в будущем узнавать атакующие инфекции.
Но организм человека не формирует иммунного ответа, как на те патогены, от которых можно вакцинироваться.
Кассолато объясняет: «Когда какой-либо чужеродный патоген проникает в тело, иммунная система в нормальных условиях идентифицирует вирус и пытается его контролировать или уничтожить. Специальные клетки под названием CD4 и СD8 узнают, что вирусу тут не место, и атакуют его.
Невозможность испытаний на животных
Генетическое разнообразие ВИЧ также существенно усложняет вакцинацию. Вирус имеет самый высокий известный нам уровень мутаций среди любых биологических объектов, а это означает, что у него существует очень много штаммов. Исследователям, таким образом, необходимо разработать вакцину, которая может защитить от всех штаммов ВИЧ, что крайне затруднительно.
Мало того что существует множество мутаций, на самом деле, есть еще и два типа ВИЧ, оба они постепенно приводят к СПИДу, если их не лечить. ВИЧ-1 — это самый распространенный вид болезни, и почти 95 % людей, зараженных ВИЧ, страдают именно ВИЧ-1. А ВИЧ-2 встречается в основном в западной Африке, откуда предположительно произошли оба вируса, потому что он куда менее заразен, чем ВИЧ-1.
Хотя ВИЧ-1 и ВИЧ-2 оказывают сходное влияние на тело человека, их генетические последовательности совпадают всего на 55 %, поэтому далеко не все тесты и препараты влияют на оба типа. Вполне может быть, что и вакцина будет предохранять только от одного.
Наконец, главная проблема заключается в том, что у ученых нет надежной экспериментальной модели на животном, позволяющей провести испытания вакцины, а это ключевая стадия разработки вакцин.
Что происходит сейчас
До сих пор наиболее успешной вакциной от ВИЧ считалась RV144, испытание которой провели в 2009 году. Исследование, более известное как тайский эксперимент, включало 16 402 мужчин и женщин в возрасте от 18 до 30 и продолжалось почти шесть лет. Участники рандомизированного двойного слепого исследования получали либо вакцину от ВИЧ, либо плацебо, а затем тестировались на ВИЧ каждые шесть месяцев в течение трех лет, чтобы ученые могли отследить их инфекционный статус.
Участникам исследования сделали четыре инъекции вакцины под названием ALVAX HIV и две инъекции другой вакцины — AIDSVAX B/E. ALVAX HIV содержала генетически сконструированные версии трех генов ВИЧ (env, gag и pol), а AIDSVAX B/E состояла из генетически сконструированного белка gp120, который находится на поверхности вирусных частиц.
Сегодня проходит ряд других испытаний вакцин от ВИЧ, и две из них — Imbokodo и Mosaico – выделяются на фоне прочих.
Imbokodo и Mosaico — два обнадеживающих исследования
Исследование Imbokodo, которое было начато в ноябре 2017 года, должно показать, сможет ли вакцина, разработанная Janssen, безопасно и эффективно сокращать число новых заражений ВИЧ. В нем участвуют молодые женщины в возрасте от 18 до 35 лет, оно проводится в Малави, Мозамбике, ЮАР, Замбии и Зимбабве. В восточной и южной Африке женщины и девочки составляют около 60 % населения с ВИЧ.
Компания Johnson & Johnson объявила в 2020 году, что все 2600 участниц испытания были наконец вакцинированы и что предварительные результаты станут доступны самое позднее в конце 2021 года.
Отталкиваясь от концепции Imbokodo, испытание Mosaico покажет, сможет ли очень сходная вакцина наладить иммунную реакцию на ряд штаммов ВИЧ среди цисгендерных мужчин и трансгендерных людей, которые занимаются сексом с другими цисгендерными мужчинами или трансгендерными людьми. Участники исследования Mosaico, которое началось в июне 2019 года, в возрасте от 18 до 60, живут в США, Аргентине, Италии, Мексике, Перу, Польше и Испании.
В Европе, Северной и Южной Америках гомосексуальные, бисексуальные мужчины и трансгендерные люди в высокой мере поражены ВИЧ — две трети новых диагнозов ВИЧ в США ставят гомосексуальным и бисексуальным мужчинам, около 14 % трансгендерных женщин в стране ВИЧ-положительны. Участники испытания Mosaico должны отвечать ряду требований: относиться к ЛГБТ — недостаточно, чтобы считаться входящими в группу риска.
В течение последних шести месяцев с ними должно произойти хотя бы что-то одно из перечисленного: занятие анальным или вагинальным сексом без презерватива в принимающей роли вне двенадцатимесячных моногамных отношений с партнером, о котором известно, что он имеет ВИЧ-отрицательный статус либо ВИЧ-положительный статус и принимает АРТ; диагноз ректальная или уретральная гонорея, хламидиоз или сифилис; употребление стимуляторов, таких как кокаин или амфетамины; или секс с пятью или более партнерами.
Эта комбинация антигенов, как надеются исследователи, может стимулировать иммунную реакцию у участников исследований. Комбинации антигенов не встречаются в каком-то конкретном вирусе ВИЧ, они собраны вместе из разных вирусов, так что вакцина сможет защищать от множества распространенных штаммов ВИЧ.
Исследования различаются тем, что именно используется как бустер инъекции. Вирусная оболочка ВИЧ содержит белок под названием gp140. В испытании Mosaico третья и четвертая инъекции будут сопровождаться комбинацией белков gp140 из Clade C, доминирующего типа ВИЧ в Африке и Азии, а также мозаикой из белков gp140 других штаммов. В набор Imbokodo, с другой стороны, входят только белки gp140 из Clade C.

Почему ВИЧ сложно лечить
Вирус иммунодефицита человека (ВИЧ) вызывает хроническое инфекционное заболевание, прогрессирующее без лечения. Это один из уникальных вирусов, которые поражают клетки иммунной системы — так называемые CD4+ Т-лимфоциты, функция которых состоит в распознавании и уничтожении чужеродных для организма агентов.
Без лечения ВИЧ-инфекция медленно прогрессирует, истощая иммунную систему организма. Через 5–10 лет после инфицирования начинается стадия вторичных проявлений, когда у ВИЧ-положительного развиваются другие сопутствующие заболевания.
Профилактика: значимое снижение рисков инфицирования ВИЧ
Доконтактная профилактика (ДКП или PrEP) — это прием неполной схемы тех же препаратов, которые принимают люди, живущие с ВИЧ: сочетания тенофовир + эмтрицитабин или тенофовир + ламивудин.
Если препараты ДКП успели попасть в организм заранее, то при проникновении в него вируса вещества ДКП убивают ВИЧ еще до того, как тот успеет закрепиться в теле человека. Препараты нужно принимать ежедневно в одно и то же время.
Защита, которую обеспечивает PrEP при правильном приеме таблеток, — почти 100%. Требуется консультация и контроль врача.
В экстренных случаях, когда есть риск заболевания после незащищенного контакта с инфицированным, используют постконтактное лечение (ПКП, PEP). Это месячный курс терапии. При быстром начале лечения в течение первых 24–72 часов есть высокие шансы избежать инфицирования. Но эти шансы никогда не равны 100%.
Лечение ВИЧ: антиретровирусная терапия
Основной способ взять ВИЧ-инфекцию под контроль — антиретровирусная терапия. Она включает в себя препараты, останавливающие жизненный цикл ВИЧ на разных этапах.
Антиретровирусная терапия меняет качество жизни пациентов с ВИЧ:
- останавливает размножение вируса;
- позволяет иммунной системе самой восстановиться;
- предотвращает передачу ВИЧ половому партнеру;
- позволяет женщине родить детей без вируса.
Ученые доказали, что ВИЧ-положительный человек, принимающий эффективную терапию, не может передать вирус при незащищенных сексуальных контактах.
Прорыв 2021 года в лечении ВИЧ — регистрация первых инъекционных форм антиретровирусной терапии на рынках Канады, США и Европы. В ближайший год эта форма должна появиться в России. Исследования доказали эффективность терапии при однократных инъекциях каждые 1–2 месяца (вместо ежедневного приема терапии). Следующее поколение лечения — инъекционный препарат с введением один раз в полгода. Потенциально эти же лекарства можно будет использовать для снижения риска инфицирования с той же продолжительностью действия.
Исследования новых методов лечения ВИЧ: генетические ножницы
Известные случаи излечения от ВИЧ связаны с пересадкой костного мозга от доноров с мутацией генов CCR5, делающих носителей этой мутации неуязвимыми для ВИЧ. В настоящее время ученые отслеживают состояние еще 38 пациентов с ВИЧ, которым был трансплантирован устойчивый к вирусу материал.
Этот метод не может быть масштабирован по двум причинам: ущерб для здоровья от трансплантации несоизмеримо выше, чем от ВИЧ-инфекции (излечившиеся пациенты проходили процедуру не в связи с ВИЧ, а из-за онкологических заболеваний), а сама мутация не может служить надежной защитой перед быстро мутирующим вирусом, новые штаммы которого могут стать невосприимчивы к этой естественной защите.
Тем не менее случаи излечения именно этим путем создали значительное поле для исследований: на их основе появились как возмутивший общественность эксперимент на генетически модифицированных детях, итог которого общественности неизвестен, так и испытание метода редактирования гена CCR5 в организме живого человека, которое завершатся в Санкт-Петербурге в 2022 году.
Разработки вакцин от ВИЧ
Эффективной вакцины против ВИЧ не существует — пока.
За все время в клинических исследованиях испытывали более 40 вакцин. Максимальный эффект в сокращении новых случаев ВИЧ — только 25%. Созданию вакцины препятствует особенность жизненного цикла ВИЧ и его высокая изменчивость — особенно его внешней оболочки. Это позволяет вирусу быстро обходить искусственный иммунитет.
Продолжается исследование бельгийской вакцины Mosaico. В 2022 году планируется публикация исследования перспективной кадидатной вакцины HIVconsvX от Оксфордского университета.

Диагностика: шесть видов анализов
Рынок средств диагностики ВИЧ активно растет. Согласно исследованию американского агентства GMI, к 2024 году объем мирового рынка средств диагностики ВИЧ превысит $5 млрд.
Диагностика включает скрининг и подтверждающие тесты для проверки на заболеваемость ВИЧ-1, 2 и группы О. Эти тесты имеют основное применение для скрининга и дифференциации различных групп и подтипов вируса иммунодефицита человека. Благодаря технологическому развитию стали доступны экспресс-тесты на уровень клеток CD4, нуклеиновые кислоты NAT, антиген p24 и диагностика для новорожденных EID.
Антитела к ВИЧ появляются после начала активного размножения вируса. Они обычно обнаруживаются в сыворотке крови через 6–12 недель после инфицирования. Тесты на антитела ВИЧ высоко надежны при относительно низкой стоимости.
При определении антигена p24 в крови ВИЧ-инфекция может быть выявлена раньше, чем традиционными тестами для определения антител. Тесты на антиген имеют низкую чувствительность. Они не дают ложноположительных результатов, но возможны ложноотрицательные. То есть отрицательный результат не исключает инфицирование, а положительный — подтверждают с помощью тестов на антитела. Тест на антиген p24 всегда применяется вместе с тестами на антитела.
- Тесты на ВИЧ четвертого поколения
В тестах четвертого поколения объединили разные технологии, чтобы обнаружить как антиген p24, так и антитела. Тесты четвертого поколения менее дорогие, чем NAT. Широко распространены в России.
- Тесты на нуклеиновые кислоты (NAT\NAAT)
Определяет наличие и количество ВИЧ в миллилитре крови и других биологических жидкостях. Имеет высокую точность и стоимость, для скрининга не применяется. Используется для определения вирусной нагрузки у ВИЧ-положительных пациентов.
Этот тест не выявляет ВИЧ, а служит для измерения уровня клеток CD4 или Т-лимфоцитов — показатели, важные для для качества жизни пациентов с ВИЧ. Это белые клетки крови, предназначенные для распознавания болезнетворных организмов в нашем теле, которые должны уничтожаться иммунной системой. Снижение уровня CD4-клеток ниже 200 означает очень серьезные нарушения иммунной системы.
Эпидемия ВИЧ началась раньше пандемии коронавируса. Согласно UNAIDS, в 2020 году во всем мире насчитывалось не менее 37,6 млн пациентов с ВИЧ. Но главный тренд — за последние десятилетия инновации существенно изменили качество и продолжительность их жизни, а доступность диагностики и лечения снизили смертность на 61% по сравнению с максимумом в 2004 году. Также с 1996 года более чем на 30 лет выросла общая продолжительность жизни человека с ВИЧ при условии раннего обнаружения и использования терапии.
Подробнее о подходах к лечению и о том, как инновации продолжают улучшать качество жизни с ВИЧ, расскажут ученые-медики из разных стран на онлайн-конференции PROHIV 2021, которая пройдет 20–21 сентября.
Читайте также:

