Схема вирусологического исследования при вирусных болезнях
Обновлено: 18.04.2024
1. Дайте понятие вирусам. Охарактеризуйте особенности строения и жизни вирусной частицы.
2. Какими факторами осуществляется защита организма человека от вируса.
3. Назовите группу и механизм действия препаратов на вирусы. Приведите примеры препаратов.
4. Назовите типы инфекции, вызываемые вирусами.
5. Назовите представителей кишечных, кровяных, респираторных вирусных инфекций, инфекций кожных покровов и слизистых.
7. Назовите, как называются мероприятия, ликвидирующие эпидемический процесс.
Самостоятельная работа студентов:
Запишите определения методов исследования вирусных инфекций.
Зарисйте в атлас внутриклеточные включения при натуральной оспе (тельца Гварниери), при бешенстве (тельца Бабеша-Негри).
3. Составьте план противоэпидемических мероприятий на вирусную инфекцию (инфекцию определяет преподаватель).
Краткие теоретические положения
Введение
Расширение возможностей в лечении и профилактике вирусных болезней с использованием противовирусных препаратов, иммуномодуляторов и вакцин с различным механизмом действия нуждается в быстрой и точной лабораторной диагностике. Узкая специфичность некоторых противовирусных препаратов также требует быстрой и высокоспецифичной диагностики инфицирующего агента. Появилась необходимость в количественных методах определения вирусов для мониторинга противовирусной терапии. Помимо установления этиологии заболевания лабораторная диагностика имеет важное значение в организации противоэпидемических мероприятий.
Ранняя диагностика первых случаев эпидемических инфекций позволяет своевременно провести противоэпидемические мероприятия – карантин, госпитализацию, вакцинацию и пр. Реализация программ по ликвидации инфекционных заболеваний, например натуральной оспы, показала, что по мере их выполнения возрастает роль лабораторной диагностики. Существенную роль играет лабораторная диагностика в службе крови и акушерской практике, например, выявление доноров, инфицированных вирусом иммунодефицита человека (ВИЧ), вирусом гепатита В (HBV), диагностика краснухи и цитомегаловирусной инфекции у беременных.
Методы диагностики вирусных инфекций
Для успешного выделения вирусов клинический материал должен быть взят в соответствии с патогенезом предполагаемого заболевания и в наиболее ранние сроки.
Как правило, берутся:
– при респираторных инфекциях – носоглоточный смыв;
– при энтеровирусных инфекциях – смыв и фекалии (рео-, энтеровирусы);
– при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа);
– при экзантемных инфекциях – смывы (корь, краснуха);
– при арбовирусных инфекциях – кровь, спинномозговая жидкость.
1. Быстрые (экспресс-методы) — прямое обнаружение вируса или его компонентов (антигенов, НК), включений непосредственно в клиническом материале.
А. Вирусоскопический метод заключается в обнаружении вируса в исследуемом материале под микроскопом. Чаще всего используют электронный микроскоп. Световая микроскопия из-за ничтожно малых размеров вирусов практически не применяется. При данном методе можно определить тип НК, размеры вириона, форму вириона, а также выявить внутриклеточные включения, которые образуются в пораженных клетках при некоторых инфекциях.


II. Вирусологический метод основан на:
Культивировании вирусов в чувствительных биологических системах (клеточных культурах, курином эмбрионе, организмах лабораторных животных),их индикации по цитопатогенному действию на биологическую систему (рис.1), идентификации по ингибиции действия вирусов соответствующими противовирусными антителами (рис.2).


Рис. 1. Цитопатическое действие вирусов на клетку: А - нормальный рост, Б - ЦПД вирусов на клетку

Рис.2 Ингибиция вируса антителами
Вирусологическое исследование - это "золотой стандарт" вирусологии и должно проводится в специализированной вирусологической лаборатории. В настоящее время оно используется практически только в условиях возникновения эпидемической вспышки того или иного вирусного инфекционного заболевания.
III. Серологический метод — определение противовирусных антител (оптимально — IgM) и/или определение динамики нарастания их титров за определенный период заболевания в парных сыворотках. Диагностически значимым считают нарастание титра антител в 4 и более раз.
Метод парных сывороток: осуществляем сбор венозной крови в количестве 10 мл в начале болезни и в конце, приготавливаем сыворотку, определяем количество антител в первой и второй сыворотке.
При этом четырехкратное нарастание титра антител во второй сыворотке в большинстве случаев служит показателем протекающей или свежеперенесенной инфекции. При исследовании одной сыворотки, взятой в острой стадии болезни, диагностическое значение имеет обнаружение антител класса Ig М, свидетельствующее об острой инфекции.
Современные методы диагностики:
1. ПЦР - выявляют персистирующие вирусы по НК, находящиеся в клиническом материале, с трудом обнаруживаемые или не обнаруживаемые другими методами.
2. Радиоизотопный иммунный анализ (РИА) - метод основан на метке антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного антигена. Широкое распространение метод получил в 80-е годы, особенно для определения маркеров HBV и других некультивируемых вирусов. К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков).
3. Иммуноферментный анализ (ИФА) – Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на мечении антител ферментами, а не красителями. Наиболее широко используется пероксидаза хрена и щелочная фосфатаза, применяют также b-галактозидазу и b-лактамазы. Меченые антитела связываются с антигеном, и такой комплекс обнаруживается при добавлении субстрата для фермента, с которым конъюгированы антитела. Конечный продукт реакции может быть в виде нерастворимого осадка, и тогда учет проводится с помощью обычного светового микроскопа, или в виде растворимого продукта, который обычно окрашен (или может флюоресцировать или люминесцировать) и регистрируется инструментально.
Поскольку с помощью ИФА можно измерять растворимые антигены, то не требуется наличия интактных клеток в образце и таким образом могут использоваться различные виды клинического материала.
Другое важное преимущество метода ИФА – возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии. ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте.
Твердофазный ИФА, дающий растворимый окрашеный продукт реакции, нашел наибольшее распространение. ИФА может быть использован как для определения антигена (тогда на твердую фазу – дно лунки полистиролового планшета – наносятся антитела), так и для определения антител (тогда на твердую фазу наносятся антигены).
4. Реакция иммунофлюоресценции (РИФ) – Метод основан на использовании антител, связанных с красителем, например флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики.
В практике применяются два варианта РИФ: прямой и непрямой. В первом случае применяются меченные красителем антитела к вирусам, которые наносятся на инфицированные клетки (мазок, культура клеток). Таким образом, реакция протекает одноэтапно. Неудобством метода является необходимость иметь большой набор конъюгированных специфических сывороток ко многим вирусам.
При непрямом варианте РИФ на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале, а затем наслаивается антивидовая сыворотка к гамма-глобулинам животного, в котором готовилась специфическая иммунная сыворотка, например антикроличья, антилошадиная и т. п. Преимущество непрямого варианта РИФ состоит в потребности лишь одного вида меченых антител.
Метод РИФ широко применяется для быстрой расшифровки этиологии острых респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки верхних дыхательных путей. Успешное применение РИФ для прямой детекции вируса в клиническом материале возможно лишь в случае содержания в нем достаточно большого числа инфицированных клеток и незначительной контаминации микроорганизмами, которые могут давать неспецифическое свечение.
5. Другие методы диагностики –
РТГА используется для диагностики заболеваний, вызванных гемагглютинирующими вирусами. Она основана на связывании антителами сыворотки больного добавленного стандартного вируса. Индикатором реакции являются эритроциты, агглютинирующиеся вирусом (формирование характерного "зонтика") при отсутствии специфических антител и оседающие на дно неагглютинированными при их наличии.
РСК является одной из традиционных серологических реакций и используется для диагностики многих вирусных инфекций. В реакции принимают участие две системы: антитела сыворотки больного + стандартный вирус и эритроциты барана + антитела к ним, а также оттитрованный комплемент. При соответствии антител и вируса этот комплекс связывает комплемент и лизиса бараньих эритроцитов не происходит (положительная реакция). При отрицательной РСК комплемент способствует лизису эритроцитов. Недостатком метода является его недостаточно высокая чувствительность и трудность стандартизации реагентов.
Для учета значимости РСК также, как и РТГА, необходимо титрование парных сывороток, то есть взятых в начале заболевания и в период реконвалесценции.
РПГА – агглютинация сенсибилизированных вирусными антигенами эритроцитов (или полистироловых шариков) в присутствии антител. На эритроцитах могут быть сорбированы любые вирусы, независимо от наличия или отсутствия у них гемагглютинирующей активности. В связи с наличием неспецифических реакций сыворотки исследуются в разведении 1:10 и более.
РНГА – агглютинация эритроцитов, сенсибилизированных специфическими антителами в присутствии вирусных антигенов. Наибольшее распространение РОПГА получила при выявлении HBs-антигена как у больных, так и у доноров крови.
Вирусология (вирус[ы] + греч. logos учение) — учение о вирусах; самостоятельная область биологии, развивающая знания о субмикроскопических внутриклеточных паразитах, поражающих людей, животных, растения и микроорганизмы. К этой же области биологии относится учение о вирусах бактерий.
Вирусология занимает значительное место в биологии и медицине, т. к. вирусы вызывают многие заболевания людей, животных, растений, поражают плесневые грибы, простейшие организмы и бактерии, а также в связи с тем, что на модели вирусов изучаются основные проблемы генетики и молекулярной биологии.
История
Основоположник Вирусологии — русский ученый Д. И. Ивановский. Изучая мозаичную болезнь табака и использовав при этом метод фильтрации, он установил в 1892 г., что фильтрат из растертой взвеси листьев, пораженных этой болезнью, не содержал видимых в микроскоп микроорганизмов, однако вызывал типичные признаки мозаичной болезни у здоровых растений. На основании этих опытов Ивановский сделал вывод, что мозаичная болезнь табака вызывается мельчайшими микроорганизмами, проходящими через керамические фильтры, задерживающие все известные в то время бактерии, что они не способны расти на искусственных питательных средах, применяемых в бактериологии, и передаются в серии последовательных пассажей (прививок). В 1902 г. Ивановский обнаружил кристаллические включения в клетках табачных растений, пораженных мозаичной болезнью, в дальнейшем другими учеными было подтверждено, что это скопление вирусных частиц.
Использование метода фильтрации позволило в дальнейшем установить прохождение через керамические фильтры возбудителей других известных заболеваний человека и животных: ящура [Ф. Леффлер и Фрош (P. Frosch), 1898], желтой лихорадки [Рид (W. Reed, 1901) с сотр.]. В 1911 г. Ф. Раус доказал вирусную этиологию саркомы кур, т. е. впервые экспериментально установил, что вирусы могут вызывать неопластические процессы.
Для изучения вирусов, поражающих животных и растения, использовались в качестве модели соответствующие виды животных и растений. Для изучения и выделения вирусов, вызывающих заболевания человека, применялись восприимчивые к этому вирусу лабораторные животные (мыши, крысы, морские свинки, кролики, хорьки и т. д.). Широко использовались приемы введения различного инфекционного материала в роговицу глаза, кожу, мозг, дыхательные пути, а также принцип повторных пассажей на различных видах животных. Так, используя экспериментальных животных, выделили и изучили вирусы бешенства, оспы, герпеса, ящура, гриппа, энцефалитов, полиомиелита, хориоменингита и др. Однако к концу 30-х годов возможности этого метода были исчерпаны, т. к. не удавалось выделить многие вирусы, к к-рым экспериментальные животные были невосприимчивы, или нельзя было получить большого количества вирусов, очищенных от тканевых элементов, и в высоких концентрациях.
В 1931 г. был предложен метод культивирования вирусов на 8—13-дневном курином эмбрионе Вудраффом (М. F. Woodruff) и Э. Гудпасчером. В 40-х годах метод получил широкое распространение в вирусологии, т. к. имел ряд преимуществ: простота применения, большая чувствительность, возможность накопления большого количества вируса, относительная герметичность, предохраняющая от контаминации, относительная простота очистки от примесей, возможность быстрого определения наличия вируса в жидкостях эмбриона по данным реакции гемагглютинации.
Методом культивирования в курином эмбрионе (в клетках амниотической оболочки, в отдельных органах зародыша и клетках желточного мешка) были изучены вирусы гриппа человека и животных, чумы птиц, коровьей оспы, герпеса человека, энцефаломиелита лошадей и др. Эндерс, Роббинс, Уэллер (J. F. Enders, F. С. Robbins, Т. H. Weller, 1948—1952) применили для выделения и изучения вирусов метод культур клеток и тканей. Этот метод стал широко использоваться в различных вирусологических исследованиях и за несколько лет обогатил науку не только открытием сотен неизвестных ранее вирусов, но расширил возможности производства более качественных вирусных вакцин и диагностических препаратов; метод тканевых культур открыл новые возможности изучения различных аспектов и этапов процесса взаимодействия вируса и клетки (см. Культивирование вирусов, Культуры клеток и тканей).
Дальнейший прогресс В., и в частности изучение структуры, физиологии, биохимии и генетики вирусов, зависел от получения их в концентрированном и очищенном виде и был связан с внедрением новых физ.-хим. методов исследования: дифференциального и градиентного центрифугирования, молекулярно-адсорбционной и ионообменной хроматографии, электрофореза на бумаге и в полиакриламидном геле, радиоактивных изотопов и ряда других.
Быстрый прогресс В. был обусловлен применением электронных микроскопов с высокой разрешающей способностью (до 1,0—0,5 нм, в сочетании с методами оттенения и двойного оттенения, ультратонких срезов, позитивного и негативного контрастирования, а также авторадиографии, цитохимических и иммунохимических методов исследования. Использование комплекса перечисленных методов позволило изучить структурную организацию вирионов различных вирусов, предложить новую классификацию вирусов, основанную на их строении и биохимическом составе, изучить закономерности репродукции вирусов и определить детали их онтогенеза, охарактеризовать основные параметры субвирусных компонентов (нуклеиновых кислот, белков и др.), начать углубленные исследования по генетике вирусов и приступить к разработке рациональных подходов к химиотерапии вирусных инфекций.
Развитие Вирусологии способствовало изучению и решению общебиологических проблем: доказательству генетической функции нуклеиновых кислот, расшифровке генетического кода, пониманию важнейших механизмов регуляции синтеза клеточных макромолекул, установлению передачи информации от клетки к клетке и др.
Практическое здравоохранение получило ряд надежных вакцин для специфической профилактики не только оспы, что было известно еще задолго до рождения В. как науки, но и желтой лихорадки, полиомиелита, кори; появились новые средства для неспецифического воздействия на вирусные инфекции, напр, интерферон (см.).
Основные направления современной вирусологии
Основные направления современной общей и мед. вирусологии: дальнейшее изучение тонкой структуры вирусов, их биохимии и генетики, репликации вирусных нуклеиновых кислот, взаимодействия вируса с клеткой, углубленное изучение противовирусного иммунитета, совершенствование методов выделения вирусов и диагностики вирусных заболеваний, разработка основ химиотерапии и химиопрофилактики вирусных инфекций; изучение экологии вирусов, разработка более совершенных методов профилактики, поиски и испытание препаратов для лечения вирусных заболеваний.
Особое внимание будет сосредоточено на изучении вирусов, вызывающих неопластические процессы, а также латентных вирусных инфекций и скрытого вирусного носительства, поисках возбудителей инфекционного и сывороточного гепатита, разработке профилактики гриппа.
В 30-х годах в СССР были созданы первые вирусологические лаборатории: по изучению вирусов растений— при Украинском институте защиты растений (1930), по изучению вирусов животных — в Ин-те экспериментальной ветеринарии в Москве в 1930 г. (Н. Ф. Гамалея), Центральная вирусологическая лаборатория НКЗ РСФСР в Москве (Л. А. Зильбер) и отдел вирусологии в Ин-те эпидемиологии и микробиологии им. Л. Пастера в Ленинграде (А. А. Смородинцев) в 1935 г. В послевоенные годы в СССР созданы и функционируют профильные научно-исследовательские, научно-производственные и практические учреждения. По данным на 1-е января 1973 г., в СССР исследования по общей и мед. В. проводились в 60 научных, научно-производственных учреждениях и учебных заведениях. Наиболее значительные: Ин-т вирусологии им. Д. И. Ивановского АМН СССР, Ин-т полиомиелита и вирусных энцефалитов АМН СССР, Ин-т эпидемиологии и микробиологии им. Н. Ф. Гамалеи АМН СССР, Ин-т экспериментальной и клинической онкологии АМН СССР, Ин-т молекулярной биологии АН СССР, Ин-т микробиологии АН СССР, Всесоюзный ин-т гриппа М3 СССР, Московский научно-исследовательский ин-т вирусных препаратов М3 СССР, Свердловский научно-исследовательский ин-т вирусных инфекций М3 РСФСР, Ин-т вирусологии и микробиологии АН Украинской ССР, Одесский научно-исследовательский ин-т вирусологии и эпидемиологии им. И. И. Мечникова М3 Украинской ССР, Институт инфекционных болезней М3 Украинской ССР, Ин-т микробиологии им. А. Кирхенштейна АН Латвийской ССР; во всех научно-исследовательских ин-тах микробиологии и эпидемиологии союзных республик созданы вирусологические лаборатории и отделы.
Наиболее крупные зарубежные учреждения, проводящие научные исследования по общей и мед. В.: National Institute for Medical Research (Лондон), National Communicable Disease Centre (Атланта, США), National Institute of Health (Токио), National Institute of Health (Бетесда, США), Institute of Epidemiology and Microbiology (Прага), Institute of Virology (Братислава), Institute Pasteur (Париж), Institute Inframicrobiology (Бухарест), Institute of Virology (Глазго, Англия), State Institute of Hygiene (Будапешт), Virus Research Centre (Пуна, Индия), Queensland Institute of Medical Research (Брисбейн, Австралия).
Результаты научных исследований по общей и мед. В. публикуются в следующих научных журналах: Доклады АН СССР (Москва), Бюллетень экспериментальной биологии и медицины (Москва), Вопросы вирусологии (Москва), Журнал микробиологии, эпидемиологии и иммунологии (Москва), Вестник АМН СССР (Москва), Archiv fur die gesamte Virusforschung (Вена), Acta Virologica (Прага), Virology (Нью-Йорк), Ann. Institute Pasteur (Париж), Revue Romanine de Virologie (Бухарест), Inter. Journal of Cancer (Хельсинки), Journal of Virology (Вашингтон), Advances Virus Research (Питтсбург, США), Journal of the National Cancer Institute (Бетесда, США), Intervirology (Берн).
Первые монографии по вирусологии: Rivers Т., Filterable Viruses, Baltimore, 1928; Hauduroy P., Les Ultra Virus, Paris, 1929; Гамалея H. Ф. Фильтрующиеся вирусы, М., 1930.
Результаты научных исследований по В. обсуждаются на конференциях, сессиях, проводимых профильными ин-тами, а также на международных конгрессах.
В СССР первая научная конференция по вирусным болезням растений состоялась в марте 1935 г. в Харькове, первая научная конференция по ультрамикробам, фильтрующимся вирусам и бактериофагам — в декабре 1935 г. в Москве. В 1966 г. на 9-м Международном конгрессе по микробиологии впервые был избран Международный комитет по номенклатуре вирусов.
1-й Международный конгресс по В. состоялся в 1968 г. в Хельсинки, 2-й — в 1971 г. в Будапеште (был принят устав секции вирусологов, учрежденной в рамках Международной ассоциации микробиологов), 3-й в 1975 г. в Мадриде.
Развитие В. привело к открытию новых вирусов, количество которых быстро возрастало, в связи с чем создавались коллекции вирусов — музеи, где хранились вирусы, выделенные как в данной стране, так и полученные из других стран. Наиболее крупные коллекции вирусов: в СССР (Москва, Ин-т вирусологии АМН СССР) — Государственная коллекция вирусов, основана в 1956 г. как филиал Всесоюзного музея живых культур и условнопатогенных микроорганизмов; в США (Вашингтон) — коллекция вирусов и риккетсий, основана в 1959 г. на базе коллекции типовых культур (American type culture collection, Washington 7, Rockville, Maryland, USA); в ЧССР (Прага, Ин-т эпидемиологии и микробиологии) — Чехословацкая национальная коллекция типовых культур, основана в 1969 г. (Czechoslovak National collection of type cultures of the Institute Epidemiology and Microbiology, Prague); в Японии (Токио) — Японская коллекция культур микроорганизмов, основана в 1962 г. (The Japanes Federation of Culture collection of Microorganisms, Tokyo, Japan); в Англии (Лондон) — каталог национальной коллекции типовых культур, основан в 1936 г. (Medical Research Council, Catalog of the National collection of Type cultures, London, England); в Швейцарии (Лозанна, Международный центр живых культур) имеется международный каталог вирусов.
Преподавание Вирусологии в медицинских вузах СССР проводится кафедрами микробиологии на II и III курсах, а по вирусным инфекциям лекции и клинические занятия проводят кафедры инфекционных болезней на V курсе.
На биол, ф-тах Московского и Киевского ун-тов созданы в течение последних 10 лет кафедры В., где готовят специалистов-вирусологов и ведется преподавание В. в течение одного семестра студентам других ф-тов.
Прогресс мед. В. в СССР сопровождался ростом числа специалистов высокой квалификации: с 1946 по 1960 г. подготовлено 16 докт, наук, с 1961 по 1972 г.— 140, кандидатов наук соответственно 217 и 836 (из них 54% путем обучения в аспирантуре). Важное значение в подготовке кадров вирусологов (специализация и усовершенствование) сыграла созданная в 1955 г. кафедра В. при ЦИУ, к-рая подготовила с октября 1955 г. по 1964 г.— 688 специалистов, а с 1965 г. по январь 1974 г.— 933, гл. обр. для обеспечения вирусологической работы в сан.-эпид, станциях.
Библиография: Авакян А. А. и Быковский А. Ф. Атлас анатомии и онтогенеза вирусов человека и животных, М., 1970, библиогр.; Бешенство, под ред. В. Д. Соловьева, М., 1954, библиогр.; Гаврилов В. И., Семенов Б. Ф. и Жданов В. М. Хронические вирусные инфекции и их моделирование, М., 1974, библиогр.; Гамалея Н. Ф. Фильтрующиеся вирусы, М.—Л., 1930; Гендон Ю. 3. Генетика вирусов человека и животных, М., 1967, библиогр .; Жданов В. М. и Гайдамович С. Я. Вирусология, М., 1966; Жданов В.М.,Соловьев В. Д. и Эпштейн Ф. Г. Учение о гриппе, М., 1958; Зильбер Л. А. Учение о вирусах (общая вирусология), М., 1956; Ивановский Д. И. О двух болезнях табака, Сельское хоз. и лесоводство, т. 169, № 2, с. 104, 1892; Косяков П. Н. и Ровнова 3. И. Противовирусный иммунитет, М., 1972; Морозов М. А. и Соловьев В. Д. Оспа, М., 1948; Першин Г. Н. и Богданова Н. С. Химиотерапия вирусных инфекций, М., 1973, библиогр.; С о-ловьев В. Д. Весенне-летний клещевой энцефалит, М., 1944, библиогр.; Соловьев В. Д. и Баландин PI. Г. Биохимические основы взаимодействия вируса и клетки, М., 1969, библиогр.; они же, Клетка и вирус, М., 1973, библиогр.; Соловьев В. Д. и Бектемиров Т. А. Интерферон в теории и практике медицины, М., 1970, библиогр.; Тихоненко Т. И. Биохимия вирусов, М., 1965, библиогр.; Шубладзе А. К. и Гайдамович С. Я. Краткий курс практической вирусологии, 2-е изд., М., 1954; Шубладзе А. К., Бычкова E. Н. и Баринский И. Ф. Вирусемия при острых и хронических инфекциях, М., 1974; Comprehen sive virology, ed. by H. Fraenkel-Conrat a. R. R. Wagner, v. 1 — 4, N. Y., 1974, bibliogr.; Starke G. u. HlinakP. Grundriss der allgemeinen Virologie, Jena, 1974, Bibliogr.
Периодические издания — Вопросы вирусологии, М., с 1956; Медицинский реферативный журнал, Раздел III — Медицинская микробиология, Вирусология, Медицинская паразитология, Эпидемиология, Инфекционные болезни, М., с 1960; Acta virologica, Praha, с 1957; Archiv fiir die gesamte Virusforschung, Wein, с 1939; Excerpta medica, Section IV — Microbiology, Bacteriology, Virology, Mycology and Parasitology, Amsterdam, с 1968; Journal of General Virology, L., с 1967; Journal of Virology, Baltimore , с 1969; Virology, N. Y., с 1955.
Вирусологический метод включает два основных этапа: выделение вирусов и их идентификацию. Материалами могут быть кровь, другие биологические и патологические жидкости, биоптаты органов и тканей.
Вирусологическое исследование крови часто проводят с целью диагностики арбовирусных инфекций. В слюне могут быть обнаружены вирусы бешенства, эпидемического паротита, простого герпеса. Носоглоточные смывы служат для выделения возбудителей гриппа и других ОРВИ, кори. В смывах с конъюнктивы обнаруживают аденовирусы. Из фекалий выделяют различные энтеро-, адено-, рео- и ротавирусы.
Для выделения вирусов используют культуры клеток, куриные эмбрионы, иногда лабораторных животных. Большинство патогенных вирусов отличает наличие тканевой и типовой специфичности', например, полиовирус репродуцируется только в клетках приматов, поэтому для выделения определенного вируса используют соответствующую культуру ткани. Для выделения неизвестного возбудителя целесообразно одномоментно заражать 3—4 культуры клеток, предполагая, что одна из них может оказаться чувствительной. Наличие вируса в зараженных культурах определяют по развитию специфической дегенерации клеток, т.е. цитопатогенному действию, обнаружению внутриклеточных включений, а также на основе выявления специфического антигена методом иммунофлюоресценции, положительных реакций гемадсорбции и гемагглютинации. Эмбрионы птиц с их малодифференцированными тканями пригодны для культивирования очень многих вирусов. Чаще всего используют эмбрионы кур. При размножении в эмбрионах вирусы могут вызвать их гибель (арбовирусы), появление изменений на хорион-аллантоисной оболочке (оспенные вирусы) или в теле эмбриона, накопление в эмбриональных жидкостях гемагглютининов (вирусы гриппа, паротита) и комплементсвязывающего вирусного антигена.
Вирусы идентифицируют с помощью иммунологических методов: реакции торможения гемагглютинации, связывания комплемента, нейтрализации, преципитации в геле, иммунофлюоресценции.
3.4 Биологический метод
Биологический метод состоит в заражении различным материалом (клиническим, лабораторным) лабораторных животных для индикации возбудителя, а также для определения некоторых свойств микроорганизмов, характеризующих их патогенность (токсигенность, токсичность, вирулентность). В качестве лабораторных животных используют белых мышей, белых крыс, морских свинок, кроликов и др.
Воспроизведение заболевания у животного — абсолютное доказательство патогенности выделенного микроорганизма (в случае бешенства, столбняка и др.). Поэтому биологическая проба на животных является ценным и достоверным диагностическим методом, особенно при тех инфекциях, возбудители которых в исследуемых биологических средах организма человека содержатся в малых концентрациях и плохо или медленно растут на искусственных средах.
3.5 Иммунологический метод
Диагностически значимо увеличение титра антител в исследуемой сыворотке крови не менее чем в 4 раза относительно первоначального уровня. Этот феномен называют сероконверсией. При редких инфекционных болезнях, а также вирусных гепатитах, ВИЧ-инфекции и некоторых других факт наличия антител свидетельствует об инфицированности пациента и имеет диагностическое значение.
Кроме определения титра антител, при проведении серологических исследований можно установить изотип антител. Известно, что при первой встрече организма человека с возбудителем в остром периоде болезни выявляют более быстрое нарастание антител, принадлежащих к IgM, уровень которых, достигая максимального значения, затем снижается. В более поздние сроки болезни повышается количество IgG-антител, которые дольше сохраняются и определяются в периоде ре-конвалесценции. При повторной встрече с возбудителем благодаря иммунологической памяти реакции гуморального иммунитета проявляются более быстрой продукцией IgG-анти-тел, а антитела класса М вырабатываются в незначительном количестве. Обнаружение IgM-антител свидетельствует о наличии текущего инфекционного процесса, а наличие IgG-антител — о перенесенной в прошлом инфекции или поствакцинальном иммунитете.
Учитывая особенности первичного и вторичного иммунного ответа, анализ соотношения IgM- и IgG-антител позволяет в некоторых случаях дифференцировать стадию инфекционного процесса (разгар заболевания, реконвалесценция, рецидив). Например, в случае вирусного гепатита А (ГА) надежным методом диагностики служит определение анти-HAV IgM-антител в сыворотке крови. Их выявление свидетельствует о текущей или недавно возникшей HAV-инфекции.
Серологическое исследование для обнаружения антител при инфекционных заболеваниях является более доступным методом лабораторной диагностики, чем выделение возбудителя. Иногда положительная серологическая реакция служит единственным доказательством встречи и взаимодействия организма с возбудителем соответствующего инфекционного заболевания. Кроме того, ряд заболеваний со сходной клинической картиной (например, риккетсиозы, энтеровирусные инфекции) могут быть дифференцированы лишь серологически, что отражает значение серологических методов в диагностике инфекционных болезней.
Лабораторная диагностика – это система мер по обнаружению, индикации вируса. В нее входят: получение посланного патологического материла, исследование патологического материала методом быстрой диагностики, исследование длительными методами (ретроспективная диагностика, исследование парных сывороток в серореакциях).
Лабораторные исследования. I.Индикация вируса в патологическом материале. 1.Обнаружение – световая микроскопия крупных вирусов (Poxviridae), электронная микроскопия. 2.Обнаружение телец-включений. (тельца Бабеша-Шенегри при бешенстве) 3.Обнаружение вирусных антигенов: серологические реакции. 4.Обнаружение вирусных НК (ДНК-зонды и ПЦР – полимеразно-цепная реакция). 5.Обнаружение активной формы вируса путем биопробы (лабораторные животные, куриные эмбрионы, культура клеток). 6.Обнаружение гемаглютининов у гемаглютинирующих вирусов (в настоящее время практически не используется по причине наличия более точных методов). II.Изоляция (выделение) вируса из патологического материала. Проводится не менее трех слепых пассажей, делается биопроба. А)Лабораторные животные (клиника, гибель, пат. изменения) Б)Куриные эмбрионы (гибель, пат. изменения, РГА) В)Культура клеток (ЦПД, РГАд, метод бляшек) III.Идентификация выделенного вируса – серологические реакции. IV.Доказательство этиологической роли. Иногда требуется доказать этиологическую роль выделенного вируса. Для этого используют парные сыворотки крови в серологических реакциях. В качестве АГ используют выделенный вирус, а в качестве АТ – парные сыворотки. Повышение титра антител во второй сыворотке в 4 и более раз свидетельствует о этиологической роли выделенного вируса.
Клинико-эпизоотологическая или до-лабораторная диагностика – проводится в хозяйствах и позволяет поставить лишь предварительный диагноз, проводится распознавание на основе сбора, сопоставления анализа о больных животных (клинические симптомы болезни, Патологоанатомические изменения в органах). Сбор эпизоотологических данных очень важен, позволяет получить данные о том, как протекает заболевание, сведения о хозяйствах. Если хозяйства неблагополучны, то это лишний раз подтверждает диагноз. Клинический осмотр ориентирует ветеринара только на несколько видов болезней. Основное значение все же у лабораторной диагностики.
I.Индикация вируса в патологическом материале. 1.Обнаружение – световая микроскопия крупных вирусов (Poxviridae), электронная микроскопия. 2.Обнаружение телец-включений (тельца Бабеша-Шенегри при бешенстве) 3.Обнаружение вирусных антигенов: серологические реакции. 4.Обнаружение вирусных НК (ДНК-зонды и ПЦР – полимеразно-цепная реакция). 5.Обнаружение активной формы вируса путем биопробы (лабораторные животные, куриные эмбрионы, культура клеток). 6.Обнаружение гемаглютининов у гемаглютинирующих вирусов (в настоящее время практически не используется по причине наличия более точных методов). Для идентификация выделенного вируса – серологические реакции. 1.РИФ – реакция иммунофлюорисценции. АГ + АТ меченные флюорохромом. Дают контакт 30 минут при 37 С, затем производят тщательный отмыв в ИХН. Метод обнаружения – флюоресцентное свечение под микроскопом. 2.ИФА – иммуно-ферментный анализ. АГ + АТ с ферментом. Контакт, отмыв, затем добавляют субстрат, который при контакте с АТ-ферментным комплексом дает цветную реакцию. 3.РСК – реакция связывания комплемента. АГ + АТ + комплемент. Контакт. Затем добавляют гем-систему (гемолизин + эритроциты барана). Контакт. Если гемолиза не происходит, значит АГ и АТ связали комплемент. Задержка гемолиза – реакция положительная. Если произошел гемолиз, значит комплемент связан гем-системой – реакция отрицательная. 4.РДП - реакция диффузной преципитиции. АГ + АТ (диффузия в агаровом геле). Метод обнаружения – образование контура преципитации. 5.РНГА – реакция непрямой гемаглютинации. Эритроциты нагружают АГ и при образовании комплекса АГ-АТ происходит агглютинация эритроцитов. 6.РТГА – реакция торможения гамаглютинации 7.РТГАд – реакция торможения гемадсорбции 8.РН – реакция нейтрализации. Вирус + АТ. Контакт. Ввод в чувствительную к вирусу систему. Метод обнаружения – нейтрализация инфекционной активности вируса.
Ретроспективная диагностика – преследует цель обнаружить динамику прироста АТ, основана на исследовании парных сывороток, которые берут дважды, в начале болезни и в конце. Их проверяют в одной из серореакций. Если прирост АТ в 4-5 раз больше – 100% постановка диагноза.
+ роль – метод позволяет достоверно поставить диагноз в большинстве случаев.
- роль – длительность ретроспективной диагностики.
Болезнь Ауески (псевдобешенство, зудящая чума, бешеная чесотка, инфекционный бульбарный паралич) – остро протекающая болезнь всех видов сельскохозяйственных животных, пушных зверей и грызунов. Характеризуется признаками поражения головного и спинного мозга, сильным зудом и расчесами.
Особый ущерб БА приносит в свиноводстве и пушном звероводстве. У пушных зверей это острая кормовая инфекция. Причиной является пища, которой нередко служат боенские отходы и субпродукты, полученные от больных животных или животных вирусоносителей.
Клиника. Инкубационный период – 1,5 суток – 10-12 дней в зависимости от метода заражения, вирулентности вируса и устойчивости животного. Вирус пантропен.
У свиней клиника протекает без признаков зуда. Тяжело болеют сосуны и отъемыши. Болезнь носит септический характер. Поросята обычно погибают через 4-12 часов. У поросят от 10 дней до 3-х месяцев первые признаки болезни – лихорадка (40-42), угнетение, слизистые истечения из носа. Позднее появляются признаки поражения ЦНС: беспокойство, манежные движения, потеря ориентации, судороги, прогиб спины, параличи глотки, гортани, конечностей, отек легких, слюнотечение. Болезнь длится от нескольких часов до 3-х дней. Летальность: 70-100%
У свиноматок проявляется в виде гриппоподобного синдрома с выздоровлением через 3-4 дня.
У КРС повышается температура до 42 С, прекращается жвачка, сильный зуд в областе ноздрей, губ, щек, отказ от корма, вялость, беспокойство, страх, учащенное дыхание, потливость, судороги жевательных и шейных мышц. Смерть наступает при нарастающей вялости через 1-2 суток. Выздоровления крайне редки.
У плотоядных животных наблюдается отказ от корма, пугливость, беспокойство, сильный зуд. Иногда у собак и кошек проявляются признаки бешенства. Потом наступает паралич глотки. Смерть через 2-3 суток. Животные не являются источником вируса и не выделяют его, являясь экологическим тупиком.
Заподозрить болезнь Ауески можно по характерным клиническим симптомам и патологоанатомическим изменениям (клинико-эпизоотологическая и патологоанатомическая диагностика).
Материал для исследования: смывы из носовой полости и кровь (лучше парные сыворотки), от трупов - кусочки головного мозга, легких, печени, селезенки.
Экспресс-метод - обнаружение вирусного антигена в РИФ. Вирусологический метод: а) выделение вируса на культуре клеток почек поросят: б) биопроба на кроликах (характерны зуд и расчесы в месте заражения).
Идентификация: РИФ, РН.
Ретроспективная диагностика: по приросту титра антител в парных выворотках.
Следует дифференцировать болезнь Ауески от бешенства, чумы свиней, гриппа, рожи, отравления поваренной солью.
Применятся живая вирусвакцина ВГНКИ, инактивированная культурная вакцина – иммунитет на 6-10 месяцев.За рубежом используются субъединичные и рекомбинантные вакцины.
Смотри вопрос №7
В целях определения вида данного вируса при изучении защитных процессов в организме больного человека или зараженного животного применяются серологические методы. Серология (от лат. Serum - сыворотка, жидкая составная часть крови) - это раздел иммунологии, изучающий реакции антигена специфическими защитными веществами, антителами, которые находятся в сыворотке крови. Антитела нейтрализуют действие вируса. Они связываются с определенными антигенными веществами, находящимися на поверхности вирусных частиц. В результате связывания молекул антител с поверхностной структурой вируса последний теряет свои патогенные свойства. Для установления уровня (количества) антител в сыворотке или определения типа данного вируса проводится реакция нейтрализации вируса. Ее можно проводить как на животных, так и на культуре клеток.
Минимальную концентрацию сыворотки, содержащей антитела, достаточную для того, чтобы нейтрализовать вирус, не дать ему проявить ЦПД, называют титром сыворотки, нейтрализующей вирус. Эта концентрация может быть выявлена и с помощью метода бляшек.
С помощью серологической реакции можно: определять титр АТ к гемагглютинирующему вирусу в сыворотке; идентифицировать неизвестный гемагглютинирующий вирус по известным сывороткам; установить степень АГ родства 2 вирусов, определять титр вируснейтрализующих АТ в сыворотке, или индекс нейтрализации, идентифицировать неизвестный вирус путем испытания его с различными заведомо известными сыворотками.
1. РИФ – реакция иммунофлюорисценции.
АГ + АТ меченные флюорохромом. Дают контакт 30 минут при 37 С, затем производят тщательный отмыв в физрастворе. Метод обнаружения – флюоресцентное свечение под микроскопом.
2. ИФА – иммуно-ферментный анализ.
АГ + АТ с ферментом. Контакт, отмыв, затем добавляют субстрат, который при контакте с АТ-ферментным комплексом дает цветную реакцию.
3. РСК – реакция связывания комплемента.
АГ + АТ + комплемент. Контакт. Затем добавляют гем-систему (гемолизин + эритроциты барана). Контакт. Если гемолиза не происходит, значит АГ и АТ связали комплемент. Задержка гемолиза – реакция положительная. Если произошел гемолиз, значит комплемент связан гем-системой – реакция отрицательная.
4. РДП - реакция диффузной преципитиции.
АГ + АТ (диффузия в агаровом геле). Метод обнаружения – образование контура преципитации.
5. РНГА – реакция непрямой гемаглютинации.
Эритроциты нагружают АГ и при образовании комплекса АГ-АТ происходит агглютинация эритроцитов.
6. РТГА – реакция торможения гамаглютинации
7. РТГАд – реакция торможения гемадсорбции
8. РН – реакция нейтрализации.
Вирус + АТ. Контакт. Ввод в чувствительную к вирусу систему. Метод обнаружения – нейтрализация инфекционной активности вируса.
Цель занятия: разбор теоретических основ общей вирусологии (репродукция и генетика вирусов, особенности вирусных инфекций и противовирусного иммунитета); знакомство с методами индикации и идентификации вирусов, серологическими реакциями, применяемыми для диагностики вирусных инфекций.
Перечень конкретных учебно-целевых вопросов
1. Репродукция вирусов. Основные стадии взаимодействия вирусов с клеткой: адсорбция, характеристика вирусных лигандов и клеточных рецепторов; проникновение в клетку, механизмы; депротеинизация; синтез вирусных макромолекул; сборка вирионов; выход из клетки, пути выхода.
2. Интерференция. Дефектные интерферирующие частицы и их значение в развитии вирусной инфекции. Вирусы-сателлиты. Интегративная инфекция.
3. Генетика вирусов. Значение вирусологии в развитии генетики. Организация генетического аппарата вирусов. ДНК и РНК – носители генетической информации.
4. Генетическая изменчивость вирусов: мутации и рекомбинации. Мутации, причины возникновения. Фенотипические проявления. Генетические взаимодействия между вирусами. Рекомбинация. Генетическая реактивация. Модификационная изменчивость вирусов: комплементация и фенотипическое смешивание.
5. Патогенетические особенности вирусных инфекций. Инфекционность вирусных нуклеиновых кислот. Острая и персистирующая вирусная инфекция.
6. Индикация вирусов на биологических моделях. Характеристика цитопатогенного действия вирусов в культурах клеток. Вирусные включения. Бляшкообразование под агаровым покрытием. Гемадсорбция.
7. Идентификация вирусов с помощью реакций иммунитета – РН, РСК, РТГА, РП, ИФА, РИА, РИФ и др.
8. Методы лабораторной диагностики вирусных инфекций: микроскопический, вирусологический, серологический, молекулярно-генетические (ПЦР, молекулярная гибридизация).
9. Особенности противовирусного иммунитета.
Методы выявления (индикация) и идентификации вирусов
Перед выявлением вируса в клетках его обычно отделяют от клеток хозяина путем их разрушения с помощью многократного замораживания и оттаивания или растирания со стерильным песком. Полученный вирусосодержащий материал центрифугируют или пропускают через бактериальный фильтр, обрабатывают антибиотиками для деконтаминации и предотвращения бактериального загрязнения.
Индикация вирусов
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла. Частичная дегенерация культур клеток может протекать по следующим типам:
гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).


Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х200
Индикация вирусов с помощью реакции гемадсорбции (РГад). Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 4 0 , 20 0 или 37 0 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе. Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям. Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому- Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявление вирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).

Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Индикация вирусов в куриных эмбрионах. Зараженные РКЭ инкубируют в термостате при 35- 37 0 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри.
При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов -поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке. Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
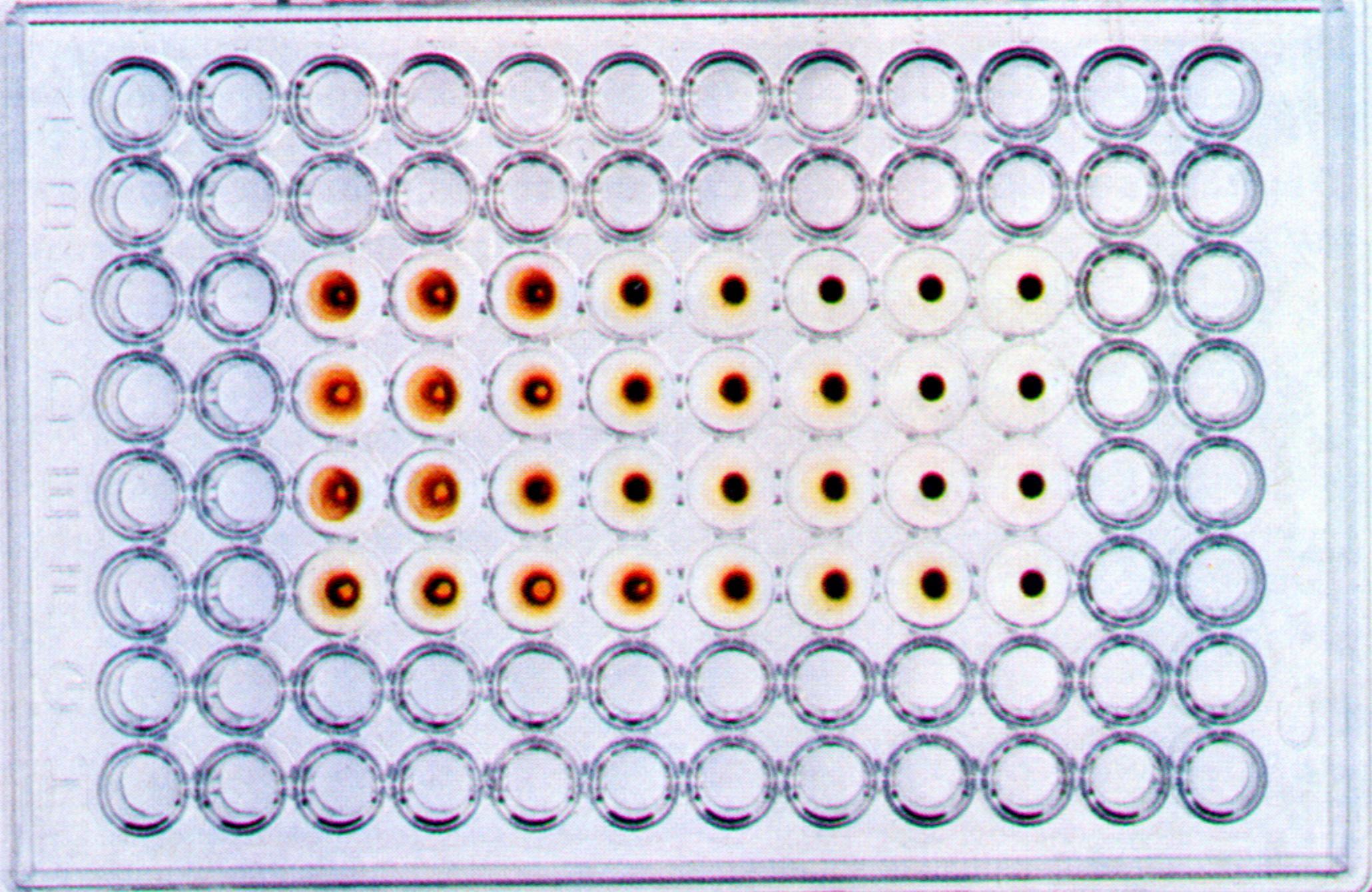
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Читайте также:

