Синий йод лечение папиллом
Обновлено: 24.04.2024
Проблема очаговых заболеваний, вызванных бактериальными патогенами, актуальна для медицины в целом, однако особое значение она приобретает для медицинских специальностей, где основные нозологические формы представлены гнойно-воспалительными заболеваниями. Такой специальностью, в частности, является оториноларингология. Несмотря на большое количество лекарственных средств и современных технологий, летальность от развившихся генерализованных септических осложнений остается высокой. Острые респираторные вирусные инфекции (ОРВИ) являются наиболее частой патологией и в структуре общей заболеваемости занимают одно из ведущих мест. Их распространение в периоды сезонной заболеваемости принимает масштабы эпидемий. Так как для лечения большинства ОРВИ применения антибиотиков не требуется, следует обращаться к эффективным антисептическим средствам.
Роль инфекционного агента в развитии гнойно-септических инфекций очень важна, т. к. именно от вида микроорганизма, вызывающего инфекционный процесс, зависит специфика клинической картины и особенность морфологических изменений в органах. Появление в последние годы новых антисептических препаратов предоставляет возможность наиболее эффективного местного воздействия в оториноларингологической практике. Представляем препарат Бетадин ® – антисептик широкого спектра действия, обладающий бактерицидными, спороцидными и антивирусными свойствами.
Ключевые слова: антисептики, Бетадин, оториноларингология, ОРВИ.
The use of antiseptics in otorhinolaryngology
Kryukov A.I., Kunelskaya N.L., Tsarapkin G.Yu., Tovmasyan A.S.
Scientific Research Clinical Institute of Otorhinolaryngology named after L.I. Sverzhevskiy, Moscow
The problem of local diseases caused by bacterial pathogens is relevant for medicine in general, but it acquires special significance for medical specialties, where the main nosological forms are represented by purulent-inflammatory diseases. One of these specialties, in particular, is otorhinolaryngology. Despite the large number of medicines and the use of modern technologies, the lethality from the developed generalized septic complications remains high. Acute respiratory viral infections (ARVI) are the most frequent pathology and occupy one of the leading positions in the structure of the overall morbidity. The incidence of these infections remains at a high level, acquiring epidemic proportions during periods of seasonal diseases. As for the treatment of the majority of acute respiratory viral infections, the use of antibiotics is not required, excessive use should be avoided, and antiseptic drugs may be an effective option of the therapy.
The role of the infectious agent in the development of purulent-septic infections is very important, since it is known, that specificity of the infectious process and morphological changes in the organs depend the type of microorganism, causing the disease. In recent years some new antiseptic preparations have appeared, that provides the possibility of the most effective local antibacterial therapty in otorhinolaryngological practice. The article is devoted to the description of the preparation Betadine ® . It is a broad-spectrum antiseptic drug with bactericidal, sporicidal and antiviral properties.
Key words: antiseptics, Betadine, otorhinolaryngology, ARVI.
For citation: Kryukov A.I., Kunelskaya N.L., Tsarapkin G.Yu., Tovmasyan A.S. The use of antiseptics in otorhinolaryngology //
RMJ. 2018. № 3(II). P. 78–81.
Статья посвящена возможностям применения антисептических средств в оториноларингологии. Показано, что при лечении большинства ОРВИ применения антибиотиков не требуется и необходимо обращаться к эффективным антисептическим средствам (препарат Бетадин).
Введение
Антисептики
Антисептическими (от лат. antisepticus – против гниения) называют противомикробные средства, которые задерживают развитие микроорганизмов, а дезинфицирующими – вещества, которые убивают микробы. Соответственно различают бактериостатическое действие, когда происходит остановка развития микроорганизмов, и бактерицидное действие, когда микроорганизмы полностью погибают.
При использовании антисептиков обеспечивается доставка оптимальной дозы активного ингредиента непосредственно на слизистую оболочку дыхательных путей или в очаг воспаления. При этом преимуществами местной терапии при инфекционно-воспалительных заболеваниях верхних дыхательных путей и уха являются простота и доступность введения в зону патологических изменений, высокая концентрация лекарственного вещества в очаге воспаления при малой общей дозе препарата, минимальный риск системных побочных эффектов.
Местные антисептики подразделяются на 11 основных групп: 1 – галоиды, в т. ч. препараты йода, 2 – окислители, 3 – кислоты, 4 – альдегиды, 5 – фенолы, 6 – спирты, 7 – гипертонические растворы, 8 – красители, 9 – соли тяжелых металлов, 10 – детергенты и 11 – производные нитрофуранов. Важной особенностью современной инфекции является наличие нескольких возбудителей – аэробных и анаэробных [7, 8], как правило, устойчивых к большинству антибиотиков. К сожалению, все чаще стала встречаться резистентность и ко многим антисептическим препаратам [9, 10].
Антисептические средства должны обладать: а) минимальной всасываемостью в месте их нанесения; б) низкой токсичностью; в) бактерицидным действием с сильным антимикробным и антипаразитарным эффектом; г) кратким латентным периодом действия, высокой активностью, в т. ч. в присутствии биологических субстратов, т. е. быть химически стойкими. Они не должны обладать повреждающим действием на ткани и процесс регенерации, а также аллергенными свойствами.
В настоящее время известно большое количество таких антисептических средств [11]. Однако в последнее время результаты исследований демонстрируют, что некоторые штаммы микроорганизмов, в особенности госпитальные, становятся устойчивыми ко многим антисептикам (водный раствор хлоргексидина, раствор калия перманганата, фурацилин и др.). В связи с этим активно ведется поиск новых препаратов, надежно предупреждающих распространение госпитальной инфекции.
Препараты йода
Так, все более широкое применение находят хорошо нам известные препараты йода и его комплексных соединений. В этом отношении особого внимания заслуживает препарат Бетадин ® (фармацевтическая компания Egis, Венгрия). Этот йодофор является антисептиком широкого спектра действия, обладающим бактерицидными, спороцидными и антивирусными свойствами [12]. Биологически активное вещество препарата – повидон-йод (в форме комплекса поливинилпирролидон-йода), антимикробный эффект которого обусловлен окислительным повреждением и блокированием мембраны клетки микроорганизма. Повидон-йод широко используется в хирургической практике уже более 30 лет, начиная с 1970–80-х годов [13, 14].
Действие Бетадина основано на повреждении йодом клеточной стенки патогенных микроорганизмов за счет окисления аминокислоты бактериальных белков, содержащих SH и OH-группы. В основном это бактериальные ферменты и трансмембранные белки. При окислении изменяется их четвертичная структура и они теряют каталитическую и энзимную активность [15]. Соединение йода с поливинилпирролидоном – синтетический полимер, не обладающий токсичными и антигенными свойствами, который способен обратимо присоединять другие вещества, такие как лекарственные токсины, препараты, гормоны [12]. В комплексе с поливинилпирролидоном йод теряет свойство вызывать жжение при нанесении, но сохраняет высокую бактерицидную активность, что позволило расширить область его применения как антисептического средства. Благодаря полимерной молекуле йод проникает глубоко в воспаленные ткани. Бетадин ® оказывает широкий спектр антимикробного действия, проявляя высокую активность в отношении грамотрицательных (Escherichia coli, Klebsiella pneumoniae, Mycobacterium tuberculosis, Neisseria gonorrhoeae, Proteus spp., Pseudomonas aeruginosa, Salmonella typhi, Shigella spp.), грамположительных (Bacillus subtilis, Clostridium perfringens, C. tetani, Propionibacterium acnes, Staphylococcus aureus, S. pyogenes) микроорганизмов, грибов (Aspergillus niger, Candida albicans, Microsporum audouinii, Nocardia spp., Penicillium spp., Triсhophyton spp.), а также спорообразующей флоры, простейших, трепонем, некоторых вирусов [14, 16, 17]. Особенно важным является тот факт, что, несмотря на длительный период применения повидон-йода в хирургической практике, наиболее часто встречающиеся возбудители инфекций не приобрели устойчивости к этому препарату [14, 18–21].
По сравнению с другими антисептиками препарат Бетадин ® обладает рядом важных преимуществ: сохраняет антисептические свойства в течение длительного периода нахождения на слизистой оболочке; сохраняет высокие антисептические свойства даже в присутствии крови и плазмы; не вызывает развития резистентных форм микроорганизмов; хорошо растворим в воде; нетоксичен при длительном и частом применении; редко вызывает аллергические реакции и устойчив при хранении [15].
Бетадин® выпускается в виде 10% раствора по 30, 120 и 1000 мл (соответственно содержит 3, 12 и 100 г комплексного соединения йода с поливинилпирролидоном) и 10% мази по 20 г (2 г комплексного соединения йода с поливинилпирролидоном). Несмотря на длительный период активного использования повидон-йода, проблемные возбудители гнойной инфекции не приобрели устойчивость к нему [14].
Применение препаратов йода при патологии глотки
Раствор Бетадин ® для полоскания глотки используется как дезинфицирующий при тонзиллите (обострении тонзиллита – ангине), фарингите, ларингите.
Для промывания лакун небных миндалин и полоскания глотки Бетадин ® необходимо развести в кипяченой воде или физиологическом растворе. Добавлять раствор при этом в горячую воду нельзя из-за снижения эффективности препарата; обычно 1 часть Бетадина разводят в 10 частях воды. При этом должен получиться желтый или светло-коричневый цвет раствора. Для предотвращения побочных эффектов полоскать следует 2 р./сут в течение 3 мин. Полоскать горло раствором Бетадина допустимо у детей старше 5 лет, поскольку дети младшего возраста не смогут правильно выполнить процедуру. При этом необходимо следить, чтобы ребенок не проглатывал жидкость. После полоскания следует воздержаться от приема воды и пищи на протяжении 20–30 мин для закрепления эффекта. Использовать следует только свежеприготовленный раствор, нельзя полоскать горло заранее приготовленной жидкостью. Длительное полоскание йодсодержащими растворами нежелательно и даже опасно, поэтому при отсутствии лечебного эффекта спустя 3–5 дней следует проконсультироваться с врачом. Эффективно применение повидон-йода, содержащегося в препарате Бетадин ® , при тонзиллитах для промывания и полоскания лакун миндалин в дозе 20 капель на 200 мл физраствора (1:10) 1 р./сут через день в течение 10 дней.
При местном лечении хронического тонзиллита препарат Бетадин ® способствует более быстрому купированию воспалительного процесса [22]. Результаты исследования содержимого лакун небных миндалин на наличие флоры и чувствительность к антибиотикам свидетельствуют об отсутствии патогенной микрофлоры на фоне применения повидон-йода у 78% больных, а при использовании раствора фурацилина – у 48,2%. Таким образом, на основании полученных данных можно сделать вывод о более выраженной эффективности местного применения препарата Бетадин ® в сравнении с фурацилином при лечении хронического тонзиллита [22].
Применение препарата Бетадин ® при лечении синуситов
При лечении синуситов ежедневно производят пункцию верхнечелюстной пазухи, промывают ее 0,01% раствором Бетадина, а затем вводят в пазуху 0,1% раствор Бетадина в количестве 10 мл. Курс лечения составляет 3–4 пункции. Способ эффективен при лечении острого синусита без назначения общей антибактериальной терапии за счет одновременного воздействия Бетадина на бактериальную и вирусную составляющие патогенной микрофлоры [23, 24].
Клинический случай
Больной Г., 35 лет, обратился в консультативно-диагностическое отделение ГБУЗ НИКИО им. Л.И. Свержевского по поводу двустороннего острого гнойного верхнечелюстного синусита. При поступлении: жалобы на затруднение носового дыхания, ощущение тяжести, распирания в проекции верхнечелюстных пазух, гнойные выделения из обеих половин носа, головную боль, пониженное обоняние, общую слабость. При пункции верхнечелюстных пазух с двух сторон получено жидкое гнойное отделяемое. Микробиологическое исследование выявило в содержимом верхнечелюстных пазух Staph. aureus 104 КОЕ/мл и Str. pneumoniae 105 КОЕ/мл. Больному назначено лечение: амоксициллин клавуланат по 1,0 г 2 р./сут в течение 7 дней, сосудосуживающие капли в нос. Ежедневно больному производились пункции верхнечелюстных пазух с промыванием их 0,01% раствором Бетадина и введением в просвет пораженной пазухи 5 мл 0,1% раствора Бетадина. После первой процедуры у больного исчезли головная боль, ощущение тяжести в проекции верхнечелюстных пазух. При передней риноскопии было отмечено значительное уменьшение отека слизистой оболочки полости носа и количества гнойного отделяемого в средних носовых ходах. После второй пункции верхнечелюстных пазух получены единичные слизисто-гнойные сгустки. При 3-й пункции на 3-и сутки лечения – промывная жидкость чистая. При микробиологическом исследовании отделяемого из верхнечелюстных пазух отмечается отсутствие в промывной жидкости патогенной микрофлоры. На 4-е сутки лечения больной отметил исчезновение выделений из носа и восстановление носового дыхания.
Таким образом, современные антисептические препараты, содержащие повидон-йод, в частности Бетадин ® , являются высокоэффективными средствами профилактики и лечения гнойно-воспалительных процессов в оториноларингологии. Препарат Бетадин ® обладает широким спектром антимикробной, фунгицидной активности и, что немаловажно, хорошо переносится больными при минимальном количестве побочных реакций. Высокая клиническая и бактериологическая эффективность в сочетании с высоким профилем безопасности говорит в пользу более широкого применения антисептического препарата Бетадин ® в практике врача-оториноларинголога.
Ключевые слова: рак шейки матки, папилломавирусная инфекция, противовирусный эффект, повидон-йод, Бетадин.
The article discusses the actual problem associated with human papillomavirus (HPV) of diseases of the uterine cervix in the reproductive age. Cervical cancer (CC) is the third most common gynecological cancer. At the present, there is a tendency to its rejuvenation. Each year, about 500,000 new cases of cervical cancer are detected worldwide, 90% of which occurs in developing countries. According to the WHO, in 2015 in Russia, 16710 new cases of cervical cancer were registered. 6,628 patients died from the progression of the malignant process of this localization in 2015. The incidence rate in 2015 was 15.1 per 100 thousand population. More than 100 HPV genotypes have been identified in the female reproductive tract. 13 types of HPV are recognized as high oncogenic (13HR), causing cancer. Considering the increase in the incidence of CC, options for management of patients with papilloma viral infection are observed. An analysis of the effectiveness of povidone-iodine in the comprehensive treatment of papilloma viral lesions of the mucous membrane of the vagina and uterine cervix was carried out. Povidone-iodine, widely used in clinical practice as an antiseptic, has been shown to have cytotoxic effects. Besides, povidone-iodine significantly suppresses cell proliferation at a low concentration corresponding to 20 μM I2. Experiments with fresh samples of human blood have shown that the antiproliferative activity of povidone-iodine is preserved in a high degree of blood plasma. These data indicate that povidone-iodine can be a potent agent for use in the development of anti-tumor tactics.
Key words: cervical cancer, papilloma viral infection, antiviral effect, povidone-iodine, Betadine.
For citation: Dubovina S.O., Krasilnikova L.V., Ardintseva O.A. et al. Povidone-iodine effect on the eradication of highly oncogenic HPV types in women with lesions in the uterine cervix. Russian Journal of Woman and Child Health. 2018;1(2):156–161.
В статье обсуждается проблема ассоциированных с вирусом папилломы человека заболеваний шейки матки в репродуктивном возрасте. Рассмотрено влияние повидон-йода на эрадикацию высокоонкогенных типов ВПЧ.
Актуальность
За последнее десятилетие достигнуты значительные успехи в понимании роли вируса папилломы человека (ВПЧ) в развитии рака шейки матки (РШМ) и других аногенитальных раков. ВПЧ является основным этиологическим агентом дисплазии шейки матки и карциномы [1].
РШМ — третий по распространенности гинекологический рак в развитых странах. В России число смертей от РШМ увеличилось на 3500 женщин в год. Приблизительно половину пациенток с РШМ составляют женщины репродуктивного возраста (моложе 50 лет) [2]. В последнее время по этой причине ежегодно умирают более 200 женщин в возрасте 20–39 лет. ВПЧ является распространенным вирусом, который передается горизонтально через гетеросексуальный контакт. Примерно 80% всех женщин инфицированы ВПЧ в какой-то момент их жизни, но при этом у порядка 90% папилломавирусная инфекция (ПВИ) спонтанно регрессирует в течение нескольких лет. При отсутствии самостоятельной элиминации может развиваться РШМ. Практически 100% плоскоклеточных интраэпителиальных поражений и РШМ, порядка 43% опухолей вульвы и 70% опухолей влагалища связаны с ПВИ, ежегодно вызывающей 530 тыс. новых случаев РШМ и 21 тыс. случаев рака вульвы и влагалища во всем мире [3]. При отсутствии скрининговой стратегии наблюдается рост заболеваемости РШМ и раком вульвы у молодых женщин [4].
ВПЧ представляет собой двуцепочечный ДНК-вирус, принадлежащий к роду Papilloma в семействе Papovaviridae [5]. Установлено, что ВПЧ — наиболее частая сексуально-трансмиссионная инфекция, являющаяся основной причиной цервикальных плоскоклеточных интраэпителиальных поражений и инвазивного РШМ. Выделяют более 100 типов, инфицирующих эпителий полового тракта. Передача ВПЧ происходит в первую очередь путем контакта кожи с кожей и, вероятно, при нарушении целостности эпидермиса, при этом вирус может инфицировать базальные клетки плоского эпителия [6].
Типы ВПЧ и их роль в развитии онкологических процессов
На сегодняшний день в женском репродуктивном тракте идентифицировано более 100 генотипов ВПЧ. 13 типов ВПЧ (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68) признаны высокоонкогенными (13HR), вызывающими рак. Тем не менее другие типы ВПЧ также могут быть связаны с развитием рака. По данным N. Munoz, два дополнительных типа ВПЧ — 73 и 82 — следует считать канцерогенными. G. Halec et al. на основании систематического обзора продемонстрировали, что 26, 53, 66, 67, 68, 70, 73 и 82 типы ВПЧ могут быть онкогенными [7]. Одна из наиболее важных проблем заключается в том, что диагностика на основе полимеразной цепной реакции (ПЦР), используемая в эпидемиологических исследованиях, имеет ограничения. Во-первых, метод ПЦР обнаруживает не только высокоонкогенные, но и другие типы ВПЧ. Во-вторых, некоторые ПЦР-тесты с использованием консенсусных праймеров показали несогласованные результаты в определении типов ВПЧ, т. к. чувствительность детекции у некоторых типов ВПЧ ниже, чем у других. Типы ВПЧ с низким риском, такие как 6, 11, 40, 42, 43, 44 и 54, связаны с генитальными бородавками и аногенитальными поражениями низкого уровня риска [8]. ВПЧ 16 и 18 типов с высоким риском вместе составляют порядка 70% случаев РШМ, в то время как ВПЧ 6 и 11 типов с низким риском ответственны за 90% генитальных бородавок [9].
Иммунная система играет важную роль в контроле развития рака. Геном ВПЧ кодирует два онкопротеина — Е6 и Е7, способные инактивировать белки р53, и ретинобластомы (pRB) — регуляторы пролиферативной активности клеток. Они необходимы для возникновения и поддержания злокачественного клеточного фенотипа [10]. Адаптивный иммунный ответ защищает от ВПЧ-индуцированных заболеваний [11]. Прогрессирование заболеваний, вызванных ВПЧ, связано с отсутствием сильного ВПЧ-специфического ответа CD4+ и CD8+ Т-клеток. Химиотерапия или лучевая терапия влияет на иммунную регуляторную активность и в сочетании с вакцинацией потенцирует эффективный локальный ВПЧ-специфический Т-клеточный иммунитет в опухолевых моделях мышей. Успешное лечение ВПЧ-индуцированных поражений может быть достигнуто с помощью низкодозированного циклофосфамида, изменяющего местный иммунитет. С учетом важности локального микроокружения в персистенции ВПЧ-индуцированных поражений и опухолей эффективными могут быть методы лечения, способные на местном уровне сместить баланс иммуноэффекторов, таких как ингибиторы циклооксигеназы-2, за счет продукции простагландина Е2 и трансформирующего фактора роста β [12].
Факторы, повышающие восприимчивость к ВПЧ
Микробы считаются основным триггерным фактором развития злокачественных новообразований. По данным проекта Human Microbiome (HMP) определено, что 20% всех смертельных злокачественных опухолей являются микробиологически индуцированными. Эктоцервикс колонизирован микробами, тогда как эндоцервикс и верхний генитальный тракт считаются практически стерильными у здоровых женщин. Изменения цервико-вагинального микробиома и такие процессы, как бактериальный вагиноз, воспаление шейки матки и повышение вагинального рН, влияют на восприимчивость к цервикальному ВПЧ. Женщины в разных этнических группах отличаются микробиомом влагалища [24]. Большинство цервико-вагинальных инфекций и вагинального дискомфорта обусловлены Gardnerella vaginalis или Atopobium vaginae [25], а также Candida albicans [26]. Цервикальный эпителий становится уязвимым под влиянием инфекционных микробных агентов для таких инфекций, как ВПЧ [27]. С развитием современных методик секвенирования становится понятным, что микробиом влияет на восприимчивость к раку из-за производства вредных метаболитов и их влияния на клеточную функцию, поскольку дерегулированный метаболизм и воспаление являются признаками рака [28]. Связь специфических микробов (прокариотических и эукариотических) с ВПЧ-инфекциями и цервикальной неоплазией остается одним из значимых вопросов в исследованиях. Известно, что в микробиноме здоровых женщин доминируют Lactobacilli. Этот константный вагинальный вид производит молочную кислоту в виде ферментации продуктов, что приводит к снижению вагинального рН до 3,5–4,5, создавая химический барьер для патогенов [29]. Высокий уровень L. iners связан с риском развития ВПЧ-ассоциированных цервикальных поражений. Повышение индекса массы тела коррелирует с увеличением численности L. iners, что делает ожирение значимым фактором развития CIN [30]. L. iners более приспособлены к изменению pH и разнообразным метаболическим состояниям, чем другие лактобациллы. Высокая обсемененность шейки матки L. kitasatonis и L. crispatus в сочетании с высокоонкогенными типами ВПЧ повышает риск развития CIN 3. Разнообразие флоры коррелирует с тяжестью CIN. Обнаружение Sneathia sanguinegens, Anaerococcus tetradius и Peptostreptococcus anaerobius у кавказских, азиатских и чернокожих женщин в микробиоме влагалища часто сочетается с развитием CIN. P. мicros — необычный таксон, часто встречающийся в ротовой полости, обнаруженный в слюнном микробиоме и распространенный при наличии цервикальных поражений. Выдвинуто предположение, что P. мicros может проникать в цервико-вагинальный тракт в результате орального секса [31].
Обнаружена прямая связь ВПЧ с доминированием трех грибов родов Candida, Malassezia и Sporidiobolaceae. Malassezia — липофильные, паразитирующие в верхних слоях кожи человека грибы, вызывающие поверхностные грибковые инфекции, такие как атопический дерматит и псориаз. Malassezia часто обнаруживается у мужчин на крайней плоти и головке полового члена. Malassezia производят биоактивные индолизины, включая активаторы арильного углеводородного рецептора (AhR). Рецепторы AhR опосредуют многие функции кожи, включая ускорение деления клеток, поэтому было высказано предположение, что Malasseziа могут участвовать в кожном канцерогенезе. Проведенное недавно исследование выявило, что определенная структура микробиома цервико-вагинального тракта коррелирует как с высокоонкогенными типами ПВИ, так и с CIN-тяжестью в популяции женщин репродуктивного возраста. Поэтому поиск особенностей микробиома цервико-генитальной системы может быть важным шагом в понимании биологии цервикальной неоплазии и разработке новых терапевтических схем, нацеленных на микробиоту [32].
Лечение диспластических изменений шейки матки
Поскольку CIN затрагивает в основном женщин репродуктивного возраста, имеется необходимость раннего выявления и улучшения стратегий лечения наиболее клинически значимых CIN. Персистирующая инфекция высокоонкогенными типами ВПЧ является необходимым условием прогрессирования патологии шейки матки. Первичная (вакцинация) и вторичная профилактика (скрининг шейки матки) может оказать решающее влияние на профилактику рака [32].
Поиск препаратов, направленных на лечение диспластических изменений шейки матки, — важное направление гинекологии. Йод — это антисептик, который используется в лечебной практике более 150 лет. Повидон-йод — одно из самых мощных и эффективных йодсодержащих антисептических средств широкого спектра действия. Главное отличие этого препарата в том, что на фоне его приема не возникает резистентности микроорганизмов, он реже, чем антибиотиксодержащие препараты, вызывает аллергическую реакцию. Антисептическое действие повидон-йода связано с сильным окислительным эффектом. Под действием повидон-йода происходит образование пор в мембранах клеток микроорганизмов, что приводит к нарушению целостности клеточной оболочки, повреждению клетки и утрате ею жизнеспособности. Препарат имеет несколько преимуществ перед другими антисептиками. Во-первых, он эффективнее купирует размножение микроорганизмов даже в большом разведении. Во-вторых, у повидон-йода самый широкий противовирусный спектр действия, включающий энтеровирусы, вирусы полиомиелита и герпеса, а также аденовирусы и вирус гриппа.
Повидон-йод — устойчивый препарат, его эффективность не изменяется под действием физико-химических условий в очаге воспаления, обусловленных изменением рН, белками, кровью, действием ферментов. В гинекологической практике он чаще всего используется для лечения воспалительных процессов и профилактики развития осложнений после инвазивных вмешательств [33].
Было продемонстрировано, что препарат индуцирует гибель эпителиальных клеток HeLa у крыс. Дополнительные данные, подтверждающие сильное противоопухолевое действие молекулы йода и иодолактонов, были установлены с помощью исследований клеточной культуры. Они выявили значительное снижение клеточного роста при раке молочной железы. Снижение пролиферации под действием молекул йода отмечено и в других злокачественных клеточных линиях человека (нейробластома, глиома, меланома, карциномы легких, толстой кишки и поджелудочной железы) [34]. Сравнительный анализ антипролиферативной/цитотоксической способности I2, йодида калия (KI), комбинированного раствора KI+I2, повидон-йода и I2+ [KI+глицерол] на клетках карциномы человека показал, что повидон-йод может быть потенциальным инструментом для непосредственного вмешательства в рост опухолевых клеток [35].
Рандомизированное исследование, проведенное в США, выявило, что у всех 88 обследуемых пациенток в возрасте 23–67 лет (в среднем 34,8 года) с аномальной цитологией и наличием высокоонкогенного типа ВПЧ после проведения 2 курсов криотерапии шейки матки и локального лечения повидон-йодом через 6 мес. после терапии ВПЧ не был обнаружен [36]. Исследования показали, что применение препарата Бетадин ® после обработки кондилом раствором для наружного применения с местно-некротизирующим действием повышает эффективность лечения, снижает частоту присоединения бактериальной инфекции и рецидивирования ПВИ слизистой влагалища и шейки матки. В связи с вышеизложенным очевидна целесообразность комплексного лечения патологии шейки матки, включающего повидон-йод [37].
Заключение
Понимание особенностей персистенции ПВИ в эпителии шейки матки и связанного с ней процесса развития заболеваний данной области определяет тактику терапии повреждений шейки матки, ассоциированных с ВПЧ. Методов лечения ВПЧ гениталий много, однако частота рецидивов этого заболевания высока. Поэтому весьма перспективным направлением является разработка комплексной терапии с целью профилактики рецидивирования ВПЧ-ассоциированных заболеваний шейки матки. Применение повидон-
йода (например, препарата Бетадин ® ) в комплексной терапии ПВИ повышает эффективность лечения, снижает частоту бактериальной инфекции, а также частоту рецидивирования ПВИ слизистой влагалища и шейки матки.
Для цитирования: Тихомиров А.Л., Сарсания С.И., Тускаев К.С. Актуальность применения повидон-йода в практике акушера-гинеколога. РМЖ. Мать и дитя. 2014;22(1):50.
За последнее десятилетие инфекционно-воспалительные заболевания не утратили своей значимости в структуре гинекологических заболеваний. На протяжении времени меняется только приоритет того или иного возбудителя, частота, значимость различных осложнений, появление и выделение новых штаммов и патогенных микроорганизмов в различных биоптатах. Частое и подчас избыточное, не всегда обоснованное использование антибиотиков привело к тому, что произошел целый ряд изменений как характеристик патогенных микроорганизмов, так и состава микрофлоры человека.
В настоящее время обращает на себя внимание частота рецидивов вирусных заболеваний, специфических и неспецифических вульвовагинитов, бактериального вагиноза (БВ). Отмечено, что вагиниты относятся к заболеваниям, которые сами по себе не представляют прямой угрозы здоровью женщины, однако при данных состояниях в нижних отделах полового тракта накапливаются и постоянно сохраняются в высоких концентрациях условно-патогенные микроорганизмы, которые являются основными возбудителями гнойно-воспалительных заболеваний органов малого таза [16]. Доказана роль БВ как триггера воспалительных заболеваний органов малого таза. Остаются актуальными вопросы ранней и адекватной диагностики, профилактики распространения инфекционно-воспалительных заболеваний.
Так, все более широкое применение находят хорошо всем известные препараты йода, в особенности его различные комплексные соединения.
Биологически активное вещество повидон-йод представляет собой свободный комплекс элементарного йода с нейтральным, амфипатическим органическим соединением – поливинилпирролидоном, который служит в качестве резервуара с замедленным высвобождением йода. Повидон-йод – антисептик широкого спектра действия, обладающий бактерицидными, спороцидными и антивирусными свойствами (т. е. спектр действия распространяется на грамположительные и грамотрицательные бактерии, грибы, вирусы, простейшие и даже прионы). Прионы – особый класс инфекционных агентов, представленных белками с аномальной третичной структурой и не содержащих нуклеиновых кислот. Прионы не являются живыми организмами, но они могут размножаться, используя функции живых клеток (в этом отношении прионы схожи с вирусами). Прион – это белок с аномальной трехмерной (третичной) структурой, способный катализировать конформационное превращение гомологичного ему нормального клеточного белка в себе подобный (прион).
Повидон-йод (Бетадин) является антисептическим и дезинфицирующим препаратом, антимикробное действие которого обусловлено бактерицидностью. Бактерицидное действие йода объясняется его сильными окислительными свойствами. Йод повреждает клеточные стенки патогенных микроорганизмов за счет окисления аминокислот бактериальных белков, содержащих SH- и OH-группы. В основном это бактериальные ферменты и трансмембранные белки, не имеющие мембранной защиты. При окислении изменяется их четвертичная структура, и они теряют каталитическую и энзимную активность. Интрацеллюлярно йод блокирует систему транспорта электронов в цитоплазматической мембране бактерий. Эффект развивается быстро, обычно в течение 15–60 с. Спектр действия Бетадина представлен в таблице 1.
Среднее время антимикробного воздействия на микроорганизмы:
- Грам+/грам- – 15–30 с;
- вирусы – 15 с;
- грибы – 15–30 с;
- трихомонады – 30–60 с.
Бетадин – это комплексное соединение йода и поливинилпирролидона (ПВП), который является инертным синтетическим полимером и выполняет роль носителя, не обладающего токсичными и антигенными свойствами, способен обратимо присоединять другие вещества, такие как лекарственные токсины, препараты, гормоны. Все фармакологические свойства препарата связаны непосредственно с йодом, при этом теряется свойство вызывать жжение тканей при нанесении, но сохраняется высокая бактерицидная активность, что позволило расширить области его применения как антисептического средства. В ходе соприкосновения с кожей и слизистыми находящийся в комплексе с ПВП йод высвобождается постепенно и равномерно, что проявляется тонким окрашенным слоем, который сохраняется до тех пор, пока не освобождается все количество йода, действует более медленно и продолжительно [Никулин В.Н., Герасименко В.В., Свирская Е., 2008]. Благодаря полимерной молекуле йод проникает глубоко в рану, в воспаленные ткани и под струп. Проникновение в ткани на глубину около 1 мм не препятствует нормальным процессам регенерации.
По сравнению с другими антисептиками у повидон-йода есть ряд существенных преимуществ:
- эффективнее других антисептиков подавляет размножение микроорганизмов даже в большом разведении (вплоть до 1/256);
- физико-химические условия в очаге воспаления, обусловливаемые рН, белком, кровью, ферментами, мало влияют на действие повидон-йода;
- обладает наиболее высокой специфической активностью в отношении большинства инфекций и более широким противовирусным спектром действия (энтеровирусы, вирусы полиомиелита, герпеса, аденовирусы, вирусы гриппа, а также HРV).
Доказана высокая эффективность повидон-йода в местной терапии герпетических поражений слизистых оболочек [15] и высокая активность в профилактике передачи папилломавирусной инфекции половому партнеру [14]. При этом отмечено, что папилломавирус не чувствителен к другим антисептикам. В некоторых исследованиях повидон-йод проявил себя как более эффективное средство в лечении и профилактике вирусных инфекций по сравнению со специфическими противовирусными средствами.
По данным S. Tsutomu, S. Junko (1996–1998), R. Kawana и соавт. (1998), E. Shanbrom (1996):
- противоинфекционные средства, содержащие повидон-йод, могут использоваться для борьбы с болезнями, вызванными ВИЧ, хламидиями, гонококками, трепонемой и вирусом простого герпеса (табл. 2);
- не описано ни одного факта развития резистентности микроорганизмов к повидон-йоду, несмотря на длительный период применения в хирургической практике;
- отсутствие системного эффекта за счет больших размеров комплекса (400–4000 kDa) повидон-йода;
- повидон-йод, в отличие от других антисептиков, нормализует кислотность вагинальной среды, чем создает условия для быстрого восстановления нормальной микрофлоры влагалища, что является важным фактором отсутствия рецидивов вагинальной инфекции после лечения.
- для лечения банальных вагинитов;
- для профилактики в повседневной жизни (незащищенный половой акт при случайной связи, посещение сомнительного бассейна в сауне, изнасилование и т. д.);
- перед введением внутриматочной спирали (ВМС);
- перед плановыми хирургическими гинекологическими вмешательствами и далее совместно с приемом антибиотиков в течение всего курса антибиотикотерапии;
- перед лечением миомы матки методом эмболизации маточных артерий;
- перед чрезвлагалищной микрокатетерной баллонной рентгеноконтрастной реканализацией маточных труб при лечении бесплодия;
- в комплексном лечении поражений шейки матки.
В отношении профилактики послеоперационных осложнений показательно одно из наших исследований. Перед проведением аборта или диагностического выскабливания 80 женщинам был назначен Бетадин в течение 7 дней по 1 свече на ночь, а непосредственно перед процедурой проведена ультразвуковая резонансная инстилляция цервикального канала 10% раствором Бетадина в течение 2 мин. В результате мы не зафиксировали ни одного случая воспалительных изменений ни в день выписки, ни через 10 дней. Из 80 женщин, которым не проводилась превентивная терапия Бетадином, 45% в послеоперационном периоде пришлось назначать современные антибиотики. Проведенное нами исследование свидетельствует о том, что около 45% больных в оперативной гинекологии имеют нарушения микроценоза влагалища, что может стать причиной развития инфекционных осложнений после хирургических вмешательств на органах малого таза. При этом не оправдано введение антибиотиков задолго до операции (не обеспечивают предоперационную деконтаминацию больной, существенно возрастает риск появления антибиотикорезистентных микроорганизмов).
Эффективности Бетадина посвящено большое количество исследований, тем не менее, в них не уделяется должного внимания индивидуальной переносимости данного препарата женщинами. С этой целью нами было проведено еще одно изучение. В исследовании приняли участие 60 женщин. У 20 из них свечи Бетадин назначали перед инвазивными процедурами (аборт, раздельное диагностическое выскабливание, установка ВМС), у 20 – параллельно приему антибиотиков, 10 женщин использовали Бетадин с профилактической целью и 10 пациенткам Бетадином проводили лечение вагинита.
Широкий спектр действия Бетадина дает большие возможности его применения при таких заболеваниях, как:
- вагиниты любой этиологии (бактериальной, грибковой, вирусной, трихомониаз);
- бактериальный вагиноз;
- хламидийная, уреаплазменная и микоплазменная инфекция (в комплексе этиотропной терапии);
- генитальный герпес и остроконечные кондиломы (в качестве местного этиотропного препарата и для профилактики суперинфекции);
- вагиниты смешанной этиологии (до 30% всех вагинитов – смешанные!) – препарат выбора.
При применении Бетадина важно помнить: им можно начать лечение сразу после взятия мазка. Чем раньше начат использоваться препарат, тем реже возникает необходимость в антибиотиках. Длительное антибактериальное лечение хронических неспецифических вульвовагинитов изменяет эндогенную микрофлору, обусловливая увеличение числа устойчивых к действию антибактериальных препаратов штаммов. Именно поэтому большинство исследователей главную роль отводят местному лечению вульвовагинитов. Преимущества местного лечения заключаются в минимальном риске побочных реакций, простоте и удобстве применения, в отсутствии противопоказаний (кроме индивидуальной непереносимости препарата) и возможности применения при экстрагенитальной патологии [2].
Учитывая определенную чувствительность папилломавирусной инфекции и способность повидон-йода проникать под струп, мы использовали Бетадин при хирургических методах лечения патологии шейки матки в объеме эксцизий/конизаций. В первой группе (20 чел.) после хирургического лечения шейки матки назначали Бетадин по 1 свече на ночь в течение 10 дней, во второй (20 чел.) – перед деструктивным лечением в течение 3 дней и после лечения шейки матки в течение 7 дней Бетадин по 1 свече на ночь, в третьей (20 чел.) – после хирургического лечения шейки матки назначали свечи, содержащие декспантенол + хлоргексидина биглюконат. В первой и второй группе отмечена более быстрая эпидермизация шейки матки на 5±3 дня, причем существенной разницы в эпидермизации шейки матки в 1-й и 2-й группах (с применением Бетадина) не отмечено.
Бетадин имеет большое значение в прегравидарной деконтаминации женщин, может применяться с целью лечения БВ и смешанных вагинитов в I триместре беременности, когда нежелательно использовать антибактериальные препараты. Бетадин применяют для дезинфекции на этапах подготовки к родам или кесареву сечению, во время родов, для обработки кожи, пуповины и глазной щели у новорожденных. Клинический опыт показал, что обработка кожи новорожденных 0,1% раствором Бетадина полностью исключает возможность развития нозокомиальной инфекции. Важно отметить также, что раствор Бетадина более эффективен и менее токсичен, чем традиционные средства для профилактики конъюнктивита у новорожденных. Белорусские исследователи [Сафина М.Р., Солошкина Д.А., 2006] сообщают об убедительных результатах применения Бетадина для лечения смешанных вагинальных инфекций у беременных в I триместре. Оценка эффективности терапии проводилась через 7–8 сут. Критериями излеченности считались субъективная оценка пациентки, уменьшение влагалищных выделений и нормализация бактериоскопической картины при контрольном исследовании мазка. В группе беременных, у которых применяли Бетадин, клиническая излеченность смешанных инфекций достигала 91%, что совпадает с данными литературы. Применение этого препарата в течение 7 дней на сроке 37–40 нед. беременности является эффективным способом профилактики септических осложнений после родов через естественные родовые пути, а также после оперативного родоразрешения. Предродовая профилактика снижает частоту возникновения в родах травматического повреждения тканей родового канала и улучшает результаты заживления послеродовых травм [12].
Кроме профилактики воспалительных заболеваний при проведении инвазивных процедур Бетадин незаменим в ситуациях незащищенного полового акта, изнасилования или разрыва презерватива, когда существует вероятность заражения от полового партнера. В этих случаях скорейшее введение Бетадина с последующим его использованием по 1 свече на ночь в течение 7 дней позволяет избежать развития воспалительного процесса.
Бетадин может заменить частые влагалищные души и спринцевания у женщин, склонных к мизофобии (боязнь заражения). Кроме этого, с профилактической целью Бетадин может применяться в предменструальный период у женщин с частыми рецидивами БВ, поскольку именно в этой фазе рН влагалища повышается, что может способствовать активации роста анаэробов.
Таким образом, необходимо четко обозначить основные области применения препарата Бетадин. Во-первых, Бетадин является антисептиком, его задача – не лечение, а профилактика, хотя в отношении БВ Бетадин может рассматриваться с терапевтической точки зрения. Бетадин применяется для профилактики воспалительных заболеваний органов малого таза при инвазивных вмешательствах и инфекционных осложнениях в акушерстве. Использование Бетадина в комбинации с антибиотиками позволяет снизить частоту развития кандидозного вульвовагинита. В повседневной жизни женщины Бетадин – это профилактика БВ и инфекций, передающихся половым путем.
Принято считать, что около 93% населения земного шара являются носителями вируса папилломы человека. Однако лишь у небольшой части людей заболевание проявляется появлением папиллом. Сегодня мы поговорим о том, как можно лечить папилломы и что можно сделать если они появились вновь после удаления.
Как на самом деле они выглядят?
Очень часто пациенты, которые приходят ко мне на приём, просят удалить им папиллому или несколько и указывают на пигментный невус, фибропапиллому или бородавку. Один раз в качестве папилломы для удаления мне предложили клеща (не шучу):
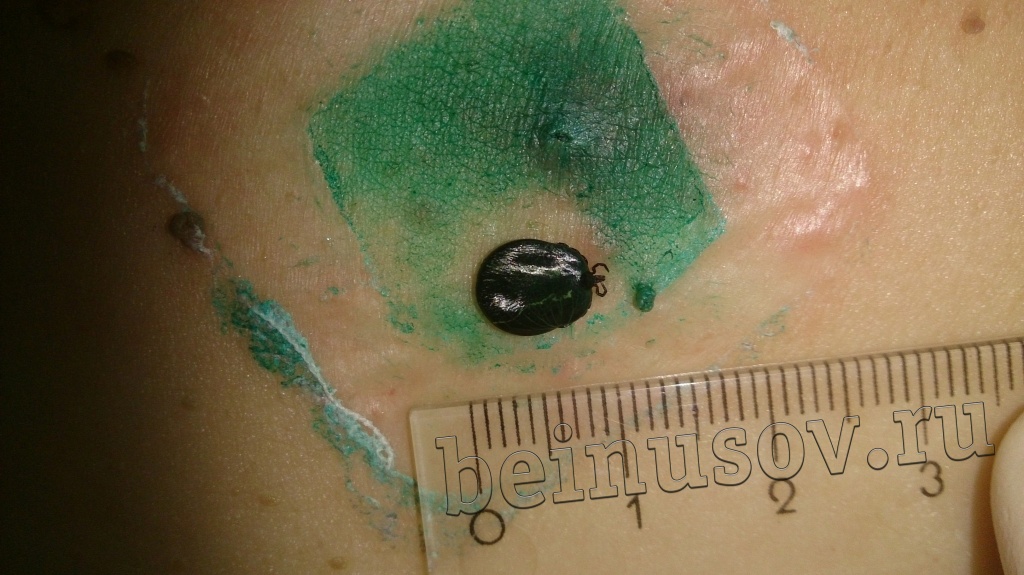
Считаю необходимым чётко обозначить, что такое папиллома и чем она отличается от остальных кожных новообразований. Чаще всего это небольшое, размерами 1-3 мм кожное образование на тонкой ножке. Основных отличий папилломы от остальных образований кожи три. Первое - ножка всегда тоньше, чем верхняя часть. Второе - консистенция папилломы всегда мягче окружающей кожи. Третье - размер папилломы, как правило, небольшой - не более 5 мм. На фотографии ниже - типичная папиллома.
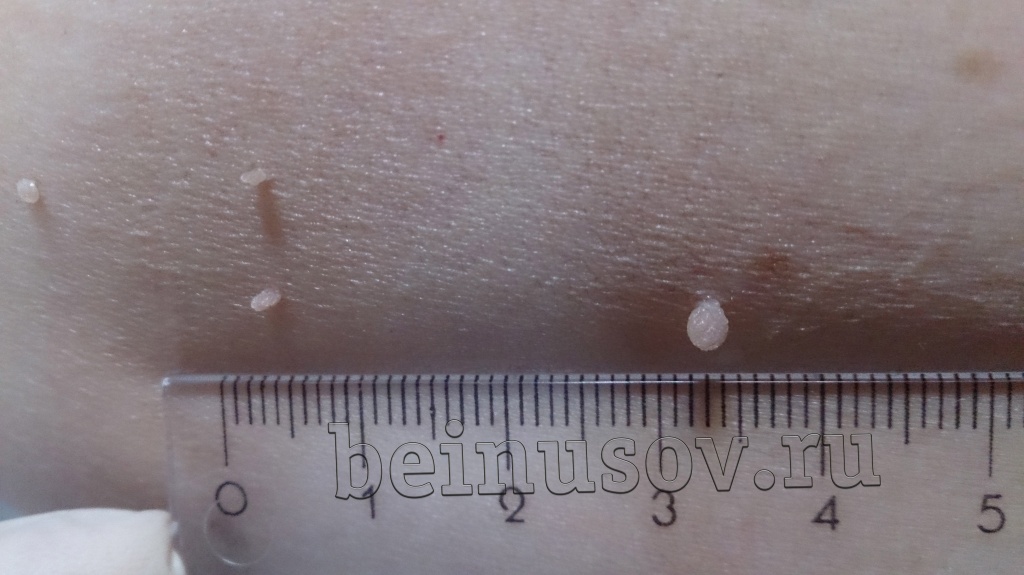
Как избавиться от папиллом?
Существует всего два основных метода лечения папиллом
- Наиболее простым и эффективным методом лечения является удаление папиллом различными методами (лазер, радиоволновая хирургия, электрокоагуляция и т.п.). В большинстве случае однократного полного удаления папиллом со всего тела бывает достаточно. Более подробно о том, как папилломы удаляются методом радиоволновой хирургии в нашей клинике, я расскажу чуть ниже.
- Очень популярным методом в последнее время стало удаление папиллом в домашних условиях. Чаще всего, это происходит с помощью двух видов препаратов - растворы кислот с названием вроде "Супер чистотел" и смесь диметилового эфира и пропана (популярный препарат "Криофарма"). Ничего не могу сказать об эффективности этих двух способов, т.к. никогда не удалял папилломы таким образом.
ВАЖНО. Пожалуйста, не ставьте себе диагноз "папиллома" самостоятельно на основании изучения интернета. Перед применением указанных выше препаратов всегда стоит показаться онкологу и убедиться, что то, что Вы собираетесь удалить в домашних условиях - действительно папиллома. Если диагноз поставлен не верно и на пигментный невус будет нанесена любая из этих жидкостей - последствия могут быть крайне печальными .
Если папилломы появились вновь после удаления?
К сожалению, ни один из перечисленных выше методов не даёт 100% гарантии исчезновения папиллом. В очень редких случаях, даже при удалении у квалифицированного доктора они могут появиться снова. Если это произошло в течение короткого срока (полгода или несколько месяцев) нужно проверить состояние иммунитета - проконсультироваться с иммунологом. Как правило в таких ситуациях назначаются иммуномодуляторы, которые помогут организму бороться с вирусом папилломы человека.
Как проходит удаление папиллом?
В нашей клинике удаление папиллом производится методом радиоволновой хирургии.
Просто посмотрите это короткое видео и многие вопросы отпадут сами собой.
Папиллома фиксируется специальным пинцетом, после чего инструментом в виде петли отсекается от кожи у основания. В момент соприкосновения с кожей на конце инструмента концентрируется радиоволна высокой частоты, которая испаряет клетки папилломы и одновременно "склеивает" кровеносные сосуды. Как правило обезболивание при такой процедуре не требуется - болезненные ощущения сравнимы с эпиляцией пинцетом. В редких случаях производится обезболивание кремом ЭМЛА.
Коротко о главном:
Если Вы решили избавиться от папиллом - есть 2 способа:
Первый - удалить папилломы в клинике, желательно у онколога. Плюсы этого метода очевидны - максимальная эффективность и безопасность.
Второй способ - удаление в домашних условиях с помощью препаратов, которые можно купить в аптеках. Преимуществом этого метода является невысокая стоимость, однако для безопасного удаления я рекомендую предварительно проконсультироваться с врачом-онкологом.
Если лечение папиллом ни одним из указанных способов не эффективно - стоит проверить иммунитет. Для этого лучше проконсультироваться у иммунолога.
Решили расстаться с Вашими папилломами? Это можно сделать по адресам в Санкт-Петербурге (Асафьева 7/1)
Другие статьи:
Полезная статья? Сделайте репост в Вашей социальной сети!
Оставьте комментарий или задайте вопрос

Записывайтесь на вебинар "Канцерогены в косметике: правда, ложь и. маркетинг"
Читайте также:

