Синтез собственных днк из нуклеотидов клетки-хозяина характерен для вирусов
Обновлено: 24.04.2024
Этап синтеза вирусных компонентов. Синтез вирусных компонентов - эклипс-период.
Вскоре после обнажения вирусного генома происходит уменьшение или исчезновение инфекционности, поскольку вирионов как таковых уже не существует, а инфекционность нуклеиновой кислоты намного меньше инфекционности полных вирионов. Данное явление было названо эклипсом (затмением), а фаза вирусной инфекции с момента адсорбции и до появления в клетке новых инфекционных вирионов — эклипс-фазой, или латентным периодом. При высокой множественности заражения клеток некоторая часть вирионов сохраняет инфекционные свойства в течение всей эклипс-фазы, что зачастую затрудняет определение ее продолжительности.
В течение этого периода происходят все существенные процессы вирусной репродукции, приводящие к образованию вирусных компонентов и формированию нового потомства вирионов. С появлением в клетке первых вновь синтезированных вирионов завершается эклипс-период размножения вируса.
Процессы, происходящие в эклипс-фазе, схематично показаны на рисунке, где в качестве примера представлены основные этапы репликации аденовирусов.
Из представленной схемы видно, что после прикрепления вирион входит в клетку и частично или полностью лишается оболочки, обнажая вирусный геном. Некоторые ранние вирусные гены транскрибируются с образованием мРНК, которые могут затем изменяться различными путями, включая сплайсинг. Ранние мРНК транслируются с образованием трех главных продуктов: белков, которые подавляют или останавливают синтез белков и нуклеиновых кислот; белков, которые регулируют экспрессию вирусного генома; ферментов, необходимых для репликации вирусных нуклеиновых кислот. Вслед за репликацией вирусной нуклеиновой кислоты транскрибируются поздние вирусные гены, продуктами трансляции которых являются в основном структурные вирусные белки, используемые при сборке новых вирионов. Некоторые из них претерпевают посттрансляционные изменения перед включением в структуру вирионов. В каждой инфицированной клетке образуются сотни и тысячи вирионов, которые, освобождаясь, заражают другие клетки.
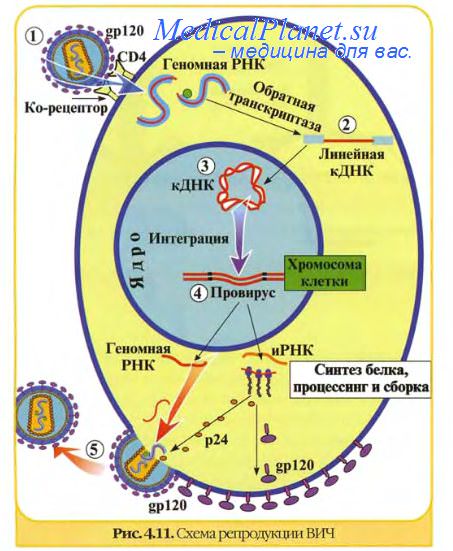
У большинства ДНК-вирусов транскрипция и репликация ДНК происходит в ядре клетки, с использованием клеточной РНК-полимеразы II и других клеточных ферментов. Большинство РНК-вирусов размножается в цитоплазме, где отсутствуют ферменты, копирующие РНК на РНК-матрице, поэтому вирусный геном должен сам по себе функционировать как мРНК или вирус должен нести свою РНК-полимеразу, чтобы транскрибировать РНК на РНК-геноме.
Синтез вирусных белков происходит только в цитоплазме клетки. В инфицированных клетках вирусные нуклеиновые кислоты и вирусспецифические белки синтезируются в значительно большем количестве, чем включаются в вирионы. Избыточный синтез структурных компонентов при репродукции вирусов является своеобразной платой за паразитизм на генетическом уровне.
Потомство вирионов проявляется спустя определенный период после того, как начал осуществляться синтез составляющих их компонентов. Продолжительность периода от момента инфицирования до появления дочерних вирионов довольно вариабельна и отражает глубокое различие между разными вирусами.
Латентный период мелких вирусов, не имеющих оболочки и содержащих односпиральную РНК, длится примерно 2 часа и является наиболее коротким среди всех известных вирусов животных. ДНК-содержащие вирусы имеют более продолжительный латентный период. Длительный латентный период отмечен также у реовирусов и вируса саркомы Рауса. У простых мелких РНК-содержащих вирусов быстрее протекает не только латентный период, но и весь цикл размножения вируса. Вирусы, геном которых выполняет функции мРНК, имеют более короткий репликативный цикл, чем вирусы, у которых функции мРНК выполняет не вирионная РНК, а комплементарная ей минус-нить.
Размножение ДНК-содержащих вирусов может продолжаться даже через 24 часа после заражения. Причины, определяющие длительность цикла размножения разных вирусов, не выяснены. Возможно, что это связано с более сложной последовательностью событий при репродукции крупных, сложно устроенных вирусов.
Укорочение латентного периода при высокой множественности заражения было обнаружено у различных РНК и ДНК вирусов и, возможно, связано с ускорением процесса образования ферментов, участвующих в синтезе нуклеиновой кислоты. При высокой множественности заражения не исключается также роль капсидных белков в ускорении начала цикла репродукции.
Число инфекционных вирусных частиц, образуемых в одной клетке, зависит от типа вируса, и количество их варьирует очень широко. Интересно, что на долю вирусспецифических продуктов приходится от 0,1 до 5% массы клетки животного.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Строение вирусов. Классификация вирусов
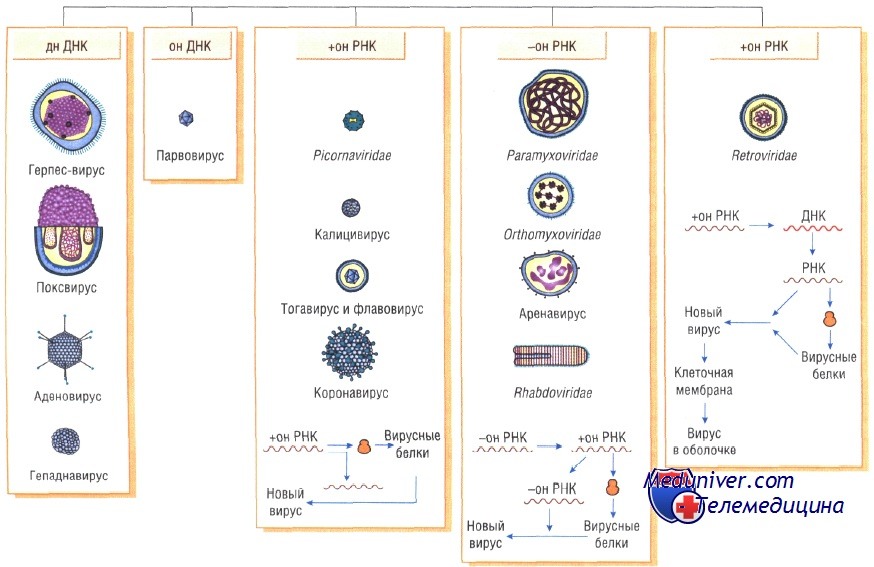
Вирусы классифицируют по типу генетического материала, способам репликации, строению и расположению структурных белков (капсидов), а также наличию или отсутствию оболочки.
Генетическая структура и способы репликации ДНК-вирусы. Могут быть только двунитевыми и одноните-выми. К. первым относят вирус оспы, герпес-вирусы, аденовирусы, паповавирусы и полиомавирусы. Последние два вируса вызывают развитие доброкачественных (бородавки) и злокачественных (рак шейки матки) опухолей. Вирус гепатита В частично дву- и однонитевой. К однонитевым вирусам относят парвовирусы, вызывающие инфекционную эритему.
Репликация ДНК-вирусов обычно происходит в ядре клеток хозяина и сопровождается продукцией полимераз, воспроизводящих вирусную ДНК. При этом последняя не всегда встраивается в хромосомную ДНК хозяина.
РНК-вирусы. Эти вирусы содержат однонитевую РНК, но различаются по стратегии репродукции, (вирусы, содержащие плюс-однонитевую РНК и минус-однонитевую РНК). У плюс-однонитевых вирусов РНК транслируется в структурные белки и служит матрицей (мРНК) для РНК-зависимой РНК-полимеразы.
В состав минус-однонитевых вирусов входит собственная РНК-зависимая РНК-полимераза, продуцируемая на базе генома вируса мРНК. Последняя в свою очередь может быть матрицей для продукции вирусной (минус-однонитевой) РНК.
Строение капсидов вирусов. Вирусная нуклеиновая кислота покрыта белковой оболочкой, состоящей из повторяющихся единиц (капсида) с икосаэдрическим (кубическим) или спиральным типами симметрии. Капсиды вирусов с икосаэдрическим типом симметрии имеют практически сферическую форму. Спиральный тип симметрии свойствен РНК-вирусам, капсиды которых окружают нуклеиновую кислоту, располагающуюся в виде спирали.
Капсид состоит из повторяющихся компонентов (капсомеров), количество генов, кодирующих его, снижено, тем самым облегчён процесс сборки вируса.
Оболочка вирусов. В некоторых случаях нуклеиновая кислота и капсидные белки вируса (нуклеокапсид) окружены липидной оболочкой, состоящей из компонентов клетки хозяина или ядерных мембран. Мембрана клетки хозяина изменяется под действием белков, кодируемых вирусом, или гликопротеинов, выступающих в роли рецепторов для других клеток хозяина. Покрытые оболочкой вирусы чувствительны к действию веществ, растворяющих липидную мембрану (например, эфиров).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
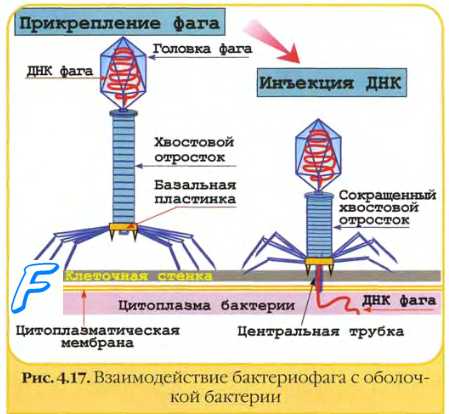
Взаимодействие бактериофагов с клеткой специфично, так как они, как правило, инфицируют бактерии только определённого вида (рис. 5-11). Подобно вирусам животных, репродуктивный цикл литических бактериофагов включает адсорбцию свободного фага на клетке, инъекцию ДНК, репродукцию фага, выход дочерних популяций.
Адсорбция бактериофага
Прикрепление фага к бактерии происходит при помощи поверхностных структур бактериальной стенки, служащих рецепторами для вирусов. Например, рецепторы для фагов ТЗ, Т4 и расположены в липополисахаридном слое, для Т2 и Т6 — в наружной мембране. На бактериях клеточной оболочки (протопласты, L-формы) бактериофаги не адсорбируются. Некоторые фаги в качестве рецепторов используют F-пили. Помимо рецепторов, адсорбция фага зависит от рН среды, температуры, наличия катионов и некоторых соединений (например, триптофана для Т2-фага). При избытке фага на одной клетке может адсорбироваться до 200-300 вирусных частиц.
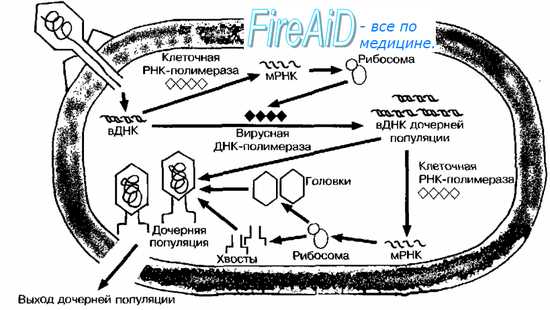
Рис. 5-11. Литическое взаимодействие фага с бактериальной клеткой. Бактериофаг вводит в вирусную ДНК (вДНК) в цитоплазму бактериальной клетки. Клеточные РНК-полимеразы транскрибируют ДНК в мРНК, транслирующуюся на рибосомах. В результате осуществляется синтез вирусной полимеразы и других ранних вирусных белков. Вирусная полимераза участвует в образовании вДНК дочерних популяций. Часть образовавшейся вДНК используется как матрица для синтеза белков головок и хвостов. После присоединения вДНК последние образуют дочернюю популяцию фагов.
Инъекция бактериофага
После адсорбции происходит ферментативное расщепление клеточной стенки лизоцимом, находящимся в дистальной части отростка. Базальная пластина хвоста лизирует прилегающий фрагмент клеточной стенки, выделяя присутствующий в отростке лизоцим. Одновременно в чехле высвобождаются ионы Са2+, активизирующие АТФазу, что вызывает сокращение чехла и вталкивание стержня хвоста через ЦПМ в клетку. Затем вирусная ДНК впрыскивается в цитоплазму (внедрение вирусной ДНК). Поскольку диаметр канала лишь немного превышает диаметр молекулы ДНК (около 20 нм), то ДНК способна попадать в цитоплазму только в форме нити.
Репродукция бактериофага
Репликация нуклеиновых кислот реализуется за счёт активности вновь синтезированных вирусных ДНК-полимераз, производящих множественные копии вирусных нуклеиновых кислот.
Выход дочерних популяций бактериофага
Негативные колонии бактериофага
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

В прошлом номере мы рассмотрели происхождение эукариот путем симбиоза между археей и бактерией в условиях перехода бактериального сообщества к аэробному обмену. Однако этот сценарий не объясняет всех особенностей эукариотических клеток. Непонятно, как переход археи к фагоцитозу и обзаведение симбионтами могли способствовать появлению, например, полового размножения и мейоза. Не очень понятно происхождение линейных хромосом. И совершенно несуразной выглядит такая деталь эукариотической системы трансляции, как кэпы матричных РНК. Кэп — это остаток 7-метилгуанина, пришитый к 5'-концу мРНК специальным 5'-5'-трифосфатным мостиком (рис. 1). Он требуется для начала трансляции на эукариотической рибосоме — без него рибосома не может связаться с мРНК.
Для узнавания кэпа служит специальный белок — фактор инициации eIF4E, не имеющий гомологов у прокариот. Важно, что из-за наличия кэпа и eIF4E эукариоты не имеют оперонов — групп генов, которые транскрибируются в одну длинную мРНК, кодирующую несколько белков последовательно, один за другим. Опероны позволяют бактериям и археям экономить на регуляции активности генов: достаточно одного регуляторного участка в начале оперона, чтобы одновременно управлять активностью всех его генов. (Обычно белки, которые кодируются генами одного оперона, функционально связаны, а значит, требуются в равных количествах.) Переход к кэпированным мРНК у протоэукариота потребовал бы массированной перестройки генома, распада всех оперонов и появления тысяч новых промоторов для индивидуализирующихся генов. Сложно представить себе причину, по которой это было бы адаптивно для клетки, и еще сложнее найти причину, по которой система пришивания и узнавания кэпа вообще возникла.
Эти особенности эукариот находят объяснение, если допустить, что в их появлении участвовали, помимо архейного и бактериального партнеров, еще и вирусы.
Вирусное происхождение отдельных компонентов эукариотической клетки не вызывает сомнения. Так, фермент теломераза происходит от обратной транскриптазы ретровирусов, а часть генетического аппарата митохондрий — ДНК-полимераза, РНК-полимераза и праймаза — от Т-четного бактериофага, встроенного в геном бактериального предка митохондрий. Однако есть и более радикальное мнение о роли вирусов в появлении эукариотической клетки — вирусная теория происхождения ядра.
Сходство LNCDV с ядром эукариот наблюдается по многим признакам:
— генетический материал ограничен двухслойной липидной оболочкой с белковым каркасом;
— транскрипция и трансляция разделены в пространстве (транскрипция идет внутри вириона, трансляция — в цитоплазме клетки-хозяина);
— мРНК активно экспортируется через поры в мембранной оболочке;
— геном состоит из линейных молекул ДНК с тандемными повторами на концах;
— расхождение дочерних молекул ДНК при делении может сопровождаться исчезновением оболочки.
Геном таких вирусов представлен линейной двухцепочечной ДНК длиной до 200 тысяч пар нуклеотидов у поксвирусов и более миллиона — у мимивирусов, что сравнимо с размером самых малых бактериальных геномов. Открытые в 2013 году пандоравирусы имеют геном размером до 2,5 миллионов пар нуклеотидов, что соответствует геному средней свободноживущей бактерии. Для репликации ДНК эти вирусы разбирают вирион, а по мере накопления вирусной ДНК в цитоплазме клетки собираются новые вирионы, которые окружаются впячиваниями эндоплазматического ретикулума и плазматической мембраны. Кэпирование, полиаденилирование, а часто и синтез дезоксирибонуклеотидов и восстановление рибозы при размножении этих вирусов осуществляют их собственные ферменты, без участия клеточных белков.
Проведенный Беллом филогенетический анализ гуанилилтрансфераз — ферментов пришивания кэпа — показывает, что ферменты современных вирусов образуют на дереве единую самостоятельную ветвь, а ферменты эукариот — другую. Перемешивания между ними нет, это означает, что не было многократных переносов гена между вирусами и их хозяевами.
Чтобы понять, какой из узлов дерева гуанилилтрансфераз самый древний и соответствует предковому ферменту, к ним добавлены родственные ферменты — АТФ-зависимые ДНК-лигазы. Это более древние белки, предковые по отношению к гуанилилтрансферазам, соответственно ближайший к ним узел гуанилилтрансферазной части дерева укажет нам первую гуанилилтрансферазу в истории. Оказывается, она принадлежала вирусам — одна ветвь ее потомков содержит ферменты поксвирусов, другая — фермент вируса ASF (африканской чумы свиней — African swine fever). Гуанилилтрансферазы эукариот происходят от фермента вирусной линии, давшей начало вирусу ASF. Это доказывает, что кэпирование мРНК, как и другие инновации в генетических системах, появилось сначала среди вирусов и лишь затем было заимствовано эукариотами (рис. 2).
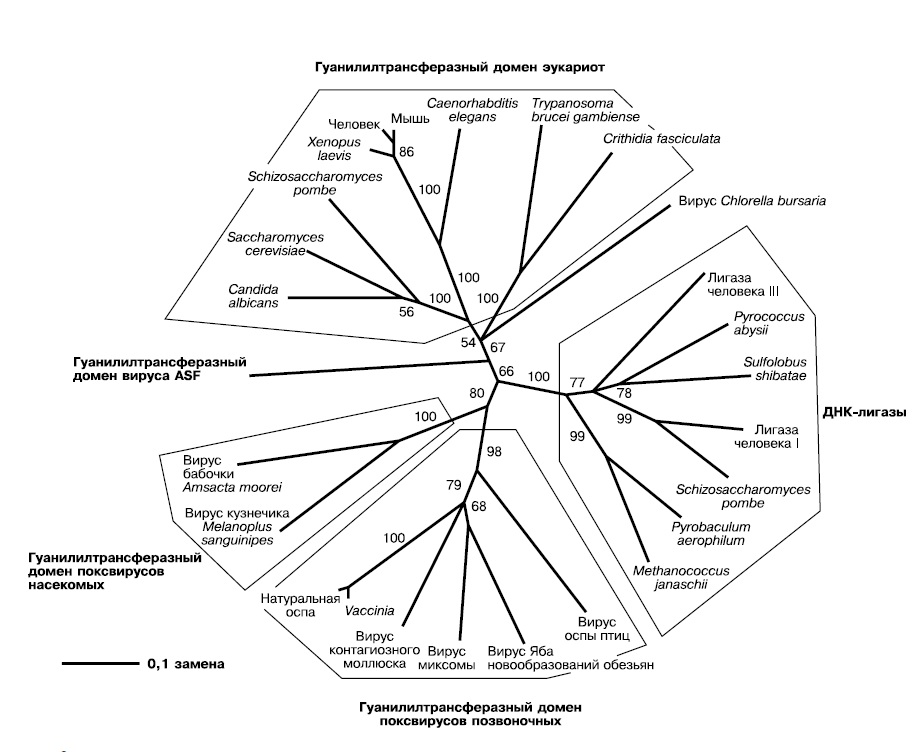 |
| 2. Филогенетическое дерево гуанилилтрансфераз (Bell, 2001) |
Для вирусов, в отличие от клеток, есть очевидная выгода в создании такой системы. Это средство перехвата управления рибосомами хозяина: белок — предок eIF4E присоединяется к рибосомам, после чего они узнают только кэпированные вирусные мРНК, останавливая синтез белков клетки. У мимивируса обнаружен собственный белок-аналог eIF4E, роль его пока непонятна. Аналогичным образом полиаденилирование РНК продлевает их существование в цитоплазме и тоже могло быть сначала адаптацией вируса. Возможно, вирусный фермент когда-то разрушал хозяйские матричные РНК, не имеющие поли-А хвоста.
Такемура обратил внимание на другой ключевой фермент эукариот, ДНК-полимеразу альфа. Как мы помним из предыдущих номеров, главная ДНК-полимераза эукариот, полимераза дельта, которая синтезирует основную часть новой ДНК, унаследована от архей. Полимераза альфа строит первые несколько десятков нуклеотидов новой цепи после РНК-праймера, после чего уступает место полимеразе дельта. В пробирке возможен синтез новой ДНК с помощью одной только полимеразы дельта, но в клетках эукариот этого не происходит. Полимераза альфа, судя по филогенетическим деревьям, получена предком эукариот от вирусов группы LNCDV, родственные, но менее сходные полимеразы встречаются у хвостатых бактериофагов.
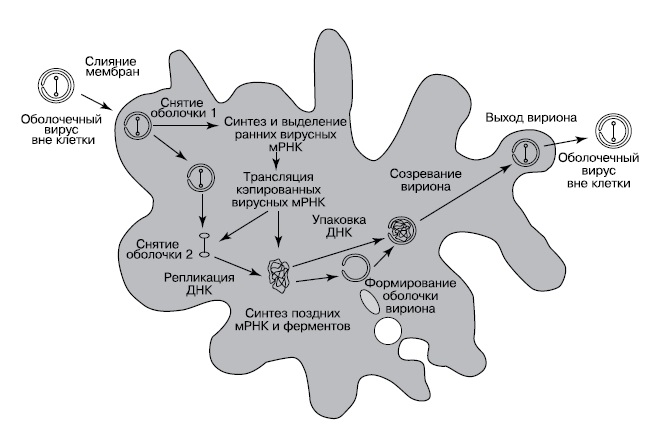 |
| 3. Предполагаемый цикл развития вируса — предка ядра (Bell, 2006) |
Ключевым моментом превращения вируса в ядро должен был стать, как мы уже упоминали, переход такого вируса в лизогенное состояние. Многие вирусы способны переключаться между литическим жизненным циклом (быстрое размножение с гибелью клеток хозяина) и лизогенным существованием — скрытой инфекцией, практически не влияющей на жизнеспособность хозяина. Лизогенное состояние достигается двумя способами: можно интегрировать свой геном в геном хозяина и пользоваться хозяйскими системами репликации или же, переключив активность вирусных генов, постоянно существовать в цитоплазме. В этом случае вирус временно превращается в плазмиду — автономную молекулу ДНК. Он тоже может пользоваться хозяйской системой репликации, но ему нужны собственные механизмы контроля количества копий. Если он будет отставать в репликации от генома хозяина, то деления хозяина будут часто порождать незараженные клетки, а если репликация вируса будет слишком активной, то он будет снижать жизнеспособность хозяина.
Большинство лизогенных бактериофагов и крупные плазмиды поддерживают свое число копий минимальным и используют специальную систему разделения копий по дочерним клеткам, похожей на ту, которая разделяет хромосомы в клетках современных эукариот. Эта система обычно включает в себя белок, обратимо полимеризующийся в нити, центромерные участки ДНК (то есть участки, к которым должны прикрепляться нити веретена деления и в которых соединяются сестринские хромосомы до того, как разойдутся по разным клеткам) и второй белок, связывающий центромеры с нитями первого белка. Запуск полимеризации нитей растаскивает две копии плазмиды или вирусной ДНК по двум концам удлиненной делящейся клетки. У некоторых плазмид, например R1, белок нитей похож на актин, у других встречаются гомологи тубулина. Плазмиды, не способные образовывать вирионы, имеют другой путь горизонтальной передачи в незараженные клетки — конъюгацию, образование специальных контактов между бактериальными клетками, по которым передается плазмидная ДНК.
Лизогенные вирусы, такие, как N15, и плазмиды, как R1, уже имеют цикл размножения, напоминающий митоз: они реплицируются однократно, после чего две копии остаются связанными в центромерном регионе. Дальнейшая репликация блокируется до тех пор, пока полимеризация нитей не растащит две копии далеко друг от друга. Гигантский вирус — предок ядра, в отличие от N15 и R1, имел оболочку вириона. Поэтому ему приходилось разбирать оболочку на время репликации и деления и восстанавливать ее для транскрипции генов, что еще ближе к митозу.
Итак, вирусная теория происхождения ядра лучше других объясняет такие особенности эукариот, как кэпирование и полиаденилирование мРНК, отсутствие оперонов, митоз, мейоз и половые процессы. Она объясняет также происхождение систем слияния мембран и отшнуровки мембранных пузырьков. Серьезными доказательствами в ее пользу могут стать:
— обнаружение среди вирусов архей близких родственников LNCDV-вирусов;
— обнаружение у архейных вирусов системы кэпов;
— находка вирусных гомологов белков мейоза.
К сожалению, архейные вирусы пока остаются практически terra incognita.
Участие вируса в симбиозе, давшем начало эукариотам, снимает многие проблемы взаимодействия архейного и бактериального геномов в одной клетке и защиты от попадания чужеродной ДНК при фагоцитозе. Вирусы, особенно LNCDV, обладают изощренными механизмами для манипуляции чужими генетическими системами. Благодаря транскрипции внутри вирусной частицы, наличию кэпов и полиаденилированию матричных РНК вирус мог поддерживать функционирование зараженной клетки, несмотря на мощный поток чужих генов из фагоцитированных бактерий.
Используя вирусное наследие, эукариоты смогли подчинить сначала альфа-протеобактерий, ставших митохондриями, затем цианобактерий, ставших хлоропластами, а потом множество других бактерий. Всякий раз, когда эукариотам требовался какой-нибудь экзотический биохимический путь, они брали на работу бактерий, уже владеющих им. Так, десятки групп глубоководных животных независимо приручили хемосинтетические бактерии, окисляющие сероводород или метан. Азотфиксация, разложение целлюлозы, синтез витаминов и многое другое эукариоты делают благодаря симбиотическим бактериям. Более того, эукариоты способны вступать в эндосимбиоз с другими эукариотами. Гигантская группа водорослей, в том числе бурые, золотистые, диатомовые, криптофитовые, гаптофитовые и динофлагелляты, произошла от хищного жгутиконосца, приручившего одноклеточную красную водоросль. Следы этого симбиоза видны в четырехмембранных хлоропластах большинства представителей этих групп, а также в нуклеоморфе — маленьком остатке ядра красной водоросли между второй и третьей мембраной хлоропласта криптофитовых водорослей.
И конечно, нужно заключение, раз уж мы подобрались к концу цикла. Итак, мы последовательно рассмотрели этапы биогенеза, от синтеза химических элементов в звездах и до образования эукариотной клетки. Мы видели, как сложные системы, казалось бы, неработоспособные без любой детали, могли эволюционировать из более простых благодаря смене функций. Были найдены удовлетворительные сценарии для большинства маловероятных событий на пути возникновения жизни — от появления хиральной чистоты первых биомолекул до возникновения сложно организованной клетки эукариот, объединившей в себе детали бактерий, архей и вирусов.
Читайте также:

