Синусовая тахикардия при гепатите
Обновлено: 18.04.2024
Синусовая тахикардия представляет собой вид наджелудочковой тахиаритмии, характеризующаяся ускоренным синусовым ритмом с частотой сердечных сокращений более 100 в минуту у взрослого человека.
Причины синусовой тахикардии
Причинами возникновения синусовой тахикардии могут стать сердечные и внесердечные факторы.
Сердечные причины возникновения тахикардии:
- Сердечная недостаточность
- Кардиомиопатия и кардиосклероз
- Инфаркт миокарда
- Миокардиты, эндокардиты и перикардиты
- Стенокардия пороки сердца
Внесердечные причины развития синусовой тахикардии:
- Физические нагрузки
- Эмоциональный стресс
- Неврозы
- Эндокринные нарушения
- Острые болевые приступы
- Лихорадка
- Применение некоторых лекарственных средств, например, ваголитиков, кортикостероидов, диуретиков и других.
- Злоупотреблением чаем, кофе, алкоголем и сигаретами
Синусовая тахикардия классифицируется на адекватную и неадекватную.
Неадекватная синусовая тахикардия сохраняется в покое и не зависит от нагрузки и приема лекарственных препаратов. Сопровождаться ощущениями сильного сердцебиения и нехваткой воздуха.
Симптомы синусовой тахикардии
Проявления синусовой тахикардии зависит от степени ее выраженности, длительности и характера основного заболевания, повлекшего за собой изменение сердечного ритма.
При синусовой тахикардии пациенты могут жаловаться на сердцебиение, неприятные ощущения, чувство тяжести или боли в области сердца.
Также состояние может сопровождаться нехваткой воздуха и слабостью, частыми головокружениями, повышенной утомляемостью и снижение работоспособности, бессоницей и ухудшением настроения.
При синусовой тахикардии отмечаются постепенное начало и конец приступа. При длительной тахикардии наблюдается снижение артериального давления и похолодание конечностей.
Диагностика синусовой тахикардии
В комплексном обследовании пациента с подозрением на синусовую тахикардию проводится ряд обследований, в том числе и для выявления причины нарушения сердечного ритма.
План обследования включает:
- ЭКГ для определения частоты и ритмичности сердечных сокращений
- Холтеровское мониторирование позволяет оценить изменение деятельности сердца в условиях обычной активности пациента
- Эхокардиография и МРТ сердца проводят для определения внутрисердечной патологии -- причины тахикардии
- Электрофизиологическое исследование позволяет определить механизм тахикардии и нарушений проводимости сердца
- Дополнительно могут потребоваться общий анализ крови, определение содержания тиреотропных гормонов в крови, электроэнцефалография головного мозга и другие.
Что можете сделать Вы
Самолечение недопустимо, необходимо обратиться к врачу. А также исключить факторы, способствующие повышению частоты сердечных сокращений: крепкий чай, кофе, алкоголь, сигареты, острую пищу и шоколад. По возможности следует оградить себя от психоэмоциональных и физических перегрузок.
Лечение
Что может сделать врач
Лечение в первую очередь направлено на устранение первопричины синусовой тахикардии, то есть основного заболевания. Основным специалистом является кардиолог, но ему могут потребоваться дополнительные консультации невролога, эндокринолога и других докторов.
Пациенту с синусовой тахикардией могут быть назначены седативные средства, β-блокаторы, антагонисты кальция и другие препараты.
При отсутствии эффекта от консервативной терапии может быть назначена трансвенозная РЧА сердца, то есть восстановление нормального сердечного ритма путем прижигания пораженного участка сердца. В тяжелых случаях может быть рекомендована имплантация электрокардиостимулятора (ЭКС) – искусственного водителя ритма.
Профилактика синусовой тахикардии
Соблюдение правил здорового образа жизни.
Перед началом применения любого препарата посоветуйтесь со специалистом и ознакомьтесь с инструкцией по применению.
ПВТ — противовирусная терапия
СН — сердечная недостаточность
ХГС — хронический гепатит С
HCV — вирус гепатита С
NT-pro-BNP — N-концевой предшественник мозгового натрийуретического пептида
Хронический гепатит С (ХГС) — актуальная междисциплинарная проблема. Хорошо изучены различные внепеченочные проявления ХГС, такие как смешанная криоглобулинемия, гломерулонефрит, поздняя кожная порфирия, красный плоский лишай, синдром Шегрена и др. Однако существует целый ряд системных проявлений, которые нуждаются в более тщательном изучении, в частности поражение сердца. При ХГС описаны миокардит, гипертрофическая (ГКМП) и дилатационная (ДКМП) кардиомиопатии, коронарит вследствие криоглобулинемического васкулита мелких сосудов сердца, аритмогенная дисплазия правого желудочка, аневризма левого желудочка, раннее развитие атеросклероза и ишемической болезни сердца [1—6]. Возможно развитие цирротической кардиомиопатии (КМП), которая наблюдается при циррозах печени различной этиологии, в том числе вирусной. Развивается диастолическая дисфункция миокарда и синдром удлиненного интервала Q—T, выраженность которого увеличивается по мере нарастания декомпенсации функции печени [7—11]. Наконец, широко используемая противовирусная терапия (ПВТ) ХГС может сопровождаться кардиотоксичностью интерферона (ИФН), имеющей клинические особенности и нередко проявляющейся развитием декомпенсации деятельности сердца.
Миокардит является одним из мало изученных внепеченочных проявлений ХГС [3, 4]. В клинике им. Е.М. Тареева описана серия наблюдений из 22 больных хроническим гепатитом вирусной этиологии с миокардитом, у 13 из которых диагностирован цирроз печени. Поражение сердца у 4 больных стало причиной летального исхода. В 3 наблюдениях на аутопсии выявлена картина хронического активного миокардита: обширные очаги лизиса кардиомиоцитов (КМЦ) с очаговой лимфогистиоцитарной инфильтрацией; многочисленные продуктивные и продуктивно-деструктивные эндофлебиты; диффузный фиброз стромы; лимфогистиоцитарная инфильтрация стромы. В одном случае диагностированы диффузный кардиосклероз, миокардиофиброз, диффузный склероз эндокарда. Особенностью двух других наблюдений явились выраженные изменения в проводящей системе сердца: волокна проводящей системы замурованы в грубоволокнистую фиброзную ткань, отмечены резко выраженная дистрофия и некробиоз КМЦ. У этих больных наблюдались различные нарушения проводимости [4].
Первичные КМП представляют собой гетерогенную группу заболеваний миокарда различной этиологии. Наибольший интерес к проблеме миокардитов и КМП, ассоциированных с HCV-инфекцией, отмечен у исследователей из Японии. Выявлена высокая распространенность HCV-инфекции у больных ГКМП, ДКМП и миокардитом [17—20]. При многоцентровом исследовании по программе Комитета по изучению идиопатических КМП в Японии, антитела HCV в сыворотке выявлены у 74 (10,6%) из 697 больных ГКМП и у 42 (6,3%) из 633 больных ДКМП, значительно превышая частоту обнаружения антител HCV у сопоставимых по возрасту доноров крови (2,4%) [20].
По данным A. Matsumori [1], у 113 больных ГКМП, HCV-инфекция диагностирована у 16 (14,1%), причем ни у одного из них не было семейного анамнеза по ГКМП. В 4 наблюдениях имелись указания на гемотрансфузии в анамнезе, у 10 больных определялся повышенный уровень трансаминаз в сыворотке, у 7 выявлен гепатоцеллюлярный рак. При морфологическом исследовании отмечены умеренная или выраженная гипертрофия правого и левого желудочков, фиброз различной степени и умеренная клеточная инфильтрация миокарда. РНК HCV генотипа 1b выявлена в сыворотке у 7 больных, РНК HCV в ткани миокарда — у 6, минус-цепи РНК HCV обнаружены в биоптатах сердца у 2 больных. Другая группа исследователей выявила антитела HCV у 18 (22,5%) из 80 больных ГКМП [21].
Многоцентровое исследование, проводимое научным комитетом по изучению КМП Всемирной федерации заболеваний сердца, ставило задачу выявления вирусных геномов энтеровирусов, аденовируса, цитомегаловируса и HCV в формалиновых срезах ткани сердца. Геном HCV выявлен в 2 (18%) из 11 биоптатов больных ДКМП и миокардитом в Италии и у 4 (36%) из 11 больных в США, у 2 из них выявлен миокардит и у 2 — аритмогенная дисплазия правого желудочка. Несмотря на то что метод выявления генома HCV в парафиновых (фиксированных в формалине) срезах менее чувствительный, чем в замороженных образцах, предполагается, что HCV-инфекция может быть более частой причиной ряда заболеваний миокарда, в первую очередь миокардита [22]. Показано также, что частота развития КМП, обусловленных HCV, варьирует в различных регионах мира и различных популяциях. Среди больных КМП в Канаде (Ванкувер) РНК HCV не обнаружена ни в одном из 24 образцов ткани сердца. Ряд европейских исследователей также высказываются против связи HCV-инфекции и заболеваний сердца [23].
В последние годы также изучается вопрос о взаимосвязи ХГС и уровня натрийуретических пептидов. Так, в крупном ретроспективном исследовании антитела к HCV выявлены у 59 (4,4%) из 1355 больных с СН неясной этиологии, что значительно превышало частоту НCV-инфекции в общей популяции (1,8%). Уровень N-концевого предшественника мозгового натрийуретического пептида (NT-pro-BNP) в сыворотке у больных с СН и ХГС достоверно выше, чем у больных с СН без маркеров HCV (р<0,0001) [24]. Интересным представляется исследование А. Antonelli и соавт. [25], которые выявили повышенный уровень NT-pro-BNP у 34% больных ХГС, в то время как в группе неинфицированных, сопоставимых по полу и возрасту, повышение данного лабораторного показателя отмечалось лишь в 6% наблюдений. Это может свидетельствовать в пользу субклинического поражения сердца у некоторых больных ХГС.
Генетические факторы и патогенетические звенья поражения сердца при HCV. Несмотря на то что в последнее время в литературе описываются клинические наблюдения ДКМП и ГКМП, ассоциированных c HCV [1, 6, 18, 21]; механизм, посредством которого HCV приводит к их развитию, полностью не изучен. У ряда пациентов с ассоциированной с HCV КМП идентифицированы HLA- и не-HLA-гаплотипы, которые дают основание полагать, что фактором развития данного вида поражения сердца является генетическая предрасположенность. Так, в развитии ДКМП участвует α-фактор некроза опухоли (α-ФНО) — один из ключевых цитокинов, усиление синтеза которого наблюдается при HCV-инфекции [26].
Причиной миокардита, приводящего к ДКМП и СН, могут быть некоторые вирусы, обладающие тропизмом к миокарду [27, 28]. Считается, что в основе развития вирусного миокардита и прогрессирования его в КМП лежат механизмы смерти клетки в результате апоптоза, а также индуцированные вирусами иммунные реакции [29]. Предполагаемым иммунным механизмом является постоянное обновление иммунокомпетентных клеток и продуцируемых ими цитокинов [30, 31]. Среди всех цитокинов, участвующих в развитии и прогрессировании миокардита, наиболее важную роль играет α-ФНО [32—34]. Отдельные исследования показали, что имеется связь как между сниженной функцией миокарда и повышенной экспрессией α-ФНО, так и между концентрацией α-ФНО в плазме и миокарде у больных миокардитом [35] и ДКМП [36]. С помощью иммуногистохимического анализа установлено, что α-ФНО продуцируется КМЦ при вирусных миокардитах, ассоциированных с аденовирусом, цитомегаловирусом, вирусом Эпштейна—Барр, вирусами гриппа, А и B, а также HCV [35, 37]. Отрицательный инотропный эффект α-ФНО обусловлен связыванием α-ФНО со специфическими рецепторами TNFR1 и TNFR2, которые экспрессируются на мембране КМЦ [38]. Также вероятно, что α-ФНО ингибирует кальциевые каналы L-типа, что приводит к снижению систолической функции миокарда [39]. Другим механизмом, посредством которого α-ФНО влияет на миокард, является стимулирование продукции оксида азота (NO), который оказывает отрицательное инотропное действие на миокард, действуя как эндогенный ингибитор и фактически уменьшая положительный инотропный ответ на β-адренергическую стимуляцию [40].
Некоторые гены, например гены системы HLA, причастны к клиренсу и персистенции HCV-инфекции [41]. В нескольких исследованиях сообщалось, что ДКМП и ГКМП ассоциируются с некоторыми аллелями системы HLA. Так, у инфицированных HCV пациентов, у которых развивается ДКМП, более часто выявляются гаплотипы HLA-DPB1*0901 и HLA-DRB1*1201, а у инфицированных HCV пациентов с ГКМП — гаплотипы HLA DRB1*0901 и DQB1*0303 [1, 42]. По данным других авторов, развитие ДКМП, ассоциированной с HCV, наиболее отчетливо коррелирует с аллелями не-HLA-генов, чем с генами системы HLA [43]. Таким образом, пилотные исследования демонстрируют, что имеется генетическая предрасположенность к развитию поражения миокарда у пациентов с ХГС (рис. 1).

Рис. 1. Генетическая предрасположенность к поражению миокарда при HCV-инфекции.
По данным N. O’Garra и соавт. [44], в печени развивается выраженный CD4+ Th1 клеточный ответ, наиболее вероятно индуцируемый интерлейкином (ИЛ) 12, ИФН-α и ИФН-β, которые продуцируются моноцитами, нейтрофилами и макрофагами после стимуляции Toll-like-рецепторов HCV производными продуктами. Если определенные гаплотипы кодируют молекулы главного комплекса гистосовместимости (ГКГ) II класса с более высоким сродством к производным пептидам HCV, то их функция как молекул, презентирующих антигены клеткам Th1 CD4+, повышается. После активации клетки Th1 CD4+ продуцируют ИФН-γ, который активирует макрофаги к продукции провоспалительных цитокинов [44]. Главными цитокинами, продуцируемыми макрофагами, являются ИЛ-1 и α-ФНО [45], которые могут приводить к обновлению иммунных клеток и высокой концентрации α-ФНО в миокарде.
Другим механизмом, посредством которого гаплотипы HLA могут влиять на развитие ДКМП, ассоциированной с HCV, в контексте α-ФНО является так называемая неклассическая функция клеток ГКГ II класса, т. е. их роль в качестве сигнальных трансдукционных молекул, активируемых суперантигенами в клетках некоторых типов [46, 47]. Суперантигены являются протеинами бактериального или вирусного происхождения, которые активируют до 20% Т-клеточной популяции путем одновременного связывания Т-клеточных рецепторов и молекул ГКГ II класса, что приводит к массивному высвобождению цитокинов, которые секретируются как Т-клетками, так и антигенпрезентирующими клетками [48—50]. В контексте полиморфизма HLA предполагалось, что они принимают непосредственное участие в исходе, к которому приводит продукция цитокинов, стимулируемая суперантигенами [51, 52]. Можно предположить, что определенные гаплотипы HLA кодируют эпитопы молекул ГКГ II класса с высоким сродством к производным HCV суперантигенам или антителам, а это ведет к чрезмерной продукции цитокинов, в частности α-ФНО. Более активное обновление иммунных клеток может привести у генетически предрасположенных инфицированных HCV пациентов к развитию миокардита и впоследствии к ДКМП. Следует отметить, что часто при ассоциированном с HCV хроническом активном миокардите у пациентов отмечался нормальный уровень активности печеночных трансаминаз в сыворотке крови вплоть до формирования терминальной стадии СН [53].
Развитие и прогрессирование вирусного миокардита, в том числе у больных ХГС, осуществляется через различные патогенетические звенья (рис. 2): 1) прямое действие вируса на миокард; 2) непрямое (иммунологическое) действие; 3) смерть клеток в результате апоптоза.

Рис. 2. Механизмы поражения миокарда при HCV-инфекции. АФК — активные формы кислорода.
Воздействие HCV на миокард. Ряд исследователей указывают на возможность прямого воздействия HCV на миокард. Показано, что HCV реплицируется в миокарде, о чем свидетельствует выявление там негативных цепей РНК [53—55]. Механизм, посредством которого протеин HCVcorе вызывает повреждение миокарда, остается неясным; однако он может быть сходным с механизмом поражения печени. Показано, что изменения в структуре рецепторов TNFR1, вызываемых протеином HCVcorе, повышают чувствительность клеток к цитолизу, опосредованному α-ФНО [56]. Кроме того, протеин HCVcorе вызывает дисфункцию митохондрий, что приводит к развитию окислительного стресса клеток печени [57, 58]. Фактически, протеин HCVcore ограничивает свое действие в митохондриях, в частности он взаимодействует с наружной мембраной митохондрий, повышает поглощение кальция митохондриями и вызывает окисление глутатиона, что приводит к дальнейшему повышению продукции АФК [59, 60]. Повышение образования АФК инициирует продукцию α-ФНО [61], который, как отмечено ранее, оказывает отрицательное инотропное действие на миокард. В некоторых ранее проводимых исследованиях продемонстрировано, что у пациентов с острой и хронической СН, развившихся в исходе КМП, в миокарде определяется повышение выработки АФК [62, 63].
К тому же ряд исследований на животных подтверждают роль протеина HCVcore в развитии КМП. В частности, развитие КМП наблюдалось у трансгенных мышей, носителей гена HCVcore, в возрасте 12 мес. Гистологический анализ миокарда этих мышей выявил гипертрофию КМЦ, кардиальный фиброз, дезорганизацию, дефицит и лизис миофибрилл, вакуолизацию и деформацию ядер, повышенное количество митохондрий неправильной формы [55], что убедительно подтверждает определяющие действие протеина HCVcore на развитие КМП, ассоциированной с HCV.
Непрямой иммунологический механизм поражения миокарда включает вовлечение в патологический процесс В-клеток, Т-клеток и макрофагов. Участие В-клеток в КМП, ассоциированной с HCV, предположено в результате обследования 3 пациентов с ассоциированным с HCV миокардитом, ответивших на иммуносупрессивную терапию. В сыворотке крови этих больных выявлены антитела к миокарду, что дало основание предполагать иммунологический механизм повреждения клеток. В дальнейшем подтверждение иммуноопосредованного механизма КМП, ассоциированной с HCV, было основано на эффективности иммуносупрессивных препаратов (преднизолон и азатиоприн), терапия которыми привела к нормализации размеров камер сердца и регрессу признаков СН, несмотря на продолжающуюся персистенцию HCV [54].
Прямой и непрямой механизмы развития ДКМП, ассоциированной с HCV, связаны со смертью клеток через апоптоз. Благодаря способности повышать продукцию АФК, протеин HCVcore может инициировать митохондриальный путь апоптоза. АФК могут вызывать диссоциацию цитохрома С на внутренней мембране митохондрий, что приводит к активации каспаз, результатом чего является фрагментация геномной ДНК и смерть клетки [64]. В результате связывания лигандов с внеклеточными рецепторами суперсемейства рецепторов α-ФНО происходит активация рецепторзависимого сигнального пути апоптоза [65]. Наиболее важными лигандами этих рецепторов являются α-ФНО и Fas-лиганд (FasL). Высокий уровень α-ФНО в миокарде у пациентов с ассоциированным с HCV миокардитом может активировать данный механизм смерти клеток путем взаимодействия с рецепторами ФНО [66].
Заключение
Имеются убедительные доказательства того, что поражение сердца служит одним из внепеченочных проявлений HCV-инфекции. Механизм, посредством которого HCV может приводить к поражению миокарда у генетически предрасположенных пациентов, является многофакторным и включает прямое повреждающее действие вируса, аутоиммунный механизм и апоптоз.
Поражение миокарда при ХГС может прогрессировать в хронический персистирующий миокардит через прямой (вирусный) и непрямой (иммунный) механизмы повреждения, которые приводят к активации зависимой от рецепторов смерти КМЦ, результатом чего является развитие фиброза миокарда с возможной трансформацией в ДКМП. Кроме того, описаны случаи взаимосвязи HCV и ГКМП.
До настоящего момента HCV-инфицированным больным с вовлечением сердца ПВТ, как правило, не проводилась из-за побочных эффектов ИФН. Однако за последние несколько лет в ПВТ вирусного гепатита С произошли кардинальные изменения. Длительное изучение механизмов репликации HCV привело к созданию ингибиторов протеаз HCV (NS¾A, NS5A, NS5B), которые позволяют достичь элиминации вируса у 90—99% пациентов за существенно более короткий срок (как правило, 12 нед) без применения препаратов ИФН (так называемая безинтерфероновая терапия). Это делает данную терапию гораздо более безопасной и хорошо переносимой, в том числе в отношении миокарда [67—69].
Нуждается в отдельном изучении вопрос эффективности и безопасности ПВТ у пациентов с ХГС и ассоциированного с ним поражения сердца, включая сравнение только ПВТ и сочетания ПВТ с сердечно-сосудистыми препаратами и/или иммуносупрессорами. Выявление антител к миокарду и определение уровня α-ФНО в сыворотке крови во время терапии может быть использовано для оценки влияния терапии на данные маркеры.
Тахикардия – вид аритмии, характеризующийся частотой сердечных сокращений более 90 ударов в минуту. Вариантом нормы тахикардия считается при увеличении физической или эмоциональной нагрузки. Патологическая тахикардия – следствие заболеваний сердечно-сосудистой или других систем. Проявляется ощущением сердцебиения, пульсацией сосудов шеи, беспокойством, головокружением, обмороками. Может привести к развитию острой сердечной недостаточности, инфаркта миокарда, ИБС, остановки сердца.
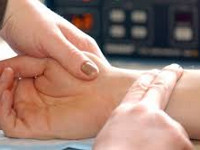
Общие сведения
Тахикардия – вид аритмии, характеризующийся частотой сердечных сокращений более 90 ударов в минуту. Вариантом нормы тахикардия считается при увеличении физической или эмоциональной нагрузки. Патологическая тахикардия – следствие заболеваний сердечно-сосудистой или других систем. Проявляется ощущением сердцебиения, пульсацией сосудов шеи, беспокойством, головокружением, обмороками. Может привести к развитию острой сердечной недостаточности, инфаркта миокарда, ИБС, остановки сердца.
В основе развития тахикардии лежит повышенный автоматизм синусового узла, в норме задающего темп и ритмичность сердечных сокращений, или эктопических центров автоматизма.
Ощущение человеком своего сердцебиения (учащения и усиления сердечных сокращений) не всегда свидетельствует о заболевании. Тахикардия появляется у здоровых людей при физической нагрузке, стрессовых ситуациях и нервной возбудимости, при недостатке кислорода и повышенной температуре воздуха, под влиянием некоторых лекарств, алкоголя, кофе, при резкой перемене положения тела из горизонтального в вертикальное и т. д. Тахикардия у детей младше 7 лет считается физиологической нормой.
Появление тахикардии у практически здоровых людей связано с физиологическими компенсаторными механизмами: активацией симпатической нервной системы, выбросом в кровь адреналина, ведущими к увеличению сердечных сокращений в ответ на воздействие внешнего фактора. Как только действие внешнего фактора прекращается, ЧСС постепенно возвращается к норме. Однако нередко тахикардия сопровождает течение целого ряда патологических состояний.

Классификация тахикардии
С учетом причин, вызвавших учащение сердечных сокращений, выделяют тахикардию физиологическую, возникающую при нормальной работе сердца как адекватную реакцию организма на определенные факторы, и патологическую, развивающуюся в покое вследствие врожденной либо приобретенной сердечной или иной патологии.
Патологическая тахикардия является опасным симптомом, т. к. ведет к снижению объема выброса крови и другими расстройствам внутрисердечной гемодинамики. При слишком частом сердцебиении желудочки не успевают наполняться кровью, уменьшается сердечный выброс, понижается артериальное давление, ослабевает приток крови и кислорода к органам, в том числе и к самому сердцу. Длительное снижение эффективности работы сердца приводит к возникновению аритмогенной кардиопатии, нарушению сократимости сердца и увеличению его объема. Плохое кровоснабжение сердца повышает риск развития ишемической болезни и инфаркта миокарда.
По источнику, генерирующему электрические импульсы в сердце, выделяют тахикардию:
- синусовую - развивается при увеличении активности синусового (синоатриального) узла, являющегося основным источником электрических импульсов, задающим в норме сердечный ритм;
- эктопическую (пароксизмальную) тахикардию, при которой генератор ритма находится вне синусового узла - в предсердиях (наджелудочковая) или желудочках (желудочковая). Обычно протекает в виде приступов (пароксизмов), которые начинаются и прекращаются внезапно, продолжаются от несколько минут до нескольких суток, при этом частота сердцебиений остается постоянно высокой.
Для синусовой тахикардии характерно увеличение ЧСС до 120–220 ударов в минуту, постепенное начало и правильный синусовый сердечный ритм.
Причины синусовой тахикардии
Синусовая тахикардия встречается в разных возрастных группах, чаще у здоровых людей, а также среди пациентов, сердечными и другими заболеваниями. Возникновению синусовой тахикардии способствуют интракардиальные (сердечные), или экстракардиальные (внесердечные) этиологические факторы.
Синусовая тахикардия у больных с сердечно-сосудистыми заболеваниями чаще всего является ранним симптомом сердечной недостаточности или дисфункции левого желудочка. К интракардиальным причинам синусовой тахикардии относятся: острая и застойная хроническая сердечная недостаточность, инфаркт миокарда, тяжелая стенокардия, миокардиты ревматического, токсико-инфекционного и другого генеза, кардиомиопатии, кардиосклероз, пороки сердца, бактериальный эндокардит, экссудативный и адгезивный перикардит.
Среди физиологических экстракардиальных причин синусовой тахикардии могут быть физические нагрузки, эмоциональный стресс, врожденные особенности. Неврогенные тахикардии составляют большинство экстракардиальных аритмий и связаны с первичной дисфункцией коры головного мозга и подкорковых узлов, а также нарушениями вегетативной нервной системы: неврозами, аффективными психозами (эмоциональная тахикардия), нейроциркуляторной дистонией. Нейрогенным тахикардиям подвержены чаще всего люди молодого возраста с лабильной нервной системой.
Среди прочих факторов экстракардиальной тахикардии встречаются эндокринные нарушения (тиреотоксикоз, увеличение выработки адреналина при феохромоцитоме), анемии, острая сосудистая недостаточность (шок, коллапс, острая кровопотеря, обморок), гипоксемия, острые болевые приступы (например, при почечной колике).
Фармакологическая (медикаментозная) и токсическая синусовая тахикардия возникают при влиянии на функцию синусового узла лекарственных и химических веществ: симпатомиметиков (адреналина и норадреналина), ваголитиков (атропина), эуфиллина, кортикостероидов, тиреотропных гормонов, диуретиков, гипотензивых препаратов, кофеина (кофе, чай), алкоголя, никотина, ядов (нитратов) и др. Некоторые вещества не оказывают прямого действия на функцию синусового узла и вызывают, так называемую, рефлекторную тахикардию посредством повышения тонуса симпатической нервной системы.
Синусовая тахикардия может быть адекватной и неадекватной. Неадекватная синусовая тахикардия может сохраняться в покое, не зависеть от нагрузки, приема медикаментов, сопровождаться ощущениями сильного сердцебиения и нехваткой воздуха. Это достаточно редкое и малоизученное заболевание неясного генеза. Предположительно, оно связано с первичным поражением синусового узла.
Симптомы синусовой тахикардии
Наличие клинических симптомов синусовой тахикардии зависит от степени ее выраженности, длительности, характера основного заболевания. При синусовой тахикардии субъективные симптомы могут отсутствовать или быть незначительными: сердцебиение, неприятные ощущения, чувство тяжести или боли в области сердца. Неадекватная синусовая тахикардия может проявляться стойким сердцебиением, чувством нехватки воздуха, одышкой, слабостью, частыми головокружениями. Могут наблюдаться утомляемость, бессонница, снижение аппетита, работоспособности, ухудшение настроения.
Степень субъективных симптомов диктуется основным заболеванием и порогом чувствительности нервной системы. При заболеваниях сердца (например, коронарном атеросклерозе) увеличение числа сердечных сокращений может вызывать приступы стенокардии, усугубление симптомов сердечной недостаточности.
При синусовой тахикардии отмечаются постепенное начало и конец. В случае выраженной тахикардии симптомы могут отражать нарушения кровоснабжения различных органов и тканей в связи с уменьшением сердечного выброса. Появляются головокружение, иногда обмороки; при поражении сосудов головного мозга - очаговые неврологические нарушения, судороги. При длительной тахикардии происходит снижение артериального давления (артериальная гипотония), уменьшение диуреза, наблюдается похолодание конечностей.
Диагностика синусовой тахикардии
Диагностические мероприятия проводятся для выявления причины (поражения сердца или внесердечных факторов) и дифференциации синусовой и эктопической тахикардии. ЭКГ принадлежит ведущая роль в дифференциальной диагностике вида тахикардии, определении частоты и ритмичности сердечных сокращений. Суточный мониторинг ЭКГ по Холтеру высоко информативен и абсолютно безопасен для пациента, выявляет и анализирует все виды нарушенй сердечного ритма, изменение деятельности сердца в условиях обычной активности пациента.
ЭхоКГ (эхокардиографию), МРТ сердца (магнитно-резонансную томографию) проводят для выявления внутрисердечной патологии, вызывающей патологическую тахикардию ЭФИ (электрофизиологическое исследование) сердца, изучая распространение электрического импульса по сердечной мышце, позволяет определить механизм тахикардии и нарушений проводимости сердца. Дополнительные методы исследования (общий анализ крови, определение содержания тиреотропных гормонов в крови, ЭЭГ головного мозга и др.) позволяют исключить заболевания крови, эндокринные нарушения, патологическую активность ЦНС и т. п.
Лечение синусовой тахикардии
Принципы лечения синусовой тахикардии определяются, в первую очередь, причинами ее возникновения. Лечение должно проводится кардиологом совместно с другими специалистами. Необходимо устранить факторы, способствующие повышению частоты сердечных сокращений: исключить кофеинсодержащие напитки (чай, кофе), никотин, алкоголь, острую пищу, шоколад; оградить себя от психоэмоциональных и физических перегрузок. При физиологической синусовой тахикардии лечения не требуется.
Лечение патологической тахикардии должно быть направлено на устранение основного заболевания. При экстракардиальных синусовых тахикардиях неврогенного характера пациенту необходима консультация невролога. В лечении используют психотерапию и седативные средства (люминал, транквилизаторы и нейролептики: мебикар, диазепам). В случае рефлекторной тахикардии (при гиповолемии) и компенсаторной тахикардии (при анемии, гипертиреозе) необходимо устранение вызвавших их причин. Иначе терапия, направленная на снижение ЧСС, может привести к резкому понижению артериального давления и усугубить нарушения гемодинамики.
При синусовой тахикардии, обусловленной тиреотоксикозом, в дополнение к назначенным эндокринологом тиреостатическим препаратам применяют β-адреноблокаторы. Предпочтение отдается β-блокаторам группы оксипренолола и пиндолола. При наличии противопоказаний к β-адероноблокаторам используют альтернативные лекарственные препараты - антагонисты кальция негидропиридинового ряда (верапамил, дилтиазем).
При синусовой тахикардии, обусловленной сердечной недостаточностью, в сочетании с β-адреноблокаторами назначаются сердечные гликозиды (дигоксин). Целевая ЧСС должна подбираться индивидуально, в зависимости от состояния пациента и его основного заболевания. Целевая ЧСС покоя при стенокардии обычно равна 55-60 ударов в минуту; при нейроциркуляторной дистонии – 60 - 90 ударов в минуту, в зависимости от субъективной переносимости.
При параксизмальной тахикардии повышения тонуса блуждающего нерва можно достичь специальным массажем - надавливанием на глазные яблоки. При отсутствии эффекта вводят внутривенно антиаритмическое средство (верапамил, амиодарон и др.). Пациентам с желудочковой тахикардией требуется неотложная помощь, экстренная госпитализация и проведение противорецидивной антиаритмической терапии.
При неадекватной синусовой тахикардии, при неэффективности b-адреноблокаторов и в случае значительного ухудшения состояния больного, применяют трансвенозную РЧА сердца (восстановление нормального сердечного ритма путем прижигания пораженного участка сердца). При отсутствии эффекта или угрозе жизни пациента проводят хирургическую операцию имплантации электрокардиостимулятора (ЭКС) — искусственного водителя ритма.
Прогноз и профилактика синусовой тахикардии
Синусовая тахикардия у пациентов с заболеваниями сердца чаще всего является проявлением сердечной недостаточности или дисфункции левого желудочка. В этих случаях прогноз может быть достаточно серьезным, так как синусовая тахикардия является отражением реакции сердечно-сосудистой системы на уменьшение фракции выброса и расстройство внутрисердечной гемодинамики. В случае физиологической синусовой тахикардии, даже при выраженных субъективных проявлениях, прогноз, как привило, удовлетворительный.
Профилактика синусовой тахикардии заключается в ранней диагностике и своевременной терапии сердечной патологии, устранении внесердечных факторов, способствующих развитию нарушений частоты сердечных сокращений и функции синусового узла. Во избежание серьезных последствий тахикардии необходимо соблюдение рекомендаций по здоровому образу жизни.
Синусовая тахикардия у ребенка — это повышение частоты сердечных сокращений на 10-60% от возрастной нормы вследствие нарушения работы синоатриального узла. У грудничков патология проявляется плачем и беспокойством, отказом от еды, изменением цвета кожных покровов. Старшие дети предъявляют жалобы на слабость и головокружение, сердцебиение, дискомфорт в предсердечной области. С диагностической целью ребенку назначают инструментальные методы (ЭКГ, Эхо-КГ, КТ сердца) и анализы крови. Лечение включает антиаритмическую и кардиометаболическую терапию, в осложненных случаях применяют интервенционные и хирургические вмешательства.
МКБ-10
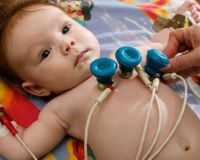
Общие сведения
Проблема нарушений сердечного ритма, к которым относится синусовая тахикардия, остро стоит в современной детской кардиологии. Это обусловлено трудностью ранней диагностики патологии, разнообразием и атипичностью клинической симптоматики, возможностью бессимптомного течения. Частота встречаемости аритмии составляет 22,5 случая на 100 тыс. детского населения, а синусовая тахикардия занимает первое место среди всех видов расстройств ритма. Чаще всего болезнь регистрируется у детей до 1 года, в возрасте 5-8 лет и у подростков 12-16 лет.

Причины
В большинстве случаев в детском возрасте наблюдается физиологическая тахикардия. Она развивается у ребенка при сильном стрессе, после обильного приема пищи, при физической нагрузке и пребывании в жарком помещении. Для нее характерно быстрое восстановление ЧСС после ликвидации провоцирующего фактора и отсутствие неблагоприятных изменений кардиоваскулярной системы. Патологические причины синусовых нарушений ритма делятся на 2 группы:
- Экстракардиальные. Основными из этих факторов являются нарушения иннервации сердца при расстройствах работы центральной и вегетативной нервной системы. Реже синусовая тахикардия связана с метаболическими изменениями (гиперкальциемия, гипогликемия, гипоксемия), нейротоксикозом, передозировкой кардиотропных лекарств.
- Кардиальные. В эту группу относятся любая органическая кардиопатология: врожденные и приобретенные пороки развития, воспалительные и невоспалительные поражения миокарда, травматические и токсические повреждения. Изредка сердечный ритм нарушается при системных болезнях соединительной ткани.
Этиология синусовой тахикардии зависит от возраста ребенка. У детей 1-го года жизни основной причиной выступают врожденные пороки (аномалия Эбштейна, дефект межпредсердной перегородки) и перинатальные повреждения сердца. У дошкольников и школьников в равной степени выявляются органические и внесердечные факторы. У подростков преобладают экстракардиальные факторы, что связано с половым созреванием и нейрогуморальными изменениями в организме.
Патогенез
Патофизиологической основой заболевания служат нарушения функционирования и автоматизма синоатриального узла (СА). Они возникают при морфологических изменения в электрической системе сердца либо при негативных нейрогуморальных воздействиях. Ученые называют 2 основных механизма формирования синусовой тахикардии: повышенный автоматизм синусового узла и увеличение влияния симпатических нервных волокон.
Гемодинамические изменения на ранней стадии расстройства носят компенсаторный характер — возрастает минутный объем кровообращения и усиливается кровоток в венечных сосудах. При длительном существовании синусовой тахикардии и повышении ЧСС более чем на 50% от нормы у ребенка наблюдается сокращение диастолы. В результате этого коронарный кровоток снижается, миокард страдает от дефицита кислорода и энергетических молекул.
Классификация
Расстройство относят к наджелудочковой аритмии согласно локализации нарушений ритма. Она может быть врожденной и приобретенной, первичной (идиопатической) и вторичной, возникающей как симптом кардиоваскулярных болезней. Для клинической оценки тяжести синусовой тахикардии у ребенка используют деление на 3 стадии по уровню ЧСС:
- Умеренная (I степень) — частота сердечных сокращений возрастает на 10-20% от нормы, соответствующей возрасту.
- Средняя (II степень) — учащение сердцебиения на 20-40%.
- Выраженная (III степень) — пульс учащается на 40-60% от нормы.
Симптомы
Клинические проявления широко варьируют в зависимости от причины заболевания и возраста ребенка. Синусовая тахикардия у новорожденных и грудничков не имеет патогномоничных симптомов. В момент учащения сердцебиения ребенок становится беспокойным, громко плачет, отказывается от еды. Заметны бледность кожи и повышенная потливость. Изредка отмечаются рвота, задержка мочеиспускания. Когда физиологический ритм восстанавливается, состояние приходит в норму.
Синусовую тахикардию в дошкольном и младшем школьном возрасте также сложно заметить, поскольку у ребенка обычно отсутствуют жалобы либо он не может описать свое состояние. Родители замечают, что дети становятся вялыми, у них резко меняется настроение, пропадает желание играть и учиться. Некоторые школьников беспокоит дискомфорт в груди слева, головокружение и головные боли.
Наиболее яркая клиническая картина синусовой тахикардии встречается у пациентов пубертатного возраста, особенно у девочек, которые отличаются эмоциональной лабильностью. Подростки жалуются на дискомфорт в грудной клетке слева и чувство ускоренного сердцебиения, неприятное ощущение биения в ушах, резко появившуюся головную боль. Наблюдается слабость, учащается дыхание, кожа краснеет или бледнеет и покрывается потом.
Осложнения
При внезапно начавшемся приступе синусовой тахикардии нарушается кровоснабжение головного мозга, что проявляется предобморочными состояниями и потерей сознания. Изменения гемодинамики негативно сказываются на реологических свойствах крови, поэтому у ребенка существует риск тромбообразования и вероятность летального исхода вследствие педиатрического инсульта.
Самое распространенное последствие запущенной синусовой тахикардии — сердечная недостаточность. Миокард теряет способность к эффективным сокращениям, нарушается центральная и периферическая гемодинамика, нарастают одышка, отеки и другие типичные симптомы. Длительное существование СН чревато отставанием ребенка в физическом и нервно-психическом развитии, а в некоторых случаях происходит инвалидизация.
Диагностика
Признаки синусовой тахикардии у ребенка неспецифичны, поэтому поставить диагноз без осмотра и специальных методов затруднительно. При физикальном обследовании (перкуссии и аускультации прекардиальной области) обращают внимание на расширение границ органа и шумы, которые сигнализируют об органической кардиоваскулярной патологии. Затем назначаются инструментальные и лабораторные исследования:
- ЭКГ. Основные электрокардиографические симптомы синусовой тахикардии — заостренный и укороченный зубец Р, уменьшение интервалов PQ и QT, снижение амплитуды зубца Т. Реже выявляют отсутствие интервала ТР и смещение сегмента ST ниже изолинии. Чтобы определить приступообразные нарушения ритма, используют суточное мониторирование ЭКГ.
- УЗИ сердца. Эхокардиография рекомендована для оценки сократительной способности миокарда, измерения сердечного выброса. По этим результатам врач диагностирует осложнения нарушенного сердечного ритма. Эхокардиография информативна для диагностики воспалительных болезней и сердечных пороков, которые зачастую выступают причиной синусовой тахикардии.
- КТ сердца. Высокоинформативный и безопасный метод заменяет традиционную коронарографию, поскольку он показывает не только состояние органа, но и венечных артерий. Врач прибегает к КТ в сложных диагностических случаях, когда другие неизвазивные исследования не дают достоверной информации.
- Лабораторные методы. При биохимическом исследовании крови измеряют уровень глюкозы и электролитов. Для исключения воспалительных процессов применяется гемограмма. При подозрении на семейную форму кардиоваскулярных заболеваний проводится генетическое обследование.
Лечение синусовой тахикардии у детей
Консервативная терапия
Перед назначением лечения важно четко отдифференцировать физиологическую и патологическую форму синусовой тахикардии. В первом случае медикаменты не используются. Если состояние не сопровождается резким ухудшением самочувствия, нет поводов для беспокойства. Чтобы предотвратить повторные приступы, врач рекомендует избегать стрессовых факторов, нормализовать режим дня и питания.
Купирование выраженной синусовой тахикардии начинают с немедикаментозных вагусных проб — переворот вниз головой на 1-2 минуты, прикладывание холода к лицу, надавливание на корень языка. Действия активизируют парасимпатическую нервную регуляцию и замедляют частоту сердечных сокращений у ребенка. Они наиболее эффективны в первые полчаса после появлений симптомов синусовой тахикардии.
Лечение аритмии состоит из трех направлений. Основное из них — рациональный подбор антиаритмических лекарственных средств, которые в остром периоде вводят парентерально, а затем переходят на пероральный прием медикаментов. Второе направление — прием кардиометаболических препаратов, которые улучшают окислительно-восстановительные и трофические процессы. Третье направление — медикаментозная нормализация вегетативной регуляции.
Антиаритмическая терапия продолжается от 3 месяцев до полугода и отменяется постепенно при условии нормализации ритма и отсутствия у ребенка клинических признаков. Противорецидивное лечение у детей грудного возраста проводится сроком до года и включает нейрометаболические препараты (производные пиридоксина, синтетические аналоги и производные ГАМК). Детский кардиолог обеспечивает динамическое наблюдение за пациентом минимум 3 года.
Хирургическое лечение
Интервенционная терапия синусовых тахикардий показана при неэффективности консервативных методов и наличии выраженных клинических симптомов. Операции проводятся детям старше 1 года. У младенцев интервенционные методы используются только при развитии аритмогенной дисфункции миокарда. Если синусовая тахикардия обусловлена врожденным сердечным пороком, рекомендована его плановая кардиохирургическая коррекция.
Прогноз и профилактика
1. Нарушения сердечного ритма у детей и подростков/ М.Л. Столина, М.Г. Шегеда, Э.Ю. Катенкова// ТМЖ. – 2019.
2. Тахикардии у детей первого года жизни/ М.А. Школьникова, Л.А. Кравцова, В.В. Березницкая// Детская кардиология и ревматология. – 2012.
3. Эпидемиология, особенности клинического течения и общие принципы медикаментозной терапии тахиаритмий у детей раннего возраста/ М.А. Школьникова, Л.А. Кравцова, М.С. Харлан// Анналы аритмологии. – 2011.
4. Тахикардия как одна из актуальных проблем детской кардиологии/ Н.В. Нагорная, А.А. Мустафина// Здоровье ребенка. – 2007.
Читайте также:

