Смеси вирусов и бактерии
Обновлено: 17.04.2024
Кем приходятся друг другу представителя микромира – вирусы и бактерии? Можно ли считать их врагами, друзьями, кровными родственниками или партнерами? Разберемся в их взаимодействии и роли в человеческом организме.
Чаще всего человек знакомится с вирусами и бактериями в сезон простуд. Острые респираторные инфекции – одни из самых распространенных заболеваний в мире. Большая часть таких болезней возникает из-за вирусов и бактерий, попадающих в организм человека вместе с вдыхаемым воздухом и оседающих на слизистых оболочках носа или рта 1 .
Для понимания процесса заражения можно привести аналогию с любым публичными заведением, которое в нашем случае является организмом человека. Через открытые двери в заведение попадают различные гости – вирусы и бактерии. Некоторые бактерии являются интеллигентной публикой и вреда не приносят, а некоторым вход категорически запрещен: они могут спровоцировать настоящий конфликт. Что касается вирусов – это, по большей части, бандиты. Не стоит ждать от них ничего хорошего.
Так в чем заключается основная разница между ними? Для начала нужно четко понять, что они представляют собой, а уже на основании этого определить разницу и принцип воздействия на организм.
Что такое вирусы
Вирус – это мельчайший организм, который способен существовать и размножаться только внутри живых клеток. Во внешней среде вирус находится в микрочастицах биологического материала, но размножается исключительно в клетках живых существ. Другими словами, вирус не активен до тех пор, пока не окажется внутри человека 2 .
А попадает он туда следующим образом:
- Воздушно-капельным путем, как и большинство респираторных инфекций
- При употреблении грязной воды, с пищей, при несоблюдении правил гигиены
- От матери к будущему ребенку
- Контактным – при тесном контакте через кожу или слизистые оболочки
- Парентеральным способом – минуя желудочно-кишечный тракт, посредством инъекций
После попадания в организм вирус вначале прикрепляется к клетке, затем доставляет в нее свой биологический геном, теряет оболочку и только потом размножается. После размножения вирус покидает клетку, а инфекционный агент распространяется вместе с кровью, продолжая тотальное заражение. Вирусы могут подавлять иммунную систему 2 .
Что такое бактерии
Бактерия представляет собой полноценный, пусть и одноклеточный организм. Она умеет размножаться благодаря делению, чем активно и занимается в природе или внутри человека 3 .
Далеко не все бактерии вызывают инфекционные заболевания. Некоторые приносят пользу и живут в органах тела. Например, молочнокислые или бифидобактерии, которые обитают в кишечнике и желудочном тракте, активно участвуют в процессе жизнедеятельности человека и фактически составляют часть его иммунной защиты 3 .
Попадание бактерий в организм повторяет пути вирусов. Но размножение бактерий осуществляется чаще вне клетки, чем внутри нее. Список болезней, которые развиваются в результате их проникновения в тело человека, чрезвычайно велик. Бактерии могут вызывать 3 :
- Респираторные болезни (чаще всего их вызывают стафилококки и стрептококки)
- Инфекции ЖКТ (провоцируются кишечной палочкой и энтерококками)
- Поражения нервной системы (бывают вызваны менингококками)
- Ряд заболеваний репродуктивной системы и др.
Размножаясь, они распространяются по кровяному руслу, что приводит к генерализации инфекции и клиническому утяжелению состояния больного. Бактерии также в состоянии подавлять иммунную систему, из-за чего организму становится тяжелее противостоять вирусам 3 .
Чем отличается вирус от бактерии
Таким образом, и вирусы, и бактерии способны поражать организм, вызывая инфекционное заражение. Ключевая разница между ними – в механизме размножения. Вирусы не могут размножаться во внешней среде, поэтому им необходимо внедриться в клетку. Бактерии размножаются делением и могут жить во внешней среде длительное время, дожидаясь попадания в организм человека. Соответственно, механизмы для противобактериальной и противовирусной защиты также должны различаться 4 .
Подведем краткие итоги. Отличия вируса от бактерии таковы 4 :
- Размер и форма существования. Вирус – простейшая жизненная форма, бактерия – одноклеточное живое существо.
- Жизнедеятельность. Вирус существует только внутри клетки и заражает её, после чего происходит размножение (клонирование). Бактерия живет полноценной жизнью, размножаясь делением, а организм для неё – лишь благоприятное место существования.
- Форма проявления. Вирусам свойственно проявлять себя повышением температуры тела, общей слабостью, мышечными и суставными болями. Бактерии проявляют себя нездоровыми выделениями (гнойные или как специфический налет).
Типичные вирусные заболевания: ОРВИ, грипп, герпес, корь и краснуха. Также к ним относятся энцефалит, гепатиты, оспа, ВИЧ и др.
Типичные бактериальные заболевания: сифилис, коклюш, холера, туберкулез, дифтерия, брюшной тиф и кишечные инфекции, ИППП.
Бывает, что и те, и другие вызывают одно заболевание совместно. Подобный симбиоз требует особого лечения. Примером могут служить: синусит, тонзиллит, менингит, пневмония и другие заболевания 5 .
Борьба с вирусами и бактериями
Иммуномодулятор ИРС®19 станет помощником на пути к здоровому и крепкому иммунитету. В его составе заключена смесь лизатов бактерий, которые представляют собой специально выделенные части бактерий-вредителей. Лизаты активируют иммунную систему и направляют ее на борьбу с бактериями и вирусами. Препарат обладает высоким уровнем безопасности и может назначаться для профилактики инфекций у взрослых и детей старше 3-х месяцев. Он был многократно протестирован и показал отличные результаты в борьбе с инфекциями, в т.ч с ОРВИ 6 .
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Везде, где есть жизнь, есть вирусы. Водная среда, занимающая бóльшую часть нашей планеты, в которой сосуществует огромное число различных организмов, создает прекрасные условия и для жизни вирусов. В водных экосистемах вирусы атакуют все живые организмы – от бактерий до китов. Оставим за рамками рассмотрения вирусы крупных организмов и останемся в микромире – в мире микроскопических организмов, которые являются основой пищевых цепей и, как выясняется, многих глобальных процессов
Первая информация о количестве вирусных частиц в водных экосистемах, потрясшая исследователей, была получена в 1989 г. (Bergh et al., 1989). Материал из проб морской воды был осажден центрифугированием прямо на сеточки с пленкой-подложкой и исследован в трансмиссионном (просвечивающем) электронном микроскопе. В одном миллилитре оказалось до 2,5 × 10 8 вирусных частиц, представленных в основном фагами с характерной морфологией (капсид-отросток, или голова-хвост), что в 10 3 —10 7 раз превышало концентрацию фагов, определенную путем традиционного высева проб на бактериальный газон (метод бляшек). Разница на порядки объясняется тем, что не все бактерии культивируются, и не все вирусы-фаги инфицируют именно бактерии.
Бактериофаги в глобальном круговороте
Во-первых, удаление из экосистемы части бактерий, уничтоженной фагами, уменьшает интенсивность перевода нерастворимого (взвешенного в водной толще и осаждающегося на дно) биогенного вещества (различных частиц, отмерших организмов и др.) – в растворенное (расщепленное, гидролизованное). Таким образом фаги нарушают классическую пищевую цепь. Этот процесс был назван вирусным шунтом (Wilheln, Suttle 1999). По оценкам авторов, через этот шунт может проходить до четверти первичной продукции углерода океана.
Количественная мультитрофическая модель, созданная авторским коллективом океанологов и математиков описывает влияние морских вирусов на микробиальные пищевые сети и процессы, проходящие в экосистемах. Согласно этой модели водные экосистемы, содержащие вирусы, будут иметь усиленный круговорот органического вещества, уменьшенный перенос этого вещества на более высокие трофические уровни и увеличенную валовую первичную продуктивность (Weitz et al., 2014). Авторы модели считают, что в оценках круговорота углерода и азота необходимо учитывать роль вирусов, так как они являются важной составляющей пищевых сетей и регулируют глобальные биогеохимические циклы.
Цианофаги – особый случай?
Цианобактерии (синезеленые водоросли), хотя и относятся к домену Bacteria, благодаря способности к фотосинтезу играют иную нежели гетеротрофные бактерии роль в водных экосистемах. Это одни из самых древних организмов. Они доминировали на ранних стадиях эволюции биосферы Земли и определяли биогеохимические циклы. Их бурное развитие вызвало изменение атмосферы, обогатило ее кислородом, что сделало возможным появление других организмов и направило эволюцию биосферы нашей планеты. Можно предположить, что цианофагов тогда еще не было.
Вирус морской диатомеи Chaetoceros debilis CdebDNAV – сохраняет инфекционность при широком диапазоне температур (от 20°С до -196°С) без добавления криопротекторов (Nagasaki, 2008).
Вирусы токсичной красной водоросли Heterosigma akashiwo сохраняют литическую активность в донных отложениях (Lawrence, 2002).
Цианофаги могут сохраняться в осадках до 100 лет (Suttle, 2000).
Гигантский вирус амеб Pithovirus sibericum – выделен из вечной мерзлоты возрастом 30 тыс. лет (Legendre et al., 2014)
И сегодня среди цианобактерий есть экстремофилы – виды, прекрасно существующие в горячих источниках, жарких пустынях, а также арктических и антарктических условиях. Если у таких видов есть цианофаги, то насколько они, эти цианофаги, уникальны?
За разнообразием – на Байкал!
В настоящее время согласно Международной классификации и таксономии вирусов (ICTV) бактериофаги, в зависимости от типа нуклеиновой кислоты разделяют на ДНК- и РНК-содержащие, которые, в свою очередь, разделяются на семейства по морфологическим признакам.
Исторически исследования водных бактериофагов связаны со сточными водами, где обнаруживаются колифаги, – бактериофаги кишечной палочки. Но на самом деле задача гораздо шире – обнаружить разнообразные фаги, поражающие другие бактерии, а не только Escherichia coli, или новые неизвестные фаги с возможными новыми свойствами. Практически одновременно с введением понятия вириопланктона в морской среде, были начаты исследования бактериофагов в воде озера Байкал. Сначала были выявлены фаги, поражающие присутствующую в воде кишечную палочку (Дрюккер, Масленников, 1998), а с 2002 г. для определения морфологии бактериофагов стали использовать трансмиссионную электронную микроскопию.
В Байкале за рекордно долгий для пресноводных водоемов период существования, несмотря на климатические катаклизмы (а, может, и благодаря им) сформировалась уникальная биота, с большим видовым богатством и высоким уровнем эндемизма практически во всех группах организмов. Как оказалось, из десяти известных семейств ДНК-содержащих бактериофагов в Байкале обитают морфологически разнообразные представители девяти из них (Myoviridae, Podoviridae, Siphoviridae, Fuselloviridae, Inoviridae, Microviridae, Tectiviridae, Leviviridae, Rudiviridae). Кроме того, обнаружено и несколько морфотипов неизвестного систематического положения (Дрюккер, Дутова, 2006, 2009). Таким образом, огромное биоразнообразие, характерное для флоры и фауны озера Байкал, распространяется и на фаги
Вирусы древнейших
Ферменты архей применяются в пищевой промышленности, так как могут работать при высоких температурах, а ДНК-полимераза археи Pyrococcus furiosus используется в ПЦР (полимеразной цепной реакции). Сами археи являются компонентом очистных сооружений, обеспечивая анаэробное разложение сточных вод; используются при обогащении руд ценных металлов. Ясно, что в промышленном производстве лизис архей вирусами – большая неприятность.
Структурные исследования вирусных капсидов показали, что бесхвостые икосаэдры, инфицирующие архей, бактерий и эукариот, имеют общего предка (Abrescia et al., 2012). Например, структурные сходства имеют белки оболочки нитчатых вирусов табачной мозаики, двух вирусов архей из рода Acidianus и вируса гепатита B. Несмотря на низкую гомологию аминокислотных последовательностей, белки вирусов архей могут иметь сходные элементы третичной структуры с вирусами других доменов (Dallas et al., 2014). А совсем недавно был описан нитевидный вирус гипертермофильной археи Pyrobaculum, который имеет уникальную среди ДНК-содержащих нитевидных вирусов структуру вириона. Его линейный геном заключен в трехслойный панцирь, состоящий из двух белковых слоев и дополнительной наружной оболочки. Вирион организован в виде суперспирали подобно вирусам Эбола и Марбург, но они являются РНК-содержащими (Rensen et al., 2016).
Каждую секунду в океане происходит 10 23 вирусных инфекций. Каждая инфекция имеет возможность для введения новой генетической информации в организм и в вирусное потомство, способствуя таким образом эволюции как сообществ хозяина, так и вирусов (Suttle, 2007). И хотя важность водных вирусов уже стала очевидной, на многие вопросы наука пока ответить не может.
Bergh Ø, Borsheim KY, Bratbak G, Heldal M. Abundance of viruses found in aquatic environments // Nature. 1989. V. 340. P. 467—468.
Hug L. A., Baker B. J., Anantharaman K. et al. A new view of the tree of life //Nature Microbiol. 2016. 11 Apr. N. 16048. DOI 110.1038.
Pietilä M. K., Demina T. A., Atanasova N. S., Oksanen H. M., Bamford D. H. Archaeal viruses and bacteriophages: comparisons and contrasts // Trends in Microbiology. 2014. V. 2. N. 6. P. 334—344.
Prangishvili D. The wonderful world of archaeal viruses // Annu. Rev. Microbiol. 2013. V. 67. P. 565–85.
Suttle C. A. Viruses in the sea // Nature. 2005. V. 437. P. 356—361.
Дрюккер В. В., Дутова Н. В. Бактериофаги как новое трофическое звено в экосистеме глубоководного озера Байкал // Докл. РАН. 2009. Т. 427, № 2. С. 277—281.
Автор благодарит Г. И. Филиппову (ЛИН СО РАН, Иркутск) за помощь в подготовке публикации
Вирус гепатита С – один из наиболее опасных вирусов человека, передающихся через кровь: по данным ВОЗ число носителей этой хронической инфекции в мире составляет не менее 170 млн человек! Поэтому производство лечебных препаратов из плазмы крови требует разработки специальных подходов, обеспечивающих надежный уровень вирусной безопасности. Одним из главных методических затруднений на этом пути служит отсутствие удобной биологической модельной системы, позволяющей количественно оценивать жизнеспособные вирусные частицы.
Вирус гепатита С является потенциальным биологическим контаминантом (загрязняющим агентом) продуктов крови, в том числе препаратов иммуноглобулинов, использующихся для лечения и профилактики опасных вирусных болезней. Одной из главных причин, затрудняющих поиск эффективных вирусинактивирующих реагентов против этого вируса при производстве лечебных средств, является отсутствие удобной модельной биосистемы для размножения возбудителя, которая позволяла бы количественно регистрировать жизнеспособные полноценные вирусные частицы.
Вирусная модель
Известно, что в качестве моделей опасных для человека вирусов в некоторых случаях используют родственные им вирусы животных. Ближайшим родственником возбудителя гепатита С является вирус диареи крупного рогатого скота (ВД КРС). Оба этих вируса относятся к одному семейству Flaviviridae и имеют очень близкое молекулярно-генетическое родство (Buckwold, 2003).
Вирус диареи крупного рогатого скота – представитель семейства Flaviviridae рода Pestivirus; ближайшй родственник вируса гепатита С. В качестве наследственного материала содержит РНК. Вирионы имеют размер 30–50 нм. Характеризуется тропизмом преимущественно к лимфоидной ткани
Вирус диареи крупного рогатого скота причиняет значительный ущерб животноводству. Он является мощным иммуносупрессором, на фоне которого активизируются другие инфекционные агенты; кроме того, вирус отрицательно влияет на репродуктивную систему коров, приводя к абортам, врожденным уродствам плода и гибели новорожденных телят. Искоренение ¬болезни требует огромных экономических вложений.
Но значимость этого инфекционного агента не исчерпывается ветеринарией. Как известно, для культивирования различных вирусов в медицинских целях используют клетки человека и животных, которые выращивают в питательной среде с добавлением в качестве основного ростового компонента эмбриональной сыворотки крови крупного рогатого скота. И эта сыворотка почти в 90—100 % случаев контаминирована нецитопатогенным (т. е. не убивающим клетки) вирусом диареи (Vilcek, 2001). Таким образом, этот вирус, как и вирус гепатита С, может загрязнять биологическую продукцию, выпускаемую для нужд медицины и ветеринарии.
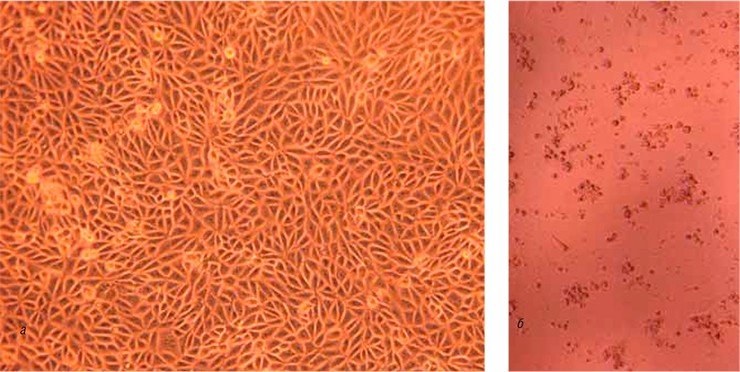
Использование вируса крупного рогатого скота в качестве модели вируса гепатита С при отработке технологии инактивации вирусов в препаратах иммуноглобулинов имеет ряд преимуществ. К ним относятся наличие у него цитопатогенных штаммов, способность размножаться в культурах клеток в высоких концентрациях, экономичность подобных экспериментов, а также возможность проведения экспериментальных исследований на животных.
В результате был определен оптимальный режим инактивации, обеспечивающий необходимое снижение активных инфекционных частиц вируса в двух временных контрольных точках процесса (через 1 ч и через 5 сут.). Оказалось, что для инактивации вируса оптимальным является время инкубации, равное 1—2 сут. Данный режим обеспечил высокую воспроизводимость результатов в опытах с тремя сериями иммуноглобулинов.
Исследователи надеются, что дальнейшее изучение эффективности метода инактивации вирусов при низких значениях pH (в кислой среде) позволит решить одну из актуальных задач производства медицинских и ветеринарных препаратов, связанных с биобезопасностью продукции.
Методы по очистке биопрепаратов от загрязнения вирусом диареи крупного рогатого скота важны не только сами по себе: их можно рассматривать в качестве перспективного подхода для деконтаминации лекарственных препаратов от вируса гепатита С, представляющего непосредственную угрозу для здоровья и жизни человека.
К этому можно добавить, что на сегодняшний день нет исчерпывающей информации о безопасности действия самого вируса диареи крупного рогатого скота на организм человека. Учитывая же тот факт, что этот вирус подвержен сильной мутационной изменчивости, можно предположить, что он также может в принципе оказаться способным преодолевать межвидовые барьеры и заражать человека (Giangaspero, 1997).
Buckwold V.E., Beer B.E., Donis R.O. Bovine viral diarrhea virus as a surrogate model of hepatitis C virus for the evaluation of antiviral agents // Antiviral Res. 2003. V. 60. No. 1. P. 1—15.
Vilcek S. Identification of pestiviruses contaminating cell lines and fetal calf sera // Acta Virol. 2001. V. 45. No. 2. P. 81—86.

Обзор
Автор
Редакторы
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Читайте также:

