Стволовые клетки и вирусы
Обновлено: 25.04.2024
Инфекционные причины лейкозов - лимфома Беркитта, иммунобластная лимфома, Т-клеточный лейкоз взрослых (ТКЛВ)
В экспериментальной лейкозологии существует много видов вирусов, с помощью которых индуцируют различные формы лейкозов. Известны также вирусы, вызывающие лейкозы у разных видов животных в естественных условиях. Для этих вирусов доказаны вертикальная трансмиссия (передача от матери потомству) и значительное распространение носительства в популяциях животных без признаков заболевания.
Эндемические формы инфекционных гемобластозов
Для большинства эндемических форм гемобластозов человека с определенностью установлено участие в индукции заболевания инфекционных агентов. В отношении некоторых убиквитарных форм существуют лишь более или менее убедительные подозрения. Рабочая группа МАИР в настоящее время причисляет к доказанным этиологическим факторам (группа 1) лимфопролиферативных гемобластозов следующие инфекционные агенты: вирус Эпштейна—Барр (EBV), вирус Т-клеточной лимфомы/лейкоза взрослых (HTLV-1), вирус иммунодефицита человека ВИЧ (HIV) и бактерию Helicobacter pylori.
Носительство EBV распространено очень широко и охватывает до 90 % взрослого населения. Вирус крайне неустойчив во внешней среде, поэтому заражение возможно только при прямом контакте — воздушно-капельным путем через слюну. Возраст, в котором происходит инфицирование, зависит от социальных условий: в развитых странах до трехлетнего возраста инфицируется около 20 % детей, тогда как в развивающихся —до 70 %. EBV обладает высокой тропностью к эпителию ротоглотки, где в нормальных условиях происходит его репродукция, и к В-лимфоцитам, в которых осуществляется бессимптомное носительство в виде кольцевой ДНК (эписома).
Доля содержащих эписому В-лимфоцитов невелика и довольно постоянна — 1 клетка на 10 5 —10 6 . В продуктивной фазе вирусная ДНК в В-клетках приобретает линейную форму.
В экваториальной зоне Африки с EBV связана лимфома Беркитта (ЛБ), которая занимает первое место по распространенности среди гемобластозов у детей на территориях, расположенных до 1550 м над уровнем моря в теплом и влажном климате. Особенно часто заболевание развивается у детей 5—13 лет; в 95 % всех случаев болезнь возникает до 16 лет. У детей моложе 2 лет заболевание практически не встречается. Классическое начало ЛБ: быстро растущая опухоль челюсти или органов брюшной полости у ребенка 5—8 лет. Мальчики преобладают в соотношении (1,7—2,0):1. Неберкиттовские лимфомы в этом регионе исключительно редки.
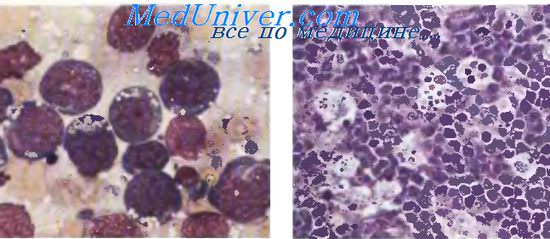
Морфология лимфомы Беркитта
Повышенное внимание к признакам лимфомы Беркитта (ЛБ) привело к тому, что это новообразование стали обнаруживать в западных странах среди НХЛ детского возраста (до 20 %). Раболеваемость в Африке значительно выше — в среднем 8 на 100 тыс. детей против 0,2 среди белого населения США.
Практически у 100 % больных лимфомой Беркитта (ЛБ) в африканских очагах в клетках опухоли выявляются включения ДНК EBV и определяются высокие титры антител к капсидным и ранним антигенам. Для здоровых детей с антителопродукцией к EBV риск ЛБ повышен в 50—60 раз. Среди спорадических случаев ЛБ носительство ДНК EBV в клетках опухоли много реже — около 30 %. В отличие от общего пула В-клеток ДНК ЕВУ содержится во всех опухолевых клетках ЛБ, причем в моноклоновой форме, что является основным подтверждением этиологической роли вируса. Известна способность EBV к трансформации клетки и индукции бесконечного деления В-лимфоцитов in vitro, тем не менее его роль в патогенезе ЛБ не вполне ясна.
Есть данные, что кофактором в развитии заболевания служит малярийный плазмодий: ареал высокого риска ЛБ совпадает, как правило, с эндемическими регионами малярии. У переселившихся в эти регионы из благополучных районов повышается вероятность возникновения обоих заболеваний. Проведение тотальной лекарственной профилактики малярии приводило к достоверному снижению заболеваемости ЛБ, а после прекращения противомалярийных мероприятий заболеваемость возвращалась на прежний уровень. Эпидемиологические наблюдения позволили построить следующую схему патогенеза ЛБ: малярийная инвазия, хроническая инфекция и, возможно, другие факторы могут служить активаторами пролиферации лимфоцитов.
Контакт с EBV вводит В-лимфоцит в бесконечный цикл деления (нечто близкое к инфекционному мононуклеозу). На следующем этапе случайная хромосомная транслокация способна вывести одну из активированных клеток из-под контроля, и она становится родоначальницей клона.
Анализ 665 случаев лимфомы Беркитта (ЛБ) из регистра Ибадана (Нигерия) показал значимое снижение относительной частоты заболеваний в период 1973—1990 гг. (37,1 % от всех опухолей у детей) по сравнению с 1960—1972 гг. (51,5 %). По всей видимости, это отражает реальное снижение заболеваемости за счет улучшения условий жизни и успешного контроля малярии.
Т-клеточный лейкоз взрослых (ТКЛВ) — заболевание, характерное для юго-восточных областей Японии (Окинава, Киуши, Шикоку), Экваториальной Африки и Карибских островов, Южной Америки и Ближнего Востока. В эндемических очагах до 20 % населения продуцируют антитела к HTLV-1 (среди населения США — 0,025 %). Наиболее распространен HTLV-1 в Африке —до 10 млн инфицированных, всего в мире их 15 — 20 млн. Трансмиссия вируса происходит вертикально (при грудном вскармливании ребенка), а также при гемотрансфузиях. Выявляемость носителей увеличивается с возрастом и достигает пика к 50 годам, причем доля женщин больше. Один случай ТКЛВ в год возникает среди приблизительно 1500 носителей HTLV-1.
В итоге заболевание развивается у 1—4 % носителей через 20— 30 лет после заражения, причем более 90 % заболевших серопозитивны к HTLV-1. Максимальное число заболевших регистрируется в Японии в возрасте около 60 лет, а в Африке — в 40—45 лет. Случаи заболевания детей исключительно редки, частота заболеваний у мужчин и женщин примерно равная. Смертность от ТКЛВ среди инфицированных достигает у мужчин 68, а у женщин 36 на 100 тыс.; среди серонегативных лиц она много ниже. Обследованные в эндемических районах матери заболевших ТКЛВ оказались инфицированными HTLV-1 в 100 %, тогда как матери больных другими формами лимфом — в 30 % случаев.
В Африке выявлено широкое распространение родственного вируса HTLV-2, который подозревается в инициации В-клеточных лейкозов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Обзор
иллюстрация автора статьи
Автор
Редакторы

Смертельные клешни
Человечество столкнулось с этой загадочной болезнью еще до нашей эры. Ее пытались понять и лечить ученые мужи в самых различных уголках мира: в Древнем Египте — Еберс, в Индии — Сушрута, Греции — Гиппократ. Все они и многие другие медики вели борьбу с опасным и серьезным противником — раком. И хоть эта битва продолжается до сих пор, сложно определить, есть ли шансы на полную и окончательную победу. Ведь чем больше мы изучаем болезнь, тем чаще возникают вопросы — можно ли полностью излечить рак? Как избежать болезни? Можно ли сделать лечение быстрым, доступным и недорогим?
Мутации: погибнуть или жить вечно?

Рисунок 1. Генетическая модель рака: рак толстой кишки. Первый шаг — потеря или инактивация двух аллелей гена АРS на пятой хромосоме. В случае семейного рака (familiar adenomatous polyposis, FAP) одна мутация гена АРС наследуется. Потеря обоих аллелей ведет к образованию доброкачественных аденом. Последующие мутации генов на 12, 17, 18 хромосомах доброкачественной аденомы могут привести к трансформации в злокачественную опухоль.
Очевидно, что развитие определенных видов рака включают в себя изменение большинства или даже всех этих генов и может проходить различными путями. Из этого следует, что каждую опухоль следует рассматривать как биологически уникальный объект. На сегодняшний день существуют специальные генетические информационные базы по раку, содержащих данные о 1,2 млн. мутаций из 8207 образцов тканей, относящихся к 20 видам опухолей: атлас Ракового Генома (Cancer Genome Atlas) и каталог соматических мутаций при раке (Catalogue of Somatic Mutations in Cancer, COSMIC) [2].

Рисунок 2. Распространение метастазов
Однако клетки вооружены специальными механизмами, защищающими от развития опухолей:
-
— механизм эпигенетических модификаций, который контролирует нормальный рост и правильное развитие организма. Любые нарушения в метилировании определенных генов могут поспособствовать возникновению рака. Например, в исследованиях было обнаружено, что потеря импринтинга после инактивации материнского аллеля гена IgF2 увеличивает риск развития рака прямой кишки в 3–5 раз [3]; (например, однонуклеотидная эксцизионная репарация защищает ДНК от мутаций, вызванных канцерогенными агентами) [4]; — используют специфичные белки-мессенжеры, такие как ATM, ATR и комплекс RAD17-RFC для поиска повреждений в молекулах ДНК. Сигнальные белки активируют р53 и инактивируют циклин-зависимые киназы, что, в свою очередь, ингибирует клеточный цикл от G1 до S (G1/S точка рестрикции), репликацию ДНК в S-фазе и G2-фазу (G2/M-точка рестрикции) [5];
- программируемая клеточная смерть — апоптоз и связанные регуляторные гены имеют огромное влияние на возникновение злокачественного фенотипа. Некоторые онкогенные мутации нарушают апоптоз, что приводит к инициации канцерогенеза и метастазирования [6];
- иммунная система — активация естественных киллеров (NK — natural killer cells), макрофагов, нейтрофилов, эозинофилов и специфических Т-цитотоксических клеток; синтез цитокинов и специфических антител [7].
Традиционные методы и их недостатки
- хирургическая (полное удаление опухоли). Используется, когда опухоль имеет небольшие размеры и хорошо локализована. Также удаляют часть тканей, которые контактируют со злокачественным новообразованием. Метод не применяется при наличии метастазов;
- лучевая — облучение опухоли радиоактивными частицами для остановки и предотвращения деления раковых клеток. Здоровые клетки тоже чувствительны к этому излучению и часто погибают;
- химиотерапия — используются лекарства, тормозящие рост быстро делящихся клеток. Лекарства оказывают негативное воздействие и на нормальные клетки.
Вышеописанные подходы не всегда могут избавить больного от рака. Часто при хирургическом лечении остаются единичные раковые клетки, и опухоль может дать рецидив, а при химиотерапии и лучевой терапии возникают побочные эффекты (снижение иммунитета, анемия, выпадение волос и др.), которые приводят к серьезным последствиям, а часто и к смерти пациента. Тем не менее, с каждым годом улучшаются традиционные и появляются новые методы лечения, которые могут победить рак, такие как биологическая терапия, гормональная терапия, использование стволовых клеток, трансплантация костного мозга, а также различные поддерживающие терапии. Наиболее перспективной считается генная терапия, так как она направлена на первопричину рака — компенсацию неправильной работы определенных генов.
Генная терапия как перспектива
По данным PubMed, интерес к генной терапии (ГТ) раковых заболеваний стремительно растет, и на сегодняшний день ГТ объединяет ряд методик, которые оперируют с раковыми клетками и в организме (in vivo) и вне его (ex vivo) (рис. 3).

Рисунок 3. Две основные стратегии генной терапии. ex vivo — генетический материал с помощью векторов переносится в клетки, выращиваемые в культуре (трансдукция), а затем трансгенные клетки вводят реципиенту; in vivo — введение вектора с нужным геном в определенную ткань или орган.
Вирусные векторы
В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса и другие. Эти вирусы отличаются по эффективности трансдукции, по взаимодействию с клетками (распознавание и заражение) и ДНК. Главным критерием является безопасность и отсутствие риска неконтролируемого распространения вирусной ДНК: если гены вставляются в неправильном месте генома человека, они могут создать вредные мутации и инициировать развитие опухоли. Также важно учитывать уровень экспрессии перенесенных генов, чтобы предотвратить воспалительные или иммунные реакции организма при гиперсинтезе целевых белков (табл. 1).
| Вектор | Краткое описание |
|---|---|
| Вирус кори (measles virus) | содержит отрицательную последовательность РНК, которая не вызывает защитного ответа в раковых клетках |
| Вирус простого герпеса (HSV-1) | может переносить длинные последовательности трансгенов |
| Лентивирус | производный от ВИЧ, может интегрировать гены в неделящиеся клетки |
| Ретровирус (RCR) | не способный к самостоятельной репликации, обеспечивает эффективное встраивание чужеродной ДНК в геном и постоянство генетических изменений |
| Обезьяний пенистый вирус (SFV) | новый РНК-вектор, который передает трансген в опухоль и стимулирует его экспрессию |
| Рекомбинантный аденовирус (rAdv) | обеспечивает эффективную трансфекцию, но возможна сильная иммунная реакция |
| Рекомбинантный аденоассоциированный вирус (rAAV) | способен к трансфекции многих типов клеток |
Невирусные векторы
Синтетические катионные липосомы в настоящее время признаны перспективным способом доставки функциональных генов. Положительный заряд на поверхности частиц обеспечивает слияние с отрицательно заряженными клеточными мембранами. Катионные липосомы нейтрализуют отрицательный заряд цепи ДНК, делают более компактной ее пространственную структуру и способствуют эффективной конденсации. Плазмидно-липосомный комплекс имеет ряд важных достоинств: могут вмещать генетические конструкции практически неограниченных размеров, отсутствует риск репликации или рекомбинации, практически не вызывает иммунного ответа в организме хозяина. Недостаток этой системы состоит в низкой продолжительности терапевтического эффекта, а при повторном введении могут появляться побочные эффекты [12].
Электропорация является популярным методом невирусной доставки ДНК, довольно простым и не вызывающим иммунного ответа. С помощью индуцированных электрических импульсов на поверхности клеток образуются поры, и плазмидные ДНК легко проникают во внутриклеточное пространство [13]. Генная терапия іn vivo с использованием электропорации доказала свою эффективность в ряде экспериментов на мышиных опухолях. При этом можно переносить любые гены, например, гены цитокинов (IL-12) и цитотоксические гены (TRAIL), что способствует развитию широкого спектра терапевтических стратегий. Кроме того, этот подход может быть эффективным для лечения и метастатических, и первичных опухолей [14].
Выбор техники
В зависимости от типа опухоли и ее прогрессии, для пациента подбирается наиболее эффективная методика лечения. На сегодняшний день разработаны новые перспективные техники генной терапии против рака, среди которых онколитическая вирусная ГТ, пролекарственная ГТ (prodrug therapy), иммунотерапия, ГТ с использованием стволовых клеток.
Онколитическая вирусная генная терапия
Для этой методики используются вирусы, которые с помощью специальных генетических манипуляций становятся онколитическими — перестают размножаться в здоровых клетках и воздействуют только на опухолевые. Хорошим примером такой терапии является ONYX-015 — модифицированный аденовирус, который не экспрессирует белок Е1В. При отсутствии этого белка вирус не может реплицироваться в клетках с нормальным геном p53 [15]. Два вектора, сконструированных на базе вируса простого герпеса (HSV-1) — G207 и NV1020 — также несут в себе мутации нескольких генов, чтобы реплицироваться только в раковых клетках [16]. Большим преимуществом техники является то, что при проведении внутривенных инъекций онколитические вирусы разносятся с кровью по всему организму и могут бороться с метастазами. Основные проблемы, которые возникают при работе с вирусами — это возможный риск возникновения иммунного ответа в организме реципиента, а также неконтролируемое встраивание генетических конструкций в геном здоровых клеток, и, как следствие, возникновение раковой опухоли.
Геноопосредованная ферментативная пролекарственная терапия
Минус терапии состоит в том, что в опухолях присутствуют все защитные механизмы, свойственные здоровым клеткам, и они постепенно адаптируются к повреждающим факторам и пролекарству. Процессу адаптации способствует экспрессия цитокинов (аутокринная регуляция), факторов регуляции клеточного цикла (отбор самых стойких раковых клонов), MDR-гена (отвечает за восприимчивость к некоторым медикаментам).
Иммунотерапия
Благодаря генной терапии, в последнее время начала активно развиваться иммунотерапия — новый подход для лечения рака с помощью противоопухолевых вакцин. Основная стратегия метода — активная иммунизация организма против раковых антигенов (ТАА) с помощью технологии переноса генов [18].
Главным отличием рекомбинантных вакцин от других препаратов является то, что они помогают иммунной системе пациента распознавать раковые клетки и уничтожать их. На первом этапе раковые клетки получают из организма реципиента (аутологичные клетки) или из специальных клеточных линий (аллогенные клетки), а затем выращивают их в пробирке. Для того чтобы эти клетки могли узнаваться иммунной системой, вводят один или несколько генов, которые производят иммуностимулирующие молекулы (цитокины) или белки с повышенным количеством антигенов. После этих модификаций клетки продолжают культивировать, затем проводят лизис и получают готовую вакцину.
Когда было доказано, что большинство видов рака имеют специфические антигены и способны индуцировать свои защитные механизмы [22], была выдвинута гипотеза, что блокировка иммунной системы раковых клеток облегчит отторжение опухоли. Поэтому для производства большинства противоопухолевых вакцин в качестве источника антигенов используют опухолевые клетки пациента или специальные аллогенные клетки. Основные проблемы иммунотерапии опухолей — вероятность возникновения аутоиммунных реакций в организме больного, отсутствие противоопухолевого ответа, иммуностимуляция роста опухоли и другие.
Стволовые клетки
Заключение
Если подвести итоги, можно с уверенностью говорить, что наступает эпоха персонализированной медицины, когда для лечения каждого онкобольного будет подбираться определенная эффективная терапия. Уже разрабатываются индивидуальные программы лечения, которые обеспечивают своевременный и правильный уход и приводят к значительному улучшению состояния пациентов. Эволюционные подходы для персонализированной онкологии, такие как геномный анализ, производство таргетных препаратов, генная терапия рака и молекулярная диагностика с использованием биомаркеров уже приносят свои плоды [17].
Инфекционные осложнения трансплантации гемопоэтических стволовых клеток (ТГСК)
При трансплантации гемопоэтических стволовых клеток крови развивается тяжелое иммунодефицитное состояние, продолжительность и степень выраженности которого зависят от вида трансплантации гемопоэтических стволовых клеток крови (аутологичная, аллогенная), режима кондиционирования, совместимости по HLA-системе донора и реципиента, протокола профилактики острой РТПХ.
Вероятность возникновения инфекционных осложнений увеличивается при продолжительном периоде гранулоцитопении на ранних этапах после трансплантации гемопоэтических стволовых клеток крови и лимфопении в позднем периоде, а также при тяжелой степени клинических проявлений острой или хронический РТПХ.
Продолжительное состояние иммунодефицита у больных после трансплантации гемопоэтических стволовых клеток крови увеличивает вероятность развития инфекционных осложнений бактериальной, вирусной, протозойной и грибковой этиологии, которые возникают на любом этапе после трансплантации гемопоэтических стволовых клеток крови (сепсис, пневмония, инфекции урогенитальной системы, желудочно-кишечного тракта, ЦНС и др.).
Течение инфекционных осложнений имеет свои особенности в зависимости от периода после трансплантации гемопоэтических стволовых клеток крови: до появления признаков приживления трансплантата, в раннем периоде (до 100 дней) и позднем периоде (после 100 дней) после трансплантации гемопоэтических стволовых клеток крови.
Дифференциальную диагностику проводят на основании динамики изменения показателей крови и регулярного тестирования всех биологических жидкостей реципиента (кровь, моча, стул, слюна) на наличие признаков инфекции.
Риск возникновения инфекции в раннем периоде после трансплантации гемопоэтических стволовых клеток крови увеличен при развитии мукозитов различной степени тяжести после назначения режима кондиционирования вследствие имеющейся колонизации бактериями желудочно-кишечного тракта, а также при наличии локальной грибковой или вирусной инфекций, возможной реактивации у больного латентной инфекции, постановки центрального катетера. Однократное повышение температуры тела более 38,3 °С, неоднократное повышение в течение 24 ч или температура 38 °С в течение одного часа является показанием к эмпирическому назначению антибактериальной терапии.
Как правило, для профилактики инфекционных осложнений перед началом режима кондиционирования и до момента восстановления содержания гранулоцитов (более 0,5 • 10 9 /л) в крови больным производят специальную обработку (деконтамина-цию) кишечника назначением внутрь неабсорби-руемых антибиотиков: гентамицин в дозе 40— 80 мг/сут либо фторхинолоны: ципрофлоксацин в дозе 10 мг/кг в сутки, метронидазол по 20—30 мг/кг в сутки. С момента приживления трансплантата присоединяют противовирусные препараты: ацик-ловир в дозе 250 мг/м2; для профилактики протозойной инфекции, вызванной Pneumocystis cari-nii, — бисептол по 5 мг/кг в сутки (по триметоприму) 3 раза в неделю.
Основные осложнения миелотрансплантации
| Ранние (менее 100 дней) | Поздние (после 100 дней) |
| 1. Инфекционные. 2. Геморрагические. 3. Поражение желудочно-кишечного тракта. 4. Кардиоваскулярные. 5. Легочные. 6. Веноокклюзионная болезнь. 7. Нефрологические. 8. Острая РТПХ. 9. Отторжение (неприживление) СКК донора | 1. Инфекционные. 2. Хроническая РТПХ. 3. Последствия кондиционирования (катаракта, полигландулярная эндокринная недостаточность, обструктивные заболевания легких). 4. Рецидив основного заболевания. 5. Вторичные опухоли. 6. Задержка роста (у детей) |
При восстановленном количестве гранулоцитов их дисфункция также существует, происходит нарушение хемотаксиса и фаложнений, в том числе клиническими проявлениями асептического менингита, механизм которого неясен.
Грибковые инфекции остаются одной из основных причин смерти больных после трансплантации гемопоэтических стволовых клеток. До настоящего времени не решена задача выбора оптимального способа профилактики осложнений грибковой этиологии ввиду выраженной токсичности используемых препаратов.
Возбудителями грибковой инфекции наиболее часто являются различные виды рода Candida и Aspergillus. Вероятность возникновения аспергиллеза у больных после алло-трансплантации гемопоэтических стволовых клеток в настоящее время достигает 20 %, а количество летальных осложнений, связанных с этой инфекцией, равно 90 %.
При глубоких микозах (кандидоз, аспергиллез и т. д.) используются амфотерицин В (фунгизон, амфоцил, абельцет, липосомальная форма — амбизом), а также итраконазол, флуконазол, флюцитозин. Применение амбизома как менее токсичного из них является оптимальным.
В настоящее время получены противогрибковые средства, превышающие по эффективности и минимальному количеству токсических проявлений перечисленные препараты (каспофунгин, вориконазол), что позволяет надеяться на возможность эффективной профилактики и лечения осложнений грибковой природы у больных после трансплантации гемопоэтических стволовых клеток.
Важным способом профилактики развития грибковых осложнений, особенно аспергиллеза, является назначение больному стерилизованной пищи после трансплантации гемопоэтических стволовых клеток и помещение в специальные палаты, оснащенные установками для фильтрации воздуха (НЕРА-фильтры).
Развитие вирусных осложнений в первую очередь ассоциировано с группой вирусов герпеса (HHV6, HSV, VZV), в которую входит и цитомегаловирус (CMV). У 60—70 % больных, бывших серопозитив-ными по CMV-инфекции до трансплантации, возможна реактивация вируса на фоне глубокого иммунодефицита после любого вида ТГСК с развитием энтероколита, гепатита, ретинита, миелита, тяжелой CMV-пневмонии. Реактивация CMV-инфекции может сопровождаться миелосупрессией вплоть до полного отторжения трансплантата.
До появления эффективных противовирусных препаратов (ганцикловир, фоскарнет), иммуноглобулинов, являющихся специфическими CMV-нейтра-лизующими антителами (цитотект), смертность от CMV-инфекции при трансплантации гемопоэтических стволовых клеток составляла до 20 %.
Существенной мерой профилактики CMV-инфекции остается скрининг доноров КМ/ПСКК и доноров компонентов крови на наличие носительства CMV-инфекции и использование лейкоцитарных фильтров при переливании эритроцитной и тромбо-цитной массы.
Вирусная инфекция после трансплантации гемопоэтических стволовых клеток может быть следствием присоединения респираторно-синцити-ального вируса, риновируса, вируса параинфлюэн-цы. Особое клиническое значение имеют осложнения, связанные с аденовирусами (поражение желудочно-кишечного тракта, геморрагический цистит).
Для профилактики вирусных осложнений необходимо назначение ацикловира в профилактической дозе в течение длительного периода после трансплантации гемопоэтических стволовых клеток (6—12 мес).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Пересадка стволовых клеток при генетических болезнях. Эффективность
Стволовые клетки — самообновляющиеся клетки, которые характеризуются двумя свойствами:
1) способностью размножаться, формируя клетки различных типов тканей in vivo и
2) способностью самообновляться, формируя другие стволовые клетки.
Эмбриональные стволовые клетки, способные построить целый организм.
Использование эмбриональных стволовых клеток для лечения болезней в настоящее время — тема большой научной, этической и политической дискуссии. Тем не менее, если появится возможность дифференциации эмбриональных стволовых клеток в различные типы клеток для использования в качестве замены утраченных или поврежденных болезнью, взгляды общества на такое лечение могут измениться.
В настоящее время в клинических целях используют только два типа стволовых клеток — кроветворные, которые могут изменить кроветворную систему после пересадки костного мозга; и роговичные, используемые для регенерации эпителия роговицы. Возможность клинического использования стволовых клеток других типов в будущем огромна, поскольку их исследование — одна из наиболее активных и перспективных областей биомедицинских исследований.
Стволовые клетки обнаружены во многих различных зрелых тканях, включая, например, кожу или мозг, как у людей, так и у животных, и существует надежда, что эти клетки окажутся способными регенерировать утраченные или поврежденные клетки того типа ткани, из которой они произошли. Хотя легко преувеличить потенциал такого лечения, оптимизм в связи с будущим терапии стволовыми клетками вполне оправдан.
Пересадка кроветворных стволовых клеток при болезнях, не сопровождающихся накоплением метаболитов
Кроме применения при лечении опухолей, пересадка кроветворных стволовых клеток с использованием стволовых клеток костного мозга является также методом выбора при лечении группы моногенных нарушений иммунитета, включая тяжелые комбинированные иммунодефициты любого типа. Их роль в лечении генетической болезни вообще, тем не менее, оценивают осторожно.
Например, отличные результаты получены при пересадке костного мозга для лечения бета-талассемии у пациентов до 16 лет. Однако для каждой болезни, при которой пересадка костного мозга может приносить пользу, результаты следует оценивать в течение многих лет и сравнивать с результатами, полученными при других видах лечения.

Пересадка стволовых кроветворных клеток при лизосомных болезнях накопления
Пересадка стволовых кроветворных клеток костного мозга. Пересадка стволовых клеток костного мозга эффективна при лечении лизосомных болезней накопления во многих тканях, включая, для некоторых болезней, мозг.
Во-первых, пересаженные клетки служат источником лизосомных ферментов, способных передаваться в другие клетки через внеклеточную жидкость, что впервые показано в экспериментах по совместному культивированию клеток больных с синдромами Гурлер и Хантера.
Поскольку клетки, происходящие из костного мозга, составляют около 10% общей массы клеток тела, количественное влияние ферментов, передающихся из них, может быть значимым.
Во-вторых, система мононуклеарных фагоцитов в большинстве, если не во всех тканях, происходит из стволовых клеток костного мозга, поэтому после пересадки костного мозга эта система во всем организме становится донорского происхождения.
Пересадка костного мозга исправляет или уменьшает висцеральные нарушения при многих болезнях накопления, включая, например, болезнь Гоше. Нормализация или уменьшение в размере печени, селезенки и сердца также достигается при синдроме Гурлер, кроме того, улучшаются проходимость верхних дыхательных путей, общая подвижность и ослабление помутнения роговицы.
Полезным оказалось влияние пересадки и на неврологический компонент болезни. Пациенты, имевшие перед пересадкой хорошие показатели развития и перенесшие пересадку до 24-месячного возраста, после пересадки костного мозга продолжают интеллектуально развиваться, в отличие от неотвратимой утраты интеллектуальных функций в противном случае. Интересно, что в костном мозге донора обнаруживается эффект дозы генов; дети, получившие донорские клетки от гомозиготных нормальных доноров, с большей вероятностью сохраняют нормальный интеллект, чем реципиенты клеток гетерозиготных доноров.
Еще более радикальное влияние на неврологическую патологию при болезни накопления наблюдается после пересадки костного мозга пациентам с поздней формой глобоидноклеточной лейкодистрофии (или болезни Краббе) — дегенеративном заболевании белого вещества мозга.
Пациенты с поздним началом болезни, вызванной недостаточностью фермента галактоцереброзидазы, имеют начало клинических проявлений в возрасте от полугода до трех лет. В отсутствие лечения заболевание характеризуется неуклонной дегенерацией центрального и периферического миелина, спастичностью, деменцией и периферической нейропатией.
Реципиенты испытывали не только замедление процесса болезни, но и фактическое улучшение или нормализацию таких симптомов, как тремор, атаксия, моторная дискоординация и другие нарушения. Впечатляет, что даже структурные дефекты белого вещества в мозге пролеченных пациентов часто обратимы.
Пересадка стволовых кроветворных клеток из плацентарной крови при генетических болезнях
Открытие того факта, что плацентарная кровь — богатый источник кроветворных стволовых клеток, оказало заметное влияние на лечение наследственных болезней. Использование плацентарной крови имеет три больших преимущества перед костным мозгом как источником переносимых стволовых кроветворных клеток. Во-первых, реципиенты более гистосовместимы с плацентарной кровью, чем с другими клетками аллогенного донора.
При лечении синдрома Гурлер пересадка плацентарной крови неродственных доноров оказалась такой же эффективной, как пересадка костного мозга от совместимого донора. При неонатальной форме болезни Краббе пересадка плацентарной крови играет особую роль, поскольку интеллектуальное развитие может быть сохранено только в том случае, если пересадку проводят очень рано (желательно до 45 дней жизни), до возникновения клинической симптоматики.
Поскольку рамки терапевтических возможностей при неонатальной форме болезни Краббе настолько узки, большая доступность и эффективность стволовых клеток плацентарной крови, в отличие от сложностей поиска подходящего донора для пересадки костного мозга, дают большое преимущество.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

