Судороги в ногах при гепатите
Обновлено: 15.04.2024
Признаки болезни печени. Сигналы организма о нарушении работы печени
Гиппократ считал, что пессимистичный настрой человека и его раздражительность непременно связаны с застоем желчи в печени. И в некоторой степени "отец медицины" был прав. Во время злости и гнева рефлекторно задерживается отток желчи из печени и желчного пузыря. Вероятно, отсюда и корни выражения "желчный человек".
В наше время определять наличие заболеваний печени по настроению человека уже не будет ни один врач, так как существуют более явные признаки, сигнализирующие о проблемах с работой этого жизненного важного органа.
Печень выполняет огромное количество функций, среди которых главные - очищение организма от шлаков, токсинов и излишков гормонов, синтез холестерина и участие в обмене веществ. Поэтому крайне важно своевременно выявить признаки развития заболеваний печени и начать ее лечить, пока болезнь не успела нанести непоправимый вред здоровью. Вот характерные сигналы организма о нарушении работы печени:
- Боль в правом подреберье. Может быть от умеренной до интенсивной (трудно согнуться), отдавать в спину или правое плечо;
- Пожелтение склер глаз и кожи, тремор рук;
- Неприятные ощущения во рту: сухость, появление кисло-горького вкуса, тошнота;
- "Печеночные ладони". Внутренние стороны кистей (иногда подошвы) становятся ярко-красными. При надавливании бледнеют, затем красный цвет восстанавливается;
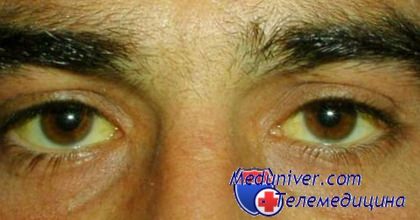
Желтуха при болезни печени - гепатите от воды
- Проблемы со сном. Он становится тревожным, прерывистым, особенно в один-три часа ночи, часто мучает бессонница;
- Язык становится ярко- красного цвета, иногда с фиолетовым оттенком, сухим, отечным, гладким;
- Запах - сладковатый, напоминающий запах свежего мяса или печени, чувствуется при дыхании и от тела больного;
- Постоянная жажда, которая не проходит даже после принятия достаточного количества жидкости;
- Поражение волос и ногтей. У мужчин волосы редеют на голове, у женщин - чаще под мышками и в лобковой области;
- Ногти становятся бледными и тусклыми, на них могут появиться бороздки, белые пятна;
- Пигментация кожи. Пятна обычно появляются на боковой поверхности щек с переходом на шею. Может темнеть кожа в подмышечных впадинах и на руках;
- Головокружение, головная боль, тахикардия;
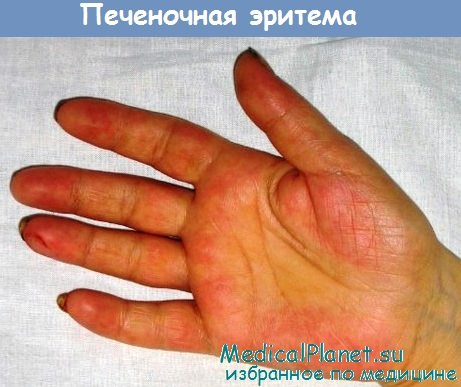
Пальмарная эритема - печеночные ладони
- Нарушение зрения, особенно в вечернее время;
- Появление аллергического дерматита, а также фурункулеза, атрофических полос (стрий) на бедрах, ягодицах, в нижней части живота;
- Кожный зуд. Чаще на отдельных местах туловища, ног и рук. Может сопровождаться сыпью. В основном имеет приступообразный, кратковременный характер;
- Появление натоптышей на мизинцах ног.
- Изменение окраса и запаха кала и мочи. Моча приобретает нездоровый коричневый оттенок, а кал меняется в цвете на светло-жёлтый или зелёный.
Чтобы избежать проблем в работе печени, не злитесь, не раздражайтесь по пустякам. А если обнаружили у себя признаки нарушения, не игнорируйте SOS-сигналы организма - пройдите обследование. Одним из самых опасных заболеваний является рак печени, которому характерно постепенное нарастание симптомов. Среди онкологических заболеваний он находится на 7-м месте по распространённости. Выявить рак печени можно по беспричинному резкому похудению и чувству тяжести под правым подреберьем. Мучают тупые боли в этой области, изжога и жажда.
При обнаружении первых симптомов неполадок в работе печени нужно, прежде всего, пересмотреть свой рацион. Исключить из рациона жирное мясо, консервы, копчености, острые блюда, алкоголь, наваристые бульоны. А также острые пряности и овощи: горчицу, хрен, чеснок, редис, поскольку они вызывают раздражение стенок желчного пузыря и, как следствие, спазмы.
Есть больше фруктов, особенно полезны для печени авокадо, свежие и запеченные яблоки, сырая и вареная свекла, зелень и мед. Пить свежевыжатые соки. Самая полезная для печени пряность - куркума. Добавляйте его по щепотке в каждое блюдо. Это поможет облегчить пищеварение, снизить уровень холестерина в крови, защитить от воздействия на печень токсичных веществ. Откажитесь от употребления сладостей, сахар тоже разрушает печень.
Для очищения печени от токсинов каждый день по утрам пейте на голодный желудок стакан теплой воды с добавлением 2 столовых ложек лимонного сока.
- Вернуться в оглавление раздела "Профилактика заболеваний"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Какие клинические симптомы позволяют диагностировать ПЭ? Каковы проявления неврологических нарушений на разных стадиях развития ПЭ? В чем заключаются особенности развития ПЭ при алкоголизме? Каких ошибок должен избежать врач при лечении ПЭ?
Какие клинические симптомы позволяют диагностировать ПЭ?
Каковы проявления неврологических нарушений на разных стадиях развития ПЭ?
В чем заключаются особенности развития ПЭ при алкоголизме?
Каких ошибок должен избежать врач при лечении ПЭ?
Этиология и патогенез
Печеночная энцефалопатия (ПЭ) представляет собой потенциально обратимое расстройство нервной и психической деятельности, возникающее при любом из заболеваний печени, протекающем с недостаточностью печеночно-клеточной функции. В большинстве случаев ПЭ осложняет течение терминальной стадии хронических диффузных заболеваний печени или острого некротизирующего (фульминантного) гепатита. Установлено, что при поражении печени любой этиологии ПЭ может привести к развитию комы и стать непосредственной причиной смерти пациента (см. таблицу 1).
Патогенез ПЭ не до конца установлен. Считается, что развитие ПЭ является результатом сочетанного влияния на ЦНС нескольких механизмов, активность которых инициируется и поддерживается выраженным нарушением печеночного клиренса токсинов и метаболитов (см. рисунок 1). Наиболее существенным для развития ПЭ считают:
- быстро нарастающее увеличение концентрации аммиака в плазме;
- увеличение плазменной концентрации и нарушение баланса между синтезом и катаболизмом нейротрансмиттеров и их предшественников в ЦНС.
Механизм развития ПЭ
К ранним признакам нарушений сознания (НС) при ПЭ относят уменьшение спонтанных движений, фиксированный взгляд, заторможенность, апатию. Для нарушения сознания при ПЭ в принципе характерны сонливость и инверсия нормального ритма сна и бодрствования. При этом ухудшение состояния и переход сонливости в кому могут произойти в течение очень короткого времени. Для определения степени НС нередко применяют шкалу Глазго (см. таблицу 2). Однако в клинической практике для оценки глубины НС именно при ПЭ используют более простую качественную шкалу, в соответствии с которой:
- для I стадии НС характерны ослабление концентрации внимания, эйфория и тревожность;
- для II стадии характерны появление сонливости, дезориентация, изменения личности и неадекватное поведение;
- на III стадии НС развиваются ступор, гиперсомния и спутанность сознания, однако больной может выполнять простые команды и произносить слова членораздельно;
- при IV степени НС пациент впадает в кому и контакт с ним оказывается невозможен.
Наиболее надежным способом определить степень нарушений интеллекта при ПЭ является проведение теста связывания чисел (тест Рейтана). Изменения личности и интеллекта при ПЭ наиболее трудны для диагностики, поскольку всегда накладываются на конституциональные, приобретенные ранее нарушения и всегда требуют оценки в динамике. Наибольшие трудности в клинической практике встречаются при дифференциальной диагностике ПЭ и нарушений личности, развивающихся при хроническом злоупотреблении алкоголем (токсическая или алкогольная энцефалопатия, наличие которой прямо не влияет на исход острой ПЭ, однако определяет риск развития делирия на фоне алкогольного абстинентного синдрома). Важно, что при алкоголизме острая ПЭ может развиться при любой из клинико-морфологических форм алкогольной болезни печени (см. рисунок 2).
Характерной особенностью ПЭ является изменчивость клинической картины. Диагностировать ПЭ легко, например, у больного с циррозом печени,
с массивным желудочно-кишечным кровотечением или сепсисом, при обследовании которого определяют спутанность сознания и хлопающий тремор. В случае, когда очевидных причин ухудшения состояния выявить не удается и признаков цирроза печени также нет, распознать начало ПЭ невозможно, если не придать должного значения малозаметным признакам синдрома. Большое значение при этом могут иметь данные анамнеза, полученные от членов семьи, заметивших изменения в состоянии или поведении больного.
У больных с острой ПЭ без признаков хронической портальной гипертензии (варикозные вены передней стенки живота, отечно-асцитический синдром, спленомегалия, заболевание печени или алкоголизм в анамнезе) диагностика на догоспитальном этапе особенно затруднена. В этих случаях она должна базироваться, во-первых, на тщательном изучении анамнеза, если это возможно; во-вторых — на анализе эффективности применения стандартной неспецифической терапии комы. Дифференциальный диагноз у больных без цирроза печени необходимо проводить с рядом заболеваний, приводящих к внезапному и выраженному нарушению сознания (см. таблицу 4).
У больных циррозом печени и активным портосистемным шунтированием важнейшим вопросом диагностики также является определение причин, приведших к развитию ПЭ (см. таблицу 5).
- нарушения электролитного баланса (прием диуретиков, массивная рвота, выраженная диарея)
- длительное голодание
- прекращение приема алкоголя (абстинентный синдром)
- массивный лапароцентез
- из варикозных вен пищевода и желудка
- из острых гастродуоденальных язв (печеночная портальная гастропатия)
- при синдроме Мэллори-Вейсса
- при хирургическом пособии или травме
- острый алкогольный эксцесс
- прием опиатов, бензодиазепинов, барбитуратов
- cпонтанный бактериальный перитонит
- инфекции мочевыводящих путей
- бронхолегочная инфекция
В большинстве случаев любой из перечисленных выше факторов либо напрямую подавляет функции ЦНС, либо нарушает их опосредованно — угнетая функцию печени, увеличивая концентрацию азотсодержащих продуктов в кишечнике и количество крови, протекающей, минуя печень, через портокавальные анастомозы.
Лабораторные данные занимают довольно скромное место в диагностике ПЭ. Известно, что ни функциональные печеночные пробы, ни повышенная концентрация аммиака в плазме прямо не коррелируют с выраженностью нарушений сознания.
Лечение ПЭ
Лечение ПЭ преследует три базовые цели:
- выявление и немедленное устранение факторов, провоцирующих ПЭ;
- уменьшение количества аммиака и других токсинов, образующихся в кишечнике в процессе пищеварения и жизнедеятельности микробной флоры;
- нормализацию обмена нейромедиаторов.
Схематично лечение ПЭ (III и IV стадии) представлено в таблице 6.
- Поддержание калорийности рациона на уровне 2000 ккал/сут
- Поддержание водно-электролитного баланса:
- контроль гиповолемии: для коррекции гиповолемии под контролем ЦВД вводить 5-или 10-процентный р-р глюкозы или альбумина, а не изотонический р-р;
- коррекция гипокалиемии до уровня выше 3,5 ммоль/л;
- отмена диуретиков.
Объем лечебных мероприятий при ПЭ относится к числу стандартных и выверенных клинической практикой алгоритмов неотложной помощи, поскольку эффективность лечения прямо зависит от как можно более раннего начала терапии. В этом смысле фармакотерапия ПЭ прямо относится к презумпции скорой медицинской помощи. Тем не менее на практике оказывается, что пациенты с ПЭ, как на догоспитальном этапе, так и в условиях стационара, нередко не получают адекватного лечения. Более того, во многих случаях больным назначают фармакотерапию, которая способна спровоцировать ухудшение состояния сознания и нарушение вегетативных функций. К числу наиболее распространенных ошибок лечения можно отнести:
- недостаточную инфузию концентрированных растворов глюкозы, обладающих помимо энергонесущей активности также ярким осмотическим действием, что важно при угрожающем отеке мозга;
- необоснованное и неконтролируемое введение изотонического и других неконцентрированных полиионных растворов, что влечет за собой прямую угрозу развития отека мозга и легких;
- недооценку важности планового назначения осмотических слабительных и экстренной очистки кишечника высокими осмотическими клизмами (эффективно уменьшают всасывание аммиака в кишечнике и его бактериальную контаминацию, способствуют снижению портального давления);
- недооценку опасности диуретической терапии, массивного лапароцентеза и назначения седативных средств в отношении углубления стадии ПЭ.
- К 70.0: алкогольная жировая дистрофия печени
- К 70.1: алкогольный гепатит
- К 70.2: алкогольный фиброз/склероз печени
- К 71: токсические поражения печени:
- 71.0 — с холестазом
- 71.1 — с некрозом
- 71.2 — по типу острого гепатита
- 71.5 — по типу хронического гепатита
- 71.7 — с фиброзом и циррозом печени
- К 72.0: острая и подострая печеночная недостаточность
- К 71.1: хроническая печеночная недостаточность
- К 76.6: портальная гипертензия
- G 31.2: дегенерация ЦНС, вызванная алкоголем
- G 61.1: алкогольная полинейропатия
- F 10.0: острое отравление, вызванное употреблением алкоголя
- F 10.3: абсистентное состояние, вызванное употреблением алкоголя
- F 10.4: абсистентное состояние с делирием, вызванное употреблением алкоголя
- F 10.2: хронический алкоголизм (алкогольная зависимость)
При выявлении ПЭ на догоспитальном этапе пациенты с III и IV стадиями нарушения сознания должны быть немедленно госпитализированы в отделение интенсивной терапии.
Прогноз ПЭ
Прогноз ПЭ всецело зависит от выраженности печеночно-клеточной недостаточности и времени начала лечения. При циррозе печени у больных с относительно сохранной функцией паренхимы и интенсивным коллатеральным кровообращением прогноз лучше, а у больных с острым гепатитом — хуже. Прогноз существенно улучшается, если удается быстро устранить факторы, ведущие к усугублению ПЭ: инфекцию, передозировку диуретиков или кровопотерю. Однако наиболее эффективным способом улучшить прогноз является как можно более точная диагностика и раннее начало лечения ПЭ.
Судороги в ногах наблюдаются при болезнях сосудов, синдроме крампи, плоскостопии, нарушениях электролитного баланса, гиповитаминозах, ряде эндокринных заболеваний, отравлениях, передозировке лекарственных препаратов, поражениях головного мозга, некоторых других состояниях. Могут охватывать одну мышцу или несколько мышечных групп, быть изолированными либо сочетаться с судорогами других локализаций. Диагностируются на основании данных опроса, внешнего осмотра, ЭФИ, лабораторных анализов, аппаратных методов. Лечение включает миорелаксанты, противоэпилептические и противосудорожные средства, спазмолитики, физиотерапевтические методики, хирургические вмешательства.
Почему возникают судороги в ногах
Синдром крампи
Представляет собой кратковременные болезненные сокращения мышц. Чрезвычайно широко распространен, по различным данным, выявляется у 20-90% взрослых людей, чаще встречается в пожилом возрасте. Может возникать, как физиологическая реакция на различные внешние воздействия, быть идиопатическим либо симптоматическим. В подавляющем большинстве случаев страдают икроножные мышцы.
Во время судороги отмечаются резкая боль и подошвенное сгибание стопы. Проявления сохраняются на протяжении нескольких секунд или минут, уменьшаются при ходьбе, массаже, пассивном разгибании ступни. После приступа в течение 1-2 дней наблюдаются незначительная болезненность, повышенная чувствительность икр. Синдром нередко появляется по ночам, предваряется фасцикуляциями. Провоцируется следующими обстоятельствами:
- Физические факторы. Спазмы в ногах беспокоят после непривычной интенсивной нагрузки – длительной ходьбы, занятий на тренажерах. Развиваются в воде, особенно холодной, что сопряжено с опасностью утопления. В качестве других раздражителей выступают обезвоживание, переохлаждение, употребление соленых продуктов.
- Идиопатические крампи. Появляются без видимых причин, обнаруживаются как в покое, так и при движениях. Наблюдаются ежедневно или несколько раз в неделю. Могут быть связаны с наследственной предрасположенностью (выявляться у нескольких членов одной семьи).
- Соматические болезни.Крампи потенцируются хронической почечной недостаточностью, циррозом печени, хронической сердечной недостаточностью, редко – гликогенозами, паранеопластическим синдромом.
- Неврологические заболевания. Синдром возникает на фоне патологий с гипертонусом и спонтанной мышечной активностью: БАС, множественного склероза, синдрома Паркинсона, болезни Шарко-Мари-Тута, синдрома крампи-фасцикуляции. Иногда сопровождает остеохондроз, моно- и полинейропатии.
Плоскостопие
Судороги в ногах определяются при всех разновидностях плоскостопия: продольном, поперечном, смешанном. Вызываются неправильным распределением нагрузки, которое влечет за собой постоянное переутомление мышц дистальных отделов конечностей. Чаще отмечаются во второй половине дня, развиваются после продолжительного стояния или ходьбы. Могут беспокоить в ночное время.
Болезни сосудов
Спазмы при сосудистых заболеваниях обусловлены ухудшением обменных процессов, гипоксией, снижением количества АТФ в клетках. Выявляются при следующих патологиях:
- Варикозная болезнь. Симптом беспокоит преимущественно в стадии декомпенсации, чаще отмечается по ночам. Сочетается с повышенной утомляемостью, отеками, тупыми болями, постоянной тяжестью в ногах, выраженными внешними изменениями вен, трофическими расстройствами.
- Облитерирующий атеросклероз. Чаще диагностируется у пожилых людей. Болям и судорогам в икроножных мышцах предшествуют онемение стоп, жжение, зябкость, повышенная чувствительность к холоду. Через некоторый период времени (как правило, незначительный) к перечисленной симптоматике присоединяется перемежающаяся хромота.
- Облитерирующий эндартериит. Среди больных преобладают молодые мужчины. Симптомы напоминают клиническую картину атеросклероза, включают зябкость, онемение пальцев, парестезии, спазмы в стопах и икроножных мышцах, перемежающуюся хромоту. Характерно менее благоприятное течение, быстрое развитие трофических нарушений.
- Облитерирующий тромбангиит. Всегда двусторонний. Наряду с судорогами, болями, повышенной чувствительностью стоп, кровоизлияниями в области пальцев обнаруживаются синдром Рейно, мигрирующий тромбофлебит дистальных отделов ног. При прогрессировании возникают тяжелые трофические нарушения.
Эндокринные заболевания
Судорожный синдром наиболее характерен для гипопаратиреоза, обусловлен повышением нервно-мышечной возбудимости при низком уровне паратгормона. Как правило, симметрично вовлекаются сначала руки, затем – ноги, преимущественно поражаются сгибатели. Иногда судороги распространяются на лицевые мышцы, мускулатуру туловища, внутренних органов. В легких случаях приступы продолжаются 1-2 минуты, повторяются1-2 раза в неделю. При тяжелом течении наблюдается множество ежедневных пароксизмов длительностью до нескольких часов.
В некоторых случаях спазмы беспокоят пациентов с выраженным нарушением функций щитовидной железы при гипертиреозе и гипотиреозе. Могут сочетаться с миоклонусом, когнитивными и поведенческими расстройствами. При сахарном диабете причиной спазмов в ногах становится диабетическая макроангиопатия, которая возникает через 10-15 лет с момента манифестации заболевания, обнаруживается примерно у 10% больных. Симптом дополняется зябкостью, онемением стоп, отеками, резкой болью в голенях, бедрах, а иногда и ягодицах, усиливающейся при движениях.
Водно-электролитные нарушения
Тонические судороги, обусловленные изменениями электролитного баланса, встречаются при заболеваниях желудочно-кишечного тракта (мальабсорбции, состоянии после резекции желудка и кишечника), болезнях почек, эндокринопатиях. Причиной также могут стать наружные и внутренние кровотечения, кишечные инфекции, отравления, сопровождающиеся многократной рвотой, частой диареей. Симптом определяется при таких состояниях, как:
- Гипокальциемия. Судороги стоп сочетаются со спазмами кистей рук, мимической и жевательной мускулатуры.
- Гипомагниемия. Карпопедальный спазм дополняется дрожанием конечностей, гиперрефлексией, тетанией, слабостью, сонливостью, диспепсическими расстройствами.
- Гиперкалиемия. Судорожные приступы кратковременные, быстро сменяются снижением тонуса мышц. Выявляются брадикардия, аритмии, боли в эпигастральной области.
- Гипер- и гипонатриемия. В отличие от других состояний, симптом имеет генерализованный характер. Пароксизму предшествуют дыхательные расстройства, тошнота, рвота.
Гиповитаминозы
Нарушения сократительной функции мышц чаще всего обнаруживаются при дефиците витаминов группы В:
- Гиповитаминоз В1. Судороги в мышцах голени характерны для сухой формы бери-бери. Отмечаются невриты, изменения болевой и температурной чувствительности нижних конечностей.
- Гиповитаминоз В2. Неврологические расстройства определяются при длительном течении болезни, включают спазмы, парестезии, атаксию, гиперрефлексию. Перечисленным симптомам предшествуют слабость, поражения глаз, кожи и слизистых.
- Гиповитаминоз В6. Судорожный синдром развивается по ночам. Дополняется снижением зрения, конъюнктивитом, сухостью кожи. Язык становится малиновым, приобретает лакированный вид.
Интоксикации и отравления
Спонтанные судороги в ногах, других частях тела связаны с передозировкой медикамента или индивидуальной реакцией на лекарственное средство. Причиной симптома чаще всего являются препараты из группы блокаторов кальциевых каналов, бета-блокаторы, статины, диуретики. Иногда симптом развивается под влиянием ингибиторов ацетилхолинэстеразы, стероидных гормонов, ноотропов, ряда психотропных и антибактериальных средств.
У некоторых больных судорожный синдром появляется на выходе из наркоза с использованием миорелаксантов. Перечень токсичных веществ, способных спровоцировать локальные (в том числе – в ногах) или генерализованные судороги, включает дихлофос, другие инсектициды, пестициды. Аналогичным действием обладают мышьяк, формальдегид, фенол, а также спорынья, белладонна и мухоморы.
Патологии беременности
Судороги, обусловленные синдромом нижней полой вены, появляются во 2-3 триместре беременности. Обусловлены сдавлением сосуда увеличивающейся маткой и, как следствие, нарушением кровообращения в ногах. Симптом выявляется в положении лежа на спине, на поздних сроках сочетается с постуральной гипертензией, головокружениями, сердцебиением, усилением движений плода.
Другие причины
Существует много состояний, при которых судороги в ногах возникают, но не являются специфическим симптомом или, как при эклампсии, становятся генерализованными. Спастические сокращения возможны при солнечном и тепловом ударе. Могут выявляться у больных с постгеморрагической анемией, обусловленной массивной кровопотерей. Обнаруживаются при эпилепсии, ЧМТ, церебральных опухолях. Встречаются при тетании, миотонии, некоторых миопатиях.
Диагностика
Диагностические мероприятия осуществляются врачом-неврологом. По показаниям больных направляют к ортопеду, сосудистому хирургу, акушеру-гинекологу, другим специалистам. Программа обследования включает следующие методики:
- Опрос. Врач уточняет, когда впервые появились спазмы, как часто повторяются, чем провоцируются приступы. Выясняет другие жалобы. Расспрашивает об имеющихся заболеваниях, особенностях образа жизни, принимаемых лекарственных средствах, чтобы определить возможные причины симптома.
- Физикальное обследование. В ходе осмотра специалист выявляет изменения в ногах: признаки плоскостопия, гипертрофию или повышение тонуса мышц, фасцикуляции, расширенные поверхностные вены, отеки. Оценивает пульсацию, исследует чувствительность, рефлексы.
- Электрофизиологические исследования.Электронейрография и электромиография помогают определить состояние нервно-мышечной передачи, скорость прохождения нервных импульсов, наличие или отсутствие спонтанной мышечной активности, которое в ряде случаев указывает на возможную причину судорог.
- Лабораторные анализы. Скрининговое обследование включает ОАК, ОАМ, определение глюкозы, креатинина, мочевины, печеночных ферментов, белков крови. При водно-электролитных нарушениях исследуют уровень электролитов, при гиповитаминозах оценивают содержание витаминов, при эндокринных патологиях выполняют анализы на гормоны. При отравлениях производят токсикологические тесты.
- Аппаратные методики. Пациентам с сосудистыми болезнями показаны ультразвуковые исследования (допплерография, дуплексное сканирование) сосудов нижних конечностей. Больным с плоскостопием рекомендована рентгенография стоп с нагрузкой. При эндокринных заболеваниях проводят УЗИ желез внутренней секреции, при органных поражениях – УЗИ брюшной полости и почек. Для исключения неврологических патологий осуществляют МРТ головного мозга.
Лечение
Консервативная терапия
Лечебная тактика определяется причиной судорог в ногах. С учетом особенностей патологии применяются следующие методики:
- Синдром крампи. При симптоматических спазмах показана терапия основного заболевания. Для устранения судорожной активности используются противоэпилептические препараты, блокаторы кальциевых каналов, хинин. Для купирования приступов назначают миорелаксанты. При выраженном болевом синдроме в схему лечения включают НПВС, при нарушениях сна – мягкие снотворные.
- Плоскостопие. Ведущую роль играют немедикаментозные методики. Больным рекомендуют нормализовать вес, выбирать удобную обувь, избегать продолжительных статических нагрузок. Для укрепления свода стопы полезны ходьба по мелким камешкам, массаж, специальные упражнения, СМТ, магнитотерапия, другие физиотерапевтические процедуры. При необходимости осуществляют подбор ортопедической обуви.
- Болезни сосудов. Терапия варикоза проводится с применением венотоников, лечебной физкультуры, средств эластической компрессии, методов компрессионной склеротерапии. Необходимо уменьшить нагрузку на ноги. Медикаментозное лечение облитерирующих заболеваний артерий производится спазмолитиками, антикоагулянтами, тромболитиками, анальгетиками. В рамках немедикаментозной терапии назначаются ВЛОК, озонотерапия, гипербарическая оксигенация, бальнеологические и физиотерапевтические процедуры.
- Эндокринные заболевания. Гипопаратиреоз корректируется путем диеты, приема препаратов кальция и витамина Д, успокаивающих, противосудорожных средств. Полезно УФО. При гипотиреозе проводят гормонозаместительную терапию, пациентам с гипертиреозом назначают тиреостатики. При диабете с макроангиопатией необходима инсулинотерапия в сочетании с антиагрегантами.
Нарушения водно-электролитного баланса устраняют путем внутривенного введения растворов электролитов. Больным гиповитаминозами рекомендуют витаминные препараты. При интоксикациях требуется дезинтоксикационная терапия. Беременным с СНПВ советуют сон на левом боку, умеренные физические нагрузки. Эклампсия является показанием для проведения комплексных реанимационных мероприятий.
![Упражнения при судорогах ног]()
Хирургическое лечение
Больным с судорогами могут выполняться следующие операции:
- Плоскостопие: различные варианты коррекции Hallux valgus, пересадка сухожилий, резекция участков костей.
- Варикозная болезнь:флебэктомия, минифлебэктомия, клеевая облитерация, лазерная и радиочастотная коагуляция, криофлебэктомия.
- Облитерирующие болезни сосудов:эндартерэктомия, стентирование, дилатация или протезирование артерий, шунтирующие вмешательства, артериализация вен стопы, профундопластика, тромбоэмболэктомия.
- Эндокринные патологии:резекция щитовидной железы у больных гипертиреозом, эндартерэктомия и пластика трофических язв при диабетической макроангиопатии.
1. Мышечные крампи: вопросы патогенеза, дифференциальной диагностики и лечения/ Бородулина И.В., Супонева Н.А.// РМЖ – 2015 - №4.
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. Рассмотрены вопросы выбора терапии с использованием антиспастических препаратов в зависимости от заболевания, выраженности мышечной спастичности, побочных эффектов
Myorelaxants are the basic preparations used for reduction in the muscular tone. Issues of selection of therapy by anti-spastic preparations depending on the disease, manifestation of muscular spasticity, side effects and special features of the preparation effect are considered.
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. По механизму действия различают миорелаксанты центрального действия (влияют на синаптическую передачу возбуждения в центральной нервной системе) и периферического действия (угнетают прямую возбудимость поперечно-полосатых мышц). При применении миорелаксантов могут возникать достаточно значимые побочные действия, которые при выборе препарата надо тщательно оценивать [1, 2].
При выборе антиспастических препаратов учитывают в основном их способность тормозить полисинаптические рефлексы (уменьшение спастики), оказывая при этом наименьшее влияние на моносинаптические рефлексы (сила мышц). Антиспастический препарат должен уменьшать мышечную спастичность при минимальном снижении мышечной силы [3, 4].
Медикаментозная терапия основана на использовании таблетированных и инъекционных форм. Применяемые внутрь антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры, предупредить развитие контрактур [5]. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых нередко вызывает нежелательные побочные эффекты. Лечение миорелаксантами начинают с минимальной дозы, затем ее медленно повышают для достижения эффекта [6].
К миoрелаксантам центрального действия, наиболее часто используемым в России для лечения спастического мышечного гипертонуса, относятся баклофен, тизанидин, толперизон, диазепам [7, 8].
Баклофен (Баклосан, Лиорезал) оказывает антиспастическое действие преимущественно на спинальном уровне. Препарат представляет аналог гамма-аминомасляной кислоты (ГАМК), который связывается с пресинаптическими ГАМК-рецепторами, приводя к уменьшению выделения возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности. Препарат проявляет также умеренное центральное анальгезирующее действие. Баклофен используется при спинальном и церебральном спастическом мышечном гипертонусе различного генеза. Начальная доза составляет 5–15 мг/сут (в один или три приема), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта. Препарат принимают во время еды. Максимальная доза баклофена для взрослых составляет 60–75 мг/сут. Побочные эффекты чаще проявляются седацией, сонливостью, снижением концентрации внимания, головокружением и часто ослабевают в процессе лечения. Возможно возникновение тошноты, запоров и диареи, артериальной гипертонии, усиление атаксии, появление парестезий. Требуется осторожность при лечении больных пожилого возраста, пациентов, перенесших инсульт, пациентов с язвенной болезнью желудка и двенадцатиперстной кишки. Баклофен противопоказан при эпилепсии, наличии судорог в анамнезе [9, 10].
При выраженной спастичности, когда обычное пероральное применение антиспастических препаратов не эффективно, показано интратекальное введение баклофена, которое впервые было предложено в 1984 г. R. Penn. Для достижения необходимой концентрации препарата в спинномозговой жидкости необходимо принимать довольно значительные дозы баклофена, что может привести к нарушениям сознания, сонливости, слабости. В связи с этим были разработаны системы, при помощи которых баклофен доставляется непосредственно в подоболочечное пространство спинного мозга при помощи подоболочечной баклофеновой насосной системы. При этом клинического эффекта добиваются гораздо меньшими дозами баклофена, чем при использовании таблетированных форм [11, 12].
Данная система состоит из резервуара, где содержится баклофен или аналогичный препарат, насоса (помпы), при помощи которого препарат дозированно подается в подоболочечное пространство спинного мозга через люмбальный катетер и блока питания. Из резервуара баклофен поступает непосредственно в спинномозговую жидкость, а его дозировка контролируется специальным радиотелеметрическим устройством. Количество поступающего в спинномозговую жидкость лекарственного препарата можно изменять в зависимости от клинической картины. Добавление баклофена в резервуар производится через 2–3 месяца при помощи чрезкожной пункции [13].
Использование баклофеновой помпы улучшает скорость и качество ходьбы больных с нефиксированными рефлекторными контрактурами, обусловленными высокой спастичностью мышц-синергистов и дисбалансом мышц-антагонистов. Имеющийся 15-летний клинический опыт применения баклофена интратекально у больных, перенесших инсульт, свидетельствует о высокой эффективности этого метода в уменьшении не только степени спастичности, но и болевых синдромов и дистонических расстройств. Отмечено положительное влияние баклофеновой помпы на качество жизни больных, перенесших инсульт [14].
Тизанидин (Сирдалуд) — миорелаксант центрального действия, агонист альфа-2-адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот L-глутамата и L-аспартата и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Тизанидин обладает также умеренным центральным анальгетическим действием. Препарат эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах. Начальная доза препарата составляет 2–6 мг/сут в один или три приема, при индивидуальном подборе увеличение дозы происходит на 3–4 день на 2 мг. При пероральном приеме действие препарата проявляется через 30–45 минут, максимальный эффект наступает в течение 1–2 часов. Средняя терапевтическая доза составляет 12–24 мг/сут, максимальная доза — 36 мг/сут. В качестве побочных эффектов могут возникнуть сонливость, сухость во рту, головокружение и снижение артериального давления, что ограничивает использование препарата при постинсультной спастичности. Антиспастический эффект тизанидина сопоставим с эффектом баклофена, однако тизанидин при адекватном подборе дозировки лучше переносится, т. к. не вызывает общей мышечной слабости и не усиливает мышечную слабость в парализованной конечности [15, 16].
Толперизон (Мидокалм) — антиспастический препарат центрального действия, угнетает каудальную часть ретикулярной формации и обладает Н-холинолитическими свойствами. Толперизон снижает активность спинальных нейронов, участвующих в формировании спастичности, путем ограничения потока натрия через мембрану нервных клеток. Наиболее часто используется по 300–450 мг/сут в два или три приема. Снижение мышечного тонуса при назначении толперизона иногда сопровождается сосудорасширяющим действием, что следует учитывать при назначении больным с тенденцией к артериальной гипотонии. Также препарат может вызывать или усиливать у больных недержание мочи [17].
Основным побочным эффектом баклофена, тизанидина и толперизона является быстрое наступление мышечной слабости, причем в каждом случае врач должен находить баланс между снижением тонуса и усилением слабости. Кривая баланса между снижением спастического тонуса и усилением мышечной слабости у больных на фоне увеличения дозы Мидокалма, Сирдалуда или Баклофена показывает, что наиболее быстрое усиление слабости происходит при приеме Баклофена, а самый мягкий препарат, позволяющий эффективно подобрать индивидуальную дозировку, — Мидокалм. Во всех случаях, учитывая наличие узкого терапевтического окна, курс лечения начинают с небольшой дозы препарата, постепенно наращивая ее до достижения отчетливого антиспастического эффекта, но не до появления слабости [18, 19].
Диазепам (Реаланиум, Релиум, Сибазон) является миорелаксантом, поскольку обладает способностью стимулировать уменьшенное пресинаптическое торможение на спинальном уровне. Он не имеет прямых ГАМК-ергических свойств, увеличивает концентрацию ацетилхолина в мозге и тормозит обратный захват норадреналина и дофамина в синапсах. Это приводит к усилению пресинаптического торможения и проявляется снижением сопротивляемости растяжению, увеличением диапазона движений. Диазепам также обладает способностью уменьшать болевой синдром, вызываемый спазмом мышц. Наряду со снижением мышечного тонуса, развиваются заторможенность, головокружение, нарушение внимания и координации ввиду токсического действия на центральную нервную систему. Это значительно ограничивает применение диазепама в качестве миорелаксанта. Используется он, в основном, для лечения спастичности спинального происхождения при необходимости кратковременного снижения мышечного тонуса. Для лечения спастичности назначают в дозе 5 мг однократно или по 2 мг 2 раза в день. Максимальная суточная доза может составлять 60 мг. При больших дозах могут отмечаться расстройства сознания, преходящая дисфункция печени и изменения крови. Продолжительность лечения ограничена из-за возможного развития лекарственной зависимости [20].
Клоназепам является производным бензодиазепина. Клоназепам оказывает успокаивающее, центральное миорелаксирующее, анксиолитическое действие. Миорелаксирующий эффект достигается за счет усиления ингибирующего действия ГАМК на передачу нервных импульсов, стимуляции бензодиазепиновых рецепторов, расположенных в аллостерическом центре постсинаптических ГАМК-рецепторов восходящей активирующей ретикулярной формации ствола головного мозга и вставочных нейронов боковых рогов спинного мозга, а также уменьшения возбудимости подкорковых структур головного мозга и торможения полисинаптических спинальных рефлексов.
Быстрое наступление сонливости, головокружения и привыкания ограничивает применение этого препарата. Для снижения проявления возможных побочных реакций, достигать терапевтической дозы необходимо путем медленного титрования в течение двух недель. Для приема внутрь взрослым рекомендуется начальная доза не более 1 мг/сут. Поддерживающая доза — 4–8 мг/сут. Возможно назначение небольших доз в сочетании с другими миорелаксантами. Клоназепам эффективен при пароксизмальных повышениях мышечного тонуса. Противопоказан при острых заболеваниях печени, почек, миастении [21].
Дикалия клоразепат (Транксен) — аналог бензодиазепина, трансформируется в главный метаболит диазепама, обладает большей активностью и длительностью антиспастического действия, чем диазепам. Отмечен его хороший эффект при лечении в виде уменьшения фазических рефлексов на растяжение, обладает незначительным седативным эффектом. Первоначальная доза составляет 5 мг 4 раза в сутки, затем уменьшается до 5 мг 2 раза в сутки [22].
Дантролен — производное имидазолина, действует вне центральной нервной системы, преимущественно на уровне мышечных волокон. Механизм действия дантролена — блокирование высвобождения кальция из саркоплазматического ретикулума, что ведет к снижению степени сократимости скелетных мышц, редукции мышечного тонуса и фазических рефлексов, увеличению диапазона пассивных движений. Важным преимуществом дантролена по отношению к другим миорелаксантам является его доказанная эффективность в отношении спастичности не только спинального, но и церебрального генеза. Начальная доза — 25 мг/сут, при переносимости дозу увеличивают в течение 4 недель до 400 мг/сут. Побочные эффекты — сонливость, головокружение, тошнота, диарея, снижение скорости клубочковой фильтрации. Серьезную опасность, особенно у пожилых пациентов в дозе более 200 мг/сут, представляет гепатотоксическое действие, поэтому в период лечения надо регулярно следить за функцией печени. Элиминация дантролена на 50% осуществляется за счет печеночного метаболизма, в связи с этим он противопоказан при заболеваниях печени. Осторожность следует соблюдать и при тяжелых сердечных или легочных заболеваниях.
Катапресан — применяется в основном при спинальных повреждениях, действует на альфа-2-агонисты головного мозга, обладает пресинаптическим торможением. Из побочных эффектов отмечаются снижение артериального давления и депрессия. Первоночальная доза — 0,05 мг 2 раза в день, максимальная — 0,1 мг 4 раза в день.
Темазепам — взаимодействует с бензодиазепиновыми рецепторами аллостерического центра постсинаптических ГАМК-рецепторов, расположенных в лимбической системе, восходящей активирующей ретикулярной формации, гиппокампе, вставочных нейронах боковых рогов спинного мозга. В результате открываются каналы для входящих токов ионов хлора и таким образом потенцируется действие эндогенного тормозного медиатора — ГАМК. Рекомендуемая доза — 10 мг 3 раза в день. Эффективно его сочетание с баклофеном [23, 24].
Основные лекарственные средства, используемые для лечения спастического мышечного гипертонуса, представлены в табл.
Таким образом, выбор препарата определяется основным заболеванием, выраженностью мышечной спастичности, а также побочными эффектами и особенностями действия конкретного препарата.
Так, например, тизанидин и баклофен в большей степени действуют на тонус мышц-разгибателей, поэтому в случаях наличия значительного гипертонуса мышц-сгибателей руки, легкой спастичности мышц ноги их прием не показан, поскольку легкое повышение тонуса мышц-разгибателей ноги компенсирует мышечную слабость в ноге и стабилизирует походку больного. В таком случае средством выбора являются методы физического воздействия на мышцы верхней конечности.
При лечении церебральной спастичности наиболее часто применяют Сирдалуд, а при спинальной спастичности — Сирдалуд и Баклофен. Важным преимуществом перед другими миорелаксантами обладает Мидокалм, который не оказывает седативного эффекта и имеет благоприятный спектр переносимости, поэтому является препаратом выбора для лечения в амбулаторных условиях и для лечения пожилого контингента пациентов.
Допустима комбинация нескольких средств, что позволяет эффективно снижать тонус на меньших дозах каждого из препаратов. Сочетание препаратов с разными точками приложения, начиная от центров в головном мозге и до мышц, может привести к суммированию терапевтического эффекта.
Эффективность пероральных антиспастических препаратов снижается при их длительном использовании, часто возникает необходимость возрастающего повышения дозировок для поддержания начального клинического эффекта, что сопровождается увеличением частоты и тяжести побочных реакций [25–27].
В ситуации, когда спастичность носит локальный характер и системный эффект пероральных миорелаксантов нежелателен, предпочтительны локальные методы воздействия, одним из которых является локальное введение ботулотоксина [28, 29].
Литература
А. А. Королев, кандидат медицинских наук
Причины неврологических осложнений прививок (вакцинации) у ребенка
Неврологические осложнения после иммунизации, безусловно, имеют различные причины и механизмы, включая прямое воздействие ослабленных возбудителей или их токсинов. Более всего вероятен иммуноаллергический механизм, а для удобства все осложнения будут рассмотрены в этом разделе.
Предмет обсуждения поднимает сложные проблемы, потому что связь между специфической иммунизацией и заболеваниями нередко слабая, а подтверждения порой основаны на эпидемиологических исследованиях, ограниченных рядом ошибок (погрешностей) или на гипотезах, не являющихся окончательными. В дополнение к этому, толерантность населения к вакцинациям повсеместно находится на низком уровне, и правовые проблемы компенсации делают объективное исследование более трудным.
а) Осложнения вероятно иммуноаллергического механизма. Осложнения, вероятно, относящиеся к иммуноаллергическому механизму, могут затрагивать центральную и/или периферическую нервную систему. Такие поражения включают в себя энцефалопатию, энцефалит, энцефаломиелит и полирадикулоневрит (синдром Гийена-Барре), нейропатию плечевого сплетения, острый поперечный миелит, невропатии черепных нервов и оптический неврит (Peter, 1992, Fenichel, 1994).
Термины энцефалопатия и энцефалит часто используются как синонимы для обозначения любой комбинации изменений поведения и сознания, судорог и очагового неврологического дефицита. Термин энцефалит предпочтительнее в случаях, когда присутствуют воспалительные изменения, такие как плеоцитоз в ликворе.
Эти расстройства клинически не отличаются от схожих заболеваний, развивающихся вследствие вирусных инфекций или, по-видимому, спонтанно. Осложнения предположительно иммуноаллергического механизма встречались при иммунизации против гриппа, бешенства, краснухи, кори и дифтерии-столбнякакоклюша, а также от оспы, желтой лихорадки и японского энцефалита В (Ohtaki et al., 1992; Plesner et al., 1998; Piyasirisilp и Hemachudha, 2002). Неврологические осложнения вследствие иммунизации против эпидемического паротита крайне редки (Fenichel, 1994).
![Осложнения прививок - вакцинации]()
б) Осложнения в связи с непосредственным воздействием вакцинного возбудителя или токсических веществ. Осложнения, которые отражают прямое действие живых, аттенуированных вакцин встречаются довольно редко. Они более разнообразны по типу и клиническим проявлениям, чем при иммуноаллергическом механизме. Поэтому они описаны отдельно для каждой вакцины. В этом разделе также описаны осложнения, относящиеся к иммунизации против коклюша, так как токсический механизм представляется более вероятным, чем иммуноаллергический патогенез, хотя последнее полностью не исключено.
1. Реакции на прививки от свинки, кори, краснухи. Редкие случаи острой энцефалопатии возникали после иммунизации живыми вирусными вакцинами, но причинно-следственные отношения между неврологическими расстройствами и фактом вакцинации далеки от подтверждения. Частота судорог вследствие коревой вакцинации, включая фебрильные судороги, значительно ниже, чем при дикой инфекции (I.andrigan и Witte, 1973). Припадки наблюдались у 1,9% вакцинированных по сравнению с 7,7% у пациентов с естественным заболеванием. По данным одного обзора заболеваемость энцефалитом через 15-35 дней после иммунизации колеблется в пределах от 1 из 11000 до 1 из 100000 доз (Miller D. L. et al., 1993). Исход обычно благоприятный.
Описаны случаи подострого склерозирующего панэнцефалита (ПСПЭ) после вакцинации живыми вирусами, но эпидемиологические исследования установили, что такие случаи встречаются значительно реже, чем случаи вследствие природной кори (0,14:100 000 доз вакцины в отличие от 4:100000 случаев при естественном заражении). Назначение вакцины после природной кори не повышает риск развития ПСПЭ (Miller et al., 1992). Вполне вероятно, что вакцинопрофилактика обеспечила значительное снижение заболеваемости ПСПЭ за последнее десятилетие.
Встречается информация о передаче вируса краснухи плоду после иммунизации беременных женщин (Modlin et al., 1975), следовательно, необходима вакцинация девочек в препубертатном возрасте. Судороги редко могут возникать после назначения вакцины против паротита, кори и краснухи (Miller Е. et al., 1993). В литературе описан случай менингита после иммунизации против эпидемического паротита (Sugiura и Yamada, 1991).
2. Полиовакцина. Инактивированная (Salk) полиовакцина имеет исключительные показатели безопасности и эффективности. Использование оральной живой аттенуированной вирусной вакцины было связано с развитием паралитического полиомиелита у некоторых пациентов или у их ближайших контактов. 15% этих детей страдали иммунодефицитом (Ruuskanen et al., 1980). У таких пациентов заболевание часто протекало в атипичной форме, и инкубационный период мог длиться дольше одного месяца, наблюдаемого у здоровых реципиентов. С 1980 по 1996 гг. в США наблюдалось 142 случая паралитического полиомиелита у детей в возрасте до двух лет, контактировавших с вакцинированными или иммунодефицитными детьми, 93% из которых имели отношение к живой полиовакцине (Strebel et al., 1992).
Уровень заболеваемости на период с 1980 по 1989 гг. в США составлял приблизительно один случай к 2,5 миллионам доз. Эти случаи вызванного вакциной полиомиелита привели к разработке министерством здравоохранения последовательной схемы с ранним назначением инактивированной вакцины после оральной, что, очевидно, не связано со значительным изменением заболеваемости (Wattigney et al., 2001). Инактивированная вакцина преимущественно используется в других странах, но при всех достоинствах ее эффективности и безопасности вакцина все же противопоказана детям с иммунной недостаточностью или контактирующим с ними (Querfurth и Swanson, 1990). Rantala et al. (1994) не обнаружили связи между возникновением синдрома Гийена-Барре и назначением оральной полиовакцины.
3. Вакцина против дифтерии, столбняка и коклюша (АКДС). Показатели безопасности дифтерийно-столбнячной вакцины безупречны. Случаи серьезной неврологической патологии описаны как исключение (Mancini et al., 1996; Perriol et al., 2004).
Судороги и гипотонические-гипореспонсивные эпизоды, кажется, имеют четкую связь с коклюшным компонентом АКДС вакцины (Baraff et al., 1988), хотя Pollock и Morris (1983) обнаружили, что гипотонические-гипореспонсивные эпизоды также возникают после АДС вакцины без коклюшного компонента, и частота судорог в их исследовательской работе не отличалась при назначении АДС или АКДС вакцины. Гипотонические-гипореспонсивные эпизоды (Fenichel, 1988; Piyasirisilp и Hemachudha, 2002) могут возникать в среднем через 12 часов после вакцинации с длительностью от нескольких минут до четырех часов, не оставляя последствий.
В ряде работ Blumberg et al. (1993) судороги или гипотонические-гипореспонсивные эпизоды возникали в 1 из 1750 вакцинаций, стойкий плач у 1:100 и лихорадка >40,5°С в 1:330 случаев. Выбухание родничка наблюдалось также после назначения АДС вакцинации (Gross et al., 1989).
Выявлена связь фебрильных судорог с АКДС вакциной (Miller et al., 1981, Shields et al., 1988), что подтверждено изменением распределения фебрильных судорог в Германии после смены схемы АКДС вакцинации. Shields et al. (1988) выявили максимум 5,9% случаев фебрильных судорог до двухлетнего возраста связанных с вакциной АКДС. Приблизительно 10% судорог после АКДС имеют афебрильный характер (Blumberg et al., 1993).
Острая энцефалопатия, характеризующаяся повторными судорогами, комой и смертельным исходом или последствиями, является основным неврологическим осложнением в связи с коклюшной вакциной. Помимо этого развивается эпилептический статус, кома и, реже, очаговый неврологический дефицит, которые развиваются через 72 часа и, особенно, через 12-24 часа после назначения вакцины (Aicardi и Chevrie, 1975). Тем не менее, клиническая картина неспецифична, и в большинстве описанных случаев, вероятно, первые проявления представляют собой случайное неврологическое состояние, особенно при синдроме Драве (тяжелая миоклоническая эпилепсия) (Menkes и Kinsbourne 1990; глава 15), который развивается в те же периоды жизни.
Осложнения самого коклюша, вероятней всего, только частично имеют токсическое происхождение и аноксия, вызванная затрудненным кашлем, может играть ведущую роль. Повреждения мозга, преимущественно гипоксического типа, могут возникать в результате гипоксии и повышения венозного давления из-за интенсивного кашля. Кроме этого могут присутствовать распространенные петехии, а иногда субдуральные или спинномозговые эпидуральные гематомы.
По имеющимся данным все-таки отмечается редкая связь между АКДС вакциной и серьезными неврологическими проявлениями, но возможность тяжелых повреждений мозга не была убедительно продемонстрирована.
4. Реакции на другие вакцинации. Вакцинация против гриппа была связана с развитием в США синдрома Гийена-Барре (Fenichel, 1994), появляющимся через 5-16 недель после введения вакцины. Эта взаимосвязь была, однако, спорной.
Sunaga et al. (1995) сообщали о мозжечковой атаксии после вакцинации против ветряной оспы.
Известны случаи возникновения осложнений при назначении оригинальной вакцины Пастера против бешенства в форме ОДЭМ и асептического менингита. Они стали редкостью при появлении современных вакцин, изготовленных на основе диплоидных клеток человека (Hemachudha et al., 1987, 1988; Fenichel, 1994). Им приписывают развитие иммунологического ответа против нечеловеческой нервной ткани, использующейся при изготовлении вакцины и не встречающейся с применяемыми в настоящее время диплоидными клетками человека.
Вакцинация против оспы как причина неврологических нарушений сегодня имеет лишь исторический интерес.
При иммунизации против гепатита В предполагалось его участие в индуцировании некоторых, возможно, аутоиммунных состояний, включая PC и оптический неврит, или в провоцировании обострений. Это вызвало определенное волнение, и споры не завершились и по сей день. Возможная молекулярная мимикрия НВ антигенов одного или нескольких ЦНС белков или неспецифическая активация аутореактивных лимфоцитов (Gout, 2001) может придать некоторое правдоподобие этой гипотезе (Geier и Geier, 2004). При обзоре эпидемиологических данных не удалось найти доказательств связи между заболеванием и вакцинацией (Duclos, 2003; Mikaeloff et al., 2007).
Среди клинических проявлений отмечают гипотонию, отставание в двигательном и психомоторном развитии, а в некоторых случаях общие симптомы, предполагающие митохондриальное заболевание (Rivas et al., 2005). Состояние предположительно возникает в связи с неадекватной реакцией на алюминий-содержащие компоненты отдельных вакцин.
в) Сывороточная болезнь. Введение лечебной сыворотки может вызвать неврологические проявления. Некоторые сыворотки чаще были причиной осложнений, чем другие. Столбнячный анатоксин — наиболее распространенный инициирующий фактор, что может быть связано с более частым его применением.
Симптомы обычно развиваются через 5-12 дней после введения сыворотки. Наиболее характерным признаком является нейропатия плечевого сплетения в сопровождении менингеального раздражения, часто присутствуют системные признаки, включая лихорадку, зуд, крапивницу и рвоту. В иных случаях картина представлена только невритом. В редких случаях выявляются мозговая симптоматика, такая как головная боль, волнение, отек сосочка зрительного нерва и очаговый дефицит.
Прогноз в целом благоприятный, с выздоровлением в течение недель или месяцев. Общемозговые симптомы исчезают в течение нескольких дней или, в крайнем случае, недель.
Сывороточная болезнь в настоящее время встречается редко, поскольку животные сыворотки практически не применяют.
г) Другие случаи аллергического происхождения. Аллергические реакции, затрагивающие нервную систему, могут встречаться при разнообразных преципитирующих процессах. Укусы ос и пчел, также как других насекомых, могут вызвать повреждение центральной или периферической нервной системы (Means et al., 1973).
Читайте также:



