Сыворотка против вирусной диареи крс
Обновлено: 25.04.2024
Ротавирусная инфекция крупного рогатого скота. Возбудитель ротавирусной инфекции.
Ротавирусная инфекция крупного рогатого скота (РВИК) — широко распространена во всем мире. Инфекция клинически проявляется только у телят в виде рецидивирующей диареи. Заболеваемость может достигать 90%, смертность -5—25%. Ротавирусу крупного рогатого скота присуща значительная вариабельность вирулентности и антигенности. Известно три серотипа возбудителя и, кроме того, у крупного рогатого скота выявлены антитела к трем серотипам ротавируса человека.
Отмечено, что в естественных условиях ротавирусная диарея у телят протекает гораздо тяжелее, чем при экспериментальном заражении. В эволюции естественного заболевания, по-видимому, участвуют и другие факторы. При экспериментальном заражении телят большой дозой культурального вируса выявлено явление аутоинтерференции. Ротавирус размножается в дифференцированных эпителиальных клетках ворсинок (в апикальной части ворсинок) всего тонкого отдела кишечника. Слизистая оболочка тонкого отдела кишечника не повреждается. Поражение эритроцитов приводило к нарушению пищеварительной и всасывающей функции кишечника. На вершинах ворсинок происходили ускоренная миграция и преждевременное слущивание энтероцитов. Ускоренная регенерация поверхности апикальной части ворсинок за счет незрелых, резистентных к вирусной инфекции эпителиальных клеток из крипт являлась причиной нарушенного пищеварения уже после окончания инфекционного процесса. В дальнейшем происходит восстановление нормальной структуры ворсинок и пищеварения. Вирус в фекалиях появляется через 1 —2 дня после заражения и выделяется в течение месяца. ВНА появляются в крови на 7-й день и достигают максимума через четыре недели после заражения. У некоторых телят спустя 2 месяца после выздоровления выделение вируса повторялось 2—3 раза. Иногда выделенные от одних и тех же телят штаммы отличались между собой. По-видимому, это было результатом реинфицирования одних и тех же телят разными штаммами или связано с антигенным дрейфом вируса в процессе персистентной инфекции. С другой стороны, стабильность отдельных серотипов, циркулирующих на фермах, сохранялась в течение года. Только на одной ферме выявлена инфекция двумя антигенно различными возбудителями. Заражение разными серотипами ротавируса крупного рогатого скота не сопровождается перекрестной защитой. Реинфекция телят даже через четыре недели после перенесенной диареи другим серотипом вируса приводит к повторному заболеванию.
Кроме существования известных серотипов вируса, не исключается возможность циркуляции атипичных ротавирусов (параротавирусов) крупного рогатого скота, что значительно затрудняет решение и без того сложной проблемы специфической профилактики ротавирусной диареи телят.
Наряду с системным иммунным ответом при ротавирусной диарее телят важную роль играет местный кишечный иммунитет. Антитела в тощей кишке появились через 3— 12, а в фекалиях — через 4-18 дней после инфицирования телят ротавирусом. В содержимом тощей кишки выявили антитела классов IgA, IgG и IgM. У большинства телят преобладали антитела изотипа IgG.

Предполагают, что иммунная система крупного рогатого скота распознает нейтрализующие антигены, общие для разных ротавирусов. Например, повторная иммунизация коров одним из четырех серотипов ротавируса человека, ротавирусом обезьян или крупного рогатого скота ведет к индукции нейтрализующей активности против всех указанных ротавирусов. При этом отмечается повышение в 10—100 раз нейтрализующей ротавирусы активности в молоке в первые восемь дней. Молоко коров, гипериммунизированных ротавирусами животных, может быть использовано для пассивной пероральной иммунизации детей. Гомо- и гетерологичная защита телят через молозиво и молоко бустеризированных коров представляется более надежной, чем вакцинация самих телят. Кормление телят молозивом от матерей, ранее иммунизированных инактивированной вакциной, может предотвратить появление диареи новорожденных.
Изучение защиты при перекрестном заражении телят различными ротавирусами крупного рогатого скота показало, что одни штаммы обладают гомологичной и гетерологичной защитой, другие только гомологичной, третьи — никакой, хотя индуцируют образование гомо- и гетерологичных гуморальных ВН-анти-тел. Титр копроантител существенно повышался после заражения телят вторым вирусом. Высказано предположение, что перекрестная защитная активность разных штаммов (серотипов) ротавируса у телят обусловлена не ВН-антителами, а другими невыясненными факторами.
Специфическая профилактика ротавирусной инфекции крупного рогатого скота находится в стадии разработки и испытания. Создаются и проверяются живые и инактивированные вакцины. Аттенуированные штаммы получают серийным пассированием вируса в чувствительных культурах клеток. Необходимую степень атгенуации достигали после 114 пассажей в культуре клеток почки телят при 37 "С. Живую комбинированную вакцину против рота- и коронавирусной инфекции вводили телятам перорально в первые часы жизни. Через шесть дней такая вакцинация телят при отсутствии специфических антител в молоке матерей создавала устойчивость к заражению вирулентными штаммами рота- и коронавирусов. Однако при наличии антител в молозиве эффективность вакцинации снижалась.
В специфической профилактике ротавирусной инфекции крупного рогатого скота предпочтение, как правило, отдается разработке инактивированных вакцин и способам их применения. За небольшим исключением применение таких вакцин сопровождалось в различной степени положительным эффектом.
Культуральную инактивированную эмульгированную вакцину вводили коровам двукратно в область подгрудка по 10 мл за месяц до отела и перед самым отелом. Иммунное молоко собирали с 3-го по 24-й день лактации и хранили при -20°С. Аналогичные результаты получены от коров, привитых двукратно инактивированной вакциной за 40 и 20 дней до отела. В результате вакцинации у стельных коров приблизительно в 10 раз повышался титр специфических антител в молозиве и молоке. Скармливание таких препаратов защищало телят от заболевания и снижало экскрецию ротавируса в случае инфицирования.
Комбинированную вакцину готовили из рота- и коронавирусов крупного рогатого скота, инактивированных БПЛ, и вводили коровам подкожно дважды по 5 мл с интервалом 21 день. Вакцинация сопровождалась нарастанием титра сывороточных антител, который достигал максимума спустя 3—4 недели, а затем постепенно снижался. Однако испытание такой вакцины в полевых условиях не дало положительного эффекта. Инактивированную вакцину против рота-вирусной инфекции готовили с различными адъювантами. Коров вакцинировали двукратно подкожно в конце стельности. Наиболее высокие титры антител и наиболее продолжительную их секрецию с молоком наблюдали после введения вакцины, содержащей ГОА и сапонин в качестве адъюванта. Титр специфических антител в молозиве после вакцинации увеличился в 10—12 раз. Вакцинация коров таким препаратом за 1—3 мес. до отела в значительной степени предохраняла телят от ротавирусной инфекции. Аналогичные данные получены при вакцинации стельных коров эмульгированной вакциной против рота- и коронавирусной инфекций.
Живую вакцину из аттенуированных штаммов рота- и коронавирусов крупного рогатого скота вводили стельным коровам в заднюю четверть вымени в дозе 2 мл. У родившихся от них телят в 2 и более раз снижались случаи и продолжительность диарей по сравнению с контрольными группами животных. Вакцинация телят в суточном возрасте дала сходные результаты.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
04.09.2020
Повышение сохранности телят с помощью гипериммунных сывороток
Высокая заболеваемость телят первого месяца жизни на предприятиях промышленного типа регистрируется преимущественно от ассоциированных инфекций, обусловленных двумя и более возбудителями вирусной и бактериальной этиологии. Как правило, заболевание протекает в виде энзоотических вспышек, с поражением желудочно-кишечного и респираторного трактов.
Возникновение и развитие инфекционного процесса обусловлены высокой концентрацией поголовья скота, латентным персистированием возбудителей в организме взрослого поголовья (коров/нетелей), впоследствии вызывающих острое течение заболевания у новорожденных телят.
Антитела, полученные с молозивом, обеспечивают защиту телят от заболеваний до тех пор, пока у них не разовьются собственные механизмы иммунитета. Недостаточный уровень резистентности телят может являться одной из причин высокой заболеваемости и как следствие смертности.
Новорожденный теленок абсолютно беззащитен, с практически стерильным желудочно-кишечным трактом, и потому восприимчив к различным заболеваниям. С первым глотком воздуха, а также через ротовую полость в организм попадают микроорганизмы, в том числе возбудители в комбинации вирус + вирус, вирус + бактерии, вызывая смешанную инфекцию.
При этом активная иммунизация в раннем возрасте малоэффективна, так как имеющиеся у телят колостральные антитела блокируют вакцинные антигены, тем самым препятствуя формированию напряженного иммунитета, зачастую усугубляя инфекционный процесс. Использование живых вакцин может вызывать иммунодепрессивное состояние и поствакцинальную болезнь.
Таким образом, эффективными средствами иммунопрофилактики являются лечебно-профилактические иммунологические препараты, содержащие готовые антитела к возбудителям заболеваний и их токсинам. При введении иммунных сывороток в организм теленка развивается пассивный иммунитет.
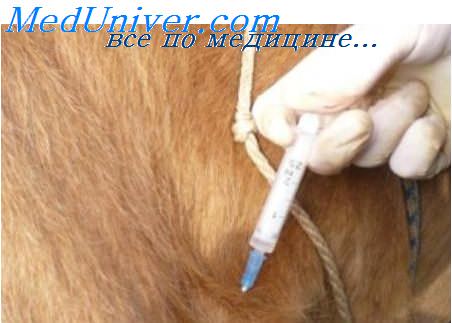
Трехкратное применение сыворотки в дозе 20 мл подкожно на голову способствует формированию у теленка пассивного иммунитета продолжительностью до 14 дней с момента последней инъекции (рис. 1).

Для достижения максимального эффекта первое введение сыворотки необходимо произвести не позднее 3 часов после рождения теленка. Перед введением сыворотку тщательно встряхивают и подогревают на водяной бане до 36–37°С.

Для экстренного создания иммунитета против смешанных форм респираторно-кишечных инфекций — пневмоэнтеритов используют сывороточный иммунный препарат ИММУНОСЕРУМ. Сыворотка ИММУНОСЕРУМ содержит антитела против вирусов парагриппа-3, инфекционного ринотрахеита, диареи — болезни слизистых, рота-, корона- и аденовируса крупного рогатого скота, являющихся основными возбудителями кишечных и респираторных болезней телят.


Острые вспышки заболевания регистрируются очень редко и проявляются чаще в виде респираторного синдрома. В этих случаях вирус проявляет своё иммуносупрессивное свойство, что приводит к провоцированию и усилению клинического течения других (в том числе и вирусных) болезней.
Заболевание широко распространено на территории Урала и Сибири, однако уровень инфицированности скота в областях различен. Возможно, это связано с наличием или отсутствием вирусологических исследований в них. Наибольшее распространение заболевание имеет в крупных хозяйствах с интенсивным типом ведения животноводства, где сохранено поголовье, активно проводится искусственное осеменение и т.д. Особенно это касается племенных хозяйств.
Вирусная диарея (Diarrhea viralis bovum) – контагиозное заболевание крупного рогатого скота, проявляющееся сильной депрессией, гиперимией, изъявлением слизистых оболочек пищеварительного тракта и дыхательных путей, повышением температуры тела, диареей, ринитом и конъюктивитом. Восприимчив скот различных возрастных групп, однако тяжелее всего болеет молодняк в возрасте от 3 до 12 месяцев.
05.07.13 г. произвели взятие крови у 98 животных, в дальнейшем получены парные сыворотки крови и отправлены для исследования в краевую ветеринарную лабораторию г.Красноярска.
05.07.13 г. для всех животных применили поливалентную гипериммунную сыворотку против вирусной диареи, сальмонеллеза, колибактериоза, пастереллёза, парагриппа – 3, инфекционного ринотрахеита, короновирусной инфекции крупного рогатого скота.
Основные патологические изменения в пищеварительном тракте.
Содержимое всех отделов кишечника слизисто-водянистое, с примесью слизи и крови, зловонное. Тонкий кишечник местами катарально, геморрагически воспалён, с наличием язв серо-жёлтого цвета, слизь жёлто-зелёного цвета. Толстый отдел кишечника очагово гиперемирован и воспалён.
Брызжеечные лимфатические узлы увеличены, сочны. Печень тёмно-вишнёвого цвета, увеличена, с очагами некроза величиной с горошину белого цвета. Желчный пузырь воспалён, увеличен, слизистая с точечными кровоизлияниями. Желчь густая тёмно-зелёного цвета. Почки увеличены в объёме, отёчны, дряблой консистенции. Мочевой пузырь наполнен жидкостью соломенного цвета, слизистая – с кровоизлияниями.
С лечебной целью применили поливалентную гипериммунную сыворотку против сальмонеллёза, колибактериоза, пастереллёза, диплококкоза, вирусной диареи, парагриппа – 3, инфекционного ринотрахеита, короновирусной инфекции крупного рогатого скота. Препарат вводили внутримышечно молодняку по 30-40 мл., взрослому крупному рогатому скоту по 50-60 мл. Иммунитет у привитых сывороткой животных длился 10-14 суток. Для подавления секундарной микрофлоры использовали антибиотики и сульфаниламидные препараты.
Биомицин внутрь 2-3 раза в день по 0,02 г/кг в течение 5 дней. Внутримышечно стрептомицин 3-5 тыс. ЕД на 1 кг. массы животного 5-7 дней. Перорально левомицитин 10-20 тыс. ЕД применяют препарат 2 раза в день 5-7 дней. Также использовали ихтиол в дозе 5-10 г в 100-200 мл. воды в течение 3-4 дней.
В рацион ввели витамины, увеличили дачу щелочных кормов (костную золу и муку), корнеклубнеплоды, корма содержащие сахар, глюкозу.
Клинически здоровым животным в рацион также ввели витамины, увеличили дачу щелочных кормов (костную золу или муку), корнеклубнеплоды, корма содержащие сахар.
Вирусная диарея-болезнь слизистых оболочек крупного рогатого скота (историческая справка, характеристика возбудителя, особенности эпизоотологии, клиническое проявление и экономическое значение): Рекомендации / РАСХН, Сиб. отд-ние, ГНУ ИЭВСиДВ.- Новосибирск, 2006.
Наставление по применению сыворотки против ИРТ, ПГ-3, вирусной диарей, сальмонеллёза, пастереллёза, диплококкоза, короновирусной инфекции крупного рогатого скота.
Инфекционные болезни молодняка сельскохозяйственных животных. А.Н. Куриленко, В.Л. Крупальник – М.: Колос, 2001.
Вакцины от инфекционного ринотрахеита. Методика вакцинации от ринотрахеита.
В качестве живой вакцины предложен дефектный по тимидинкиназе (ТК-) мутант. Интраназальное и внутримышечное введение вакцины телятам не вызывало развития у них признаков болезни, но способствовало образованию нейтрализующих антител и устойчивости к последующему интраназальному заражению вирулентным штаммом вируса, снижало его репродукцию в слизистой носа. Вакцинный (ТК-) штамм способен персистировать в организме привитых телят не менее 3 мес. и передаваться телятам при контакте без перехода в ТК+ генотип.
Персистенция и экскреция аттенуированного штамма вируса обнаружена также при применении других живых вакцин. Особенно часто и длительно вакцинный штамм вируса выделяется с семенной жидкостью привитых быков. Введение живой вакцины во время астрального периода может сопровождаться поражением яичников, а вакцинация в ранний период стельности — к прерыванию беременности.
При интраназальном введении вакцинный вирус быстро проникает в клетки верхних дыхательных путей и глоточного кольца. Размножаясь в указанных клетках, вирус может выделяться во внешнюю среду в течение двух недель. После парентерального введения вакцинный вирус из секретов выделяется не всегда и с трудом.
Преимущество интраназальной вакцинации состоит в том, что при этом усиливается синтез IgA и локальное образование интерферона. Считается, что сухая вакцина для парентерального или интраназального применения должна содержать соответственно 105 и 104 ТЦД50/мл. Наряду с живыми вакцинами применяют инактивированные, обладающие рядом преимуществ, хотя их изготовление связано с дополнительными затратами. Инактивированные вакцины так же, как и живые, применяют двукратно с 2—3-недельным интервалом. Они могут существовать в виде моно- и комбинированных препаратов. Эффективность инактивированных вакцин против ИРТ зависит от ряда факторов, и прежде всего от концентрации протективных адъювантов.
Различные способы инактивации вируса оказывали неодинаковое влияние на антигенные детерминанты — мишени вируснейтрализующих антител. По степени разрушения антигенных детерминант инактиваторы располагались следующим образом: ультрафиолетовое облучение, нагревание (56°С), пропиолактон и формальдегид. Согласно этим данным последнему должно отдаваться предпочтение при изготовлении инактивированной вакцины. С целью повышения иммуногенности вакцины вирусные антигены концентрировали полиэтиленгликолем.
Инактивированная формолвакцина с масляным адъювантом из вируса ИРТ с исходным титром 10 8 ТЦД50/мл после двукратного введения в дозе 2 мл с 4-недельным интервалом индуцировала у телят выраженный иммунитет независимо от предшествующего иммунного фона. У телят, перенесших спонтанную инфекцию с низким титром сывороточных и отсутствием секреторных антител, после вакцинации формировались гуморальные (1:128 - 1:256) и секреторные (1:2—1:8) антитела. Наблюдалась корреляция между уровнем сывороточных антител и устойчивостью телят к заражению. Иммуносупрессия дексаметазоном показала, что вакцинация серонегативных телят не предупреждала от инфицирования и последующей латенции вируса.
Инактивированные вакцины против ринотрахеита и ПГ-3 оказались эффективными при испытании в производственных условиях. Вакцинальный иммунитет у телят развивался, несмотря на высокий уровень колостральных антител. Иммуногенность субъединичной и инактивированной вакцин с масляным адъювантом оказалась сходной. Титр гуморальных антител у крупного рогатого скота после однократного и двукратного применения субъединичной вакцины был выше, чем при вакцинации инактивированной вакциной. Секреторные антитела формировались лишь после двукратной вакцинации и были равнозначными у животных, привитых обоими препаратами. Через 14 дней после второй прививки телята были устойчивы к интраназальному заражению вирулентным штаммом вируса ИРТ. Интенсивность размножения и продолжительность экскреции вирулентного штамма у животных, вакцинированных обеими вакцинами, были сходными. Иммунизированные телята выделяли меньше вируса и менее продолжительное время, чем непривитые.
Считают, что двукратное введение инактивированной вакцины сообщает привитым животным иммунитет продолжительностью 2 года. Имеется хороший опыт сочетанного применения живой и инактивированной вакцины ИРТ и ФРГ. Живую вакцину вводили двукратно с интервалом в 6 недель сразу после установления диагноза. Спустя 7 мес. двукратно с тем же интервалом вводили инактивированную вакцину. В результате такой вакцинопрофилактики новые случаи заболевания не регистрировали. Спустя четыре года после прекращения вакцинации животные оказались серонегативными, за исключением некоторых телят, имевших материнские антитела перед вакцинацией. Авторы оценивают предложенную схему применения живой и инактивированной вакцины как эффективную для оздоровления поголовья. Комбинированная инактивированная вакцина, включающая высокоактивные антигены вирусов ИРТ, вирусной диареи и парагриппа-3, оказалась эффективным средством профилактики массовых патологических состояний, в том числе связанных с транспортировкой скота.
Испытание иммуногенности маркированной делеционной (gE) вакцины против ГВ-1 КРС на телятах показало, что внутримышечная или назальная иммунизация полностью не защищают от латентного инфицирования вирулентным штаммом гомологичности вируса. Инактивированная маркированная вакцина против ИРТ из негативного по гликопротеину Е штамма позволяла дифференцировать вакцинированных и инфицированных животных. Иммуногенность вакцины зависела от концентрации вирусного антигена.
Таким образом, существующие средства вакцинопрофилактики защищают крупный рогатый скот от инфекционного ринотрахеита, но не от заражения полевым вирусом, установления его латенции и последующей реактивации, реэкскреции. Однако живые вакцины при интраназально-внутримышечном применении обусловливают хороший локальный иммунитет и защиту животных от клинического проявления инфекции. Инактивированные высокоантигенные вакцины после повторного введения также индуцируют локальный иммунитет и предотвращают распространение вируса. Перспективным является разработка высокоэффективных рекомбинантных субъединичных вакцин, основанных главным образом на иммуногенности одного из главных гликопротеинов оболочки вириона, особенно гликопротеина Д. Этот гликопротеин может быть экспрессирован в бакуловирусной системе или включен в геном векторного вируса и использован в качестве живой вакцины.
Многие европейские страны для искоренения болезни используют интегрированную программу, включающую иммунизацию маркированными вакцинами, выявление и убой всех животных, имеющих антитела на полевой вирус.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусная диарея. Болезнь слизистых крупного рогатого скота.
Вирусная диарея (ВД), или болезнь слизистых крупного рогатого скота вызывается одним вирусом. Острое течение болезни называют вирусная диарея; хроническое течение, связанное с персистентной инфекцией, называют болезнь слизистых. Заболевание крупного рогатого скота и других жвачных, характеризующееся неяркими клиническими признаками, главными из которых являются диарея и поражение слизистых оболочек желудочно-кишечного тракта. В естественных условиях к заболеванию восприимчивы также буйволы и олени.
Восприимчивы животные всех возрастов, но чаще болеют животные в возрасте 8—24 месяца. Уровень материнских антител у телят исчезает к 3—8 месяцам, и они могут быть инфицированы. Заболевание у телят может осложняться вторичными респираторными и кишечными инфекциями. Вирус патогенен для овец, коз и диких жвачных.
Вирус распространен во всем мире. Антитела к нему выявляются в сыворотке крови у 50—90% КРС. У взрослого крупного рогатого скота инфекция может протекать субклинически. Несмотря на то, что инфицирование чувствительных взрослых коров обычно имеет небольшие последствия, передача вируса плодам происходит с высокой частотой. Результат такого заражения зависит от возраста (иммунологической зрелости плода) и от штамма вируса. В большинстве случаев инфицирование плодов происходит в первые 40 дней беременности и сопровождается гибелью эмбриона, его рассасыванием, мумификацией плода или абортом. Заражение коров при осеменении может вызывать раннюю гибель эмбрионов.
Инфицирование на 80—120 день беременности (перед развитием иммунологической компетентности плода — около 125 дней) часто сопровождается нарушениями развития, гибелью плода или рождением потомства с низкой массой тела. Телята, инфицированные трансплацентарно, остаются инфицированными на всю жизнь. Они выделяют вирус, оставаясь серонегативными.
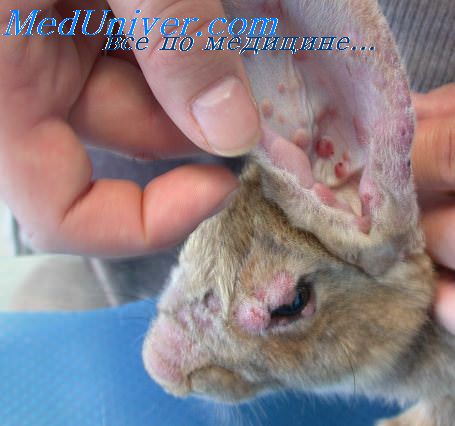
Эмбрионы, инфицированные после 125 дней беременности, обычно выживают, у них могут быть патологические изменения. Они образуют ВНА и освобождаются от вируса.
Различают два биотипа вируса диареи крупного рогатого скота: цитопатогенный и нецитопатогенный (биотипы I и II). Все цитопатегенные и нецитопатогенные изоляты вируса ВД обладают общим антигеном, который несет основной эпитоп нейтрализации. У цитопатогенного биотипа вируса диареи крупного рогатого скота в области ггна неструктурного белка р 125 обнаружена вставка, напоминающая последовательность, кодирующую убиквитин. Полагают, что она приобретается в результате рекомбинации вирусного и клеточного геномов и сообщает вирусу цитопатогенные свойства.
Нецитопатогенный биотип вызывает латентную персистентную инфекцию крупного рогатого скота без образования антител, что предрасполагает к развитию тяжелого клинического заболевания после заражения цитопатогенными биотипами вируса ВД. Предложена гипотеза, согласно которой для проявления клинически выраженной ВД требуется персистентная инфекция нецитопатогенным, а затем и цитопатогенным биотипом вируса диареи. Персистентное инфицирование нецитопатогенный биотипом происходит при первичном появлении инфекции в стаде или при трансплацетарном заражении плода до развития иммунокомпетентности (первые 125 дней стельности). Если в постнатальный период жизни такие животные суперинфицируются цитопатогенными биотипами вируса, то это приводит к появлению клинически выраженной болезни, что обычно сопровождается гибелью.
Цитопатогенные штаммы вируса попадают в организм персистентно инфицированных животных извне или в результате превращения эндогенного нецитопатогенного биотипа вируса в цитопатогенный биотип.
Первоначально нецитопатогенный вирус заражает плод и приводит к развитию персистентной виремии у телят. Болезнь слизистых оболочек у таких телят может возникнуть при супериинфицировании эндогенным цитопатогенным вирусом, образовавшимся в результате мутации или включения клеточных последовательностей в геном вируса в результате рекомбинации. В конечном счете генетические модификации вируса сказываются на продукции вирусного белка, который ответственен за цитопатогенность в культуре клеток и болезни слизистых у телят, которые иммуннотолерантны к нецитопатогенному биотипу вируса.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

