Т киллеры и вирус
Обновлено: 18.04.2024
СD8 + -лимфоциты. Мембранные Аг CD8 экспрессируют субпопуляции Т-клеток, разделяемые на регуляторные (супрессоры) и эффекторные (цитотоксические Т-лимфоциты).
Т супрессоры.
Т-супрессоры [от англ. to supress, подавлять) регулируют интенсивность иммунного ответа, подавляя активность СD4 + -клеток. Т-супрессоры предотвращают развитие аутоиммунных реакций, защищают организм от нежелательных последствий иммунных реакций. Эти клетки обеспечивают толерантность матери к чужеродным Аг, представленным на клетках вынашиваемого плода. Это даёт возможность развиваться чужеродному в иммунном отношении плоду в организме матери. Т-супрессоры дифференцируются из предшественников в результате антигенной стимуляции. По-видимому, активация супрессоров находится вне контроля МНС, и представления Аг макрофагом не требуется. Аутоантигены могут стимулировать развитие ауторегуляторных Т-супрессоров.
Чужеродные Аг в неиммуногенной форме (гаптены) или иммуногенные Аг в очень высокой концентрации также способны индуцировать специфическую супрессорную активность клеток. После распознавания Аг зрелые лимфоциты препятствуют развитию иммунного ответа, действуя непосредственно на клетки или секретируя супрессорные факторы.
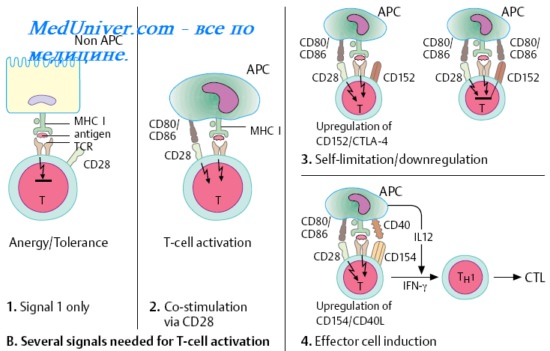
Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров.
Цитотоксические Т-лимфоциты (ЦТЛ), или Т-киллеры [от англ. to kill, убивать] лизируют клетки-мишени, несущие чужеродные или видоизменённые аутоантигены (например, клетки опухолей, трансплантатов, инфицированные вирусами, клетки, несущие поверхностные вирусные Аг). В большинстве случаев функция ЦТЛ также МНС-рестригирована — цитотоксические Т-лимфоциты распознаёт чужеродный вирусный, опухолевый или трансплантационный Аг в комплексе с молекулой МНС I на мембране клетки-мишени. Индукция цитотоксических свойств клетки-предшественницы Т-киллера происходит под действием двух сигналов.
Первый сигнал включает взаимодействие между двумя комплексами: поверхностной молекулой CD8 лимфоцита и комплексом эпитоп-молекула МНС I на клетке-мишени. Второй сигнал — ИЛ, секретируемые близлежащими макрофагами и Т-клетками. Т-хелпер играет ключевую роль в стимуляции цитотоксических Т-лимфоцитов в качестве источника необходимых цитокинов, усиливающих их пролиферацию и созревание до функционально активных ЦТЛ.
Цитотоксический эффект Т-киллеров реализуется через образование в клетках-мишенях пор под действием особых белков — перфоринов. Нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки.
Т-клетки памяти
Т-клетки памяти образуются при первичном иммунном ответе. Специфически распознают Аг и участвуют в иммунном ответе при вторичном попадании Аг. Большинство клеток памяти обладает функциями Т-клеток, экспрессируют CD4 и рестригированы по молекулам МНС II, то есть узнают Аг только на Аг-представляющих клетках в связи с молекулой МНС II.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Обзор
Т-клеточный стартап TScan Therapeutics начал коллаборацию с компанией Qiagen для разработки теста на Т-клеточный иммунитет к COVID-19
Автор
Редакторы

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Вакцинация от коронавирусной инфекции SARS-CoV-2 — одна из самых горячих тем на границе 2020 и 2021 гг. Не утихают споры о безопасности вакцин, разработанных в сжатые сроки, о принципах производства и об основных принципах иммуногенности. Много спорят и о том, стоит ли добровольно прививаться тем, кто уже успел переболеть COVID-19, или, по крайней мере, подозревает об этом. Достаточно ли привиться один раз, а если вирус будет мутировать, как действовать дальше? Достаточно ли переболеть один раз или стоит бояться заболеть одной и той же инфекцией раз в сезон?
Увидеть адаптивный иммунитет
Запоминает инфекцию только адаптивный иммунитет: В-клетки и Т-клетки . Врожденный иммунитет имеет очень общие представления о типах инфекций, с которыми приходится бороться организму, и эти абстрактные, туманные представления выражаются в ограниченном наборе рецепторов в иммунных и эпителиальных клетках. Запомнить и различить разные типы вируса гриппа врожденный иммунитет не способен. Напротив, Т- и В-клетки заточены именно под задачу различения похожих молекул и выбора оптимальной реакции. И те, и другие формируют клон потомков после первой встречи с инфекцией. Часть клеток-потомков работает и расходуется сразу, другая часть сохраняется в специальных органах иммунной системы, к примеру, в красном костном мозге. Там клетки редко делятся, но могут быстро активироваться при повторном заражении — именно этот феномен называют иммунной памятью.
Чтобы увидеть Т-клетки и В-клетки разных типов, иммунологи чаще всего используют проточную цитометрию (FACS) [4]. Например, если мы хотим увидеть клетки памяти, то крепим флуоресцентную метку на молекулу, присутствующую только на поверхности клеток иммунной памяти, и подсчитываем клетки, пролетающие по одной через лазер и детектор флуоресценции.
Так можно узнать процент клеток, выполняющих определенную функцию, например, весь объем клеток памяти в крови на все прошлые инфекции. Теперь усложним задачу и выделим только клетки памяти на конкретную инфекцию — например, интересующий всех SARS-CoV-2, — как это сделать? Мы можем увидеть недавно активированные клетки среди клеток памяти. Лимфоциты из образца крови пациента смешиваются и инкубируются с молекулами, принадлежащими вирусу, чаще всего, — с очищенными белками, нарезанными на фрагменты. Т- и В-клетки, способные узнать и связать вирусный антиген, активируются, станут активированными эффекторными клетками, и мы сможем их различить среди всей иммунной памяти на FACS-анализе. Такие тесты проводятся в качестве дополнительных научных исследований.
Тест требует не только несколько часов на выделение клеток и их активацию вирусными белками либо пептидами, но и время дорогостоящего специалиста по проточной цитометрии, у которого прибор для FACS всегда работает и настроен, а не простаивает. Сочетание сразу двух факторов приводит к тому, что метод далеко не массовый. Можно представить метод рутинным в нескольких ведущих медицинских центрах, но сложно распространить: на порядки сложнее, чем внедрить регулярное ПЦР-тестирование.
Антитела или Т-лимфоциты
В качестве гораздо более дешевого и доступного теста, чем FACS, иммунологи смотрят не на сами клетки, а на то, что иммунные клетки производят [5]. Вспомним рецепторы, которые служат для решения задачи точного, прочного и выборочного связывания вирусных белков-антигенов. Т-клетки держат рецепторы на поверхности, на клеточной мембране. А вот В-лимфоциты свои уникальные рецепторы синтезируют как в мембранной, так и в растворимой форме — эти растворимые В-клеточные рецепторы и есть антитела. Получается, что вместо флуоресцентных меток и В-клеток памяти можно просто измерить концентрацию антител? Вдобавок, учебник иммунологии рассказывает, что В-клетки формируют память с помощью Т-клеток. Значит ли это, что если антитела есть, то уже произошло формирование памяти: сначала на уровне Т-клеток, затем на уровне В-клеток?
Да, текущие представления об иммунологии человека говорят: высокий уровень антител подразумевает, что Т-клеточный иммунный ответ тоже есть. Тем не менее известны и неклассические механизмы, при которых В-клетки быстро начинают производить антитела (чаще классов IgD, IgM) вне особых зон лимфоузла и при меньшем контроле со стороны Т-клеток. Обратная логика оказывается неверной: Т-клеточная иммунная память не зависит от наличия антител в крови, формируется независимо и сохраняется дольше.
Интуитивно кажется, что было бы отлично сохранять в крови антитела к коронавирусу после вакцинации или инфекции на всю жизнь. Некоторые инфекции формируют такой иммунный ответ, и это коррелирует с иммунной защитой, то есть вероятностью не заболеть при повторном заражении [6]. Но для других инфекций уровень антител в крови достаточно быстро, за несколько месяцев, снижается. Так происходит потому, что за свою жизнь человек встречает сотни тысяч типов вирусов, и производить антитела на все вирусные антигены просто невозможно. Приходится выбирать, происходит конкуренция с защитой от других инфекций, а также конкуренция с антителами, которые нужны для регуляции собственной физиологии организма. Антитела постепенно снижают концентрацию и пропадают из крови, но сохраняются В-клетки памяти, которые смогут вновь производить нужные антитела при необходимости.
Было бы идеально, чтобы организм производил антитела и держал их в оптимальной концентрации в крови не во время повторной болезни, а чуть заранее: до заражения. Именно для этого существуют сезонные ревакцинации: небольшая бустерная доза антигена поступает заранее и через 9–14 дней иммунитет снова подготовлен к сезонному контакту с большим количеством вирусных частиц вокруг. А постоянное, круглогодичное производство антител на высоком уровне можно оставить тем В-лимфоцитам, которые действительно каждый день сталкиваются с одними и теми же бактериями и вирусами: например, В-лимфоцитам слизистой ЖКТ, работающим с кишечными симбионтами.
ELISPOT: ИФА для Т-клеток?

Рисунок 1. Схема работы теста ELISPOT, определяющего активацию Т-лимфоцитов при взаимодействии с антигенами нового коронавируса SARS-CoV-2
[11], рисунок с изменениями
Поиск коронавирусных Т-клеток. Инновация TScan
ELISPOT используется во всех лабораториях, которые исследуют иммунитет человека. Метод ELISPOT и его модификации на пересекающихся пулах пептидов (наборах фрагментов, на которые нарезается белковый антиген) использовались в исследованиях эффективности вакцин от ВИЧ, и позже медленно распространились на исследования и других вакцин. В диагностических лабораториях метод стал популярен потому, что для более точной диагностики туберкулеза необходимо оценивать Т-клеточный иммунный ответ. Коммерческий тест получил название T-SPOT. Кроме туберкулеза, для других инфекций аналогичная диагностика не применялась — до 2020 года и кризиса, вызванного новой коронавирусной инфекцией SARS-CoV-2. Необходимость широкой диагностики самой инфекции и иммунной памяти к ней подтолкнула одновременно исследователей и производителей диагностических тестов к разработке новых методов и оптимизации старых и привычных. Интерес к быстрому и дешевому измерению Т-клеточной памяти растет параллельно с популярными в медиа опасениями, что у переболевших COVID-19 быстро пропадают антитела в крови.
Очень многие академические коллективы, которые работают на стыке биохимии, иммунологии человека и прикладных биотехнологий, весной 2020 года стали заниматься разработками для борьбы с пандемией, в том числе разрабатывать и налаживать диагностику инфекции. Нельзя не упомянуть пример коллектива Григория Ефимова из НМИЦ гематологии в Москве, активно работающий как над диагностикой Т-клеточного иммунитета к новому коронавирусу на основе FACS, так и в коллаборации по созданию одного из ИФА-тестов для определения антител к антигенам SARS-CoV-2 [9], [10]. Тем не менее вернемся к теме масштабируемого производства быстрых ELISPOT-тестов на Т-клеточный иммунитет: откуда берутся такие разработки, тоже из фундаментальных и клинических академических лабораторий?
Первой ELISPOT-тест на ковид (T-SPOT Discovery SARS-CoV-2 assay) выпустила компания Oxford Immunotec, ранее создавшая одну из самых популярных версий теста на туберкулез [11]. Этот тест использует пул разнообразных антигенов коронавируса и активацию Т-клеток в смеси с другими лейкоцитами периферической крови: иначе говоря, дизайн теста даже несколько упрощен по сравнению с тестом на туберкулез (рис. 1).
Куда более интересную модификацию запустил небольшой биотех-стартап под названием TScan Therapeutics. Этот стартап переориентировался на инфекционную иммунологию во время пандемии. Как и многие другие коллективы, к примеру, BioNTech (разработчик вакцины от коронавируса совместно с Pfizer), до пандемии они занимались онкологией и задачей оптимальной активации противоопухолевого иммунитета.
Осенью 2020 года TScan Therapeutics подписали соглашение о совместной разработке диагностического теста ELISPOT-типа с компанией Qiagen — крупнейшим производителем лабораторных реагентов и универсальных наборов для типовых экспериментов в молекулярной и клеточной биологии [12], [13]. Эта диагностика Т-клеточной памяти во многом отличается от версии Oxford Immunotec, и в первую очередь отличается идеологически: оксфордская компания быстро и практично сделала аналог своего существующего продукта-бестселлера, сохранив всю платформу и протокол метода и изменив только антиген. TScan же демонстрирует почти идеальный инновационный подход: вначале провели исследования Т-клеточного иммунитета, опубликовали выводы в престижном журнале Immunity, затем появилась идея для диагностического теста и, наконец, возможность производства в партнерстве с Qiagen.
Обнаружение важнейших участков вируса, вызывающих долгую Т-клеточную память — это поиск иммунодоминантных эпитопов. Если активировать Т-клетки именно такими пептидами, можно существенно повысить качество диагностического теста. Уникальные данные TScan позволяют вычесть фон иммунной памяти на родственные и далекие коронавирусы и поднять специфичность диагностики иммунной памяти. При этом используется платформа, сходная с ELISPOT, что позволяет объединять много образцов и делать тест быстрым и широко доступным. Сейчас исследования Т-клеточного иммунитета при коронавирусе проводится либо в рамках научных исследований, либо на коммерческой основе, но точность и интерпретация теста затруднена, клиент получает результат через 1–2 неделю после теста. Партнерство TScan с Qiagen вселяет оптимизм по поводу доступности теста: ведь продукцией этой компанией пользуются буквально в каждой молекулярной и биохимической лаборатории на планете.

Обзор
Репертуар Т-клеточных рецепторов (TCR) определяет эффективность адаптивного иммунного ответа. Рисунок в оригинальном разрешении.
Автор
Редакторы

Пятерка по системной биологии
В статьях цикла наши авторы пообщаются со стипендиатами разных лет, профессорами и преподавателями Сколтеха, а также с представителями ФМИ.
Т-клеточный рецептор (TCR) — ключевая молекула адаптивного иммунного ответа
Системная иммунология в контексте курения
Чтобы оценить преимущества, связанные с переходом на альтернативные продукты с пониженным риском, важно полностью понимать последствия курения для здоровья. Курение сигарет, выделяющих множество токсикантов, оказывает пагубное воздействие на иммунную систему, и этот эффект лежит в основе развития многих, если не всех, связанных с курением заболеваний. Иммунная система страдает даже у на первый взгляд здоровых курильщиков. Компоненты табачного дыма затрагивают множество клеточных популяций, участвующих в иммунном ответе, включая эндотелиальные и эпителиальные клетки, лимфоциты, макрофаги, нейтрофилы и дендритные клетки [7].
Воспалительная реакция, управляемая иммунной системой, участвует в развитии сердечно-сосудистых заболеваний (ССЗ), хронической обструктивной болезни легких (ХОБЛ) и астмы. Хроническое воздействие сигаретного дыма приводит к развитию симптомов ХОБЛ у части курильщиков: прогрессирующей потери функции легких, разрушению дыхательных путей и альвеол [8]. Иммунные клетки и их лиганды участвуют в воспалительной реакции при ХОБЛ. Нейтрофилы и макрофаги секретируют сериновые протеазы, включая нейтрофильную эластазу, катепсин G и протеиназу-3, а также матриксные металлопротеиназы ММП-8 и ММП-9, которые могут способствовать разрушению альвеол. Дополнительно было показано влияние цитотоксических CD8+ Т-лимфоцитов, Тh1 и Th17 CD4+ клеток, а также В-клеток на продукцию антител при ХОБЛ. Количество CD8+ Т-лимфоцитов в легких существенно возрастает по мере развития болезни. Эти данные говорят о влиянии иммунного ответа на прогрессирование ХОБЛ [9].
Мы надеемся, что понимание влияния сигаретного дыма на кардиореспираторные заболевания позволит оценить потенциал продуктов с пониженным риском для уменьшения побочных эффектов от курения.
Вакцина из табака

В формировании иммунитета, как и в любом сложном биологическом процессе, участвуют по меньшей меры две силы: наследственность человека, запечатленная в его генах, и факторы внешней среды, определяющие особенности индивидуального развития. Чтобы сравнить их относительный вклад, в биологии издавна используется близнецовый метод.
Однако репертуар Т-клеточных рецепторов на первый взгляд не кажется особенно подходящим объектом для изучения таким способом. Перестройка гена ТCR [11] происходит случайно не только в каждом организме, но в каждой отдельной клетке-предшественнице (рис. 1), так что, казалось бы, у близнецов не больше шансов иметь клетки с одинаковыми Т-клеточными рецепторами, чем у любых случайно взятых людей. Однако Михаил Погорелый, стипендиат 2016 года, решил проверить, а так ли это на самом деле?

Дальше исследователи решили проверить, как организмы уже взрослых близнецов реагируют на введение чужеродного антигена.
Рецептор TCR представляет собой гетеродимерный белок, состоящий из двух субъединиц — α и β либо γ и δ, представленных на поверхности клетки (рис. 1). Субъединицы закреплены в мембране и связаны друг с другом дисульфидной связью, α/β вариант рецептора присутствует на подавляющем большинстве Т-лимфоцитов и лучше всего изучен. — Прим. автора статьи.
Михаил продолжает: «Дальше посмотрели на сами эти последовательности. Выяснилось, что:
Из результатов этой работы родилась следующая идея. Поскольку в активном иммунном ответе принимает участие много схожих TCR одновременно, то можно создать алгоритм, который будет по единственному образцу репертуара находить TCR, вовлеченные в текущий иммунный ответ (они часто собраны в кластеры схожих последовательностей). Такой алгоритм был разработан и протестирован в лаборатории. И действительно, оказалось, что он позволяет выявлять клоны, отвечающие на вакцинацию, по единственному анализу репертуара (скажем, через три недели после вакцинации). Это, разумеется, куда дешевле и проще, чем делать множество измерений в разных временных точках с той же целью [14].
Михаил Погорелый о стипендии ФМИ на базе Сколтеха:
Как вы узнали о программе? Какие впечатления от участия в ней?

Рисунок 2. Михаил Погорелый с проектом High throughput sequencing of identical twins TCR repertoires after yellow fever vaccination на отчетном семинаре в научно-исследовательском центре ФМИ в швейцарском городе Невшатель
Чем занимаетесь сейчас, через четыре года после получения стипендии?
Мы продолжаем заниматься мониторингом иммунного ответа на инфекции/вакцинацию с помощью секвенирования репертуаров, но под другими углами: на примере других вирусов (лихорадка Денге, новая коронавирусная инфекция [15]) и с большим числом пациентов.
Эти многоликие Т-лимфоциты


Рисунок 3. Дифференциация Т-лимфоцитов в различные субпопуляции — длительный и сложный процесс, молекулярные механизмы которого изучают иммунологи. Потенциальная способность зрелых Т-лимфоцитов менять свою специализацию (пластичность) является перспективной целью для иммунотерапии различных заболеваний.
иллюстрация Любови Колосовской по данным Софьи Касацкой
Софье удалось показать, что репертуары TCR в популяциях Th17- и Th22-лимфоцитов, играющих важную роль в регуляции аутоиммунных реакций, частично совпадают с репертуаром Th2-клеток, что указывает на тесную связь между этими тремя популяциями. При этом клетки типа Th1-17, обладающие, как это следует из названия, свойствами как Th1, так и Th17-лимфоцитов, имеют общие TCR только с Th1-клетками, но не с Th17. Это позволяет с уверенностью говорить об их происхождении от Th1-лимфоцитов [17]. Так, изучение разнообразия Т-клеточных рецепторов позволяет пролить свет на механизмы пластичности Т-лимфоцитов, понимание которых очень важно, например, при разработке новых видов иммунотерапии.
Особое внимание в проекте уделяется регуляторным Т-клеткам (Treg). Эта популяция Т-лимфоцитов имеет особый путь развития. Их задача в организме — удерживать иммунный ответ в безопасных для организма рамках. Нарушение в активности этих клеток может привести к развитию аутоиммунных заболеваний. Чтобы изучить процесс формирования этой стороны иммунитета, исследователи планируют сравнить TCR-репертуар регуляторных клеток у новорожденных с незрелой иммунной системой, контактировавшей лишь с небольшим числом чужеродных агентов, и у взрослых людей.
Первая статья с результатами по этому проекту уже отправлена в журнал, так что пожелаем Софье скорой и успешной публикации.
Софья Касацкая о стипендии:
Как вы узнали о программе? Какие впечатления от участия в ней?
Я предложила свой проект на конкурс на второй год обучения в аспирантуре: у меня уже были наработки и хорошее понимание проекта, и я знала, что есть такой конкурс, который вместе проводят Philip Morris International и Сколтех. На тот момент мой коллега и соавтор Женя уже получил стипендию на год раньше, с другим проектом.
Стипендия, как и другие гранты, на которые я подавала заявки или которые я выигрывала, устроена довольно безлично: я не получала никакой обратной связи по своему проекту ни по начальной заявке, ни по отчету первого года . Это молчаливый процесс: меня просто уведомляют, что мою стипендию одобрили/продлили, ура. Хотелось бы, конечно, получить обратную связь от экспертов, рекомендации, как улучшить проект. Я была бы рада более плотной работе со стипендиатами, будь то научные семинары, менторские программы, возможность поучаствовать в других научных, лидерских или образовательных инициативах для стипендиатов и бывших стипендиатов.
В этом месте менеджер индустриальных проектов Сколтеха Вера Рыбко отмечает, что обычно обратная связь дается на отчетном семинаре, который не проводился только в 2020 году из-за эпидемиологической обстановки. Этот семинар обязательно возобновится в будущем. — Прим. автора статьи.
Тем, кто планирует участвовать в конкурсе, советую побольше обсуждать план проекта для стипендии перед тем, как подавать заявку. Советы старших коллег и кого-то, кого вы хотели бы видеть своим ментором, могут помочь доработать заявку, сделать ее более реалистичной и хорошо спланировать части исследования по годам выполнения проекта. Может быть, советы даст человек, который не так хорошо знает вашу область науки, как вы, но обладает бóльшим опытом организации, администрирования таких проектов. Лучше пройти несколько итераций такой обратной связи, чем подавать сыроватую заявку, когда вы в себе не уверены.
Что вам дало получение стипендии, что изменило в вашей жизни? Что вы планируете делать после ее завершения?
Мое рабочее время делится между несколькими проектами, к которым добавляется участие в проектах моих коллег и коллабораторов. Только часть этой деятельности связана со стипендией и кандидатской диссертацией. Не могу сказать, что стипендия сильно меняет фокус или режим работы или жизни. Но исследования, использующие высокопроизводительное секвенирование, всегда дорогостоящие, и тут поддержка моих экспериментов Сколтехом и стипендией ФМИ очень ценна: получается покрыть стоимость реагентов на 1–2 запуска прибора в год.
Широкие горизонты системной иммунологии

Рисунок 4. Иван Звягин, с.н.с. отдела геномики адаптивного иммунитета ИБХ РАН и зав. лабораторией механизмов иммунотолерантности НИИ трансляционной медицины РНИМУ им. Н.И. Пирогова
«В современной иммунологии есть интереснейшие направления, где алгоритмы анализа больших “иммунологических” и вообще “биологических” данных играют главенствующую роль, так как на их основе можно создавать инструменты, предсказывающие те или иные иммунологические явления и позволяющие манипулировать иммунным ответом в нужном направлении.
В частности, на данный момент мы плохо понимаем, каким образом в каждом конкретном случае происходит связывание Т-клеточного рецептора с комплексом пептид—МНС (pMHC, peptide-loaded major histocompatibility complex), которое приводит к активации Т-лимфоцитов.
Если мы научимся предсказывать силу связывания TCR с тем или иным pMHC на основе их аминокислотных последовательностей, это позволит понять, чем определяется иммуногенность того или иного антигена. В сочетании со знаниями о закономерностях формирования репертуара распознающих рецепторов, это даст возможность разработать алгоритмы для предсказания оптимальных эпитопов для выработки нужного иммунного ответа против новых инфекций или терапии опухолей, оценки риска распознавания “своего” и рационального дизайна узнающей части рецепторов при совершенствовании способов клеточной терапии (например CAR-T-терапия [19]).
С другой стороны, те же алгоритмы будут задействованы и в направлении создания неиммуногенных вариантов белковых последовательностей, когда это важно — например при генотерапии.
Свое видение будущего системной иммунологии есть и у Джулии Хёнг из ФМИ:
Ключевая задача биологии и иммунологии XXI века состоит в том, чтобы определить, на какие факторы мы должны воздействовать, чтобы перепрограммировать иммунную систему в нужном нам направлении и улучшить здоровье человека при различных воспалительных заболеваниях. Чтобы добиться этой цели, мы должны понимать сложные молекулярные взаимодействия, которые управляют развитием болезни. Системная иммунология позволяет измерять, как различные компоненты иммунной системы изменяются и взаимодействуют во времени и пространстве в ответ на изменение факторов внешней среды или генетические вариации, с целью точного определения ключевых компонентов (молекул, клеток, тканей) и взаимодействий, которые управляют иммунными реакциями. Вычислительный анализ тысяч молекулярных изменений одновременно должен обеспечить понимание иммунных изменений в пораженной ткани [20], [21].
Кроме того, современные проблемы диагностики и лечения заболеваний заключаются в отсутствии биомаркеров, которые можно было бы обнаружить в образцах, взятых неинвазивным путем (кровь, моча и т.д). Воспаленная ткань посылает сигналы в систему кровообращения, когда ситуация обостряется. Однако если бы болезнь можно было обнаружить на ранних стадиях, у нас было бы больше возможностей для вмешательства. В настоящее время неинвазивные (например, из крови, а не из биоптата тканей) биомаркеры, как правило, основаны на отдельных молекулах и плохо работают в ранней диагностике. Но можно надеяться, что вычислительные методы системной иммунологии, позволяющие анализировать тысячи молекул и их взаимодействий одновременно, позволят найти более эффективные решения для ранней диагностики многих заболеваний [22], [23].
В частности, наша группа продемонстрировала потенциал подобного подхода на примере образцов крови курильщиков [24] и при переходе на продукты с пониженным риском [25].
Заключение
Иммунные клетки, как было рассказано выше, проходят сложные пути дифференциации и развития, которые мы пока понимаем лишь отчасти. Чтобы разобраться в фундаментальных механизмах, определяющих разнообразие клеточных популяций в человеческом теле (около 200 типов!), мы должны опуститься еще глубже — с клеточного на молекулярный уровень — и попытаться понять, каким образом организация хроматина в ядрах клеток определяет их способность участвовать в тех или иных сигнальных путях. Этой интереснейшей теме будет посвящена следующая статья нашего цикла.


Острый лимфобластный лейкоз — самое распространенное онкологическое заболевание у маленьких детей (пик заболеваемости приходится на возраст 1–5 лет), которое успешно лечится CAR-T-терапией. При этом заболевании в опухолевые превращаются B-клетки, и для их детекции удобно использовать характерные для них белки вроде СD19 или СD20. Они расположены на поверхности любых зрелых B-клеток, поэтому в норме обычные Т-киллеры приучены игнорировать эти белки (в противном случае возникла бы аутоиммунная реакция, которая привела бы к геноциду В-клеток). Но в случае лейкоза, когда среди В-клеток много злокачественных, их геноцид оказывается оправдан. При этом предковые клетки не страдают, так что в будущем они смогут восстановить популяцию зрелых B-клеток. Кроме того, опухолевые клетки отличаются особенно высокой экспрессией этих белков, поэтому шанс погибнуть в ходе терапии у них выше, чем у здоровых клеток.

CAR-T-терапия выгодно отличается от терапии антителами тем, что Т-клетки размножаются в теле человека и способны самостоятельно поддерживать свою популяцию на протяжении долгого времени. Тем не менее при всех своих плюсах CAR-T не являются панацеей. Пока всего два типа CAR-T одобрены для использования управлением по контролю за продуктами и лекарствами США (Food and Drug Administration). В обоих случаях речь идет только о борьбе со злокачественными В-клетками. Кроме того, свежие данные говорят о том, что этот новый метод может не сработать и тут. Причина этого — в появлении B-клеток с альтернативным сплайсингом гена CD19, которые не узнаются рецептором, или же B-клеток вообще без гена CD19 на поверхности. Такие дефектные клетки могут встречаться в следовых количествах, но в ходе терапии они должны получать огромное преимущество перед другими.

Исследователи пробовали применить эту технологию к солидным опухолям (от англ. solid — твердый), но пока CAR-T работают в них гораздо менее эффективно: для рецепторов сложно подобрать хорошую мишень, а сами Т-клетки там быстро устают (см. картинку дня Истощение Т-лимфоцитов) — например, из-за нехватки кислорода.
Читайте также:

