Тамифлю при орви помогает или только грипп
Обновлено: 24.04.2024
Для цитирования: Ленева И.А. Осельтамивир (Тамифлю) – противовирусный препарат нового поколения: эффективность осельтамивира против вируса гриппа H5N1. РМЖ. 2006;29:2059.
Грипп – заболевание, способное создать чрезвычайные эпидемические ситуации, является одной из самых актуальных медицинских и социально–экономических проблем. В России на грипп и ОРВИ ежегодно приходится до 90% от всех регистрируемых инфекционных заболеваний. Это до 30 млн. больных, из которых 45–60% составляют дети. Кроме того, после каждой эпидемии возрастает число летальных исходов от наиболее частых осложнений гриппозной инфекции – сердечно–сосудистых и легочных заболеваний [1,2,3].
Литература
1. Онищенко Г.Г. Ситуация по заболеваемости гриппом птиц в мире и в Российской Федерации. Совершенствование надзора и контроля за гриппом при подготовке к возможной пандемии. Документы Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
2. Острые респираторные заболевания у детей: лечение и профилактика /Научно–практическая программа Союза педиатров России.–М.: Международный фонд охраны здоровья матери и ребенка. 2002.–69с.
3. Kaiser L., Couch R., Galasso G. et al.. First International Symposium on influenza and other respiratory viruses: summary and overview. Kapalua, Maui, Hawaii, December 4–6, 1998. Antiviral Research.– 1999.– 42.– 149–176.
4. Centers for Disease Control and Prevention. Prevention and Control of Influenza: recommendations of the Advisolry Committee on Immunization Practices (ACIP).MMWR.–2006.–55 (RR–10).–1–42.
5. Hayden F. WHO Guidelines on the Use of Vaccines and Antivirals during Influenza. Annex 5–Considerations for the Use of Antivirals during an Influenza pandemic, Geneva, 2–4 October, 2002.
6. Ершов Ф.И. Антивирусные препараты. Справочник. Гэотар Медицина, Москва. 2006.–312 с.
7. Glushkov R.G. Arbidol. Antiviral, Immunostimulant, Interferon inducer. //Drug of the Future.– 1992.–№. 17–P.1079–1081.
8. Treanor J., Hayden F., Vrooman P. et al., Efficacy and safety of the oral neuraminidase inhibitor oseltamivir in treating acute influenza// JAMA.–2000.– 283.– 1016–1024.
9. F.Aoki, M.Macleod, P.Paggiaro et al., Early administration of oral oseltamivir maximizes the benefits of influenza treatment // Antim. Agents Chem.– 2003.–51.–123–129.
10. Cooper N., Sutton A., Abrams K. et al., Effectiveness of neuraminidase inhibitors in treatment and prevention of influenza A and B : systematic review and meta–analyses of randomized controlled trials // BMJ.– 2003.–26.–1235.
11. Ward P., Small I., Smith J. Oseltamivir (Tamiflu) and its potential for use in the event of an influenza pandemic.// J Antimicrob Chemother.–2005.– 55 Suppl.– 1:i5–i21. Review.
12.Gubareva L.V., Bethell R.C., Hart G.J., еt al. Characterization of mutants of influenza A virus selected with the NA inhibitor 4–guanidino–Neu5Ac2en. // J. Virology.– 1996.–V. 70.–P. 1818–1827.
13.Gubareva L.V., Robinson M.J., Bethell R.C. et al. Catalyc and framework mutations in the neuraminidase active site of influenza viruses that are resistant to 4–guanidino–Neu5Ac2en. // J.Virology.– 1997– V. 71.–P. 3385–3390.
14. McKimm–Breshkin J., Trivedi T., Hampson A., еt al. Neuraminidase sequence analysis and susceptibilities of influenza virus clinical isolates to zanamivir and oseltamivir. // Antimicrob. Agents Chemotherapy.– 2003.– V. 47.–P. 2264–2272.
15. Kiso M., Mitamura K., Sakai–Tagawa Y.et al. Resistant influenza A viruses in children treated with oseltamivir: descriptive study. // Lancet.–2004.– V.364.–P. 759–765.
16..Avian influenza A (H5N1) infection in humans. The writing Committee of the WHO Consultation on human influenza A/H5.// N. Engl. J. Med.– 2005.– V. 353.–P.1374–1385.
17. Le Q., Kiso M., Someya K., еt al. Avian flu: isolation of drug–resistant H5N1 virus // Nature.–2005.–438.–P.754.
18. Claas E.C., Osterhaus A.D., van Beek R., еt al. Human influenza A H5N1 virus related to a highly pathogenic avian influenza virus. // Lancet.– 1998.–V. 351–P. 472–477.
19. De Jong J.C., Claas E.C., Osterhaus A.D.M.E., еt al. A pandemic warning? //Nature.– 1997.–V. 389–P. 554.
20. Subbarao, K., Klimov, A., Katz, J., еt al. 1998. Characterization of an avian influenza A (H5N1) virus isolated from child with fatal respiratory illness. // Science.–V. 279.–P. 393–396.
21. Peiris M., Yuen K.Y., Leung C.W., еt al. Human infection with influenza H9N2. // Lancet.– 1999.–V. 354.–P. 916–917.
22. Tran T.N., Nguyen T.L., Nguyen T.D., еt al. World Organization International Avian Influenza Investigative Team. Avian influenza A ( H5N1) in 10 patients in Vietnam. // N. Engl. J. Med.– 2004.– V. 350.–P.1179–1188.
23..Koopmans M., Wilbrink B., Conyn M., еt al. Transmission of H7N7 avian influenza A virus to human beings during a large outbreak in commercial poultry farms in the Netherlands.//
Lancet.– 2004.–363.–:587–593.
24. Leneva I., Roberts N., Govorkova E., еt al. The neuraminidase inhibitor GS4104 (oseltamivir phosphate) is efficacious against A/Hong Kong/156/97 (H5N1) and A/Hong Kong/1074/99 (H9N2) influenza virus. // Antiviral Research.– 2000.–V. 48. –P. 101–115.
25. Govorkova E.A., Leneva I.A, Goloubeva O.G., еt al. Сomparison of the efficacy of RWJ–270201, zanamivir, and oseltamivir against H5N1, H9N2, and other avian influenza viruses // Antimicrob. Agents and Chemotherapy.– 2001.–V.45.– P. 2723–2732.
26. Yen H., Monto A., Webster R., еt al.// Virulence may determine the necessary duration and dosage of oseltamivir treatment for highly pathogenic A/Vietnam/1203/04 influenza virus in mice.// J.Infect.Diseases.–2005.–192.–P.665–672.
27. De Jong M., Tran T., Truong H et al. Oseltamivir resistance during treatment of influenza A (H5N1) infection. N.Eng.J.Med.–2005.–353.–2667–2672.
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около 50 млн инфекционных заболеваний, из которых до 90% случаев приходится на ОРВИ и грипп.
Почти 90% населения как минимум один раз в году переносят одну из респираторных инфекций вирусной этиологии, что в целом предопределяет высокую заболеваемость и даже влияет на показатель смертности [2].
Столь высокая частота заболеваний респираторного тракта объясняется многообразием этиологических факторов (вирусы гриппа, парагриппа, аденовирусы, риновирусы, реовирусы, респираторно-синцитиальные (РС) вирусы, микоплазмы, хламидии, бактериальные агенты), а также легкостью передачи возбудителя и высокой изменчивостью вирусов.
Дифференциальная диагностика гриппа и ОРВИ затруднена из-за сходства клинической картины этих заболеваний, но вполне возможна. Основными отличиями можно считать начальные признаки заболевания, симптомы интоксикации, характер катаральных явлений и лихорадки, тип развивающихся осложнений и др. Клинический диагноз, подтвержденный данными лабораторных анализов, и определяет выбор терапии.
Клиническая картина ОРВИ и гриппа зависит от вируса-возбудителя (см. таблицу).
Следует отметить, что осложнения при ОРВИ, особенно в период эпидемии, регистрируются в 20–30% случаев. Основными причинами осложнений являются нарушения иммунной защиты, приводящие к длительной недостаточности в работе иммунной системы. Снижение антибактериальной резистентности организма приводит к затяжным периодам реконвалесценции и обусловливает возможность осложнений в течение длительного времени. Особое место среди осложнений занимает так называемый синдром послевирусной астении (СПА), который может развиваться у 65% больных в течение 1 мес от начала заболевания. Ведущими симптомами СПА являются усталость, эмоциональные нарушения и различные психические расстройства.
Круг препаратов, используемых при лечении ОРВИ и гриппа, широк и разнообразен. Он включает живые и инактивированные вакцины, химиопрепараты этиотропного действия, а также средства, применяющиеся для иммунокорригирующей и патогенетической терапии.
Тем не менее течение гриппа и других ОРВИ по-прежнему плохо поддается контролю. Это связано не только с полиэтиологичностью данных заболеваний, но и с уникальной изменчивостью вирусов и глобальным характером эпидемий. Распространение ОРВИ в значительной степени зависит от экологической, социально-экономической ситуации, наличия у пациентов аллергических заболеваний и ряда других факторов.
Противовирусные препараты
Химиопрепараты
Механизм действия этой группы препаратов основан на избирательном подавлении отдельных звеньев репродукции вирусов, без нарушения жизнедеятельности клетки макроорганизма. При респираторных инфекциях используются две группы препаратов — блокаторы М2-каналов и ингибиторы нейроаминидазы, а также рибавирин, активный против РС-вируса.
Блокаторы М2-каналов
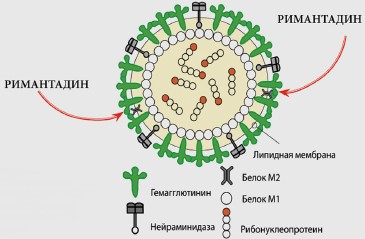
В 1961 г. был синтезирован симметричный амин — амантадин, а затем и ряд его производных (римантадин, мидантан, дейтифорин). В нашей стране получил широкое применение римантадин, который используется для лечения и профилактики гриппа, вызванного вирусом типа А. Эффективность этого средства составляет 70–90%.
Противовирусный эффект реализуется путем блокирования особых ионных каналов (М2) вируса, что сопровождается нарушением его способности проникать в клетки и высвобождать рибонуклеопротеид. Тем самым ингибируется важнейшая стадия репликации вирусов. Примерно в 30% случаев может развиваться резистентность к римантадину [6].
Римантадин выпускается в форме ремантадина в таблетках по 50 мг и сиропа для детей от 1 до 7 лет альгирем—2 мг/мл. С лечебной целью препарат назначается с момента регистрации первых симптомов. Длительность терапии не должна превышать 5 дней во избежание появления резистентных форм вируса. Профилактически римантадин необходимо принимать не менее 2 нед.
Ингибиторы нейроаминидазы
Препараты этой группы эффективны не только против вирусов гриппа типа А, но и против вирусов типа В.
Нейроаминидаза (сиалидаза) — один из ключевых ферментов, участвующих в репликации вирусов гриппа. При ингибировании нейроаминидазы нарушается способность вирусов проникать в здоровые клетки, снижается их устойчивость к защитному действию секрета дыхательных путей и таким образом тормозится дальнейшее распространение вируса в организме. Ингибиторы нейроаминидазы способны уменьшать продукцию цитокинов (ИЛ-1 и фактора некроза опухоли), препятствуя развитию местной воспалительной реакции и ослабляя такие системные проявления вирусной инфекции, как лихорадка, боли в мышцах и суставах, потеря аппетита [7].
Предварительные исследования показали, что эффективность такого ингибитора в качестве профилактического средства составляет 70–80%. Прием этих препаратов позволяет сократить длительность болезни на 1–1,5 дней (если препарат начать принимать не позднее, чем через 36–48 ч с момента появления первых симптомов). В начале заболевания и на ранних его стадиях средняя продолжительность репликации вируса сокращается в среднем на 3 дня, а число тяжелых форм ОРВИ и гриппа, характеризующихся повышенной температурой, — на 85%. Препараты не оказывают вредного воздействия на центральную нервную систему. Однако следует отметить, что далеко не всегда представляется возможность их применения в первые 48 ч: из-за сложностей, связанных с дифференциальной диагностикой гриппа и других ОРВИ.
Представителями ингибиторов нейроаминидазы являются озельтамивир и занамивир.
Озельтамивир (тамифлю) назначается по 75–150 мг 2 раза в день в течение 5 дней. Для профилактики — по 75 мг 1 или 2 раза в день в течение 4–6 нед. У пациентов с клиренсом креатинина менее 30 мл/мин доза снижается в 2 раза.
Занамивир (реленца) является структурным аналогом сиаловой кислоты — естественного субстрата нейроаминидазы вирусов гриппа — и, следовательно, обладает способностью конкурировать с ней за связывание с активным центром. Ингалируется с помощью специального устройства — дискхалера. С лечебной целью назначается по 10 мг 2 раза в день (с интервалом 12 ч) в течение 5 дней, для профилактики — по 10 мг 1 раз в день в течение 4–6 нед. Ингаляционный способ введения имеет преимущество, так как обеспечивает достаточно быстрый противовирусный эффект в зоне первичного очага инфекции.
Побочные реакции данной группы препаратов составляют не более 1,5% случаев. Чаще всего это головная боль, головокружение, тошнота, диарея, явления синусита. У пациентов с обструктивными бронхолегочными заболеваниями возможно развитие бронхоспазма.
Препараты, активные против других вирусов
Рибавирин (виразол, ребетол), действующий на многие РНК- и ДНК-содержащие вирусы, в аэрозольной лекарственной форме используется при лечении инфекций, вызванных РС-вирусом. Предполагается, что препарат ингибирует ранние этапы вирусной транскрипции, нарушая синтез рибонуклеопротеидов, информационной РНК, блокируя РНК-полимеразу. Применяется ингаляторно с помощью небулайзера только в условиях стационара.
При приеме рибавирина могут отмечаться бронхоспазм, сыпь, раздражение глаз, причем не только у пациентов, но и у медперсонала. В редких случаях наблюдаются лейкопения, бессонница, раздражительность. Существует риск кристаллизации препарата в дыхательных путях и интубационных трубках. Обладает тератогенным действием.
Перспективным противовирусным препаратом является недавно разработанный в США пленоконарил. В исследованиях in vitro и в экспериментах на животных выявлена его активность против энтеровирусов и риновирусов. Данные первых плацебо-контролируемых исследований свидетельствуют об эффективности препарата при респираторных инфекциях и энтеровирусном менингите [8].
В России применяются оригинальные противовирусные препараты, созданные на основе отечественных разработок. Наиболее широко известный из них — арбидол. Он оказывает ингибирующее действие на вирусы гриппа типа А и В и другие респираторные вирусы, механизм которых до конца не выяснен. Предполагают, что подобное воздействие связано и с интерферониндуцирующими и с иммуномодулирующими свойствами препарата. В частности, арбидол стимулирует активность фагоцитарных клеток. Выпускается в таблетках по 0,1 г. В лечебных целях назначается по 0,2 г 3–4 раза в день в течение 3–5 дней. С профилактической целью применяется по 0,2 г/сут в течение 10–14 дней.
Интерфероны
Интерфероны (ИФН) относятся к числу регуляторов иммуногенеза. Они продуцируются различными клетками и не только реализуют противовирусный ответ, но и регулируют иммунологические реакции. Основные эффекты интерферонов можно подразделить на антивирусные, антимикробные, антипролиферативные, иммуномодулирующие и радиопротективные.
Несмотря на разнообразие генетического материала вирусов, ИФН подавляют их репродукцию на стадии, обязательной для всех вирусов: они блокируют начало трансляции, т. е. синтез вирусспецифических белков. Этим можно объяснить универсальность антивирусного действия интерферона. Под воздействием интерферона в организме усиливается активность естественных киллеров, Т-хелперов, цитотоксических Т-лимфоцитов, фагоцитарная активность, интенсивность дифференцировки В-лимфоцитов, экспрессия антигенов МНС I и II типа [1].
Для лечения вирусных инфекций применяются α- и β-интерфероны. Хороший эффект при лечении дает комбинированное применение химиопрепаратов и препаратов ИФН.
β-интерферон (бетаферон) выпускается в форме порошка, во флаконах, содержащих по 9,5 млн ЕД ИФН. При гриппе его закапывают или распыляют в носовые ходы не менее 4–5 раз в сутки [2].
Человеческий лейкоцитарный интерферон представляет собой смесь интерферонов, синтезируемых лейкоцитами донорской крови в ответ на воздействие вирусного индуктора. Препарат вводят ингаляторно или закапывают в носовые ходы водный раствор, приготавливаемый из сухого вещества в ампуле или флаконе.
Виферон — рекомбинантный интерферон-α 2b — выпускается в форме ректальных свечей и применяется при лечении ОРВИ и гриппа. Повреждение клеточных мембран, наблюдаемое в ходе развития инфекционного процесса, является причиной снижения противовирусной активности интерферона. Токоферола ацетат и аскорбиновая кислота, входящие в состав виферона, являются мембраностабилизирующими компонентами, антиоксидантами, в сочетании с которыми противовирусная активность рекомбинантного интерферона-α 2b возрастает в 10–14 раз [1].
Особенности введения лекарственной формы обеспечивают длительную циркуляцию в крови интерферона-α 2b.
Препарат применяется как у новорожденных детей, так и у взрослых больных при ОРВИ и гриппе в возрастных дозировках. Детям до 7 лет назначается виферон-1, детям старше 7 лет и взрослым — виферон-2.
Индукторы интерферона
Амиксин — низкомолекулярный синтетический индуктор эндогенного интерферона ароматического ряда, относящийся к классу флуоренонов. Основными структурами, продуцирующими интерферон в ответ на введение амиксина, являются клетки эпителия кишечника, гепатоциты, Т-лимфоциты, гранулоциты. В лейкоцитах человека амиксин индуцирует образование интерферона, уровень в крови которого составляет 250 ЕД/мл. После приема амиксина внутрь максимум интерферона у человека определяется последовательно в кишечнике, печени, крови через 4–24 ч [2].
При лечении гриппа и ОРВИ амиксин назначается в первые часы заболевания, на курс достаточно 5–6 таблеток. С целью профилактики назначается 1 раз в неделю в течение 4–6 нед.
Циклоферон является низкомолекулярным индуктором ИФН-α , что определяет широкий спектр его биологической активности. Он быстро проникает в клетки, накапливаясь в ядре и цитоплазме. Циклоферон интеркалирует ДНК клетки, с чем связан механизм его интерферониндуцирующей активности [3].
Циклоферон быстро проникает в кровь. Отмечается низкое связывание его с белками крови и в то же время широкое распространение в различных органах, тканях, биологических жидкостях организма.
Ввиду того что циклоферон является низкомолекулярным препаратом, он легко преодолевает гематоэнцефалический барьер, вызывая образование ИФН в мозге. Циклоферон быстро выводится из организма: 99% введенного препарата элиминируется почками в неизмененном виде в течение 24 ч.
Циклоферон хорошо переносится больными и назначается с первого дня от начала заболевания в виде таблетированной формы или парентерально [4].
Ридостин — высокомолекулярный индуктор ИФН природного происхождения. Ридостин представляет собой двуспиральную РНК, полученную из лизата киллерных дрожжей Saccharamyces cervisiae.
Системное введение ридостина стимулирует продукцию раннего ИФН. Максимальное накопление ИФН в сыворотке отмечается через 6–8 ч после инъекции; через 24 ч в кровотоке не определяется [1].
Препарат проявляет выраженный иммуномодулирующий эффект. Он стимулирует Т-клеточное и гуморальное звенья иммунитета, пролиферацию стволовых клеток костного мозга и фагоцитарную активность макрофагов и нейтрофилов периферической крови. Ридостин повышает уровень кортикостероидных гормонов; применяется для лечения и профилактики гриппа и других ОРВИ.
В настоящее время незаслуженно забывают препарат дибазол, применяемый для лечения и профилактики гриппа и ОРВИ. Дибазол обладает иммуномодулирующей активностью и индуцирует выработку эндогенного интерферона. Для профилактики назначается по 1 таблетке (0,02–0,05 г) 1 раз в день — 3–4 нед, для лечения — по 1 таблетке 3 раза в день — 5 дней.
Незаменимы в лечении гриппа и ОРВИ такие комплексные препараты, как гриппостад, ринза, терафлю, фервекс, а также препараты для наружного и местного применения — мазь от простуды доктор Мом, туссамаг бальзам от простуды.
Несмотря на многообразие препаратов, представленных для лечения ОРВИ и гриппа на современном этапе, выбор лекарственного препарата остается актуальной задачей для практикующего врача. Выбор тактики назначения и ведения больного с ОРВИ или гриппом напрямую связан с тяжестью течения инфекционного процесса, формой заболевания и наличием осложнений. Успех лечения зависит от правильной оценки состояния больного и раннего начала лечения.
Ежегодно от гриппа и его осложнений умирает более полумиллиона человек [1]. Самым эффективным способом снижения заболеваемости является специфическая вакцинопрофилактика. Но так как вирусы гриппа обладают способностью к антигенной изменчивости поверхнос
Ежегодно от гриппа и его осложнений умирает более полумиллиона человек [1]. Самым эффективным способом снижения заболеваемости является специфическая вакцинопрофилактика. Но так как вирусы гриппа обладают способностью к антигенной изменчивости поверхностных белков гемагглютинина и нейраминидазы, разработчики вакцин вынуждены ежегодно создавать новые антигенные препараты, выпуск которых занимает как минимум 9 мес, в связи с чем нельзя гарантировать полного соответствия вакцины и циркулирующего штамма [2]. (Кроме того, учитывая возникшую угрозу нового пандемического штамма птичьего гриппа (H5N1), который может появиться достаточно внезапно, встает вопрос о необходимости применения эффективных этиотропных химиопрепаратов.)
В настоящее время класс противогриппозных препаратов включает адамантадины амантадин и римантадин, действие которых направлено на ионные каналы М2 и ингибиторы нейраминидазы осельтамивир и занамивир [3]. Однако адамантадины в настоящее время на 30–60% оказываются неэффективными. Так, за 10 лет наблюдения частота случаев лекарственной устойчивости выросла с 0,4% в 1995 г. до 12,3% в 2004 г. Развитие резистентности к обоим препаратам связано с мутацией вируса гриппа А, в результате которой функция ионного канала белка М2 оказалась защищенной от действия адамантадинов [4, 5, 6, 7, 8].
Напротив, мутации, необходимые для развития устойчивости к ингибиторам нейраминидазы, происходят в труднодоступном участке молекулы фермента нейраминидазы, что снижает ее активность и возможность развития резистентности, обусловливая тем самым активность ингибиторов этого фермента в отношении всех подтипов вирусов А и В.
Первым препаратом в этой группе был занамивир, предназначенный для местного применения в виде ингаляции, но не оказывающий системного воздействия при гриппе, что послужило причиной разработки нового лекарственного средства — осельтамивира (тамифлю). По данным литературы, применение тамифлю при гриппе у взрослых больных уменьшает тяжесть заболевания, сокращает период клинических проявлений, уменьшает частоту осложнений, требующих применения антибактериальных средств [9, 10, 11, 12, 13]. Однако информации по применению тамифлю у детей собрано немного, что послужило целью настоящего исследования по изучению клинической эффективности и безопасности этого препарата при гриппе и других респираторных инфекциях у детей.
Под наблюдением находились 50 детей в возрасте от 12 до 15 лет, 25 из которых получали тамифлю (основная группа) и 25 — общепринятое лечение (группа контроля). К категории часто болеющих относились 34% детей. У 9 детей имелась хроническая патология: у 1 — рецидивирующий обструктивный бронхит, у 1 — бронхиальная астма, у 7 — хронический тонзиллит, у 2 — поллиноз.
По совокупности клинических данных грипп можно было диагностировать у 16 больных основной и у 14 — контрольной групп, парагрипп — у 9 и у 11 больных, аденовирусную инфекцию — у 8 и у 6 больных соответственно.
Препарат тамифлю в дозе 75 мг назначали в остром периоде болезни по 2 раза в день не позднее первых 30 ч заболевания в течение 5 дней на фоне сопутствующей симптоматической терапии. Дети из группы контроля с первого дня обращения к врачу получали антигистаминные, жаропонижающие, муколитические препараты, а 13 из них, помимо симптоматического лечения, получали антибиотики в связи с возникновением у них бактериальных осложнений.
У больных, лечившихся тамифлю, отмечена достоверно меньшая продолжительность клинических симптомов, независимо от тяжести ОРВИ (рисунок, а).
Как видно из приведенных данных, продолжительность лихорадки и других проявлений интоксикационного синдрома (недомогание, снижение аппетита, слабость, сонливость, снижение физической активности) сокращалась в 3 и более раз; ринита — в 2,6 раза; на фоне терапии тамифлю продуктивный кашель с эффектом разжижения мокроты появлялся со 2–3-го дня, а в группе контроля — после 4-го дня. Максимальный клинический эффект среди больных ОРВИ отмечался у 72% детей уже на вторые сутки приема препарата. В эти же сроки у 67% детей отмечалось изменение плотности мокроты в сторону ее разжижения, в то время как в группе контроля эти изменения регистрировались только у 43% детей.
У больных ОРВИ из группы контроля с бактериальными осложнениями продолжительность лихорадки и других проявлений интоксикационного синдрома уменьшились в 4,4 раза; продолжительность ринита — в 3,2 раза; продуктивный кашель с эффектом разжижения мокроты появлялся на фоне лечения тамифлю в среднем со 2-го дня, а в группе контроля — с 5-го дня (рисунок, б).
Переносимость препарата у всех детей была хорошей. Побочных реакций в виде болей в животе, тошноты, рвоты, диспепсических явлений, ощущения комка или инородного тела, сухости/саднения в горле, связанных с получением тамифлю, не отмечалось. На фоне терапии тамифлю не было выявлено аллергических реакций. У детей, страдающих атопическим дерматитом, поллинозом, бронхиальной астмой, не отмечалось также усугубления проявлений заболевания.
Проведенное исследование показало, что препарат тамифлю безвреден, хорошо переносится, эффективен при лечении не только гриппа, но и ОРВИ. Механизм клинического улучшения при ОРВИ на фоне лечения тамифлю не совсем ясен. Поскольку в ходе лечения препаратом (по 75 мг 2 раза в день в течение 5 дней) у всех детей, независимо от этиологии заболевания, отмечали значительное улучшение самочувствия и быструю обратную динамику клинических проявлений, можно допустить, что тамифлю ингибирует не только нейраминидазу, но и другие факторы патогенности вирусов. Несомненно, клинический эффект препарата напрямую связан с подавлением вирусной агрессии, а это, как известно, ведет к уменьшению уровня провоспалительных цитокинов, количества клеток, экспрессирующих CD95+, снижению адгезивной способности мононуклеарных клеток крови, к активации лимфоцитов, целенаправленной поляризации Th-0-лимфоцитов в Th-1, экспрессии на мембране клеток HLA-DR 11 класса, стимуляции фагоцитарной системы макрофагов и нейтрофилов, росту и активации цитотоксических и NK-клеток [14, 15, 16].
Такие сдвиги в иммунной системе способствуют подавлению бактериальной и грибковой флоры, определяя неосложненное течение заболевания.
Наши данные согласуются с информацией других авторов. Так, по данным L. Kaiser (2003), при применении тамифлю не только быстрее разрешаются симптомы основного заболевания, но и снижаются на 55%, по сравнению с плацебо, частота вторичных осложнений со стороны нижних дыхательных путей, а также число госпитализаций. У пациентов повышенного риска частота бактериальных осложнений, требующих назначения антибиотикотерапии, уменьшалась на 34%, а число госпитализаций — на 59% [17].
По данным C. M. Machado (2004), у больных с ослабленным в результате пересадки костного мозга иммунитетом не только отмечалась высокая эффективность при применении тамифлю, но и его хорошая переносимость [18].
В работе R. J. Whitley (2001 г.) показана эффективность тамифлю у детей в возрасте 1 года и старше. У детей, получавших препарат, выздоровление наступало на 36 ч раньше, чем в контрольной группе. При этом на 44% снизилась частота бактериальных осложнений, у детей с бронхиальной астмой наблюдалось достоверное увеличение объема форсированного выдоха за 1 с [19].
На основании результатов нашего исследования можно сделать следующие выводы.
- Осельтамивир (тамифлю) можно считать препаратом выбора при лечении гриппа и других респираторных инфекций.
- Современная этиотропная терапия гриппа и ОРВИ препаратом тамифлю способствует сокращению продолжительности лихорадки, явлений интоксикации, а также сроков купирования катаральных явлений.
- При системной терапии осельтамивиром (тамифлю) не отмечается развитие обструкции дыхательных путей и бактериальных осложнений, что позволяет избежать госпитализации в стационар и отказаться от назначения антибактериальной терапии.
- Случаев гиперчувствительности к тамифлю не выявлено, препарат хорошо переносится и не имеет противопоказаний.
- Осельтамивир (тамифлю) при гриппе и других респираторных инфекциях необходимо назначать по 75 мг 2 раза в день в течение 5 дней у детей старше 12 лет, в остром периоде заболевания - не позднее чем через 48 ч с момента появления первых симптомов.
По вопросам литературы обращайтесь в редакцию.
О. В. Кладова, доктор медицинских наук
Т. Ф. Погодина
В. Ф. Учайкин, доктор медицинских наук, профессор, академик
РГМУ, Москва
Несмотря на очевидные научные достижения и противоэпидемические мероприятия, врачи, эпидемиологи и организаторы здравоохранения вынуждены констатировать, что острые респираторные вирусные инфекции (ОРВИ) и грипп остаются до сих пор плохо контролируемыми и
Несмотря на очевидные научные достижения и противоэпидемические мероприятия, врачи, эпидемиологи и организаторы здравоохранения вынуждены констатировать, что острые респираторные вирусные инфекции (ОРВИ) и грипп остаются до сих пор плохо контролируемыми инфекциями. Это объясняется полиэтиологичностью возбудителей, отсутствием вакцин (за исключением гриппа) для специфической профилактики, массовостью заболеваний, смешанным характером инфекций, изменчивостью антигенных свойств вирусов и развивающейся резистентностью к препаратам.
Суммарный экономический ущерб от заболеваемости гриппом и ОРВИ в России, по оценке специалистов, составляет в последние годы не менее 40 млрд. рублей ежегодно. С ОРВИ связано 30–50% потерь рабочего времени у взрослых и 60–80% пропусков школьных занятий у детей, до 80% всех случаев острых респираторных заболеваний (ОРЗ) приходится именно на часто болеющих детей. В детских стационарах частота перекрестной инфекции респираторными вирусами может достигать 40–80% [1].
Можно констатировать, что, хотя 90–95% инфекций верхних дыхательных путей вызвано вирусами и только 5% — бактериями, в 75% случаев пациентам назначаются антибиотики [2]. При этом данные о целесообразности использования антибиотиков при ОРВИ неоднозначны. Известно, что антибиотики синтетического происхождения против вирусов бесполезны и не рекомендуются [3]. Установлено, что антибактериальная терапия при вирусной инфекции не влияет на длительность заболевания, динамику основных клинических симптомов, выраженность постинфекционного астенического синдрома, состояние здоровья пациента.
Антивирусные препараты являются соединениями природного и/или синтетического происхождения, обладающими этиотропным действием и применяемыми для лечения и/или профилактики вирусных инфекций. Данная группа включает противовирусные химиопрепараты, интерфероны и индукторы интерферона. Противовирусные препараты, применяемые при ОРВИ, можно разделить на две группы: специфического (например, осельтамивир (Тамифлю) для лечения гриппа, паливизумаб (Синагис) для лечения РС-вирусной инфекции) и широкого действия, назначаемые при ОРВИ любой этиологии (препараты рекомбинантного альфа-интерферона, в т. ч. лейкоцитарный назальный интерферон, Реаферон, Виферон; индукторы интерферона, такие как Арбидол, Циклоферон, Неовир, Амиксин).
В данной фармакологической форме римантадин высвобождается не сразу, что дает постепенное и продолжительное его поступление в кровь, пролонгированную циркуляцию его в организме, постоянную концентрацию препарата в крови, улучшается фармакокинетика и механизм действия препарата, который в настоящий момент хорошо изучен. Орвирем предназначен для детей от одного года и позиционируется для лечения гриппа А. Однако уже в процессе предрегистрационного изучения (НИИ гриппа, Санкт-Петербург, проф. Дриневский В. П., 2000) была установлена его эффективность и безопасность в терапии и других ОРВИ. Исследования препаратав период 2003–2004 гг. проводили: Институт вирусологии имени Д. И. Ивановского РАМН РФ, Москва; ГУ Всесоюзный научно-исследовательский институт гриппа, Санкт-Петербург; кафедра детских инфекционных болезней РГМУ, Москва.
Экспериментальные исследования показали избирательное взаимодействие Орвирема с трансмембранным вирусным белком М2, выполняющим функцию протонного насоса. Препятствуя понижению рН эндосом, препарат блокирует слияние оболочки вируса с мембранами эндосом и предотвращает, таким образом, передачу вирусного генетического материала в цитоплазму клетки. В результате угнетение выхода вирусных частиц из клетки прерывает транскрипцию генома вируса (рис. 1). Подавление репродукции вируса гриппа Орвиремом сопровождается индукцией интерферона, второго уровня защиты, что позволяет усилить химиотерапевтическое действие препарата и предотвратить развитие наиболее тяжелых осложнений гриппа: ларингита и пневмонии [4, 5].
Вышеизложенное объясняет наш интерес к Орвирему и явилось предпосылкой клинического изучения эффективности данного препарата в качестве этиотропного противовирусного и противовоспалительного средства в ДИКБ № 6 УЗ САО г. Москвы (на клинической базе педиатрического факультета РУДН) у детей, госпитализированных по поводу острых респираторных вирусных заболеваний, в том числе у детей с сопутствующими врожденными пороками сердца, госпитализированных в открытое здесь с 2004 года первое в России отделение инфекционной кардиологии. Данная категория пациентов документировано имеет вторичную иммунологическую недостаточность, что способствует персистенции респираторных вирусов, причастных к развитию миокардита, тонзиллогенных заболеваний сердца эндотелиальной дисфункции и других осложнений, включая риск раннего атерогенеза. По современным представлениям, острый бронхиолит, как одна из форм ОРВИ, особенно опасен для детей с врожденными пороками сердца (ВПС), 18% которых умирают от острого бронхиолита [6–9].
Целью настоящего исследования явилась оценка эффективности Орвирема в терапии среднетяжелых и тяжелых (осложненных) форм острой респираторной патологии у детей в условиях инфекционного педиатрического стационара.
Материалы и методы
Критериями включения детей в основную группу являлись наличие симптомов ОРЗ, интоксикация и фебрильные подъемы температуры, первые 3 дня заболевания, отсутствие антибактериальной, противовирусной и иммуномодулирующей терапии до госпитализации. При оценке тяжести течения использовались принятые критерии тяжести ОРВИ, а именно: выраженность синдрома интоксикации и синдрома поражения респираторного тракта. Легкой формой считали слабо выраженный синдром интоксикации, температуру тела не более 38–38,5 °С; среднетяжелой формой — умеренно выраженную интоксикацию с температурой тела 39–39,5 °С, умеренно выраженными местными изменениями; тяжелая (токсическая) форма характеризовалась наличием нейротоксикоза, менингеального, энцефалитического, судорожного синдромов, выраженной интоксикации, первично возникающих тяжелых местных осложнений, геморрагического синдрома.
На основании данных критериев среднетяжелое течение было диагностировано у 29 детей (58%) и тяжелое у 21 ребенка (42%) детей основной группы (табл. 2).
Контрольную группу составили 30 детей идентичного возраста со сходной патологией, госпитализированные в ДИКБ № 6 УЗ САО г. Москвы, получавшие с момента поступления с 1–3 дня заболевания только симптоматическую терапию и/или антибактериальное лечение.
Основные клинические симптомы при поступлении в стационар в основной и контрольной группах были сопоставимы (табл. 3). При раннем поступлении и неосложненных формах ОРВИ 21-му ребенку основной группы назначался только Орвирем в качестве монотерапии с момента госпитализации в стационар в дозе: детям 1–3 лет по 2 ч. л. (10 мл) 3 раза в день на 1-й и 2-й день заболевания, 2 раза в день на 3-й и 1 раз в день на 4-й день болезни. Детям 3–7 лет в дозе по 3 ч. л. (15 мл) 3 раза в день на 1-й и 2-й день заболевания, 2 раза в день на 3-й и 1 раз в день на 4-й день болезни. Детям с исходно осложненными (бронхитом, пневмонией, острым тонзиллитом, отитом) формами ОРВИ, преимущественно в возрасте до двух лет, и детям с ВПС и недостаточностью кровообращения Орвирем назначался на фоне антибактериальной терапии (Цефазолин, Сумамед) в возрастных дозировках (n = 29). Дети осматривались ЛОР-врачом на первые, пятые, седьмые и десятые сутки лечения. Идентификация возбудителей ОРВИ (вирусов гриппа А и В, вирусов парагриппа, аденовируса, РС-вируса, микоплазмы пневмонии) проводилась методами иммуноферментного анализа (ИФА) и полимеразной цепной реакции (ПЦР) по принятым стандартам.
Результаты исследования
При оценке данных вирусологического исследования, проведенного в первые 24 ч с момента поступления в стационар у 22 детей основной группы (в 44% наблюдений) и у 14 детей контрольной группы (в 46,7% наблюдений) были идентифицированы возбудители респираторных инфекций. Возбудители идентифицированы не были у 28 детей основной группы (56%) и 16 детей контрольной (53,7%).
Анализ частоты положительных результатов вирусологического исследования в основной и контрольной группах, а также характера основных клинических проявлений респираторного заболевания в зависимости от вида возбудителя показал полную сопоставимость групп сравнения для последующего анализа эффективности терапии.
Как следует из рис. 2, рис 3, в целом на фоне терапии Орвиремом интоксикационный и катаральный синдром регрессировали существенно быстрее и у большего числа пациентов основной группы по сравнению с контрольной. Лихорадочный период сокращался в среднем до 12–48 часов, уменьшение других симптомов интоксикации (слабость, адинамия, потливость) наблюдалось в среднем к 2–3 суткам приема препарата. Катаральные явления, ринит и кашель достаточно быстро ликвидировались в течение 2–4 суток у 50% больных основной группы.
За период наблюдения у пациентов основной группы, получавших Орвирем, ни в одном случае не было отмечено вновь возникших бактериальных осложнений и обострений хронической очаговой инфекции.
В контрольной группе больных с идентичной симптоматикой динамика реконвалесценции отставала по срокам и выраженности, несмотря на использование современных антибактериальных средств, в 5% наблюдений отмечено обострение хронической очаговой инфекции (хронического тонзиллита) или бактериальных осложнений (бронхит, пневмония).
Анализ динамики интоксикационного и катарального синдромов в основной группе на фоне терапии Орвиремом в зависимости от вида возбудителя показал достаточно высокую эффективность при гриппе А, в соответствии с аннотацией препарата, однако сопоставимая высокая эффективность была подтверждена в случаях аденовирусной, РС-вирусной и микоплазменной инфекций.
Анализ динамики интоксикационного и катарального синдромов в основной группе на фоне терапии Орвиремом показал тенденцию к более быстрой ликвидации симптомов у пациентов с положительными результатами вирусологического исследования. Это, с большой вероятностью, позволяет считать, что в этиологии ОРЗ у детей с отрицательными результатами вирусологического исследования могли иметь значение бактериальная и атипичная микрофлора и другие (не изучавшиеся в данном исследовании) вирусные агенты.
Проведенные исследования показали, что в педиатрической практике Орвирем достаточно эффективен для монотерапии и комплексной терапии катарального и интоксикационного синдромов ОРВИ, для профилактики осложнений, ускорения реконвалесценции, сокращения сроков пребывания в стационаре (рис. 4).
Таким образом, помимо ранее декларированной для гриппа А, достаточная эффективность Орвирема отмечена для РС-вирусной, микоплазменной и аденовирусной инфекций, а также для гриппа В и для смешанной вирусно-бактериальной этиологии респираторных инфекций.
Наши исследования показали, что на фоне лечения Орвиремом в основной группе существенно реже, чем в контрольной группе, отмечались обострения хронической очаговой ЛОР-патологии в виде хронического тонзиллита и ринофарингита (соответственно у 10% и 30% больных детей). Таким образом, применение Орвирема уменьшало показания к назначению дорогостоящих симптоматических средств (в частности, бронхолитиков), уменьшало полипрагмазию. Орвирем хорошо переносился детьми, его прием не сопровождался аллергическими реакциями и иным побочным действием.
Заключение
Использование противовирусного препарата Орвирем в ранние сроки острого инфекционного поражения респираторного тракта у детей в возрасте 1–7 лет (включая детей с сопутствующей кардиальной патологией) сокращает длительность интоксикационного и катарального синдромов, уменьшает частоту специфических и неспецифических бактериальных осложнений, сокращает сроки пребывания в стационаре.
Максимальная эффективность препарата по динамике основных клинических синдромов отмечена при этиологически подтвержденных гриппе А, адено- и РС-вирусной инфекции, микоплазменной инфекции. Достаточная эффективность подтверждена для гриппа В и при смешанной вирусно-бактериальной этиологии респираторных инфекций.
Литература
Романцов М. Г., Ершов Ф. И. Часто болеющие дети. Современная фармакотерапия: Руководство для врачей. М., 2009. 352 с.
Романцов М. Г., Горячева Л. Г., Коваленко А. Л. Противовирусные и имунотропные препараты в детской практике. Руководство для врачей. СПб. 2008. 123 с., с. 12.
Самсыгина Г. А. Современные подходы к лечению острой инфекции респираторного тракта у часто болеющих детей // Педиатрия. Consilium Medikum. 2008. № 2.
Пикуза О. И, Ослопов В. Н., Вахитов Х. М., Бабкшкина А. А., Никольский С. Е. Прогнозирование атеросклероза у детей и возможности ранней профилактики ишемической болезни сердца // Казанский медицинский журнал. 1999, т. LXXX, № 4, с. 296–297.
Вахитов Х. М, Пикуза О. И. Повторные острые респираторные заболевания как фактор риска развития дислипидемий у детей // Педиатрия Сперанского. 2004. № 5. С. 35–37.
Degtyareva H., Samuilova D. Sh., Razuvaev M. K., Khurges I. S. Immunological Scrining and Immune Correction in Cardiosurgery ofInfants // Bul. of Experimental Biology and Medisin, Consultants Bureau. New-York. 1993. Vol. 115. № 4. P. 417–421.
Дегтярева Е. А. Иммунологическая недостаточность и иммунореабилитация в детской кардиологии // Лекции по педиатрии. 4 том. Кардиология, 2004. М., с. 323–344.
Е. А. Дегтярева, доктор медицинских наук, профессор, академик РАЕН
Д. Ю. Овсянников, кандидат медицинских наук, доцент
О. И. Жданова
С. И. Лазарева
РУДН, Детская инфекционная клиническая больница № 6, Москва
Форма выпуска, упаковка и состав препарата Тамифлю ®
Капсулы твердые желатиновые, размер №2, корпус серого цвета, непрозрачный, крышечка светло-желтого цвета, непрозрачная; с надписью "ROCHE" (на корпусе) и "75 mg" (на крышечке) светло-синего цвета; содержимое капсул - порошок от белого до желтовато-белого цвета.
| 1 капс. | |
| осельтамивира фосфат | 98.5 мг, |
| что соответствует содержанию осельтамивира | 75 мг |
Вспомогательные вещества: крахмал прежелатинизированный, повидон К30, кроскармеллоза натрия, тальк, натрия стеарилфумарат.
Состав оболочки капсулы: корпус - желатин, краситель железа оксид черный (E172), титана диоксид (E171); крышечка - желатин, краситель железа оксид красный (E172), краситель железа оксид желтый (E172), титана диоксид (E171).
Состав чернил для нанесения надписи на капсуле: этанол, шеллак, бутанол, титана диоксид (E171), лак алюминиевый на основе индигокармина, этанол денатурированный (спирт метилированный).
10 шт. - блистеры (1) - пачки картонные.
Примечание: по истечении 5 лет хранения препарата могут наблюдаться признаки "старения" капсул, что может привести к их повышенной хрупкости или другим нарушениям физического состояния, которые не оказывают влияния на эффективность или безопасность препарата.
Фармакологическое действие
Противовирусный препарат. Осельтамивира фосфат является пролекарством, его активный метаболит (осельтамивира карбоксилат, ОК) - эффективный и селективный ингибитор нейраминидазы вирусов гриппа типа А и В - фермента, катализирующего процесс высвобождения вновь образованных вирусных частиц из инфицированных клеток, их проникновения в клетки эпителия дыхательных путей и дальнейшего распространения вируса в организме.
Тормозит рост вируса гриппа in vitro и подавляет репликацию вируса и его патогенность in vivo, уменьшает выделение вирусов гриппа А и В из организма. Концентрация ОК, необходимая для ингибирования нейраминидазы на 50% (IC 50 ), составляет 0.1-1.3 нМ для вируса гриппа А и 2.6 нМ для вируса гриппа В. Медиана значений IC 50 для вируса гриппа В несколько выше и составляет 8.5 нМ.
В проведенных исследованиях Тамифлю ® не оказывал влияния на образование противогриппозных антител, в т.ч. на выработку антител в ответ на введение инактивированной вакцины против гриппа.
Исследования естественной гриппозной инфекции
В клинических исследованиях, проведенных во время сезонной инфекции гриппа, пациенты начинали получать Тамифлю ® не позднее 40 ч после появления первых симптомов гриппозной инфекции. 97% пациентов были инфицированы вирусом гриппа А и 3% пациентов - вирусом гриппа В. Тамифлю ® значительно сокращал период клинических проявлений гриппозной инфекции (на 32 ч). У пациентов с подтвержденным диагнозом гриппа, принимавших Тамифлю ® , тяжесть заболевания, выраженная как площадь под кривой для суммарного индекса симптомов, была на 38% меньше по сравнению с пациентами, получавшими плацебо. Более того, у молодых пациентов без сопутствующих заболеваний Тамифлю ® снижал примерно на 50% частоту развития осложнений гриппа, требующих применения антибиотиков (бронхита, пневмонии, синусита, среднего отита). Были получены четкие доказательства эффективности препарата в отношении вторичных критериев эффективности, относящихся к антивирусной активности: Тамифлю ® вызывал как укорочение времени выделения вируса из организма, так и уменьшение площади под кривой "вирусные титры-время".
Данные, полученные в исследовании по терапии Тамифлю ® у пациентов пожилого и старческого возраста, показывают, что прием Тамифлю ® в дозе 75 мг 2 раза/сут в течение 5 дней сопровождался клинически значимым уменьшением медианы периода клинических проявлений гриппозной инфекции, аналогичным таковому у взрослых пациентов более молодого возраста, однако различия не достигли статистической значимости. В другом исследовании больные гриппом старше 13 лет, имевшие сопутствующие хронические заболевания сердечно-сосудистой и/или дыхательной систем, получали Тамифлю ® в том же режиме дозирования или плацебо. Отличий в медиане периода до уменьшения клинических проявлений гриппозной инфекции в группах Тамифлю ® и плацебо не было, однако период повышения температуры при приеме Тамифлю ® сокращался примерно на 1 день. Доля пациентов, выделяющих вирус на 2-й и 4-й день, становилась значительно меньше. Профиль безопасности Тамифлю ® у пациентов группы риска не отличался от такового в общей популяции взрослых пациентов.
Лечение гриппа у детей
У детей в возрасте 1-12 лет (средний возраст 5.3 года), имевших лихорадку (≥37.8°С) и один из симптомов со стороны дыхательной системы (кашель или ринит) в период циркуляции вируса гриппа среди населения, было проведено двойное слепое плацебо-контролируемое исследование. 67% пациентов были инфицированы вирусом гриппа А и 33% пациентов - вирусом гриппа В. Препарат Тамифлю ® (при приеме не позднее 48 ч после появления первых симптомов гриппозной инфекции) значительно снижал продолжительность заболевания (на 35.8 ч) по сравнению с плацебо. Продолжительность заболевания определялась как время до купирования кашля, заложенности носа, исчезновения лихорадки, возвращения к обычной активности. В группе детей, получавших Тамифлю ® , частота острого среднего отита снижалась на 40% по сравнению с группой плацебо. Выздоровление и возвращение к обычной активности наступало почти на 2 дня раньше у детей, получавших Тамифлю ® , по сравнению с группой плацебо.
В другом исследовании участвовали дети в возрасте 6-12 лет, страдающие бронхиальной астмой; 53.6% пациентов имели гриппозную инфекцию, подтвержденную серологически и/или в культуре. Медиана продолжительности заболевания в группе пациентов, получавших Тамифлю ® , значительно не снижалась. Но к последнему 6 дню терапии Тамифлю ® объем форсированного выдоха за 1 сек (ОФВ 1 ) повышался на 10.8% по сравнению с 4.7% у пациентов, получавших плацебо (р=0.0148).
Профилактика гриппа у взрослых и подростков
Профилактическая эффективность Тамифлю ® при естественной гриппозной инфекции А и В была доказана в 3 отдельных клинических исследованиях III фазы. На фоне приема Тамифлю ® гриппом заболели около 1% пациентов.Тамифлю ® также значительно уменьшал частоту выделения вируса из дыхательных путей и предотвращал передачу вируса от одного члена семьи к другому.
Взрослые и подростки, которые были в контакте с больным членом семьи, начинали прием Тамифлю ® в течение двух дней после возникновения симптомов гриппа у членов семьи и продолжали его в течение 7 дней, что достоверно уменьшало частоту случаев гриппа у контактировавших лиц на 92%.
У лиц пожилого и старческого возраста, находившихся в домах для престарелых, 80% из которых были привиты перед сезоном, когда проводилось исследование, Тамифлю ® достоверно снижал заболеваемость гриппом на 92%. В том же исследовании Тамифлю ® достоверно (на 86%) уменьшал частоту осложнений гриппа: бронхита, пневмонии, синусита. Пациенты принимали препарат в течение 42 дней.
Профилактика гриппа у детей
Профилактическая эффективность Тамифлю ® при естественной гриппозной инфекции была продемонстрирована в исследовании у детей в возрасте от 1 года до 12 лет после контакта с заболевшим членом семьи или с кем-то из постоянного окружения. Основным параметром эффективности была частота лабораторно подтвержденной гриппозной инфекции. У детей, получавших Тамифлю ® /порошок для приготовления суспензии для приема внутрь/ в дозе от 30 до 75 мг 1 раз/сут в течение 10 дней, и не выделявших вирус исходно, частота лабораторно подтвержденного гриппа уменьшилась до 4% (2/47) по сравнению с 21% (15/70) в группе плацебо.
Профилактика гриппа у лиц с ослабленным иммунитетом
Риск появления вирусов гриппа со сниженной чувствительностью или резистентностью к препарату изучался в клинических исследованиях, спонсированных компанией Рош. У всех пациентов-носителей ОК-резистентного вируса носительство имело временный характер, не влияло на элиминацию вируса и не вызывало ухудшения клинического состояния.
| Популяция пациентов | Пациенты с мутациями, приводящими к резистентности | |
| Фенотипирование * | Гено- и фенотипирование * | |
| Взрослые и подростки | 4/1245 (0.32%) | 5/1245 (0.4%) |
| Дети (1-12 лет) | 19/464 (4.1%) | 25/464 (5.4%) |
* Полное генотипирование не было проведено ни в одном из исследований.
При приеме Тамифлю ® с целью постконтактной профилактики (7 дней), профилактики контактировавших в семье (10 дней) и сезонной профилактики (42 дня) у лиц с нормальной функцией иммунной системы случаев резистентности к препарату не отмечено.
В 12-недельном исследовании по сезонной профилактике у лиц с ослабленным иммунитетом случаев возникновения резистентности также не наблюдалось.
Данные отдельных клинических случаев и наблюдательных исследований
У пациентов, не получавших осельтамивир, обнаружены возникающие в природных условиях мутации вирусов гриппа А и В, которые обладали сниженной чувствительностью к осельтамивиру. В 2008 году мутация по типу замены H275Y, приводящая к резистентности, была обнаружена более чем у 99% штаммов вируса 2008 H1N1, циркулирующих в Европе. Вирус гриппа 2009 H1N1 ("свиной грипп") в большинстве случаев был чувствителен к осельтамивиру. Устойчивые к осельтамивиру штаммы обнаружены у лиц с нормальной функцией иммунной системы и лиц с ослабленным иммунитетом, принимавших осельтамивир. Степень снижения чувствительности к осельтамивиру и частота встречаемости подобных вирусов может отличаться в зависимости от сезона и региона. Устойчивость к осельтамивиру обнаружена у пациентов с пандемическим гриппом H1N1, получавших препарат как для лечения, так и для профилактики.
Частота встречаемости резистентности может быть выше у более молодых пациентов и пациентов с ослабленным иммунитетом. Устойчивые к осельтамивиру лабораторные штаммы вирусов гриппа и вирусы гриппа от пациентов, получавших терапию осельтамивиром, несут мутации нейраминидазы N1 и N2. Мутации, приводящие к устойчивости, часто являются специфическими для подтипа нейраминидазы.
При принятии решения о применении Тамифлю ® следует учитывать сезонную чувствительность вируса гриппа к препарату (последнюю информацию можно найти на сайте ВОЗ).
Доклинические данные, полученные на основании стандартных исследований по изучению фармакологической безопасности, генотоксичности и хронической токсичности, не выявили особой опасности для человека.
Канцерогенность: результаты 3 исследований по выявлению канцерогенного потенциала (двух 2-летних исследований на крысах и мышах для осельтамивира и одного 6-месячного исследования на трансгенных мышах Tg:AC для активного метаболита) были отрицательными.
Мутагенность: стандартные генотоксические тесты для осельтамивира и активного метаболита были отрицательными.
Влияние на фертильность: осельтамивир в дозе 1500 мг/кг/сут не влиял на генеративную функцию самцов и самок крыс.
Тератогенность: в исследованиях по изучению тератогенности осельтамивира в дозе до 1500 мг/кг/сут (на крысах) и до 500 мг/кг/сут (на кроликах) влияния на эмбриональное развитие не обнаружено. В исследованиях по изучению антенатального и постнатального периодов развития у крыс при введении осельтамивира в дозе 1500 мг/кг/сут наблюдалось увеличение периода родов: предел безопасности между экспозицией для человека и максимальной не оказывающей эффекта дозой у крыс (500 мг/кг/сут) для осельтамивира выше в 480 раз, а для его активного метаболита - в 44 раза. Экспозиция у плода составляла 15-20% от таковой у матери.
Прочее: осельтамивир и активный метаболит проникают в молоко лактирующих крыс. Согласно ограниченным данным осельтамивир и его активный метаболит проникают в грудное молоко человека. По результатам экстраполяции данных, полученных в исследованиях у животных, их количество в грудном молоке может составлять 0.01 мг/сут и 0.3 мг/сут, соответственно.
Примерно у 50% протестированных морских свинок при введении максимальных доз активной субстанции осельтамивира наблюдалась сенсибилизация кожи в виде эритемы. Также выявлено обратимое раздражение глаз у кроликов.
В то время как очень высокие пероральные однократные дозы (657 мг/кг и выше) осельтамивира фосфата не оказывали влияния на взрослых крыс, данные дозы оказывали токсическое действие на незрелых 7-дневных детенышей крыс, в т.ч. приводили к гибели животных. Нежелательных эффектов не наблюдалось при хроническом введении в дозе 500 мг/кг/сут с 7 по 21 день постнатального периода.
Фармакокинетика
Осельтамивир легко всасывается из ЖКТ и экстенсивно превращается в активный метаболит под действием печеночных и кишечных эстераз. Концентрации активного метаболита в плазме определяются в пределах 30 мин и более чем в 20 раз превышают концентрации пролекарства, время достижения C max составляет 2-3 ч. Не менее 75% принятой внутрь дозы попадает в системный кровоток в виде активного метаболита, менее 5% - в виде исходного препарата. Плазменные концентрации как пролекарства, так и активного метаболита пропорциональны дозе и не зависят от приема пищи.
V d активного метаболита - 23 л. По данным исследований, проведенных на животных, после приема внутрь осельтамивира фосфата его активный метаболит обнаруживался во всех основных очагах инфекции (легких, промывных водах бронхов, слизистой оболочке полости носа, среднем ухе и трахее) в концентрациях, обеспечивающих противовирусный эффект. Связывание активного метаболита с белками плазмы - 3%. Связывание пролекарства с белками плазмы - 42%, что недостаточно, чтобы служить причиной существенного лекарственного взаимодействия.
Осельтамивир экстенсивно превращается в активный метаболит под действием эстераз, находящихся преимущественно в печени. Ни осельтамивир, ни активный метаболит не являются субстратами или ингибиторами изоферментов системы цитохрома Р450.
Выводится (>90%) в виде активного метаболита преимущественно почками. Активный метаболит не подвергается дальнейшей трансформации и выводится почками (>99%) путем клубочковой фильтрации и канальцевой секреции. Почечный клиренс (18.8 л/ч) превышает скорость клубочковой фильтрации (7.5 л/ч), что указывает на то, что препарат выводится еще и путем канальцевой секреции. Через кишечник выводится менее 20% принятого препарата. T 1/2 активного метаболита 6-10 ч.
Фармакокинетика в особых клинических случаях
Пациенты с поражением почек. При применении Тамифлю ® (100 мг 2 раза/сут в течение 5 дней) у пациентов с различной степенью поражения почек AUC обратно пропорциональна снижению функции почек. Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточности (с КК
Пациенты с поражением печени. Полученные in vitro и в исследованиях на животных данные об отсутствии значительного повышения AUC осельтамивира или его активного метаболита при нарушении функции печени легкой и средней степени тяжести были подтверждены и в клинических исследованиях. Безопасность и фармакокинетика осельтамивира у пациентов с тяжелым нарушением функции печени не изучалась.
Пациенты пожилого и старческого возраста. У пациентов пожилого и старческого возраста (65-78 лет) экспозиция активного метаболита в равновесном состоянии на 25-35% выше, чем у более молодых пациентов при назначении аналогичных доз Тамифлю ® . T 1/2 препарата у пациентов пожилого и старческого возраста существенно не отличался от такового у более молодых пациентов. С учетом данных по экспозиции препарата и его переносимости пациентами пожилого и старческого возраста коррекции дозы при лечении и профилактике гриппа не требуется.
Дети в возрасте от 1 года до 8 лет и подростки. Фармакокинетику Тамифлю ® изучали у детей в возрасте от 1 года до 16 лет в фармакокинетическом исследовании с однократным приемом препарата и в клиническом исследовании по изучению многократного приема препарата у небольшого числа детей в возрасте 3-12 лет. Скорость выведения активного метаболита с поправкой на массу тела у детей младшего возраста выше, чем у взрослых, что приводит к более низким AUC по отношению к конкретной дозе. Прием препарата в дозе 2 мг/кг и однократных доз в 30 мг или 45 мг в соответствии с рекомендациями по дозированию для детей, приведенными в разделе "Режим дозирования", обеспечивает такую же AUC осельтамивира карбоксилата, какая достигается у взрослых после однократного приема капсулы с 75 мг препарата (что эквивалентно примерно 1 мг/кг). Фармакокинетика осельтамивира у детей старше 12 лет такая же, как у взрослых.
Читайте также:

