Телеангиэктазия при гепатите с
Обновлено: 25.04.2024
ПВТ — противовирусная терапия
СН — сердечная недостаточность
ХГС — хронический гепатит С
HCV — вирус гепатита С
NT-pro-BNP — N-концевой предшественник мозгового натрийуретического пептида
Хронический гепатит С (ХГС) — актуальная междисциплинарная проблема. Хорошо изучены различные внепеченочные проявления ХГС, такие как смешанная криоглобулинемия, гломерулонефрит, поздняя кожная порфирия, красный плоский лишай, синдром Шегрена и др. Однако существует целый ряд системных проявлений, которые нуждаются в более тщательном изучении, в частности поражение сердца. При ХГС описаны миокардит, гипертрофическая (ГКМП) и дилатационная (ДКМП) кардиомиопатии, коронарит вследствие криоглобулинемического васкулита мелких сосудов сердца, аритмогенная дисплазия правого желудочка, аневризма левого желудочка, раннее развитие атеросклероза и ишемической болезни сердца [1—6]. Возможно развитие цирротической кардиомиопатии (КМП), которая наблюдается при циррозах печени различной этиологии, в том числе вирусной. Развивается диастолическая дисфункция миокарда и синдром удлиненного интервала Q—T, выраженность которого увеличивается по мере нарастания декомпенсации функции печени [7—11]. Наконец, широко используемая противовирусная терапия (ПВТ) ХГС может сопровождаться кардиотоксичностью интерферона (ИФН), имеющей клинические особенности и нередко проявляющейся развитием декомпенсации деятельности сердца.
Миокардит является одним из мало изученных внепеченочных проявлений ХГС [3, 4]. В клинике им. Е.М. Тареева описана серия наблюдений из 22 больных хроническим гепатитом вирусной этиологии с миокардитом, у 13 из которых диагностирован цирроз печени. Поражение сердца у 4 больных стало причиной летального исхода. В 3 наблюдениях на аутопсии выявлена картина хронического активного миокардита: обширные очаги лизиса кардиомиоцитов (КМЦ) с очаговой лимфогистиоцитарной инфильтрацией; многочисленные продуктивные и продуктивно-деструктивные эндофлебиты; диффузный фиброз стромы; лимфогистиоцитарная инфильтрация стромы. В одном случае диагностированы диффузный кардиосклероз, миокардиофиброз, диффузный склероз эндокарда. Особенностью двух других наблюдений явились выраженные изменения в проводящей системе сердца: волокна проводящей системы замурованы в грубоволокнистую фиброзную ткань, отмечены резко выраженная дистрофия и некробиоз КМЦ. У этих больных наблюдались различные нарушения проводимости [4].
Первичные КМП представляют собой гетерогенную группу заболеваний миокарда различной этиологии. Наибольший интерес к проблеме миокардитов и КМП, ассоциированных с HCV-инфекцией, отмечен у исследователей из Японии. Выявлена высокая распространенность HCV-инфекции у больных ГКМП, ДКМП и миокардитом [17—20]. При многоцентровом исследовании по программе Комитета по изучению идиопатических КМП в Японии, антитела HCV в сыворотке выявлены у 74 (10,6%) из 697 больных ГКМП и у 42 (6,3%) из 633 больных ДКМП, значительно превышая частоту обнаружения антител HCV у сопоставимых по возрасту доноров крови (2,4%) [20].
По данным A. Matsumori [1], у 113 больных ГКМП, HCV-инфекция диагностирована у 16 (14,1%), причем ни у одного из них не было семейного анамнеза по ГКМП. В 4 наблюдениях имелись указания на гемотрансфузии в анамнезе, у 10 больных определялся повышенный уровень трансаминаз в сыворотке, у 7 выявлен гепатоцеллюлярный рак. При морфологическом исследовании отмечены умеренная или выраженная гипертрофия правого и левого желудочков, фиброз различной степени и умеренная клеточная инфильтрация миокарда. РНК HCV генотипа 1b выявлена в сыворотке у 7 больных, РНК HCV в ткани миокарда — у 6, минус-цепи РНК HCV обнаружены в биоптатах сердца у 2 больных. Другая группа исследователей выявила антитела HCV у 18 (22,5%) из 80 больных ГКМП [21].
Многоцентровое исследование, проводимое научным комитетом по изучению КМП Всемирной федерации заболеваний сердца, ставило задачу выявления вирусных геномов энтеровирусов, аденовируса, цитомегаловируса и HCV в формалиновых срезах ткани сердца. Геном HCV выявлен в 2 (18%) из 11 биоптатов больных ДКМП и миокардитом в Италии и у 4 (36%) из 11 больных в США, у 2 из них выявлен миокардит и у 2 — аритмогенная дисплазия правого желудочка. Несмотря на то что метод выявления генома HCV в парафиновых (фиксированных в формалине) срезах менее чувствительный, чем в замороженных образцах, предполагается, что HCV-инфекция может быть более частой причиной ряда заболеваний миокарда, в первую очередь миокардита [22]. Показано также, что частота развития КМП, обусловленных HCV, варьирует в различных регионах мира и различных популяциях. Среди больных КМП в Канаде (Ванкувер) РНК HCV не обнаружена ни в одном из 24 образцов ткани сердца. Ряд европейских исследователей также высказываются против связи HCV-инфекции и заболеваний сердца [23].
В последние годы также изучается вопрос о взаимосвязи ХГС и уровня натрийуретических пептидов. Так, в крупном ретроспективном исследовании антитела к HCV выявлены у 59 (4,4%) из 1355 больных с СН неясной этиологии, что значительно превышало частоту НCV-инфекции в общей популяции (1,8%). Уровень N-концевого предшественника мозгового натрийуретического пептида (NT-pro-BNP) в сыворотке у больных с СН и ХГС достоверно выше, чем у больных с СН без маркеров HCV (р<0,0001) [24]. Интересным представляется исследование А. Antonelli и соавт. [25], которые выявили повышенный уровень NT-pro-BNP у 34% больных ХГС, в то время как в группе неинфицированных, сопоставимых по полу и возрасту, повышение данного лабораторного показателя отмечалось лишь в 6% наблюдений. Это может свидетельствовать в пользу субклинического поражения сердца у некоторых больных ХГС.
Генетические факторы и патогенетические звенья поражения сердца при HCV. Несмотря на то что в последнее время в литературе описываются клинические наблюдения ДКМП и ГКМП, ассоциированных c HCV [1, 6, 18, 21]; механизм, посредством которого HCV приводит к их развитию, полностью не изучен. У ряда пациентов с ассоциированной с HCV КМП идентифицированы HLA- и не-HLA-гаплотипы, которые дают основание полагать, что фактором развития данного вида поражения сердца является генетическая предрасположенность. Так, в развитии ДКМП участвует α-фактор некроза опухоли (α-ФНО) — один из ключевых цитокинов, усиление синтеза которого наблюдается при HCV-инфекции [26].
Причиной миокардита, приводящего к ДКМП и СН, могут быть некоторые вирусы, обладающие тропизмом к миокарду [27, 28]. Считается, что в основе развития вирусного миокардита и прогрессирования его в КМП лежат механизмы смерти клетки в результате апоптоза, а также индуцированные вирусами иммунные реакции [29]. Предполагаемым иммунным механизмом является постоянное обновление иммунокомпетентных клеток и продуцируемых ими цитокинов [30, 31]. Среди всех цитокинов, участвующих в развитии и прогрессировании миокардита, наиболее важную роль играет α-ФНО [32—34]. Отдельные исследования показали, что имеется связь как между сниженной функцией миокарда и повышенной экспрессией α-ФНО, так и между концентрацией α-ФНО в плазме и миокарде у больных миокардитом [35] и ДКМП [36]. С помощью иммуногистохимического анализа установлено, что α-ФНО продуцируется КМЦ при вирусных миокардитах, ассоциированных с аденовирусом, цитомегаловирусом, вирусом Эпштейна—Барр, вирусами гриппа, А и B, а также HCV [35, 37]. Отрицательный инотропный эффект α-ФНО обусловлен связыванием α-ФНО со специфическими рецепторами TNFR1 и TNFR2, которые экспрессируются на мембране КМЦ [38]. Также вероятно, что α-ФНО ингибирует кальциевые каналы L-типа, что приводит к снижению систолической функции миокарда [39]. Другим механизмом, посредством которого α-ФНО влияет на миокард, является стимулирование продукции оксида азота (NO), который оказывает отрицательное инотропное действие на миокард, действуя как эндогенный ингибитор и фактически уменьшая положительный инотропный ответ на β-адренергическую стимуляцию [40].
Некоторые гены, например гены системы HLA, причастны к клиренсу и персистенции HCV-инфекции [41]. В нескольких исследованиях сообщалось, что ДКМП и ГКМП ассоциируются с некоторыми аллелями системы HLA. Так, у инфицированных HCV пациентов, у которых развивается ДКМП, более часто выявляются гаплотипы HLA-DPB1*0901 и HLA-DRB1*1201, а у инфицированных HCV пациентов с ГКМП — гаплотипы HLA DRB1*0901 и DQB1*0303 [1, 42]. По данным других авторов, развитие ДКМП, ассоциированной с HCV, наиболее отчетливо коррелирует с аллелями не-HLA-генов, чем с генами системы HLA [43]. Таким образом, пилотные исследования демонстрируют, что имеется генетическая предрасположенность к развитию поражения миокарда у пациентов с ХГС (рис. 1).

Рис. 1. Генетическая предрасположенность к поражению миокарда при HCV-инфекции.
По данным N. O’Garra и соавт. [44], в печени развивается выраженный CD4+ Th1 клеточный ответ, наиболее вероятно индуцируемый интерлейкином (ИЛ) 12, ИФН-α и ИФН-β, которые продуцируются моноцитами, нейтрофилами и макрофагами после стимуляции Toll-like-рецепторов HCV производными продуктами. Если определенные гаплотипы кодируют молекулы главного комплекса гистосовместимости (ГКГ) II класса с более высоким сродством к производным пептидам HCV, то их функция как молекул, презентирующих антигены клеткам Th1 CD4+, повышается. После активации клетки Th1 CD4+ продуцируют ИФН-γ, который активирует макрофаги к продукции провоспалительных цитокинов [44]. Главными цитокинами, продуцируемыми макрофагами, являются ИЛ-1 и α-ФНО [45], которые могут приводить к обновлению иммунных клеток и высокой концентрации α-ФНО в миокарде.
Другим механизмом, посредством которого гаплотипы HLA могут влиять на развитие ДКМП, ассоциированной с HCV, в контексте α-ФНО является так называемая неклассическая функция клеток ГКГ II класса, т. е. их роль в качестве сигнальных трансдукционных молекул, активируемых суперантигенами в клетках некоторых типов [46, 47]. Суперантигены являются протеинами бактериального или вирусного происхождения, которые активируют до 20% Т-клеточной популяции путем одновременного связывания Т-клеточных рецепторов и молекул ГКГ II класса, что приводит к массивному высвобождению цитокинов, которые секретируются как Т-клетками, так и антигенпрезентирующими клетками [48—50]. В контексте полиморфизма HLA предполагалось, что они принимают непосредственное участие в исходе, к которому приводит продукция цитокинов, стимулируемая суперантигенами [51, 52]. Можно предположить, что определенные гаплотипы HLA кодируют эпитопы молекул ГКГ II класса с высоким сродством к производным HCV суперантигенам или антителам, а это ведет к чрезмерной продукции цитокинов, в частности α-ФНО. Более активное обновление иммунных клеток может привести у генетически предрасположенных инфицированных HCV пациентов к развитию миокардита и впоследствии к ДКМП. Следует отметить, что часто при ассоциированном с HCV хроническом активном миокардите у пациентов отмечался нормальный уровень активности печеночных трансаминаз в сыворотке крови вплоть до формирования терминальной стадии СН [53].
Развитие и прогрессирование вирусного миокардита, в том числе у больных ХГС, осуществляется через различные патогенетические звенья (рис. 2): 1) прямое действие вируса на миокард; 2) непрямое (иммунологическое) действие; 3) смерть клеток в результате апоптоза.

Рис. 2. Механизмы поражения миокарда при HCV-инфекции. АФК — активные формы кислорода.
Воздействие HCV на миокард. Ряд исследователей указывают на возможность прямого воздействия HCV на миокард. Показано, что HCV реплицируется в миокарде, о чем свидетельствует выявление там негативных цепей РНК [53—55]. Механизм, посредством которого протеин HCVcorе вызывает повреждение миокарда, остается неясным; однако он может быть сходным с механизмом поражения печени. Показано, что изменения в структуре рецепторов TNFR1, вызываемых протеином HCVcorе, повышают чувствительность клеток к цитолизу, опосредованному α-ФНО [56]. Кроме того, протеин HCVcorе вызывает дисфункцию митохондрий, что приводит к развитию окислительного стресса клеток печени [57, 58]. Фактически, протеин HCVcore ограничивает свое действие в митохондриях, в частности он взаимодействует с наружной мембраной митохондрий, повышает поглощение кальция митохондриями и вызывает окисление глутатиона, что приводит к дальнейшему повышению продукции АФК [59, 60]. Повышение образования АФК инициирует продукцию α-ФНО [61], который, как отмечено ранее, оказывает отрицательное инотропное действие на миокард. В некоторых ранее проводимых исследованиях продемонстрировано, что у пациентов с острой и хронической СН, развившихся в исходе КМП, в миокарде определяется повышение выработки АФК [62, 63].
К тому же ряд исследований на животных подтверждают роль протеина HCVcore в развитии КМП. В частности, развитие КМП наблюдалось у трансгенных мышей, носителей гена HCVcore, в возрасте 12 мес. Гистологический анализ миокарда этих мышей выявил гипертрофию КМЦ, кардиальный фиброз, дезорганизацию, дефицит и лизис миофибрилл, вакуолизацию и деформацию ядер, повышенное количество митохондрий неправильной формы [55], что убедительно подтверждает определяющие действие протеина HCVcore на развитие КМП, ассоциированной с HCV.
Непрямой иммунологический механизм поражения миокарда включает вовлечение в патологический процесс В-клеток, Т-клеток и макрофагов. Участие В-клеток в КМП, ассоциированной с HCV, предположено в результате обследования 3 пациентов с ассоциированным с HCV миокардитом, ответивших на иммуносупрессивную терапию. В сыворотке крови этих больных выявлены антитела к миокарду, что дало основание предполагать иммунологический механизм повреждения клеток. В дальнейшем подтверждение иммуноопосредованного механизма КМП, ассоциированной с HCV, было основано на эффективности иммуносупрессивных препаратов (преднизолон и азатиоприн), терапия которыми привела к нормализации размеров камер сердца и регрессу признаков СН, несмотря на продолжающуюся персистенцию HCV [54].
Прямой и непрямой механизмы развития ДКМП, ассоциированной с HCV, связаны со смертью клеток через апоптоз. Благодаря способности повышать продукцию АФК, протеин HCVcore может инициировать митохондриальный путь апоптоза. АФК могут вызывать диссоциацию цитохрома С на внутренней мембране митохондрий, что приводит к активации каспаз, результатом чего является фрагментация геномной ДНК и смерть клетки [64]. В результате связывания лигандов с внеклеточными рецепторами суперсемейства рецепторов α-ФНО происходит активация рецепторзависимого сигнального пути апоптоза [65]. Наиболее важными лигандами этих рецепторов являются α-ФНО и Fas-лиганд (FasL). Высокий уровень α-ФНО в миокарде у пациентов с ассоциированным с HCV миокардитом может активировать данный механизм смерти клеток путем взаимодействия с рецепторами ФНО [66].
Заключение
Имеются убедительные доказательства того, что поражение сердца служит одним из внепеченочных проявлений HCV-инфекции. Механизм, посредством которого HCV может приводить к поражению миокарда у генетически предрасположенных пациентов, является многофакторным и включает прямое повреждающее действие вируса, аутоиммунный механизм и апоптоз.
Поражение миокарда при ХГС может прогрессировать в хронический персистирующий миокардит через прямой (вирусный) и непрямой (иммунный) механизмы повреждения, которые приводят к активации зависимой от рецепторов смерти КМЦ, результатом чего является развитие фиброза миокарда с возможной трансформацией в ДКМП. Кроме того, описаны случаи взаимосвязи HCV и ГКМП.
До настоящего момента HCV-инфицированным больным с вовлечением сердца ПВТ, как правило, не проводилась из-за побочных эффектов ИФН. Однако за последние несколько лет в ПВТ вирусного гепатита С произошли кардинальные изменения. Длительное изучение механизмов репликации HCV привело к созданию ингибиторов протеаз HCV (NS¾A, NS5A, NS5B), которые позволяют достичь элиминации вируса у 90—99% пациентов за существенно более короткий срок (как правило, 12 нед) без применения препаратов ИФН (так называемая безинтерфероновая терапия). Это делает данную терапию гораздо более безопасной и хорошо переносимой, в том числе в отношении миокарда [67—69].
Нуждается в отдельном изучении вопрос эффективности и безопасности ПВТ у пациентов с ХГС и ассоциированного с ним поражения сердца, включая сравнение только ПВТ и сочетания ПВТ с сердечно-сосудистыми препаратами и/или иммуносупрессорами. Выявление антител к миокарду и определение уровня α-ФНО в сыворотке крови во время терапии может быть использовано для оценки влияния терапии на данные маркеры.
Признаки болезни печени. Сигналы организма о нарушении работы печени
Гиппократ считал, что пессимистичный настрой человека и его раздражительность непременно связаны с застоем желчи в печени. И в некоторой степени "отец медицины" был прав. Во время злости и гнева рефлекторно задерживается отток желчи из печени и желчного пузыря. Вероятно, отсюда и корни выражения "желчный человек".
В наше время определять наличие заболеваний печени по настроению человека уже не будет ни один врач, так как существуют более явные признаки, сигнализирующие о проблемах с работой этого жизненного важного органа.
Печень выполняет огромное количество функций, среди которых главные - очищение организма от шлаков, токсинов и излишков гормонов, синтез холестерина и участие в обмене веществ. Поэтому крайне важно своевременно выявить признаки развития заболеваний печени и начать ее лечить, пока болезнь не успела нанести непоправимый вред здоровью. Вот характерные сигналы организма о нарушении работы печени:
- Боль в правом подреберье. Может быть от умеренной до интенсивной (трудно согнуться), отдавать в спину или правое плечо;
- Пожелтение склер глаз и кожи, тремор рук;
- Неприятные ощущения во рту: сухость, появление кисло-горького вкуса, тошнота;
- "Печеночные ладони". Внутренние стороны кистей (иногда подошвы) становятся ярко-красными. При надавливании бледнеют, затем красный цвет восстанавливается;
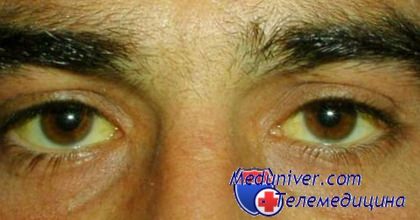
Желтуха при болезни печени - гепатите от воды
- Проблемы со сном. Он становится тревожным, прерывистым, особенно в один-три часа ночи, часто мучает бессонница;
- Язык становится ярко- красного цвета, иногда с фиолетовым оттенком, сухим, отечным, гладким;
- Запах - сладковатый, напоминающий запах свежего мяса или печени, чувствуется при дыхании и от тела больного;
- Постоянная жажда, которая не проходит даже после принятия достаточного количества жидкости;
- Поражение волос и ногтей. У мужчин волосы редеют на голове, у женщин - чаще под мышками и в лобковой области;
- Ногти становятся бледными и тусклыми, на них могут появиться бороздки, белые пятна;
- Пигментация кожи. Пятна обычно появляются на боковой поверхности щек с переходом на шею. Может темнеть кожа в подмышечных впадинах и на руках;
- Головокружение, головная боль, тахикардия;
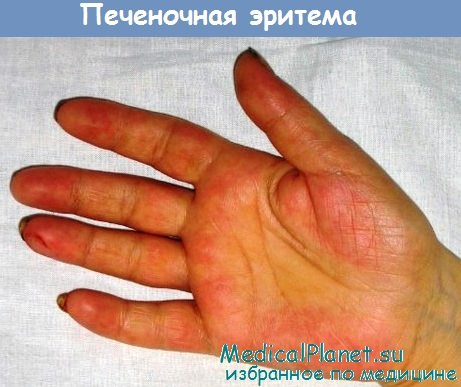
Пальмарная эритема - печеночные ладони
- Нарушение зрения, особенно в вечернее время;
- Появление аллергического дерматита, а также фурункулеза, атрофических полос (стрий) на бедрах, ягодицах, в нижней части живота;
- Кожный зуд. Чаще на отдельных местах туловища, ног и рук. Может сопровождаться сыпью. В основном имеет приступообразный, кратковременный характер;
- Появление натоптышей на мизинцах ног.
- Изменение окраса и запаха кала и мочи. Моча приобретает нездоровый коричневый оттенок, а кал меняется в цвете на светло-жёлтый или зелёный.
Чтобы избежать проблем в работе печени, не злитесь, не раздражайтесь по пустякам. А если обнаружили у себя признаки нарушения, не игнорируйте SOS-сигналы организма - пройдите обследование. Одним из самых опасных заболеваний является рак печени, которому характерно постепенное нарастание симптомов. Среди онкологических заболеваний он находится на 7-м месте по распространённости. Выявить рак печени можно по беспричинному резкому похудению и чувству тяжести под правым подреберьем. Мучают тупые боли в этой области, изжога и жажда.
При обнаружении первых симптомов неполадок в работе печени нужно, прежде всего, пересмотреть свой рацион. Исключить из рациона жирное мясо, консервы, копчености, острые блюда, алкоголь, наваристые бульоны. А также острые пряности и овощи: горчицу, хрен, чеснок, редис, поскольку они вызывают раздражение стенок желчного пузыря и, как следствие, спазмы.
Есть больше фруктов, особенно полезны для печени авокадо, свежие и запеченные яблоки, сырая и вареная свекла, зелень и мед. Пить свежевыжатые соки. Самая полезная для печени пряность - куркума. Добавляйте его по щепотке в каждое блюдо. Это поможет облегчить пищеварение, снизить уровень холестерина в крови, защитить от воздействия на печень токсичных веществ. Откажитесь от употребления сладостей, сахар тоже разрушает печень.
Для очищения печени от токсинов каждый день по утрам пейте на голодный желудок стакан теплой воды с добавлением 2 столовых ложек лимонного сока.
- Вернуться в оглавление раздела "Профилактика заболеваний"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Цирроз печени - диагностика
Биопсия печени — самый чувствительный метод диагностики цирроза, однако в 10% случаев с ее помощью заболевание диагностировать не удается. Согласно традиционной морфологической классификации цирроз подразделяют на крупноузловой и мелкоузловой варианты, в последнем случае диаметр узлов составляет 3 мм и меньше. Однако классификация условна, так как в печени одного и того же пациента часто могут присутствовать как крупные, так и мелкие узлы.
Размер узлов обычно увеличивается по мере прогрессирования цирроза. Алкогольный цирроз, как правило, мелкоузловой.
Классификация цирроза в зависимости от его этиологии
• Вирусные гепатиты:
- гепатит В (HBV);
- гепатит С (HCV).
• Токсины:
- алкоголь — алкогольный цирроз;
- железо — гемохроматоз;
- медь — болезнь Вильсона;
- метилдофа — лекарственный цирроз; - мышьяк.
• Холестаз:
- мелкие протоки — синдром Кароли;
- первичный билиарный цирроз;
- крупные протоки — вторичный билиарный цирроз;
- мелкие и крупные протоки — склерозирующий холангит.
• Венозная обструкция:
- мелкие вены — веноокклюзионная болезнь;
- крупные вены — синдром Бадда—Киари;
- врожденный дефект мембран;
- кардиальный цирроз.
• Другие:
- аутоиммунные реакции — люпоидный гепатит;
- неалкогольная жировая дистрофия печени — криптогенный цирроз.
Мелкоузловой цирроз (а). Печень реципиента, удаленная при трансплантации. Контуры печени неровные за счет рубцового процесса, множество мелких узлов регенерации создают эффект зернистой поверхности.
Срез печени больного с мелкоузловым циррозом (б). Нормальная печеночная ткань замещена многочисленными мелкими одинакового размера узлами регенерации, каждый из которых окружен тонкой прослойкой соединительной ткани.
Желтый цвет узлов обусловлен жировой дистрофией.
При циррозе печень может быть увеличена, нормальных размеров или уменьшена и даже сморщена. При мелкоузловом варианте архитектоника печени полностью нарушена, узлы лишены центральных вен и портальных трактов. При крупноузловом циррозе среди рубцовой ткани могут сохраняться участки нормальной ткани печени, что затрудняет диагностику с помощью биопсии печени.
Кроме того, полученный биопсийный материал нередко крошится. Для активного цирроза характерно наличие клеток воспаления и ступенчатых некрозов, в зависимости от этиологии можно обнаружить также включения железа, жировой ткани и признаки холестаза. По мере прогрессирования цирроза его активность снижается, в терминальной стадии установить его этиологию по биопсийному материалу, как правило, невозможно.
Ярко-красные телеангиэктазии на лице, как и увеличение околоушных желез, указывают на алкогольную этиологию цирроза. Еще одно типичное для цирроза изменение кожи — сосудистые звездочки, представляющие собой артериолы с отходящими от них тонкими боковыми ветвями. Обнаружить их можно только на руках и верхней части туловища (область бассейна верхней полой вены).
Лейконихия (появление белых полосок на ногтях) — признак нарушения белкового обмена, часто сопутствующий хроническим заболеваниям печени. Симптом барабанных палочек — редкое, но примечательное проявление патологии печени, связанное с общей гипоксией в результате формирования внутрилегочных шунтов.
Контрактура Дюпюитрена, ранее считавшаяся симптомом алкогольного цирроза, часто встречается и при других заболеваниях, а в ряде случаев носит доброкачественный семейный характер. Кровотечения из мест инъекций и пурпура появляются, когда заболевание печени приводят к коагулопатии. Генерализованная гиперпигментация кожи в большей степени характерна для билиарного цирроза и гемохроматоза.
Артралгии и артриты присущи хроническому активному аутоиммунному гепатиту и первичному билиарному циррозу, тогда как при гемохроматозе наблюдают эрозивные артриты и хондрокальциноз. Выпадение волос на теле, в том числе на лобке, особенно у мужчин, а также атрофия яичек сопутствуют гормональным изменениям при циррозе. Отложение меди в роговице (кольцо Кайзера—Флейшера) — патогномоничный симптом болезни Вильсона.
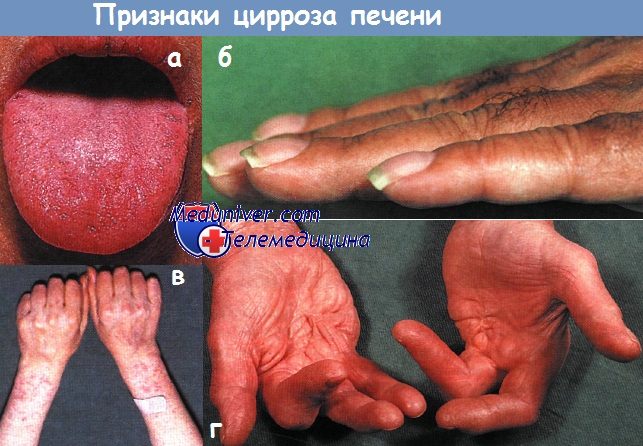
а - Цианоз слизистых оболочек у больного с алкогольным циррозом.
б - Утолщение концевых фаланг пальцев рук у больного с первичным билиарным циррозом.
в - Кровоподтеки и телеангиэктазии у больного с алкогольным циррозом.
г - Контрактура Дюпюитрена у больного с алкогольным поражением печени.
Сочетание котрактур ладоней и пальцев с ампутациями связано с ранним развитием деформаций.
Диагноз ставят при обнаружении большого количества лейкоцитов (более 250/мл) в асцитической жидкости, подозревать перитонит нужно у любого пациента с асцитом при внезапном ухудшении самочувствия без очевидных на то причин. Психические нарушения как проявление печеночной энцефалопатии, сопровождающееся характерными изменениями на электроэнцефалограмме, — симптом прогрессирования заболевания.
Избражение, полученное при ультразвуковом исследовании больного циррозом с асцитом.
Асцитическая жидкость выглядит как участок темного цвета, определяется неровный контур печени. а - Электроэнцефалография больного с печеночной энцефалопатией.
Определяется характерная трехфазная электрическая активность, преимущественно в лобных отведениях.
б - Эндоскопическая ретроградная холангиограмма больного с циррозом после чрескожного внутрипеченочного портосистемного шунтирования.
Контуры периферических желчных протоков извиты (белая стрелка) вследствие рубцевания, приводящего к сморщиванию печени.
Печень уменьшена в размерах. Стент (обозначен короткими черными стрелками) соединяет систему воротной вены с системой печеночных вен.
Свойственное циррозу истончение внутрипеченочных желчных протоков можно установить с помощью ретроградной холангиографии, однако применение этого инвазивного вмешательства только в целях диагностики не оправдано. Основной метод выявления портальной гипертензии — УЗИ. Кроме того, УЗИ позволяет увидеть узловую структуру паренхимы печени, ее неровные контуры и асцит, отсутствие которых никоим образом не исключают цирроз.
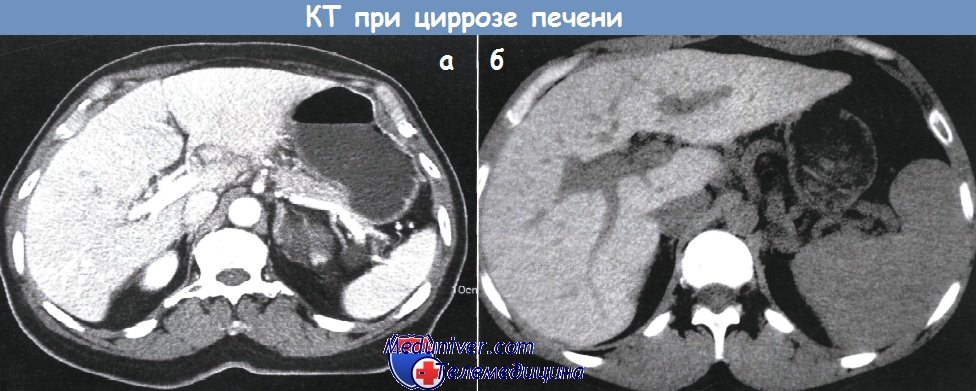
Ранние признаки цирроза (а): печень немного уменьшена, паренхима изменена.
Диагноз подтвержден морфологически (б). Изменения печени позволяют заподозрить гемохрамотоз.
Компьютерная томография.
Компьютерную томографию и МРТ применяют для диагностики выраженных изменений печени, начальные стадии цирроза эти методы позволяют распознать не всегда. В редких случаях при помощи компьютерной томографии можно определить этиологию заболевания печени, например гемохроматоз. Магнитно-резонансную ангиографию и трехмерную компьютерную томографию используют для оценки проходимости сосудов печени, кроме того, они позволяют определить выраженность портальной гипертензии.
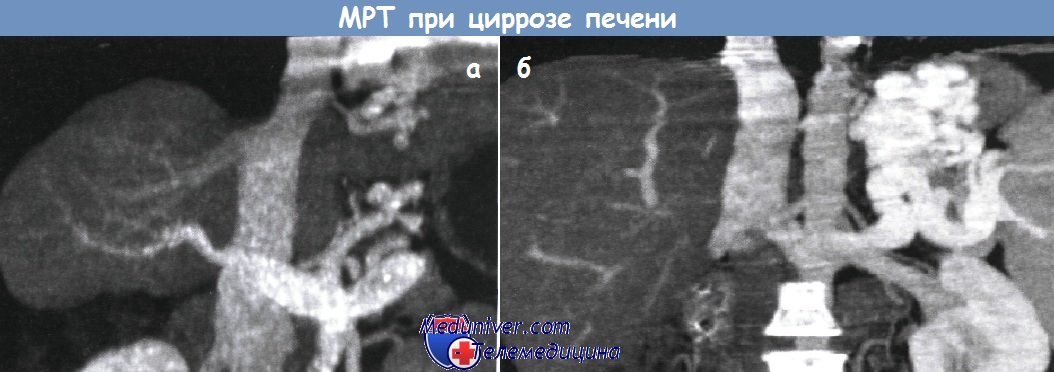
а - Портальная гипертензия: определяется сморщенная печень и кровоток по венозным коллатералям.
Магнитно-резонансная ангиография.
б - Магнитно-резонансная ангиография другого пациента с портальной гипертензией.
Определяется выраженное варикозное расширение вен и коллатеральный кровоток.
Варикозное расширение пищеводных вен устанавливают с помощью рентгенографии пищевода с контрастированием барием, а также с помощью компьютерной томографии, однако методом выбора диагностики данной патологии признана оптико-волоконная эндоскопия, особенно если необходимо исключить кровотечение из варикозно расширенных вен.
Варикозно расширенные вены пищевода можно обнаружить у трети больных циррозом печени, кровотечения из них обусловливают треть всех летальных при циррозе исходов. Вероятность кровотечения можно установить по размеру, цвету, особым локальным симптомам на стенке сосудов и высокому градиенту давления в печеночных венах.
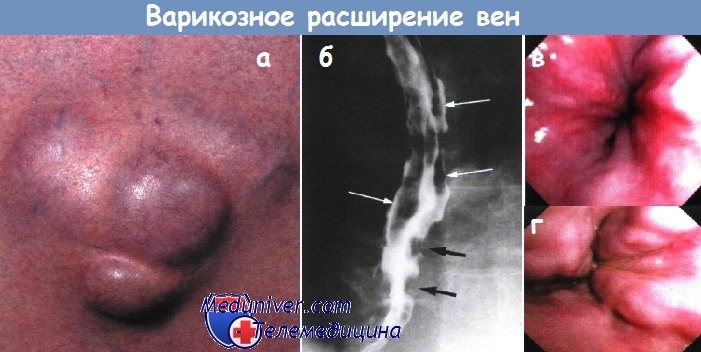
а - Варикозное расширение пупочных вен (крупный план), над которыми определяется венозный шум (шум Крювелье-Баумгартена).
б - Варикозное расширение вен — многокамерные дефекты наполнения во фронтальной (белые стрелки) и сагиттальной (черные стрелки) проекции дистального отдела пищевода.
Рентгеноконтрастное исследование.
в - Первая степень варикозного расширения вен пищевода.
г - Вторая степень варикозного расширения вен пищевода. Извитые вены.
Согласно классификации японской ассоциации по изучению портальной гипертензии, варикозно расширенные вены пищевода характеризуются по степеням:
0 — не определяются,
1 — мелкие, неизвитые,
2 — более 50% радиуса пищевода, извитые,
3 — более 50% радиуса пищевода.
Существуют следующие локальные симптомы на стенке варикозно расширенных вен, указывающие на высокую вероятность кровотечения из них: вишневые пятна, желобовидные углубления слизистой оболочки, геморрагические пузырьки.
Портальная гипертензия может сопровождаться и другой сосудистой патологией ЖКТ, так, у 5—15% больных циррозом выявляют варикозное расширение вен желудка. Варикозное расширение вен в области дна желудка без расширения вен пищевода указывает на высокий риск тромбоза селезеночных вен.
У больных с портальной гипертензией нередко обнаруживают варикозно расширенные вены прямой кишки, представленные единичными или множественными узлами, но они редко служат причиной кровотечения из нижних отделов ЖКТ. Варикозное расширение вен вышележащих отделов толстого кишечника практически не встречается. Варикозное расширение прямокишечных вен необходимо дифференцировать от геморроя.
Все чаще встречается гастропатия, ассоциированная с портальной гипертензией, преимущественно у пациентов с портальной гипертензией (у 40—80% из них). Выделяют начальную, умеренную и выраженную степени гастропатии. Для начальной степени клинические проявления нехарактерны, при выраженной степени высок риск кровотечения.
Несколько реже у больных с портальной гипертензией можно обнаружить варикозное расширение вен антрального отдела желудка. Поскольку данная патология наблюдается и при отсутствии портальной гипертензии, при ее наличии у больного трудно определить, является ли варикозное расширение вен желудка самостоятельным состоянием или проявлением гастропатии, ассоциированной с портальной гипертензией. Изменения, подобные гастропатии, можно обнаружить и в других отделах ЖКТ, включая толстый кишечник.
Несмотря на то что ассоциированная с портальной гипертензией гастропатия макроскопически напоминает катаральный гастрит, ее гистологическая картина иная — определяют расширенные вены слизистой оболочки и подслизистого слоя, тогда как воспалительный инфильтрат отсутствует.
С помощью УЗИ можно определить диаметр портальной вены, а допплеровское исследование позволяет оценить ее проходимость и направление тока крови. Посредством чрескожной спленопортографии можно увидеть расположение венозных коллатералей, однако этот довольно опасный метод в настоящее время используют редко. При введении контраста в селезеночную или верхнюю брыжеечную артерии у больных с портальной гипертензией визуализация сосудов в позднюю венозную фазу ухудшается из-за разведения контрастного вещества, однако этот способ иногда применяют для оценки венозной патологии.
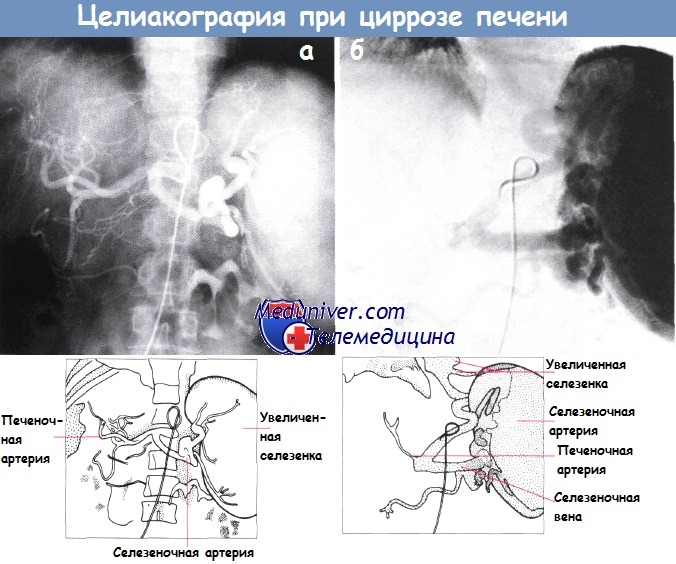
Целиакография пациента с циррозом печени, окклюзией воротной вены и портальной гипертензией.
Внутрипеченочные сосуды изменены, селезенка увеличена вследствие артериальной инъекции (а).
Венозная фаза (б): обструкция воротной вены и расширенные параэзофагеальные вены.
Радиоизотопная сцинтиграфия с меченной технецием коллоидной серой у пациентов с циррозом демонстрирует уменьшение накопления изотопа в печени с нарастанием его захвата в селезенке и костном мозгу. С появлением УЗИ и компьютерной томографии этот метод стали использовать реже.
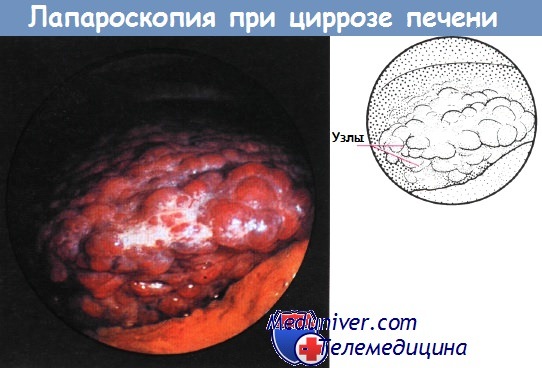
При лапароскопии поверхность печени больного с циррозом выглядит узловатой, неровной. Лапароскопию применяют в отдельных странах для постановки диагноза в тех случаях, когда результаты биопсии сомнительны или невозможно получить материал.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
КТ, МРТ, УЗИ, ангиография печени при наследственной геморрагической телеангиэктазии
б) Визуализация:
6. Рекомендации по визуализации:
• Лучший метод диагностики:
о Цветовая допплерография (для неинвазивного скрининга)
о КТ с контрастным усилением (и МРТ) с мультипланарным реформатированием и трехмерными реконструкциями сосудов с целью визуализации патологически измененных сосудов печени при наследственной геморрагической телеангиэктазии
• Выбор протокола:
о КТ-артериография с использованием проекции максимальной интенсивности (MIP) в аксиальной и корональной плоскости в артериальной и паренхиматозной фазе контрастного усиления
в) Дифференциальная диагностика наследственной геморрагической телеангиэктазии:
2. Травматические внутрипеченочные артерио-венозные фистулы:
• Причины: биопсия, чреспеченочная холангиостомия, тупая травма или проникающие ранения, разрыв аневризмы печеночной артерии с формированием свища между артерией и воротной веной
• Расширение артерии на ограниченном участке, раннее контрастное усиление вены, затруднение визуализации артерии дистальнее фистулы из-за перераспределения кровотока
3. Опухолевые артериовенозные шунты:
• Формируются как в первичных, так и вторичных опухолях печени; возникновение шунтов означает прорастание опухоли в вену
4. Синдром Бадда-Киари:
• Обструкция путей венозного оттока от печени, формирование коллатералей между печеночными венами, воротной веной и системными венами
• КТ: неоднородная плотность паренхимы печени, перипортальное и периферическое контрастное усиление, увеличение хвостатой доли
• Сужение либо окклюзия печеночных вен:
о В то время как при НГТ происходит расширение ветвей печеночной и(или) воротной вены
г) Патология:
1. Общая характеристика:
• Этиология:
о Гены, кодирующие белок, связывающий трансформирующий фактор роста
• Генетика:
о Наследственная геморрагическая телеангиэктазия-заболевание с аутосомно-доминантным типом наследования, характеризующееся высокой пенетрантностъю и гетерогенностью
о Фенотипы НГТ:
- НГТ 1: мутации гена, кодирующего эндоглин (ENG), расположенного в девятой хромосоме
- НГТ 2: мутации гена (ACVRL), кодирующего белок актинин (ALK1) (хромосома 12)
• Ассоциированные изменения:
о У пациентов с наследственной геморрагической телеангиэктазией симптоматика и осложнения чаще всего обусловлены АВМ легких
2. Макроскопические и хирургические особенности:
• Изменения со стороны сосудов печени (ангиодисплазия):
о Телеангиэктазии, кавернозные гемангиомы, аневризмы паренхиматозных ветвей печеночной артерии, а также паренхиматозные, печеночно-портальные, артерио-венозные фистулы
д) Клинические особенности:
2. Демография:
• Возраст:
о Дебют заболевания происходит у взрослых людей, поражение печени обнаруживается 10-20 лет спустя после возникновения первой телеангиэктазии
• Пол:
о М=Ж
• Эпидемиология:
о 10-20:100000
3. Течение и прогноз:
• Осложнения: застойная сердечная недостаточность с повышенной фракцией выброса, портальная гипертензия, печеночная энцефалопатия, билиарная ишемия, печеночная недостаточность:
о Внепеченочные поражения: кровохарканье, гемоторакс, инсульт, абсцесс мозга
• Прогноз: чаще всего благоприятный
4. Лечение:
• Поддерживающая терапия: препараты железа, переливание крови
• Спиральная эмболизация печеночной артерии, лигирование печеночной артерии, трансплантация печени
е) Диагностическая памятка. Следует учесть:
• Все пациенты с наследственной геморрагической телеангиэктазией должны подвергаться скринингу из-за высокой распространенности АВМ легких и головного мозга в этой группе
• Необходимо также исследовать родственников пациентов с НГТ на предмет наличия признаков заболевания
Читайте также:

