Тест-системы иммуноферментные вирус гепатита 480 определений
Обновлено: 19.04.2024
Исследование для выявления возбудителя гепатита B (HBV), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени определяется наличие генетического материала (ДНК) вируса и его количество (вирусная нагрузка) в образце крови.
ДНК HBV может быть обнаружена в концентрации, находящейся за нижней границей линейного диапазона концентраций. Линейный диапазон концентраций - это диапазон, в котором можно точно посчитать количество копий возбудителя. Для данного анализа линейный диапазон концентраций ДНК HBV, определяемых детектирующим амплификатором, составляет 7,5×102 – 1,0×108копий/мл образца.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Единицы измерения
Копия/мл (копия на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до сдачи крови.
Общая информация об исследовании
Вирусный гепатит В (ВГВ) - инфекционное заболевание печени, вызванное ДНК-содержащим вирусом гепатита В (HBV). Среди всех причин развития острого гепатита и хронической вирусной инфекции вирус гепатита В считается одной из самых распространенных в мире.
В России количество носителей HBV превышает 5 миллионов человек.
Источник инфекции - больной ВГВ или бессимптомный вирусоноситель. HBV передается с кровью и другими биологическими жидкостями. Заразиться можно при незащищенном половом контакте, использовании нестерильных шприцев, переливании крови и пересадке донорских органов, ребенка может заразить мать во время или после родов (через трещины в сосках).
В группу риска входят: медицинские работники, у которых возможен контакт с кровью пациента, пациенты, получающие гемодиализ, инъекционные наркоманы, люди, ведущие беспорядочную половую жизнь, дети, рожденные от матерей с ВГВ.
Инкубационный период заболевания - от 4 недель до 6 месяцев. Вирусный гепатит В может протекать как в виде легких форм, длящихся несколько недель, так и в виде многолетней хронической инфекции. Основные признаки гепатита: желтушность кожных покровов, лихорадка, тошнота, утомляемость, в лабораторных анализах - нарушения функции печени и специфические антигены вируса гепатита В. Острое заболевание может быстро приводить к летальному исходу, переходить в хроническую инфекцию или заканчиваться полным выздоровлением. Считается, что после перенесенного ВГВ формируется стойкий иммунитет. Хронический вирусный гепатит В связан с развитием цирроза и рака печени.

На нашем YouTube-канале опубликована серия видео по ИФА-диагностике респираторных инфекций. Подробнее
Новый набор для дифференциального выявления IgG к S- и N-белкам SARS-CoV-2. Подробнее
HBsAg-ИФА-БЕСТ (комплект 1/авто)
Набор реагентов для иммуноферментного выявления HBs-антигена вируса гепатита В.
Срок годности: 12 месяцев
HBsAg-ИФА-БЕСТ (комплект 2)
Набор реагентов для иммуноферментного выявления HBs-антигена вируса гепатита В.
Срок годности: 12 месяцев
HBsAg-ИФА-БЕСТ (комплект 3)
Набор реагентов для иммуноферментного выявления HBs-антигена вируса гепатита В.
Срок годности: 12 месяцев
HBsAg-подтверждающий-ИФА-БЕСТ
Набор реагентов для иммуноферментного подтверждения присутствия HBs-антигена вируса гепатита В.
Срок годности: 12 месяцев
Вектогеп B-HBs-антиген-авто (комплект 1)
Набор реагентов для иммуноферментного выявления HBsAg для автоматических ИФА анализаторов.
Вектогеп B-HBs-антиген-авто (комплект 2/Чароит)
Набор реагентов для иммуноферментного выявления HBsAg для автоматических ИФА анализаторов.
Вектогеп B-HBs-антиген (комплект 1)
Набор реагентов для иммуноферментного выявления HBsAg. Одностадийная постановка.
Срок годности: 24 месяцев
Вектогеп B-HBs-антиген (комплект 2)
Набор реагентов для иммуноферментного выявления HBsAg. Одностадийная постановка.
Срок годности: 24 месяцев
Вектогеп B-HBs-антиген (комплект 3)
Набор реагентов для иммуноферментного выявления HBsAg. Одностадийная постановка.
Срок годности: 24 месяцев
Вектогеп B-HBs-антиген (комплект 4)
Набор реагентов для иммуноферментного выявления HBsAg. Одностадийная постановка.
Срок годности: 24 месяцев
Вектогеп В-HBs-антиген-подтверждающий тест (комплект 1)
Набор реагентов для иммуноферментного подтверждения наличия HBsAg. Одностадийная постановка.
Срок годности: 24 месяцев
Вектогеп В-HBs-антиген-подтверждающий тест (комплект 2)
Набор реагентов для иммуноферментного подтверждения наличия HBsAg. Одностадийная постановка.
Срок годности: 24 месяцев
HBsAg-ИФА-БЕСТ-количественный
Набор реагентов для иммуноферментного количественного определения HBs-антигена вируса гепатита В в сыворотке (плазме) крови
Диапазон измерений: 0 - 10 МЕ/мл (нг/мг)
ВектоHBsAg-антитела
Набор реагентов для иммуноферментного качественного и количественного определения антител к HBs-антигену вируса гепатита В в сыворотке (плазме) крови.
ВектоHBcAg-IgМ
Набор реагентов для иммуноферментного выявления иммуноглобулинов класса М к core-антигену вируса гепатита В.
ВектоHBcAg-антитела
Набор реагентов для иммуноферментного выявления суммарных антител к core-антигену вируса гепатита В.
ГепаБест анти-HBc-IgG
Набор реагентов для иммуноферментного выявления иммуноглобулинов класса G к core-антигену вируса гепатита В в сыворотке (плазме) крови.
ВектоHBe-антиген
Набор реагентов для иммуноферментного выявления E-антигена вируса гепатита В в сыворотке (плазме) крови.
ВектоHBe-IgG
Набор реагентов для иммуноферментного выявления иммуноглобулинов класса G к HВe-антигену вируса гепатита В.
Набор для внутрилабораторного контроля качества ИФА "Сыворотка, содержащая НВsАg".
HBsAg-стандартная панель сывороток
Набор образцов сывороток крови, содержащих разные субтипы и мутантные формы HBsAg вируса гепатита В.
ИФА в диагностике вирусных гепатитов. Возможности иммуноферментного анализа
Специфическая лабораторная диагностика вирусных гепатитов основывается на применении иммунохимических и молекулярно-биологических методов исследований. Основными иммунохимическими методами являются радиоизотопный или радиоиммунный (РИА) и иммуноферментный (ИФА). В основе иммунохимических методов диагностики лежит специфическое взаимодействие антиген — антитело с последующим выявлением комплекса при помощи специальных меток. Наиболее распространенным является иммуноферментный анализ.
В результате инкубации иммуносорбента и испытуемой сыворотки при наличии определяемого агента происходит их связывание в комплекс антиген — антитело. После процедуры промывки, в ходе которой удаляются несвязанные антигены и антитела, проводится инкубация с конъюгатом. В качестве конъюгата при детекции HBsAg используют анти-HBs, при детекции антител к вирусу гепатита С —антитела к иммуноглобулинам человека (антивидовой конъюгат), меченные пероксидазой хрена. В итоге этой инкубации происходит присоединение к уже имеющимся комплексам антиген — антитело дополнительно внесенного конъюгата. После удаления несвязавшегося конъюгата (отмывки) в лунки вносится субстрат. При использовании пероксидазного конъюгата в качестве субстрата используют перекись водорода в сочетании с индикатором, в качестве которого наиболее часто применяют ортофенилендиамин (ОФД) или тетраметилбензидин (ТМБ). Результат оценивается фотометрически.
Качество и надежность аналитических возможностей иммуноферментного метода характеризуются рядом критериев, к числу которых относятся чувствительность, специфичность, правильность и воспроизводимость.

Чувствительность — то минимальное количество вещества, которое может быть обнаружено при помощи иммуноферментного анализа. При этом нижним пределом чувствительности данного метода является концентрация исследуемого вещества в образце, которая соответствует наименьшему положительному результату определения, статистически достоверно отличающемуся от показателей заведомо отрицательных образцов. Чувствительность ИФТС зависит от ряда обстоятельств, связанных как с конструкцией тест-системы (аффинность иммуносорбента, качества экстракционных и буферных систем), так и разрешающей способностью и точностью метода регистрации.
Специфичность — способность выявлять именно те компоненты, для определения которых предназначена данная иммуноферментная тест-система. Специфичность ИФА определяется во многом перекрестной реакцией антител или антигенов (то есть композиции, используемой в качестве иммуносорбента), с близкородственными соединениями, а также составом инкубационной среды (матрикс-эффект).
Правильность — соответствие среднего значения результатов повторных определений одного и того же контрольного образца с истинной величиной измеряемого параметра. Правильность определения в ИФА зависит от качества самой тест-системы и контрольного образца. Для хороших иммуноферментных тест-систем показатели правильности лежат в пределах 90-110 %. Особенностью медико-биологических исследований в ИФА является невозможность установления точной величины, и поэтому за истинную величину принимается средняя от нескольких экспертных лабораторий. Статистическим критерием правильности служит средняя арифметическая и степень ее отклонения от истинного значения, выраженная в процентах.
Воспроизводимость — способность тест-системы показывать одни и те же значения при повторных исследованиях одного и того же образца. Воспроизводимость зависит как от случайных погрешностей (ошибок) при проведении процедуры постановки реакции, так и от качества тест-систем и точности метода регистрации результатов. Считается, что воспроизводимость одних и тех же контрольных образцов одной фирмы в разных лабораториях не должна превышать величину коэффициента вариации в 15%.
Из молекулярно-биологических методов диагностики вирусных гепатитов чаще используются полимеразная цепная реакция и гибридизация. Эти методы, особенно ПЦР, позволяют выявлять очень малые количества специфической вирусной ДНК или РНК и, таким образом, судить о репликации, а в ряде случаев и об активности репликации.
Современная диагностика гепатита В. Выявление HBsAg
Серологическая диагностика гепатита В в настоящее время строится на основании определения маркеров НВ-вирусной инфекции, как правило, с помощью имуноферментного анализа, то есть антигенов вируса гепатита В или антител к ним в биологических субстратах, главным образом, в сыворотке крови. В качестве основных маркеров гепатита В, имеющих самостоятельное значение для серологической диагностики, сегодня признаны:
HBsAg (поверхностный антиген вируса гепатита В) — основной маркер, свидетельствующий о наличии вируса гепатита В. При остром гепатите В HBsAg можно обнаружить еще в продромальном периоде, и длительность его персистенции при неосложненном течении составляет до 10 недель;
HBeAg — показатель высокой степени активности инфекционного процесса. Маркер репликации HBeAg определяется, как правило, при наличии HBsAg, однако циркулирует в крови менее продолжительное время — в среднем 4 недели;
anti-HBc класса IgM — показатель острого инфекционного процесса или, при хронических формах гепатита В, косвенный показатель активной репликации HBV. Возможна их длительная циркуляция;
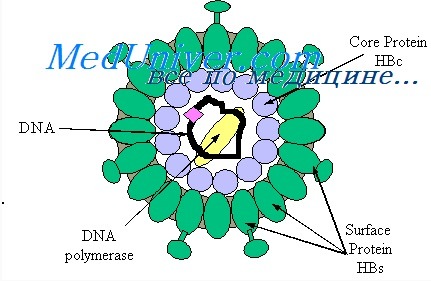
anti-HBe — не являются показателем, характеризующим какое-либо конкретное состояние при гепатите В. Эти антитела могут быть и в конце острого гепатита В и при хроническом гепатите и в случаях, так называемого здорового носительства HBsAg.
Хронический гепатит В: в фазу обострения наблюдается следующий профиль маркеров: HBsAg, HBeAg, DNA HBV, anti-HBc IgM и суммарные. В период стихания процесса обнаруживаются HBsAg, anti-HBc IgG (суммарные), возможна сероконверсия HBeAg на anti-HBe.
В основе всей серологигеской диагностики гепатита В: как острых, так и хронигеских форм—лежит определение HBsAg. Современные иммуноферментные тест-системы позволяют выявлять HBsAg в концентрациях до 0,1 нг/мл. Схема определения у разных тест-систем, как правило, одна и та же. В качестве иммуносорбента используются антитела к HBsAg. Как правило, применяются моноклональные антитела.
Именно они обеспечивают строгую специфичность применяемых в настоящее время диагностических наборов.
ПЦР (полимеразная цепная реакция) в диагностике гепатита В
Метод полимеразной цепной реакции используют для подтверждения НВ-вирусной инфекции, наличия репликации вируса при остром и хроническом гепатите В, а также определения эффективности курса лечения. Наибольшей чувствительностью обладает двойной нестед-метод, который предполагает использование двух пар праймеров. Чувствительность нестедметода весьма высока и позволяет выявлять несколько копий DNA HBV в образце, что существенно превосходит возможности ИФА.
Сегодня разработаны соответствующие технологии производства отечественные тест-системы для детекции DNA HBV с помощью ПЦР, которые активно применяются в практическом здравоохранении. Высокая чувствительность ПЦР-диагностики при гепатите В расширила возможности раннего определения вируса гепатита В при острой инфекции. Длительность инкубационного периода при гепатите В достигает 6 месяцев, а в ряде случаев и больше. В это время вирус попадает в кровь, проникает в клетки печени, запускается механизм репликации, и в результате размножение приобретает устойчивый характер.
Эти процессы не затрагивают в значительной степени жизнедеятельность печени и других органов в течение длительного времени. В этот период эффекторные реакции иммунной системы организма не задействованы. Число вирусных частиц резко возрастает к концу инкубационного периода и становятся максимальными. В этот период методом ПЦР можно обнаружить в крови вирус гепатита В, тогда как остальные маркеры НВ-вирусной инфекции, главным образом серологические, ещё отсутствуют. Таким образом, с помощью полимеразной цепной реакции стала возможной более ранняя диагностика острого гепатита В.
Белки и антигены вируса гепатита С. Диагностика ВГС
Сегодня известно минимум 10 структурных и неструктурных белков, кодируемых геномом HCV. К структурным белкам относят core, envelop 1 и envelop 2. Белок core является белком нуклеокапсида, тогда как envelop 1 и envelop 2 — гликопротеины внешней оболочки вируса. В структурной зоне кодируется также белок р7, функция которого не ясна, однако аналогия с другими представителями семейства Flaviviridae позволяет предположить, что его функция связана с высвобождением вириона из инфицированной клетки.
Этот белок отщепляется клеточной пептидазой от envelop 2, но не во всех случаях, что обусловливает существование envelop 2 в виде двух форм более и менее протяженной.
Неструктурная область генома HCV кодирует 6 белков — NS2, NS3, NS4A, NS4B, NS5A и NS5B. Белок NS2 является вирусной металлозависимой протеиназой. Белок NS4A действует как эффектор или кофактор для NSЗ-протеолитической активности в NS4A/NS4B, NS4B/NS5A, NS5A/NS5B сайтах нарезания полипротеина вируса.
В настоящее время фрагменты структурных и неструктурных белков, полученных генноинженерным путем (рекомбинантные белки) или с помощью химического синтеза, используют в качестве антигенов при конструировании иммуноферментных тест-систем. Первое поколение иммуноферментных тест-систем появилось на рынке в 1989 году и было основано на прямом ИФА. В качестве иммуносорбента были использованы фрагменты двух белков, NS3 и NS4, обозначаемых как 5-1-1 и С100-3.
Одновременно были разработаны и подтверждающие тесты на основе иммуноблота с рекомбинантными белками (RIBA). Чувствительность этих тест-систем первого поколения составляла только 64% для ИФА и 55% для иммуноблота. Тест-системы второго поколения появились на рынке в 1991 году. В качестве антигенов, сорбированных на твердой фазе, в этих тест-системах использовали капсидные белки (фрагмент с22-3) и антигены неструктурных регионов NS3 (фрагменты с200 и сЗЗс) и NS4, что позволило повысить чувствительность и специфичность исследований. Поскольку гуморальный иммунный ответ на капсидные антигены (структурные белки) нагинается быстрее, гем на неструктурные белки, период от инфицирования до выявляемой сероконверсии удалось уменьшить до двух месяцев.
Подтверждающие тест-системы на основе иммуноблота позволяли идентифицировать участвующие в реакции антигены. Результаты, полученные при помощи этих тест-систем, интерпретировали как положительные лишь при реакции антител, находящихся в исследуемом субстрате, по крайней мере, с двумя антигенами, тогда как при наличии реакции лишь с одним из антигенов результат считали неопределенным. Было установлено, что специфичность второго поколения тест-систем зависела от источника антигенов. В 1993 году на рынке появилось третье поколение тест-систем. В дополнение к вышеупомянутым антигенам в этих тест-системах используются также антигены, аминокислотная последовательность которых соответствует иммунодоминантным участкам NS5 белков.
В тест-системах первого, второго и третьего поколений в качестве антигенов использовались или рекомбинантные, или синтетические пептиды. В настоящее время можно выделить также тест-системы четвертого поколения, в которых в качестве иммуносорбента используют сочетания рекомбинантных и синтетических пептидов.
Опыт применения тест-систем различных поколений в мире очень большой. Было установлено, что если с помощью тест-систем первого или второго поколения у больных с острым вирусным гепатитом С антитела выявляли на 10-16, а в ряде случаев и 25-30 неделе от начала заболевания, то диагностикумы третьего поколения позволяли сократить этот срок до 2-3 недель. Согласно обобщенным данным чувствительность тест-систем первого, второго и третьего поколений составляет соответственно 70-80%, 92-95% и 97%.
В то же время, по данным С. Colin, 2001, чувствительность тест-систем третьего поколения составила 98,9% у пациентов с хроническими заболеваниями печени и 97,2% на специальных контрольных панелях сывороток. Достижение высокой чувствительности иммуноферментных тест-систем 3 и 4 поколения сопряжено с некоторыми проблемами в обеспечении специфичности исследований, что в ряде случаев может приводить к появлению ложноположительных результатов. В литературе имеются данные о возможных погрешностях в специфичности ELISA 3 тест-систем. Они являются общими для всех ELISA тест-систем, включая тест-системы для диагностики СПИДа.
Ложнопозитивные результаты могут быть следствием повышенного содержания в образцах гамма-глобулинов (сыворотки пациентов африканской расы, миеломная болезнь, ревматоидные факторы), заболеваний печени (цирроз, рак), аутоиммунных заболеваний (коллагенозы, аутоиммунные гепатиты), других вирусных инфекций (ВИЧ, гепатит В) и длительного хранения сывороток в меняющихся температурных условиях. Проведение какой-либо иммунизации также может сопровождаться повышением частоты ложнопозитивных реакций. Рекомендуемые в настоящее время меры по устранению этой проблемы следующие: а) повторная постановка образца в этой же ИФТС; б) повторная детекция anti-HCV в другой ИФТС; в) использование подтверждающих тестов на основе ИФА и иммуноблота.
Однако использование предлагаемых способов подтверждения результатов зачастую приводят к расхождениям в их итоговой трактовке, что показано исследованиями российских и зарубежных исследователей.
В настоящее время производители ИФТС для детекции anti-HCV достигают высокой чувствительности или за счет более полного выявления антител к NS3 или антител к антигенам core. Сравнительные исследования, выполненные на различных группах риска и специальных контрольных панелях показали, что тест-системы, лучше выявлявшие антитела к NS3, оказались несколько более чувствительными, чем тест-системы, лучше выявлявшие антитела к антигенам core. Их чувствительность составляла, соответственно 99,9% и 98,6%.
Читайте также:

